Изобретение относится к биотехнологии, генной и белковой инженерии, конкретно - к получению одноцепочечных антител против вируса клещевого энцефалита, обладающих вируснейтрализующими свойствами.
Вирус клещевого энцефалита (ВКЭ), представитель семейства Flaviviridae, является высокопатогенным инфекционным агентом, вызывающим серьезные поражения нервной системы. Современная эпидемическая ситуация в отношении клещевого энцефалита (КЭ) характеризуется беспрецедентным ростом заболеваемости [1, 2]. Эта закономерность характерна не только для России, где регистрируется большая часть случаев заболеваний, но и для многих европейских стран. В Российской Федерации за последнюю четверть двадцатого века заболеваемость КЭ возросла в девять раз и достигла 10000 случаев в год [1]. Этот рост обеспечивался главным образом за счет регионов Сибири и Дальнего Востока. В этой связи остро встает вопрос о стратегии борьбы с клещевым энцефалитом.
В настоящее время единственным специфическим средством лечения этого заболевания является γ-глобулин, получаемый из крови иммунизированных людей. Высокая стоимость данного препарата и возможный биологический риск при его применении делают необходимым поиск альтернативных терапевтических средств.
В последние годы опубликован ряд работ, посвященных созданию искусственных антител, которые, как полагают, будут более дешевыми, безопасными и более эффективными, чем иммуноглобулины, выделенные из крови иммунизированных животных и людей. Большой интерес представляют одноцепочечные антитела, которые состоят из вариабельных доменов тяжелой и легкой цепей иммуноглобулинов, объединенных гибким пептидным линкером. Небольшие размеры одноцепочечных антител облегчают проникновение их в ткани и выведение из организма [3, 4]. Кроме того, отсутствие константных доменов приводит к значительному снижению иммуногенности этих молекул, что позволяет рассчитывать на их использование в медицинской практике, в частности, для борьбы с вирусными заболеваниями.
Известны способы получения одноцепочечных антител к разнообразным антигенам, в том числе к рецепторам раковых клеток [5, б], ферритину человека [7], риновирусу человека [8]. Известен способ получения одноцепочечных антител к вирусу шотландского энцефаломиелита овец (LIV), принадлежащего к семейству Flaviviridae, которые обладают вируснейтрализующей активностью [9]. В Российской Федерации были запатентованы мономерные и димерные одноцепочечные антитела против ВКЭ, однако наличия у этих антител вируснейтрализующих свойств в отношении ВКЭ выявлено не было [10, 11].
Ранее в результате слияния мышиной миеломы Sp2/0-Ag 14 со спленоцитами мыши, иммунизированной очищенным белком Е ВКЭ, была получена гибридомная клеточная линия, продуцирующая мышиное моноклональное антитело 13D6 (МКА 13D6). Это антитело распознает группоспецифический эпитоп вирусов комплекса КЭ, блокирует гемагглютинирующую активность вируса КЭ и обладает вируснейтрализующей активностью [12]. Описанное антитело взаимодействует с доменом Е2 поверхностного гликопротеина Е [12], играющим основную роль в формировании вируснейтрализующих и протективных антител. Было показано также, что МКА 13D6 распознает район гликопротеина Е, взаимодействующий с клеточным рецептором [12].
Технической задачей изобретения является создание рекомбинантной плазмидной ДНК, содержащей гены, кодирующие вариабельные домены МКА 13D6 против вируса клещевого энцефалита, и бактериального штамма Escherichia coli - продуцента одноцепочечных антител против вируса клещевого энцефалита, обладающих вируснейтрализующими свойствами.
Поставленная техническая задача достигается конструированием рекомбинантной плазмидной ДНК pSC13D6, содержащей ген одноцепочечного антитела против вируса клещевого энцефалита, и получением рекомбинантного штамма бактерий Escherichia coli - продуцента одноцепочечных антител против вируса клещевого энцефалита, обладающих вируснейтрализующими свойствами.
Конструируют плазмиду pSC13D6 путем встройки в плазмидный вектор pGEM1 фрагмента ДНК, кодирующего лидерный пептид пектатлиазы В (pelB) Erwinia carotovora, и генов, кодирующих вариабельные домены МКА 13D6 против вируса клещевого энцефалита в составе единой ДНК-последовательности.
Гены, кодирующие вариабельные домены МКА 13D6, получают на основе мРНК, выделенной из клеток гибридомы 13D6, в системе обратной транскрипции-полимеразной цепной реакции с использованием в качестве праймеров Vh for 5TGAGGAGACGGTGACCGTGGTCCCTTGGCCCC и Vk for 5'GTTAGATCTCCAGCTTGGTCCC, комплементарных 3'-концу мРНК, кодирующих вариабельные домены тяжелой и легкой цепей иммуноглобулинов мыши соответственно, и Vh back 5'AGGTIIAICTICTCGAGTCAGG и Vk back 5'GACATTGAGCTCACCCAGTCTCCA, соответствующих 5'-концу мРНК, кодирующих вариабельные домены тяжелой и легкой цепей иммуноглобулинов мыши соответственно. Коннектор, кодирующий линкерный пептид (Glу4Sеr)3, получают отжигом олигонуклеотидов: 5'GTCACCGTCTCCTCAGGTGGCGGTG GCTCGGGCGGTGGT, 5'GGGTCGGGTGGCGGCGGATCTGACATTGAGCT, 5'GAGCCACCGCCACCTGAGGAGACG, 5'CAATGTCAGATCCGCCGCCACCCGACCCACCACCGCC
согласно [13] и сшивают при помощи лигазы фага Т4 с 3'-концом гена вариабельного домена тяжелой цепи по BstEII сайту рестрикции и с 5'-концом гена вариабельного домена легкой цепи по SacI сайту. Фрагмент ДНК, кодирующий лидерный пептид pelB Erwinia carotovora, получают в полимеразной цепной реакции с использованием в качестве матрицы плазмиды pET(rFll) [7] и олигонуклеотидных праймеров: 5'-CCGCTCGAGCAGCTGCACCTGGGC, 5'-GGAATTCGACCACACTCCCCTTG, обеспечивающих в амплификационном фрагменте сайты рестрикции EcoRI и XhoI.
В качестве плазмидного вектора, обеспечивающего встройку фрагмента, кодирующего лидерный пептид, и гена одноцепочечного антитела и его экспрессию под контролем позднего промотора Т7 ДНК-полимеразы, используют плазмиду pGEM1("Promega"), обработанную рестриктазами EcoRI и HindIII.
Сконструированная рекомбинантная плазмидная ДНК pSC13D6 имеет размер 3782 п.о. и мол.м. 2,5 Md и содержит:
- плазмидный вектор pGEM1, гидролизованный по EcoRI и HindIII-сайтам и содержащий сайт инициации репликации плазмиды pUC18, промотор фага Т7 и уникальные сайты рестрикции EcoRI (969), HindIII (7), PvuI (2483), PvuII (1015), SphI (3350), BglI (2195), AatII(3006);
- XhoI-BstEII- фрагмент размером 348 п.о., представляющий собой ген вариабельного домена тяжелой цепи моноклонального антитела 13D6 против вируса клещевого энцефалита;
- SacI-HindIII- фрагмент размером 327 п.о., представляющий собой ген вариабельного домена легкой цепи моноклонального антитела 13D6 против вируса клещевого энцефалита;
- синтетический BstEII-SacI коннектор размером 71 п.о., кодирующий линкерный пептид (Gly4Ser)3;
- EcoRI-XhoI - амплификационный фрагмент размером 220 п.о., содержащий регуляторные элементы и первые 22 триплета гена пектатлиазы В Erwinia carotovora;
- генетические маркеры: b1a - ген ампициллин резистентности (ген (β-лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli.
Для получения штамма-продуцента одноцепочечных антител, обладающих вируснейтрализующими свойствами, компетентные клетки бактерий Escherichia coli BL21(DE3) (F-, ompT, hsd Sb(rb -, mb -), gal dcm (DE3)) трансформировали сконструированной плазмидой pSC13D6. Полученный таким образом штамм E.coli BL21 (DE3)/pSC13D6 характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие, утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Difko" - колонии круглые, гладкие, прижатые, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при температуре 37°С при оптимуме рН от 6.8 до 7.0.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (100 мкг/ мл), обусловленную наличием плазмиды.
Штамм E.coli BL21(DE3)/pSC13D6 обеспечивает индуцируемый изопропил-β(D)-тиогалактопиранозидом (ИПТГ) синтез одноцепочечных антител с уровнем экспрессии около 12% суммарного клеточного белка.
Полученный штамм депонирован в Коллекции микроорганизмов ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора под номером В-1226.
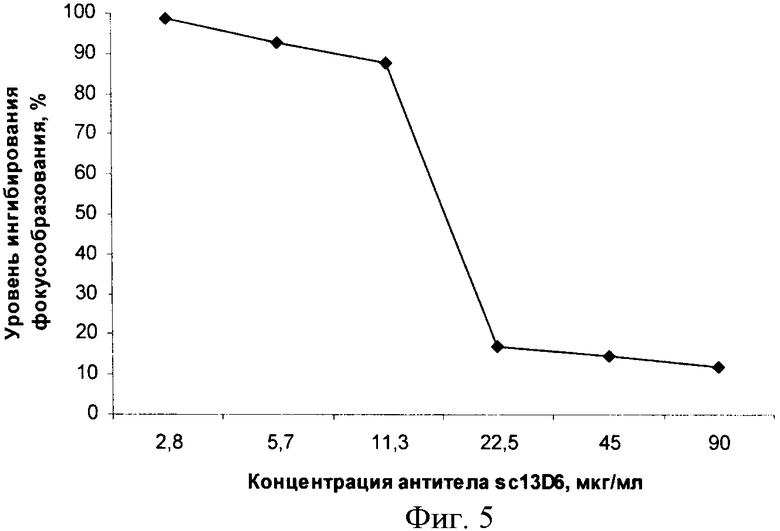
Экспрессию рекомбинантного одноцепочечного антитела осуществляют в клетках E.coli BL21(DE3) с использованием индуктора ИПТГ. Индикацию экспрессии осуществляют с помощью белкового электрофореза. Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси-К250. Уровень экспрессии составляет около 12% суммарного клеточного белка. Очистку одноцепочечного антитела из клеток E.coli BL21(DE3) проводят с помощью гель-фильтрации на сефакриле S-300. Очищенное одноцепочечное антитело sc13D6 взаимодействует с рекомбинантным белком Е вируса КЭ. Константу аффинности одноцепочечного антитела измеряют с помощью твердофазного непрямого ИФА, ее размер составляет Кафф=(2,8±0,3)×107 М-1. Очищенное одноцепочечное антитело способно ингибировать фокусообразование вирусом КЭ на монослое эукариотических клеток. IC50, определяемая как концентрация препарата одноцепочечных антител, при которой происходит снижение числа образующихся фокусов на 50% по сравнению с контрольными лунками, инфицированными вирусом КЭ без препарата одноцепочечных антител sc13D6, составляет IС50=16,7 мкг/мл.
Таким образом, впервые получена плазмидная ДНК и штамм-продуцент, обеспечивающие экспрессию одноцепочечных антител против вируса клещевого энцефалита, обладающих вируснейтрализующими свойствами, в бактериальных клетках E.coli.
Изобретение иллюстрируется следующими чертежами.
Фиг.1. Общая схема структурной организации плазмиды pSC13D6, где: Vh и V1 - гены тяжелой и легкой цепей иммуноглобулина, L - коннектор, pelB - фрагмент ДНК, кодирующий лидерный пептид, Т7 - промотор фага Т7, Арr - ген устойчивости к ампициллину; указаны некоторые сайты рестрикции.
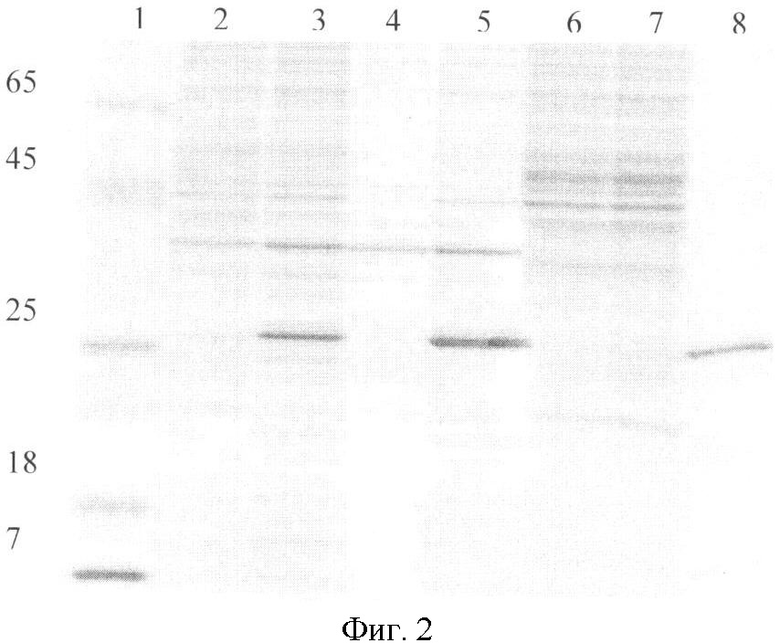
Фиг.2. Электрофореграмма в 12% SDS-ПААГ клеточных лизатов, периплазматических, цитоплазматических фракций и очищенного рекомбинантного одноцепочечного антитела sc13D6. Дорожки: 1 - маркер молекулярных масс, 2 - лизат клеток BL21(DE3)/pGEM1, 3 - лизат клеток BL21(DE3)/pSC13D6, 4 - периплазматическая фракция клеток BL21(DE3)/pGEM1, 5 - периплазматическая фракция клеток BL21(DE3)/pSC13D6, 6 - цитоплазматическая фракция клеток BL21(DE3)/pGEM1, 7 - цитоплазматическая фракция клеток BL21(DE3)/pSC13D6, 8 - очищенное одноцепочечное антитело sc13D6.
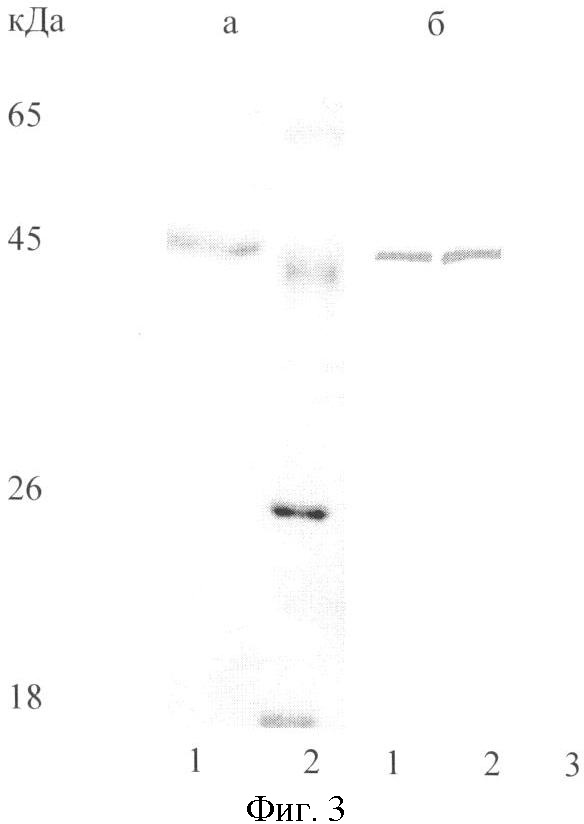
Фиг.3. Электрофореграмма в 12% SDS-ПААГ рекомбинантного белка Е ВКЭ (а) и вестерн-блот анализ рекомбинантного белка Е с использованием очищенного одноцепочечного антитела scl3D6, а также исходного МКА 13D6 (б). Дорожки: 1а - рекомбинантный белок Е ВКЭ, 2а - маркер молекулярных масс, 1б - одноцепочечное антитело sc13D6, 2б - МКА 13D6, 3б - нормальная неимунная мышиная сыворотка.
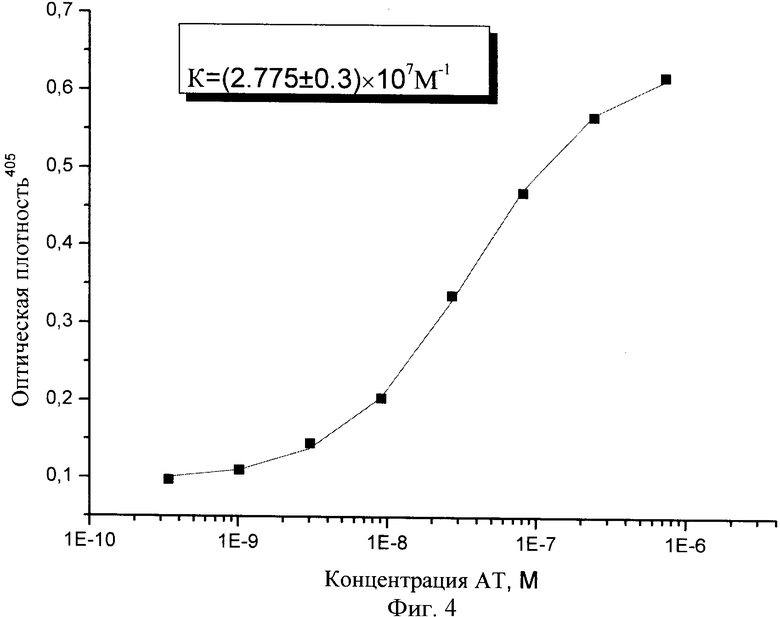
Фиг.4. Иммуноферментный анализ взаимодействия одноцепочечных антител sc13D6 с рекомбинантным белком Е ВКЭ. На твердую фазу сорбируют рекомбинантный белок Е в концентрации 200 нг/лунку. Параллельное титрование на антигене осуществляют одноцепочечными антителами sc13D6 с исходной концентрацией 1,82 мг/мл и шагом при титровании 1:3; проявление - антивидовым конъюгатом щелочной фосфатазы в разведении 1:1000.
Фиг.5. Нейтрализация ВКЭ одноцепочечными антителами sc13D6 в реакции ингибирования фокусообразования вирусом КЭ на монослое перевиваемых линий клеток СПЭВ (почки эмбриона свиньи).
Изобретение иллюстрируется следующими примерами конкретного выполнения изобретения.
Пример 1. Конструирование плазмиды pSC13D6.
1.1 Конструирование гена, кодирующего одноцепочечное антитело sc13D6.
В качестве источника генов тяжелой и легкой цепей МКА 13D6 против вируса клещевого энцефалита используют гибридому, продуцирующую МКА 13D6. На первом этапе работы из клеток гибридомы 13D6 выделяют суммарную мРНК с помощью гуанидин-изотиоцианатного метода с использованием коммерческого реагента TRIzol согласно инструкции производителя. Синтез кДНК и амплификацию генов, кодирующих вариабельные домены тяжелой и легкой цепей МКА 13D6, проводят методами ОТ-ПЦР и ПЦР в одной системе с использованием коммерческого набора "Titan one tube RT-PCR" ("Roche Applied Science") согласно инструкции производителя. Для синтеза фрагментов ДНК, кодирующих вариабельные домены тяжелых цепей, в реакционную смесь добавляют праймеры Vh back 5'AGGTIIAICTICTCGAGTCAGG и Vh for 5'TGAGGAGACGGTGACCGTGGTCCCTTGGCCCC. Для синтеза фрагментов ДНК, кодирующих вариабельные домены легких цепей, в реакционную смесь добавляют праймеры Vk back 5'GACATTGAGCTCACCCAGTCTCCA и Vk for 5'GTTAGATCTCCAGCTTGGTCCC. Продукты аплификации, кодирующие вариабельные домены тяжелой и легкой цепей МКА 13D6, выделяют методом электрофореза в полиакриламидном геле с последующей электроэлюцией и расщепляют рестриктазами Xhol, BstEII и SacI, HindIII соответственно в реакционной смеси, содержащей 50 mM трисНСl, рН 7.5; 10 mM MgCl2; 50 mM Nad и по 50 ед. активности соответствующих ферментов. Реакцию ведут 1 час при 37°С. После этого Vh и Vl - фрагменты длиной 348 п.о. и 327 п.о. вновь фракционируют методом электрофореза в полиакриламидном геле с последующей электроэлюцией.
Отдельно проводят отжиг двух пар олигонуклеотидов, кодирующих гибкий пептидный линкер (Gly4Sеr)3, после чего лигируют их в стандартных условиях. Выделенные фрагменты генов тяжелой и легкой цепей иммуноглобулина объединяют в единой реакционной смеси с 10-кратным избытком олигонуклеотидного коннектора и лигируют.
1.2. Конструирование рекомбинантной плазмиды pSC13D6.
Фрагмент ДНК, кодирующий лидер реlВ, получают в полимеразной цепной реакции с Taq-ДНК-полимеразой, которую проводят в стандартном буфере при следующих условиях: I цикл - 94°С, 1 мин, II цикл - 45°С, 1 мин, III цикл - 72°С, 1 мин с использованием праймеров и плазмиды pET(rF11) [7] в качестве матрицы. Фрагмент ДНК размером 220 п.о. выделяют методом электрофореза в полиакриламидном геле с последующей электроэлюцией. Затем обрабатывают его рестриктазами EcoRI и XhoI в стандартном буфере при 37°С в течение 1 часа. Ферменты инактивируют прогреванием при 65°С 20 мин.
Плазмидную ДНК pGEM1 обрабатывают рестриктазами EcoRI и HindIII при 37°С в течение 1 часа, затем ферменты инактивируют нагреванием при 65°С 20 мин и добавляют фрагмент ДНК, кодирующий лидер реlВ, и фрагмент ДНК, содержащий ген одноцепочечного антитела. Лигирование проводят в стандартном буфере. Полученной лигазной смесью трансформируют клетки E.coli DH5αF'. С помощью рестрикционного анализа отбирают клоны, содержащие вставку нужного размера. Полученную таким образом целевую плазмиду обозначают как pSC13D6. Схема плазмидной ДНК pSC13D6 представлена на фиг.1.
Пример 2. Получение штамма-продуцента одноцепочечного антитела против вируса клещевого энцефалита - продукта плазмиды pSC13D6.
Клетки E.coli BL21(DE3), несущие ген РНК-полимеразы фага Т7 под индуцибельным lacUV5 промотором, трансформируют сконструированной плазмидой pSC13D6. Клетки E.coli BL21(DE3), трансформированные плазмидой pSC13D6, растят ночь при 37°С. Ночную культуру (1/50) засевают в свежую среду YT×2 с ампициллином (50 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением ИПТГ до концентрации 0,5 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят ночь при 37°С, после чего собирают центрифугированием при 5000g и анализируют методом электрофореза по Лэммли [14] в 12% SDS-полиакриламидном геле (ПААГ). Результаты этого анализа, представленные на фиг.2, показывают наличие в индуцированной культуре клеток BL21(DE3)/pSC13D6 дополнительного белка с молекулярной массой около 26 кДа, что соответствует расчетной молекулярной массе одноцепочечных антител (дорожка 3), которые отсутствуют в контрольном лизате клеток E.coli BL21(DE3)/pGEM1 (дорожка 2).
Пример 3. Очистка одноцепочечного антитела scl3D6 из клеток E.coli BL21(DE3)/pSC13D6.
Индуцированные клетки E.col BL21(DE3)/pSC13D6 фракционируют на периплазму и цитоплазму. Полученные фракции анализируют методом электрофореза по Лэммли в 12% SDS-полиакриламидном геле (ПААГ). Результаты этого анализа, представленные на фиг.2, показывают, что практически весь целевой белок секретируется в периплазматическое пространство (дорожка 5). Фракцию периплазмы используют для очистки одноцепочечных антител с помощью гельфильтрации. На хроматографическую колонку (длина 80 см, диаметр 1,4 см), упакованную сорбентом Sephacryl S-300 и уравновешенную буфером, содержащим 10 мМ Трис-HCl, рН 7,6; 0,1М NaCl, наносят периплазматическую фракцию в объеме 2 мл со скоростью потока 20 мл/час. На выходе из колонки располагают спектрофотометрический детектор, за которым следует коллектор фракций. Оптическую плотность элюата на выходе из колонки регистрируют на длине волны 280 нм. Как только фронт достигает выхода колонки, начинают собирать фракции объемом 2 мл. Состав фракций анализируют методом электрофореза по Лэммли в 12% SDS-полиакриламидном геле (ПААГ). Фракции, содержащие одноцепочечное антитело sc13D6, объединяют и осаждают сульфатом аммония. Осадок растворяют в 0,9% растворе NaCl и диализуют против него. Пример такой очистки приведен на фиг.2 (дорожка 8). Уровень очистки, определенный при сканировании геля с использованием программы "Gel-Pro", составляет приблизительно 70%.
Пример 4. Оценка иммунохимических свойств одноцепочечного антитела sc13D6 против вируса клещевого энцефалита.
Для подтверждения соответствия специфичности полученных одноцепочечных антител sc13D6 специфичности исходного МКА данные антитела тестируют с помощью Вестерн-блот анализа. Рекомбинантный белок Е ВКЭ [15] разделяют электрофоретически в SDS-ПААГ, переносят на нитроцеллюлозную мембрану, которую после блокирования сайтов неспецифического связывания инкубируют с исследуемыми антителами. В результате показано, что одноцепочечное антитело sc13D6 выявляет рекомбинантный белок Е ВКЭ. В качестве положительного контроля используют исходное МКА 13D6. В качестве отрицательного контроля используют нормальную неимунную мышиную сыворотку. Результаты этого анализа представлены на фиг.3.
Способность очищенных одноцепочечных антител взаимодействовать с вирусным антигеном проверяют методом ИФА с использованием рекомбинантного белка Е вируса КЭ. Рекомбинантный белок Е сорбируют на полистироловые планшеты в концентрации 200 нг/лунку и после блокирования мест неспецифического связывания раствором 2% бычьего сывороточного альбумина инкубируют с последовательными разведениями очищенного одноцепочечного антитела. Иммунный комплекс выявляют добавлением антивидового конъюгата щелочной фосфатазы в разведении 1:1000. В качестве хромогена используют пара-нитрофенилфосфат.
Результаты экспериментов, представленные на фиг.4, подтверждают способность очищенных одноцепочечных антител взаимодействовать с рекомбинантным белком Е вируса КЭ. Величину константы аффинности рассчитывают, используя формулу

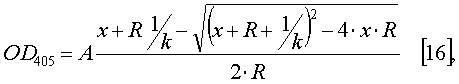
где х - концентрация антител в растворе, R - концентрация сорбированного антигена, k - константа аффинности, А - нормировочный множитель. Расчет константы аффинности проводят с использованием программы "Origin 7.0". Расчетная величина константы аффинности для одноцепочечного антитела sc13D6 составляет Кафф=(2,8±0,3)×107 М-1, что примерно в 1,5 раза ниже константы аффинности исходного МКА 13D6 (Кафф=4×107 М-1) [12].
Пример 5. Оценка вируснейтрализующих свойств одноцепочечного антитела sc13D6 против вируса клещевого энцефалита.
Для оценки вируснейтрализующей способности одноцепочечных антител sc13D6 данные антитела тестируют в реакции ингибирования фокусообразования вирусом КЭ на монослое перевиваемых линий клеток СПЭВ (почки эмбриона свиньи). В стерильном 96-луночном планшете на питательной среде RPMI 1640 с добавлением 2% инактивированной фетальной сыворотки готовятся серийные двукратные разведения одноцепочечных антител и контрольного лизата клеток BL21 (DE3) (начиная с разведения 1:20), а также рабочее разведение вируса КЭ, соответствующее 100-500 ФОЕ/лунку. К серийным разведениям исследуемых одноцепочечных антител и контроля добавляют рабочее разведение вируса, после чего смеси инкубируют при 37°С в течение 1 ч. После окончания инкубации содержимое лунок переносят на соответствующие лунки 2-суточного монослоя клеток СПЭВ в 96-луночном планшете, после чего планшет с монослоем инкубируют при 37°С в течение 42 часов. Для окрашивания инфицированных клеток в лунки добавляют охлажденный ацетон на 10-15 мин. После двукратной промывки лунок фосфатно-солевым буфером на 30 мин вносят раствор моноклональных антител мыши против гликопротеина Е вируса клещевого энцефалита. Иммунный комплекс выявляют добавлением антивидового конъюгата пероксидазы хрена в разведении 1:3000. В качестве хромогена используют 3-амино-9-этилкарбазол. Через 30 мин инкубации субстратный раствор заменяют на фосфатно-солевой буфер и окрашенные клетки учитывают в микроскопе.
Результаты экспериментов, представленные на фиг.5, подтверждают способность очищенных одноцепочечных антител ингибировать фокусообразование вирусом КЭ на монослое эукариотических клеток. Величину IC50, определяемую как концентрация одноцепочечных антител, при которой происходит уменьшение количества окрашенных клеток (фокусов) в лунке на 50% по сравнению с лунками, инфицированными вирусом КЭ без добавления одноцепочечных антител, рассчитывают с помощью пробит-анализа (метод Финни) с использованием программы ProbitLin. Расчетная величина IC50 для одноцепочечного антитела sc13D6 составляет IС50=16,7 мкг/мл.
Таким образом, впервые получены рекомбинантная плазмидная ДИК pSC13D6, содержащая ген, кодирующий одноцепочечное антитело sc13D6, и бактериальный штамм E.coli BL21(DE3)/pSC13D6, обеспечивающий продукцию одноцепочечного антитела sc13D6 против вируса клещевого энцефалита, способного ингибировать инфекционность вируса клещевого энцефалита на культуре эукариотических клеток.
ЛИТЕРАТУРА
1. Злобин В.И. Клещевой энцефалит в Российской Федерации: современное состояние проблемы и стратегия профилактики // Вопр. вирусол. - 2005. - №3. - С.26-32.
2. Локтев В.Б., Терновой В.А., Нетесов С.В. Молекулярно-генетическая характеристика вируса клещевого энцефалита // Вопр. вирусол. - 2007. - №5. - С.6-10.
3. Hauschield J., Faro H.P., Pack P., Pluckthun A. Pharmacokinetic properties of bivalent miniantibodies and comparison to other immunoglobulin forms // Antibody Immunoconjugates and Radiopharmaceuticals. - 1995. - Vol.8. - P.111-129.
4. Yokota Т., Milenic D.E., Whitlow M., Schlom J. Rapid tumor penetration of a single-chain Fv and comparison with other immunoglobulin forms // Cancer Res. - 1991. - Vol.51. - P.6363-6365.
5. Schier R., Bye J., Apell G., et al. Isolation of high-affinity monomeric human anti-c-erbB-2 single-chain Fv using affinity-driven selection // J.Mol.Biol. - 1996. - Vol.255. - P.28-43.
6. Ни S., Shively L., Raubitschek A.. Minibody: A novel engineered anti-carcinoembryonic antigen antibody fragment (single-chain Fv-CH3) which exhibits rapid, high-level targeting of xenografts // Cancer Res. - 1996. - Vol.56. - P. 3055-3061.
7. Беспалов И.А., Шиянов П.А., Лукашевич Л.В. и др. Получение одноцепочечных антител к ферритину человека в клетках Escherichia coli // Мол. биол. - 1995. - Т.27. - С.451-460.
8. Condra J.H., Sardana V.V., Tomassini J.E., et al. Bacterial expression of antibody fragment that block human rhinovirus infection of cultured cells // J. Biol. Chem. 1990. - Vol.265. - P. 2292-2295.
9. Jiang W., Bonnert T.P., Venugopal K., Gould E.A. A single chain antibody fragment expressed in bacteria neutralizes tick-bome flaviviruses // Virology. - 1994. - Vol.200. - P.21-28.
10. Николенко Г.Н., Тикунова Н.В., Головин С.Я., Протопопова Е.В., Локтев В.Б., Ильичев А.А., Деев С.М. Рекомбинантная плазмидная ДНК pTLS, содержащая ген одноцепочечного антитела против вируса клещевого энцефалита, и штамм бактерий Escherichia coli - продуцент одноцепочечных антител против вируса клещевого энцефалита. Патент РФ №2158309, 2000.
11. Николенко Г.Н., Тикунова Н.В., Протопопова Е.В., Локтев В.Б., Карпенко Л.И., Коновалова С.Н., Ильичев А.А. Рекомбинантная плазмидная ДНК p7SHSHis для продукции димерных одноцепочечных антител против вируса клещевого энцефалита и штамм бактерий Escherichia coli - продуцент димерной формы одноцепочечных антител против вируса клещевого энцефалита. Патент РФ №2190017, 2002.
12. Tsekhanovskaya N.A., Matveev L.E,, Rubin S.G., Karavanov A.S. and Pressman E.K. Epitope analysis of tick-bome encephalitis (TBE) complex vimses using monoclonal antibodies to envelope glycoprotein of TBE vims (persulcatus subtype) // Virus Research. - 1993. - Vol.30. - P.1-16.
13. Маниатис Т., Фрич Э., Сэмбрук Д. Молекулярное клонирование. М.: Мир, 1984.
14. Laemmli U.K. Cleavage of structural proteins during the assembly of the head ofbacteriophage T4 // Nature. - 1970. V.227. - P.680-685.
15. Нетесова Н.А., Белавин П.А., Малыгин Э.Г., Рукавишников М.Ю. Рекомбинантная плазмидная ДНК PGSDEI, кодирующая белок Е вируса клещевого энцефалита, и штамм Escherichia coli - продуцент рекомбинантного белка Е вируса клещевого энцефалита. Патент РФ №2136754, 1999.
16. Варфоломеев С.Д., Гуревич К.Г. Биокинетика: Практический курс. М.: ФАИР-ПРЕСС, 1999.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTLS, СОДЕРЖАЩАЯ ГЕН ОДНОЦЕПОЧЕЧНОГО АНТИТЕЛА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI-ПРОДУЦЕНТ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1998 |
|
RU2158309C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК p7SHSHis ДЛЯ ПРОДУКЦИИ ДИМЕРНЫХ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА И ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ДИМЕРНОЙ ФОРМЫ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2000 |
|
RU2190017C2 |
| Рекомбинантная плазмида pHis6-flagG-protE, обеспечивающая синтез рекомбинантного химерного белка, включающего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G S.typhii и используемого в качестве основы для вакцины против вируса клещевого энцефалита | 2018 |
|
RU2702716C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGSDEI, КОДИРУЮЩАЯ БЕЛОК E ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА E ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1997 |
|
RU2136754C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pCLm4/hygro-14D5, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ЛЕГКОЙ ЦЕПИ ХИМЕРНОГО АНТИТЕЛА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, И РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pCHm2-14D5, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ТЯЖЕЛОЙ ЦЕПИ ХИМЕРНОГО АНТИТЕЛА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ХИМЕРНОЕ АНТИТЕЛО, ОБЕСПЕЧИВАЮЩЕЕ ЭКСТРЕННУЮ ПРОФИЛАКТИКУ КЛЕЩЕВОГО ЭНЦЕФАЛИТА У МЫШЕЙ | 2013 |
|
RU2550252C1 |
| Рекомбинантные плазмидные ДНК pFLAG -sc14D5a-NLuc-r1 и pFLAG-NLuc-r2-sc14D5a, обеспечивающие синтез гибридных белков sc14D5a-NLuc-r1 и NLuc-r2-sc14D5a, и гибридные белки sc14D5a-NLuc-r1 и NLuc-r2-sc14D5a, связывающие белок Е вируса клещевого энцефалита с комплементацией фрагментов NLuc-r1 и NLuc-r2 и появлением биолюминесцентной активности | 2022 |
|
RU2784817C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFLAG-sc14D5a-Rm7, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА sc14D5a-Rm7, ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА sc14D5a-Rm7 И ГИБРИДНЫЙ БЕЛОК sc14D5a-Rm7, СВЯЗЫВАЮЩИЙ БЕЛОК Е ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА И ОБЛАДАЮЩИЙ БИОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2565545C1 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PC-NS3, ОБЕСПЕЧИВАЮЩАЯ ИНТЕГРАЦИЮ КОМПЛЕКСА ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА (ВКЭ) В ГЕНОМ ВИРУСА ОСПОВАКЦИНЫ (ВОВ) И РЕКОМБИНАНТНЫЙ ШТАММ ВИРУСА ОСПОВАКЦИНЫ, ЭКСПРЕССИРУЮЩИЙ В КЛЕТКАХ ИММУНИЗИРОВАННОГО ОРГАНИЗМА КОМПЛЕКС ГЕНОВ C, PRM, E, NS1, NS2A, NS2B, NS3 ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1995 |
|
RU2112038C1 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита на основе рекомбинантного вируса рода Flavivirus | 2022 |
|
RU2795800C1 |
Изобретение относится к биотехнологии, генной и белковой инженерии. Конструируют рекомбинантную плазмидную ДНК pSC13D6, содержащую ген одноцепочечного антитела против вируса клещевого энцефалита sc13D6. Плазмида имеет размер 3782 п.о. и содержит: плазмидный вектор pGEM1, промотор фага Т7 и уникальные сайты рестрикции. Раскрыт также штамм бактерий Escherichia coli BL21(DE3)/pSC13D6 - продуцент вируснейтрализующего одноцепочечного антитела scl3D6 против вируса клещевого энцефалита. Изобретение позволяет получать одноцепочечные антитела sc13D6 против вируса клещевого энцефалита, способные эффективно его ингибировать. 2 н.п. ф-лы, 5 ил.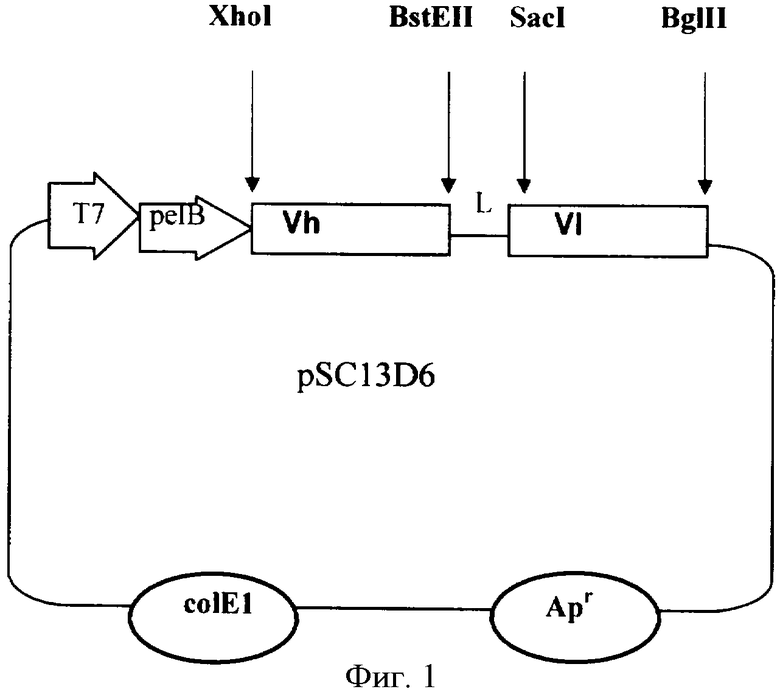
1. Рекомбинантная плазмидная ДНК pSC13D6, обеспечивающая синтез вируснейтрализующего одноцепочечного антитела sc13D6 против вируса клещевого энцефалита, имеющая размер 3782 п.о. и мол.м. 2,5 Md, содержащая:
плазмидный вектор pGEM1, гидролизованный по EcoRI и HindIII-сайтам и содержащий сайт инициации репликации плазмиды pUC18, промотор фага Т7 и уникальные сайты рестрикции EcoRI (969), HindIII (7), PvuI (2483), PvuII (1015), SphI (3350), BglI (2195), AatII(3006);
XhoI-BstEII - фрагмент размером 348 п.о., представляющий собой ген вариабельного домена тяжелой цепи моноклонального антитела 13D6 против вируса клещевого энцефалита;
SacI-HindIII- фрагмент размером 327 п.о., представляющий собой ген вариабельного домена легкой цепи моноклонального антитела 13D6 против вируса клещевого энцефалита;
синтетический BstEII-SacI коннектор размером 71 п.о., кодирующий линкерный пептид (Gly4Ser)3;
EcoRI-XhoI - амплификационный фрагмент размером 220 п.о., содержащий регуляторные элементы и первые 22 триплета гена пектатлиазы В Erwinia carotovora,
генетические маркеры: bla - ген ампициллин резистентности (ген 3-лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli.
2. Штамм бактерий Escherichia coli BL21(DE3)/pSC13D6, депонированный в Коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» под регистрационным номером В-1226 - продуцент вируснейтрализующего одноцепочечного антитела sc13D6 против вируса клещевого энцефалита.
Авторы
Даты
2010-01-10—Публикация
2008-04-21—Подача