Изобретение относится к химии и может быть использовано в медицине, ветеринарии, технике и в быту.
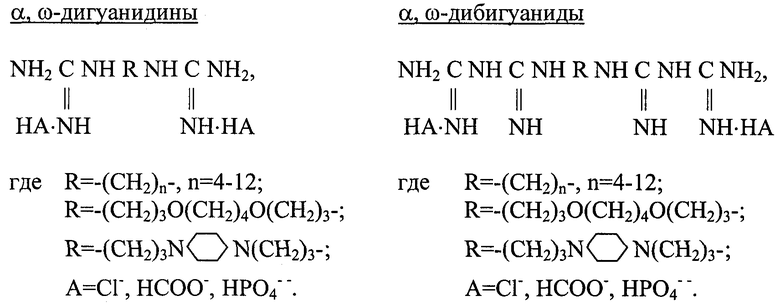
Рассматриваются α, ω-полигуанидины, включающие α, ω-дигуанидины и α, ω-дибигуаниды.
Производные гуанидина, с одной стороны, физиологичны, так как многие из них входят в состав живых организмов, а с другой проявляют различную биологическую и химическую активность. Так, известно, что растения защищаются от атак микроорганизмов с помощью гуанидиновых биоцидов агматина и хордатина. А из тела моллюска Arka Noae выделен 1,4-дигуанидинобутан (α, ω-дигуанидин), выполняющий сходную роль.
Поэтому можно считать, что синтетические α, ω-дигуанидины используют природную защитную схему, будучи использованы как биоциды. Естественно, что в живом организме имеются ферментные системы, способные как строить, так и деградировать α, ω-дигуанидины.
Что касается бигуанидов, то они являются полностью синтетическими соединениями, хотя по свойствам, в основном, повторяют гуанидины.
Известен 1,10-дигуанидино-n-декан (синталин), обладающий антидиабетической и биоцидной активностью (П.А.Гембицкий, И.И.Воинцева. Полимерный препарат полигексаметиленгуанидин. - Запорожье: "Полиграф", 1998.-с.6).
Недостаток его заключается в том, что это индивидуальное соединение из ряда α, ω-дигуанидинов сравнительно труднодоступно и имеет достаточно узкую область применения. Указанными недостатками объясняется слабое развитие этого направления за сравнительно длительный период времени.
Известен также биглюконат N,N’-бис(4-хлорфенил)-1,6-дибигуанидогек-сана (Пат. США 2830006, кл. 256-106, 1958) - эффективное дезинфицирующее средство, распространенное под названиями "хлоргексидин" или "гибитан".
Недостаток этого препарата состоит в сложности синтеза и отсутствии вирулицидной активности.
Другим недостатком известных соединений является образование при метаболизме или деструкции их токсичных α, ω-алкилендиаминов-1,6-диамино-гексана и 1,10-диаминодекана.
Технической задачей, решаемой данным изобретением, являются значительное расширение числа физиологически активных α, ω-дигуанидинов и α, ω-дибигуанидов для применения в различных областях (антитуберкулезные, противовирусные, фунгицидные, противоплесневые, антитрипаносомные препараты). Кроме того, повышается биоцидная активность и снижается токсичность за счет подбора мостиковых группировок между концевыми гуанидиновыми или бигуанидными группами, а также противоионов из числа органических физиологически активных кислот.
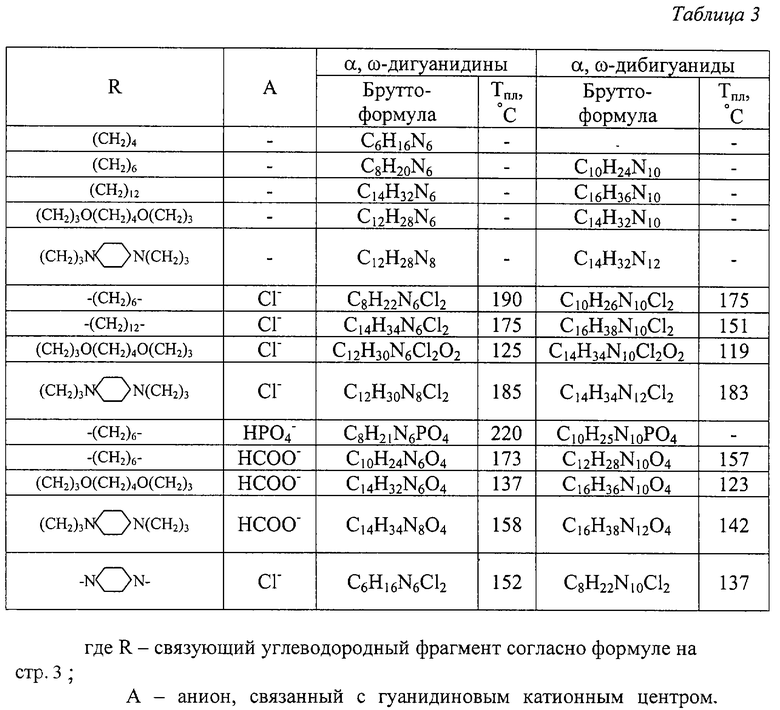
Для решения технической задачи синтезируют и используют производные полигуанидинов общей формулы
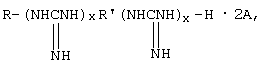
где R= H, Alk, ArAlk;
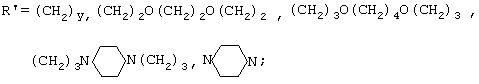
х=1,2;
y=4, 6, 12;
А=Сl-, НРO
х=1 соответствует а, ω-дигуанидинам, х=2-α, ω-дибигуанидам.
Сущность изобретения поясняется следующим образом.
Предлагается использовать весь класс биоцидных препаратов α, ω-дигуанидинов и α, ω-дибигуанидов. Одновременно рассматриваются способы их синтеза из различных исходных веществ, а также способ модификации.
Получение α, ω-дигуанидинов осуществляется в одну стадию исходя из соответствующих α, ω-диаминов тремя следующими путями:
1. С использованием цианамида:
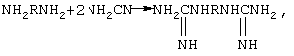
где R=-(CH2)n-, -(CH2)2O(CH2)2O(CH2)2-, -(CH2)3O(CH2)4O(CH2)3-,
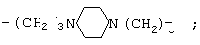
n=4-12.
2. С использованием дициандиамида:

где R=-(CH2)n-, -(CH2)2O(CH2)2O(CH2)2-, -(CH2)3O(CH2)4O(CH2)3-,
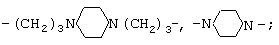
n=4-12.
3. С использованием гидрохлорида гуанидина:
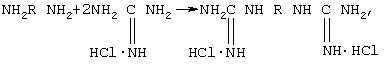
где R=-(CH2)n-, -(CH2)2O(CH2)2O(CH2)2-, -(CH2)3O(CH2)4O(CH2)3-,
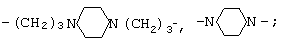
n=4-12.
Разработан способ модификации α, ω-дигуанидинов, направленный на придание им специальных свойств: противотуберкулезных, противовирусных и др.
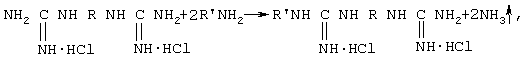
где R=(CH2)n, (CH2)xO(CH2)zO(CH2)x, 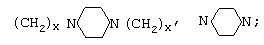
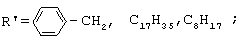
n=4,6;
x=2,3;
z=2,3,4.
Способ основан на термическом алкилировании (аралкилировании) гуанидиновых групп алкил(аралкил)аминами.
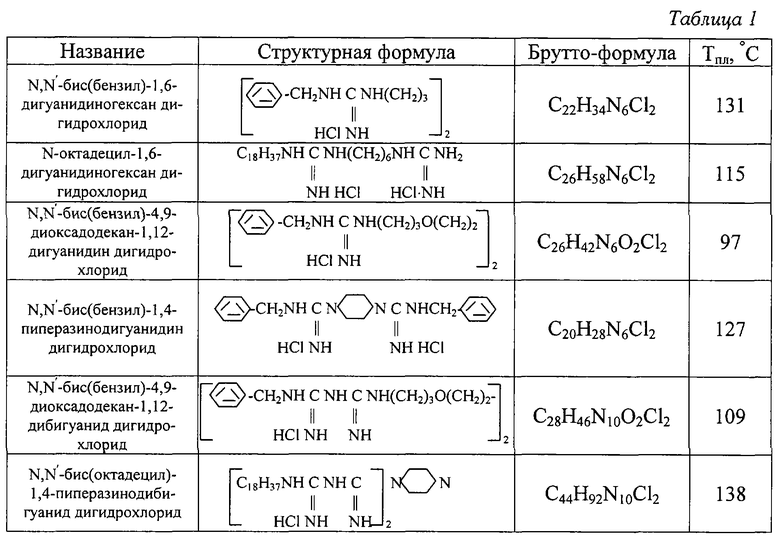
Свойства полученных модификатов показаны в табл. 1.
Синтез α, ω-дибигуанидов осуществляется двумя путями:
1. С использованием бигуанидин гидрохлорида:
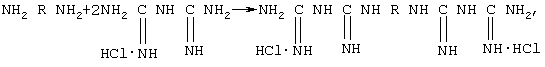
где R=-(CH2)n-, -(CH2)2O(CH2)2O(CH2)2-, -(CH2)3O(CH2)4O(CH2)3-,
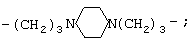
n=4-12.
2. С использованием дициандиамида:

где R=-(CH2)n-, -(CH2)2O(CH2)2O(CH2)2-, -(CH2)3O(CH2)4O(CH2)3-,
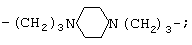
n=4-12.
Свободные основания α, ω-дигуанидинов и α, ω-дибигуанидов могут быть получены непосредственно синтезом с использованием цианамида или действием едких щелочей на водные растворы соответствующих дигидрохлоридов:
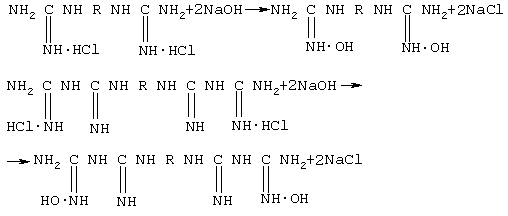
Действием органических или неорганических кислот на полученные основания α, ω-дигуанидинов или α, ω-дибигуанидов могут быть получены соли этих соединений с физиологически активными кислотами:
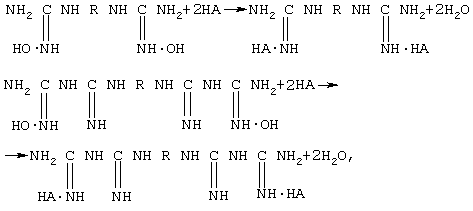
где А - анион физиологически активной кислоты.
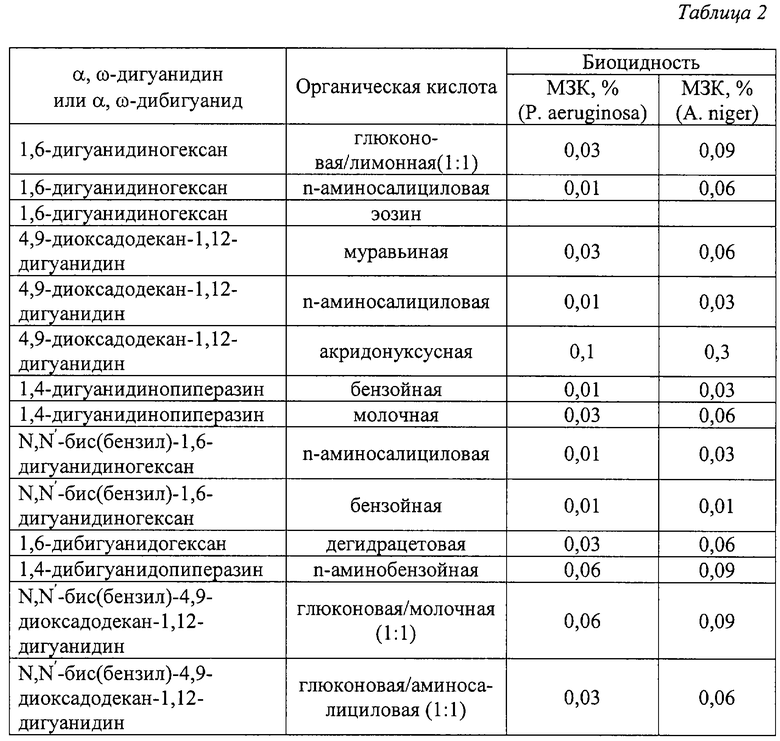
Поскольку в солях α, ω-дигуанидинов и α, ω-дибигуанидов физиологической (фунгицидной, антимикробной) активностью обладают два гуанидиновых катиона, использование в качестве противоионов анионов органических физиологически активных кислот представляет дополнительные возможности усиления биоцидных свойств. Для снижения токсичности препаратов использовался разработанный прием детоксикации путем сопряжения полигуанидинового катиона с анионом глюконовой кислоты, являющейся важным продуктом обмена веществ в живых организмах.
В качестве анионов физиологически активной органической кислоты использовали анионы таких кислот, как муравьиная, уксусная, дегидрацетовая, лимонная, молочная, бензойная и сорбиновая, известных в качестве консервирующих добавок в пищевые продукты. Для придания или усиления специальных физиологических свойств (противотуберкулезных, противовирусных, иммунностимулирующих спороцидных) у α, ω-дигуанидинов и α, ω-дибигуанидов, помимо рассмотренной выше специальной модификации, использовалось сопряжение их с анионами таких физиологически активных кислот, как акридонуксусная, n-аминобензойная, n-аминосалициловая, 1,3,6,8-тетрабромфлуоресцеин (эозин). Свойства солей α, ω-дигуанидинов и α, ω-дибигуанидов с органическими физиологически активными кислотами представлены в табл. 2.
Брутто-формулы и температуры плавления полученных соединений сопоставлены в табл. 3.
Пример 1. Синтез дигидрохлорида 1,6-дигуанидиногексана.
Порцию 116 г (1 моль) гексаметилендиамина сплавляли со 107 г (2 моля) хлористого аммония. После прекращения выделения аммиака из реакционной смеси к ней было добавлено 84 г (1 моль) дициандиамида, и нагревание было продолжено при температуре 150°С до получения гомогенного расплава дигидрохлорида 1,6-дигуанидиногексана.
C8H20N6. Вычислено, %: С 48,0; Н 10,0; N 42,0. Найдено, %: С 47,2; Н 9,8; N41.7.
Пример 2. Синтез дигидрохлорида 1,12-дигуанидиногексана.
Порцию 200 г (1 моль) 1,12-диаминододекана сплавляли со 191 г (2 моля) гидрохлорида гуанидина при температуре 180°С. По завершении выделения аммиака из реакционной смеси нагревание было прекращено, и полученный дигидрохлорид 1,12-дигуанидинододекана исследовался на биоцидную активность.
C8H20N6. Вычислено, %: С 48,0; Н 10,0; N 42,0. Найдено, %: С 47,2; Н 9,8; N 41,7.
Пример 3. Синтез основания 1,6-дигуанидиногексана.
Порцию 273 г дигидрохлорида 1,6-дигуанидиногексана растворяли в 250 мл воды и добавляли раствор 80 г едкого натра в 100 мл воды. Отделяли всплывающий верхний слой от водного раствора NaCl и подсушивали его твердым едким натром. Полученное основание 1,6-дигуанидиногексана анализировали.
C8H22N6O2. Вычислено, %: С 41,0; Н 9,4; N 36,0. Найдено, %: С 41,2; Н 9,8; N 36,7.
Пример 4. Синтез фосфата 1,6-дигуанидиногексана.
К 20 г (0,1 моля) основания 1,6-дигуанидиногексана добавляли по каплям при перемешивании 5 г (3,5 мл) концентрированной фосфорной кислоты (d=1,72 г/см3). Наблюдалось интенсивное разогревание реакционной смеси. По охлаждении до комнатной температуры смесь закресталлизовывалась. Ее измельчали в ступке и анализировали.
C8H23N6PO4. Вычислено, %: С 32,0; Н 7,7; N 28,0; Р 10,3. Найдено, %: С 31,3; Н 7,8; N 27,7; Р 9,9.
Пример 5. Синтез основания 4,9-диоксадодекан-1,12-дигуанидина.
К 20,4 г (0,1 моля) 4,9-диоксадодекан-1,12-диамина, растворенного в 50 мл ацетонитрила, добавляли при перемешивании 8,4 г (0,2 моля) цианамида.
Реакционную смесь прибавляли по каплям в 100 мл кипящего ацетонитрила, выдерживали 1 час при температуре 50°С, и ацетонитрил отгоняли. Жидкий остаток анализировали.
C12H30N6O4. Вычислено, %: С 44,7; Н 9,4; N 26,1. Найдено, %: С 43,7; Н 9,1; N 26,0.
Пример 6. Синтез формиата 4,9-диоксадодекан-1,12-дигуанидина.
К 14,4 г (0,05 моля) основания 4,9-диоксадодекан-1,12-дигуанидина добавляли по каплям при перемешивании 5,4 г 85% муравьиной кислоты. Реакционную смесь высушивали до постоянного веса и анализировали.
C14H32N6O6. Вычислено, %: С 44,2; Н 8,4; N 22,1. Найдено, %: С 43,7; Н 8,0; N 21,5.
Пример 7. Синтез дигидрохлорида бис(3-гуанидинопропил)пиперазина. Порцию 20 г (0,1 моля) бис(3-аминопропилпропил)пиперазина нагревали с 19 г (0,2 моля) гидрохлорида гуанидина гидрохлорида при температуре 120-150°С до прекращения выделения аммиака. Полученный дигуанидин анализировали.
C12H30N8Cl2. Вычислено, %: С 40,3; Н 8,4; N 31,4; Cl 20,0. Найдено, %: С 39,5; Н 7,9; N 30,8; Cl 19,3.
Пример 8. Синтез дигидрохлорида 3,6-диоксаоктан-1,8-дигуанидина. Порцию 148 г (1 моль) 3,6-диоксаоктан-1,8-диамина сплавляли с 48 г (0,5 моля) гуанидингидрохлорида при температуре 150°С. По завершении выделения аммиака продукт анализировали.
C6H22N6O2Cl2. Вычислено, %: С 25,6; Н 7,8; N 30,0; Cl 25,1. Найдено, %: С 25,2; Н 8,1; N 29,7; Cl 25,5.
Пример 9. Синтез дигидрохлорида 1,6-дибигуанидогексана.
Порцию 11,6 г (0,1 моля) гексаметилендиамина нагревали при температуре 120-150°С с 27,5 г (0,2 моля) гидрохлорида бигуанида до прекращения выделения аммиака. По охлаждении до комнатной температуры реакционная смесь закристаллизовывалась. Ее анализировали.
C10H26N10Cl2. Вычислено, %: С 30,8; Н 7,3; N 39,0; Cl 20,0. Найдено, %: С 29,7; Н 7,5; N 37,9; Cl 20,5.
Пример 10. Синтез фосфата 1,6-дибигуанидогексана.
Порцию 37,5 г (0,1 моля) дигидрохлорида 1,6-дибигуанидогексана растворяли в 50 мл воды и добавляли при перемешивании раствор 4 г NaOH в 5 мл воды. Собирали всплывающее основание 1,6-дибигуанидогексана, тщательно отделяли его от раствора NaOH и нейтрализовали его добавлением 7,0 мл (10 г, 0,01 моля) концентрированной фосфорной кислоты. Полученный фосфат 1,6-дибигуанидогексана высушивали до постоянного веса и анализировали.
C10H27N6PO4. Вычислено, %: С 31,4; Н 7,1; N 36,6; Р 8,1. Найдено, %: С 30,7; Н 7,3; N 3,8; Р 7,8.
Пример 11. Синтез дигидрохлорида 4,9-диоксадодекан-1,2-дибигуанида. Порцию 20,4 г (0,1 моля) 4,9-диоксадодекан-1,12-диамина нагревали с 19 г (0,2 моля) гидрохлорида гуанидина. По окончании выделения аммиака из реакционной массы к ней добавляли при перемешивании 8,4 г (0,1 моля) дициандиамида, нагревали еще 1 час при температуре 150°С и анализировали.
C14H34N10O2Cl2. Вычислено, %: С 45,1; Н 8,6; N 37,6. Найдено, %: С 44,5; Н 8,8; N 38,0.
Пример 12. Синтез дигидрохлорида бис(3-бигуанидопропил)пиперазина. Порцию 20 г (0,1 моля) бис(3-аминопропил)пиперазина нагревали при температуре 120-150°С с 27,5 г (0,2 моля) гидрохлорида бигуанида до прекращения выделения аммиака, охлаждали и анализировали.
C14H34N12Cl2. Вычислено, %: С 38,1; Н 7,7; N 38,1; Cl 16,1. Найдено, %: С 38,1; Н 7,7; N 38,1; Cl 16.1.
Пример 13. Синтез дигидрохлорида 1,4-пиперазинодигуанидина.
В 200 мл концентрированной соляной кислоты добавляли небольшими порциями при перемешивании 86 г (1 моль) пиперазина. Полученный водный раствор дигидрохлорида пиперазина обезвоживали, а затем сплавляли с 84 г (1 моль) дициандиамида. Полученный дигидрохлорид 1,4-пиперазинодигуанидина анализировали.
C6H16N6Cl2. Вычислено, %: С 29,6; Н 6,6; N 34,6; Cl 29,2. Найдено, %: С 28,3; Н 7,1; N 35,5; Cl 30,0.
Пример 14. Синтез дигидрохлорида 1,4-пиперазинодибигуанида.
Порцию 24,5 г (0,1 моля) дигидрохлорида 1,4-пиперазинодигуанидина сплавляли с 85 г (0,1 моля) дициандиамида. Полученный дигидрохлорид 1,4-пиперазинодибигуанида анализировали.
C8H22N10Cl2. Вычислено, %: С 29,4; Н 6,6; N 42,4; Cl 21,5. Найдено, %: С 28,3; Н 7,1; N 41,5; Cl 22,0.
Пример 15. Синтез N,N’-бис(бензил)-1,6-дигуанидиногексан дигидрохлорида.
Порцию 27,5 г (0,1 моля) дигидрохлорида 1,6-дигуанидиногексана нагревали с обратным холодильником с 21,4 г бензиламина при температуре 150-170°С. Процесс заканчивали после прекращения выделения аммиака из обратного холодильника. Полученный продукт анализировали.
С22Н34Н6Сl2. Вычислено, %: С 58,3; Н 7,5; N 18,8; Cl 15,7. Найдено, %: С 56,5; Н 6,9; N 17,9; Cl 16,1.
Пример 16. Синтез N-октадецил-1,6-дигуанидиногексан дигидрохлорида. Порцию 27,5 г (0,1 моля) дигидрохлорида 1,6-дигуанидиногексана нагревали с 26,0 г (0,1 моля) октадециламина в стаканчике на масляной бане при 150-170°С до прекращения выделения аммиака. Полученный продукт анализировали.
C26H58N6Cl2. Вычислено, %: С 59,4; Н 11,0; N 16,0; Cl 13,5. Найдено, %: С 57,5; Н 10,9; N 15,8; Cl 13,7.
Пример 17. Синтез N,N-бис(бензил)-4,9-диоксадодекан-1,12-дигуанидин дигидрохлорида.
Порцию 28,7 г (0,2 моля) гидрохлорида бензиламина сплавляли при температуре 120-150°С с 8,4 г (0,1 моля) дициандиамида. После получения гомогенного расплава бензилгуанидина к нему добавляли порциями 20,4 г (0,1 моля) 4,9-диоксадодекан-1,12-диамина и нагревание продолжали до прекращения выделения аммиака. Полученный продукт анализировали.
С26H42N6О2Сl2. Вычислено, %: С 57,7; Н 7,8; N 15,5; Cl 13,0. Найдено, %: С 55,9; Н 7,3; N 15,1; Cl 12,7.
Пример 18. Синтез N,N’-бис(бензил)-1,4-пиперазинодигуанидин дигидрохлорида.
Порцию 24,5 г (0,1 моля) дигидрохлорида 1,4-пиперазинодигуанидина смешивали с 21,4 г (0,2 моля) бензиламина и нагревали на масляной бане при температуре 120-150°С с обратным холодильником до прекращения выделения аммиака. Полученный продукт анализировали.
C20H28N6Cl2. Вычислено, %: С 56,7; Н 6,6; N 20,0; Cl 16,8. Найдено, %: С 54,9; Н 5,8; N 19,7; Cl 15,5.
Пример 19. Синтез N,N’-бис(бензил)-4,9-диоксадодекан-1,12-дибигуанида дигидрохлорида.
Порцию 44,5 г (0,1 моля) дигидрохлорида 4,9-диоксадодекан-1,2-дибигуанида нагревали при температуре 120-150°С с обратным холодильником с 21,4 г (0,2 моля) бензиламина до прекращения выделения аммиака. Полученный продукт анализировали.
C28H46N10O2Cl2. Вычислено, %: С 55,7; Н 7,3; N 22,4; Cl 11,4. Найдено, %: С 50,9; Н 7,0; N 21,3; Сl 11,7.
Пример 20. Синтез NN’-бис(октадецил)-1,4-пиперазинодибигуанид дигидрохлорида.
Порцию 33 г (0,1 моля) дигидрохлорида 1,4-пиперазинодибигуанида смешивали с 54 г (0,2 моля) октадециламина и нагревали в открытом стаканчике на масляной бане при температуре 150-170°С до прекращения выделения аммиака. Полученный продукт анализировали.
C44H92N10Cl2. Вычислено, %: С 63,5; Н 11,07; N 16,8; Cl 8,3. Найдено, %: C 62,1; H 10,9; N 15,3; Cl 8,8.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ ЯЩУРА | 2013 |
|
RU2522868C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЦИДНОГО ПОЛИГУАНИДИНА И БИОЦИДНЫЙ ПОЛИГУАНИДИН | 2006 |
|
RU2324478C2 |
| ПОЛИБИГУАНИДЫ ЛИНЕЙНОГО И ГРЕБЕНЧАТОГО СТРОЕНИЯ | 2003 |
|
RU2239629C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИГУАНИДИНОВ | 2007 |
|
RU2487118C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА | 1999 |
|
RU2172748C2 |
| Способ получения @ , @ -бис-N-азиридиноалканов | 1989 |
|
SU1668359A1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРОВ СОЛЕЙ ПОЛИГУАНИДИНОВ И СОПОЛИМЕРЫ СОЛЕЙ ПОЛИГУАНИДИНОВ | 2008 |
|
RU2373192C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАРБОФУНКЦИОНАЛЬНЫХ ОЛИГОДИОРГАНОСИЛОКСАНОВ | 1995 |
|
RU2095377C1 |
| ДИЦИКЛОГЕКСИЛАМИДЫ N-ЗАМЕЩЕННЫХ α-АМИНОКАРБОНОВЫХ КИСЛОТ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ И АНТИФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2114821C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОРГАНОМИНЕРАЛЬНОГО СОРБЕНТА НА ОСНОВЕ КЛИНОПТИЛОЛИТА | 2000 |
|
RU2167706C1 |
Изобретение относится к производным полигуанидинов, которые могут найти применение в медицине, ветеринарии и в быту в качестве антитуберкулезных, противовирусных и противоплесневых препаратов. Производные полигуанидинов общей формулы (I)
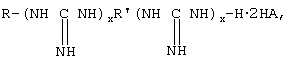
где R=H, Alk, ArAlk; R′=(CH2)y, (CH2)2O(CH2)2O(CH2)2,
(CH2)3O(CH2)4O(CH2)3,
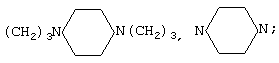
x=1, 2; y=4, 6, 12; A=Cl-, HPO
Производные полигуанидинов общей формулы
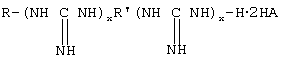
где R=H, Alk, ArAlk;
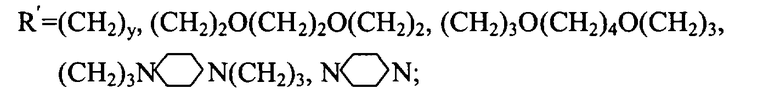
x=1, 2;
y=4, 6, 12;
A=Cl-, HPO
x=1 соответствует α,ω-дигуанидинам, x=2 - α,ω-дибигуанидам.
| СПОСОБ ПОЛУЧЕНИЯ ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА (ВАРИАНТЫ) | 2000 |
|
RU2170743C1 |
| RU 2052453 C1, 20.01.1996 | |||
| БИОЦИДНЫЙ ПРЕПАРАТ | 1998 |
|
RU2142293C1 |
| Коньюгат на основе магнитных наночастиц для терапии солидных опухолей и способ его получения | 2023 |
|
RU2830006C1 |
| Способ получения бигуанидовых солей | 1975 |
|
SU572200A3 |
Авторы
Даты
2004-06-20—Публикация
2003-06-09—Подача