УРОВЕНЬ ТЕХНИКИ
Рост клеток регулируется различными белками, относящимися к группе факторов роста (Schalch DS et al. (1979) Endocrinolody 104:1143-1151). Наиболее важные факторы роста связаны с развитием клеток и способны оказывать воздействие по аутокринному и паракринному механизмам, с участием трансформирующих факторов роста (TGFs) (Braun L. et al. (1988) Cell Biol. 85:1539-1543; Lyons RM and Moses HL (1990) Eur. J. Biochem. 187:467-473).
Термин "трансформирующий фактор роста TGF" впервые был использован для описания активности, продуцированной линией клеток, трансформированных под действием вируса саркомы у мышей или крыс (deLarco JE and Todaro GJ (1978) Proc. Natl. Acad. Sci. 75:4001-4005; Mizel SB et al. (1980) Proc. Natl. Acad. Sci. 77:2205-2208). Супернатант этих клеток обладал способностью индуцировать нормальный рост в мягком агаре таких клеток, для роста которых был необходим твердый носитель. Более детальные исследования выявили два класса трансформирующих факторов роста TGF, названных TGFα и TGFβ, которые, в свою очередь, включают семейства родственных белков. Семейство белков TGFβ включает 5 изоформ (Brand T. and Schneider MD (1995) J. Mol. Cell Cardiol. 27:5-18) димерной структуры (Schlunneger MP and Grutter MG (1992) Nature 358:430-434; Brand T. and Schneider MD (1995) J. Mol. Cell Cardiol. 27:5-18). Исследования зрелых очищенных белков, происходящих от одного вида, свидетельствуют о высокой степени идентичности последовательностей этих белков (таблица 1).
TGFβ1, который синтезирован как предшественник из 390 аминокислот, называют Pre-Pro-TGFβ1. При первом гидролизе высвобождается гидрофобный фрагмент, состоящий из 29 аминокислот, что приводит к появлению Pro-TGFβ1. Затем при следующем разрыве цепи на участке, который располагается перед С-концом TGFβ1 и который состоит из двух остатков аргинина, высвобождается зрелый TGFβ1 - появляется белок, состоящий из 112 аминокислот, с молекулярной массой 12 кДа. Для получения биологически активной формы два из этих мономеров соединяют вместе с помощью дисульфидных мостиков, получая при этом димер с молекулярной массой 25 кДа. Изменения этой структуры приводят к потере биологической функции (Barnard JA et al. (1990) Biochim. Biophys. Acta 1032:79-87).
Как известно, внутри структуры TGFβ1 существуют различные домены. Один из этих доменов, как обнаружено, располагается между аминокислотами 40 и 82 и участвует в связывании TGFβ1 с его клеточными рецепторами. (Quian SW et al. (1992) Proc. Natl. Acad. Sci. 89:6290-6294; Burmester JK et al. (1993). Proc. Natl. Acad. Sci. 90:8628-8632).
Рецепторы трансформирующего фактора роста TGFβ1 и другие связывавшиеся белки
Охарактеризовано пять типов специфических рецепторов, связывающихся с TGFβ1 (Cheifetz S et al. (1988) J. Biol. Chem. 263:17225-17228 and Lopez Casillas F. et al. (1991) Cell 67:785-795). Эти рецепторы обладают различным сродством к различным типам TGFβ1. До настоящего времени наилучшим образом изучены рецепторы типов I, II и III (обзор приведен Attisano L et. al. (1994) Biochim. Biophys. Acta 1222:71-80; Derynck R. (1994) Trends Biochem. Sci. 19:548-553; Yingling et al. (1995) Biochim. Biophys. Acta 1242:115-136). Также описаны рецепторы IV типа (МасКау К. and Daniel-pour D. (1991) J. Biol. Chem. 266:9907-9911) и рецепторы V типа Ichijo H. et al. (1991) J. Biol. Chem. 266:22459-22464). Также сообщалось, что трансмембранные и цитоплазматические домены эндоглина (Cheifetz S et al. (1993) J. Biol. Chem. 267:19027-19030; Bellon T. et al. (1993) Eur. J. Immunol. 23:2340-2345; Yamashita et al. (1995) J. Biol. Chem. 269:1995-2001; Zhang H. et al. (1996) J. Immunol. 156:564-573)) примерно на 70% схожи с рецепторами типа III, как человека, так и крысы.
RIII мог бы явиться подходящим для связывания с TGFβ1 и доставки к RII, который, в свою очередь, мог бы образовывать комплекс с RI (Yamashita et al. (1994) J. Biol. Chem. 269:29172-20178) или к комплексам, в которых различные молекулы RI сочетаются с RII (Weiss G. and Massague J. (1996) EMBO J 15:276-289). RII-RI взаимодействия могли бы вызывать фософрилирование RI и последующую активацию им серин/треонинкиназы, что приводило бы к фософрилированию других молекул, несущих генетическую информацию, такого типа, как молекулы белков MADR2 (Macias-Silva M et al., (1996) Cell 87:1215-1224) (1).
Роль трансформирующего фактора роста TGFβ1 в дифференцировке и регенерации клеток печени
Оказываемое воздействие различается в зависимости от момента развития и типа клетки.
- Увеличение внеклеточного матрикса при воздействии на звездчатые клетки печени (Ito-клетки), основной источник матриксных белков (Mustce ТА et al. (1987) Science 237:1333-1336).
- Дифференцирование эпителиальных клеток и гепатоцитов (Florini JR et al. (1986) J. Biol. Chem. 261:16509-16513).
- Ингибирование роста клеток в процессе регенерации печени. Этот эффект имеет огромное значение для сохранения клеточного статуса in vivo (Kato Y. et al. (1988) Proc. Natl. Acad. Sci. 85:9552-9556).
- Ингибирование эндоцитоза рецепторов эпителиального фактора роста (EGF), как наблюдали в случае культуры гепатоцитов эмбриона крысы (Noda M. and Rodan GA (1987) J. Cell Physiol. 133:426-437).
Роль трансформирующего фактора роста TGFβ1 при фибриозе печени
Как было обнаружено, TGFβ1 связан с процессом фиброза печени (Czaja MJ et al. (1989) J. Cell Biol. 108:2477-2482; Annoni G. et al. (1992) J. Hepatol. 14:259-264), вызывая увеличение образования белков внеклеточного матрикса при участии звездчатых клеток печени (липоциты или Ito-клетки) или их рецепторов и ингибирование синтеза протеолитических ферментов, которые вызывают разрушение матрикса (Ignotz RA and Massague J. (1986) J. Biol. Chem. 261:4337-4345). В печени TGFβ1 индуцирует синтез коллагена и фибронектина в звездчатых клетках печени (Weiner FR (1990) Hepatology 11:111-117). Происходит также авторегуляция путем повышения его собственного синтеза, посредством индуцирования его под действием мРНК.
Также было обнаружено, что TGFβ1 связан с повышением образования α2-макроглобулина, синтезируемого гепатоцитами и активированного звездчатыми клетками печени. При связывании с TGFβ1, вызывая его инактивацию (Bachem MG (1994) Ann NY Acad. Sci. 737:421-424), а2-макроголобулин, как полагают, удаляет TGFβ1 из межклеточного пространства.
Исследования пациентов с хроническими расстройствами печени показали, что существует корреляция между экспрессией TGFβ1 и экспрессией мРНК для проколлагена типа I и уровнем в сыворотке пептида типа III проколлагена (Castilla A. et al. (1991) N. Engl. J. Med. 324:933-940).
Продолжительность жизни больных с циррозом печени меньше, чем обычная, вследствие осложнений, которые возникают при течении заболевания, таких, как портальная гипертензия и печеночная недостаточность.
Воздействие трансформирующего фактора роста TGFβ1 на межклеточный матрикс
Взаимодействие TGFβ1 с рецепторами клеток вызывает:
- Активацию синтеза проколлагена, фибронектина (Ignotz RA et al. (1987) J. Biol. Chem. 262:6443-6446) и родственных белков, включая мембранные белки, способные взаимодействовать с компонентами межклеточного матрикса (Carter WG (1982) J. Biol. Chem. 257:13805-13815).
- Ингибирование синтеза протеолитических ферментов, способных вызывать разрушение матрикса (Fukamizu H. and Grinnell F. (1990) Exp. Cell Res. 190:276-282).
- Стимулирование синтеза ингибиторов протеолитических ферментов (Fukamizu H. and Grinnell F. (1990) Exp. Cell Res. 190:276-282).
Эти эффекты приводят к росту взаимодействия клеток с межклеточным матриксом, которые сочетаются с более выраженной перестройкой белков, из которых он состоит, и приводит к суммарному повышению количества межклеточного матрикса (Roberts CJ et al. (1988) J. Biol. Chem. 263:4586-4592). Эти данные подтверждают, что TGFβ1 участвует в процессах рубцевания (Fukamizu H. and Grinnell F. (1990) Exp. Cell Res. 190:276-282; Barnard JA et al. (1990) Biochim. Biophys. Acta 1032:79-87).
Пептиды в качестве ингибиторов взаимодействия лиганд-рецепторов
Существует возможность использования небольших молекул, синтетических пептидов, в качестве аналогов молекул, которые присутствуют в организме, в целях имитирования их действия. Исследования, проведенные ЛеСате с сотр. (LeSateur), показывают возможность использования циклических аналогов факторов роста нервов (NGF), имитирующих β кольцевой фрагмент, обусловливающий связывание факторов роста нервов с рецептором (LeSateur L. et al. (1996) Nature Biotechnology 14:1120-1122). Также возможно использовать пептиды в качестве антагонистов этих молекул, предотвращая взаимодействие природного белка со своим рецептором блокировкой участия пептида (La-sarte JJ et al. (1994) J. Acquired Immune Deficiency Sydromes 7:129-134; LeSateur et al. (1995) J. Biol. Chem. 270:6564-6569). Предшествующие исследования показали возможность использования синтетических пептидов в качестве ингибиторов взаимодействия лиганд-рецептор, даже в случае, когда распознающий эпитоп не является непрерывным (Daniels AJ et al. (1995) Mol. Pharmacol. 48:425-432). Другие исследования, проведенные в отношении рецептора TGFβ1 типа II и в отношении фетуина-гликопротеина, относящегося к группе рецепторов типа II, показали возможность использования циклических пептидов в качестве ингибиторов взаимодействия TGFβ1 с RII (Demetriou М. et al. (1996) J. Biol. Chem. 271:12755-12761). При такой циклизации возможно получить пептиды, обладающие структурой, сходной со структурой, которая могла бы существовать in vivo.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с указанными выше причинами авторы настоящего изобретения полагали, что пептиды, полученные как из TGFβ1, так и из его рецепторов, или из белков, обладающих способностью к связыванию с TGFβ1, могли бы ингибировать действие TGFβ1. Таким образом, авторы настоящего изобретения решили рассмотреть эту возможность.
Выбор пептидов, которые необходимо синтезировать
Пептиды для синтеза выбирали различными способами, в зависимости от того, являлись ли они производными TGFβ1 или производными его рецепторов.
В случае последовательности TGFβ1, пептиды синтезировали из 15 аминокислот, которые входят в полную последовательность TGFβ1. Каждый пептид содержал 10 аминокислот подобно двум его ближайшим соседям.
В случае последовательности его рецепторов пептиды выбирали с использованием программного обеспечения, разработанного в лаборатории авторов настоящего изобретения. Одна из компьютерных программ позволяла сравнить две аминокислотные последовательности с целью предсказания частично комплементарных областей. Другие программы, которые также использовались, позволяли предсказать области белков, которые могли бы быть наиболее подвержены воздействию, исходя из гидрофобности и гидрофильности аминокислот, образующих их аминокислотную последовательность.
Синтез пептидов
Пептиды синтезировали твердофазным методом (Merrifield (1963) J. Am. Chem. Soc. 85:2149-54), используя флуоренилметилоксикарбонил (Fmoc) в качестве временной защитной группы для альфа-аминогруппы (Atherton et al. (1989) Journal of Chemical Society Perkins Transactions 1: 538-546). Для синтеза в небольшом количестве большого числа пептидов использовали многопозиционный синтезатор, позволяющий одновременно синтезировать 96 пептидов (Borras-Cuesta et al. (1991) Biologi-cals 19: 187-190). До использования пептиды хранили при температуре -80°С в твердом состоянии.
Очистка пептидов методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
Синтезированные пептиды анализируют и очищают методом высокоэффективной жидкостной хроматографии (ВЭЖХ), используя систему Waters 600Е-900 (Millipore Corp., Bedford, USA).
Для анализа пептидов методом аналитической ВЭЖХ используют колонку Waters Radial-Pak™ C18 300  , 15 мкм, 8×100 мм (Millipore Corp., Bedford, USA). Пептид растворяют в 0,1% растворе трифторуксусной кислоты (TFA) в дистиллированной воде, до максимальной концентрации 1 мг/мл. Раствор пептида (100 мкл) вводят в колонку и элюируют градиентом вода/ацетонитрил (фиг.15) (Romil Ltd., Cambridge, USA), оба в 0,1% растворе TFA при скорости потока 1 мл/мин. Фракции, содержащие пептид, определяют по их поглощению при 220 нм и 280 нм (матричный фотодиодный детектор. Waters 991, Millipore Corp., Bedford, USA).
, 15 мкм, 8×100 мм (Millipore Corp., Bedford, USA). Пептид растворяют в 0,1% растворе трифторуксусной кислоты (TFA) в дистиллированной воде, до максимальной концентрации 1 мг/мл. Раствор пептида (100 мкл) вводят в колонку и элюируют градиентом вода/ацетонитрил (фиг.15) (Romil Ltd., Cambridge, USA), оба в 0,1% растворе TFA при скорости потока 1 мл/мин. Фракции, содержащие пептид, определяют по их поглощению при 220 нм и 280 нм (матричный фотодиодный детектор. Waters 991, Millipore Corp., Bedford, USA).
Для очистки пептидов используют колонку Waters DeltaPak™ C18 300  , 15 мкм, 25×100 мм (Millipore Corp., Bedford, USA). Пептид растворяют и вводят (2 мл) в тех же самых условиях, как и в предыдущем случае, используя тот же самый градиент при скорости потока 5 мл/мин. Фракцию, которая содержит чистый пептид, собирают в колбу.
, 15 мкм, 25×100 мм (Millipore Corp., Bedford, USA). Пептид растворяют и вводят (2 мл) в тех же самых условиях, как и в предыдущем случае, используя тот же самый градиент при скорости потока 5 мл/мин. Фракцию, которая содержит чистый пептид, собирают в колбу.
ТЕСТЫ IN VITRO, ИССЛЕДОВАНИЕ АКТИВНОСТИ ПЕПТИДОВ
Линии клеток
Используют линию, полученную из легочного эпителия норки, MV-1-Lu, (CCL-64, American Type Cell Culture, Virginia, USA). Клетки выращивают в колбах для культур площадью 162 см2 (Costar Corporation, Cambridge, USA) в термостате при 37°С и с 5% CO2, до слияния. Используют полную среду: RPMI 1640 с L-глутамином (CibcoBRL, Life Technologies Ltd., Paisley, Scotland), содержащую 5% эмбриональной телячьей сыворотки (FCS, Biological Industries, Kubbutz Beit Haemek, Israel), 10 мМ N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты, HEPES (1 М HEPES Buffer, Bio-Whittaker, Verviers, Belgium) и антибиотики (100 Ед/мл пенициллина и 100 мкг/мл стрептомицина).
Тест на ингибирование роста клеток MV-1-Lu
Клетки линии MV-1-Lu, выращенные, как показано выше, удаляют со дна колбы с культурой, используя 5 мл смеси трипсин-ЭДТА (Biological Industries, Kubbitz Beit Haemek, Israel), ресуспендируют в полной среде и центрифугируют при 1500 об/мин в течение 8 минут. После центрифугирования клетки ресуспендируют в полной среде до концентрации 50000 клеток в 1 мл. Для проведения теста берут 10 мл суспензии клеток и распределяют в 96-луночном плоскодонном планшете для культур клеток, помещая по 100 мкл в лунку (Costar Corporation, Cambridge, USA), и инкубируют в течение ночи при 37°С и 5% CO2, что приводит к адгезии клеток ко дну лунок. К концу указанного промежутка времени пептиды, которые необходимо исследовать, вносят в RPMI, до конечной концентрации 200 мкг/мл в присутствии TGFβ1 в RPMI в концентрации 200 пг/мл (R&D Systems Europe Ltd., Abingdon, UK). Окончательная концентрация эмбриональной телячьей сыворотки в лунке составляет 2,5%. Через 24 часа инкубирования в каждую лунку добавляют 1 мкКи содержащего тритий тимидина (25 Ки/ммоль [метил-3H]-тимидин, производство фирмы "Amersham Life Science", Buckinghamshire, UK) и далее инкубируют в течение 12 часов (Grubeck-Loebenstein В. et al. (1989) J. Clin. Invest. 83:764-770; Brennan FM et al. (1990) Clin. Exp. Immunol. 81:278-285).
После окончания периода инкубирования клетки удаляют со дна лунок, используя смесь трипсин-ЭДТА, и собирают, используя ручной харвестер клеток (Titertek cell harvester, Skatron Instruments Inc., Sterling, USA), который разрушает клетки, собирая ДНК на нитроцеллюлозные фильтры (Filter MAT 11731, Skatron Instruments Inc., Sterling, USA), где осуществляют фиксацию. Фильтры помещают по отдельности в 5 мл полипропиленовые пробирки, в которые добавляют по 4 мл сцинтиллирующей жидкости (Biogreen-11, Reactivos Scharlau S.A., Barcelona, Spain). Активность каждой пробирки подсчитывают в течение 90 секунд с помощью β сцинтилляционного счетчика LKB (Beta plate system, LKB, Uppsala, Sweden).
Исследование ингибирования связывания трансформирующего фактора роста TGFβ1 с рецепторами клеток
Введение селективных меток в рецепторы клеток (введение аффинных меток)
Клетки линии MV-1-Lu удаляют со дна колбы с культурой, инкубируя их при 37°С в течение 10 минут с 10 мл раствора 1 (128 мМ NaCl, 5 мМ КСl, 25 мМ 4-(2-гидроксиэтил)-1-пиперазин-этансульфоната при рН 7,5, 5 мМ глюкозы и 1 мМ ЭДТА). Удаленные таким образом клетки ресуспендируют в растворе 2 (128 мМ NaCl, 5 мМ КСl, 50 мМ 4-(2-гидроксиэтил)-1-пиперазин-этансульфоната при рН 7,5, 1,2 мМ CaCl2, 1,2 мМ MgSO4 и 5 мг/мл БСА) и затем собирают центрифугированием при 1000×g в течение 5 минут. После центрифугирования клетки ресуспендируют в растворе 2 до концентрации 106 клеток на 1 мл.
Из полученной суспензии клеток отбирают аликвоты по 0,5 мл и помещают на 24-луночные планшеты (Greider GmbH, Frickenhausen, Germany), добавляют пептиды, в 50 мкл раствора концентрации 0,8 мг/мл, затем полученный продукт инкубируют в течение 2 часов при 4°С при перемешивании. Затем добавляют 125I-TGFβ1 (2 мкКи) до окончательной концентрации 277,2 пМ (рекомбинантный 125I-TGFβ1 человека, 800-2200 Ки/ммоль, производство фирмы "Amersham Life Science", Buckinghamshire, UK) и далее инкубируют в течение двух часов при 4°С при перемешивании.
После инкубирования клетки переносят в пробирки для центрифугирования и центрифугируют на холоде при 12000хg в течение 1 минуты. Затем дважды промывают холодным раствором 2 и ресуспендируют в 0,5 мл холодного раствора 2 с 5 мкл диметил-сульфоксида (DMSO 99,5%, производство фирмы "Sigma Chemical Co.", St. Louis, USA) и дисукцимидилсуберата (DSS, производство фирмы "Pierce Chemical Co.", Rockford, USA), устанавливая при этом окончательную концентрацию, равную 0,25 мМ DSS. Реакцию останавливают через 15 минут путем разбавления, центрифугируют и промывают раствором, содержащим 0,25 мМ сахарозы, 10 мМ Tris и 1 мМ ЭДТА при рН 7,4. Осадок клеток ресуспендируют в 0,5 мл Тритона Х-100 (производство фирмы "Bio-Rad Laboratories", Hercules, USA), 1% об./об., содержащем 10 мМ Tris при рН 7,0, 1 мМ ЭДТА, 0,1 мМ фенилметилсульфонилфторида, 1 мкг/мл пепстатина и 1 мкг/мл лейпептина (производство фирмы "Sigma Chemical Co.", St. Louis, USA), и инкубируют в течение 40 минут при 4°С. Фракцию, которая нерастворима в детергенте, отделяют центрифугированием при 12000×g в течение 15 минут. Фракцию, которая растворима в детергенте (супернатант), и фракцию, которая нерастворима (осадок), замораживают при -20°С (Massague J. and Like В. (1985) J. Biol. Chem. 260:2636-2645).
Электрофорез белков в геле полиакриламида с додецилсульфатом
Фракции, растворимые и нерастворимые в детергенте, использовали для анализа методом электрофореза в гелях акриламид/бисакриламид с концентрацией 7,5% в течение 5-6 часов при напряжении 220 вольт.
Белки визуализируют окрашиванием раствором красителя кумасси бриллиантового голубого (comassie brilliant blue® (производство фирмы "Serva Feinbiochemica GmbH", Heidelberg, Germany)) в метаноле (50%), уксусной кислоте (10%) и дистиллированной воде в течение 30 минут. Последующее промывание осуществляют раствором метанола (50%), уксусной кислоты (10%) и дистиллированной воды в течение 15 минут для первого промывания, и с дальнейшими последовательными промываниями метанолом (2,5%), уксусной кислотой (0,5%) и дистиллированной водой до удаления окраски фона.
Проточная цитометрия
Ингибирование связывания TGFβ1 с рецепторами клеток при посредничестве пептидов измеряют методом прямой флуоресценции. Для этого используют флуоресцентный набор (Fluorokine rh TGFβ-biotin, R&D Systems Europe Ltd., Abingdon, UK). Эта методика основана на способности биотинилированного TGFβ1 связываться с рецепторами клеток особым образом и последующем взаимодействии биотина с авидином, содержащим флуоресцентную метку, так что интенсивность сигнала будет зависеть от количества TGFβ1, связанного с рецепторами клеток.
Клетки линии MV-1-Lu, выращенные в колбах с площадью 162 см2, удаляют, используя раствср 1 (описанный выше) и ресуспендируют в физиологическом растворе для последующего центрифугирования при 500×g в течение 5 минут. После центрифугирования клетки опять ресуспендируют в физиологическом растворе при концентрации клеток 4×106 клеток в 1 мл. По 25 мкл этой суспензии клеток добавляют в боросиликатные пробирки размером 12×75 мм, в которые затем добавляют пептид, который необходимо исследовать, в 40 мкл среды RPMI 1640, получая при этом окончательную концентрацию 0,42 мкг/мкл, и 10 мкл биотинилированного TGFβ1. Для контроля специфичности добавляют 10 мкл биотинилированного реагента из набора, 10 мкл биотинилированного TGFβ1 добавляют в качестве положительного контроля и 20 мкл анти-TGFβ1 блокирующих антител добавляют в качестве отрицательного контроля. Физиологический раствор добавляют во все контрольные образцы до получения суммарного объема, равного 75 мкл. Все пробирки инкубируют в темноте в течение 1 часа при 4°С.
В конце периода инкубирования добавляют 10 мкл авидина, содержащего флуоресцентную метку, инкубируют в течение 30 минут в темноте при 4°С, после чего добавляют 2 мл промывочного раствора (RDF1), после чего центрифугируют при 500×g в течение 6 минут. Осадок клеток ресуспендируют в 0,2 мл холодного PBS для цитометрии (FACScan, Becton Dickinson Immummocytometry Systems, California, USA). Эта методика позволяет измерить флуоресценцию, излучаемую каждой клеткой в тех случаях, когда лазерный луч падает на нее, с помощью компьютерной программы (Lisys™ II, Becton Dickinson Immunocytometry Systems, California, USA). На фиг.16 показано типичное изображение, получаемое при анализе методом проточной цитометрии.
Для того, чтобы получить данные, относящиеся к связыванию TGFβ1 с рецепторами, применяемый в тесте ″положительный контроль″ используют для установления границ областей, соответствующих меченным клеткам, которые связаны с TGFβ1-биотином (М2), и областей, которые соответствуют немеченым клеткам (M1). Как только границы областей установлены, рассчитывают процентное содержание клеток, содержащихся в каждой из них. Ту же самую процедуру осуществляют с данными, полученными в тех случаях, когда пептиды инкубируют с TGFβ1-биотином или с клетками, в зависимости от того, получены ли пептиды из рецепторов или от TGFβ1 соответственно. Используя эти данные, вычисляют величину ингибирования в процентах для каждого из пептидов, используя следующую формулу: 100-((М2 Пептид - М2 "Отрицательный контроль")·100/(М2 "Положительный контроль" - М2 "Отрицательный контроль")).
ЭКСПЕРИМЕНТЫ IN VIVO. ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ФИБРОЗА
Использовали белых крыс-самцов (альбиносы линии Вистар) одного возраста (5 недель ± 1,5 недели) для того, чтобы получить группу, однородную по возрасту и исходному весу. В течение всего эксперимента животных содержали при постоянной температуре (22°С) и 12-часовом цикле освещение-темнота. Животным был предоставлен свободный доступ к воде и пище.
Цирроз печени (НС) вызывали путем ингаляций четыреххлористого водорода в течение 11 недель, два раза в неделю ( Novoa JM et al. (1976) Patologia IX:223-240; Camps J. et al. (1987) Gastroenterology 93:498-505). Выдержку под действием ССl4 осуществляли путем пропускания сжатого воздуха со скоростью 3 л/мин через промывную склянку для газов. Первоначально использовали выдержку, равную одной минуте, увеличивая затем выдержку на одну минуту в неделю, достигая 4 минут на четвертой неделе. В течение пятой недели ССl4 не вводили, а на шестой неделе начинали опять с выдержки, равной 5 минутам. Это время выдержки сохраняли вплоть до недели 11. К питьевой воде добавляли 400 мг/мл фенобарбитала (Luminal®, Bayer, Leverkusen, Germany), начиная за одну неделю до начала выдержки под действием ССl4 и вплоть до конца проведения эксперимента.
Novoa JM et al. (1976) Patologia IX:223-240; Camps J. et al. (1987) Gastroenterology 93:498-505). Выдержку под действием ССl4 осуществляли путем пропускания сжатого воздуха со скоростью 3 л/мин через промывную склянку для газов. Первоначально использовали выдержку, равную одной минуте, увеличивая затем выдержку на одну минуту в неделю, достигая 4 минут на четвертой неделе. В течение пятой недели ССl4 не вводили, а на шестой неделе начинали опять с выдержки, равной 5 минутам. Это время выдержки сохраняли вплоть до недели 11. К питьевой воде добавляли 400 мг/мл фенобарбитала (Luminal®, Bayer, Leverkusen, Germany), начиная за одну неделю до начала выдержки под действием ССl4 и вплоть до конца проведения эксперимента.
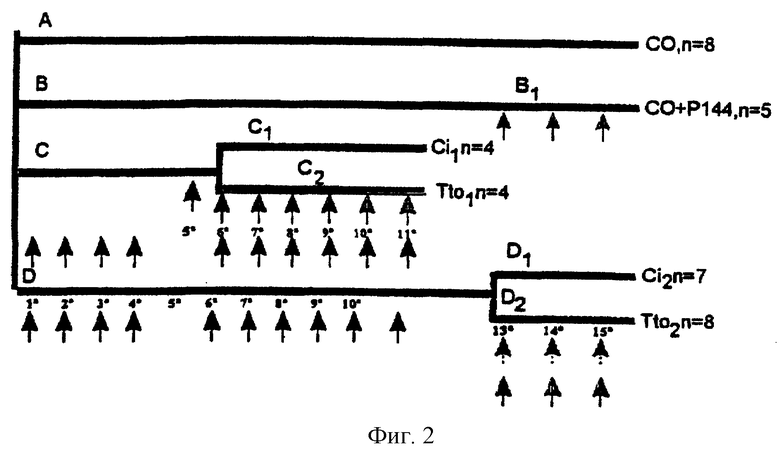
Перед началом лечения была оставлена одна неделя, в течение которой крысам не вводили ССl4. Во время лечения крысам вводили еженедельную дозу ССl4, как указано (фиг.2).
Распределение животных по группам
Перед началом индуцирования цирроза печени животные были распределены на 4 группы.
Контрольная группа здоровых животных (Со): животные, которых не подвергали процессу фиброза.
Контрольная группа здоровых животных, которых подвергали лечению (Со+Р144): животные, которых не подвергали процессу фиброза и которым вводили пептид Р144 в течение последних 3 недель (совпадающих по времени со временем лечения крыс в группе Tto2).
Контрольные группы 1 животных, подвергнутых циррозу (Ci1): животные, которых подвергали индуцированию процесса фиброза путем ингаляций ССl4 два раза в неделю. По достижению пятой недели этих животных разбили на 2 группы:
Контрольная группа 1 животных, подвергнутых циррозу (Ci1): животные, которых продолжали подвергать процессу индуцирования фиброза вплоть до недели 11 и которым не вводили пептид Р144. Этим животным на протяжении процесса индуцирования через день вводили сыворотку в солевом растворе (недели от 5 до 11).
Группа 1 животных, подвергнутых циррозу и лечению (Tto1): животные, которым вводили пептид Р144, полученный из последовательности рецептора типа III, через день, во время процесса индуцирования фиброза, недели от 5 до 11. Контрольные группы 2 животных, подвергнутых циррозу (Сi2): животные, которых продолжали подвергать процессу индуцирования фиброза, и не получавшие ни пептид Р144, ни сыворотку в солевом растворе. Эту группу по достижении недели 11 разделили на две другие группы.
Контрольная группа 2 животных, подвергнутых циррозу (Ci2): животные, подвергнутые циррозу, которые не получали какое-либо лечение, сохранялись в качестве контрольной группы. Эти животные получали инъекции сыворотки в солевом растворе в течение 3 недель (недели от 13 до 15).
Группа 2 животных, получавших лечение (Tto2): животные, подвергнутые циррозу, получавшие пептид, полученный из последовательности рецептора типа III (Р144) в течение 3 недель (недели от 13 до 15).
Лечение животных
- Группа Tro1: этих животных подвергали лечению во время процесса фиброза. Лечение с использованием пептида начали на пятой неделе (перед выдержкой под действием ССl4 в течение 5 минут) и продолжали вплоть до конца одиннадцатой недели процесса индуцирования цирроза.
- Группа Tto2: этих животных подвергали лечению после завершения процесса индуцирования цирроза (11 недель). Лечение начали через одну неделю после последней ингаляции ССl4 и продолжали в течение 21 дня.
Перед началом лечения и после его завершения у всех животных, получавших пептид, брали кровь. Пептид вводили путем подкожных инъекций в абдоминальную область в дозе 70 мкг на животное в 500 мкл физиологического раствора.
Сакрификация животных и иссечение печени
После завершения введения пептида животным, как в случае модели на крысах, так и в случае модели на мышах, животных сакрифицировали декапитацией, после взятия у них крови из заглазничного сплетения с помощью капилляра.
Сразу же после этого иссекали печень и собирали образцы.
Образцы разрезали и помещали в фиксирующий раствор - формалин для последующих гистологических исследований. Другие фрагменты помещали в криопробирки, которые помещали в жидкий азот и хранили затем при -80°С. Анатомопатологические исследования печени
Для гистологических исследований использовали фрагменты печени, предварительно зафиксированные в формалине по меньшей мере в течение 24 часов, после чего помещенные в этанол (70%).
После дегидратации препараты заделывали в парафиновые блоки. Из полученных блоков готовили последовательные срезы толщиной 3 мкм, используя дисковый микротом Лейтца и стальные лезвия. Перед окрашиванием срезы депарафинировали в ксилоле (AnalaR, BDH, Poole, UK) в течение 15 минут, после нагревания их при 60°С в термошкафу в течение 15 минут и затем гидратировали последовательными обработками спиртом понижающейся концентрации: 100%, 96%, 80% и 70%, и окончательно - водой. Использовали следующие красители:
- Гематоксилин-эозин.
- Трихромовый Мэссона (Locquin M. and Langeron, (1985) in Manual de Microscopia Ed. Labor S.A. Barcelona): Uses a specific dye for collagen proteins (green light).
- Сириус красный: краситель, специфичный для коллагена.
Подтверждение фиброза печени: анализ изображений
Для анализа изображений полученных образцов использовали оптический микроскоп (Olympus BH-2, Tokyo, Japan), соединенный с видеокамерой (Sony DXP-950P, Sony Co., Tokyo, Japan), с помощью которой получали фотографические снимки различных участков препарата. Шесть участков каждого из препаратов, выбранные случайным образом, окрашивали красителем сириус красный. Различные полученные изображения анализировали с использованием компьютерных программ (Visilog 4.1.5, Noesis, Orsay, France), которые позволяли рассчитать площадь участков, подвергнутых фиброзу, и общую площадь препарата. Из этих данных для каждого участка вычисляли показатель фиброза (площадь участков, подвергнутых фиброзу/общая площадь). Для того, чтобы использовать указанную программу, было необходимо модифицировать систему получения изображений путем использования поляризационных светофильтров (Olympus U-POT, Tokyo, Japan), и светло-зеленых фильтров (Olympus IF550, Tokyo, Japan), что позволило автоматизировать процесс анализа образцов.
Определение коллагена в срезах тканей, обработанных парафином, толщиной 14 мкм
Срезы толщиной 14 мкм, которые использовали для анализа этим методом, получали таким же способом, как и описанные выше срезы толщиной 3 мкм. Эти срезы подвергали депарафинированию в течение 12 часов в ксилоле. После того, как парафин был удален, образцы гидратировали последовательным пропусканием через спирт понижающейся концентрации: 96%, 80%, 50% и окончательно - дистиллированную воду.
После гидратации образцы подвергали предварительному окрашиванию в растворе 160 мг зеленого красителя Fast Green FCF (Fluka Chemica-BioChemica, Buchs, Switzerland) в 160 мл насыщенного раствора пикриновой кислоты (Merck, Darmstadt, Germany) в течение 15 минут в темноте. Образцы промывали, погружая в воду до тех пор, пока они не перестанут окрашивать промывные воды. После того, как избыток красителя был удален, образцы окрашивали в течение 30 минут в темноте в растворе красного красителя 160 мг Direct Red 80 (Fluka Chemica-BioChemica, Buchs, Switzerland) и 64 мг зеленого красителя Fast Green, оба красителя в 160 мл насыщенного раствора пикриновой кислоты. Образцы опять промывали, погружая в воду до тех пор, пока они не перестанут окрашивать промывные воды, и затем образцы снимали с предметного стекла, соскабливая небольшим шпателем. Снятые таким образом срезы помещали в отдельные пробирки, содержащие 3 мл 0,1 н раствора NaOH (Quimon, Montplet&Esteban S.A., Barcelona, Spain) и метанол (1:1). Отбирали аликвоты из различных пробирок для спектрофотометрического исследования (Lambda 2 UV/VIS spectrophotometer, Perkin-Elmer, Norwalk, USA) при длине волны 540 нм и 630 нм, используя в качестве раствора сравнения аликвоту смеси 0,1 н. раствора NaOH и метанола (Lopez de Leon A. and Rojkind (1985) Histochem. Cytochem. 33:737-743; Gaudio E. et al. (1993) Int. J. Exp. Path. 74:463-469).
Согласно работам Гаудио и сотр. (1993) Int. J. Exp. Path. 74:463-469), для определения количества коллагена и суммарного белка использовали следующие формулы:

Статистический анализ полученных результатов
Данные, полученные в экспериментах in vivo, были подвергнуты статистическому анализу. Соответствие количественных значений переменных нормальному распределению проверяли с помощью теста Шапиро-Вилкса.
В тех случаях, когда данные не соответствовали нормальному распределению, применяли непараметрический статистический анализ. Сравнение между группами осуществляли, используя Н критерий по Крускал-Валлис (Kruskal-Wallis) с последующим сравнением с U критерием по Манн-Уитни (Mann-Whitney). Полученные данные представлены графически в виде прямоугольников, с изображением среднего значения полученных данных (жирная линия внутри каждого прямоугольника) наряду с интерквартильной широтой (высота прямоугольника), где "усы" каждого из прямоугольников представляют наибольшее и наименьшее значение, относящееся к данной интерквартильной широте.
Связь между переменными изучали, используя точный критерий Фишера. Для определения независимости этих переменных использовали логистическую регрессию.
Значения Р, равные или меньшие 0,05, рассматривали как статистически значимые.
Все указанные методы статистического анализа осуществляли, используя программу SPSS для Windows версии 6.1.3.
ИНГИБИРОВАНИЕ АКТИВНОСТИ ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА TGFβ1 IN VITRO
Исследование ингибирования роста клеток линии MV-1-Lu
Трансформирующий фактор роста TGFβ1 представляет собой цитокин, который способен ингибировать рост клеток линии MV-1-Lu in vitro (Grubeck-Loebenstein В. et al. (1989) J. Clin. Invest. 83:764-770; Brennan FM et al. (1990) Clin. Exp. Immunol. 81:278-285), поэтому эту линию использовали для исследования блокирующего действия пептидов на TGFβ1. После различного комбинирования среды, клеток и тимидина авторы настоящего изобретения исследовали влияние различных концентраций TGFβ1 на связывание [метил-3Н] тимидина клетками линии MV-1-Lu в культуре, для того, чтобы определить наиболее подходящие условия для проведения теста. Эти условия показаны на фиг.3.
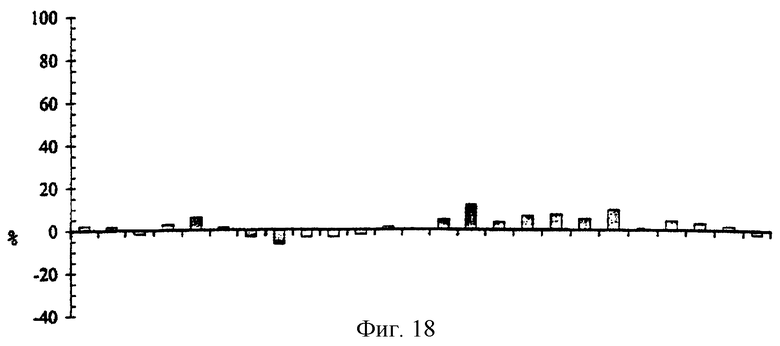
После того, как была определена оптимальная концентрация клеток линии MV-1-Lu (5000 клеток на лунку) и наименьшая концентрация TGFβ1, способная вызывать ингибирование, равное около 90% (200 пг/мл, фиг.18), ингибирующий эффект синтетических пептидов исследовали при концентрации 200 мкг/мл. Ингибирование активности трансформирующего фактора роста TGFβ1 in vitro синтетическими пептидами
Синтетические пептиды, которые являются потенциальными ингибиторами активности TGFβ1, выбранные таким образом, как показано выше в разделе "Выбор пептидов, которые необходимо синтезировать" (как пептиды, полученные из белков, которые связываются с TGFβ1, так и пептиды, полученные из самого TGFβ1) были исследованы с использованием линии клеток MV-1-Lu. Пептиды растворяли в забуференной среде RPMI, не содержащей эмбриональную телячью сыворотку, и использовали следующую методику:
пептиды, принадлежащие последовательности рецептора или комплементарные максимумам гидрофильности TGFβ1, инкубируют в течение 30 минут в присутствии этого цитокина и соединяют с культурой клеток. Пептиды, полученные из последовательности TGFβ1, добавляют к культуре клеток перед добавлением TGFβ1, поскольку они взаимодействуют с рецепторами поверхности клеток.
Это инкубирование осуществляют в 100 мкл той же самой среды, которую использовали при добавлении клеток. Активные пептиды воздействуют на рост клеток в большей или меньшей степени в зависимости от их способности ингибировать TGFβ1.
Ингибирование активности TGFβ1 пептидами, полученными из TGFβ1
На первой стадии были синтезированы пептиды с перекрывающимися последовательностями, полученные из TGFβ1. Эти пептиды (таблица 2) были синтезированы в надежде на то, что некоторые из них могли бы связываться с рецепторами клеток, препятствуя таким образом связыванию природного TGFβ1 с этими рецепторами.
На фиг.4 показано ингибирующее действие пептидов, приведенных в таблице 6, на активность TGFβ1. Поскольку TGFβ1 ингибирует рост клеток линии MV-1-Lu, ингибирование этого цитокина пептидами приводит к изменениям в росте клеток линии MV-1-Lu.
Как можно видеть из данных, приведенных на фиг.4, пептид Р12, полученный из последовательности TGFβ1, является одним из тех пептидов, которые проявляют наибольшую ингибирующую активность в отношении TGFβ1. Для более подробного изучения ингибирующего действия пептида Р12 было проведено исследование влияния концентрации пептида на ингибирование активности цитокина, описанное ниже.
Влияние дозы пептида на ингибирование активности TGFβ1 под действием пептида Р12
Исследовали влияние концентрации пептида Р12 на ингибирование активности TGFβ1 под действием Р12. Поскольку этот пептид не очень хорошо растворяется в исследуемой среде, исходные растворы или суспензии готовили в номинальной концентрации пептида (то есть такой концентрации, которая была бы достигнута, если бы пептид растворился полностью) и брали аликвоты таких растворов или суспензий, или даже использовали такие растворы и суспензии непосредственно в исследованиях ингибирования.
На фиг.5 показана оценка ингибирующего действия номинальной концентрации пептида, до и после фильтрации. Можно видеть, что пептид Р12 как после фильтрации, так и без фильтрации обладает одинаковой активностью.
После того, как были получены данные для пептида Р12, авторы настоящего изобретения решили удлинить пептид, как со стороны N-конца, так и со стороны С-конца, и исследовать влияние этого на активность пептида. В дополнение, были внесены изменения в аминокислотную последовательность пептида для того, чтобы увеличить его растворимость и определить значение двух цистеиновых остатков в его аминокислотной последовательности для ингибирования активности TGFβ1. Структура синтезированных пептидов показана в таблице 3.
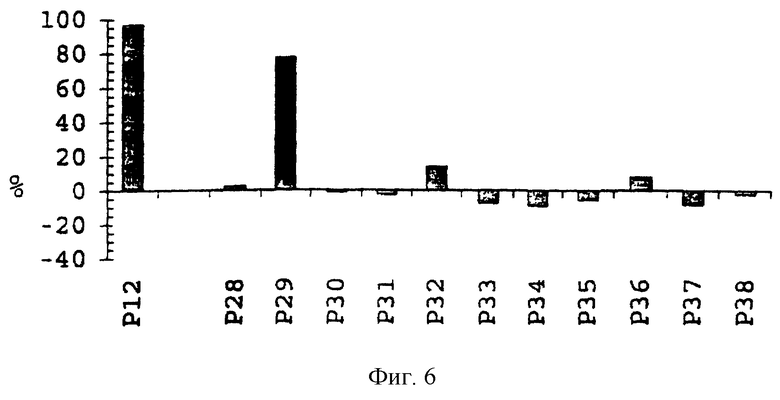
На фиг.6 показаны результаты ингибирования активности TGFβ1 под действием пептидов, приведенных в таблице 3.
Из данных, приведенных на фиг.6, можно видеть, что пептид Р29 является активным. Этот пептид включает ранее исследованный пептид Р12 и содержит 9 дополнительных аминокислот со стороны N-конца (фиг.4). Исследования, проведенные рядом авторов (Quian SW et al. (1992) Proc. Natl. Acad. Sci. 89:6290-6294) and by Burmester JK et al. (1993) Proc. Natl. Acad. Sci. 90:8628-8632) с использованием химерных рекомбинантных белков, идентифицированных как участок TGFβ1, который необходим для проявления активности этого цитокина (аминокислоты от 40 до 82 в последовательности зрелого полноразмерного TGFβ1). Предполагалось, что пептид Р29 (аминокислоты от 34 до 56 в последовательности зрелого полноразмерного TGFβ1), более протяженный, чем пептид Р12 (аминокислоты от 43 до 56), может приобретать трехмерную структуру, более схожую по действию со структурой TGFβ1. По этой причине пептид Р29 использовали для исследования связывания с рецепторами клеток, основанном на введении аффинных меток.
Исследование ингибирования связывания TGFβ1 с его рецепторами в присутствии пептида Р29 (введение аффинных меток)
Пептид Р29, полученный из аминокислотной последовательности TGFβ1, использовали в исследованиях, связанных с введением аффинных меток для подтверждения способности этого пептида ингибировать связывание TGFβ1 с соответствующими ему рецепторами клеток (Материалы и методы).
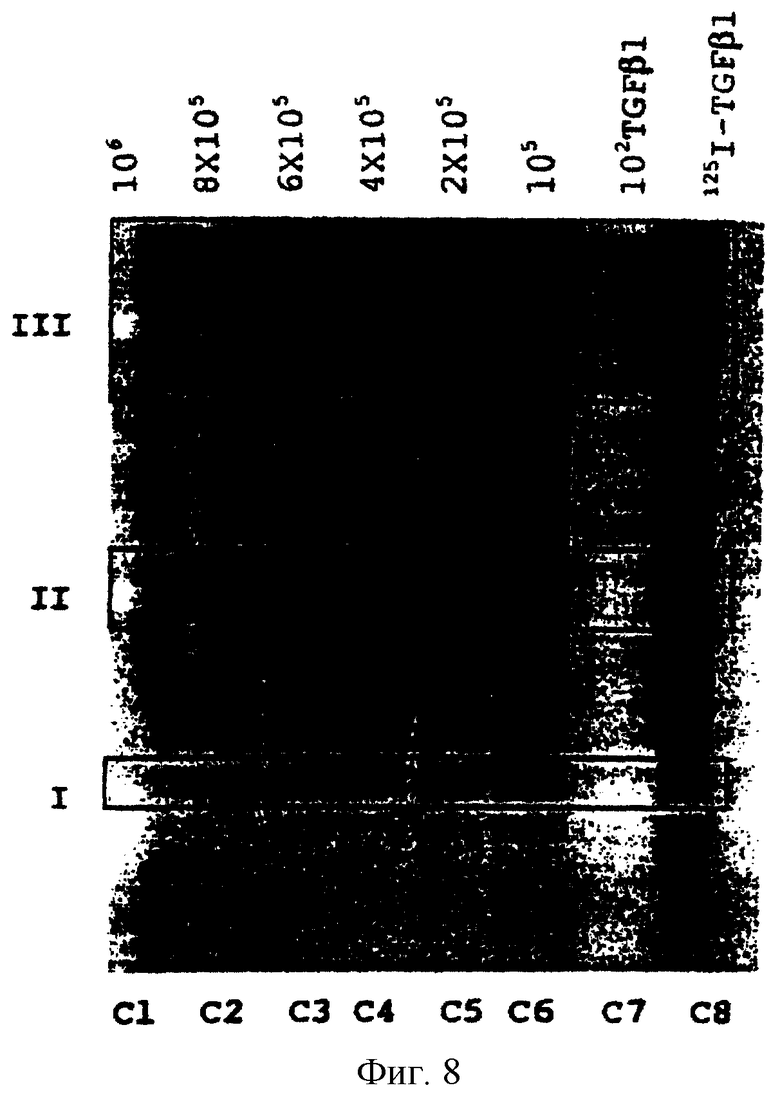
Вследствие различной активности использовавшихся партий 125I-TGFβ1, концентрацию пептида, использовавшегося при проведении исследования, в каждом случае приводили в соответствие с использовавшейся партией 125I-TGFβ1. Результаты этих исследований показаны на фиг. 7 и 8.
Дальнейшие исследования проводили для того, чтобы найти минимальную концентрацию, необходимую для блокирования связывания 125I-TGFβ1 с рецепторами клеток.
Ингибирование активности TGFβ1 пептидами, полученными из аминокислотной последовательности рецептора типа III крысы
С целью поиска новых пептидов, которые являются ингибиторами активности трансформирующего фактора роста TGFβ1, были синтезированы пептиды, полученные из рецептора типа III крысы. На основе строения областей аминокислотных последовательностей были выбраны некоторые пептиды, которые, как предполагалось, являются комплементарными блокам аминокислот в аминокислотной последовательности TGFβ1. Авторы настоящего изобретения надеялись, что эти пептиды будут способны к связыванию со свободным TGFβ1, связываясь с ним и предотвращая тем самым связывание TGFβ1 с рецепторами клеток.
Были синтезированы другие пептиды посредством перекрывания 10 аминокислот и "накрывания" части внеклеточной области рецептора типа III (аминокислоты от 45 до 410). Сообщалось, что существует растворимый рецептор типа III, который соответствует внеклеточной области рецептора, этот участок вырезают из мембраны и он действует как средство для вывода TGFβ1 из обращения ( Casillas F. et al. (1991) Cell 67:785-795). В более поздних работах описаны два возможных участка, ответственных за связывание с трансформирующим фактором роста TGFβ1, один из которых локализуется у N-конца рецептора (
Casillas F. et al. (1991) Cell 67:785-795). В более поздних работах описаны два возможных участка, ответственных за связывание с трансформирующим фактором роста TGFβ1, один из которых локализуется у N-конца рецептора ( Lopez-Casillas et al. (1994) J. Cell Biol. 124:557-568), а другой располагается в области, ближайшей к мембране, по направлению к С-концу (Fukushima D. et al. (1993) J. Biol. Chem. 268:22710-22715; Pepin MC et al. (1995) FEBS Lett 377:368-372). На основании этого были синтезированы пептиды внеклеточной области этого рецептора, при предположении, что эти пептиды могли бы быть способны к связыванию находящегося в обороте TGFβ1.
Lopez-Casillas et al. (1994) J. Cell Biol. 124:557-568), а другой располагается в области, ближайшей к мембране, по направлению к С-концу (Fukushima D. et al. (1993) J. Biol. Chem. 268:22710-22715; Pepin MC et al. (1995) FEBS Lett 377:368-372). На основании этого были синтезированы пептиды внеклеточной области этого рецептора, при предположении, что эти пептиды могли бы быть способны к связыванию находящегося в обороте TGFβ1.
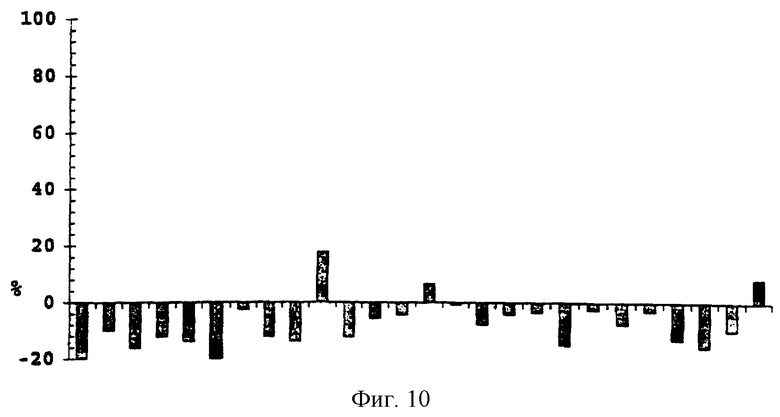
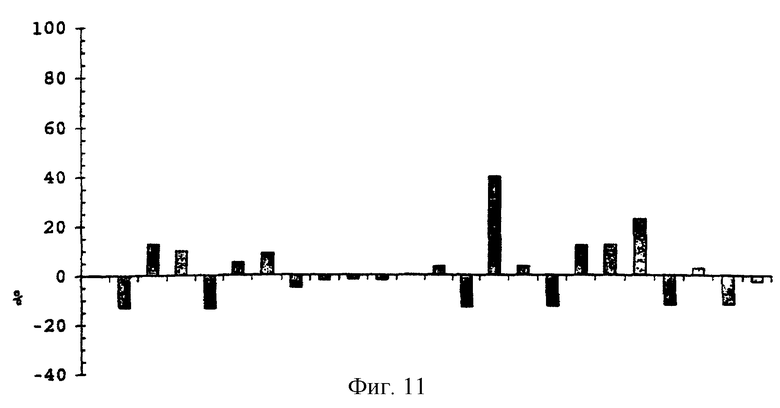
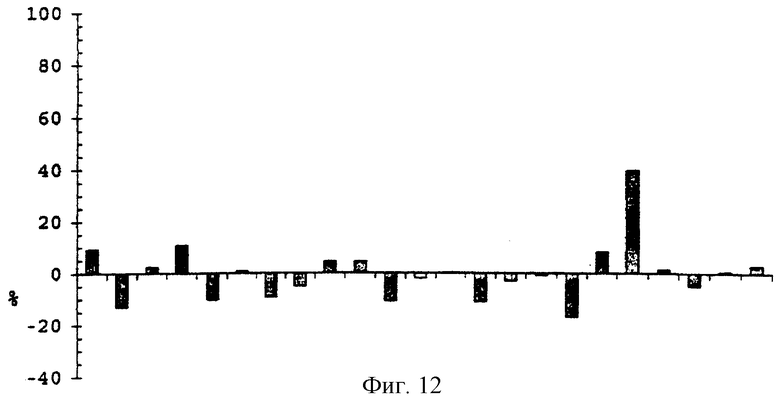
Пептиды, приведенные в таблице 4, были исследованы в отношении их способности блокировать на модели ингибирование роста клеток линии MV-1-Lu. Поскольку TGFβ1 способен ингибировать рост клеток этой линии, ингибирование трансформирующего фактора роста TGFβ1 пептидами могло бы вернуть клеткам способность к росту. Эти исследования показаны на фиг. от 9 до 12.
Как можно видеть на фиг. от 9 до 12, существуют различные пептиды, которые способны ингибировать рост клеток линии MV-1-Lu в большей или меньшей степени, но только пептид Р54 способен почти полностью ингибировать активность TGFβ1. Для более детального изучения этого пептида были проведены исследования влияния различных концентраций пептида на активность TGFβ1 при фиксированной концентрации TGFβ1, равной 200 пг/мл.
Исследование влияния дозы на ингибирование активности TGFβ1 под действием пептида Р54
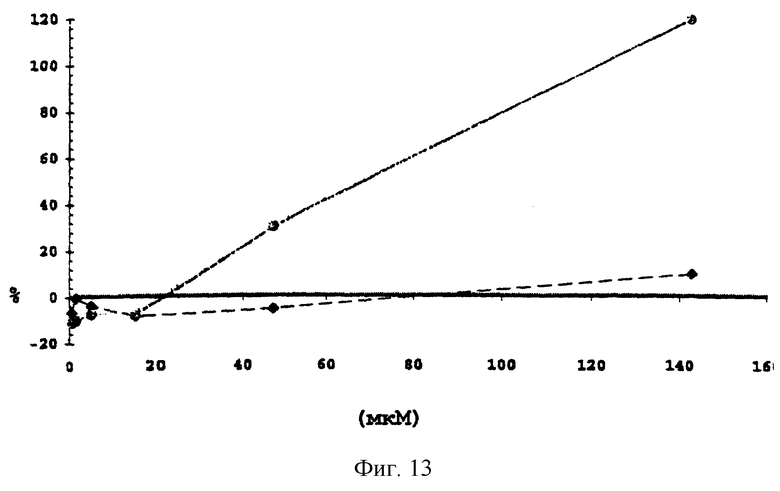
Исследовали влияние концентрации пептида Р54 на ингибирование активности TGFβ1. Вследствие низкой растворимости этого пептида готовили исходный раствор номинальной концентрации пептида, таким же образом, как и в случае пептида Р12, брали аликвоты такого раствора и фильтровали или даже использовали непосредственно в исследованиях ингибирования.
На фиг.13 показано ингибирующее действие пептида, используемого в номинальной концентрации, до и после фильтрации. Можно видеть, что при использовании фильтрата пептида Р54 не наблюдается измеримого ингибирования активности.
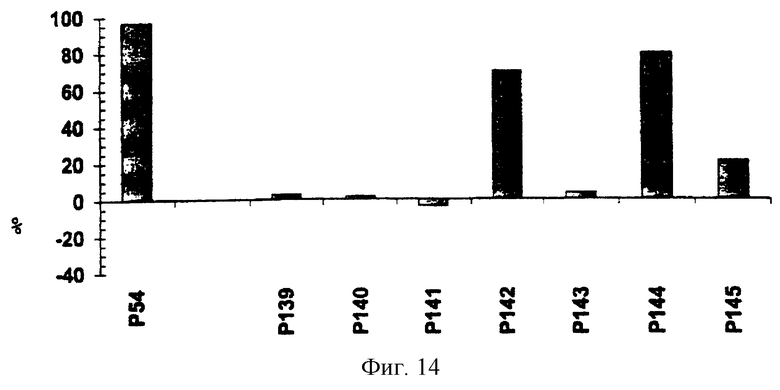
Подтвердив способность пептида Р54 ингибировать активность TGFβ1 таким образом, что ингибирование зависит от используемой дозы пептида, авторы настоящего изобретения перешли к синтезу новых пептидов, взяв за основу аминокислотную последовательность пептида Р54, с целью попытаться улучшить растворимость и, следовательно, увеличить активность пептида при использовании в меньших дозах. Также были синтезированы два пептида, полученные из рецептора типа III человека. Один из этих пептидов (Р144) был эквивалентен пептиду Р54. Другой пептид (Р145) сходен с пептидом Р106 рецептора типа III крысы, который также проявлял активность. Эти новые пептиды показаны в таблице 5.
Результаты исследования активности пептидов, приведенных в таблице 5, показаны на фиг.14.
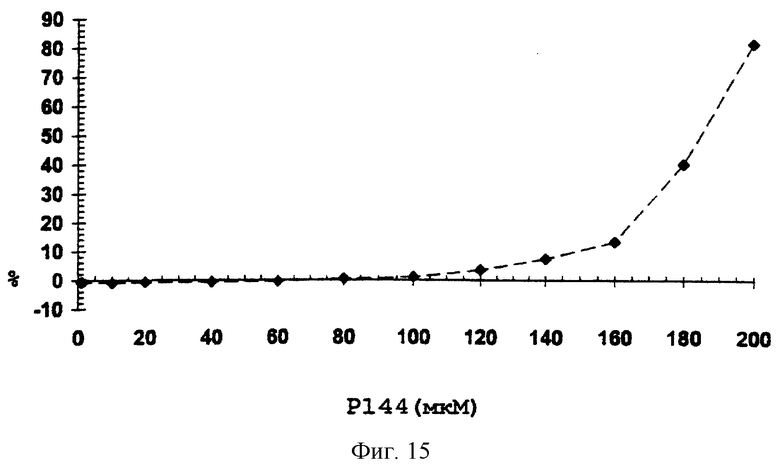
Исследование влияния дозы ингибирования TGFβ1 под действием пептида Р144
Проводили исследование влияния дозы на величину достигаемого эффекта ингибирования под действием пептида Р144, полученного из последовательности рецептора типа III человека, для того, чтобы определить, зависит ли активность этого пептида от концентрации (фиг.15). Можно видеть, что активность пептида снижается при понижении концентрации пептида, используемого в тестах.
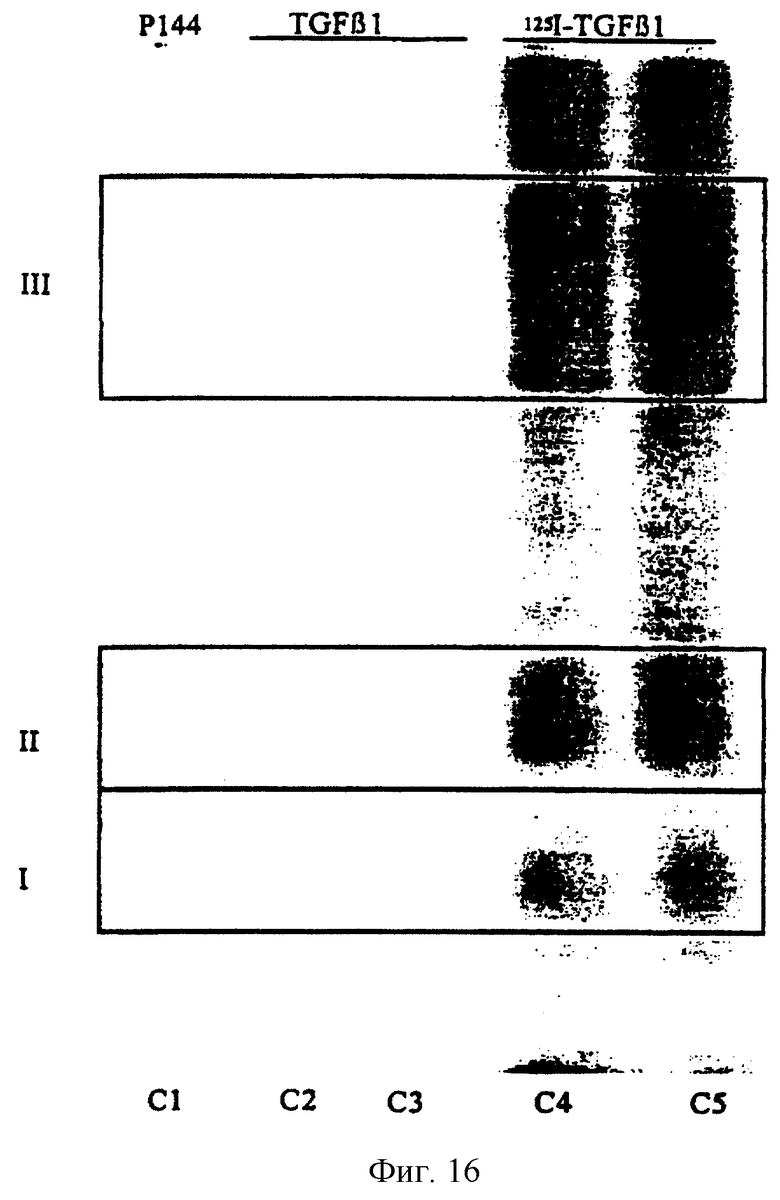
Исследование ингибирования связывания TGFβ1 с его рецепторами под действием пептида Р144 (введение аффинных меток)
Пептид Р144, полученный из последовательности рецептора типа III человека, использовали в исследованиях, связанных с введением аффинных меток, для подтверждения способности этого пептида ингибировать связывание TGFβ1 с его клеточными рецепторами (Материалы и методы).
Вследствие различной активности использовавшихся партий 125I-TGFβ1, концентрацию пептида, использовавшегося при проведении исследования, в каждом случае приводили в соответствие с использовавшейся концентрацией партии 125I-TGFβ1. Результаты этих исследований показаны на фиг.15.
После подтверждения ингибирования связывания трансформирующего фактора роста TGFβ1 с соответствующими ему рецепторами под действием пептида Р144, дальнейшие исследования проводили для того, чтобы "оттитровать" пептид Р144. Было обнаружено, что пептид теряет свою активность при концентрации, равной 2×105 молярной концентрации 125I-TGFβ1.
Ингибирование трансформирующего фактора роста TGFβ1 под действием пептидов, полученных из других белков, способных связывать трансформирующий фактор роста TGFβ1 и согласно предположениям, являющихся комплементарными трансформирующему фактору роста TGFβ1
В этой серии синтезированы пептиды, структура которых приведена в таблице 6, полученные из белков, способных к связыванию с TGFβ1.
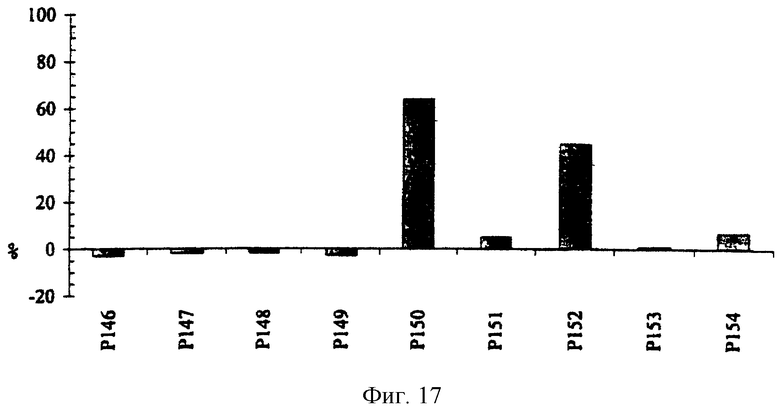
На фиг. 17 и 18 показана ингибирующая активность пептидов, приведенных в таблице 6.
Как можно видеть на фигурах 17 и 18, только пептид Р150 проявляет активность большую, чем 50%. Однако было обнаружено, что пептиды Р146 и Р149, которые, как сообщалось Деметриу и др. (Demetriou M et al. (1996) J. Biol. Chem. 271:12755-12761) обладают активностью, не проявляли активность в условиях этого исследования.
Измерения методом проточной цитометрии ингибирующего действия синтетических пептидов на связывание трансформирующего фактора роста TGFβ1 с его рецепторами
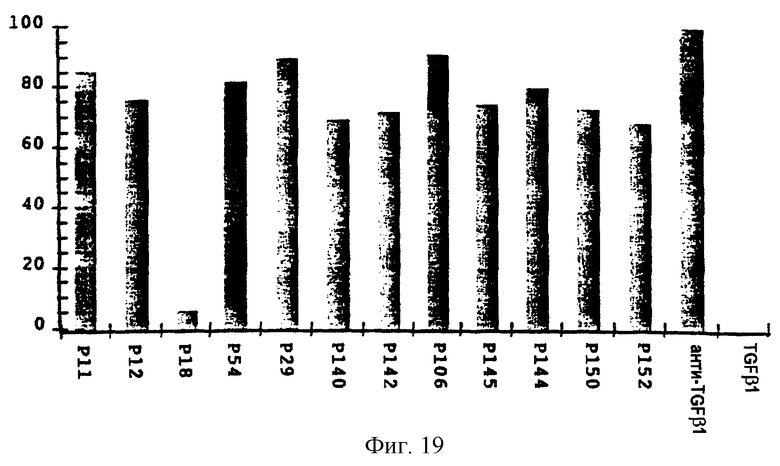
Пептиды, полученные предыдущими синтезами, как пептиды, которые были синтезированы из последовательности TGFβ1, так и пептиды, которые были синтезированы из рецептора типа III, использовали для измерения методом проточной цитометрии их способности ингибирования связывания TGFβ1 с рецепторами клеток. При проведении этих исследований клетки инкубировали с пептидом перед добавлением авидин-FITS (Материалы и методы). Затем измеряли интенсивность флуоресценции авидин-FITS: интенсивность флуоресценции будет прямо пропорциональна количеству TGFβ1, связанного с клетками, и обратно пропорциональна активности пептида. Результаты, полученные для пептидов, представляющих наибольший интерес, показаны на фиг.19 и в таблице 7.
ИНГИБИРОВАНИЕ АКТИВНОСТИ ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА TGFβ1 IN VIVO
Пептид Р144, полученный из последовательности рецептора типа III человека, активность указанного пептида была подтверждена биоанализом ингибирования роста клеток линии MV-1-Lu, использовали в исследованиях in vivo для изучения ингибирующего действия пептида по индуцированию экспериментального цирроза под воздействием ССl4 на модели у крыс. Эксперимент, моделирующий цирроз у крыс линии Вистар
На этой модели цирроз печени индуцировали ингаляцией четыреххлористого углерода в течение 11 недель, дважды в неделю (Lopez Novoa JM et al. (1976) Patologia IX:223-240; Camps J. et al. (1987) Gastroenterology 93:498-505), как описано в "Материалы и методы".
Пептид Р144 вводили в соответствии с двумя методиками:
1. Методика 1: пептид вводили через день внутрибрюшинно в течение процесса индуцирования цирроза (11 недель). Фиг. 20 и 21.
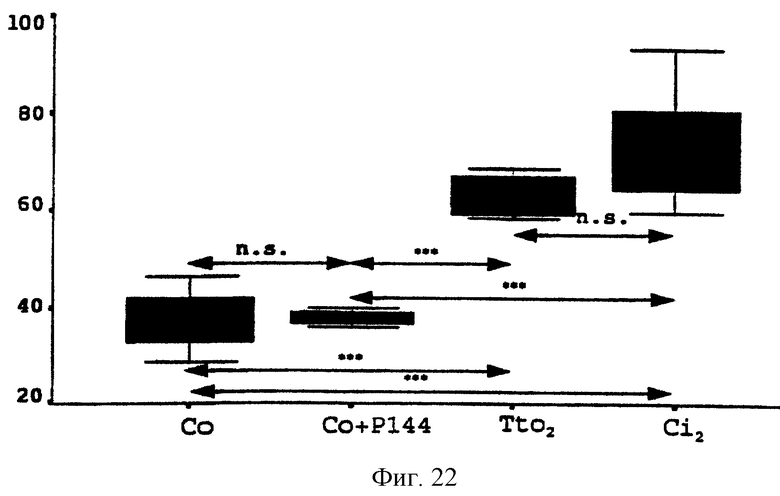
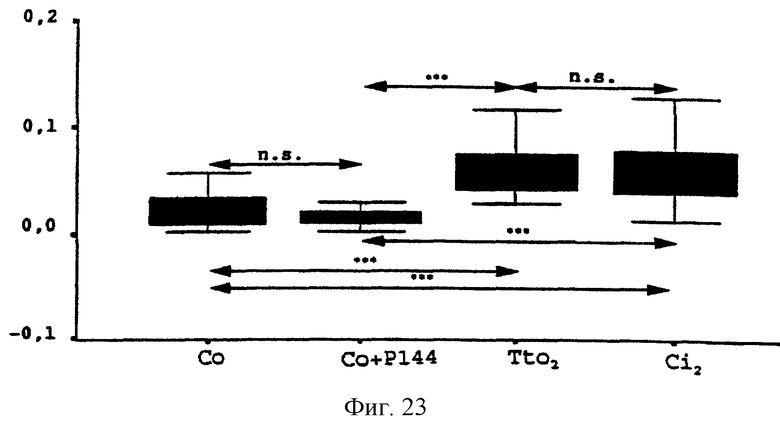
2. Методика 2: пептид вводили через день внутрибрюшинно в течение 3 недель, после того, как цирроз сформировался, а именно, с 12 недели после начала процесса индуцирования цирроза. Фиг. 22 и 23.
Образование коллагена при использовании и первой, и второй методики определяли с помощью двух методов:
На фиг. 36 и 38 показано суммарное количество образовавшегося коллагена, измеренное путем окрашивания срезов печени (два на животное) красителями зеленым Fast Green и красным Direct Red, с последующим элюированием окраски и спектрофотометрическим детектированием (материалы и методы) (Lopez de Leon A. and Rojkind (1985) Histochem. Cytochem. 33:737-743; Gaudio E. et al. (1993) Int. J. Exp. Path. 74:463-469).
На фиг. 21 и 23 показано количество образовавшегося коллагена, измеренное методом анализа изображений срезов печени, окрашенных красителем сириус красный, с использованием оптического микроскопа (материалы и методы).
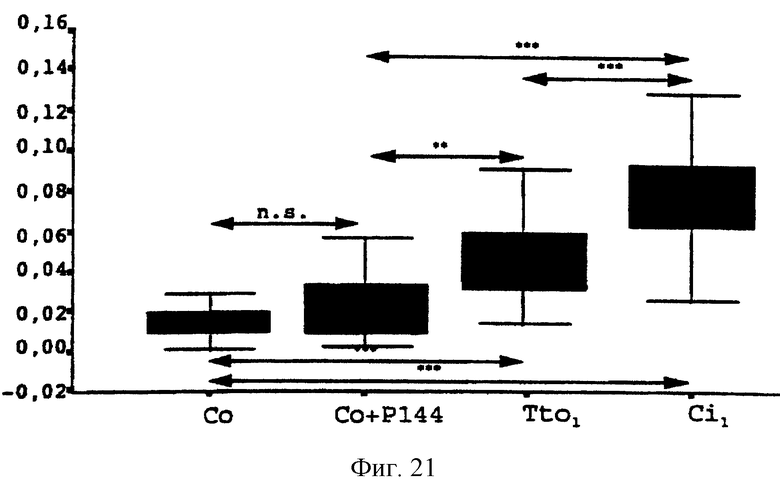
Как можно видеть на фиг. 20, при анализе величины соотношения коллагена к суммарному белку наблюдаются статистически значимые различия (Р<0,05) между группами крыс, получавших пептид Р144 (Tto1), и контрольной группой крыс, подвергнутых циррозу (Ci1). На фиг.37, в том случае, когда рассматривается площадь участков, подвергнутых фиброзу, также видны статистически значимые различия (Р<0,001) между группами крыс, получавших пептид Р144 (Tto1), и контрольной группой крыс, подвергнутых циррозу (Cl1).
Как можно видеть на фиг. 22 и 23, на которых приведены результаты, относящиеся к крысам, получавшим пептид после того, как цирроз сформировался, различия между группой крыс, получавших пептид Р144 (Tto2), и группой крыс, не получавших пептид (Ci2), не являются статистически значимыми в тех случаях, когда для оценки фиброза используется какая-либо из указанных двух методик.
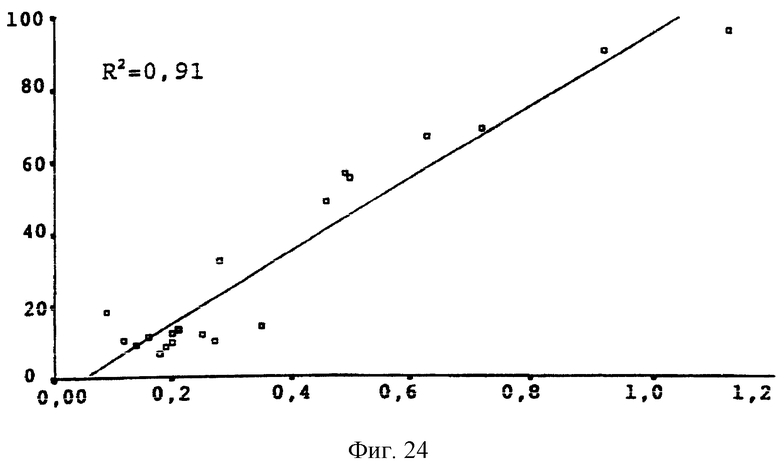
Было проведено сравнение двух методик, использованных для определения количества коллагена, с использованием регрессионного анализа, с целью проверить случайность выбора полей для исследования в каждом из препаратов и, следовательно, проверить достоверность анализа изображений, фиг. 24 и 25.
Как можно видеть на фиг. 24 и 25, существует корреляция между двумя методиками с R>0,85 в том и другом случаях, которая является статистически значимой (F<0,001). Это подтверждает, что выбор изображений для исследования осуществлялся совершенно случайно и, таким образом, подтверждает достоверность данных, полученных методом анализа изображений.
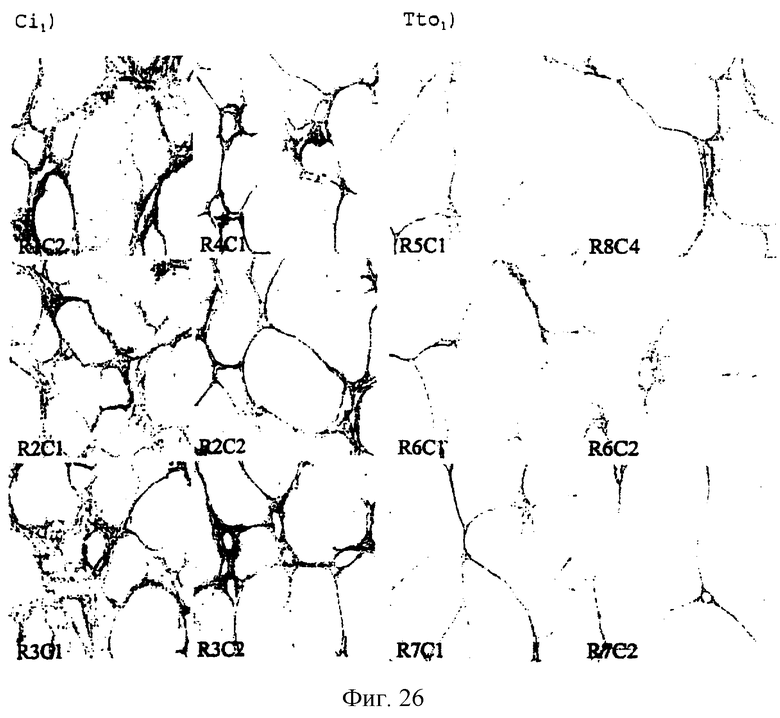
На фиг. 26 и 27 показаны изображения, полученные в оптическом микроскопе для препаратов печени, окрашенных красителем сириус красный при увеличении 10Х, полученных из печени крыс, получавших пептид во время индуцирования процесса цирроза (Ci1 и Tto1).
Изображения, приведенные на фиг. 26, были получены без использования какого-либо фильтра.
На фиг. 27 приведены изображения, после того, как они были модифицированы для исследования с использованием специальных компьютерных программ. Эти модификации заключаются в использовании двух светофильтров, одного - поляризационного светофильтра, а другого - зеленого светофильтра, для улучшения качества изображения и облегчения их автоматизированной оценки.
Фиг. 26 и 27 позволяют обнаружить различия между изображениями препаратов, полученных от крыс, подвергнутых циррозу (Ci1), и таких же крыс, получавших пептид Р144 (Tto1).
Различия в эффективности методик 1 и 2 могут быть следствием того факта, что продуцирование TGFβ1 может быть значительно ниже в том случае, когда цирроз уже вызван (методика 2), чем во время индуцирования процесса цирроза под воздействием ССl4 (методика 1), и даже может находиться на обычном уровне, так что влияние обработки пептидом Р144 может быть менее выражено в случае использования методики 2, чем в случае использования методики 1.
При сравнении группы крыс, не получавших пептид, в конце процесса индуцирования цирроза (Сi1), с группой крыс, не получавших пептид, подвергнутых циррозу, на четвертой неделе после завершения процесса индуцирования цирроза (Ci2), авторы настоящего изобретения обнаружили, что существуют статистически значимые различия (Р=0,016) между этими двумя группами (фиг.28), которые могут означать, что имеется частичная регрессия цирроза в тех случаях, когда устраняют действие агента, вызывающего цирроз, что отмечалось рядом авторов (Szende-В et al. (1992) In Vivo 6:355-361; Columbano A (1996) Carcinogenesis 17:395-400).
Указанные различия в эффективности двух методик могут также быть следствием самих методик, т. к. согласно методике 2 животных подвергают лечению только в течение 3 недель через день, в то время как согласно методике 1 животных подвергают лечению в течение более длительного времени (7 недель, также через день).
Полученные результаты свидетельствуют о том, что вполне возможно ингибировать активность трансформирующего фактора роста TGFβ1 как in vitro, так и in vivo под действием синтетических пептидов, полученных из различных белков. В будущем представляло бы большой интерес попытаться повысить биологическую активность этих пептидов. Это могло бы быть осуществлено путем систематической замены каждой из аминокислот, входящих в их последовательность, другими 19. Как только пептид с более высокой активностью будет получен, будет необходимо получить их мимеотопы (McConnell-SJ (1994) Gene 151:115-118; Steward-MW (1995) J. Virol. 69:7668-7673), для того, чтобы увеличить среднюю продолжительность жизни ингибирующего агента в организме.
ОПИСАНИЕ ФИГУР
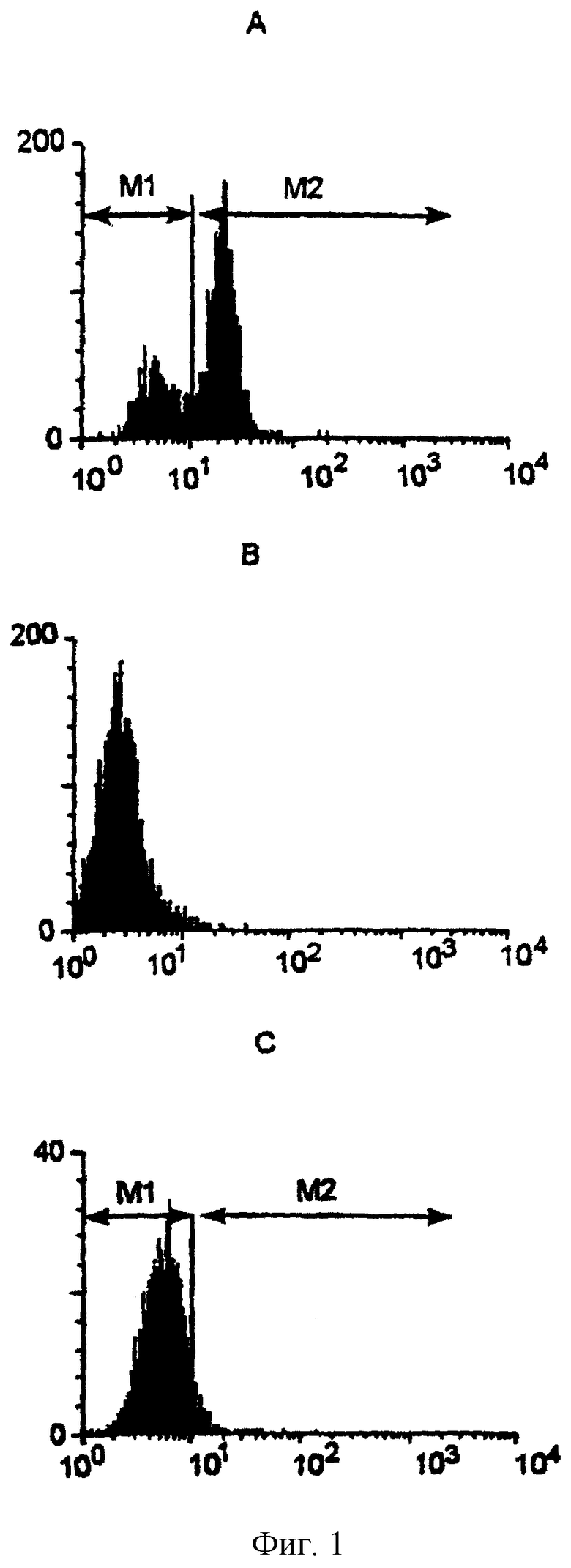
Фиг.1. Ингибирование связывания TGFβ1 с клетками линии MV-1-Lu под действием пептида Р144, измеренное методом проточной цитометрии. Изображение А, полученное при исследовании клеток, инкубированных с биотинилированным TGFβ1 и выращенных с авидин-FITC. Изображение В, полученное при исследовании клеток, инкубированных с авидин-TCFβ1 без предшествующего добавления TGFβ1. Изображение С, полученное при исследовании клеток, инкубированных с TGFβ1 и предварительно инкубированных с пептидом Р144 в концентрации 0,42 мкг/мкл, и выращенных с авидин-FITC. На оси абсцисс указано измеренное значение интенсивности флуоресценции, а на оси ординат указано количество клеток, соответствующее этому значению интенсивности флуоресценции. Также показаны области, соответствующие клеткам, меченным TGFβ1-биотином и авидин-FITC (М2), и клеткам, не содержащим метку (M1).
Фиг.2. Схематическое представление процесса цирроза под действием ССl4. Черные стрелки показывают, когда крысам вводили две недельные дозы ССl4, а черные стрелки с пунктиром показывают, когда крысам вводили одну недельную дозу. Серые стрелки показывают введение пептида Р144. А: контрольная группа здоровых крыс; В: контрольная группа здоровых крыс + Р144, B1: с пептидом в количестве 70 мкг/день; С: группа крыс, подверженных циррозу; C1 с солевым раствором; C2 с пептидом в количестве 70 мкг/день; D: группа крыс, подверженных циррозу под воздействием ССl4+фенобарбитала; D1 плюс солевой раствор; D2 плюс пептид в количестве 70 мкг/день.
Фиг.3. Влияние TGFβ1 на рост клеток линии линии MV-1-Lu. Клетки выращивали при плотности 5000 клеток на лунку и при указанной концентрации TGFβ1, пг/мл. По оси абсцисс: концентрация TGFβ1 (пг/мл); по оси ординат: число циклов в минуту (с.р.m.).
Фиг.4. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием пептидов, полученных из TGFβ1. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.5. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) в присутствии пептида Р152 в различных номинальных концентрациях, с фильтрованием (◆) и без фильтрования (•).
Фиг.6. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием пептидов, полученных из TGFβ1. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
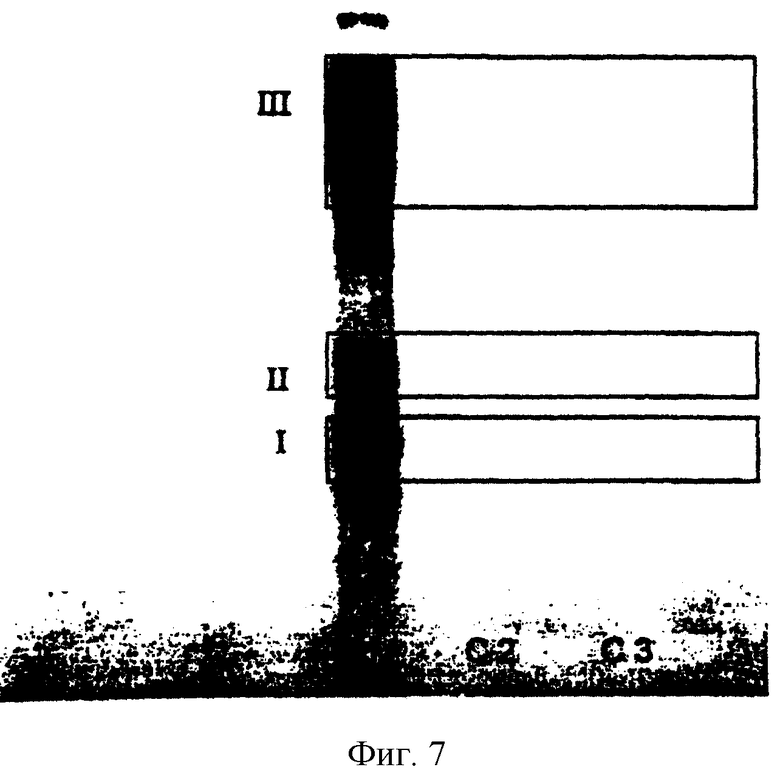
Фиг.7. Авторадиография, полученная при исследовании рецепторов трансформирующего фактора роста TGFβ1 с введением аффинных меток. Дорожка С1: влияние инкубирования клеток с 125I-TGFβ1 в концентрации 0,16 мкМ, которая соответствует радиоактивности 0,3 мкКи (положительный контроль). Дорожка С2: влияние предварительного инкубирования клеток с нерадиоактивным TGFβ1 в концентрации в 10 раз большей, чем концентрация 125I-TGFβ1 (положительный контроль). Дорожка С3: предварительное инкубирование осуществляли с пептидом Р29 в концентрации в 106 раз выше, чем молярная концентрация 125I-TGFβ1. Можно видеть, что наблюдается ингибирование связывания 125I-TGFβ1 с рецепторами клеток I, II и III типов как под действием пептида Р29, так и под действием нерадиоактивного TGFβ1.
Фиг.8. Авторадиография, полученная при исследовании рецепторов TGFβ1 с введением аффинных меток. Дорожки от С1 до С6: влияние предварительного инкубирования с клетками линии MV-1-Lu при различной концентрации пептида Р29 (106, 8×105, 6×105, 4×105, 2×l05 и 105 от молярной концентрации 125I-TGFβ1, соответственно), до добавления 125I-TGFβ1. Дорожка С7: влияние предварительного инкубирования клеток линии MV-1-Lu с немеченым TGFβ1 (102 от молярной концентрации 125I-TGFβ1) до добавления 125I-TGFβ1 (отрицательный контроль). Дорожка С8: влияние предварительного инкубирования клеток линии MV-1-Lu с 125I-TGFβ1 в концентрации 0,42 мкМ, соответствующей активности 0,4 мкКи, без предварительного инкубирования (положительный контроль).
Фиг.9. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием пептидов, полученных из рецепторов, предположительно являвшихся комплементарными областям TGFβ1. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование активности TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.10. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием перекрывающихся пептидов, полученных из внеклеточной области рецептора типа III. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.11. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием перекрывающихся пептидов, полученных из внеклеточной области рецептора типа III. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.12. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием перекрывающихся пептидов, полученных из внеклеточной области рецептора типа III. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.13. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) в присутствии пептида Р54 в различных номинальных концентрациях, с фильтрованием (◆) и без фильтрования (•).
Фиг.14. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием перекрывающихся пептидов, полученных при модификации пептида Р54 (от Р139 до Р143), и пептидов, полученных из рецептора типа III человека (Р144 и Р145). Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.15. Процентное соотношение ингибирования активности TGFβ1 (200 пг/мл) в присутствии пептида Р144 в различных номинальных концентрациях, без фильтрования.
Фиг.16. Авторадиография, полученная при исследовании рецепторов трансформирующего фактора роста TGFβ1 с введением аффинных меток. Дорожка С1: предварительное инкубирование в присутствии пептида Р144 в концентрации в 106 раз выше, чем молярная концентрации 125I-TGFβ1. Дорожки С2 и С3: влияние предварительного инкубирования клеток с нерадиоактивным TGFβ1, присутствующим в концентрации в 10 раз выше, чем концентрация 125I-TGFβ1 (отрицательный контроль). Дорожки С4 и С5: влияние инкубирования клеток с 125I-TGFβ1 в концентрации 0,1 мкМ, которая соответствует активности 0,2 мкКи (положительный контроль). Можно видеть, что наблюдается ингибирование связывания 125I-TGFβ1 с рецепторами клеток под действием пептида Р144, так и под действием нерадиоактивного TGFβ1.
Фиг.17. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием пептидов, полученных из рецептора типа II человека (Р146), из фетуина (от Р147 до Р149) и из эндоглина (от Р150 до Р154). Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.18. Процентное соотношение ингибирования TGFβ1 (200 пг/мл) под действием пептидов, полученных из α2-макроглобулина. Все пептиды тестировали при концентрации 200 мкг/мл. Ингибирование TGFβ1, равное 100%, соответствует росту клеток линии MV-1-Lu, который наблюдается в отсутствие TGFβ1.
Фиг.19. Процентное соотношение ингибирования связывания TGFβ1 с клетками линии MV-1-Lu под действием различных синтетических пептидов. Ингибирование изучали путем измерения процентного соотношения меченых клеток (эмитируют флуоресценцию) и немеченых клеток (не эмитируют флуоресценцию) для каждого из пептидов (материалы и методы).
Фиг.20. Влияние введения пептида Р144 на синтез коллагена в процессе экспериментального индуцирования цирроза под воздействием ССl4. Соотношение коллагена к суммарному белку приведено на оси ординат. Абсцисса показывает различные группы крыс: Со=группа здоровых крыс; Со+Р144=группа здоровых крыс, получавших пептид Р144; Tto1=группа крыс, подвергнутых циррозу под воздействием ССl4 и получавших пептид Р144 во время этого периода через день; Ci1=группа крыс, подвергнутых индуцированию цирроза под действием ССl4 в течение 11 недель и не получавших пептид Р144.
Фиг.21. Влияние введения пептида Р144 на синтез коллагена в процессе экспериментального индуцирования цирроза под воздействием ССl4. На оси ординат показано соотношение площади участка, подверженного циррозу. к суммарной площади тканевого препарата, окрашенного красителем сириус красный. Абсцисса показывает различные группы крыс: Со=группа здоровых крыс; Со+Р144=группа здоровых крыс, получавших пептид; Tto1=группа крыс, подвергнутых циррозу под воздействием ССl4, которым вводили пептид Р144 через день в течение этого периода и Ci1=группа крыс, подвергнутых индуцированию цирроза под воздействием ССl4 в течение 11 недель и не получавших пептид Р144.
Фиг.22. Влияние введения пептида Р144 на синтез коллагена после того, как был индуцирован цирроз под воздействием ССl4. На оси ординат показано соотношение коллагена к суммарному белку. Абсцисса показывает различные группы крыс: Со=здоровые крысы; Со+Р144=здоровые крысы, получавшие пептид; Tto2=крысы, подвергнутые циррозу под воздействием ССl4, которым вводили пептид Р144 через день в конце этого периода, и Ci2 = крысы, подвергнутые индуцированию цирроза под воздействием ССl4 в течение 11 недель и не получавшие пептид Р144.
Фиг.23. Влияние введения пептида Р144 на синтез коллагена после того, как был индуцирован цирроз под воздействием CCl4. На оси ординат показано соотношение площади, подверженной циррозу к суммарной площади тканевого препарата. Абсцисса показывает различные группы крыс: Со=здоровые крысы; Со+Р144=здоровые крысы, получавшие пептид; Tto2=крысы, подвергнутые циррозу под воздействием ССl4, которым вводили пептид Р144 через день в конце этого периода, и Ci2=крысы, подвергнутые индуцированию цирроза под воздействием ССl4 в течение 11 недель и не получавшие пептид Р144.
Фиг.24. Сравнение данных, относящихся к количеству коллагена и площади участков, подверженных фиброзу, полученных двумя использованными методами. Абсцисса показывает соотношение площади участков, подверженных фиброзу, к суммарной площади, полученное методом анализа изображений. Ордината показывает величину соотношения количества коллагена, мкг, к количеству суммарного белка, мг, полученных методом спектрофотометрического анализа срезов печени, окрашенных красителями Direct Red и Fast Green. Приведено R2. (F≤0,001).
Фиг.25. Сравнение данных, относящихся к количеству коллагена и площади участков, подверженных фиброзу, полученных двумя использованными методами для образцов, полученных в конце осуществления методики 2. Абсцисса показывает соотношение площади участков, подверженных фиброзу, к суммарной площади, полученное методом анализа изображений. Ордината показывает величину соотношения количества коллагена, мкг, к количеству суммарного белка, мг, полученных методом спектрофотометрического анализа срезов печени, окрашенных красителями Direct Red и Fast Green. Приведено R2. (F≤0,001).
Фиг.26. Изображения, которые соответствуют 24 областям препаратов печени крысы, окрашенным красителем сириус красный, полученные методом оптической микроскопии (10×). Крысы, подвергнутые циррозу (Ci1), в конце индуцирования цирроза под воздействием ССl4, и крысы, подвергнутые циррозу, получавшие пептид Р144 (Tto1) в процессе индуцирования цирроза под воздействием СС14. Из препаратов, полученных для каждого животного, взяты различные области (R=крыса и С=область).
Фиг.27. Изображения, которые соответствуют 24 областям препаратов печени крысы, окрашенным красителем сириус красный, полученные методом оптической микроскопии (10×). Крысы, подвергнутые циррозу (Ci1), в конце индуцирования цирроза под воздействием ССl4, и крысы, подвергнутые циррозу, получавшие пептид Р144 (Tto1) в процессе индуцирования цирроза под воздействием ССl4. Из препаратов, полученных для каждого животного, взяты различные области (R=крыса и С=область). Для того, чтобы обнаружить коллагеновые волокна, использовали поляризованный свет и зеленый светофильтр.
Фиг.28. Сравнение двух групп крыс, подвергнутых циррозу и не получавших лечение. Ci1 относится к крысам, подвергнутым циррозу, в конце 12 недель индуцирования цирроза под воздействием ССl4, Ci2 относится к крысам, подвергнутым циррозу, на 4 неделе после завершения процесса индуцирования цирроза. Р=0,016. По оси ординат: площадь участков, подвергнутых фиброзу/общая площадь.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С TGF-β 1 И ИНГИБИРОВАТЬ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ TGF-β 1 IN VITRO И/ИЛИ IN VIVO, ПРИМЕНЕНИЕ ПЕПТИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, КОНСТРУКЦИЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА | 2004 |
|
RU2333917C2 |
| ПРИМЕНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК, КОТОРАЯ КОДИРУЕТ ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА β1 (ВАРИАНТЫ) | 2008 |
|
RU2455358C2 |
| ПРИМЕНЕНИЕ ИНГИБИРУЮЩИХ TGF-бета1 ПЕПТИДОВ ДЛЯ ПРИГОТОВЛЕНИЯ МОДУЛИРУЮЩЕГО ИММУННЫЙ ОТВЕТ АГЕНТА | 2005 |
|
RU2420307C2 |
| АНТАГОНИСТЫ АЛЬФАVБЕТА3 И АЛЬФАVБЕТА6 ИНТЕГРИНОВ В КАЧЕСТВЕ АНТИФИБРОТИЧЕСКИХ АГЕНТОВ | 2004 |
|
RU2388472C2 |
| УСОВЕРШЕНСТВОВАННОЕ РАНЕВОЕ ПОКРЫТИЕ ДЛЯ УЛУЧШЕНИЯ ЗАЖИВЛЕНИЯ РАН | 2000 |
|
RU2245722C2 |
| СОЕДИНЕНИЯ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ ПЕПТИДНЫЕ АНАЛОГИ СТИМУЛЯТОРОВ СЕКРЕЦИИ ГОРМОНА РОСТА, И СОДЕРЖАЩИЕ ИХ ПРЕПАРАТЫ | 2007 |
|
RU2416618C2 |
| АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА IGF-I | 2018 |
|
RU2785305C2 |
| СКОНСТРУИРОВАННЫЕ АНТИ-TGF-БЕТА АНТИТЕЛА И АНТИГЕН-СВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ | 2014 |
|
RU2681502C2 |
| ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ МЕЗОТЕЛИОМЫ | 2004 |
|
RU2392967C2 |
| ГУМАНИЗИРОВАННЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ФАКТОРУ РОСТА ГЕПАТОЦИТОВ | 2007 |
|
RU2461570C2 |





















Изобретение относится к синтетическим пептидам-антагонистам связывания трансформирующего фактора роста TGFβ1 с его рецепторами в организме с последовательностью, содержащей от 2 до 15 аминокислот, которые являются идентичными или схожими с аминокислотами природного трансформирующего фактора роста TGFβ1 и/или его рецепторов. Пептиды могут использоваться в качестве активных соединений для приготовления композиций, используемых при заболеваниях печени, в частности при фиброзе печени (циррозе). 1 н. и 9 з.п. ф-лы, 7 табл., 28 ил.
| ПЕРЕДАЧА СИГНАЛОВ РАДИОМАЯКА НА ОСНОВЕ КЛАСТЕРОВ | 2019 |
|
RU2720069C1 |
| WO 9625178 A1, 22.08.1996 | |||
| WO 9220793 A1, 26.11.1992. | |||
Авторы
Даты
2004-07-20—Публикация
1999-11-23—Подача