Данное изобретение относится к композициям, состоящим из частиц лекарственного средства, нерастворимого в воде или плохо растворимого в воде, размером примерно от 0,05 до 10 микрометров, имеющих в составе модифицирующее поверхность вещество или комбинацию веществ, из которых, по меньшей мере, одно является фосфолипидом, адсорбированным на их поверхности. Композиция включает образующее(ие) матрицу вещество(а), которое(ые) присутствует(ют) в количестве, достаточном для того, чтобы обеспечить возможность лиофильной сушки и последующего высвобождения частиц лекарственного вещества с поверхностным покрытием при контакте с водной средой. Небольшие частицы с поверхностным покрытием иногда называют микрокристаллами (в патенте США №5091187 и 5091188), микрочастицами (WO 98/07414), наночастицами (US 5145684 и 5302401).
Это изобретение, кроме того, обеспечивает способы приготовления высушенных композиций из частиц лекарственного средства, нерастворимого в воде или плохо растворимого в воде, имеющих в составе модифицирующее поверхность вещество или комбинацию веществ, из которых, по меньшей мере, одно является фосфолипидом, адсорбированным на их поверхности, и образующие матрицу вещества. Образующее(ие) матрицу вещество(а) присутствует(ют) в количестве, достаточном для того, чтобы обеспечить возможность сушки из замороженного состояния, такой как лиофилизация, с последующим высвобождением частиц лекарственного вещества с поверхностным покрытием при контакте с водной средой. Способ включает контактирование указанных покрытых фосфолипидами частиц с образующим(и) матрицу веществом(ами) в течение срока и при условиях, достаточных для того, чтобы обеспечить возможность сушки замораживанием частиц лекарственного вещества, покрытого фосфолипидами.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Плохая биодоступность нерастворимых в воде соединений долго была проблемой для фармацевтического производства и производства диагностических средств. В то время как считается, что соединения с растворимостью в воде более 1% в/о не создают проблем с биодоступностью, связанной с растворением, и с абсорбцией, многие новые химические соединения имеют растворимость в воде значительно ниже этого значения (см. Pharmaceutical Dosage Forms - Tablets, Vol. 1, page 13. Edited By H. Lieberman, Marcel Dekker, Inc, 1980). Многие высокоценные соединения выпадают из разработки, или их изготавливают другим нежелательным способом из-за плохой растворимости в воде. Большое число этих соединений нестабильны в водной среде, и некоторые требуют растворения в масле, часто делая дозированную лекарственную форму неприятной для применения или даже болезненной при применении путем парентерального введения. Это может приводить к трудностям в достижении согласия пациента на лечение и, потенциально, к большим общим расходам на лечение, связанным с госпитализациями, которые не были необходимы. Поэтому существует потребность в разработке лекарственной формы с этими нерастворимыми в воде соединениями, которая может быть дозирована в простейшей возможной форме: быстро диспергируемой твердой дозированной форме.
Существует много способов приготовления быстро диспергируемых твердых дозированных лекарственных препаратов. Традиционные подходы к этой проблеме включали дисперсию биологически активного ингредиента в фармацевтически приемлемых наполнителях с применением методик смешивания и/или методов грануляции. Могут применяться специфические функциональные наполнители, известные специалистам, которые помогают освобождению лекарственного препарата, как, например, шипучие дезинтегрируемые средства, как указано в патенте США №5178878.
В качестве способа улучшения дезинтеграции твердой дозированной лекарственной формы с освобождением таким образом лекарственного вещества ранее применялись методики сушки замораживанием, которые описаны в патентах США №4371516, 4758598, 5272137. Кроме того, применялись методики распылительной сушки для подобных целей, как, например, в патенте США 5776491, в котором описано применение полимерного компонента, солюбилизирующего компонента и увеличивающего объем вещества в качестве матрицы, образующей композицию при распылительной сушке. Эта матрица в виде микрочастиц быстро дезинтегрируется при помещении в водную среду с высвобождением лекарственного вещества. Хотя при этих подходах получаются быстро высвобождающие лекарственное вещество твердые дозированные формы, они страдают рядом недостатков, особенно те, что с лекарственными веществами, которые нерастворимы в воде или плохо растворимы в воде. В этих случаях суспензии из нерастворимых в воде соединений, вероятно, будут оседать до завершения процесса сушки замораживанием (лиофилизации) или распылительной сушки, что приводит к агрегации частиц и, потенциально, к получению негомогенных сухих дозированных форм. Кроме того, большие макромолекулы полисахаридов, типичными примерами которых являются декстраны, при использовании их в качестве вспомогательных веществ в качестве формирователя матрицы имели склонность к агломерации в воспроизведенных суспензиях лиофилизированных липосом (Miyajima, 1991). Поэтому соответствующий выбор и применение сахаридных образующих матрицу веществ остаются трудным делом, что очевидно связано с физико-химической природой поверхности рассматриваемых нерастворимых в воде частиц.
Кроме того, суспензии нерастворимых в воде частиц будут подвергаться нежелательному росту размера частиц в результате процесса созревания Оствальда. Чтобы уменьшить этот процесс, может быть достигнута стабилизация этих микронизированных веществ, суспендированных в водной среде, путем использования композиций ряда фармацевтически приемлемых вспомогательных веществ, известных специалистам. Такие подходы можно найти, например, в общедоступных патентах США №5631023 и 5302401 и ЕР 0193208.
Например, в патенте США 5631023 раскрыт способ получения быстро растворяющихся таблеток (10 секунд) с использованием ксантановой камеди при максимальном весовом процентном содержании 0,05% в качестве суспендирующего и флоккулирующего вещества с желатином, в котором диспергированы частицы нерастворимого в воде лекарственного средства. В качестве предпочтительного криопротектанта использован маннит. Суспензию сушили замораживанием в формочках, чтобы получить твердую дозированную форму.
В патенте США №5302401 описан способ снижения роста размера частиц во время лиофилизации. В нем раскрывается композиция, содержащая частицы, имеющие в составе модификатор поверхности, адсорбированный на поверхности вместе с криопротектантом, причем криопротектант присутствует в количестве, достаточном для образования композиции криопротектанта, состоящей из наночастиц. Предпочтительным модификатором поверхности является поливинилпирролидон, а предпочтительным криопротектантом является углевод, такой как сахароза. Описаны также способы получения частиц, имеющих в составе модификатор поверхности, адсорбированный на поверхности, и связанный с ней криопротектант. Патент, конкретно, относится к составу с 5% даназола с добавлением 1,5% ПВП и сахарозы (2%) или маннита (2%) в качестве криопротектанта. Таким образом, хотя различные криопротектанты доступны и адекватно функционируют по защите активного вещества во время лиофилизации, твердый продукт, который получается в результате, часто трудно снова диспергировать в водной среде.
В ЕР 0193208 описан способ лиофилизации латексных частиц, покрытых реагентом для того, чтобы обеспечить возможность воспроизведения без агрегации, и обсуждается необходимость включения цвиттерионного буфера, такого как аминокислота, стабилизатора, такого как ПВП или бычий альбумин, и криопротектанта, такого как декстран Т10 или другой полисахарид.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
Это изобретение направлено на улучшение диспергируемости микронизированных частиц посредством специфического выбора наполнителей и методологии, необходимой для восстановления первоначальных частиц. Характерной особенностью при этом подходе является возможность получать стабильные водные суспензии из частиц микронного или субмикронного размеров нерастворимых или плохо растворимых в воде соединений. Эти частицы, которые необходимы для практического осуществления данного изобретения, могут быть получены методами, раскрытыми в патентах США №5091187 и 5091188, а также в WO 98/07414. В кратком изложении нерастворимые в воде или плохо растворимые в воде соединения диспергируются в водной среде в присутствии модифицирующих поверхность веществ или комбинаций веществ, из которых, по меньшей мере, одно является фосфолипидом, адсорбированным на их поверхности. Фрагментация частиц происходит, когда вышеуказанная суспензия подвергается давлению в результате переработки с применением различных методов, известных специалистам, включая, но не ограничиваясь этим, обработку ультразвуком, размалывание, гомогенизацию, микрофлюидизацию, осаждение антирастворителем и растворителем. Частички, полученные таким образом, называются микрочастицами, которым дано определение здесь как твердым частицам неправильной, несферической или сферической формы, имеющим номинальный диаметр от нанометров до микрометров, на которых адсорбируется, по меньшей мере, одно из модифицирующих поверхность веществ, одним из которых является фосфолипид.
В соответствии с данным изобретением суспензия микрочастиц, полученных таким образом, далее смешивается с модифицирующим(и) поверхность веществом(ами) и/или образующим(и) матрицу веществом(ами), которые присутствуют в количестве, достаточном, чтобы обеспечить возможность сушки замораживанием и последующего освобождения лекарственных частиц с поверхностным покрытием при контакте с водной средой. Выбор этих компонентов служит минимизации тенденции микрочастиц к образованию агрегатов при сушке. Такие агрегаты чрезвычайно трудно повторно диспергировать из-за очень большой площади поверхности частиц, что облегчает степень контакта, нужного для взаимодействия частиц, дающего в результате необратимые структуры.
Небольшие размеры частиц лекарственных средств часто необходимы при разработке лекарственной формы для того, чтобы получить максимально возможные площадь поверхности и биодоступность, а также из-за требований к растворимости. Введение подходящего(их) образующего(их) матрицу вещества (веществ) при вышеупомянутом процессе служит для стабилизации частиц лекарственного вещества, покрытых фосфолипидами в процессе сушки замораживанием и в получающемся лиофилизированном продукте путем подавления любой тенденции к агломерации частиц или росту частиц.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает быстро дезинтегрируемую твердую дозированную лекарственную форму для нерастворимых в воде соединений, которая высвобождает первичные частицы, стабилизированные одним или более модификаторами поверхности, включая, но не ограничиваясь ими, фосфолипиды. Примеры некоторых предпочтительных нерастворимых в воде лекарственных веществ включают противогрибковые вещества, иммуносупрессивные и иммуностимулирующие средства, противовирусные вещества, противораковые препараты, анальгетики и противовоспалительные средства, противоэпилептические агенты, антибиотики, анестетики, снотворные, седативные, противопсихозные средства, нейролептики, антидепрессанты, анксиолитики, противосудорожные средства, антагонисты, нейроблокаторы, антихолинергические и холиномиметические средства, антимускариновые и мускариноподобные средства, антиадренергические и антиаритмические, антигипертензивные средства, гормоны и препараты для питания. Детальное описание этих лекарственных средств можно найти в Remington’s Pharmaceutical Sciences, 18th Edition, 1990, Mack Publishing Co., PA. Концентрация нерастворимого в воде ингредиента в водной суспензии может колебаться между 0,1 и 60 мас.%, предпочтительно между 5 и 30 мас.%.
Нерастворимое в воде соединение сначала готовят в виде водной суспензии в присутствии одного или нескольких поверхностных стабилизирующих агентов, из которых, по меньшей мере, один является фосфолипидом. Фосфолипид может быть любым природным или синтетическим фосфолипидом, включая, но не ограничиваясь ими, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидная кислота, лизофосфолипиды, яичный или соевый фосфолипид или их сочетание. Фосфолипид может быть солевым или обессоленным, гидрированным или частично гидрированным, или природным, полусинтетическим или синтетическим. Концентрация фосфолипидного ингредиента в водной суспензии может меняться от 0,1 до 90 мас.%, предпочтительно от 0,5 до 50 мас.% и более предпочтительно от 1 до 20 мас.%.
Примеры некоторых подходящих второго и дополнительного модификаторов поверхности включают: (а) природные поверхностно-активные вещества, такие как казеин, желатин, природные фосфолипиды, трагакант, воски, полимеры для энтеросолюбильного покрытия, парафин, камедь акации, желатин и холестерин; (b) неионные поверхностно-активные вещества, такие как эфиры полиоксиэтилена и жирных спиртов, эфиры сорбитана и жирных кислот, эфиры полиоксиэтилена и жирных кислот, сорбитановые сложные эфиры, глицеролмоностеарат, полиэтиленгликоли, цетиловый спирт, цетостеариловый спирт, стеариловый спирт, полоксамеры, полаксамины, метилцеллюлоза, гидроксицеллюлоза, гидроксипропилцеллюлоза, гидроксипропил-метилцеллюлоза, некристаллическая целлюлоза и синтетические фосфолипиды; (с) анионные поверхностно-активные вещества, такие как лаурат калия, триэтаноламинстеарат, лаурилсульфат натрия, алкилполиоксиэтиленсульфаты, альгинат натрия, диоктилсульфосукцинат натрия, отрицательно заряженные фосфолипиды (фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидная кислота и ее соли) и отрицательно заряженные глицериловые сложные эфиры, натрийкарбоксиметилцеллюлоза и кальцийкарбоксиметилцеллюлоза; (d) катионные поверхностно-активные вещества, такие как соединения четвертичного аммония, бензалконийхлорид, цетилтриметиламмония бромид и лаурилдиметилбензиламмония хлорид; (е) коллоидные глины, такие как бентонит и вигам (veegum). Детальное описание этих поверхностно-активных веществ можно найти в Remington's Pharmaceutical Sciences, 18th Edition, 1990, Mack Publishing Co., PA и Theory and Practice of Industrial Pharmacy. Lachman et al., 1986. Концентрация дополнительных поверхностно-активных веществ в водной суспензии может изменяться в интервале между 0,1 и 90 мас.%, предпочтительно между 0,5 и 50 мас.% и более предпочтительно между 1 и 20 мас.%. Эти поверхностно-активные вещества могут или изначально добавляться во время смешивания, или их добавляют после обработки перед лиофилизацией, или сочетанием обоих способов в зависимости от природы, концентрации и числа поверхностно-активных веществ. Получаемая грубая дисперсия прежде всего предназначена для распределения поверхностно-активных веществ в водной среде в процессе стандартных способов перемешивания, таких как сдвиговые, экструзионные, кавитационные, и/или встряхивания. Грубая дисперсия - термин, определяющий смесь для целей данного описания.
Предварительную смесь затем подвергают процессу, который облегчает фрагментацию частиц, включающему, но не ограничиваемому ими, обработку ультразвуком, размалывание, гомогенизацию, микрофлюидизацию и осаждение антирастворителем и растворителем. Время растирания может меняться и зависит от физико-химических свойств медикамента, физико-химических свойств поверхностно-активных веществ и выбранного процесса растирания. Например, могут применяться процессы гомогенизации при высоком давлении, типичным примером чего является использование такого оборудования, как APV Gaulin E15, Avestin С50 или MFIC Microfluidizer M110EH. При этом процессе частицы в предварительной смеси уменьшаются в размере при давлении и температуре, которые не ухудшают существенно стабильность медикамента и/или поверхностно-активных веществ. Подходящими являются давление при обработке, равное от примерно 2000 фунт/дюйм2 (13790 кПа) до 30000 фунт/дюйм2 (206843 кПа), предпочтительно от примерно 5000 фунт/дюйм2 (34474 кПа) до 20000 фунт/дюйм2 (137900 кПа), более предпочтительно от примерно 10000 фунт/дюйм2 (68948 кПа) до 18000 фунт/дюйм2 (124106 кПа), и рабочие температуры от примерно 2 до 65°С, более предпочтительно от 10 до 45°С. Жидкость при обработке циркулирует через камеру для гомогенизации таким образом, чтобы обеспечить то, чтобы вся жидкая смесь подвергалась дискретной гомогенизации, дающей в результате гомогенную суспензию микронных или субмикронных частиц. Средний объемный размер взвешенных частиц получающегося суспендированного терапевтического средства находится в интервале между 0,05 микрометрами и 10 микрометрами, предпочтительно между 0,2 микрометрами и 5 микрометрами, как измерено с применением прибора на основе лазерной световой дифракции Malverm Mastersizer Microplus.
Полученную гомогенную суспензию микрочастиц, стабилизированную одним или несколькими модификаторами поверхности, затем смешивают с образующими матрицу увеличивающими объем и/или высвобождающими веществами (сухими или в виде водного раствора) и затем сушат. Наполнитель или образующее матрицу вещество представляет собой массу, в которую вкраплены или в которой сохраняются частицы лекарственного вещества. Высвобождающее средство помогает дезинтеграции матрицы, когда она контактирует с водной средой. Наполнитель/высвобождающее средство выбираются так, чтобы получить несущую матрицу, которая после сушки будет давать быстро диспергируемые таблетки, которые высвобождают первоначальные частицы при воспроизведении в водной среде. Примеры образующих матрицу/высвобождающих средств включают: (а) сахариды и полисахариды, такие как маннит, трегалоза, лактоза, сахароза, сорбит, мальтоза; (b) увлажнители, такие как глицерин, пропиленгликоль, полиэтиленгликоль; (с) природные и синтетические полимеры, такие как желатин, декстран, крахмалы, поливинилпирролидон, полоксамеры, акрилаты; (d) неорганические добавки, такие как коллоидный диоксид кремния, трехосновной фосфат кальция, и (е) полимеры на основе целлюлозы, такие как микрокристаллическая целлюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлозы. Образующие матрицу (формообразующие) вещества можно добавлять перед получением микронизированных частиц терапевтического средства (изготовление лекарственной формы) или к гомогенной суспензии микрочастиц перед лиофилизацией. Концентрация образующих матрицу веществ в водной суспензии может меняться в интервале между 0,1 и 90 мас.%, предпочтительно между 0,5 и 50 мас.% и более предпочтительно между 1 и 20 мас.%.
Предпочтительная водная суспензия может быть высушена с использованием нескольких методов, хорошо известных специалистам. Среди наиболее традиционных методов - распылительная сушка, покрытие распылением и сушка замораживанием. Во всех примерах, процитированных в таблице, в качестве метода сушки использовали сушку замораживанием, но это не подразумевает какого-либо ограничения. Предпочтительным методом сушки замораживанием является лиофилизация, включая сублимацию замороженной воды из водной среды суспензии под пониженным давлением. Лиофилизация этой суспензии может быть выполнена в подходящих контейнерах, таких как стеклянные сосуды, открытые лотки, формочки для элементов дозированной формы, или распылением in situ на несущую матрицу. Для процесса лиофилизации, например, полученную суспензию микрочастиц, содержащую образующие матрицу вещества, распределяют по лоткам из нержавеющей стали, которые помещают на предварительно уравновешенные полки, выдержанные при температуре, равной 5°С, в герметизированной камере с номинированным давлением. У полученной суспензии затем снижают температуру со скоростью 5°С/мин до -50°С, пока вся суспензионная среда полностью не отвердеет. При этой процедуре используются только умеренные градиенты температуры из-за потери энергии между разными границами (полка-лоток-жидкость). В качестве основного правила, обычное время для замораживания слоя разбавленной водной суспензии толщиной в 1 см составляет 40-90 мин при температуре -50°С. Замораживание вне лиофилизационной камеры может быть выполнено путем: (а) замораживания на охлаждаемых плитах, например, в лотках или в форме небольших частиц на барабанном охладителе, (b) погружения в жидкий азот или какую-то другую охлаждающую жидкость, (с) совместного распыления с жидким СO2 или жидким азотом или (d) замораживания циркулирующим холодным воздухом.
Отдельное охлаждение необходимо для осуществления непрерывного процесса сушки замораживанием. Оборудование для получения небольших гранул путем закапывания раствора в жидкий азот можно приобрести в виде оборудования для процесса Cryopel® (Buchmuller and Weyermanns, 1990). Прямое замораживание внутри лиофилизационной камеры дает преимущества, если продукт требует обработки в асептических условиях, что может быть в ситуации изготовления сухих инъекционных препаратов.
Полученную таким образом отвержденную приготовленную суспензию выдерживают при этой температуре в течение срока в 2 часа, чтобы гарантировать, что кристаллизация полностью завершилась. Давление внутри камеры снижают до давления, равного примерно 5 мм Нg, а предпочтительнее до примерно 0,1 мм Нg. Сублимация замороженной воды осуществляется путем повышения температуры стеллажей лиофилизатора до примерно -30°С - -10°С и выдерживания материала при этой температуре в течение 20 часов до тех пор, пока не завершится первая стадия сушки. Время сушки зависит от ряда факторов, некоторые из них довольно постоянны и могут быть примерно отождествлены как температура сублимации льда, теплопроводность замороженной суспензии и коэффициент массопередачи. Другие факторы, такие как температура или давление в камере, могут значительно варьироваться. Температура стеллажей может быть дополнительно повышена, чтобы осуществить вторичную сушку, что, как полагают, необходимо в соответствии с составом образца.
Материал забирают после цикла лиофилизации по возвращении камеры к комнатным условиям. С собранным высушенным материалом может быть проведена операция грубого измельчения, чтобы облегчить обработку или дальнейшие операции смешивания с другими наполнителями, необходимыми для завершения получения требуемой твердой дозированной формы. Эти наполнители могут включать вспомогательные вещества для таблетирования и для прессования, улучшающие скольжение вещества для инкапсулирования в твердые желатиновые капсулы или диспергаторы для ингаляторов с сухим порошком.
Образующее матрицу вещество, используемое в данном изобретении, должно растворяться или диспергироваться при контакте с водной средой и высвобождать покрытые фосфолипидом частицы терапевтического средства. При воспроизведении продукт снова превращается в суспензию, имеющую ту же степень дисперсности, что и ранее высушенная суспензия, с предпочтительно не более чем 20 мас.% и более предпочтительно не более чем 10 мас.%, и идеально с менее чем 1 маc.% агрегированных первичных частиц, что показано определением размера частиц и микроскопическими методами, известными специалистам. Неожиданно то, что лиофилизированная суспензия, полученная по данному изобретению, может храниться в течение продолжительных периодов времени даже при высоких температуре и влажности без потери этого свойства редиспергироваться при воспроизведении и, таким образом, по существу, свободна от агрегации частиц. Лиофилизированные суспензии, полученные в соответствии с составом из примеров 6-10, здесь могут храниться в течение по меньшей мере 60 дней при комнатной температуре, что показывает возможность долговременного хранения, согласующегося со сроком годности фармацевтической дозированной формы.
Твердый дозированный материал по данному изобретению определяется, как обладающий свойством быть быстро диспергируемым. Это свойство определяется как время, необходимое для полной дезинтеграции высушенного из замороженного состояния осадка, получаемого по этому изобретению, когда он подвергается воздействию водной среды, что происходит при введении дозированной формы в in vivo системы. Время дезинтеграции может быть измерено путем проведения испытания in vitro, такого как наблюдение за временем дезинтеграции в воде при 37°С. Дозированный материал помещают в воду без принудительного перемешивания, причем отмечается время, необходимое для того, чтобы материал в основном диспергировал по визуальному наблюдению. В контексте определения “быстрое” предполагается, что время дезинтеграции составляет менее 2 минут, а предпочтительно менее 30 секунд и наиболее предпочтительно менее 10 секунд.
На скорость растворения или высвобождения активного ингредиента могут также влиять природа медикамента и композиции из микрочастиц, так что оно может быть быстрым (5-60 сек) или промежуточным (порядка 75% дезинтеграции через 15 минут), или пролонгированным высвобождением.
В некоторых случаях визуальное наблюдение под микроскопом или микрофотографии со сканнирующего электронного микроскопа могут показать наличие агрегатов частиц, однако эти частицы имеют малые размеры и состоят из агрегатов первоначальных частиц перед лиофилизацией суспензии. Эти агрегаты легко диспергируются с помощью низких уровней энергии, таких как короткие периоды обработки ультразвуком или физическое перемешивание, и как таковые демонстрируют ключевой признак данного изобретения, т.е. предотвращение роста размера частиц и необратимой агрегации и/или агломерации.
ПРИМЕРЫ
Данное изобретение быстро диспергируемого твердого лекарственного препарата иллюстрируется примерами, обобщенными в таблице. Композиции, отмеченные в этой таблице, представлены на основе мас.% сухого продукта. Понятно, что вещество наполнителя может быть добавлено к суспензии перед стадией гомогенизации или перед стадией сушки.
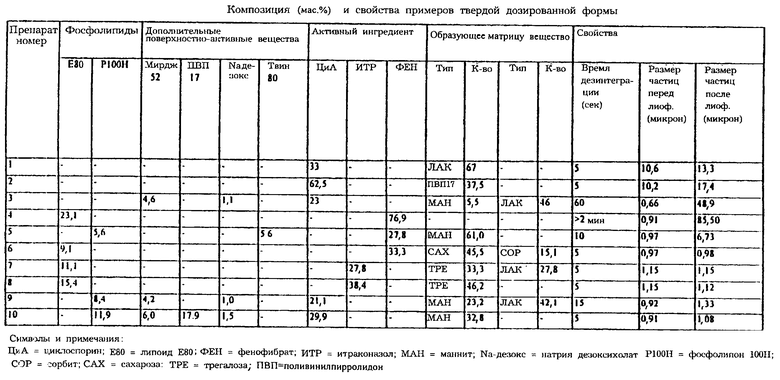
Препараты 1 и 2, которые представлены в вышеприведенной таблице, иллюстрируют то, что из этих композиций получаются воспроизводимые частицы, показывая, что относительно большой размер частиц (примерно 10 микрометров) проявляют незначительную проблему от перспектив агрегации. Эти относительно большие частицы легко получаются с помощью традиционных методик дробления. Однако, чтобы существенно влиять на биодоступность, необходимы частицы, порядок размера которых меньше по величине. Эти частицы получают, используя процедуры, описанные в патентах США №5091187 и 5091188 в виде микрокристаллов, в WO 98/07414 в виде микрочастиц и в патентах США 5145684 и 5302401 в виде нанокристаллов. Частицы получаются из тех композиций, которые требуют специального выбора наполнителя и условий обработки, чтобы получались частицы первоначальной суспензии. Примеры 3 и 5 иллюстрируют то, что некоторые композиции из микрочастиц не воспроизводятся должным образом, когда используются традиционные для лиофилизации криопротектанты, такие как лактоза или ПВП17 (PVP17), которые описаны в патенте США 5302401. Что касается этих примеров, то образуются большие агрегаты, состоящие из слипшихся первичных частиц.
Примеры 6 и 10 иллюстрируют то, что частицы первоначальной суспензии легко и быстро воспроизводятся при восстановлении суспензии из сухого порошка, не требующем интенсивного перемешивания. В этих примерах требуется тщательный выбор наполнителя, который может также действовать как криопротектант, а также увлажнитель, такой как трегалоза в препарате 8 и маннит в препарате 10.
Альтернативно, когда единственный образующий основу наполнитель не подходит, как в случае сахарозы, композиция может включать смесь наполнителей, выбранных из фармацевтически приемлемых веществ, таких как сахароза, трегалоза, маннит, сорбит или лактоза. Примеры препаратов 6, 7 и 9 демонстрируют этот тип композиции. Характеристики весообъемного распределения частиц по размеру препарата фенофибрата 6 показаны соответственно перед и после стадии лиофилизации/воспроизведения. В этом примере показан идеальный план действий для того, чтобы не изменить характеристику распределения частиц по размеру после лиофилизации и воспроизведения.
Без намерения предложить какое-либо конкретное теоретическое объяснение все же можно предположить, что компоненты из смеси наполнителей могут одновременно служить для подавления увеличения размера частиц при лиофилизации/воспроизведении с помощью одного или более механизмов, включая криопротекцию, действие увлажнителя, диспергируемость и другие.
Эти критерии представляют собой неожиданно важные обстоятельства при попытке восстановить суспензию из неагрегированных частиц после воспроизведения сухой дозированной формы, которая включает фосфолипид в качестве одного из поверхностных стабилизаторов.
В дополнение к композициям примеров, упомянутым выше, препараты этого изобретения могут дополнительно содержать подходящие количества забуферивающих рН солей и регулирующих рН веществ, таких как гидроксид натрия и/или фармацевтически приемлемые кислоты. Специалистам в области химии фосфолипидов известно, что при рН ниже 4 и выше 10 фосфолипидные молекулы подвергаются интенсивному гидролизу. Поэтому рН суспензии обычно доводится до значений внутри этого интервала перед гомогенизацией. Если необходимо, рН может быть снова отрегулирован перед стадией сушки.
Хотя изобретение и примеры были описаны в связи с тем, что в настоящее время считается наиболее практичным и предпочтительным воплощением, необходимо понять, что данное изобретение не ограничивается описанными воплощениями, а наоборот предназначено для охвата различных модификаций и эквивалентных композиций, включенных в сущность и объем следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЫСТРО ДИСПЕРГИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ РЫБИЙ ЖЕЛАТИН | 2000 |
|
RU2242969C2 |
| НАБОР ДЛЯ ПРИГОТОВЛЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ | 2002 |
|
RU2279292C2 |
| ПЕРОРАЛЬНО ДИСПЕРГИРУЕМАЯ ВАКЦИНА, СОДЕРЖАЩАЯ ВИРОСОМЫ | 2019 |
|
RU2808276C2 |
| НАНОСИСТЕМА НА ОСНОВЕ РАСТИТЕЛЬНЫХ ФОСФОЛИПИДОВ ДЛЯ ВКЛЮЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2391966C1 |
| ВЫДЕЛЯЮЩИЙ ЛЕКАРСТВЕННОЕ СРЕДСТВО МАТЕРИАЛ ХИРУРГИЧЕСКОГО ИМПЛАНТАТА ИЛИ ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА | 1995 |
|
RU2176525C2 |
| ТВЕРДАЯ ДОЗИРОВАННАЯ ФОРМА | 1993 |
|
RU2131244C1 |
| КОМПОЗИЦИЯ БЫСТРОРАСПАДАЮЩЕЙСЯ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, ВКЛЮЧАЮЩАЯ ФУНКЦИОНАЛИЗИРОВАННЫЙ КАРБОНАТ КАЛЬЦИЯ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2676087C2 |
| УЛУЧШЕННЫЕ ГОТОВЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 2003 |
|
RU2349305C2 |
| БЫСТРОДИСПЕРГИРУЮЩАЯСЯ ЛЕКАРСТВЕННАЯ ФОРМА, НЕ СОДЕРЖАЩАЯ ЖЕЛАТИН | 2000 |
|
RU2242968C2 |
| КОМПОЗИЦИИ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ МИКРОЧАСТИЦЫ ВЕЩЕСТВ, НЕРАСТВОРИМЫХ В ВОДЕ, И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 1997 |
|
RU2186562C2 |
Изобретение относится к фармацевтической промышленности. Быстро диспергируемая твердая сухая терапевтическая дозированная форма состоит из нерастворимого в воде соединения, существующего в виде наномерных или микромерных твердых частиц, поверхность которых стабилизирована фосфолипидом, причем частицы твердого вещества диспергированы в образующей объем матрице. Когда дозированную форму вводят в водную среду, образующая объем матрица по существу полностью растворяется в течение 2 минут, высвобождая тем самым частицы нерастворимого в воде твердого вещества в неагрегированном и/или неагломерированном состоянии. Дозированная форма состоит из нерастворимого в воде вещества или терапевтически полезного нерастворимого в воде или плохо растворимого в воде соединения, фосфолипида и также, необязательно, по меньшей мере, одного неионного, анионного, катионного или амфипатического поверхностно-активного вещества вместе с матрицей или образующим объем веществом и, если необходимо, высвобождающим средством. Объемно-весовой средний размер частиц, нерастворимых в воде, составляет 5 микрометров или менее. 9 з.п. ф-лы, 1 табл.
| Способ получения лиофилизата | 1990 |
|
SU1836080A3 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 5631023 А, 20.05.1997. | |||
Авторы
Даты
2004-08-10—Публикация
1999-11-19—Подача