Область техники
Изобретение относится к способам лечения заболеваний, связанных с инфекцией ободочной кишки микроорганизмом С.difficile, а также с образованием колоний, резистентных к ванкомицину энтерококков.
Уровень техники
Низин является бактериоцином - противомикробным веществом, синтезируемым микроорганизмом, размножающимся на продуктах питания, и является членом группы близких в структурном отношении веществ, называемых лантиобиотиками (или в данном тексте описания - лантоцинами). К другим членам группы относятся субтилин, эпидермин, галлидермин и pep 5.
Низин синтезируется микроорганизмом Lactococcus lactis, подвид lactis, относящимся к серологической группе N по Ланцефилду (Mattick A.T.R. и А.Hirsch, 1947, Lancet. 2, 5). Низин представляет собой пептид, содержащий 34 аминокислотных остатка и 5 циклических структур, соединенных тиоэфирными мостиковыми связями, которые образуют лантионин или бетта-метиллантионин. Тиоэфирные связи образуются при конденсации сульфгидрильных групп остатков цистеина с дегидрофрагментами боковых цепей, образованными из остатков серина или треонина, и являются результатом пост-трансляционных модификаций пептида - предшественника низина.
Согласно опубликованным данным низин действует как катионный поверхностно-активный агент, и его активность может быть нейтрализована анионными поверхностно-активными веществами (Ramseier H.R., 1960, Arch. Microbiol., 37, 57), а на молекулярном уровне низин действует на цитоплазматическую мембрану и ингибирует биосинтез пептидогликанов (Reisinger с соавт., 1980, Arch. Microbiol., 127. 187). Наиболее вероятно, что действие низина на растительные бактерии является результатом деполяризации плазматической мембраны (зависимой от разности потенциалов), которая происходит после встраивания пептида в двойной слой липидов, по-видимому, путем взаимодействия соседних молекул низина с образованием временной поры или канала. Молекулярные свойства низина и механизм его биосинтеза описаны в опубликованном недавно обзоре [Jung G. и H.G.Sahl, 1991, Nisin and novel lantibiotics (Низин и новые лантибиотики) ESCOM Science Publishers, Leiden].
Считается, что низин характеризуется узким спектром активности и, в основном, проявляет активность только против некоторых грамположительных бактерий, за исключением действия в смеси схелатным агентом, когда низин проявляет неожиданную активность против грамотрицательных бактерий и характеризуется повышенной активностью против грамположительных бактерий (Патенты США No 5217950 и No 5260271, выданные Blackburn с соавт.). Низин применяют в качестве пищевого антимикробного консерванта, утвержденного как безопасный продукт организацией JEFCA и рядом других национальных государственных органов по контролю использования пищевых добавок, включая организации США, Великобритании и Европейского Экономического Сообщества.
Несмотря на то, что предварительные исследования на моделях животных показали эффективность низина (Mattick A.T.R. и A.Hirsch, 1947, Lancet. 2:5; Bavin Е.М. с соавт., 1952, Lancet. 1:127; Gowans J.L, с соавт., 1952, Brit. J. Pharmacol. 7:438; Hirsch А. и A.T.R. Mattick, 1949, Lancet. ii:190), было установлено, что низин недостаточно эффективен для разработки терапевтических препаратов с целью их использования в медицине и ветеринарии.
Clostridium difficile является анаэробной грамположительной, споробразующей токсикогенной палочковидной бактерией, которую иногда обнаруживают в значительном количестве в ободочной кишке человека. Однако, в связи с резистентностью этой бактерии к ряду противомикробных препаратов и вызванной ею эндемией в больницах и частных лечебницах, бактерия может размножаться, если подавлена нормальная бактериальная флора ободочной кишки, в большинстве случаев после лечения противомикробными препаратами с широким спектром действия. В этом случае С.difficile может вызвать серьезные заболевания, известные как диарея и псевдомембранозный колит, связанные с применением антибиотиков. Лечение таких нарушений включает использование метронидазола и ванкомицина для орального введения. Однако в настоящее время применение ванкомицина, прежде всего оральным путем, вызывает серьезную озабоченность, так как этот антибиотик приводит к селекционному отбору нового класса высокорезистентных кишечных микроорганизмов, ванкомицин-резистентных энтерококков (ВРЭ), которые могут вызвать серьезные, не поддающиеся лечению инфекции в различных частях тела. Метронидазол не активен по отношению к энтерококкам, и таким образом, его использование также может вносить вклад в селекцию ВРЭ в ободочной кишке. Частота рецидивов заболеваний, вызванных С.difficile, чрезвычайно высока и составляет примерно 20%; предполагают, что это связано с образованием спор, которые трудно ликвидировать.
Сущность изобретения
Задачей изобретения является разработка средств для лечения вызванных бактериями заболеваний ободочной кишки и для подавления потенциально опасных бактерий, образующих колонии в ободочной кишке. Показано, что введение больших доз лантионинсодержащих антибиотиков (лантоцинов), таких как низин, в ободочную кишку характеризуется неожиданно высокой устойчивостью в ободочной кишке и отсутствием токсичности. Как следствие, другой задачей изобретения является разработка средств для доставки выбранного лантоцина в ободочную кишку в достаточном количестве для эффективного лечения очага инфекции в ободочной кишке.
Перечень фигур чертежей и иных материалов
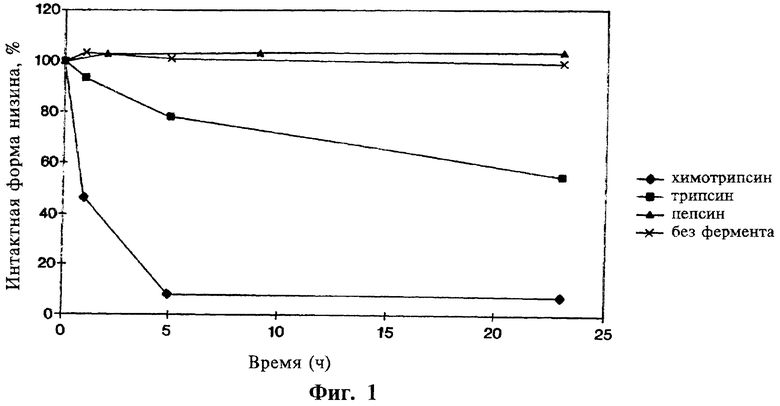
На фиг.1 показана чувствительность низина к ферментам, присутствующим в желудочно-кишечном тракте.
На фиг.2 показано влияние толщины покрытия таблеток на время до начала разложения таблеток в фосфатном буферном растворе.
На фиг.3 показано влияние толщины покрытия таблеток на времена до начала и до завершения разложения таблеток в фосфатном буферном растворе.
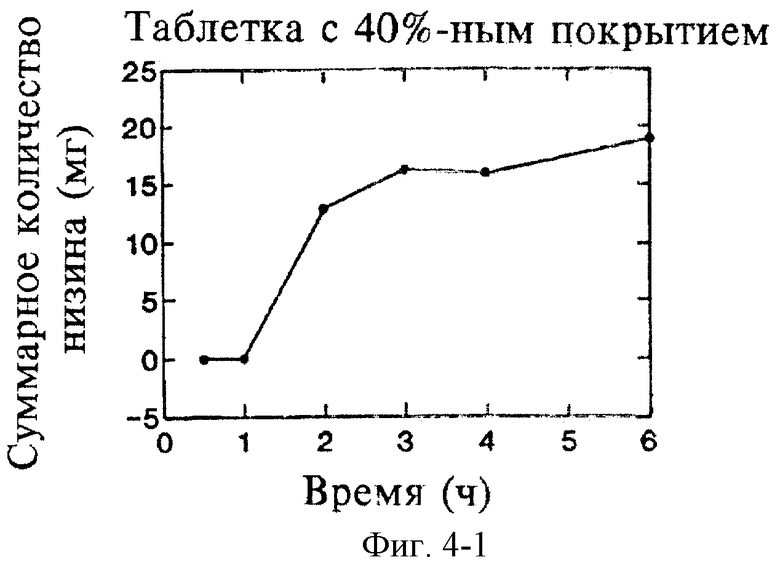
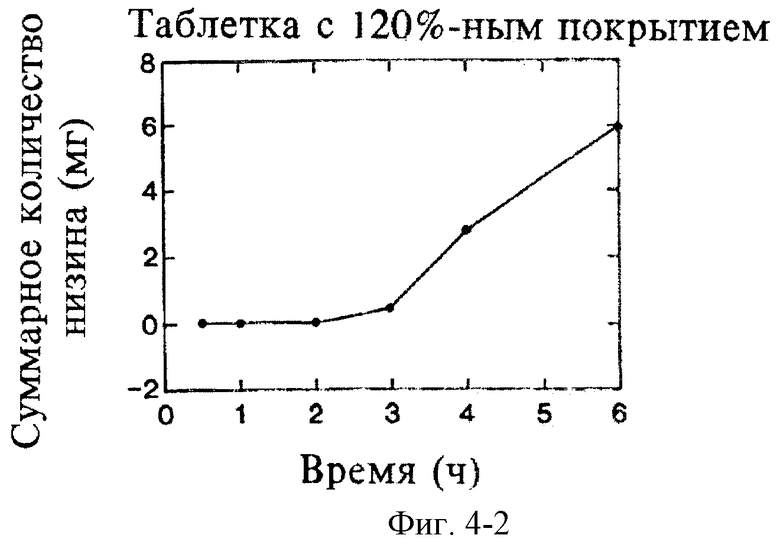
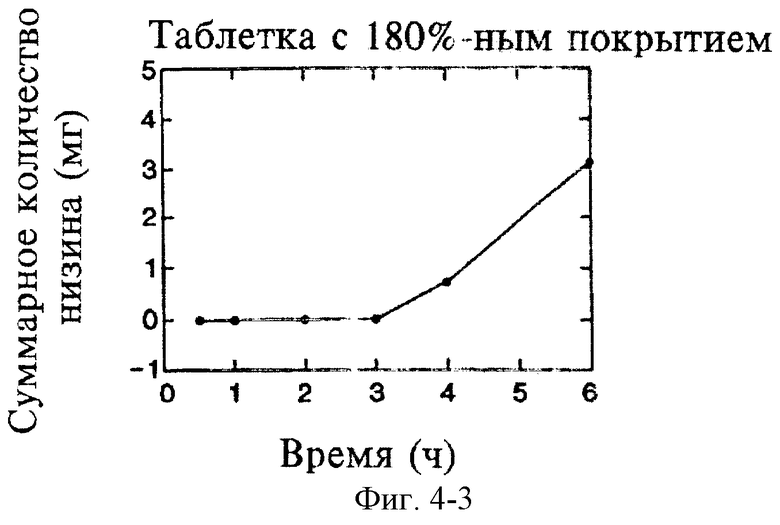
На фиг.4 показано влияние толщины покрытия таблеток на замедление высвобождения низина в фосфатном буферном растворе с рН 6,8.
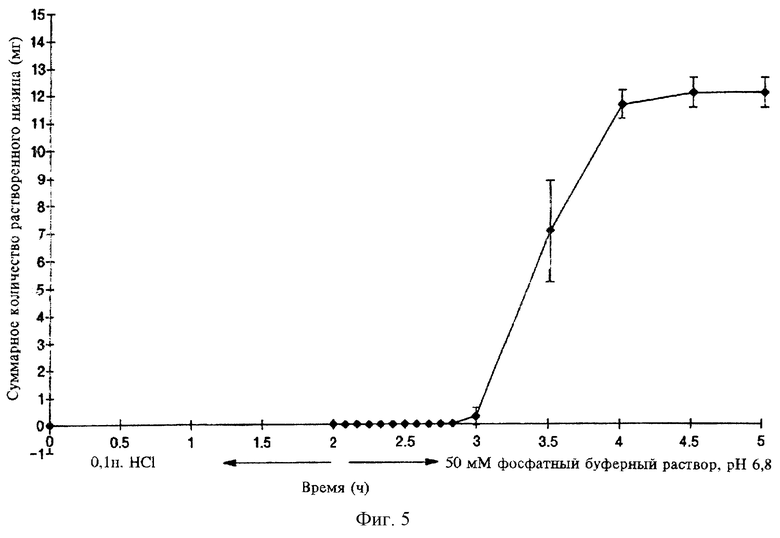
На фиг.5 показан профиль растворения 6-ти таблеток с 40%-ным покрытием из Eudragit™.
На фиг.6 показан процесс продвижения таблеток с 40%-ной толщиной покрытия через желудочно-кишечный тракт человека в процессе пищеварения в течение 7 ч.
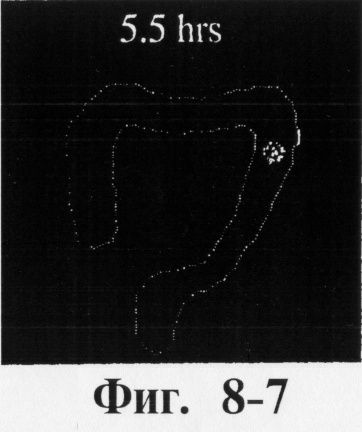
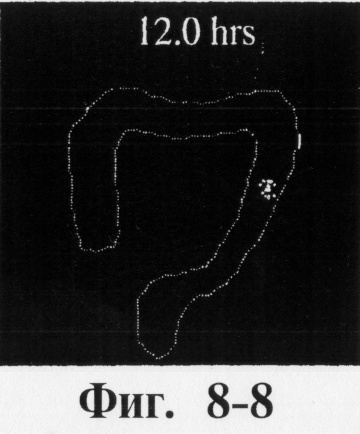
На фиг.7 показан процесс продвижения таблеток с 120%-ной толщиной покрытия через желудочно-кишечный тракт человека в процессе пищеварения в течение 12 ч.
На фиг.8 показан процесс продвижения таблеток с 180%-ной толщиной покрытия через желудочно-кишечный тракт человека в процессе пищеварения в течение 16 ч.
Сведения, подтверждающие возможность осуществления изобретения
Предметом изобретения является разработка средств лечения заболеваний ободочной кишки, вызванных микроорганизмом С.difficile, и средства для подавления бактерий, образующих колонии в толстой кишке, таких как ВРЭ.
В связи с этим авторами показано, что низин обладает высокой активностью против патогенных штаммов различных грамположительных бактерий, включая ВРЭ (заявка на выдачу патента США, регистрационный No 08/667650, включена в текст описания в виде ссылки). Известно, что низин обладает активностью против гнилостных микроорганизмов рода Clostridium, вызывающих порчу пищевых продуктов, и после открытой авторами активности низина против С.difficile такая активность была описана другими авторами (Kerr с соавт., 1997, Lancet. 349:1026).
В данном описании показано, что низин обладает высокой активностью по отношению к большому числу клинических изолятов С.difficile, включая штаммы, резистентные к клиндамицину и метронидазолу. Показано также, что низин проявляет низкую активность по отношению к преобладающей нормальной кишечной флоре человека - Bacteroides fragilis. Действительно, наблюдается значительное различие между диапазоном концентраций низина, активных против 50% штаммов С.difficile, и диапазоном концентраций, активных против 50% штаммов В. fragilis. Это означает, что в отличие от рекомендаций Kerr с соавт., представляется маловероятным, что эффективные дозы низина будут оказывать отрицательное действие на защитную комменсальную микрофлору кишечного тракта. Несмотря на то, что, как уже было установлено, низин требует использования потенцирующего средства для проявления его активности против большинства грамотрицательных бактерий, существует несколько исключений. Например, трудно культивируемые грамотрицательные бактерии, такие как Neisseria gonorrhoeae чувствительны исключительно к низину. В. fragilis является трудно культивируемым анаэробом, чувствительность которого к низину до настоящего времени не известна.
Так как низин является пептидом и может быть расщеплен протеолитическими ферментами, присутствующими в больших количествах в тонкой кишке (сравни фиг.1), его применение оральным способом для доставки к локальным инфекционным очагам в нижней части желудочно-кишечного тракта ранее не обсуждалось. Кроме того, не известна толерантность интактного низина при его доставке в нижнюю часть желудочно-кишечного тракта, а также не известно, будет ли низин достаточно устойчив, чтобы ожидать проявления его противомикробной активности в этой части организма.
При исследовании подострой внутрикишечной токсичности на моделях животных авторами показано, что низин не оказывает раздражающего действия на ободочную кишку при повторной доставке. Кроме того, показано, что интактный низин не может быть обнаружен в крови обработанных животных, что свидетельствует о том, что при таком пути прохождении низина системная абсорбция (и возможная системная токсичность) маловероятны. Кроме того, при исследовании животных, у которых на часть ободочной кишки наложена лигатура, показано, что значительная часть низина сохраняется в интактной форме in situ в течение нескольких часов после введения в ободочную кишку.
Таким образом, существует практическая необходимость в разработке систем для доставки низина или других противомикробных лантоцинов пептидной природы, включая структурные варианты этих молекул, синтезированных методом генной инженерии или полусинтетическим способом, для лечения инфекций ободочной кишки, вызванных микроорганизмами (включая, но не ограничиваясь С.difficile), чувствительными к этим пептидам, или для подавления чувствительных микроорганизмов, образующих колонии в толстой кишке (включая, но не ограничиваясь ВРЭ), которые представляют потенциальную опасность для здоровья индивидуума или других пациентов. В связи с этим, другим предметом изобретения является разработка составов композиций, которые позволяют осуществить доставку эффективных количеств низина оральным способом для лечения бактериальных инфекций в ободочной кишке.
Фармацевтические композиции этих пептидов включают таблетки с соответствующим покрытием или гранулы, или капсулы для орального введения, которые позволяют сохранять целостность лекарственной формы в процессе прохождения через желудок и тонкую кишку, а затем обеспечивают высвобождение активного компонента в соответствующей части желудочно-кишечного тракта (от нижней тонкой кишки до верхней толстой кишки). Однако, очевидно, что в качестве эффективных лекарственных форм могут быть использованы, например, суппозитории и клизмы. Специфические лекарственные формы, описанные ниже, приведены просто для примера и ни коим образом не ограничивают объем изобретения.
Примеры
В примерах 1-5 описано изучение свойств низина в среде ободочной кишки и эффективности низина против бактерий нормальной микрофлоры кишечника.
Пример 1а
Активность низина против С.difficile
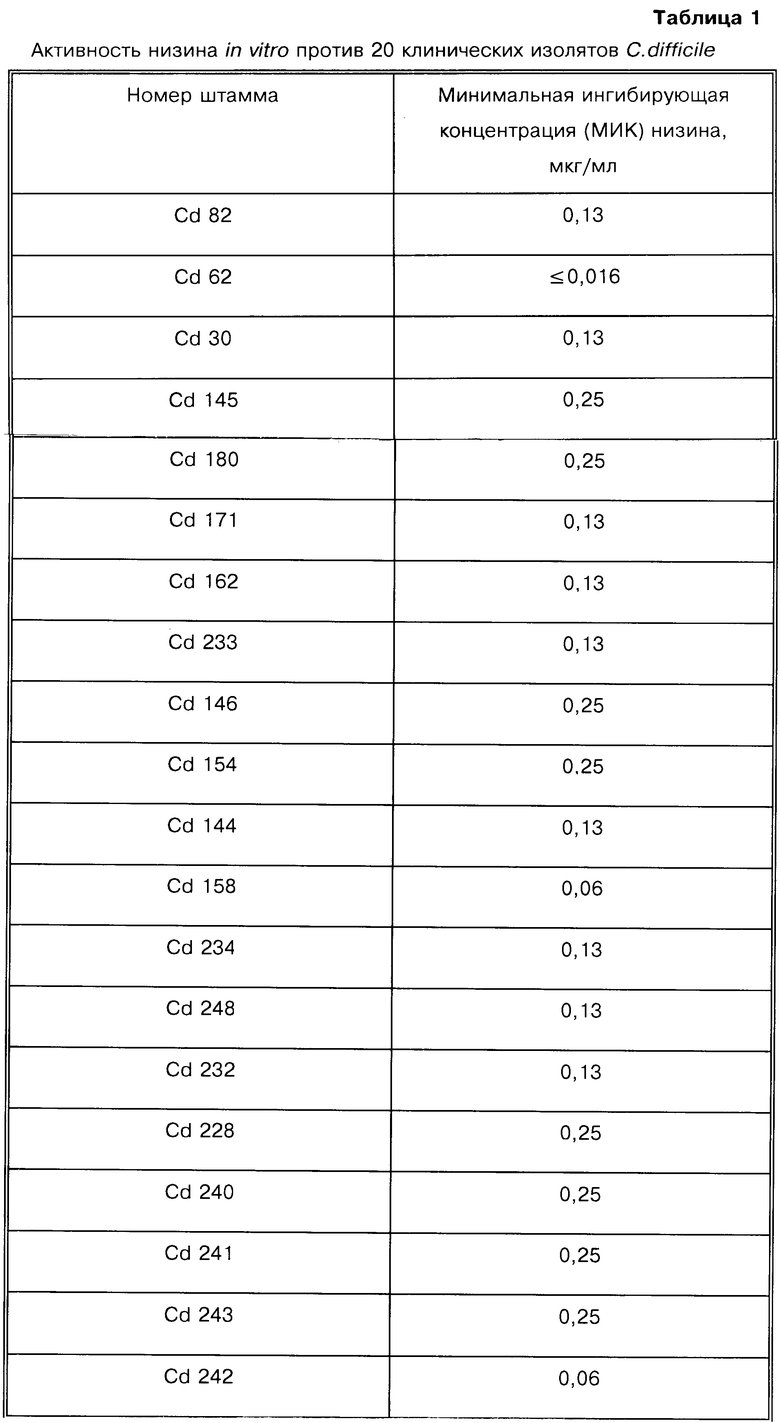
20 Клиндамицин-резистентных клинических изолятов, полученных из больницы McGuire Veterans’ Administration Hospital, г.Ричмонд, штат Вирджиния, исследуют на бруцеллезном агаре с использованием крови овцы в анаэробных условиях. Минимальную ингибирующую концентрацию (МИК) определяют как минимальную из исследованных концентраций, которая полностью ингибирует рост бактерии, наблюдаемый визуально.
Как показано в табл.1, все штаммы ингибируются при концентрации низина 0,25 мкг/мл или менее.
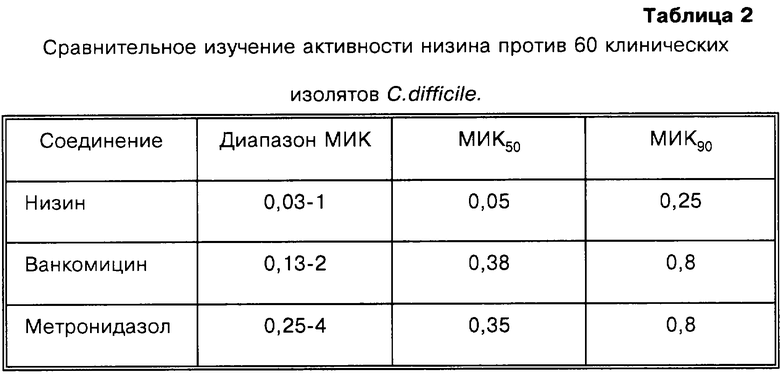
60 клинических изолятов, полученных из больницы университета г.Флоренции, Италия, исследуют на чувствительность к низину и к противомикробным средствам, используемым в настоящее время для лечения диареи и колитов, вызванных С.difficile, с использованием описанного выше метода. Как показано в табл.2, средние величины МИК или MИK50 низина (концентрация, при которой наблюдается ингибирование роста 50% или более исследованных штаммов) для всех указанных штаммов составляют 0,05 мкг/мл, что значительно ниже по сравнению с количеством ванкомицина или метронидазола, необходимым для ингибирования тех же самых штаммов. Величины МИК90 представляют собой концентрации противомикробного средства, при которых наблюдается ингибирование роста 90% исследованных штаммов или более.
Данные этого примера свидетельствуют, что С.difficile является подходящим микроорганизмом-мишенью для лечения низином или родственными пептидами.
Пример 1б
Отсутствие активности низина против Bacteroides fragilis
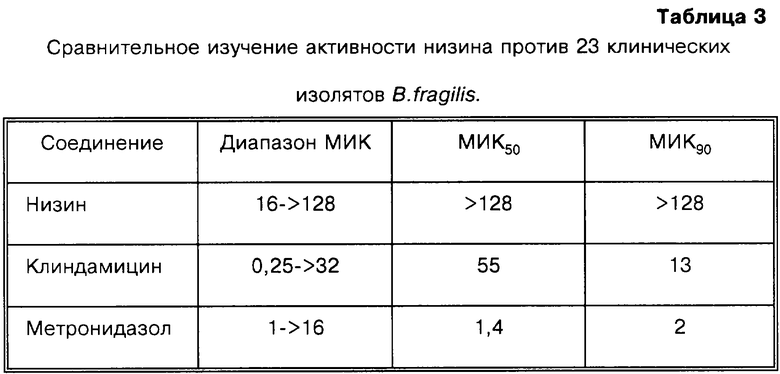
9 изолятов В.fragilis, полученных из больницы McGuire Veterans’ Administration Hospital, г.Ричмонд, штат Вирджиния, исследуют аналогичным способом, как описано выше. Ни один из штаммов не ингибируется низином даже при самой высокой из использованных концентраций низина (32 мкг/мл). Величина МИК низина по отношению к указанным штаммам составляет 64 мкг/мл или более. Аналогично, как показано в табл.3, 23 изолята из больницы университета г.Флоренции (Италия) также проявляют относительно низкую чувствительность к низину, средняя величина МИК составляет >128 мкг/мл.
Пример 2
Толерантность к низину в лигированном кишечнике кроликов
Пять кроликов анестезируют и поддерживают их в состоянии нарколепсии в течение всего эксперимента. Вскрывают брюшную полость и накладывают лигатуру на сегмент кишечника, включая илеоцекальное соединение и проксимальную ободочную кишку. Двух кроликов используют в качестве контроля, а трем вводят по 20 мг неочищенного низина (т.е. полученного от фирмы-производителя) напрямую в лигированную область кишечника. Кроликов выдерживают в течение 6 ч, а затем забивают.
При вскрытии трупов после гистопатологического исследования обработанного участка кишечника не наблюдается никаких признаков раздражения или токсичности, связанных с обработкой низином. Полученные результаты свидетельствуют о том, что при прямом введении низина в ободочную кишку кроликов в дозе, равной дозам, которые могут быть введены человеку, не наблюдается никаких признаков местной токсичности, даже если дозу выдерживают в ободочной кишке искусственно в течение 6 ч с помощью наложения лигатуры на кишечник.
Пример 3
Толерантность к низину при повторной доставке в ободочную кишку собаки
Собакам имплантируют хирургическим способом трубки в область проксимальной ободочной кишки. После выздоровления группам собак по 6 особей вводят неочищенный низин внутрь кишечника через трубку в количестве 0, 50, 125 или 300 мкг/кг вдень в течение 28 дней, причем данную дозу разделяют на две половины для введения ежедневно приблизительно в 1000 и в 1600 часов.
После аутопсии, гистопатологического и клинического исследований не наблюдается никаких признаков местного раздражения или систематической токсичности, связанных с обработкой низином. Полученные результаты свидетельствуют о том, что при повторном введении чрезвычайно высоких доз низина в ободочную кишку млекопитающих наблюдается толерантность к низину.
Пример 4
Отсутствие систематической абсорбции низина из ободочной кишки
В течение токсикологических испытаний, описанных выше в примерах 2 и 3, у животных отбирают образцы крови для определения низина в сыворотке крови.
У кроликов в модели с лигированным кишечником (пример 2) кровь отбирают через 0,5, 2 и 6 ч после введения низина. Уровень низина определяют специфическим методом иммуноферментного анализа (ИФА), предел определения которого составляет 1 мкг/мл сыворотки кролика.
Ни в одном из исследованных образцов не обнаружено присутствия низина, что свидетельствует об отсутствии абсорбции низина из ободочной кишки в данной модели животных.
В эксперименте на собаках (пример 3) образцы крови отбирают на 28 день через 0, 5, 1, 2, 3, 4, 5, 6 и 7 ч после утреннего введения низина. В этом эксперименте сыворотку крови анализируют микробиологическим методом с использованием в качестве тестируемого микроорганизма Micrococcus luteus, предел определения этого метода составляет 0,5 мкг/мл сыворотки собаки. Из 18 собак, обработанных низином, 17 выдержали испытания и 16 имели правильное расположение катетера при аутопсии. (У двух собак наблюдалась утечка материала в брюшную полость, одну необходимо было забить в процессе обработки и одна выдержала испытания). В сыворотке крови, отобранной в любой период у собак с правильным (внутрикишечным) расположением катетера, низин не обнаружен.
Полученные результаты свидетельствуют о том, что при правильной доставке низина даже в чрезвычайно высоких дозах в ободочную кишку млекопитающих не наблюдается абсорбции низина в большой круг кровообращения и, следовательно, представляется маловероятным, что низин проявляет системную токсичность.
Пример 5
Сохранение низина в ободочной кишке млекопитающих в концентрациях, достаточных для ингибирования бактерий-мишеней.
В эксперименте на кроликах, описанном выше в примере 2, при аутопсии содержимое кишечной петли собирают, экстрагируют и анализируют методом ВЭЖХ. Содержимое кишечника контрольных кроликов, необработанных низином, используют для оценки эффективности процедуры экстракции. С этой целью к указанным образцам добавляют известные количества низина, затем проводят гомогенизацию и экстракцию. Наиболее эффективный метод экстракции, который позволяет извлечь приблизительно 50% добавленного низина, используют для экстракции содержимого кишечника кроликов, обработанных низином. Из содержимого кишечника обработанных низином кроликов извлекают до 24% введенного низина, что с большой вероятностью свидетельствует об устойчивости, по крайней мере, половины введенного низина in situ в течение 6 ч.
Принимая в расчет масштабирование дозы низина до 600 мг, необходимой для лечения взрослого человека, общий (полный) объем ободочной кишки, равный приблизительно 4 л, можно предположить, что местная концентрация низина в ободочной кишке в продолжительный период времени будет достигать выше 40-80 мкг/мл (или 40-80 мкг/г содержимого ободочной кишки). Эта величина во много раз превышает величину МИК для микроорганизмов-мишеней - С.difficile и Enterococcus spp., но равна или ниже предела чувствительности защитной грамположительной микрофлоры кишечника, такой как B.fragilis. Действительная доза может быть ниже или выше, что, конечно, будет зависеть от многих факторов, таких как эффективность вскрытия и растворения лекарственной формы в организме человека, местная биологическая доступность активного компонента (количество свободного активного компонента, способного взаимодействовать с бактериями по сравнению с количеством компонента, связанного с твердым материалом), степень тяжести заболевания, время прохождения продукта у больных диареей и т.д. Очевидно также, что низин можно вводить многократно (до 6 раз) в любой 24-часовой период. Соответственно, диапазон предполагаемой ежедневной дозы составляет от минимум приблизительно 100 мг и до максимум приблизительно 6 г, предпочтительно от приблизительно 300 мг до приблизительно 2 г.
Так как известно, что противомикробное действие низина по отношению к чувствительным бактериям осуществляется очень быстро, то полученные в данном примере результаты свидетельствуют о том, что низин или родственные пептиды, доставляемые в ободочную кишку в эффективной дозе, могут быть использованы для лечения бактериальных заболеваний, вызванных чувствительными к низину бактериями, или для подавления потенциально опасных чувствительных бактерий, образующих колонии в кишечнике.
Примеры, приведенные выше, свидетельствуют о том, что низин и другие пептиды с аналогичной противомикробной активностью вопреки ожиданиям будут оказывать необходимое действие в среде ободочной кишки без рецидивов, без любых возможных нежелательных эффектов.
Предварительно были разработаны композиции для осуществления доставки терапевтического количества низина в ободочную кишку путем орального введения. Эти композиции описаны в примерах 6-8. В экспериментах, представленных ниже, был проведен поиск лекарственных форм, которые сохраняют целостность в течение, по крайней мере, 4 ч при рН желудка и в течение 0,5-3 ч при рН 6,8 (рН среды нижней части тонкой кишки), а затем начинают расщепляться в ободочной кишке или в ближайшей к ней зоне.
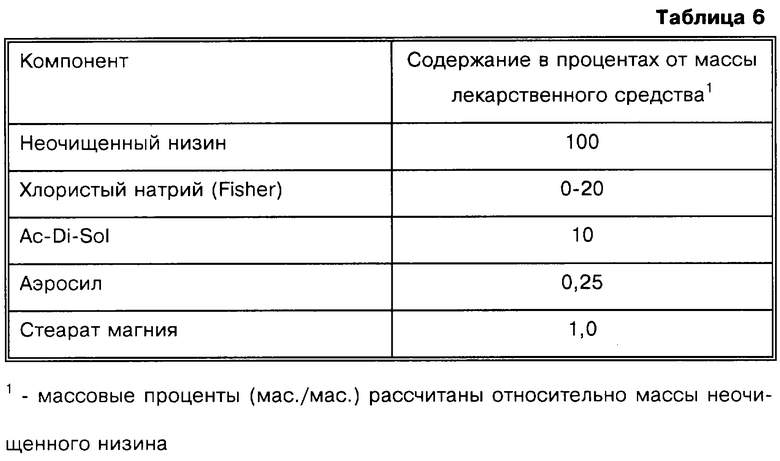
Предварительные исследования были направлены на разработку состава ядра таблетки без покрытия, которое быстро распадается в фосфатном буферном растворе, рН 7,0. Разработка состава ядра таблетки является непростой задачей из-за особых физико-химических свойств низина и в связи с тем, что относительно большую часть ядра таблетки составляет активное лекарственное средство. В отличие от большинства лекарственных средств, включая пептиды медицинского назначения, низин является амфипатическим веществом (а также гидрофобным). Таким образом, несмотря на достаточно высокую растворимость в воде, даже при нейтральном рН, низин с трудом диффундирует из спрессованного ядра при погружении ядра в буферный раствор. Вместо растворения, вокруг таблетки образуется слой гелеобразного низина, который ограничивает доступ воды внутрь таблетки. В результате расширенной программы по разработке состава композиции и изучению различных наполнителей и дезинтеграторов эта уникальная проблема была решена простым добавлением в таблетку оптимального количества хлорида натрия. Эта добавка достаточно эффективно снижает гелеобразование и обеспечивает разложение таблетки.
Второй проблемой при разработке состава таблетки является прочность ядра таблетки, так как ядро должно выдерживать жесткие условия интенсивного перемешивания при формировании последовательных покрытий таблетки с использованием процесса в псевдоожиженном слое Wuster™ Fluidized. Таблетки, содержащие различные количества связующих веществ с высокой эффективностью (Providone, Methocel и Carbopol™), характеризуются недостаточной для указанного способа прочностью. Глубокий анализ проблемы позволяет сделать вывод о том, что благодаря природе и физико-химическим свойствам низина, связыванию компонентов препятствует захватываемый воздух, который, таким образом, приводит к снижению физической прочности таблеток. Эта проблема решается путем включения в процесс изготовления таблеток способа вальцового прессования.
Характеристики высвобождения (лекарственного средства) из композиций изменяют путем формирования покрытия ядра таблеток с использованием сополимера метакриловой кислоты и метилметакрилата (Eudragitтм). Время до начала разложения таблетки и время до завершения разложения изменяют воспроизводимым способом путем изменения соотношения массы покрытия и массы ядра таблетки.
В примерах 6-11 описаны различные составы композиций и результаты исследования их пригодности для доставки эффективных количеств лантоцидов согласно настоящему изобретению в ободочную кишку.
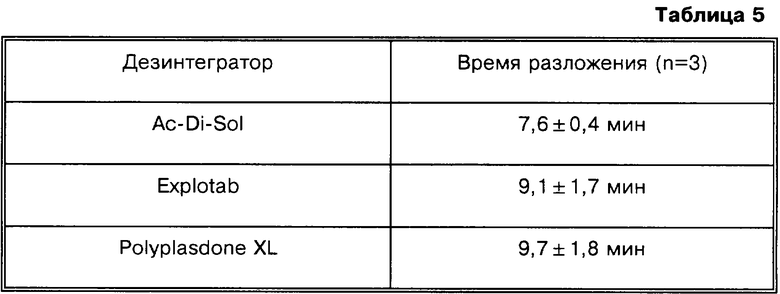
Пример 6 а
Влияние дезинтегратора на разложение таблетки
Готовят ядра таблеток следующего состава.
В качестве дезинтеграторов используют Ac-Di-Sol, Explotab и Polyplasdone XL. Времена разложения (измеренные в фосфатном буферном растворе, рН 7) таблеток, содержащих различные дезинтеграторы, приведены ниже.
Таблетки, содержащие в качестве дезинтегратора Ac-Di-Sol, разлагаются быстрее, чем таблетки, содержащие другие исследованные дезинтеграторы. Соответственно, следующие композиции получают с использованием Ac-Di-Sol.
Пример 6 б
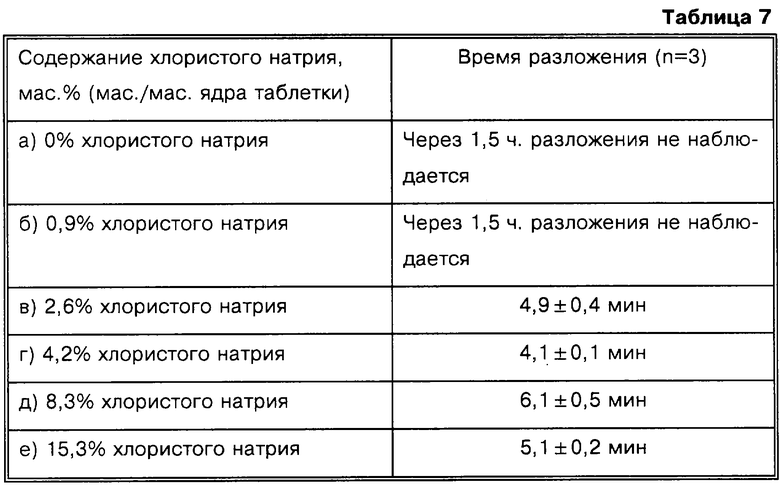
Влияние NaCl на разложение таблеток
Готовят ядра таблеток следующего состава.
Представленные выше результаты свидетельствуют о том, что присутствие хлористого натрия в достаточной концентрации позволяет исключить гелеобразование и значительно увеличить скорость разложения таблеток низина при физиологических значениях рН. Исследованные ядра таблеток, содержащие более 1% хлористого натрия, распадаются в течение 4-6 мин, в то время как при концентрации NaCl 1% или менее разложения не происходит даже через 1,5 ч. Кроме того, не наблюдается значительных изменений времени разложения при концентрации NaCl до 15,3%. Таким образом, согласно настоящему изобретению следует ожидать, что композиции, содержащие NaCl в диапазоне концентрации от приблизительно 2% до приблизительно 20%, пригодны для доставки эффективного количества низина или других лантоцидов в ободочную кишку.
Пример 7
Ядра таблеток, содержащих низин
NIP (1)
Состав: (проценты относительно массы неочищенного низина)
Внутригранулярные компоненты:
Неочищенный низин 100
Prosolv 90 12,5
Ac-Di-Sol 5
Хлористый натрий 5
Тальк 5
Внегранулярные компоненты:
Prosolv 90 12,5
Povidone 5
c-Di-Sol 5
Хлористый натрий 5
Стеарат магния 0,5
Масса всей таблетки =152,5 мг
Свойства таблетки:
Прочность на раздавливание =2559,45±856,17 кг (5,65±1,8 килофунтов, (kp)) (n=10)
Время разложения:
В R.O. воде (очищенной методом обратного осмоса)=24,4±2,5 мин (n=3)
В фосфатном буферном растворе рН 7,0=33,1±4,5 мин (n=3)
NIP (2)
Состав: (проценты относительно массы неочищенного низина)
Внутригранулярные компоненты:
Неочищенный низин 100
Prosolv 90 12,5
Ac-Di-Sol 7,5
Хлористый натрий 7,5
Тальк 2
Внегранулярные компоненты:
Prosolv 90 12,5
Povidone 5
Ac-Di-Sol 7,5
Хлористый натрий 7,5
Стеарат магния 0,5
Масса всей таблетки =162,5 мг
Свойства таблетки:
Прочность на раздавливание =2518,68±856,17 кг (5,56±1,89 килофунтов, (kp)) (n=10)
Время разложения:
В R.O. воде =23,9±2,1 мин (n=3)
В фосфатном буферном растворе рН 7,0=29,9±2,7 мин (n=3)
Показано, что не только лекарственные формы обладают приемлемыми характеристиками при разложении и необходимой прочностью на раздавливание в условиях, аналогичных условиям прохождения таблетки через желудочно-кишечный тракт, но обнаружено, что при этом сохраняется целостность низина и равномерность состава композиции.
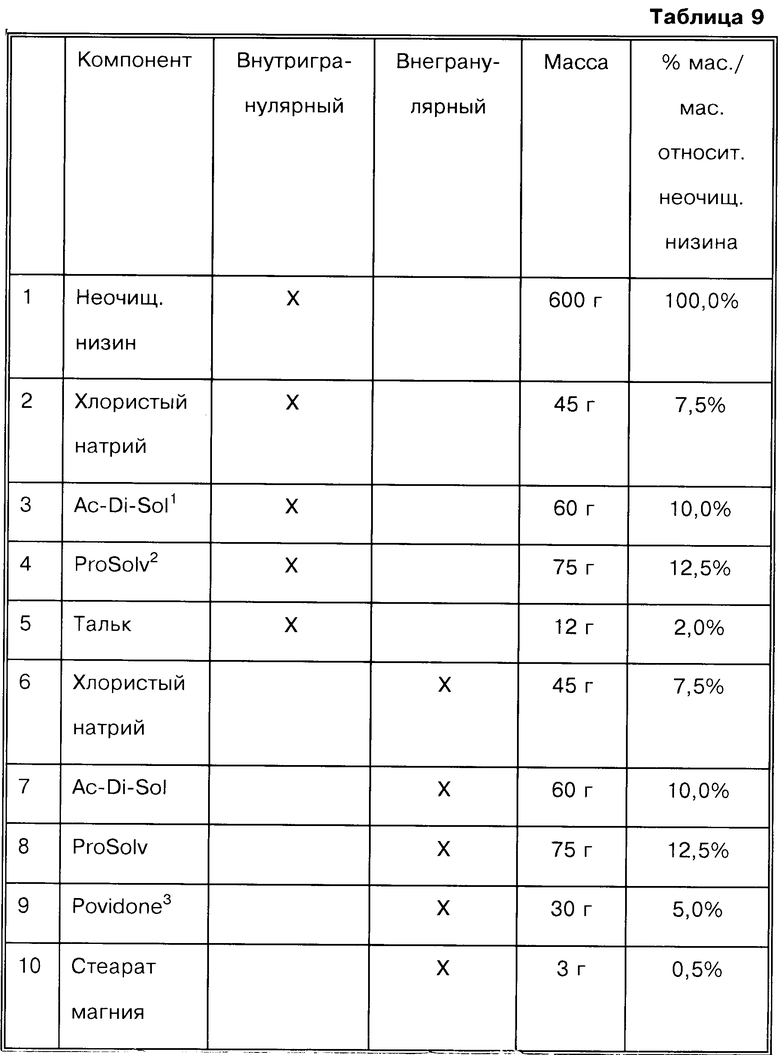
Пример 8
(А) Получение ядер таблеток
1 - Ac-Di-Sol = поперечно сшитая натрий карбоксиметилцеллюлоза
2 - ProSolv = силикатированная микрокристаллическая целлюлоза
3 - Povidone = поливинилпирролидон
Ядра таблеток получают с использованием следующих стадий:
1. Все компоненты просеивают каждый отдельно через сито № 20 (0.0331’’).
2. Взвешивают указанные количества внутригранулярных компонентов: низин, NaCl, Ac-Di-Sol и ProSolv (компоненты № 1-4). Смешивают их в подходящем стеклянном сосуде.
3. Перемешивают на турбулентной мешалке Turbula при 50 об/мин в течение 15 мин.
4. Взвешивают тальк (компонент № 5), добавляют к перемешанному продукту, полученному на стадии 3.
5. Перемешивают на турбулентной мешалке Turbula при 50 об/мин в течение 3 мин.
6. Смесь, полученную на стадии 5, уплотняют на валиковом уплотнителе (модель TF-mini), давление валков =9806,6 кН/м2 (100 кг/см2), скорость вращения валков =6 об/мин, скорость винтовой прокатки =11 об/мин.
7. Уплотненный материал, полученный на стадии 6, отсеивают на сите с размером ячеек 1,0 мм с использованием качающегося гранулятора (Erweka AR400 Wet-Dry Granulator).
8. Полученные на стадии 7 гранулы уплотняют на валиковом уплотнителе (модель TF-mini), давление валков =2941,9 кН/м2 (30 кг/см2), скорость вращения валков =8 об/мин, скорость винтовой прокатки =11 об/мин.
9. Уплотненный материал, полученный на стадии 8, отсеивают на сите с размером ячеек 1,0 мм с использованием качающегося гранулятора.
10. Полученные на стадии 9 гранулы уплотняют на валиковом уплотнителе, давление валков =2941,9 кН/м2 (30 кг/см2), скорость вращения валков =8 об/мин, скорость шнека =11 об/мин.
11. Уплотненный материал, полученный на стадии 10, отсеивают на сите с размером ячеек 1,0 мм с использованием качающегося гранулятора.
12. Взвешивают указанные количества дополнительно гранулированных порций NaCl, Ac-Di-Sol, Prosolv и Povidone (компоненты № 6-9). Добавляют к гранулам, полученным на стадии 11.
13. Перемешивают на турбулентной мешалке Turbula при 50 об/мин в течение 10 мин.
14. Взвешивают стеарат магния (компонент No 10). Добавляют к смеси, полученной на стадии 13.
15. Перемешивают на турбулентной мешалке Turbula при 50 об/мин в течение 2 мин.
16. Смесь, полученную на стадии 15, уплотняют на ротационном прессе для таблетирования Manesty D3B (давление уплотнения =679,5 кг (1500 фунтов), скорость =16 об/мин) с использованием двояковогнутых блоков размером 7,0 мм.
Показано, что полученные указанным способом ядра таблеток обладают необходимой прочностью и сохраняют целостность в процессе последующего формирования покрытия.
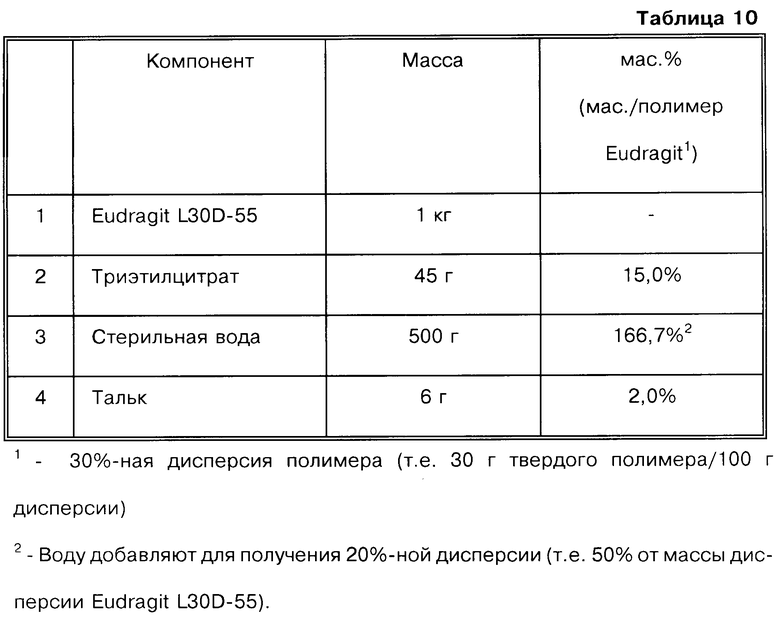
(Б) Получение таблеток с покрытием
Дисперсию для формирования покрытия ядер таблеток, полученных, как указано выше на стадии (А), готовят следующим образом.
1. Фильтруют Eudragit L30D-55 через чистое сито.
2. Взвешивают дисперсию Eudragit L30D-55.
3. Взвешивают воду. В процессе перемешивания к суспензии Eudragit добавляют приблизительно 2/3 воды.
4. Взвешивают триэтилцитрат (ТЭЦ), в процессе перемешивания кдисперсии Eudragit добавляют по каплям ТЭЦ. Промывают сосуд, из которого добавляли ТЭЦ, двумя порциями оставшегося количества воды и промывные воды добавляют к смеси.
5. Перемешивают в течение 1 ч.
6. Взвешивают тальк, добавляют к смеси при перемешивании.
7. Перемешивают в течение 1,5 ч.
Покрытие ядер таблеток формируют с использованием дисперсии для
покрытия следующим образом.
1. Ядра таблеток помещают в устройство аппарата Вурстера с псевдоожиженным слоем.
2. Дисперсию для покрытия помещают на балансир, обеспечивающий непрерывное перемешивание с помощью магнитной мешалки.
3. Покрытие таблеток формируют в следующих условиях:
Скорость распыления:7,0 г/мин
Давление распыления: 150 кН/м2 (1,5 бар)
Температура ввода:50°С.
Пример 9
Влияние толщины покрытия на разложение таблетки.
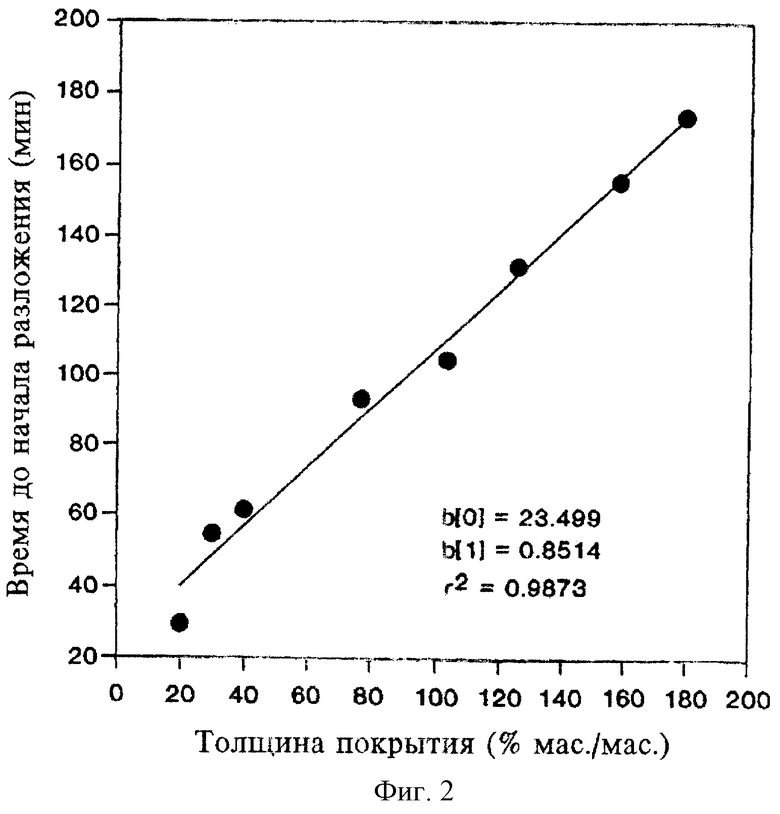
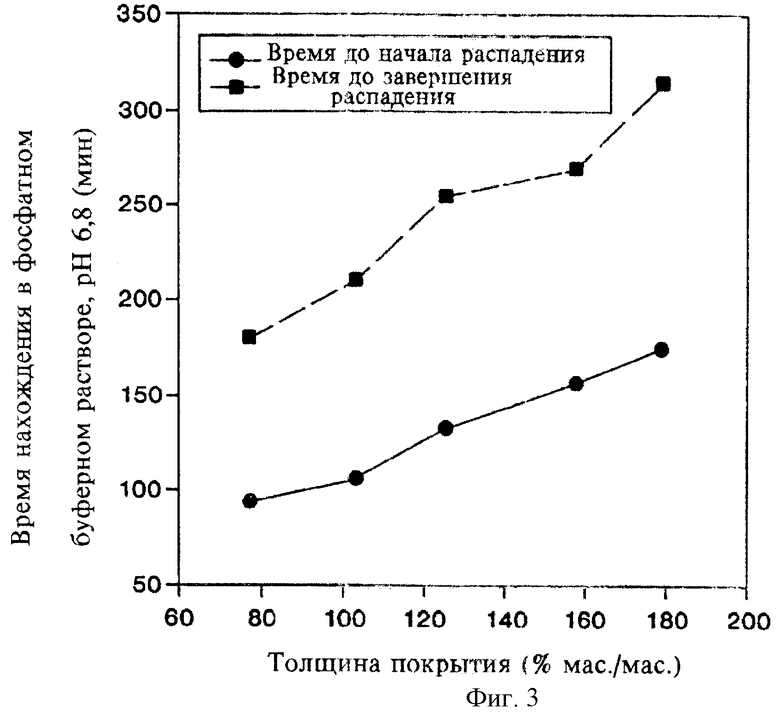
Исследуют влияние толщины покрытия из Eudragit L30D на разложение и растворение таблеток при рН 6,8. Толщину покрытия выражают в процентах, т.е. в соотношении массы покрытия и массы ядра таблетки. Полученные результаты, представленные на фиг.2 и 3, свидетельствуют о строгой пропорциональной зависимости времени до начала разложения и времени до завершения разложения от толщины покрытия из Eudragit L30D. На фиг.4 показано, что время запаздывания между первоначальным контактом таблетки с буфером и первоначальным высвобождением низина напрямую зависит от толщины покрытия. Таким образом, с помощью формирования покрытия из Eudragit L30D достаточной толщины, можно придавать необходимые характеристики пролонгированного действия, достаточные для доставки лекарственного средства в ободочную кишку посредством орального введения. Более того, характеристики пролонгированного действия можно варьировать путем изменения толщины покрытия.
Согласно настоящему изобретению следует ожидать, что толщина покрытия в диапазоне от приблизительно 20% до приблизительно 180% (от 0,15 мм до 1,316 мм, измерено по центру) будет обеспечивать необходимые характеристики пролонгированного действия композиций. Согласно наилучшему варианту воплощения настоящего изобретения толщина покрытия составляет приблизительно 40% (0,371±0,07 мм, измерено по центру).
Пример 10
Высвобождение лекарственного средства в имитированных условиях прохождения через желудочно-кишечный тракт.
Таблетки (6) с 40%-ным покрытием из Eudragit L30D (толщина покрытия 0,371 мм, измерено по центру) получают с использованием аппарата для таблетирования USP тип II в буферном растворе рН 6,8 при 37°С и при перемешивании со скоростью 100 об/мин. Зависимость растворения таблеток от времени определяют сначала при выдерживании их в 0,1 н. HCl (среда желудка), а затем в 50 мМ фосфатном буфере рН 6,8 (среда толстой кишки). Результаты, представленные на фиг.5, свидетельствуют о том, что можно приготовить содержащие низин таблетки с воспроизводимыми характеристиками пролонгированного действия низина (т.е. временем задержки растворения), необходимыми для доставки низина в ободочную кишку.
Пример 11
Иллюстрация доставки низина в ободочную кишку человека с использованием таблеток пролонгированного действия
Ядра таблеток, содержащие 100 мг неочищенного низина, формируют при соотношении активного компонента и наполнителей, как указано выше в примере 8, но кроме того, добавляют оксид самария в количестве 10 мг на таблетку. Таблетки покрывают слоем из Eudragit L30D-55, как указано в примере 8, и формируют 40%-ный слой покрытия (толщина покрытия 0,371 мм, измерено по центру). Кроме того, формируют таблетки с 120%-ным покрытием (толщина покрытия 0,896 мм, измерено по центру) и с 180%-ным покрытием (толщина покрытия 1,316 мм, измерено по центру). Затем таблетки бомбардируют нейтронами, при этом часть нерадиоактивного самария (152Sm) превращается в радиоактивный самарий (153Sm), что позволяет осуществлять наблюдение за прохождением таблетки через желудочно-кишечный тракт с использованием сцинтиграфии [Digenis G.A. and Sandefer E. Gamma scintigraphy and neutron activation techniques in the in vivo assessment of orally administered dosage forms (Методы гамма-сцинти-графии и активации нейтронов для наблюдения за продвижением введенных орально лекарственных форм in vivo), Crit.Rev.Ther.Drug Carrier Systems 7, 309-345 (1991)].
Сцинтиографические исследования проводят на 12 здоровых мужчинах. В первой группе шесть испытуемых получают по одной таблетке либо с 40%, 120%, либо 180%-покрытием из Eudragit (по два испытуемых на каждый тип композиции). Во второй группе четыре испытуемых получают по одной таблетке с 40%-ным покрытием, а два испытуемых получают по одной таблетке с 120%-ным покрытием. Таблетки запивают 250 мл ледяной воды. Наблюдение проводят через каждые 30 мин.
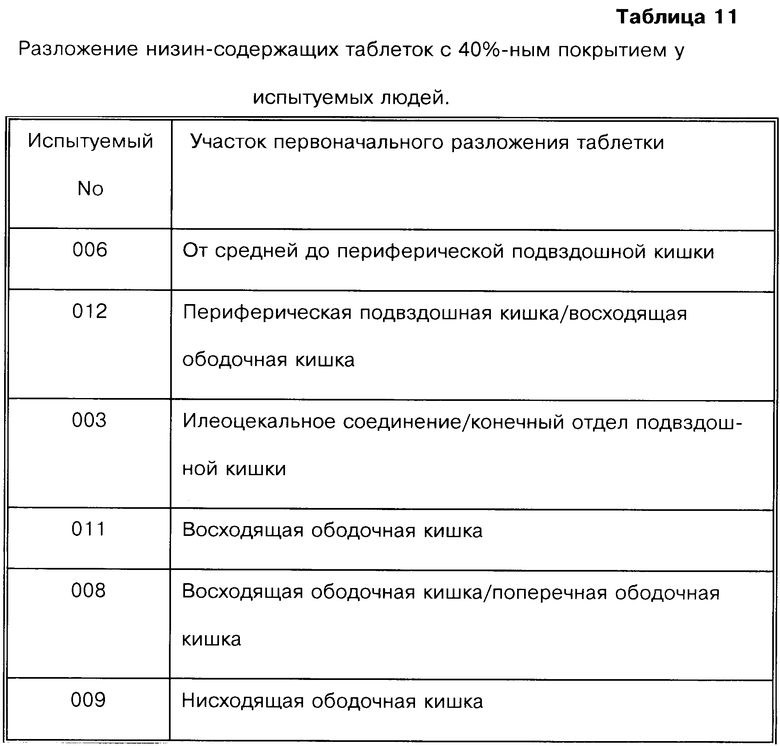
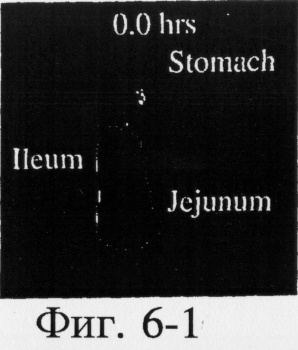
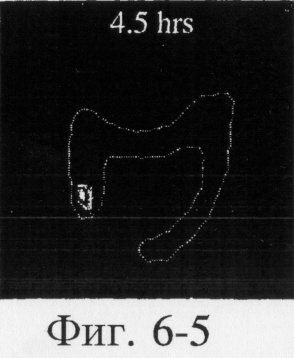
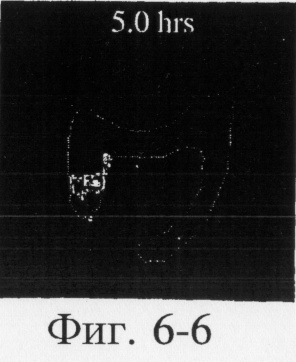
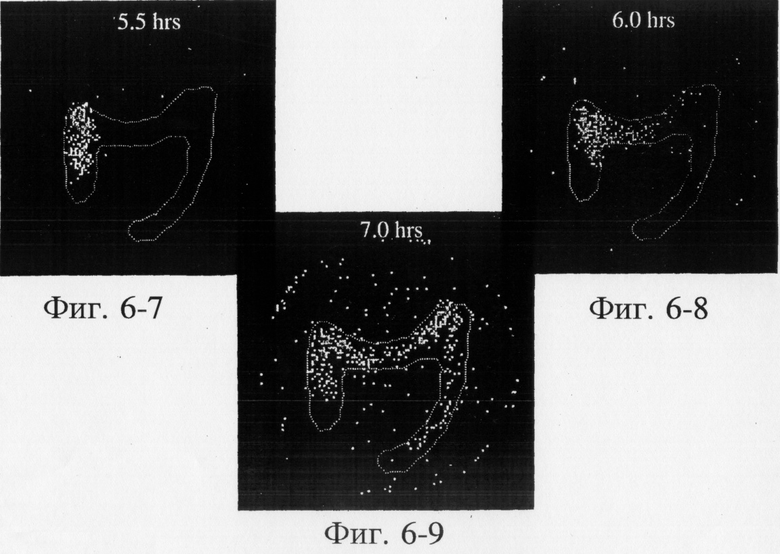
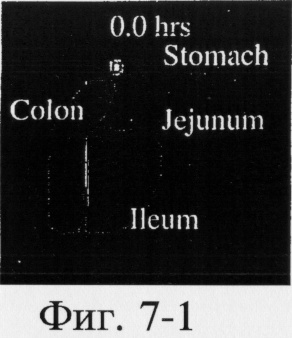
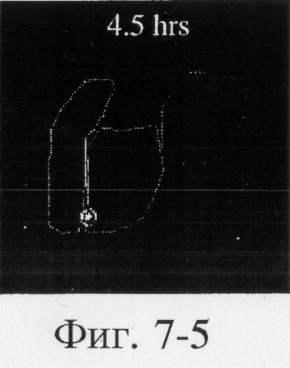
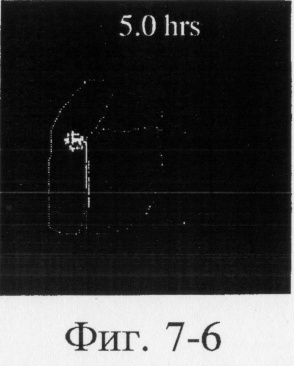
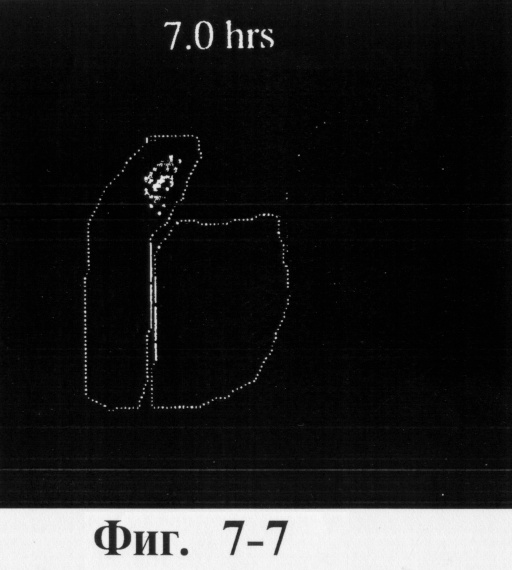
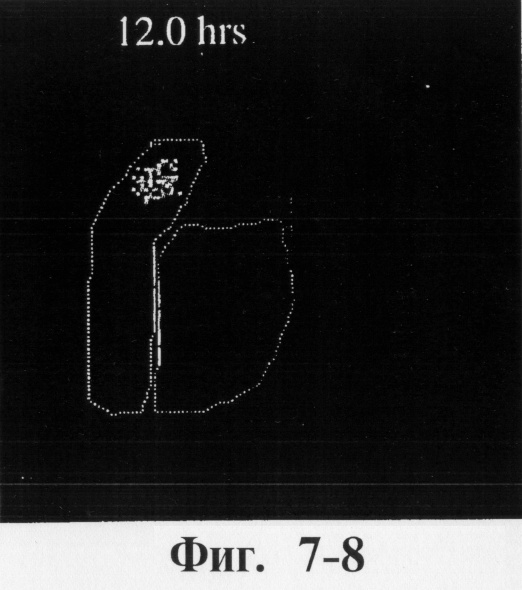
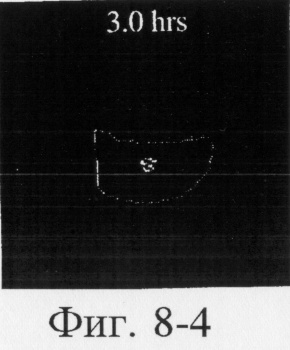
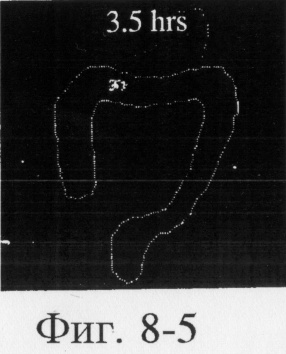
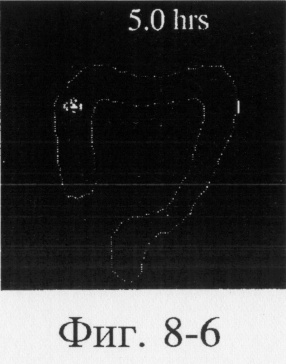
На фиг.6, 7 и 8 представлены сцинтиграммы процесса прохождения таблеток с различной композицией через желудочно-кишечный тракт. На фиг.6 показан путь прохождения таблетки с 40-%-ным покрытием у одного испытуемого, на фиг.7 - таблетки со 120%-ным покрытием, на фиг.8 - таблетки с 180%-ным покрытием. Как видно на фиг.6-1 - 6-6, таблетка с 40%-ным покрытием сохраняет свою целостность при прохождении через желудок и тощую кишку. Таблетка полностью расщепляется в проксимальной ободочной кишке через 5,5 ч (фиг.6-7 - 6-9). Таблетка с 120%-ным покрытием начинает разлагаться через 12 ч, причем в этот момент она находится в поперечной ободочной кишке (Фиг.7-7, 7-8). Таблетка с 180%-ным покрытием достигает прямой кишки, сохраняя целостность (фиг.8-1 - 8-9). Полученные результаты свидетельствуют о том, что время разложения таблетки как in vivo, так и in vitro зависит от толщины покрытия.
Данные, полученные при исследовании 6 испытуемых, получивших таблетку с 40%-ным покрытием, представлены в табл.11. У пяти из шести испытуемых таблетка начинает распадаться между периферической подвздошной кишкой и поперечной ободочной кишкой, а прогрессирующее расщепление таблетки происходит в процессе прохождения через ободочную кишку.
У всех шести испытуемых, получивших указанные композиции, отрицательного действия таблеток не наблюдается.
Данные, полученные в этом примере, свидетельствуют о том, что можно сформировать содержащую низин таблетку с подходящими характеристиками пролонгированного действия для местного лечения заболевания ободочной кишки человека, что можно обеспечить расщепление содержимого таблетки в ободочной кишке человека, а также, что доза, содержащая 100 мг неочищенного низина, характеризуется хорошей толерантностью при введении композиций пролонгированного действия в ободочную кишку человека. Согласно изобретению можно использовать таблетки, содержащие от приблизительно 50 мг до приблизительно 600 мг низина. Можно принимать несколько таблеток (до 4) при любом данном курсе лечения и применять несколько курсов лечения (до 6) в любой данный 24-часовой промежуток времени. Диапазон ежедневной дозы низина может составлять от минимум приблизительно 100 мг до максимум приблизительно 6 г, предпочтительно от приблизительно 300 мг до приблизительно 2 г. Аналогичные дозы таблеток и ежедневные дозы применимы по отношению к другим лантоцинам.

| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2478372C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2646825C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИСФОСФОНАТОВ | 2005 |
|
RU2359678C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА, УСТОЙЧИВАЯ К ДЕЙСТВИЮ ЖЕЛУДОЧНОГО СОКА, ВКЛЮЧАЮЩАЯ N-(2-(2-ФТАЛИМИДОЭТОКСИ)АЦЕТИЛ)-L-АЛАНИЛ-D-ГЛУТАМИНОВУЮ КИСЛОТУ (LK 423) | 2005 |
|
RU2375047C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ АДСОРБЕНТОВ В КИШЕЧНИК | 2016 |
|
RU2681315C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ РИЗЕДРОНАТА | 2005 |
|
RU2381791C2 |
| ФАРМАЦЕВТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ И КОМПОЗИЦИИ ФЕНИЛЭФРИНА ДЛЯ АБСОРБЦИИ В ОБОДОЧНОЙ КИШКЕ | 2007 |
|
RU2454225C2 |
| СОСТАВЫ ПАНТОПРАЗОЛА, СОСТОЯЩИЕ ИЗ МНОЖЕСТВА ЧАСТИЦ | 2004 |
|
RU2361574C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С НАБУХАЮЩИМ ПОКРЫТИЕМ | 2004 |
|
RU2375048C2 |
| pH-КОНТРОЛИРУЕМЫЕ СИСТЕМЫ ИМПУЛЬСНОЙ ДОСТАВКИ, МЕТОДЫ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЯ | 2005 |
|
RU2412694C2 |










Изобретение относится к медицине, к гастроэнтерологии, и может быть использовано для лечения заболеваний, связанных с инфекцией ободочной кишки микроорганизмом С.difficile, а также с образованием колоний резистентных к ванкомицину энтерококков. Вводят эффективное количество фармацевтической композиции, содержащей покрытие, сохраняющей свою целостность в процессе прохождения через желудочно-кишечный тракт и высвобождающей активный компонент в ободочной кишке, при этом она содержит лантоцин в качестве активного компонента, от 2 до 20% NaCl и от 20 до 180% покрытия в расчете на массу неочищенного активного компонента. Данное изобретение предназначено для разработки средств, направленных на лечение заболеваний ободочной кишки и для подавления потенциально опасных бактерий, образующих колонии в ободочной кишке, а также для разработки средств доставки выбранного лантоцина в ободочную кишку в достаточном количестве для эффективного лечения очага инфекции. 3 н. и 24 з.п. ф-лы, 8 ил., 11 табл.
Приоритет по пунктам:
| БАКТЕРИЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ КОНСЕРВИРОВАНИЯ ПИЩЕВЫХ ПРОДУКТОВ | 1990 |
|
RU2048151C1 |
| ТВЕРДАЯ ФАРМАЦЕВТИЧЕСКАЯ ФОРМА ПРОГРАММИРУЕМОГО ВЫДЕЛЕНИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1991 |
|
RU2012330C1 |
| WO 9313793, 22.07.1993 | |||
| WO 9700694, 09.01.1997. | |||
Авторы
Даты
2004-08-20—Публикация
1998-06-08—Подача