Описание
Настоящее изобретение относится к способу скрининга библиотек молекул, в частности библиотеки фагового дисплея, для идентификации или отбора одного или нескольких ее элементов, которые являются возможными партнерами связывания одного или нескольких объектов-мишеней, в частности возможными партнерами связывания молекул клеточной поверхности. Изобретение, кроме того, относится к улучшенному способу отделения вероятных партнеров связывания указанных объектов-мишеней от других элементов библиотеки.
Методика фагового дисплея антител показала себя как очень подходящую методику скрининга и отбора антител к заданным антигенам-мишеням (для обзора см. Hoogenboom et al., 1998, Immunotechnol., 4:1-20). Большинство стратегий основано на наличии очищенных и/или рекомбинантных антигенов, которых скринируют после иммобилизации на твердую подложку.
Исследование разнообразия поверхностей клеток и идентификация партнеров связывания молекул на поверхности клеток, специфичных для определенных типов клеток или состояний, связанных с заболеванием, является наиболее многообещающим подходом для развития целевых терапий. Однако идентификация таких партнеров связывания часто связана с представляющими сложность экспериментами.
Общепринятые способы идентификации партнеров связывания молекул клеточной поверхности основаны на инкубации клеток в суспензии или культуре с комплексными одноцепочечными Fv (scFv) библиотеками фагового дисплея с последующими несколькими промывками (обычно 5 или больше) и кислой или щелочной элюцией связавшихся фагов (см., например, Hoogenboom et al., 1999, Eur. J. Biochem., 260: 774-784; Ridgeway et al., 1999, Cancer Research, 59: 2718-2723; Wong et al., 2001, Cancer Immunol. Immunother., 50: 93-101). Перед этим процессом часто осуществляют удаление не имеющих отношения партнеров связывания посредством отрицательного пэннинга на не имеющих отношения клетках. Разработанный позднее и более высокоэффективный способ представляет скрининг клеток библиотекой фагового дисплея после иммобилизации клеток на нитроцеллюлозную мембрану (Radosevic et al., 2003, J. Immunol. Methods, 272:219-233).
Альтернативный и времясберегающий подход по сравнению с общепринятым подходом скрининга, отбора и сортировки пептидов, связывающихся с клеточной поверхностью, с использованием библиотеки фагового дисплея, был описан авторами Giordano et al., и назван методом BRASIL (Biopanning and Rapid Analysis of Selective Interactive Ligands (Биопэннинг и Быстрый Анализ Селективно Взаимодействующих Лигандов), 2001, Nature Med., 11; 1249-1253). Этот метод основан на одностадийном разделении в органической фазе свободных и связанных с клетками фагов, преимуществом которого является отсутствие стадий промывки, необходимых для общепринятого способа (то есть стадий, в которых свободные фаги смываются с клеток), которые являются трудоемкими, неэффективными и приводят к потере клеток и потенциальных лигандов.
Неожиданно оказалось, что вразрез с идеей способа BRASIL, существенно улучшенный способ скрининга, отбора и идентификации связывающих партнеров молекул клеточной поверхности включает применение по меньшей мере одной стадии промывки перед стадией разделения в органической фазе. Было показано, что описанный метод также имеет существенные улучшения по сравнению с общепринятыми способами промывки и элюции, описанными выше.
В наиболее общем смысле, настоящее изобретение поэтому относится к способу скрининга библиотеки молекул для идентификации или отбора одного или нескольких ее элементов, которые являются вероятными партнерами связывания одного или нескольких объектов-мишеней, предусматривающему:
(а) контактирование экспрессионной библиотеки с одним или несколькими объектами-мишенями;
(b) проведение для указанных объектов-мишеней по меньшей мере одной стадии промывки;
(c) отделение объектов-мишеней, которые связались с одним или несколькими элементами экспрессионной библиотеки, от несвязанных элементов экспрессионной библиотеки посредством разделения через органическую фазу, таким образом, отделяя вероятных партнеров связывания указанных объектов-мишеней от других элементов библиотеки.
С альтернативной точки зрения, настоящее изобретение относится к улучшенному способу отделения от экспрессионной библиотеки вероятных партнеров связывания, которые связались с объектом-мишенью, от несвязанных элементов библиотеки, в котором предусмотрены этапы от (а) до (c), определенные здесь.
Скринируемая библиотека молекул в соответствии с настоящим изобретением может быть белковой экспрессионной библиотекой, то есть любой пептидной или полипептидной экспрессионной библиотекой. Примеры соответствующих экспрессионных библиотек хорошо известны и описаны в данной области техники и включают библиотеки дисплеев, такие как библиотеки фаговых дисплеев (например, Winter et al., WO90/05144; McCafferty et al., WO92/01047), бактериальные (например, Samuelson et al., 2002, J. Biotechnol. 96, 129-154), ковалентные или нековалентные библиотеки дисплеев, такие как библиотеки рибосомных дисплеев (например, как опубликовано в WO92/02536, The Regents of the University of Colorado, WO93/03172, University Research Corporation и WO91/05058, Kawasaki), или PROfusion библиотеки (Phylos, Inc.), где экспрессируемый белок связан с мРНК, кодирующей его, или ковалентные или нековалентные системы дисплеев, где экспрессируемый белок связан с ДНК, кодирующей его (например, через ковалентную связь, как в системах, описанных в WO98/37186, Actinova Ltd, или через цис-действующие белки в цис-дисплей системах, как описано в WO 04/022746), или системы дрожжевых дисплеев (например, описанные Wittrup, K. D. et al., WO 99/36569; Wittrup, K. D. (2001) Curr. Opin. Biotechnol. 12, 395-399; Lee, S. Y. et al (2003) Trends in Biotechnol. 21, 45-52), или бактериальные двухгибридные системы (например, Chien et al, 1991, Proc. Natl. Acad. Sci. USA 88, 9578). Альтернативные типы экспрессионных библиотек также могут быть легко применены, такие как бактериальные экспрессионные библиотеки или другие библиотеки, где белки экспрессируются и секретируются в виде растворимых фрагментов. Также можно скринировать химически созданные библиотеки, например синтезированные пептидные библиотеки. Для применения в изобретении предпочтительными являются библиотеки фаговых дисплеев.
Белок, экспрессируемый в экспрессионной библиотеке, может иметь любую соответствующую длину при условии, что указанная длина является достаточной для функционирования белка (или возможного функционирования) в качестве связывающего партнера объекта-мишени. Поэтому указанные белки могут быть короткими линейными пептидами (например, порядка 5-50 или 7-30 аминокислот в длину) или более длинными пептидами или полипептидами, которые скорее могут быть более правильно свернуты (могут обладать более правильной конформацией), чем линейные. В противоположность ранее известному в данной области методу BRASIL, описанному Giordano et al. выше, способы настоящего изобретения преимущественно показаны являющимися применимыми для скрининга экспрессионных библиотек, которые содержат более длинные полипептиды, более конкретно, экспрессионных библиотек антител в отличие от библиотек коротких пептидов.
Таким образом, белки экспрессионной библиотеки могут быть кодированы целыми генами или их фрагментами, например нуклеиновые кислоты, кодирующие элементы экспрессионной библиотеки, могут быть библиотекой кДНК или мРНК или их фрагментов, например, полученной из определенного типа клеток, или могут быть библиотекой геномной ДНК или ее фрагментов.
Предпочтительные экспрессионные библиотеки экспрессируют полипептидные связывающие партнеры, которые являются потенциальными лигандами, рецепторами, ферментами, субстратами, антигенами и т.п. или их фрагментами, и особенно предпочтительные экспрессионные библиотеки экспрессируют молекулы антител или фрагменты антител, которые затем можно скринировать для поиска кандидатов, которые связывают один или несколько известных или неизвестных антигенов-мишеней. Указанные экспрессионные библиотеки антител экспрессируют антитела в любой соответствующей форме и могут содержать молекулы целых антител или фрагменты антител, такие как одноцепочечные антитела (например, scFv), Fab, Fv, Fab'2, димерные антитела (одноцепочечные Fv фрагменты, образующие димеры), биспецифичные антитела, минитела (малые версии целых антител, которые кодируют в единственной цепи все необходимые элементы целого антитела), тяжелые цепи или легкие цепи, камелоидные антитела, тетратела (одноцепочечные Fv фрагменты, образующие тетрамеры), однодоменные антитела, тритела (одноцепочечные Fv фрагменты, образующие тримеры) и т.п. Предпочтительным форматом фрагментов антител являются scFv фрагменты.
Молекулы антител или фрагменты могут быть любого Ig (иммуноглобулинового) изотипа, такие как IgG, IgM или IgA и т.д., и экспрессионные библиотеки могут содержать антитела одного или нескольких этих подтипов.
Множество библиотек антител известно и описано в данной области, и любая из них может быть скринирована с применением способов изобретения.
Когда в настоящем документе упоминается экспрессионная библиотека, то этот термин может быть использован для ссылки на такую библиотеку на уровне нуклеиновой кислоты или белка, то есть до или после того, как экспрессия кодируемых белков имела место. Однако ясно, что такие экспрессионные библиотеки должны присутствовать на белковом уровне для того, чтобы произошло взаимодействие с объектами-мишенями.
Способы конструирования таких экспрессионных библиотек и кодирующих их нуклеиновых кислот хорошо известны и описаны в данной области, и любая известная экспрессионная библиотека или только что разработанная экспрессионная библиотека может быть использована при этом. Например, такие библиотеки могут состоять из природных полипептидов или их фрагментов, или могут быть полностью или частично случайными или синтетическими. Например, в случае экспрессионных библиотек антител, библиотеки могут быть получены клонированием нуклеиновых кислот из “наивной” популяции лимфоцитов здорового донора (например, как описано в ЕР-А-368684), или из обогащенной популяции лимфоцитов, например лимфоцитов, полученных у пациента, который был подвергнут действию антигена или иммунизирован вакциной, или, например, раковыми клетками (например, как описано в WO03/095491, Affitech AS), или из популяций лимфоцитов, которые были обогащены посредством “пэннинга” на определенные антигены.
Экспрессионные библиотеки и, в частности, экспрессионные библиотеки антител могут быть получены из любого соответствующего источника, предпочтительно из источника, относящегося к млекопитающим, более предпочтительно источника, относящегося к человеку. Также можно использовать химерные экспрессионные библиотеки или гуманизированные экспрессионные библиотеки. Библиотеки также могут быть созданы путем выбора природного каркаса и включения рандомизированных последовательностей в соответствующие места. Альтернативно, каркас в качестве основы может иметь одну или несколько консенсусных последовательностей, полученных из множества природных каркасных участков.
Как правило, методики, используемые для получения конструкций библиотеки, будут основаны на известных методах генной инженерии. При этом последовательности нуклеиновых кислот, кодирующие фактический белок или пептид, который будет экспрессироваться в экспрессионной библиотеке и который обычно меняется между различными элементами библиотеки, таким образом, обеспечивая разнообразие библиотеки, включают в экспрессионные векторы, соответствующие типу используемой экспрессионной системы. Соответствующие экспрессионные векторы для применения в фаговом дисплее, ковалентном или нековалентном дисплее, бактериальной экспрессии и т.п. хорошо известны и описаны в данной области (см., например, документацию экспрессионной библиотеки, обсужденную выше). Если в качестве экспрессионной библиотеки выбран фаговый дисплей, то можно использовать или фаговые или фагмидные векторы, хотя фагмидные векторы являются предпочтительными.
Полученные молекулы нуклеиновых кислот, кодирующие различные элементы библиотеки (то есть кодирующие пептиды, которые меняются между элементами библиотеки), также могут быть затем диверсифицированы перед скринингом с использованием стандартных методик, например посредством мутации, включающей добавление, делецию и/или замену одного или нескольких нуклеотидов контролируемым (например, сайт-направленным мутагенезом) или случайным образом, или посредством перестановки доменов, кассетного мутагенеза, перетасовки цепей и т.п. Синтетические нуклеотиды могут быть использованы для создания разнообразных последовательностей нуклеиновых кислот. Таким образом, все или часть нуклеиновых кислот, кодирующих экспрессирующиеся пептиды, могут быть синтезированы химически или получены из различных организмов или типов клеток.
Конструкции библиотеки могут необязательно или дополнительно содержать другие соответствующие компоненты, например точки начала репликации, индуцибельные или неиндуцибельные промоторы для инициации транскрипции, энхансеры, гены устойчивости к антибиотикам и маркеры, общие таги или репортерные молекулы, участки связывания праймеров для возможной амплификации конструкций посредством, например, ПЦР или другие желательные элементы последовательности. Соответствующие источники и местоположение таких дополнительных компонентов в конструкциях библиотеки, с тем чтобы они желательным образом функционировали, входят в обычную практику специалиста в данной области.
Включение маркеров или репортерных молекул может быть особенно эффективным в экспрессионных библиотеках, которые используются в настоящем изобретении. Такие маркеры или репортерные молекулы могут быть обнаружены прямым или косвенным способом и включают, например, короткие последовательности тагов, которые могут быть распознаны с помощью антител, радиоактивных меток, флуоресцентных меток или меток, которые могут быть обнаружены с помощью ферментов. Другие маркеры, которые могут быть использованы, включают один из партнеров связывающейся пары, такой как стрептавидин:биотин. Такие маркеры являются обычными маркерами, которые присутствуют во всех конструкциях библиотеки и могут быть использованы для обнаружения элементов библиотеки. В дополнение, силу детектируемого сигнала также можно использовать для количественного определения присутствия отдельного элемента библиотеки. Такое количественное определение присутствия отдельного элемента библиотеки может оказаться очень удобным для определения аффинности объекта-мишени в отношении элемента библиотеки. В качестве альтернативы или дополнительно, если, например, одна или несколько нуклеиновых кислот, составляющих молекулы библиотеки, помечены различными метками или иммобилизованы на разные по размеру или помеченные разными метками шарики, то можно получить информацию о составе, например можно получить последовательность молекул нуклеиновой кислоты.
В вариантах осуществления изобретения, где способы по изобретению объединены с методом AffiSelect (см. ниже), включение общих тагов или маркеров в конструкции библиотеки и в экспрессирующиеся элементы библиотеки (вероятные партнеры связывания) является особенно важным, и такие таги используются для облегчения связывания элементов библиотеки (вероятных партнеров связывания) с твердофазным носителем. Соответствующие таги и маркеры описаны ниже в описании метода AffiSelect.
Термин “объект-мишень”, используемый в описании, относится к представляющим интерес объекту или молекуле, для которых желательно найти партнеров связывания из экспрессионной библиотеки и которые прикреплены или каким-либо путем связаны с частью, которая может быть подвергнута разделению через органическую фазу, например частью, которая будет проходить сквозь и собираться внизу органической фазы при соответствующих условиях разделения, например центробежной силы. Такие объекты-мишени могут быть известными или неизвестными молекулами, для которых желательно идентифицировать вероятных партнеров связывания.
Такие объекты-мишени также должны быть способными связывать или по-другому взаимодействовать с элементами скринируемой белковой экспрессионной библиотеки. Поэтому указанные объекты-мишени являются объектами, способными связывать белки или пептиды, и могут быть белками/пептидами, гликопептидами, углеводами, липидами, гликолипидами, малыми химическими молекулами, нуклеиновыми кислотами и т.п., прикрепленными или по-другому ассоциированными с (например, присутствуя на поверхности) соответствующей частью, которая может быть подвергнута разделению через органическую фазу, такой как клетка или твердая фаза, в частности твердая фаза в виде частиц, такая как шарики. Поэтому такие объекты-мишени могут быть молекулами клеточной поверхности, прикрепленными к или являющимися компонентами целой клетки, или мембранных фракций клеток, или молекулами, например свободными, “голыми”, выделенными или очищенными молекулами, прикрепленными к твердой фазе, или фракциями клеточных мембран, прикрепленными к твердой фазе. Предпочтительными объектами-мишенями являются белки или пептиды, например антигены. Более предпочтительными объектами-мишенями являются молекулы клеточной поверхности (то есть молекулы, присутствующие in situ на поверхности клеток или мембранных фракций клеток) и, в частности, белки клеточной поверхности или пептиды, например, антигены клеточной поверхности.
В вариантах осуществления изобретения, где объект-мишень является молекулой, прикрепленной к поверхности твердой фазы, эта молекула может быть получена из любого соответствующего источника, то есть может быть природным белком, углеводом, липидом, гликолипидом и т.п., который выделен или очищен из своего природного окружения, или может быть рекомбинантной или синтезированной молекулой, например рекомбинантным белком или пептидом, или синтезированной химической молекулой. Выделенные, очищенные или рекомбинантные антигены являются особенно предпочтительными объектами-мишенями при этом.
Термин «клетка», используемый здесь, относится к любому виду биологической частицы, представляющей интерес, которая может быть разделена через органическую фазу. Например, этот термин включает прокариотические клетки, такие как бактерии, вирусы (в частности, агрегированные вирусные частицы, например частицы, агрегированные антителами или химической модификацией, или покрытые оболочкой вирусные частицы с большим сродством к органической фазе в отличие от водной фазы), эукариотические клетки (включая низшие эукариотические клетки, такие как дрожжевые клетки, и высшие эукариотические клетки, такие как клетки млекопитающих, в частности человеческие клетки). Биологические частицы, которые обычно не имеют достаточной плотности, чтобы быть разделенными через органическую фазу, как правило, исключены из термина «клетка», используемого здесь. Фрагменты клеток также включены в пределы этого термина, например мембранные фракции, фракции клеточной стенки, белки клеточной стенки, мембранные белки и т.п., при условии, что они сохраняют или наделены способностью быть разделенными через органическую фазу. (Например, в случае белков клеточной стенки и мембранных белков они могут нуждаться в агрегации для облегчения разделения через органическую фазу).
Клетки могут быть природными клетками или смесью клеток (например, клетками, полученными из пробы биопсии или какого-либо другого образца, взятого у млекопитающего субъекта), или клеточными линиями (включая иммортализованные клетки и клеточные линии, полученные методами генной инженерии, например клетки, трансформированные или трансфицированные нуклеиновой кислотой, кодирующей определенный объект-мишень, или множество клеток, трансформированных или трансфицированных библиотекой объектов-мишеней, например библиотекой кДНК, которые затем экспрессируют объекты-мишени на клеточной поверхности), и т.п. Предпочтительными библиотеками объектов-мишеней являются библиотеки, полученные из ассоциированных с болезнью объектов, например ассоциированных с болезнью клеток или патологических агентов, таких как вирусы или бактерии. Особенно предпочтительной библиотекой является библиотека опухолевых клеток или вирусная клеточная библиотека (например, библиотека кДНК), дающая возможность идентифицировать вероятных партнеров связывания белков, ассоциированных с опухолью или вирусом. Соответствующие эукариотические клетки (или другие типы клеток) для трансфекции, такие как, например, COS клетки, хорошо известны в данной области, и любые из них можно использовать. Клетки, которые сверхэкспрессируют указанный объект-мишень, также можно использовать.
Предпочтительными «клетками» для применения в настоящем изобретении являются эукариотические клетки или их мембранные фракции. Особенно предпочтительными являются те клетки, которые ассоциированы с болезненным состоянием, такие как, например, раковые клетки или клеточные линии, например клетки или клеточные линии раков молочной железы и легких, или лимфоциты (например, лимфоциты периферической крови) больного пациента, или клетки, инфицированные вирусом и, таким образом, представляющие вирусные белки на поверхности клетки.
Клетки для использования в способах изобретения могут быть получены из любого соответствующего источника, например клетки могут быть получены напрямую у млекопитающего субъекта, или их можно получить из культур in vitro. Если используется культура in vitro, тогда указанные клетки могут быть культивированы в суспензии или в виде монослоя и могут быть использованы в способах изобретения живыми или зафиксированными. Обычно предпочтительным является использование живых клеток, так как тогда объект-мишень на поверхности клетки присутствует в своей нативной конформации, что означает, что выбранные вероятные партнеры связывания тогда распознают объект-мишень в его нативной конформации, таким образом, повышая шансы, что такие вероятные партнеры связывания будут применимы в терапии или диагностике. Как правило, в способах изобретения свежевыделенные клетки используются более предпочтительно, чем замороженные или сохраненные клетки. Однако пэннинг на тканевых слайдах и замороженном материале также является возможным.
В вариантах осуществления настоящего изобретения, где объект-мишень прикреплен к поверхности твердой фазы, можно использовать любую соответствующую твердую фазу при условии, что она может быть разделена через органическую фазу. Чтобы достичь этого, специалист в данной области легко выберет твердую фазу с соответствующей плотностью, размером и формой. Однако видно, что твердые подложки в виде частиц были бы наиболее предпочтительными для достижения этого. Особенно предпочтительными подложками являются шарики, которые необязательно могут быть магнитными или по меньшей мере способными намагничиваться, например можно использовать полимерные шарики, несущие суперпарамагнитные частицы. Такие подложки хорошо известны и документально зафиксированы в данной области, и в обычную практику специалиста входит подбор наиболее соответствующей подложки для применения в способах изобретения.
Подложки в виде частиц, например шарики, являются особенно предпочтительными, потому что с ними легко работать in vitro и они облегчают автоматизирование процесса. Например, если шарики являются магнитными, их можно отделить от образца с помощью магнитного поля и затем промыть. В качестве альтернативы, если шарики помечены, например, флуоресцентной меткой, шарики можно разделить проточной цитометрией. Подходящие меченые, немеченые и магнитные шарики коммерчески доступны от компании Dyno Specialty Polymers AS из Lillestrom, Norway и Dynal Biotech ASA. Конкретными примерами магнитных шариков, которые могут быть использованы в способах, описанных здесь, являются шарики М-450, М-270 или М-280 от Dynal Biotech ASA, Norway. Конкретными примерами немагнитных шариков, которые могут быть использованы в способах, описанных здесь, являются 5 мкм микрошарики из глицидилметакрилата (производства Bangs Laboratories, Carmel, IN). Способы прикрепления биомолекулярных объектов-мишеней к твердым фазам также хорошо известны и описаны в данной области.
Термин “один или несколько”, используемый здесь в сочетании с термином “объект-мишень”, относится к одному или нескольким определенным типам объектов-мишеней, например одной или нескольким молекулам клеточной поверхности или полипептидам. Другими словами, способы изобретения могут быть использованы для поиска вероятных партнеров связывания одного объекта-мишени, или множества, или библиотеки объектов-мишеней (например, могут быть использованы для скринирования библиотеки против библиотеки, что является особенно выгодным). Если более чем один объект-мишень вовлечен в процесс скрининга, они могут быть прикреплены к или ассоциированы с теми же или другими частями, которые можно подвергнуть разделению через органическую фазу. Например, можно видеть, что если объекты-мишени являются молекулами клеточной поверхности, прикрепленными к целым клеткам или их мембранным фракциям, тогда возможно найти вероятных партнеров связывания для ряда различных молекул клеточной поверхности (другими словами, это является примером случая, где происходит поиск вероятных партнеров связывания для библиотеки объектов-мишеней, то есть представляет собой вид скрининга библиотека против библиотеки). Конечно, если желательно, эта процедура может быть смещена в направлении отбора вероятных партнеров связывания конкретной молекулы клеточной поверхности, например, в случае клетки, имеющей иммунодоминантный объект-мишень, или путем отбора клетки, которая известна, или была выбрана для сверхэкспрессии объекта-мишени, представляющего интерес, или была создана для сверхэкспрессии такого объекта-мишени. Дополнительными примерами библиотек объектов-мишеней являются библиотеки кДНК или другие геномные библиотеки, трансфицированные и экспрессированные в клетках, например вычтенная опухолевая кДНК библиотека, трансфицированная и экспрессированная в эукариотических клетках.
Конечно, каждый объект-мишень может быть представлен множеством копий в скрининге (несомненно, это обычно является предпочтительным), например, если объект-мишень является молекулой клеточной поверхности, тогда ее множественные копии предпочтительно присутствуют или на той же клетке, и/или на множестве клеток того же или другого типа.
В особенно предпочтительных вариантах осуществления изобретения экспрессионная библиотека является библиотекой антител (более предпочтительно, библиотекой фагового дисплея антител), и объекты-мишени являются молекулами клеточной поверхности (антигенами клеточной поверхности). Такие способы скринирования называются Отбор Антител на Основе Клеток (CBAS).
Этап осуществления контакта объектов-мишеней с экспрессионной библиотекой, или наоборот, может быть проведен любым соответствующим образом при таких условиях, чтобы соответствующие связывающиеся партнеры в экспрессионной библиотеке могли взаимодействовать с или связывать присутствующие объекты-мишени. Такие условия обычно будут варьировать в зависимости от природы экспрессионной библиотеки, объекта-мишени и части, с которой связан объект-мишень. Однако специалист легко определит соответствующие условия для облегчения связывания. Такой этап «контактирования» будет обычно проходить в растворе, или в жидкой среде, или каком-либо другом окружении, таком, что смесь экспрессионной библиотеки и объекта-мишени не будет смешиваться с органической фазой, так как это облегчит последующий этап разделения органической фазы. Таким образом, если объект-мишень присутствует на клетке, которую культивируют в виде монослоя, или клетках, которые получены от млекопитающего субъекта, например, из органа или ткани млекопитающего, тогда обычно их собирают и ресуспендируют в водной среде с помощью соответствующих методик перед контактированием с экспрессионной библиотекой. Однако также возможно контактирование экспрессионной библиотеки с монослоем клеток, после которого эти клетки могут быть собраны и ресуспендированы в водной среде с помощью соответствующих методик.
Примерные условия «контактирования» могут включать инкубацию на льду или при 4°С в течение времени от 30 минут до 4 часов. В качестве альтернативы, возможно проведение этапа контактирования при комнатной температуре или 37°С, и в некоторых случаях может быть предпочтительным. Смесь экспрессионной библиотеки и объекта-мишени необязательно может быть подвергнута мягкому качанию, перемешиванию или вращению. В дополнение, могут быть добавлены другие соответствующие реагенты, такие как блокирующие агенты для уменьшения неспецифического связывания. Например, можно использовать 1-4% раствор БСА или другой подходящий блокирующий агент (например, молоко). Однако следует понимать, что условия контактирования могут быть изменены или адаптированы специалистом в зависимости от цели способа скринирования. Например, если увеличить температуру инкубации до, например, комнатной температуры, это может увеличить возможность идентификации агентов, связывающихся с другой популяцией объектов-мишеней, например связывающихся с белками клеточной поверхности, которые легко интернализуются. В свою очередь, такие адаптации условий входят в компетенцию специалистов.
Размер и сложность экспрессионной библиотеки, применяемой в способах настоящего изобретения, могут варьировать, так же как и общее число копий объектов-мишеней, включенных в этап контактирования. Например, в предпочтительных вариантах осуществления изобретения, где экспрессионной библиотекой является библиотека фагового дисплея, предпочтительно использовать фаги с титром в области 108-1013, наиболее предпочтительно в области 1011.
Удобно, чтобы число копий объектов-мишеней можно было варьировать путем изменения числа присутствующих частей, с которыми ассоциированы объекты-мишени. Например, когда объект-мишень является молекулой клеточной поверхности или полипептидом и т.п., прикрепленными к твердой подложке, тогда число объектов-мишеней может быть доведено до нужного путем увеличения или уменьшения числа клеток или твердых подложек, присутствующих в контактирующей смеси, или путем увеличения или уменьшения числа полипептидов и т.п., прикрепленных к отдельной твердой подложке. В свою очередь, число требующихся объектов-мишеней может быть легко определено методом проб и ошибок, но, например, когда объект-мишень является молекулой клеточной поверхности, удобно использовать от 105 до 107 клеток.
Соответствующая концентрация объектов-мишеней могла бы быть также легко определена методом проб и ошибок, но, например, когда объект-мишень является молекулой клеточной поверхности, удобно использовать концентрацию 1×105-2×106 клеток/мл.
Промывочные этапы (b) проводят после того, как объекты-мишени побывают в контакте с экспрессионными библиотеками при соответствующих условиях, таких, чтобы произошло связывание/взаимодействие между объектами-мишенями и соответствующими элементами библиотеки, но перед разделением в органической фазе. Важно отметить, что заявленный способ скринирования не устраняет дополнительные промывочные этапы, проводимые на других этапах процедуры, например, перед этапом (а), например, при приготовлении объектов-мишеней для контакта с экспрессионной библиотекой, или после этапа (c), например, в дополнительном анализе объектов-мишеней или элементов экспрессионной библиотеки. Однако способы, которые не включают стадию промывки после стадии контактирования экспрессионной библиотеки с объектами-мишенями и перед разделением в органической фазе (например, метод BRASIL, Giordano et al., выше), исключены.
Промывочные этапы могут быть проведены любым соответствующим путем в зависимости от природы объекта-мишени и части, к которой он прикреплен. Например, если объект-мишень прикреплен к клетке или мембранной фракции клетки, то удобно проводить указанные промывки центрифугированием смеси экспрессионной библиотеки и объекта-мишени при таких условиях, чтобы клетки образовывали осадок, удалением супернатанта, а затем ресуспендированием осадка в соответствующей водной среде (например, в той же среде, в которой был проведен этап контактирования). Такие шаги по осаждению клеток и их ресуспендированию составляли бы одну промывку. Такие условия, как правило, также были бы подходящими для промывания объектов-мишеней, ассоциированных с твердой фазой в виде частиц. Однако если объекты-мишени были ассоциированы, например, с магнитной твердой фазой, то промывочные этапы (b) могли бы быть удобно проведены путем приложения магнитного поля к сосуду, в котором был проведен этап контактирования, удалением супернатанта и ресуспендированием твердой фазы в подходящей водной среде. Подходящие методы промывания твердых фаз в виде частиц хорошо известны специалистам. В свою очередь, такие шаги по разделению с помощью магнитного поля и ресуспендирования составляли бы один промывочный этап.
В способе изобретения проводят по меньшей мере один промывочный этап (b), например могут быть проведены по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 или по меньшей мере 4 промывочных этапа. Предпочтительно проводить менее чем 5 промывок, то есть предпочтительно проводить 1, 2, 3 или 4 промывки на стадии (b). Наиболее предпочтительно проводить 1, или 2, или 3 и особенно предпочтительно 2 промывки на этапе (b) способа. Это предпочтительное число промывок имеет дополнительное преимущество в том, что способ остается значительно более быстрым и менее трудоемким, чем общепринятый способ, который включает по меньшей мере пять промывок.
Эти промывочные этапы приводят к удалению части не связавшихся элементов экспрессионной библиотеки, то есть элементов, которые не взаимодействовали или неспецифически взаимодействовали с объектом-мишенью. Оставшаяся часть несвязавшихся элементов экспрессионной библиотеки будет затем удалена на этапе (c) способа, то есть на этапе разделения в органической фазе.
Для облегчения разделения в органической фазе, после промывок (b) объекты-мишени, содержащиеся в соответствующей полярной среде, например в водной среде, приводят в контакт с органической фазой. Указанная водная среда может быть наслоена сверху на органическую фазу или можно поместить органическую фазу поверх водной среды. В первом случае, при центрифугировании, связанные объекты-мишени собираются и предпочтительно осаждаются в органической фазе, в то время как несвязавшиеся элементы библиотеки остаются в водной среде. В последнем случае, при центрифугировании, водная среда, содержащая несвязавшиеся элементы экспрессионной библиотеки, проходит вверх через органическую фазу, в то время как связанные объекты-мишени собираются и предпочтительно осаждаются под органической фазой. В качестве альтернативы, также возможно смешать две фазы, которые тогда разделятся в процессе центрифугирования. Следовательно, достигается одинаковый результат.
Термин «органическая фаза», используемый в данном описании, относится к жидкой фазе, которая не смешивается с водой или другой полярной средой или водной средой. Органическими фазами, подходящими для применения в изобретении, являются те, которые при соответствующих условиях, например центрифугировании, будут позволять отделение связанных комплексов объекта-мишени и элемента экспрессионной библиотеки от несвязанных элементов экспрессионной библиотеки, например позволять связанным комплексам объекта-мишени и элемента экспрессионной библиотеки проходить сквозь, но будут исключать несвязанные элементы экспрессионной библиотеки, то есть будут исключать не образовавшие комплексы или свободные элементы экспрессионной библиотеки. Ясно, что любая из таких экспериментальных систем не является совершенной на 100%. Следовательно, соответствующая органическая фаза является такой, которая исключает большинство или значительную часть или которая фактически исключает несвязавшиеся элементы экспрессионной библиотеки.
В дополнение, соответствующая органическая фаза выбирается таким образом, чтобы она вызывала минимальное разрушение или повреждение объектов-мишеней, частей, к которым они прикреплены, элементов экспрессионной библиотеки и реакции связывания между объектами-мишенями и элементами библиотеки в смеси, особенно в случае для объектов-мишеней, элементов экспрессионной библиотеки и реакции связывания между ними двумя. Например, следует выбирать органическую фазу таким образом, чтобы такие компоненты подходили для использования в любой соответствующей нижеследующей стадии анализа, после того как они были собраны из органической фазы. Однако, в общем, с целью минимизировать любое вредное воздействие, которое органическая фаза могла бы оказать на биомолекулы в смеси, время, в течение которого биомолекулы находятся в контакте с органической фазой, обычно стараются свести к минимуму.
На основании вышеперечисленных функциональных требований специалист может легко определить соответствующие органические фазы для применения в заявленных способах. Примерами органических фаз, которые могут быть использованы в заявленных методах, являются органические фазы на основе фталатов, такие как те, которые обсуждаются в статье Giordano et al. выше, например дибутилфталат:циклогексан в объемном соотношении 9:1, или дибутилфталат:диизооктилфталат в объемном соотношении 4:6, или не смешивающееся с водой масло, такое как Versilube F50 oil (Alfa Chemicals Ltd., Woringham). Несомненно, применение не смешивающегося с водой масла для целей отделения комплексов экспрессионной библиотеки и объекта-мишени (и, в частности, комплексов фагов и объекта-мишени) от несвязавшихся элементов экспрессионной библиотеки (и, в частности, несвязавшихся фаговых частиц) образует еще дополнительный аспект изобретения.
Разделение через органическую фазу обычно проводят путем центрифугирования на соответствующей скорости, чтобы осадить или по меньшей мере собрать объекты-мишени, которые связались с одним или несколькими элементами экспрессионной библиотеки (связанные объекты-мишени) в органической фазе, в то время как все, или значительная часть, или большинство несвязавшихся элементов экспрессионной библиотеки остаются в водной фазе. Соответствующие условия центрифугирования, действующие на это разделение, будут зависеть от природы объекта-мишени (и части, к которой они прикреплены) и от конкретной используемой органической фазы. Однако, где используются клетки и молекулы клеточной поверхности являются объектами-мишенями, примерными условиями может быть центрифугирование при 10000-11000 g в течение от 5 до 10 минут при комнатной температуре или 4°С.
После этапа разделения (c) связанные объекты-мишени могут быть собраны из органической фазы и необязательно подвергнуты дополнительному анализу. Такой этап собирания может, если желательно, быть облегчен замораживанием органической фазы и удалением осадка, содержащего связавшиеся объекты-мишени, например, путем разрезания центрифужной пробирки на соответствующем месте. Такой этап замораживания с последующим оттаиванием (в будущем, после того как связавшиеся объекты-мишени собраны) обычно не оказывает неблагоприятного действия на нижеследующий анализ комплексов связавшихся объектов-мишеней и элементов экспрессионной библиотеки. Однако рекомендуется, чтобы это было проверено в подходящих экспериментах, перед тем как включать эту стадию в любую экспериментальную процедуру.
Способы настоящего изобретения могут включать другие дополнительные стадии. Например, экспрессионную библиотеку можно подвергнуть процедуре предварительного пэннинга, чтобы удалить некоторые нежелательные элементы экспрессионной библиотеки или уменьшить сложность библиотеки, путем контактирования экспрессионной библиотеки с одним или несколькими не имеющими отношения объектами, например биомолекулярными объектами, не являющимися мишенями, или клетками, которые не представляют интерес, перед тем как привести экспрессионную библиотеку в контакт с объектами-мишенями на этапе (а) способа. Такая процедура предварительного пэннинга также называется «отрицательным пэннингом». Например, экспрессионная библиотека может быть подвергнута процедуре предварительного пэннинга с клетками или их мембранными фракциями, которые не представляют интерес, например не экспрессируют желательные объекты-мишени, представляющие интерес, или экспрессируют объекты-мишени на низком уровне. Например, если метод разработан для идентификации элементов экспрессионной библиотеки, которые связываются с определенным типом раковых клеток, процедура предварительного пэннинга может быть проведена путем контактирования элементов экспрессионной библиотеки с разными или не имеющими отношения типами клеток, например другим типом опухолевых клеток или неопухолевым типом клеток, такими как лимфоциты или эндотелиальные клетки, или другие клетки, которые не представляют интерес. Целью указанных этапов предварительного пэннинга является удаление части элементов экспрессионной библиотеки, которые не будут связываться с объектами-мишенями, представляющими интерес. Указанные этапы предварительного пэннинга являются дополнительными этапами к этапам (а), (b) и (c) способа, и, следовательно, этапы (а), (b) и (c) заявленного способа не охватывают такие этапы предварительного пэннинга. Указанные этапы предварительного пэннинга можно провести при помощи любого соответствующего метода, например общепринятого метода или даже метода BRASIL, описанного выше. Однако предпочтительно будет провести этапы предварительного пэннинга с использованием этапов (а), (b) и (c), как изложено выше, за исключением того, что на этапе (а) экспрессионная библиотека контактирует с не имеющими отношения (не являющимися мишенями) объектами, и нужно сохранять несвязавшиеся элементы экспрессионной библиотеки. Следовательно, следует сохранять, а не выбрасывать, супернатанты из любого промывочного этапа (b), а на этапе разделения (c) следует сохранять несвязавшиеся элементы библиотеки, которые не разделились через органическую фазу. Эта истощенная экспрессионная библиотека может быть тогда подвергнута способу изобретения.
Можно провести один или несколько раундов предварительного пэннинга с использованием таких же или различных не имеющих отношения объектов.
Этапы от (а) до (c) способа изобретения могут быть рассмотрены как составляющие одного раунда пэннинга объектов-мишеней против элементов экспрессионной библиотеки. Хотя после этапа разделения (c) в первом раунде пэннинга связавшиеся объекты мишени можно собрать из органической фазы и необязательно подвергнуть дополнительному анализу, однако обычно с целью дальнейшего уменьшения комплексности экспрессионной библиотеки и получения подходяще обогащенной популяции вероятных партнеров связывания указанных объектов-мишеней для возможности продуктивного и эффективного по времени дополнительного анализа можно провести один или несколько дополнительных раундов пэннинга.
Дополнительные раунды пэннинга обычно включают забор связавшихся объектов-мишеней с этапа (c) способа, разделение, открепление, элюирование или выделение элементов экспрессионной библиотеки из объектов-мишеней (необязательно расширение или амплификацию элементов экспрессионной библиотеки) и введение указанных элементов экспрессионной библиотеки в дополнительные раунды этапов от (а) до (c) способа. Лучшие способы для осуществления этого будут меняться в зависимости от используемой экспрессионной библиотеки. Например, для библиотеки фагового дисплея возможно инкубировать комплексы объектов-мишеней, связанных с фагами, с бактериями. Это будет элюировать фаги с объекта-мишени и инфицировать бактерии, так что фаговые частицы могут быть амплифицированы готовыми, например, для применения на этапе (а) заявленного метода.
Специалист может легко определить количество раундов пэннинга, если нужно, которые необходимы или желательны. Например, если экспрессионная библиотека является библиотекой фагового дисплея или даже не фаговой библиотекой, то простой поликлональный метод ELISA (твердофазный ИФА) кандидатов в партнеры связывания с этапа (c) способа против объекта-мишени может дать указание на пропорцию присутствующих положительных кандидатов и желателен ли еще один раунд пэннинга. В этом отношении увеличение связывания элемента библиотеки (например, фага) с объектами-мишенями (например, предоставленными на клетках, вызывающих интерес), но не с объектами, не являющимися мишенями (например, предоставленные клетками, не вызывающими интерес) (используемыми как сравнительные контроли), может быть достаточным, чтобы показать, что достаточное количество раундов пэннинга имело место. Так как каждый раунд пэннинга (то есть повтор этапов от (а) до (c) способа) может приводить к потере желательных элементов экспрессионной библиотеки, то число раундов пэннинга обычно сводят к минимуму. Несомненно, это является дополнительным преимуществом, которое улучшенные способы, описанные в данном документе, имеют перед методом BRASIL и общепринятым методом, основанным только на промывочных этапах, так как в сравнительных тестах было показано, что подходящее обогащение может быть получено после меньшего количества раундов пэннинга. Например, в тестах, описанных в данном документе, улучшенный способ настоящего изобретения показывал надлежащее обогащение после второго раунда пэннинга в отличие от третьего раунда (общепринятый метод) или четвертого раунда (BRASIL).
Таким образом, этапы от (а) до (c) способа могут быть повторены один или несколько раз, например до 4 или 5 раз. Однако в предпочтительных вариантах осуществления изобретения проводят только 1, 2 или 3 раунда пэннинга (то есть 1, 2 или 3 раунда стадий от (а) до (c)) до того, как вероятные партнеры связывания и/или объекты-мишени подвергаются дополнительному анализу.
Сравнительные тесты также показывают, что модифицированный способ, описанный здесь, может приводить к идентификации увеличенного количества партнеров связывания указанных объектов-мишеней, то есть может приводить к идентификации увеличенного числа позитивных клонов. Например, было показано, что после 3 раундов пэннинга 41% вероятных партнеров связывания, отобранных способом изобретения, являются позитивными в отношении объекта-мишени по сравнению с 12% для метода BRASIL и 28% для общепринятого метода.
Таким образом, с альтернативной точки зрения, настоящее изобретение предоставляет улучшенный способ идентификации партнеров связывания объектов-мишеней, включающий проведение одного или нескольких раундов этапов от (а) до (c), определенных в данном описании.
Конечно, может случиться, что если экспрессионная библиотека, которая изначально скринируется, содержит относительно маленькое число элементов или является, например, обогащенной библиотекой, например является библиотекой антител, выделенной у пациентов, которые были экспонированы на антиген, как описано в WO03/095491 выше, то дополнительные раунды пэннинга могут не потребоваться. В свою очередь, специалист может легко удостовериться в этом, например, используя методы, описанные выше.
Как только любые соответствующие дополнительные раунды пэннинга проведены, связавшиеся объекты-мишени собирают из органической фазы этапа (c), и они могут быть подвергнуты дополнительному анализу или применению. Указанный дополнительный анализ или применение обычно требуют, чтобы вероятные партнеры связывания были откреплены, удалены, выделены или элюированы с объектов-мишеней, и предпочтительно, чтобы вероятные партнеры связывания были экспрессированы или получены отдельно от указанных объектов-мишеней. Следовательно, способы настоящего изобретения могут включать необязательный этап (d), где указанные вероятные партнеры связывания открепляют, удаляют, элюируют, или, предпочтительно, выделяют из указанных объектов-мишеней, или экспрессируют, или получают отдельно от указанных объектов-мишеней. Например, в случае, где экспрессионная библиотека является фаговой библиотекой, и объекты-мишени являются молекулами клеточной поверхности, указанный дополнительный анализ или применение обычно включают выделение вероятных партнеров связывания путем инфицирования бактерий и клонирования ДНК, кодирующей вероятные партнеры связывания, в подходящий экспрессионный вектор. Такая стадия инфицирования может также позволить амплификацию вероятных партнеров связывания. Для не фаговых библиотек вероятные партнеры связывания могут быть амплифицированы на этой стадии подходящими методами, например путем ПЦР нуклеиновых кислот, кодирующих указанные вероятные партнеры связывания, или трансформацией указанной нуклеиновой кислоты в подходящую клетку-хозяин (в составе подходящего экспрессионного вектора).
Указанный дополнительный анализ может включать дополнительный анализ любого из двух или обоих вместе элементов экспрессионной библиотеки, которые связаны с объектами-мишенями (то есть вероятными партнерами связывания), или самих объектов-мишеней. Следовательно, способы изобретения позволяют скринировать и идентифицировать как новые элементы экспрессионной библиотеки (новые партнеры связывания), так и новые объекты-мишени, например новые молекулы клеточной поверхности или белки, такие как новые антигены.
Соответствующие методы анализа элементов экспрессионной библиотеки (вероятных партнеров связывания) были бы хорошо известны специалисту. Обычно первый этап дополнительного анализа включал бы анализы или тесты для подтверждения того, что отобранные элементы экспрессионной библиотеки (вероятные партнеры связывания) несомненно связались с объектами-мишенями, представляющими интерес. Любой соответствующий метод анализа может быть использован в этом случае. Однако обычно, как описано выше, поликлональный метод ELISA мог бы использоваться для этих целей. Как обсуждалось выше, этот подтверждающий этап также обеспечивал бы указание на то, что когда отобранные элементы библиотеки были бы достаточно обогащены для молекул, связанных с объектом-мишенью, представляющим интерес, тогда скринирование может быть прекращено и может быть начат более детальный анализ отобранных клонов.
Таким образом, как только закончена стадия подтверждения, за ней обычно следует анализ одиночных клонов. Этот анализ может быть проведен стандартными методами. Например, для фаговых экспрессионных библиотек такой анализ включает клонирование фагов, представляющих полипептиды, в растворимом формате (например, клонирование фагов, представляющих scFv, в формат растворимых scFv или Fab) и использование растворимых полипептидов для проведения ELISA на клетках (Hoogenboom et al, 1999, выше) или очищенных антигенах (с использованием растворимых фрагментов), скрининга на фильтрах (Radosevic et al., выше), FACS (анализ на проточном цитофлуориметре) (Ridgway et al., выше), Guava анализа (разработанный компанией Guava Technologies новый метод анализа клеток, как более дешевый и высоко пропускной аналог FACS) (Gillis and Fishwild, Application note: Monoclonal Antibody Specificity using the Guava CellPaint Assay, Guava Technologies, Inc, 2004) или иммунофлуоресцентного анализа (Wong et al., выше), окрашивания тканевых слайдов или клеток и других методов иммуногистохимии. Все эти методики хорошо обоснованы в литературе, и одна или несколько из них могут быть использованы для анализа клонов. В качестве альтернативы, методы прямого скрининга, такие как те, что описаны в WO03/095491, или анализатор FMAT (8200 Detection system - Applied Biosystems) могут быть использованы для дополнительной характеристики клонов. Наконец, метод, названный методом AffiSelect, может быть использован для дополнительного анализа вероятных партнеров связывания. Детали этого метода обсуждаются в отдельном разделе ниже.
Для не фаговых экспрессионных библиотек, где используются библиотеки дисплеев, ДНК, кодирующая вероятные партнеры связывания (которая будет отобрана вместе с экспрессируемым полипептидом), может быть клонирована в подходящий экспрессионный вектор (если необходимо, после ПЦР, чтобы превратить РНК, содержащие элементы библиотеки, в ДНК), и экспрессированные полипептиды могут быть анализированы, как описано выше. Для растворимой пептидной или полипептидной библиотеки таги, присоединенные к вероятным партнерам связывания, использовались бы для идентификации последовательностей выбранных пептидов, и они могли бы быть или синтезированными in vitro и проанализированными, как описано выше, или РНК последовательностью РНК, кодирующей пептид, которая могла бы быть определена и встроена в подходящий экспрессионный вектор, и экспрессируемый пептид анализирован, как описано выше. Поэтому указанный дополнительный анализ вероятных партнеров связывания предпочтительно включает экспрессию или продуцирование вероятных партнеров связывания, предпочтительно в растворимом формате, и проведение анализа или тестирование связывающей активности вероятных партнеров по отношению к объекту-мишени, представляющему интерес. Может быть использован любой метод анализа связывания. Однако предпочтительными методами анализа является один или несколько методов ELISA, скрининг на фильтрах, FACS, методы иммунофлуоресцентного анализа, иммуногистохимические анализы, методы анализа Guava, методы клеточной детекции 8200 или AffiSelect анализы (см. ниже).
В качестве отрицательного контроля удобно также скринировать вероятные партнеры связывания против объектов, не являющихся мишенями, например не имеющих отношения типов клеток или типов клеток, которые на экспрессируют объект-мишень на поверхности или экспрессируют объект-мишень только на низком уровне, или не имеющих отношения «голых» или очищенных молекул, по обстоятельствам.
Во всех этих методах (за исключением метода AffiSelect, который описан в деталях ниже) детекция связанного вероятного партнера связывания облегчена за счет использования реагентов, которые распознают некоторые типы тагов или меток на элементах экспрессионной библиотеки. Например, если экспрессионная библиотека является фаговой библиотекой, можно осуществить детекцию через использование антитела к белку фаговой оболочки, например анти-Fd антитела. Если использованы другие типы дисплейных библиотек или растворимые библиотеки, тогда также можно осуществить детекцию через использование антитела к тагу, который включен в элементы библиотеки, например антитела к myc тагу. Соответствующие системы присоединения тагов и детекции хорошо известны и описаны в данной области.
На любой стадии разнообразие вероятных партнеров связывания может быть проверено рестрикционным анализом кодирующей ДНК с последующим анализом нуклеотидной последовательности или ПААГ анализом. И в этом случае такие методы хорошо известны и описаны в данной области (Hoogenboom et al., выше, Ridgway et al, выше).
В одном варианте осуществления изобретения, где объект-мишень является неизвестной молекулой, например неизвестной молекулой клеточной поверхности, в частности, неизвестной молекулой поверхности клеток опухоли, ее природу можно легко анализировать и объект-мишень идентифицировать с применением специфичного партнера связывания, идентифицированного в экспрессионной библиотеке. Это особенно удобно, когда партнер связывания является молекулой антитела, например scFv молекулой. Например, как обсуждалось выше, такие партнеры связывания из экспрессионной библиотеки обычно сконструированы так, чтобы содержать таг или метку, которые могут облегчить детекцию и могут быть использованы, например, для анализа тканевого распределения неизвестной молекулы, например, путем связывания с тканевыми срезами (Рereira et al., J. Immunol. Methods, 1997, 203:11-24). В качестве альтернативы, связывающийся партнер может быть иммобилизован на твердой подложке и использован для очистки неизвестной молекулы, например, методом аффинной хроматографии. После того как неизвестная молекула очищена, ее идентичность можно удостоверить соответствующими анализами, зависящими от природы молекулы. Например, если неизвестная молекула представляет собой белок, тогда очищенный белок может быть идентифицирован и кодирующая его ДНК-последовательность может быть определена посредством определения аминокислотной последовательности пептида и клонирования, используя методы, хорошо известные и описанные в данной области. В качестве альтернативы, ДНК, кодирующая неизвестный белок, может быть легко определена путем скринирования кДНК-библиотеки с помощью идентифицированного связывающегося партнера. Для этой цели может быть использована высоко представительная кДНК-библиотека из соответствующего источника. Однако предпочтительным было бы использование меньшей по размеру, ограниченной кДНК-библиотеки. Например, если неизвестный белок был экспрессирован на поверхности определенного типа клеток, тогда кДНК-библиотеку (например, кДНК-библиотеку дисплея, такую как библиотеку фагового дисплея) можно было бы удобно сделать из этих клеток и скринировать связывающимся партнером (см., например, Ridgway et al., выше), например путем пэннинга библиотеки дисплея на твердых подложках, к которым прикреплен идентифицированный связывающийся партнер. В дополнение, если связывающийся партнер, идентифицированный в экспрессионной библиотеке, является антителом, то другие методы анализа, основанные на антителах, такие как иммунопреципитация, Вестерн-блот, профилирование экспрессии генов или иммуногистохимия, могут быть проведены с целью выделить или характеризовать объект-мишень.
Таким образом, видно, что способы изобретения можно использовать не только для отбора и идентификации партнеров связывания объектов-мишеней из соответствующих экспрессионных библиотек, но также и для идентификации новых и неизвестных объектов-мишеней. Это является важным, так как может привести к идентификации новых клеточных мишеней для терапии или диагностики, так же как к новым агентам, обладающим потенциалом для применения в терапии или диагностике, то есть связывающим партнерам.
Следовательно, настоящее изобретение также предоставляет способ выделения и/или идентификации неизвестного объекта-мишени, включающий этапы от (а) до (c) (и, необязательно, дополнительные этапы), определенные здесь, (d) выделение одного или нескольких элементов экспрессионной библиотеки, которые связывают указанный неизвестный объект-мишень и (e) применение указанного элемента библиотеки для выделения и/или идентификации объекта-мишени, с которым он связывается.
Способы изобретения могут быть поэтому использованы для отбора, идентификации или выделения партнеров связывания объекта-мишени или самого нового объекта-мишени, который может быть выделен, получен или изготовлен для различного последующего применения. Как таковые, связывающиеся партнеры/белки или объекты-мишени, идентифицированные или отобранные с использованием способов изобретения, образуют дополнительный аспект изобретения. Таким образом, дополнительный аспект настоящего изобретения предоставляет способ отбора, идентификации и/или выделения элемента библиотеки, который является специфическим партнером связывания объекта-мишени, или способ отбора, идентификации и/или выделения самого объекта-мишени из экспрессионной библиотеки указанным способом, включающим этапы скрининга экспрессионной библиотеки, использующего этапы от (а) до (c) (и, необязательно, дополнительные этапы), определенные выше, для отбора молекул, которые проявляют определенные свойства и, необязательно, (e) идентификации и/или выделения значимого(ых) элемента(ов) библиотеки, которые являются специфическими партнерами связывания объекта-мишени и, необязательно, (f) применения указанных элементов библиотеки для идентификации объекта-мишени, с которым они связываются.
Как только идентифицированы соответствующие фрагменты нуклеиновой кислоты, кодирующие партнеры связывания или объекты-мишени с определенными свойствами, нуклеиновые кислоты, кодирующие полипептиды, можно, если желательно, подвергнуть аффинному созреванию, например, чтобы исследовать и идентифицировать партнеры связывания с дополнительными улучшенными свойствами. Подобное аффинное созревание можно осуществить общепринятыми видами мутагенеза, включая, но не ограничиваясь ими, добавление, делецию и/или замену одного или нескольких нуклеотидов в контролируемой (например, сайт-направленный мутагенез) или случайной манере, с помощью метода ПЦР, подверженного ошибкам, перестановки доменов, кассетного мутагенеза и перетасовки цепей и т.п., перед повтором цикла скринирования. Такое аффинное созревание можно, если желательно, выполнить после проверочных этапов, описанных выше, и перед проведением анализа отдельных клонов.
Когда с использованием методов изобретения отобраны, идентифицированы, выделены и/или очищены один или несколько партнеров связывания объектов-мишеней, эти кандидаты или компонент, их фрагмент, вариант или производное могут быть изготовлены и, если желательно, разработаны в виде состава по меньшей мере с одним фармацевтически приемлемым носителем или вспомогательным веществом. Такие изготовленные молекулы, или их компоненты, фрагменты, варианты или производные также охвачены настоящим изобретением. В качестве альтернативы, эти молекулы могут быть представлены в форме нуклеиновых кислот, кодирующих указанные молекулы белка, нуклеиновых кислот, которые, в свою очередь, могут быть встроены в соответствующий экспрессионный вектор и/или содержаться в подходящей клетке-хозяине. Таким образом, молекулы нуклеиновых кислот, кодирующие указанные партнеры связывания или объекты-мишени, или экспрессионные векторы, содержащие указанные молекулы нуклеиновых кислот, образуют дополнительные аспекты изобретения.
Как только определенный партнер связывания или объект-мишень, или его компонент, фрагмент, вариант или производное отобран, идентифицирован и т.п. в соответствии с настоящим изобретением, можно легко использовать (или адаптировать к использованию) экспрессионный вектор, кодирующий выбранный партнер связывания или объект-мишень, для получения достаточного количества молекул путем экспрессии в соответствующих клетках-хозяевах или системах и выделения связывающихся молекул из клеток-хозяев, или системы, или культуральной среды, или их супернатанта, соответствующим образом. В качестве альтернативы, указанные связывающиеся молекулы или объекты-мишени могут быть получены другими соответствующими методами, например химическим синтезом нуклеиновой кислоты, кодирующей связывающуюся молекулу, и экспрессией в подходящем хозяине или в транскрипционной системе in vitro.
Следовательно, еще один аспект изобретения предоставляет способ изготовления специфичного партнера связывания или объекта-мишени, включающий этапы идентификации или отбора специфичного партнера связывания объекта-мишени или самого объекта-мишени в соответствии со способами изобретения, описанными выше, изготовления указанного идентифицированного партнера связывания или объекта-мишени, или его компонента, фрагмента, варианта или производного и, необязательно, разработки состава указанного изготовленного партнера связывания или объекта-мишени по меньшей мере с одним фармацевтически приемлемым носителем или вспомогательным веществом.
Указанные варианты или производные партнера связывания или объекта-мишени включают пептоидные аналоги, молекулы с непептидным синтетическим каркасом и полипептиды, родственные или производные полипептида, идентифицированного вначале, где аминокислотная последовательность модифицирована посредством одиночной или множественных аминокислотных замен, вставок и/или делеций, которые могут альтернативно или дополнительно включать замену или вставку аминокислот, которые были химически модифицированы, например, дегликозилированием или гликозилированием. Удобно, чтобы такие производные или варианты могли иметь по меньшей мере 60, 70, 80, 90, 95 или 99% идентичности последовательности исходного полипептида, производными которого они являются.
Там, где связывающим партнером является молекула антитела, указанные варианты или производные дополнительно включают конверсию молекулы антитела из одного формата в другой (например, переход из Fab в scFv или наоборот, или конверсию между любыми форматами молекул антител, описанных где-либо еще здесь), или конверсию молекулы антитела в определенный класс (например, конверсию молекулы антитела в IgG класс или его подкласс, например IgG1 или IgG3, которые являются особенно подходящими для антител, применяющихся в терапии).
Указанные варианты или производные дополнительно включают объединение молекул партнеров связывания или объектов-мишеней с дополнительными функциональными компонентами, которые могут, например, быть использованы в последующих приложениях указанных партнеров связывания или объектов-мишеней. Например, партнеры связывания или объекты-мишени могут быть ассоциированы с компонентами, которые направят их в определенные участки тела или детектируемые части, применимые, например, в визуализации или других диагностических приложениях.
Ясно, что основным требованием к таким компонентам, фрагментам, вариантам или производным молекул партнеров связывания или объектов-мишеней является то, чтобы они сохранили их исходную функциональную активность в отношении связывающей способности или имели улучшенную функциональную активность.
Молекулы партнеров связывания (предпочтительно молекулы антител) или объектов-мишеней, выделенные, обнаруженные, отобранные, идентифицированные или изготовленные с применением способов настоящего изобретения, могут быть использованы в любых методах, где требуются связывающие партнеры, специфичные к объекту-мишени (например, антитела, специфичные к конкретному антигену). Следовательно, связывающие партнеры (предпочтительно молекулы антител) или объекты-мишени могут быть использованы как молекулярные средства, и дополнительный аспект изобретения предоставляет реагент, который содержит такие молекулы связывающих партнеров или молекулы объектов-мишеней, определенных здесь. В дополнение, такие молекулы могут быть использованы для терапевтических или профилактических приложений in vitro, диагностических приложений in vivo и in vitro или методов анализа in vitro.
Связывающие партнеры могут быть использованы в терапевтических приложениях, или в выделенном из экспрессионной библиотеки виде, или в сконструированном или конвертированном виде, например, может быть желательно конвертировать scFv молекулу в IgG или мультимеризованные пептиды. Терапевтический эффект может быть достигнут индуцированием биологической активности по отношению к биологической молекуле, показывающей агонистическое или антагонистическое связывание с объектом-мишенью/лигандом, например, индуцированием апоптоза (например, в раковых или инфицированных вирусом клетках), ингибированием роста или стимуляцией открепления от матрикса, посредством блокирования связывания с природным лигандом (таким образом, ингибируя рост и/или распространение опухолей). Такие терапевтические эффекты могли бы быть достигнуты благодаря свойствам объекта-мишени/лиганда самого по себе или его мультимера (некоторые рецепторы активируются путем их перекрестной сшивки).
Там, где связывающие партнеры, отобранные или идентифицированные и т.п., являются полипептидами антител, они могут быть использованы для in vitro терапевтических и профилактических приложений, например, для придания пассивного иммунитета особенно подверженным риску пациентам (например, пациентам с ослабленным иммунитетом, маленьким детям, младенцу в утробе матери, людям в эпидемической зоне болезни и т.п.). Например, если антитела способны нейтрализовать инфекционные или болезнетворные агенты, то они могут быть назначены соответствующему субъекту для борьбы с заболеванием. В качестве альтернативы, антитела (или другие виды связывающих партнеров) могут быть прикреплены к другим молекулам с терапевтическим эффектом, например цитотоксичным агентам (малой молекуле или белку), про-токсину или другим лекарственным веществам, и нацелены на болезненную ткань или специфичный тип клеток, например опухолевые клетки или клетки, инфицированные вирусом. Дополнительные терапевтические эффекты могли бы быть достигнуты посредством других функций, внесенных в агент и примененных, таких как способность активировать макрофаги, систему комплемента или цитотоксичные Т-клетки, присвоенных, например, после смены scFv на Ig, формирования молекул с двойной специфичностью, например, связывающих опухолевые клетки и клетки-киллеры.
В качестве альтернативы, такие антитела (или даже другие типы полипептидов, которые взаимодействуют с объектами-мишенями, ассоциированными с определенной тканью или участком тела, или типом клеток, например опухолевые клетки или клетки, инфицированные вирусом) могут быть конъюгированы с метками, например красителями, флуоресцентными или радиоактивными метками, или метками для распознавания с помощью ферментов, и использованы для диагностики in vitro или in vivo, например, с помощью методов визуализации или стандартных иммуногистохимических процедур. Другие предпочтительные способы применения включают тераностическое применение (то есть антитела или связывающие партнеры, используемые и в диагностике, и в терапии). В дополнение, такие молекулы антител или других связывающих партнеров могут быть использованы в методах аффинной хроматографии для выделения объектов-мишеней.
В частности, антитела к белкам, экспрессируемым на клеточной поверхности, предоставляют хорошо описанную начальную точку для успешной разработки новых диагностических и терапевтических лекарственных средств, особенно в случае области исследований раковых заболеваний, где знание специфических маркеров клеточной поверхности, так же как и связывающих их антител, является очевидным узким местом в разработке лекарств, и способы изобретения могут быть использованы для идентификации или отбора как новых маркеров клеточной поверхности (объекты-мишени), так и антител (связывающие партнеры). На сегодняшний момент известно только очень ограниченное число экспрессируемых на клеточной поверхности, ассоциированных с опухолями или специфичных для опухолей эпитопов. Следовательно, каждый новый эпитоп такого типа и, конечно, связывающие его специфические антитела открывали бы новые возможности в лечении рака. Возможные приложения простираются от продукции в виде «голого» полноразмерного IgG для терапии, основанной на ADCC (антитело зависимой клеточной цитотоксичности), через рекомбинантные олигоспецифичные/олиговалентные конструкции, до слитых белков-иммунотоксинов и радиоактивно меченных фрагментов антител для тканеспецифичной и направленной терапии, так же как и антител, связанных с красителем или радиоактивной меткой для диагностики in vitro или in vivo.
Объекты-мишени или их фрагменты могут быть использованы как вакцины, в частности вакцины для применения при лечении раков и инфекционных заболеваний (в зависимости, конечно, от интересующего объекта-мишени). Объект-мишень может быть использован в качестве мишени для агонистов и антагонистов в виде пептидов, белков или низкомолекулярных лекарственных средств, которые могут, например, блокировать или индуцировать функции, такие как апоптоз или регуляция роста клеток. Объекты-мишени также могут быть использованы в качестве мишеней для дальнейшего скрининга, чтобы идентифицировать еще больше молекул, способных к функциям, описанным выше. В некоторых случаях объекты-мишени или их фрагменты могли бы также иметь эффект сами по себе, аналогично конкурентному связыванию молекул, которые в природе связываются с ними.
Подходящие и соответствующие адаптации молекул антител, если необходимо для таких применений, например, конверсия в IgG1 или IgG3 классы для терапии, включение или добавление соответствующей метки для визуализации и т.п. были бы хорошо известны специалисту.
Наиболее подходящие антитела для различного применения, описанные выше, могут быть легко идентифицированы с использованием соответствующих тестов, которые могут быть разработаны специалистом. Например, в приложениях, где важна высокая аффинность или авидность антитела или связывающего партнера, этот критерий может быть легко протестирован на антителах-кандидатах с использованием стандартных методов анализа (метод Biacore). В дополнение, если идентифицированы антитела против определенных инфекционных агентов, например, бактерий, вирусов и т.п., можно провести соответствующие тесты для оценки антител, являющихся наиболее эффективными для нейтрализации инфекционного агента. Например, в случае бактерий можно оценивать бактерицидную и опсонофагоцитарную активность против рассматриваемых бактерий. Подобным образом, в случае вирусов, можно провести исследования нейтрализации вирусов для идентификации лучших кандидатов.
Таким образом, еще один дополнительный аспект изобретения предоставляет применение экспрессионной библиотеки антител, описанное здесь, для выделения, обнаружения, идентификации, отбора или изготовления одной или нескольких молекул антитела, которые специфически связываются с одним или несколькими объектами-мишенями, например одним или несколькими антигенами-мишенями, которые ассоциированы с определенными болезнями, клетками, тканями или чужеродными агентами. Этот аспект мог бы, например, быть осуществлен путем скринирования экспрессионных библиотек антител с антигенами-мишенями.
Еще дополнительные аспекты изобретения предоставляют такие выделенные, обнаруженные, отобранные или изготовленные молекулы антител (или других связывающих партнеров), или объектов-мишеней для применения в терапии или диагностике in vivo, или для применения в любых приложениях, упоминаемых выше. Также защищено патентом применение таких молекул антител (или других связывающих партнеров) или объектов-мишеней для изготовления лекарственного средства или состава для применения в терапии (в частности, при терапии рака или инфекционных заболеваний), или диагностике in vivo, или для применения в любых приложениях, упоминаемых выше. Также предоставлены способы лечения пациента, предусматривающие назначение соответствующей дозы такой молекулы антитела (или другого связывающего партнера), или объекта-мишени.
Когда указанные молекулы антител (или других связывающих партнеров) или объектов-мишеней используются в вышеописанных применениях и способах, они могут быть введены любым соответствующим путем. Например, такие молекулы антител (или других связывающих партнеров) или объектов-мишеней могут быть назначены местно на участке, где требуется воздействие, или могут быть присоединены или иным способом связаны с объектами, которые будут способствовать нацеливанию молекул антител (или других связывающих партнеров) или объектов-мишеней на соответствующее место в теле.
Фармацевтические составы, содержащие молекулы антител (или других связывающих партнеров), или объекты-мишени, определенные здесь, вместе с одним или несколькими фармацевтически приемлемыми носителями или вспомогательными веществами образуют еще один дополнительный аспект изобретения.
Еще дополнительными аспектами изобретения являются способы диагностики или визуализации (состояния) пациента, предусматривающие назначение соответствующего количества молекулы антитела (или другого связывающего партнера) или объекта-мишени, определенных здесь, пациенту и детекцию присутствия, местоположения и/или количества молекулы антитела у пациента.
Молекулы антител (или других связывающих партнеров) или объекты мишени, идентифицированные, отобранные и т.п. из экспрессионных библиотек изобретения, могут равноценно использоваться в способах диагностики, которые проводятся in vitro, в соответствующем случае, например проводимых на образце ткани или каком-нибудь другом виде образца, например крови, полученной у пациента, или клетках, производных крови пациента.
Предпочтительными заболеваниями для лечения или диагностики и т.п. являются рак, инфекционные болезни, вызванные инфекционными агентами, воспалительные заболевания, аутоиммунные заболевания или дегенеративные заболевания.
Термины “терапия” или “лечение”, используемые здесь, включают профилактическую терапию. Термин “терапия” и “лечение” включают борьбу или излечение болезни или инфекций, а также включают контроль или облегчение болезни или инфекции или ассоциированных с ними симптомов.
Метод AffiSelect
Метод AffiSelect предоставляет новую методику для косвенной идентификации элемента библиотеки (вероятного партнера связывания) посредством детектирования его лиганда (или по меньшей мере посредством детектирования объекта, с которым лиганд ассоциирован), в отличие от детектирования элемента библиотеки (вероятного партнера связывания). Это имеет особую ценность при скрининге малых библиотек против комплексных лигандов, таких как живые клетки, хотя применимость метода не ограничена только этими приложениями.
Следовательно, в наиболее широком смысле метод AffiSelect предоставляет метод скрининга библиотеки молекул (в этом случае, вероятных партнеров связывания, которые будут подвергнуты дополнительному анализу) для идентификации и/или отбора одного или нескольких ее элементов, которые являются вероятными партнерами связывания одного или нескольких лигандов (объектов-мишеней), предусматривающий:
а) контактирование в растворе экспрессионной библиотеки вероятных партнеров связывания с одним или несколькими лигандами;
b) захват лигандов, которые связались с одним или несколькими элементами экспрессионной библиотеки на твердой фазе; и
c) обнаружение лиганда и, таким образом, обнаружение одного или нескольких элементов экспрессионной библиотеки, которые являются вероятными партнерами связывания лиганда.
Таким образом, при использовании в сочетании со способами скрининга настоящего изобретения с целью дополнительного анализа вероятных партнеров связывания, которые были идентифицированы, метод AffiSelect предусматривает этапы:
i) контактирования в растворе одного или нескольких указанных вероятных партнеров связывания с одним или несколькими объектами-мишенями;
ii) захвата объектов-мишеней, которые связались с одним или несколькими вероятными партнерами связывания на твердой фазе; и
iii) обнаружения объекта-мишени и, таким образом, обнаружения одного или нескольких вероятных партнеров связывания объекта-мишени.
Таким образом, применяя используемую в описании способов скрининга настоящего изобретения терминологию для обсуждении метода AffiSelect ниже, любая ссылка на экспрессионную библиотеку может считаться ссылкой на один или несколько вероятных партнеров связывания, которые будут подвергнуты дополнительному анализу, и любая ссылка на лиганды может считаться ссылкой на объекты-мишени.
Одним из главных требований для экспрессионных библиотек (в этом случае вероятных партнеров связывания, которые будут подвергнуты дополнительному анализу), которые будут использованы в методе AffiSelect, является то, что они должны быть в растворе, когда их вначале вводят в контакт с лигандами (объектами-мишенями), против которых их скринируют. Под термином “в растворе” подразумевается, что экспрессионные библиотеки не прикреплены к твердой фазе, когда их вначале вводят в контакт с лигандами, против которых их скринируют, то есть начальные экспрессионные библиотеки являются неиммобилизованными экспрессионными библиотеками.
Конструкции экспрессионной библиотеки (вероятного партнера связывания) для применения в методе AffiSelect (и, вследствие этого, также конструкции вероятных партнеров связывания, составляющие экспрессионную библиотеку, скринируемую на этапе (а) способов настоящего изобретения) могут, необязательно, дополнительно содержать другие соответствующие компоненты, например точки начала репликации, индуцибельные или неиндуцибельные промоторы для инициации транскрипции, энхансеры, гены устойчивости к антибиотикам и маркеры, универсальные таги или репортерные молекулы, сайты связывания праймеров для возможности амплификации конструкции, например, с помощью ПЦР, или другие желательные элементы последовательности. Соответствующие источники и расположение таких дополнительных компонентов в конструкциях библиотеки, такие что они выполняют свои функции, хорошо бы находились в пределах обычной практики специалиста в данной области.
Включение универсальных тагов или маркеров в конструкции библиотеки и в элементы экспрессионной библиотеки (вероятные партнеры связывания) является особенно важным в экспрессионных библиотеках для использования в методе AffiSelect, и такие таги применяются для облегчения связывания элементов библиотеки (вероятных партнеров связывания) с твердой фазой на этапе захвата, то есть применяются для облегчения этапа захвата. Любой соответствующий таг может быть использован для этих целей при условии, что он может облегчить связывание элементов библиотеки (вероятных партнеров связывания) с твердой фазой. Однако удобно, когда подобные таги являются аффинными молекулами, которые могут облегчить связывание с твердой фазой посредством связывания с аффинной молекулой-партнером, прямым или косвенным способом иммобилизованной на твердую фазу. Примерными тагами могут быть таги c-myc (которые могут, например, быть захвачены через анти-c-myc антитело), или His таги (которые могут, например, быть захваченными на поверхности, содержащей ионы никеля), или биотин (который может, например, быть захвачен через молекулы стрептавидина), или белок поверхности фага, такой как gp8 (который может, например, быть захвачен через анти-gp8 антитело), или антигенные пептидные таги, такие как FLAG или НА, которые распознаются антителами. Такие таги или маркеры также могут быть удобно обнаружены прямыми или косвенными методами. Такие таги или маркеры являются обычно универсальными тагами или маркерами, которые присутствуют во всех конструкциях библиотеки, и могут быть использованы для захвата элементов библиотеки на твердую фазу. Такие таги или маркеры не требуются для этапа детекции в методе AffiSelect (так как детекция осуществляется через детекцию лиганда, а не элемента библиотеки, более подробно см. ниже). Однако, если желательно, такие таги могут быть использованы для обнаружения элементов библиотеки. Их присутствие может оказаться очень полезным в определении аффинности лиганда к элементу библиотеки.
Как только соответствующие конструкции экспрессионной библиотеки (вероятный партнер связывания) получены на уровне нуклеиновой кислоты, они тогда могут быть экспрессированы для скрининга и для применения на этапе (i) метода в соответствующих экспрессионных системах. Соответствующие условия и методы экспрессии хорошо известны и описаны в данной области.
Объекты-мишени для применения в методе AffiSelect могут принимать любую из форм, описанных выше для способов скрининга настоящего изобретения. Поэтому, например, объекты-мишени могут быть молекулами клеточной поверхности, представленными, например, как компоненты целых клеток или как мембранные фракции клеток, или могут быть выделенным представляющим интерес объектом-мишенью, прикрепленным к твердой фазе. Предпочтительно, чтобы указанные объекты-мишени являлись молекулами клеточной поверхности. Удобно, поскольку метод AffiSelect используется для дополнительного анализа начальных вероятных партнеров связывания, найденных посредством способов скрининга разделением в органической фазе, описанных здесь, то объекты-мишени могут быть теми же, что использовались на этапе (а) этих способов.
Является ли лиганд (объект-мишень) молекулой клеточной поверхности или представляющей интерес молекулой, прикрепленной к соответствующей твердой фазе, для использования в методе AffiSelect лиганды содержат или ассоциированы с репортерной частью для возможности детекции лигандов. Такие репортерные части являются предпочтительно молекулами нуклеиновой кислоты, более предпочтительно, молекулами ДНК, которые затем могут быть обнаружены методами на основе нуклеиновых кислот. Предпочтительным методом детекции является ПЦР, но можно использовать любой соответствующий метод, например гибридизацию с меченой пробой. В качестве альтернативы, лиганд может быть прикреплен к немагнитным флуоресцентным шарикам или другой популяции шариков с различимым размером, которые могут быть подсчитаны/обнаружены с помощью микроскопии или с помощью прибора Coulter Counter ZM (Coulter Electronics Ltd.). Таким образом, очевидно, что такие репортерные части могут принимать целый ряд различных форм, обеспечивая возможность детекции указанных репортерных частей.
Такие репортерные части могут быть по природе ассоциированы с лигандами (объектами-мишенями). Например, если лиганд (объект-мишень) является молекулой клеточной поверхности, то предпочтительной репортерной частью для детекции являлась бы молекула ДНК, например ген (то есть репортерный ген), присутствующий в клетках, на которых экспрессируется/представлен лиганд. Соответствующие и предпочтительные репортерные части являются, вследствие этого, частями, присутствующими во всех типах клеток, например гены «домашнего хозяйства», такие как β-актин.
В качестве альтернативы, экзогенная репортерная часть может быть ассоциирована с лигандом (объектом-мишенью). Например, в случае клеток экзогенная репортерная часть (репортерный ген) может быть встроена в клетки стандартными методами, например трансфекцией, включая, но не ограничиваясь ими, липофекцию, ретровирусные системы или электропорацию.
Если лиганд (объект-мишень) является «голой» молекулой, например «голым» полипептидом, то к нему может быть прикреплен таг, или он может быть ассоциирован с соответствующей репортерной частью с использованием хорошо известных и описанных в данной области методов, например, если лиганд ассоциирован с кодирующей его нуклеиновой кислотой, или другим тагом на основе нуклеиновой кислоты, например, как описанные выше, репортерная часть может быть удобно предоставлена в молекуле нуклеиновой кислоты. Если лиганд является молекулой, например полипептидом, прикрепленным к твердой фазе в виде частиц, то указанная репортерная часть могла бы быть прикреплена к твердой фазе отдельно от полипептида, например, с помощью методов, аналогичных описанным выше. В частности, если используются шарики с пришитым стрептавидином, то репортерной частью предпочтительно является биотинилированный фрагмент ДНК, содержащий участок или регион, который может облегчить детекцию репортерной части, например участок отжига праймеров для возможности ПЦР амплификации фрагмента репортерного гена или участка связывания пробы. Тогда каждый шарик может нести смесь биотинилированной репортерной части и биотинилированный полипептид (или другой лиганд).
Вследствие этого видно, что такая «ассоциация» между репортерной частью и лигандом (объектом-мишенью) может предусматривать прямое взаимодействие между репортерной частью и лигандом, то есть репортерная часть и лиганд являются частью одной молекулы, например лигандный белок и репортерная часть конъюгированы друг с другом в виде части одного молекулярного объекта. В качестве альтернативы, такая «ассоциация» может быть косвенной, например репортерная часть присоединена или содержится в части, к которой прикреплен лиганд, например содержится внутри клетки, на которой лиганд экспрессирован или представлен, или иммобилизована на твердой фазе, к которой прикреплен лиганд.
Такие репортерные части предпочтительно являются универсальными репортерными частями, ассоциированными со всеми представляемыми лигандами (объектами-мишенями) и могут поэтому быть использованы в качестве универсального реагента для обнаружения любого и всех лигандов-мишеней (и, таким образом, присутствия вероятного партнера связывания).
В методе AffiSelect этап введения лигандов (объектов-мишеней) в контакт с экспрессионной библиотекой (вероятными партнерами связывания), или наоборот, может быть проведен любым соответствующим образом при таких условиях, чтобы соответствующие вероятные партнеры связывания могли взаимодействовать с или связывать присутствующие лиганды (объекты-мишени). Такие условия будут обычно варьировать в зависимости от природы экспрессионной библиотеки (вероятных партнеров связывания), лиганда (объекта-мишени) и части, с которой ассоциирован лиганд (объект-мишень). Однако соответствующие условия для облегчения связывания могут быть легко определены специалистом. Такой этап “контактирования” будет обычно происходить в соответствующем растворе или водной среде. Следовательно, если лиганд присутствует на клетке, которая культивируется в виде монослоя, или клетках, которые получены у млекопитающего субъекта, например, из органа или ткани млекопитающего, то их обычно собирают и ресуспендируют в водной среде при помощи соответствующих методик перед тем, как ввести в контакт с экспрессионной библиотекой.
Найдено важным то, что в методе AffiSelect этап контакта можно провести в среде для бактериальной экспрессии, например среде L Broth, так же как и в стандартной водной среде, такой как РВS. Это является важным и удивительным, поскольку это означает, что элементы библиотеки (вероятные партнеры связывания) могут быть экспрессированы в бактериях (например, путем культивирования их в среде для бактериальной экспрессии, такой как L Broth), и клоны можно взять напрямую из экспрессионной плашки для использования в методах скрининга AffiSelect. Предпочтительно, чтобы такая среда для бактериальной экспрессии была приготовлена изотонической (то есть приблизительно 140 мM NaCl (в LB обычно содержится приблизительно 171 мM NaCl)) перед тем как добавить лиганды (объекты-мишени), но после индукции экспрессии элементов библиотеки. Этот этап приготовления бактериальной среды изотонической является особенно предпочтительным, когда лиганды (объекты-мишени) являются молекулами клеточной поверхности на живых клетках, а не на шариках.
Примерные условия «контактирования» могут включать инкубацию на льду или при 4°С в течение времени от 30 минут до 4 часов. Однако их можно варьировать соответствующим образом в зависимости от природы лигандов, экспрессионных библиотек и т.п. Смесь экспрессионной библиотеки и лиганда может, необязательно, быть подвергнута мягкому качанию, перемешиванию или вращению. В дополнение, можно добавить другие соответствующие реагенты, такие как блокирующие агенты для уменьшения неспецифического связывания. Например, можно использовать 1-4% раствор БСА (бычьего сывороточного альбумина) или другого подходящего блокирующего агента (например, молока). Однако следует понимать, что условия контакта могут быть изменены и адаптированы специалистом в зависимости от целей метода скрининга. Например, если температура инкубации увеличена, например, до комнатной температуры, это может увеличить возможность идентификации веществ, связывающих различные субпопуляции лигандов, например веществ, связывающих белки клеточной поверхности, которые легко интернализуются. И в этом случае, такие адаптации условий находятся в компетенции специалиста.
Удобным является то, что число копий лигандов (объектов-мишеней) может быть изменено путем изменения числа присутствующих частей, с которыми ассоциирован лиганд. Например, когда лиганд является молекулой клеточной поверхности или молекулой, прикрепленной к твердой подложке, тогда число лигандов-мишеней может быть доведено до нужного путем увеличения или уменьшения числа клеток или твердых подложек, присутствующих в контактирующей смеси. Число лигандов можно легко определить методом проб и ошибок, но, например, когда лиганд является молекулой клеточной поверхности, удобно использовать от 5000 до 200000 клеток. Несомненно, что преимуществом метода AffiSelect является то, что он достаточно чувствителен для работы с таким низким числом клеток, как 5000 или 1000 (или даже более низким, например использование ПЦР в качестве метода детекции должно потенциально позволять детекцию одной клетки). В этом смысле, особенно при скрининге живых клеток, являющихся производными от млекопитающих субъектов, например пациентов-людей, такие клетки являются редкими и могут быть недоступны в больших количествах. Следовательно, важным преимуществом является возможность проводить скрининг на таком малом числе клеток. Было показано, что там, где детекция проводится при помощи ПЦР, и вероятные партнеры связывания являются антителами, для осуществления детекции требуется только 40 пг антитела. Это означает, что метод AffiSelect должен подходить для анализа вероятных партнеров связывания молекул лигандов, которые экспрессируются на очень низком уровне, например, когда экспрессируется менее чем 1000 молекул.
Один или несколько типов вероятных партнеров связывания (то есть единственный или множественные вероятные партнеры связывания) могут присутствовать в одном реакционном сосуде или отделении для анализа (например, ячейке) на этапе контакта (i) метода AffiSelect (и, следовательно, на последующих этапах метода). Предпочтительно однако, чтобы на этапе контакта (i) в реакционном сосуде или отделении для анализа присутствовал только один тип вероятных партнеров связывания.
Как только лиганды (объекты-мишени) вступят в контакт с экспрессионной библиотекой (вероятными партнерами связывания) при таких условиях, что лиганды могут связываться с одним или несколькими элементами экспрессионной библиотеки, лиганды, которые связались таким образом, затем захватываются на твердой фазе для облегчения их выделения, или удаления, или очистки от компонентов реакционной смеси, таких как несвязавшиеся лиганды. Другими словами, в течение этапа захвата только лиганды (объекты-мишени), которые связаны с элементом экспрессионной библиотеки (вероятным партнером связывания), захватываются на твердой фазе.
В этом случае предпочтительными твердыми фазами являются твердые фазы в виде частиц, которые облегчают манипулирование и промывки. Магнитные твердые фазы и, в частности, магнитные частицы/шарики являются особенно предпочтительными. Для того чтобы отличать эти твердые фазы от твердых фаз, к которым лиганды (объекты-мишени) могут быть прикреплены (как описано выше), такие твердые фазы можно именовать как «твердые фазы для захвата». Подходящие магнитные шарики коммерчески доступны от компании Dyno Specialty Polymers AS of Lillestrom, Norway и компании Dynal Biotech ASA. Конкретными примерами магнитных шариков, которые могут быть использованы в способах, описанных здесь, являются марки шариков M-450, M-270 или M-280 от компании Dynal Biotech ASA, Norway.
Комплексы лиганда (объекта-мишени) и элемента библиотеки (вероятного партнера связывания) могут быть захвачены на твердую фазу любым соответствующим методом. Предпочтительный способ, в соответствии с методом AffiSelect, включает взаимодействие захватывающей молекулы на твердой фазе с молекулой-партнером или тагом, ассоциированными с элементами экспрессионной библиотеки (вероятными партнерами связывания), то есть молекула или таг на вероятном партнере связывания способствует этапу захвата. Таким образом, только лиганды, которые связаны с элементами экспрессионной библиотеки, захватываются на твердой фазе. Все лиганды, не связывающиеся с элементами экспрессионной библиотеки, можно, если желательно, удалить посредством одного или нескольких этапов промывок твердой фазы или просто путем отделения твердой фазы от реакционной смеси после того, как захват произошел. Следовательно, очевидно, что, поскольку этапу захвата способствуют элементы экспрессионной библиотеки, а не лиганды, выделение твердой фазы из остальной смеси позволит удалить лиганды, которые не связались с элементами библиотеки.
Удобно, чтобы взаимодействие между молекулой захвата на твердой фазе и молекулой-партнером или тагом на элементе экспрессионной библиотеки было основано на аффинном взаимодействии, хотя можно использовать любую другую подходящую реакцию. Например, элементы экспрессионной библиотеки могут быть сконструированы для экспрессии одного компонента аффинного взаимодействия, а другой компонент может быть прикреплен к твердой фазе любыми соответствующими средствами. Предпочтительными примерами таких аффинных взаимодействий являются взаимодействия антитело-антиген, взаимодействия стрептавидин-биотин.
Шарики, покрытые стрептавидином, коммерчески доступны, и их можно использовать для захвата конъюгатов лиганда и элемента библиотеки через присутствие молекулы биотина в части конъюгата элемента библиотеки. В качестве альтернативы, если экспрессионная библиотека является фаговой библиотекой, то захват может быть легко достигнут применением твердой фазы, к которой прикреплено антитело к белку фаговой поверхности, например анти-gp8 антитело. В качестве альтернативы, элементы библиотеки могут быть сконструированы для экспрессии тага, который распознается аффинным партнером, что способствует связыванию с твердой фазой. Примерами соответствующих тагов являются c-myc (или другие антигенные пептидные таги) или His таги, которые распознаются анти-c-myc антителами (или другими соответствующими антителами) и ионами металлов (например, Ni2+), соответственно, которые, в свою очередь, способствуют захвату на твердую фазу. Там, где для облегчения захвата применяются антитела, они могут быть прикреплены к твердой фазе или прямым, или косвенным образом, например, через подходящее вторичное или третичное антитело, такое как анти-IgG антитело. Захват может быть осуществлен в любой соответствующей манере, в зависимости от используемых реагентов. Следовательно, антитела могут быть прикреплены к твердой фазе, которую затем вводят в контакт со смесью, содержащей комплексы лиганда (объекта-мишени) и элемента библиотеки (вероятного партнера связывания). В качестве альтернативы, можно позволить антителам связывать элементы библиотеки в реакционной смеси перед тем, как антитела будут связаны с твердой фазой (например, через вторичное антитело), чтобы способствовать захвату лиганда-элемента библиотеки. Несомненно, это является предпочтительным вариантом осуществления методов AffiSelect. Соответствующие условия захвата в смысле температуры и времени могут быть легко определены специалистом. Однако примерные условия могут включать инкубацию от 10 минут до 2 часов при комнатной температуре или 4°С (в зависимости от стабильности лиганда или элемента библиотеки), предпочтительно при мягком качании, перемешивании или вращении. Количество твердой фазы для включения или процентное соотношение твердой фазы и лиганда для того, чтобы способствовать захвату комплексов лиганд-элемент библиотеки, может быть легко определено специалистом.
Один или несколько этапов промывки могут быть проведены на любой соответствующей стадии в методе AffiSelect. Например, описанный выше промывочный этап (или по меньшей мере этап разделения) проводится после этапа (ii) для того, чтобы удалить лиганды (объекты-мишени), которые не связались с элементами экспрессионной библиотеки (вероятными партнерами связывания). Один или несколько этапов промывки частей, с которыми ассоциированы лиганды (например, промывка клеток или твердых фаз, с которыми ассоциированы лиганды), можно провести после этапа (i), для того чтобы удалить элементы экспрессионной библиотеки, которые не связались с лигандом. Несомненно, такие промывочные этапы являются предпочтительными. Также, один или несколько промывочных этапов могут быть проведены для частей, с которыми ассоциированы лиганды, или для твердых фаз в другое соответствующее время в процессе осуществления метода, например, для удаления несвязанных объектов. Специалист легко может определить, сколько промывочных этапов необходимо включить.
Этап обнаружения лиганда (объекта-мишени) проводится посредством прямой детекции лиганда или по меньшей мере посредством детекции объекта (не элемента библиотеки), с которым ассоциирован лиганд. Этот этап показывает разницу с ранее существующими методами, где детекция обычно происходит путем детекции элемента библиотеки, который связан с лигандом, а не детекцией лиганда.
Обнаружение лиганда/объекта-мишени (и, вследствие этого, присутствия комплекса лиганда-элемента библиотеки, так как лиганды, не образовавшие комплексы, должны быть удалены на этапе захвата, поскольку они не будут связаны с твердой фазой) удобно осуществить посредством детекции присутствия репортерной части на лиганде или ассоциированной с лигандом. Соответствующие репортерные части обсуждены выше. Как описано выше, указанные репортерные части обычно присутствуют на или ассоциированы со всеми лигандами, то есть являются универсальными метками для всех лигандов. Следовательно, так как одинаковая репортерная часть присутствует на (или ассоциирована с) каждом лиганде, наличие положительного сигнала указывает на присутствие конъюгата лиганда-элемента библиотеки и, следовательно, элемента библиотеки, который является вероятным партнером связывания лиганда. Следует отметить, однако, что если репортерная часть присутствует внутри клетки, то есть в вариантах осуществления изобретения, где лиганд является молекулой клеточной поверхности, то она должна быть экспонирована, например, путем лизиса клеток или другими путями разрушения клеток, перед тем как можно проводить детекцию. Таким образом, в этих вариантах осуществления изобретения, где методы AffiSelect используются для дополнительного анализа вероятных партнеров связывания, наличие положительного сигнала обеспечивает дополнительное указание на присутствие вероятного партнера связывания, который потенциально связывает значимый объект-мишень. Если более одного вероятного партнера связывания присутствует в реакции детекции, можно провести дополнительный анализ для определения, который из вероятных партнеров связывания связывает объект-мишень. Однако предпочтительно, как обсуждалось выше, чтобы только один тип вероятного партнера связывания присутствовал в реакции детекции, и поэтому наличие положительного сигнала будет указывать на присутствие вероятного партнера связывания, который потенциально связывает значимый объект-мишень.
Подходящие методы лизиса/разрушения клеток для экспонирования репортерных частей, которые, например, присутствуют в нуклеиновых кислотах, содержащихся внутри клеток, хорошо известны и описаны в данной области. Предпочтительный лизисный буфер для использования в методе AffiSelect, касающемся эукариотических клеток, содержит протеиназу К, которая расщепляет белок и может удалить гистоны из ДНК перед этапом обнаружения. Другие протеазы могут также быть включены в лизисные буферы для использования в методе AffiSelect.
Как описано выше, ПЦР является предпочтительным методом детекции в методе AffiSelect. Однако могут быть использованы другие соответствующие методы детекции репортерной части, например гибридизация с пробой, флуоресцентные шарики, шарики других размеров и т.п. (см. выше). Метод ПЦР является предпочтительным благодаря высокой чувствительности метода (даже один лиганд (или клетка) могут быть обнаружены при использовании ПЦР), а также благодаря тому, что он позволяет получить информацию о лиганде, например информацию о последовательности (если, например, лиганд ассоциирован с нуклеиновой кислотой, кодирующей его), или идентифицировать лиганд, если, например, лиганды тагированы ДНК-молекулами для возможности идентификации лиганда, например тагированы молекулами ДНК разных размеров, или тагированы молекулами ДНК со специфичными последовательностями-тагами, которые могут быть использованы для специфичной идентификации лиганда.
Удобно то, что ПЦР может быть проведена в растворе (хотя она может быть проведена на твердой фазе), и присутствие или отсутствие продукта ПЦР определяется стандартными методами, такими как анализ в агарозном геле (например, система E-gel 96, Invitrogen, обеспечивает возможность анализа 96 образцов в течение 20-30 минут). Обычно образцы хорошо перемешивают перед проведением ПЦР (или другого этапа обнаружения).
Соответствующие ПЦР праймеры для амплификации всей или порции репортерной части выбирают в соответствии с последовательностью репортерной части методами, хорошо известными и описанными в данной области. Если содержание нуклеиновой кислоты в лунках для анализа является соответствующим, например, если лиганд кодирован нуклеиновой кислотой, которая была трансфицирована в клетки с использованием соответствующего экспрессионного вектора (который содержит соответствующую репортерную часть), или лиганд ассоциирован с ДНК, кодирующей его, тогда можно выбрать ПЦР праймеры для амплификации нуклеиновой кислоты, кодирующей последовательность лиганда, так же как и репортерной части. Это может быть преимуществом в том, что продукты ПЦР могут быть напрямую клонированы в соответствующий вектор для определения нуклеотидной последовательности, таким образом, приводя к идентификации последовательности лиганда.
Обнаружение положительного сигнала посредством ПЦР или как-либо еще указывает на твердые фазы, которые требуют дополнительного исследования. Например, если ПЦР проводят в растворе в лунках плашки для анализа, положительный сигнал служит признаком того, что лунка или лунки, о которых идет речь, содержат по меньшей мере один потенциальный партнер связывания лиганда (объекта-мишени), который может быть затем подвергнут дополнительному анализу и исследованию. Например, бактериальные колонии (или другие элементы библиотеки), присутствующие в этой лунке, могут быть подвергнуты тщательному скринингу, например, методом клеточного ELISA для идентификации колонии (элемента библиотеки), которая экспрессирует вероятного партнера связывания лиганда. Затем может быть проведен соответствующий анализ для дополнительной идентификации и характеристики связывающего партнера на генном и белковом уровне.
Положительный сигнал, полученный в результате ПЦР или иного способа, удобно определять путем сравнения с базовым сигналом или известным отрицательным сигналом. Специалисту хорошо известны средства и методы измерения и сравнения указанных позитивных, базовых и/или отрицательных сигналов. В вариантах осуществления изобретения, где объекты-мишени являются молекулами клеточной поверхности, предпочтительные отрицательные сигналы для сравнения обеспечиваются путем проведения скрининга на не имеющих отношения или отрицательных клетках, например клетках, которые не экспрессируют объекты-мишени на своей поверхности или экспрессируют объекты-мишени на низком уровне.
Изобретение теперь будет описано более подробно на следующих неограничивающих примерах со ссылками на следующие чертежи.
Фигура 1 показывает FACS анализ потенциальных клонов антител 1 (scFv1) и 2 (scFv2), отобранных способами настоящего изобретения на клетках опухоли молочной железы, и демонстрирует, что оба этих клона связываются с клетками опухоли молочной железы, таким образом показывая, что антигены-мишени для обоих этих клонов экспрессируются на клетках молочной железы.
Фигура 2 показывает таблицу результатов FACS анализа для оценки связывания потенциальных клонов антител 1 (графа 1) и 2 (графа 2) с различными клеточными линиями. Результаты показывают, что клон 1 является специфичным для протестированных клеток линии карциномы молочной железы, тогда как клон 2 связывает линии клеток опухолей другой природы.
Фигура 3 показывает поликлональный фаговый метод ELISA на клеточной линии карциномы легких A-549 с разведениями фагов после раундов пэннинга 1-4 (R1-R4), с использованием 2 промывок и центрифугирования органической фазы (орг) и покрытых лектином магнитных шариков (шарики).
Фигура 4 демонстрирует пример результатов AffiSelect ПЦР, показывающих амплифицированную ДНК β-актина в случаях, где тестируемая экспрессия scFv связывалась с клетками (A-549, HUVEC и PBL). Результаты тех же образцов экспрессии scFv показаны (в том же порядке) на трех типах клеток. Стрелки отмечают образцы экспрессии scFv, которые показывали специфичную на опухолях ДНК амплификацию.
Фигура 5 показывает результат FACS анализа одного из scFv клонов, найденных после пэннинга с использованием 2 промывок и центрифугирования органической фазы. scFv клон был протестирован на тех же типах клеток, которые были использованы для этапов пэннинга и предварительного пэннинга (A-549, HUVEC и PBL).
Фигура 6 показывает результат скрининга фильтров для идентификации антигена с scFv 2. Показаны пять образцов экспрессированной кДНК опухоли (кружки) с сильными сигналами связывания по отношению к фильтру, покрытому scFv 2. Эти образцы были отрицательными на фильтре, покрытом 3% раствором БСА в РВS (не показано).
ПРИМЕРЫ
Материалы и методы
Клетки
Две линии клеток карциномы молочной железы (РМ-1 и МТ-1, любезно предоставленные Департаментом Биологии Опухолей Норвежского Радиационного Госпиталя (DNR), Осло, Норвегия), линии клеток карциномы легких (A-549, ATCC (американская коллекция тканей и клеток) номер CCL-185, любезно предоставленные компанией Viventia Biotech Inc.; SW900, ATCC HTB-59, любезно предоставленные Департаментом Биологии Опухолей, DNR) и эндотелиальная клеточная линия (HUVEC, ATCC CRL-1730, любезно предоставленная компанией Viventia Biotech Inc.) были использованы для экспериментов пэннинга. Обе линии клеток карциномы молочной железы культивировали в среде RPMI-1640 (Cambrex) с 10% FCS (фетальной сывороткой) (Gibco BRL), 2мM L-глутамином (Cambrex) и 10мМ HEPES-буфером (Cambrex). A-549 культивировали в среде Ham's F12 (BioWhittaker) с 10% FCS и 2мM глутамином. Эндотелиальную клеточную линию культивировали в среде RPMI-1640 с 10% FCS, 15 мг/л эндотелиального фактора роста (Sigma) и 50 мг/л гепарина (Sigma). Клетки культивировали при 37°С в 5% CO2 и влажной атмосфере. Для каждого эксперимента клетки промывали PBS, собирали при помощи 1мM EDTA в PBS, однократно промывали PBS и подсчитывали количество клеток. Для экспериментов пэннинга клетки или ресуспендировали в 3% растворе БСА в PBS (Sigma) или 4% растворе обезжиренного молока в PBS (Merck).
Периферические лейкоциты крови (PBL) выделяли из свежей человеческой крови или лейкоцитарных пленок с использованием набора для выделения лимфоцитов (Axis-Shield; для деталей см. протокол, предоставленный изготовителем). Клетки однократно промывали PBS, подсчитывали количество и ресуспендировали в 3% растворе БСА в PBS или 4% растворе обезжиренного молока в PBS.
Магнитные шарики, покрытые лектином
Эпоксидные шарики М-450 (Dynal) были сшиты с лектином (WGA (агглютинин из зародышей пшеницы): Wheat Germ, Triticum vulgaris; Calbiochem)) в соответствии с протоколом изготовителя. Кратко, эпоксидные шарики промывали и затем инкубировали с 10 мкг лектина на 107 шариков в 0,1M боратном буфере, pH 8,5, в течение ночи при вращении и комнатной температуре. Шарики промывали три раза 0,1% раствором БСА в PBS и хранили при 4°С в 0,1% растворе БСА в PBS, содержащем 0,02% азида натрия, при концентрации 4×108 шариков/мл.
scFv библиотека фагового дисплея
Для экспериментов пэннинга использовали библиотеку IgM scFv, которая была сконструирована из PBL 6 здоровых доноров и клонирована в систему фагмидного дисплея, основанную на pSEX 81 (Welschof et al., 1997, PNAS, 94:1902-1907, Loset, et al, 2005, J. Immunol. Methods 299:47-62) после N-концевого перемещения сайта линкера HindIII, дающего в результате линкерную последовательность длиной в 21 аминокислоту.
Этап пэннинга/контакта
Для удаления фагов, связывающихся с общими клеточными белками, 3,75×1012 фагов (150 мкл библиотеки с титром приблизительно 2,5×1013 кое/мл), инкубировали с 2×105-2×106/мл клеток, имеющих происхождение не из опухоли, в закрытой пробирке при вращении в течение 1 часа при 4°С (= отрицательный предварительный пэннинг). В качестве блокирующего реагента использовали или 3% раствор БСА в PBS, или 4% раствор молока в PBS. В одном проекте использовали PBL для этапа отрицательного предварительного пэннинга. После отрицательного предварительного пэннинга промывали PBL дважды блокирующим раствором, после которого уменьшенную фаговую библиотеку с супернатантами после двух промывок инкубировали с клетками опухоли молочной железы, как описано выше (пэннинг).
В другом проекте были проведены два этапа отрицательного предварительного пэннинга, один за другим. На этапе первого предварительного пэннинга библиотеку инкубировали с PBL, как описано выше. После первого предварительного пэннинга промывали PBL дважды блокирующим раствором, после которого уменьшенную фаговую библиотеку с супернатантами после двух промывок инкубировали с клетками HUVEC в закрытой пробирке при вращении в течение 1-2 часов при 4°С, в качестве этапа второго отрицательного предварительного пэннинга. После двух промывок второго отрицательного предварительного пэннинга супернатант с супернатантами после промывок инкубировали с клетками опухоли легких, как описано выше (пэннинг).
Промывка/Разделение
Были протестированы четыре метода отделения свободных фагов от фагов, связанных с клетками.
1) Одноэтапное разделение в органической фазе в соответствии с методом BRASIL (Giordano et al., 2001, выше)
После пэннинга 2×150 мкл суспензии опухолевых клеток непосредственно наслаивали на поверхность 2×300 мкл раствора органической фазы (дибутилфталат:циклогексан 9:1 [v:v]; d=1,03 г/мл). После центрифугирования при 10000 g в течение 10 минут при комнатной температуре (RT) пробирки быстро замораживали в жидком азоте, отрезали низ пробирки и клеточный осадок переносили в другую (закрытую) пробирку.
2) Проводили, как метод 1, но с одним или двумя промывочными этапами с 1 мл 0,4% раствора БСА в PBS перед ресуспендированием в 300 мкл 0,4% раствора БСА в PBS и центрифугированием в органической фазе.
3) Классический метод
После пэннинга клетки осаждали центрифугированием (500 g, 5 мин, 4°С) и осадок промывали пять раз 1 мл 0,4% раствора БСА в PBS.
4) С применением магнитных шариков
После пэннинга клетки осаждали центрифугированием (500 g, 5 мин, 4°С), ресуспендировали в 0,1% растворе БСА в PBS в концентрации 5×106 клеток/мл и инкубировали с шариками, покрытыми лектином (в соотношении 1:4 клетки/шарики), при вращении в течение 20 минут при 4°С. Затем шарики промывали 10 раз раствором 0,1% БСА в PBS, используя магнит, и ресуспендировали в 200 мкл раствора 0,1% БСА в PBS.
Инфекция
Клеточные осадки или шарики добавляли к 10 мл клеток штамма XLl blue E.Coli, находящихся в log фазе, и инкубировали при 37°С в течение 15 минут при частоте вращения 60 об/мин, затем в течение 45 минут при частоте вращения 200 об/мин. Бактерии высевали с разными концентрациями на плашки LBTAG (со средой LB, содержащей 30 мкг/мл тетрациклина (T), 100 мкг/мл ампициллина (A) и 100мM глюкозу (G)) для оценки и на две большие прямоугольные плашки (размером 243×243×18 мм; Nunc) для более поздней упаковки фагов. Все плашки инкубировали в течение ночи при 37°С.
Упаковка фагов
Бактерии соскребали с двух больших плашек. Размножали бактерии в жидкой культуре, и фагмиды в этих клетках упаковывали в фаговые частицы с помощью фага-помощника М13 (Stratagene) в течение ночи при 30°С. На следующий день осаждали фаги при помощи PEG/NaCl и ресуспендировали в 1 мл PBS, из которого 100 мкл фагов (приблизительно 1013 кое) использовали для нового раунда пэннинга.
Поликлональный фаговый ELISA метод
После блокирования в течение 30 минут при 4°С в 3% растворе БСА в PBS раковые клетки и PBL инкубировали в течение 1 часа при 4°С со 100 мкл фагов (в разведениях 1:10-1:106) из каждого раунда пэннинга. После 3 промывок PBS клетки инкубировали в течение 1 часа при 4°С со 100 мкл кроличьего анти-Fd антитела (Sigma; в разведении 1:4000). После 3 промывок PBS ELISA проводили с моноклональным конъюгированным с пероксидазой хрена (HRP) козлиным вторичным антителом против Ig кролика (Dako; в разведении 1:4000) и субстратом ABTS (Calbiochem). Поглощение измеряли при 405 нм. (Аналогичную методику использовали, где целесообразно, для проведения анализа ELISA с единичным фагом в отличие от поликлональных фагов).
Экспрессия и очистка scFv в E.Coli
ДНК scFv из раунда пэннинга, которая показывала увеличение связывания с опухолями (по поликлональному фаговому ELISA), клонировали в вектор секреции pHOG21 (Kipriyanov et al, 1997, J. Immunol. Methods, 200: 67-77) и экспрессировали индивидуальные scFv клоны в клетках штамма XL-1-Blue E.Coli, как описано ранее (Dörsam et al., 1997, FEBS Letters, 414: 7-13), или в формате глубокой 96-луночной плашки (с объемом лунок 100-200 мкл). Экспрессию в глубоких лунках проводили в течение ночи при 30°С в присутствии 1 мМ IPTG (Sigma). На следующий день плашки центрифугировали в течение 10 минут при 4000 об/мин, 4°С, и супернатанты (содержащие экспрессированный scFv) использовали в других экспериментах. В случае если образцы экспрессии предполагалось использовать в методе AffiSelect, поликлональную коллекцию клонированной scFv ДНК трансформировали в компетентные клетки штамма XL-I Blue E.Coli и высевали на среду LB-TAG в лотки для биоанализа размером 22×22 см (Corning). Индивидуальные клоны отбирали, используя робот QPix2 (Genetix, Ltd., UK), в 384-луночные плашки, содержащие ростовую среду LB-TAG [30 мкг/мл тетрациклина (T), 100 мкг/мл ампициллина (A), 1% (вес/об.) глюкозы (G)], добавляли ~4% глицерина и растили в течение ночи при 37°С. Одиночные scFv клоны повторно инокулировали в 384-луночные плашки, содержащие среду LB-TAG, и проводили экспрессию в присутствии 100мкM IPTG. На следующий день перед центрифугированием плашек добавляли 50 мкл 3% раствора БСА в PBS в каждую лунку (содержащую 100 мкл экспрессии).
Тестирование экспрессированных scFv на связывание с клетками с применением 5 различных методов
1) scFv ELISA
После блокирования в течение 30 минут при 4°С в 3% растворе БСА в PBS раковые клетки и PBL инкубировали в течение 1 часа при 4°С с scFv (100 мкл экспрессии в глубоких лунках или 10 мкг/мл очищенного scFv). После 3 промывок PBS клетки инкубировали в течение 1 часа при 4°С со 100 мкл мышиного моноклонального конъюгированного с HRP анти-c-myc антитела (Invitrogen; в разведении 1:4000). После 3 промывок PBS проводили ELISA, используя в качестве субстрата ABTS, и измеряли поглощение при 405 нм.
2) Cellular Detection System 8200 (Система клеточной детекции 8200) (Applied Biosystems)
5 мкл из экспрессии scFv в формате глубокой 96-луночной плашки были протестированы в 384-луночных плашках, содержащих 5×104 опухолевых клеток (PM-1) или PBL и анти-c-myc-FMAT Blue (антитело с меткой) (AppliedBiosystems), или комбинацию мышиного анти-c-myc антитела (Invitrogen; 1,25 мкг/мл) плюс козлиное анти-мышиный IgG антитело, конъюгированное с флуоресцентной меткой Alexa Fluor R647 (Molecular Probes; 2,5 мкг/мл). После инкубации в течение 2-4 часов измеряли связывание scFv с клетками, используя 8200 Cellular Detection System, с интенсивностью сигнала только вторичного антитела и связывания scFv, не имеющего отношения, в качестве отрицательного контроля.
3) AffiSelect
5 мкл из экспрессионной смеси scFv в формате глубокой 96-луночной плашки были протестированы на опухолевых клетках (A-549), PBL и HUVEC с применением метода AffiSelect. Для этого осаждали 2,2×104 клеток (при 1600 об/мин, 4°С, в течение 5 мин) и инкубировали при качании в течение 1 часа при 4°С вместе с 5 мкл образца экспрессии и 45 мкл 3% раствора БСА в PBS. Клетки промывали 150 мкл 3% раствора БСА в PBS и центрифугировали (при 1600 об/мин, 4°С, в течение 5 мин). После добавления к осадкам 50 мкл анти-c-myc антитела (Invitrogen; в разведении 1:500), плашки инкубировали при качании в течение 1 часа при 4°С.
Клетки промывали дважды, как описано выше, и инкубировали при качании в течение 1 часа при 4°С вместе с 25 мкл суспензии M-450 пан мышиных IgG шариков (Dynal) с концентрацией 5×106 шариков/мл (соотношение клетки:шарики = 1:5). После двукратной промывки шариков 100 мкл 3% раствора БСА в PBS с применением магнита их ресуспендировали в 100 мкл 3% раствора БСА в PBS и помещали в плашку для ПЦР.
Образцы на шариках инкубировали при 55°C в течение ночи в 30 мкл буфера для ПЦР, содержащего протеиназу К (200 мкг/мл), 0,45% Tween 20 и 0,45% NP40, и после этого хранили при -20°C до использования. После тепловой инактивации протеиназы K в течение 30 минут при 95°C образцы помещали на магнит и использовали для 5 мкл супернатанта для ПЦР с праймерами, специфичными к β-актину человека. В этом анализе присутствие продукта ПЦР β-актина в лунке удостоверяло возможное присутствие экспрессионного клона scFv, который связывался с клетками.
4) FACS (анализ на проточном цитофлуориметре)
1-5×105 клеток окрашивали 50 мкл экспрессионной смеси scFv в глубоких лунках в течение 1 часа при 4°С. После трех промывок 150 мкл PBS и центрифугирования (5 мин при 1600 об/мин, 4°С), инкубировали клетки с 50 мкл FITC-конъюгированного анти-с-myc антитела (Invitrogen, в разведении 1:30) в течение 1 часа при 4°C. Клетки промывали 3 раза, как описано выше, фиксировали с помощью 200 мкл 1-2% раствора формалина в PBS (Sigma) и хранили при 4°C до проведения измерений с помощью FACS прибора (Coulter).
5) метод Guava
1×105 клеток окрашивали 50 мкл экспрессионной смеси scFv в глубоких лунках способом, описанным для FACS метода. Для того чтобы избежать интернализации, в некоторых случаях клетки фиксировали 50 мкл 1-2% раствора формалина в PBS (в течение 30 мин при 4°С) и промывали три раза PBS (5 мин при 1600 об/мин, 4°С) перед инкубированием клеток с экспрессионной смесью scFv. Визуализацию связанных scFv проводили с помощью FITC-конъюгированного анти-с-myc антитела, как описано для FACS метода, или комбинации анти-с-myc антитела (1 час при 4°C с концентрацией 5 мкг/мл; Sigma) с последующими тремя промывками PBS, описанными для FACS метода, и FITC-конъюгированного антимышиный IgG антитела (1 час, 4°C; в разведении 1:200; Dako). После трех промывок PBS и фиксации, описанных для FACS метода, образцы хранили при 4°C до проведения измерений на приборе Guava Easy Cyte (Guava Technologies).
Скрининг на клеточных фильтрах
Тестовые полоски
Для определения оптимальной концентрации клеток для иммобилизации на нитроцеллюлозную мембрану (Schleicher & Schuell), тестовые полоски (размером приблизительно 6×4 см) покрывали в течение 2 часов при комнатной температуре различным числом клеток (5×104-5×106 клеток/мл) в PBS.
После двукратной промывки PBS мембраны инкубировали с мышиным моноклональным анти-МНС класса I антителом (Dako; в разведении 1:600) в течение 1 часа при комнатной температуре. Клетки, иммобилизованные на мембране, визуализировали с помощью инкубации с HRP-конъюгированным кроличьим антимышиный IgG антителом (Dako; в разведении 1:10000) и детекции с помощью набора для люминесцентной детекции ЕСL (Amersham).
Методика теста
ScFv клоны, которые, как было показано ранее, давали положительный сигнал в методе ELISA на клетках, тестировали методом скрининга на фильтрах (Stacy et al, 2003, J. Immunol. Methods, 283:247-259). Кратко, scFv клоны анализировали на нитроцеллюлозных фильтрах. После экспрессии в течение ночи в присутствии IPTG scFv клоны тестировали на их способность связывать фильтр, покрытый клетками. Фильтры инкубировали с мышиным моноклональным анти-МНС класса I антителом (в разведении 1:600) и визуализировали связывание с помощью инкубации с HRP-конъюгированным кроличьим анти-c-myc антителом (в разведении 1:10000) и детекции с помощью ЕСL. Пять различных блокирующих растворов (2% раствор БСА в PBS, 4% раствор обезжиренного молока в PBS, блокирующий раствор SuperBlock (Pierce), блокирующий буфер Casein Blocking Buffer (Sigma), блокирующий 2% раствор Blot Block (BDH)) тестировали на их способность уменьшать неспецифическое связывание.
Идентификация антигена
Конструирование опухолевой кДНК библиотеки и пэннинг
кДНК библиотека фагового дисплея была сконструирована, как описано ранее (Fossa, et al., 2004, Cancer Immunol. Immunother., 53:431-438), из опухолевой клеточной линии SW900. Чтобы найти антиген, соответствующий представляющему интерес клону scFv, проводили биопэннинг на покрытых scFv пробирках, позволяющих максимальную сорбцию (maxisorp tubes) (Nunc). Кратко, эти пробирки покрывали при вращении в течение ночи при 4°C белком scFv с концентрацией 10 мкг/мл в 3% растворе БСА в PBS или 4% растворе молока в PBS. На следующий день фаговую дисплейную библиотеку кДНК блокировали в течение 15 минут 3% раствором БСА в PBS или 4% раствором молока в PBS перед добавлением ее в пробирки, покрытые scFv. После инкубации библиотеки при вращении в течение 2 часов при комнатной температуре, пробирки промывали 10 раз раствором 0,05% Tween(20) в PBS с последующими 10 промывками PBS. Связанные фаги элюировали инкубацией пробирок при вращении в течение 5 минут с 500 мкл 100мМ буфера ТЕА (Sigma). После нейтрализации элюированных фагов при помощи 500 мкл 1М Tris-HCl с pH 7,5, 500 мкл использовали для инфекции 10 мл клеток штамма XLl-Blue (как описано выше). После упаковки фагов в частицы, описанной ранее, фаги использовали для нового раунда пэннинга на покрытых scFv пробирках. Фаги, полученные после 3 раундов пэннинга, тестировали поликлональным фаговым ELISA методом (см. выше) на покрытых scFv плашках для максимальной сорбции (Nunc).
Скрининг на фильтрах экспрессируемых опухолевых кДНК-клонов
Опухолевую кДНК из раунда пэннинга, показывающую повышение в scFv-специфичном связывании (поликлональным фаговым ELISA методом), амплифицировали с помощью ПЦР и клонировали в модифицированный вектор секреции pHOG21, содержащий таг HA. Опухолевые кДНК клоны упорядочивали на нитроцеллюлозных фильтрах и тестировали после экспрессии в течение ночи в присутствии IPTG на их способность связываться с фильтром, покрытым scFv (de Wildt, RM, et al, Nat. Biotechnol. 2000, 18(9), 989-994). Фильтры инкубировали с мышиным моноклональным анти-НА антителом (0,2 мкг/мл; Roche) и визуализировали связывание с помощью инкубации с HRP-конъюгированным кроличьим антимышиным антителом (в разведении 1:10000; Dako) и детекции с помощью ECL.
Пример 1 - Тестирование методом BRASIL
Две клеточные линии рака молочной железы и PBL центрифугировали через органическую фазу после 1-2 часов инкубации с фаговой библиотекой и тестировали их выделение из водной (верхней фазы) и органического слоя (осадка) после центрифугирования органической фазы. В качестве отрицательного контроля центрифугировали 1011 фагов, чтобы определить число свободных фагов, которые проходят через органическую фазу.
Тестировали выделение после пэннинга на линиях опухолей человека (РМ-1 и МТ-1) и PBL. Оказалось, что PBL должны быть свежевыделенными. Размороженные PBL имеют тенденцию к слипанию во время процедуры пэннинга. После центрифугирования 75% (РМ-1), 97% (МТ-1) и 71% (PBL) находились в клеточном осадке органической фазы. Эти проценты являются слишком высокими, чтобы иметь биологическую значимость: ожидается, что только несколько процентов из целой наивной библиотеки антител будут связываться с белками клеточной поверхности данного типа клеток. Число свободных фагов, которые прошли через органическую фазу, составляло всего 2×10-5% и может игнорироваться в будущем.
Таким образом, метод BRASIL оказался не пригодным как таковой: при использовании в качестве этапа разделения только центрифугирования в органической фазе слишком много (неспецифических) связывающих объектов были найдены в клеточном осадке.
Пример 2 - Сравнение четырех методов разделения свободных фагов и фагов, связанных с клетками
1) Одноэтапное разделение в органической фазе на основе метода BRASIL (Giordano et al., 2001)
После пэннинга 2×150 мкл суспензии опухолевых клеток наслаивали непосредственно на поверхность 2×300 мкл раствора органической фазы (дибутилфталат:циклогексан 9:1 [v:v]; d=1,03 г/мл). После центрифугирования при 10000 g в течение 10 минут при комнатной температуре (RT) пробирки быстро замораживали в жидком азоте, отрезали низ пробирки и клеточный осадок переносили в другую (закрытую) пробирку.
2) Проводили, как метод 1, но с одним или двумя промывочными этапами с 1 мл 0,4% раствора БСА в PBS перед ресуспендированием в 300 мкл 0,4% раствора БСА в PBS и центрифугированием в органической фазе.
3) Классический метод
После пэннинга клетки осаждали центрифугированием (500 g, 5 мин, 4°С), и осадок промывали пять раз 1 мл 0,4% раствора БСА в PBS.
4) Магнитные шарики
После пэннинга клетки осаждали центрифугированием (500 g, 5 мин, 4°С), ресуспендировали в 0,1% растворе БСА в PBS и инкубировали с шариками, покрытыми лектином (в соотношении 1:4 клетки/шарики), при вращении в течение 20 минут при 4°С. Шарики промывали 10 раз 0,1% раствором БСА в PBS, используя магнит, и ресуспендировали в 200 мкл 0,1% раствора БСА в PBS.
В первом эксперименте новый метод (2) сравнивали с методом BRASIL (1) и классическим методом с 5 промывками (3). Использовали опухолевые клетки линии РМ-1 карциномы молочной железы и проводили отрицательный предварительный пэннинг с PBL, как описано в разделе «Материалы и методы».
В другом эксперименте было сделано прямое сравнение между методом (2) и применением покрытых лектином магнитных шариков для разделения свободных фагов и фагов, связанных с клетками (метод 4). Использовали опухолевые клетки линии А-549 карциномы легких и проводили отрицательный предварительный пэннинг с PBL и HUVEC, как описано в разделе «Материалы и методы».
Сравнение методов 1, 2 и 3
После четырех раундов пэннинга, разделения (с использованием методов 1, 2 или 3 в соответствующих случаях), инфекции и упаковки в частицы проводили поликлональный фаговый ELISA метод отдельно на фагах, выделенных из каждого из 4 раундов для детекции увеличения связывания фагов и опухолевых клеток, но не PBL. После всего только 2 раундов пэннинга такое увеличение было видно в методе 2, тогда как методы 1 и 3 показывали обогащение после 4 и 3 раундов, соответственно. После субклонирования в вектор экспрессии pHOG21 проводили scFv ELISA для 95 клонов из 3 раунда каждого метода. Метод 2 оказался лучшим методом в отношении не только времени на обогащение (2 раунд), но также и количества объектов, связывающих scFv (39 из 95) по сравнению с методом 1 (4 раунд, 11 из 94) и методом 3 (3 раунд, 27 из 95).
Сравнение методов 2 и 4
Результаты поликлонального фагового ELISA метода выявили, что после всего только 2 раундов пэннинга было видно увеличение в связывании фагов и опухолевых клеток как в методе 2, так и в методе 4. В отличие от этого метод 2 показал увеличенное обогащение (кривая поднималась вверх после 100-кратного разведения фагов) после третьего и четвертого раунда пэннинга по сравнению с методом 4 (фигура 3).
Таким образом, метод 2 (то есть метод по изобретению) показывал существенные преимущества перед ранее существующими методами, особенно в смысле способности проводить меньшее количество раундов пэннинга и идентификации большего количества положительных клонов.
Пример 3 - Успешные проекты осуществления пэннинга с использованием разделения в органической фазе после 1 или 2 промывок
Для двух проектов пэннинга была успешно применена комбинация 1 или 2 промывок с разделением в органической фазе.
1) Проект на клетках карциномы молочной железы
Линию клеток карциномы молочной железы (РМ-1) использовали для пэннинга с scFv библиотекой фагового дисплея. Отрицательный предварительный пэннинг проводили на свежих PBL человека, как описано в разделе «Материалы и методы». В этих экспериментах исследовали эффект промывок перед центрифугированием органической фазы и его сравнение с классическим методом (см. выше).
После одной промывки и центрифугирования органической фазы одиночные фаги, так же как scFv из 3 раунда пэннинга, тестировали на их специфичность в методе ELISA на клетках и измерениях FACS методом против PBL и опухолевой клеточной линии. Было найдено три уникальных и специфичных к опухолевой линии клона (клоны 1, 2 и 3). При тестировании единичных экспрессионных клонов scFv с помощью 8200 Cellular Detection System и измерений на приборе компании Guava были найдены пять клонов, более уникальных и специфичных к опухолевой линии (данные не показаны). Более детальное исследование первых трех клонов в Norwegian Radium Hospital (Норвежском Радиационном Госпитале) (DNR, Oslo, Norway) в экспериментах с использованием FACS метода показало, что один scFv клон (1) связывает преимущественно клетки линий карциномы молочной железы, тогда как другой scFv клон (2) связывает клетки опухолевых линий другой природы, например простаты, глиобластомы, легких и линии опухолей прямой и ободочной кишки (фигуры 1 и 2). Результаты также показали, что антигены-мишени для обоих клонов не являются белками Her-2/neu, EGF-R ни CEA, таким образом означая, что эти клоны могли бы распознавать новый опухолевый антиген. Данные методов FACS и конфокальной микроскопии показали, что в этом случае оба scFv клона 1 и 2 связывают интернализующиеся агенты.
Таким образом, очевидно, что способы изобретения можно применять для идентификации специфичных партнеров связывания (в этом случае scFv фрагменты антител) молекул, экспрессируемых на поверхности клеток.
2) Проект на клетках карциномы легких
Использовали клетки линии карциномы легких (А-549) для пэннинга с scFv библиотекой фагового дисплея. Был проведен отрицательный предварительный пэннинг на свежих PBL человека и клетках эндотелиальной линии (HUVEC), как описано в разделе «Материалы и методы». В этих экспериментах было сделано прямое сравнение между методом, использующим 2 промывки перед центрифугированием органической фазы (метод 2), и методом, использующим магнитные шарики, покрытые лектином, для разделения свободных и связанных с клетками фагов (метод 4).
После двух промывок и центрифугирования органической фазы тестировали экспрессионные scFv клоны после 3 раунда пэннинга на их специфичность в методах AffiSelect и ELISA на клетках против PBL, HUVEC и опухолевой линии клеток А-549 (фигура 4). Как показано в примере на фигуре 4, восемь образцов экспрессии scFv, протестированных против опухолевой линии, показали ПЦР-амплифицированный β-актин ДНК, тогда как такой продукт не был виден для HUVEC и PBL. Это показывает, что в этом случае 8 из протестированных образцов scFv связывались с клетками опухолевой линии, но не с HUVEC или PBL. После подтверждения специфичного связывания с опухолевыми клетками посредством FACS метода (фигура 5 показывает представительный клон) и измерений методом Guava (данные не показаны), были найдены десять уникальных и специфичных к опухолевой линии клонов.
Таким образом, снова видно, что способы изобретения могут применяться для идентификации специфических партнеров связывания (в случае scFv фрагментов антител) молекул, экспрессируемых на поверхности клеток.
Пример 4 - Тестирование различных пробирок для ПЦР от различных производителей
Были протестированы тонкостенные пробирки для проведения ПЦР объемом 0,5 мл на их стабильность при центрифугировании органической фазы и разрезание после заморозки.
Пробирки объемом 0,5 мл компаний Eppendorf (#0030 124.502) и Axygen PCR-05-C (#321-05-051) были лучшими из протестированных пробирок. После замораживания органической фазы необходимо было разрезать пробирки сразу над коническим дном, чтобы избежать раздробления пробирки.
Пример 5 - Воздействие органической фазы на инфективность фагов
Было использовано количество 108 и 1011 фагов вместе со 100 и 200 мкл органической фазы для инфекции 10 мл клеток штамма XLl-Blue E. Coli (Stratagene) в log фазе. Бактерии инкубировали при 37°C в течение 15 минут при вращении со скоростью 60 об/мин, затем 45 минут со скоростью 200 об/мин и высевали с различными концентрациями на чашки со средой LBTAG. После инкубации при 37°C в течение ночи подсчитывали число колоний.
При работе с фагами с низким титром (108 по сравнению с 1011) присутствие органической фазы оказывало отрицательный эффект на процент инфективности (уменьшение приблизительно на 50%). Для высокого титра фагов такой эффект не наблюдался.
Как видно из результатов и обсуждений, с описанными способами скрининга экспрессионных библиотек антител на клетках, поиск антител не зависит от доступности очищенного и/или рекомбинантного антигена, и даже могут быть обнаружены новые специфичные для отдельных типов клеток антигены. Сочетание пэннинга на клетках с применением способов изобретения в комбинации с клеточным скринингом на фильтрах или другими методами, такими как AffiSelect или 8200 Cellular Detection System (Applied Biosystems), следовательно, предоставляет технологическую платформу для высокопропускного скрининга и отбора антител против антигенов клеточной поверхности.
Пример 6 - Целевая идентификация клонов антител, специфично распознающих опухолевые клетки, из успешных проектов пэннинга с применением разделения в органической фазе после 1 или 2 промывок.
Два scFv клона (клон 1 и клон 2, см. фигуры 1 и 2) из проекта пэннинга на клетках карциномы молочной железы с применением центрифугирования органической фазы после 1 промывки использовали для идентификации их объектов-мишеней.
Для целевой идентификации была сконструирована опухолевая кДНК библиотека фагового дисплея из положительной клеточной линии (SW900; сильно экспрессирующая антигены к обоим scFv 1 и 2). Эта библиотека была затем использована для пэннинга в пробирках, покрытых scFv 1 и 2, соответственно. После 3 раундов пэннинга были протестированы экспрессии одиночных опухолевых кДНК клонов посредством скрининга фильтров на их связывание с фильтрами, покрытыми scFv 1 и 2.
В случае идентификации антигена для scFv2 были найдены 5 опухолевых кДНК клонов, которые связывают фильтр, покрытый scFv2 (фигура 6). Анализ последовательностей показал, что все 5 клонов соответствуют одной и той же нуклеотидной последовательности.
В случае идентификации антигена для scFv1 12 опухолевых кДНК клонов показали связывание с фильтром, покрытым scFv1 (данные не показаны).
Связывание опухолевых кДНК клонов с scFv подтверждали методом ELISA на плашках, покрытых scFv. В дополнение, оба scFv1 и 2 теперь применяются в экспериментах по иммунопреципитации, одно- и двухмерном ПААГ, выделении пептидов и масс-спектрометрическом анализе.
Следовательно, можно видеть, что способы изобретения могут далее использоваться для идентификации объектов-мишеней (в этом случае антигенов-мишеней), которые взаимодействуют с партнерами связывания, идентифицированными улучшенными методами разделения в органической фазе, описанными в данном документе.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ СКРИНИНГА И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2622089C2 |
| СВЯЗЫВАЮЩИЕ ЭЛЕМЕНТЫ С ИЗМЕНЕННЫМИ ДИВЕРСИФИЦИРОВАННЫМИ ДОМЕНАМИ ОСТОВА | 2017 |
|
RU2778694C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕСЯ С ДВУМЯ МИШЕНЯМИ -DLL4 И VEGF-, И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2648154C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ БАКТЕРИОФАГА, СПОСОБ ВЫДЕЛЕНИЯ КЛЕТОК МЛЕКОПИТАЮЩЕГО, СПОСОБ СЕЛЕКЦИИ БАКТЕРИОФАГА (ВАРИАНТЫ), СПОСОБ ИДЕНТИФИКАЦИИ ПОДГРУППЫ БАКТЕРИОФАГОВ И ИНТЕРНАЛИЗУЮЩИЙ ЛИГАНД (ВАРИАНТЫ) | 1998 |
|
RU2234530C2 |
| SPARC-СВЯЗУЮЩИЕ ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2491085C2 |
| ОПОСРЕДОВАННАЯ РЕЦЕПТОРАМИ ДОСТАВКА ГЕНОВ С ИСПОЛЬЗОВАНИЕМ ВЕКТОРОВ НА ОСНОВЕ БАКТЕРИОФАГОВ | 1998 |
|
RU2209088C2 |
| НОВОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ К ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ТОЛСТОЙ КИШКИ | 2001 |
|
RU2268068C2 |
| ПАРТНЕРЫ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С NGF | 2006 |
|
RU2406728C2 |
| АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-6 ЧЕЛОВЕКА | 2016 |
|
RU2656160C2 |
| Однодоменные наноантитела против шиповидного белка вируса SARS-CoV-2 | 2021 |
|
RU2794141C2 |
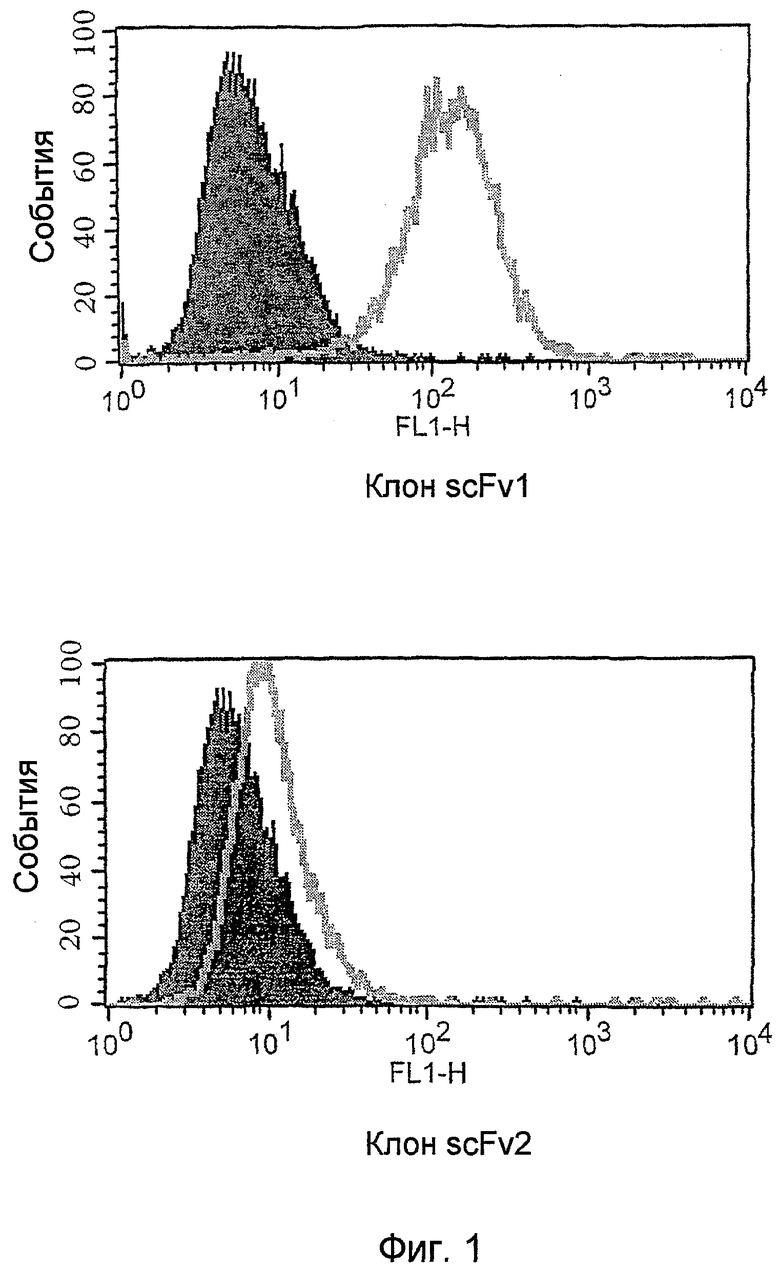
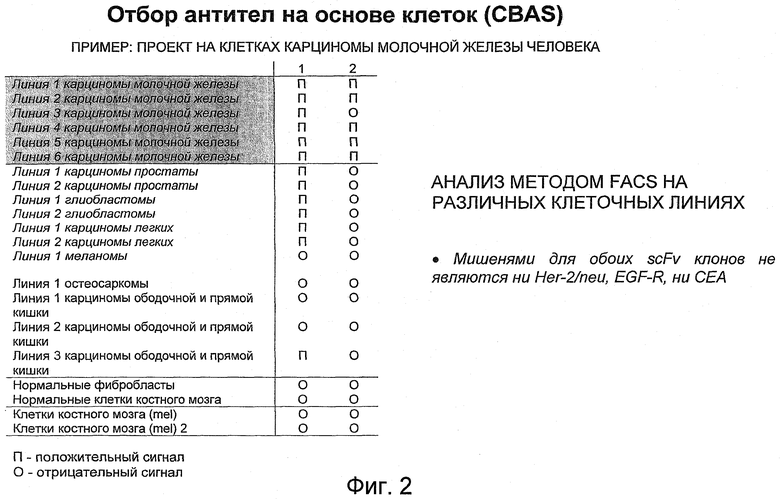
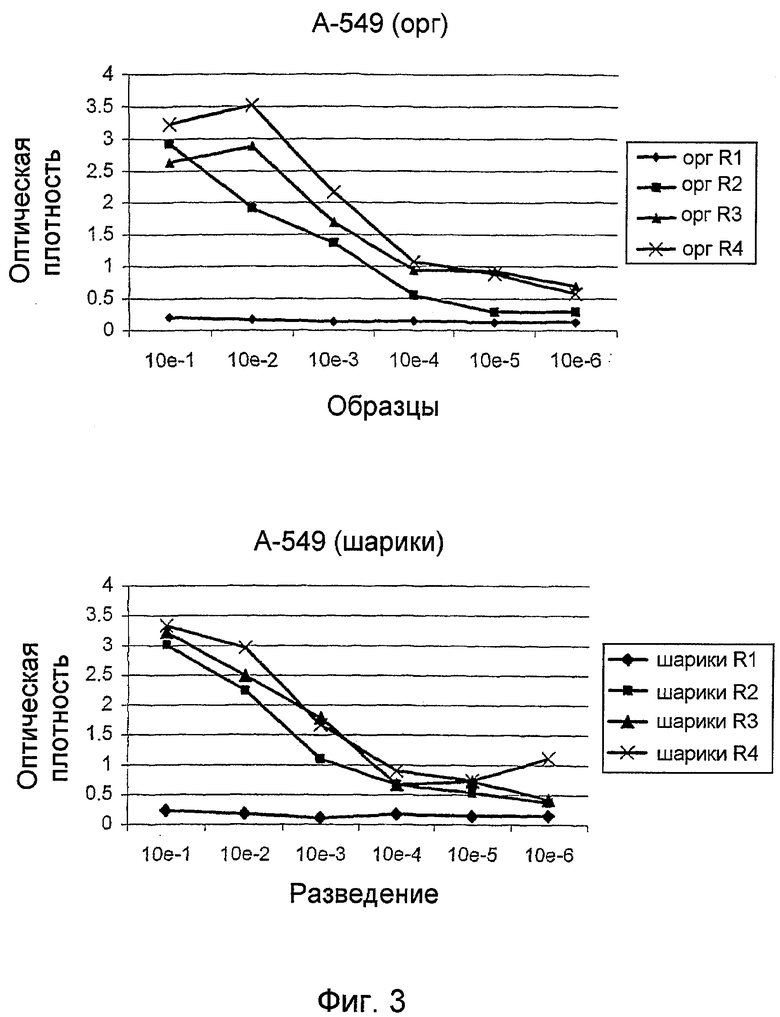
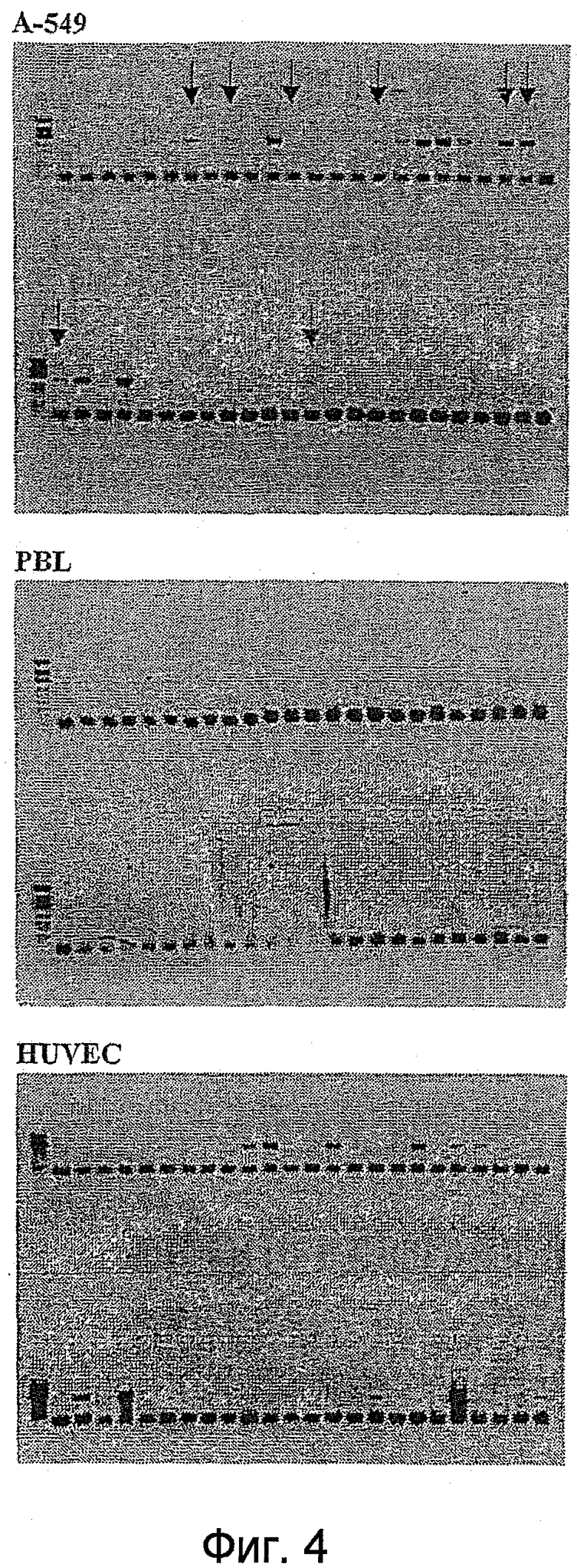
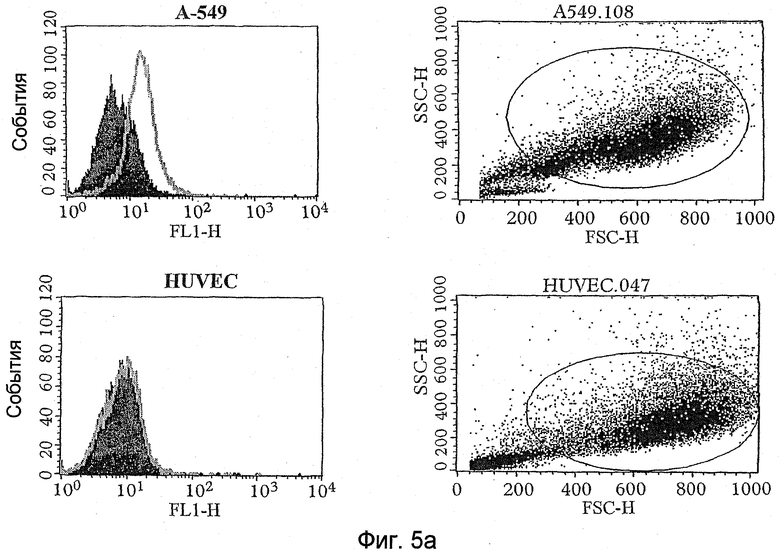
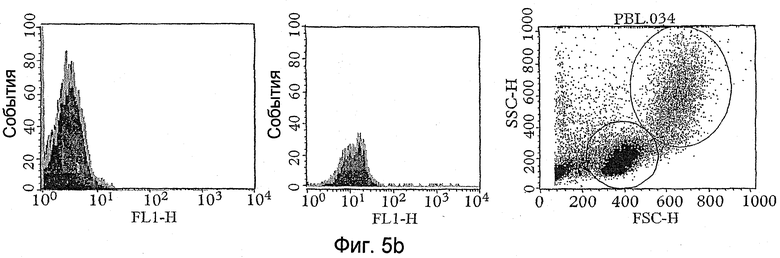

Настоящее изобретение относится к области биотехнологии и может быть использовано для получения диагностических и/или терапевтических агентов, в частности антител, специфически взаимодействующих с белками клеточной поверхности клеток-мишеней. Предложен способ скрининга библиотеки фагового дисплея и включающие его способ выделения элемента библиотеки, являющегося специфическим партнером связывания поверхностного белка клетки-мишени, и способ выделения неизвестного белка клеточной поверхности, специфически взаимодействующего с элементом библиотеки. Способ скрининга библиотеки фагового дисплея по изобретению предусматривает контактирование указанной библиотеки с представляющими интерес клетками с последующим отделением клеток, которые связались с одним или несколькими элементами экспрессионной библиотеки, от не связанных элементов посредством разделения через органическую фазу, и отличается введением дополнительной стадии, которая состоит в проведении перед указанным разделением по меньшей мере одного этапа промывки материала и обеспечивает существенное повышение эффективности метода. 3 н. и 27 з.п. ф-лы, 7 ил.
1. Способ скрининга библиотеки фагового дисплея для идентификации или отбора одного или нескольких ее элементов, которые являются вероятными партнерами связывания одного или нескольких белков клеточной поверхности, включающий:
(а) приведение в контакт библиотеки фагового дисплея с одной или несколькими клетками, экспрессирующими белки клеточной поверхности, в условиях, которые не препятствуют связыванию элементов библиотеки фагового дисплея с белками клеточной поверхности указанных клеток; и
(с) отделение клеток, экспрессирующих белки клеточной поверхности, которые связались с одним или несколькими элементами библиотеки фагового дисплея, от не связавшихся элементов библиотеки фагового дисплея путем разделения через органическую фазу и, таким образом, отделение вероятных партнеров связывания среди поверхностных белков указанных клеток от других элементов библиотеки фагового дисплея,
отличающийся тем, что после стадии (а), перед стадией (с) способ включает стадию (b), на которой указанные клетки, экспрессирующие белки клеточной поверхности, подвергают по меньшей мере одной стадии промывки.
2. Способ по п.1, где указанная библиотека фагового дисплея является библиотекой фагового дисплея, экспрессирующей антитела.
3. Способ по п.2, где указанная библиотека фагового дисплея, экспрессирующая антитела, содержит scFv антитела.
4. Способ по п.1, где указанный белок клеточной поверхности представляет собой антиген.
5. Способ по п.1, где указанные клетки трансформированы или трансфицированы нуклеиновой кислотой, кодирующей указанный белок клеточной поверхности, или трансформированы или трансфицированы нуклеиновыми кислотами, кодирующими библиотеку белков клеточной поверхности, или являются клетками, которые сверхэкспрессируют указанные белки клеточной поверхности.
6. Способ по п.1, где указанные клетки являются эукариотическими клетками.
7. Способ по п.1, где указанные клетки связаны с болезненным состоянием.
8. Способ по п.1, где указанные клетки являются раковыми клетками.
9. Способ по п.1, где на стадии (а) присутствует более одного белка клеточной поверхности, и эти белки являются различными.
10. Способ по п.1, где на стадии (b) проводят по меньшей мере 2, по меньшей мере 3 или по меньшей мере 4 стадии промывки.
11. Способ по п.1, где на стадии (b) проводят 1, 2, 3 или 4 стадии промывки.
12. Способ по п.1, где указанное разделение через органическую фазу проводят центрифугированием.
13. Способ по п.1, дополнительно включающий один или несколько этапов предварительного пэннинга, проводимых перед стадией (а) способа, где указанную библиотеку фагового дисплея приводят в контакт с одним или несколькими белками клеточной поверхности, не являющимися мишенями.
14. Способ по п.1, где стадии (а)-(с) повторяют один или несколько раз.
15. Способ по п.1, где стадии (а)-(с) повторяют 1, 2 или 3 раза.
16. Способ по п.1, где указанные белки клеточной поверхности, которые связаны с одним или несколькими элементами библиотеки фагового дисплея, подвергаются дополнительному анализу.
17. Способ по п.16, где указанный дополнительный анализ является дополнительным анализом вероятных партнеров связывания и/или белка клеточной поверхности.
18. Способ по п.1, который включает дополнительную стадию, на которой указанные вероятные партнеры связывания выделяют, удаляют, элюируют или отделяют от указанного белка клеточной поверхности, или экспрессируют, или получают отдельно от указанного белка клеточной поверхности.
19. Способ по п.18, в котором проводят дополнительный анализ вероятных партнеров связывания, и указанный анализ включает стадии:
i) приведения в контакт одного или нескольких указанных вероятных партнеров связывания с одним или несколькими белками клеточной поверхности в растворе;
ii) захвата белков клеточной поверхности, которые связались с одним или несколькими вероятными партнерами связывания на твердой фазе; и
iii) обнаружения белков клеточной поверхности и, таким образом, обнаружения одного или нескольких вероятных партнеров связывания белков клеточной поверхности.
20. Способ по п.19, где указанный белок клеточной поверхности является антигеном.
21. Способ по п.19, где указанные вероятные партнеры связывания содержат таг или маркер для облегчения этапа захвата (ii).
22. Способ по п.19, где указанные белки клеточной порверхности содержат или связаны с репортерной частью для возможности обнаружения белков клеточной поверхности.
23. Способ по п.22, где указанная репортерная часть является молекулой ДНК.
24. Способ по п.23, где указанная молекула ДНК является эндогенным геном «домашнего хозяйства» или является экзогенной репортерной частью.
25. Способ по п.19, где указанная твердая фаза на этапе (ii) является магнитной и, предпочтительно, находится в виде частиц.
26. Способ по п.19, где указанный этап захвата облегчен посредством взаимодействия молекулы захвата на твердой фазе и тага или молекулы, связанной с вероятным партнером связывания.
27. Способ по п.19, где указанный этап обнаружения проводится посредством обнаружения репортерной части на или связанной с белками клеточной поверхности.
28. Способ по п.27, где этапом обнаружения является ПЦР.
29. Способ выделения неизвестного белка клеточной поверхности, включающий стадии, определенные в любом из пп.1-28, и дополнительно включающий:
(d) выделение одного или нескольких элементов библиотеки фагового дисплея, которые связывают указанный неизвестный белок клеточной поверхности, и
(e) использование указанного элемента библиотеки фагового дисплея для выделения белка клеточной поверхности, с которым он связывается, посредством
использования указанного элемента библиотеки фагового дисплея для скрининга библиотеки кДНК, полученной из клеток, на которых экспрессируется неизвестный белок клеточной поверхности;
иммобилизации указанного элемента библиотеки фагового дисплея на твердой фазе и очистку указанных белков клеточной поверхности аффинной хроматографией;
иммунопреципитации;
Вестерн-блоттинга;
характеристик экспрессии; или
иммуногистохимии.
30. Способ выделения элемента библиотеки фагового дисплея, который является специфическим партнером связывания белка клеточной поверхности, где способ включает стадии, определенные в любом из пп.1-28, для отбора элементов библиотеки фагового дисплея, которые являются специфическими партнерами связывания белка клеточной поверхности, и стадию (е) выделения элемента (ов) библиотеки фагового дисплея.
| ОБЕСПЫЛИВАЮЩАЯ ЭМУЛЬСИЯ ДЛЯ ОБРАБОТКИ ПОКРЫТИЙ АВТОДОРОГ | 0 |
|
SU220822A1 |
| RIDGEWAY ЕТ AL., Cancer Res., 59, 2718-2723, 1999 | |||
| ПЕПТИД-ИМИТАТОР ЭПИТОПА БЕЛКА gp120 ВИЧ-1 | 2000 |
|
RU2184780C2 |
Авторы
Даты
2010-10-27—Публикация
2005-10-07—Подача