Настоящее изобретение относится к детектированию антител и, в частности, к определению недавно синтезированных антител, вырабатываемых в образцах в ответ на инфицирование или вакцинацию и т.д., с помощью простого способа, включающего в себя разрушение лимфоцитов до детектирования присутствия антител.
ELISA в течение длительного времени использовали для детектирования и количественного определения уровней антител (или антигенов). В более общем плане ELISA используют в качестве серологического анализа, но его используют также для изучения иммунохимических характеристик антигенов или антител и он часто находит применение, например, для оценки и характеризации иммунных реакций, для исследования выработки антител клеточными культурами, в гибридомных технологиях и т.д.
Анализ ELISA прост для использования, чувствителен и относительно быстр, но он дает возможность лишь просто определять присутствие в образце антитела-мишени; с его помощью нельзя определить разницу между происходящим в настоящее время синтезом антител в ответ на антиген и антителами, которые уже присутствуют как следствие прошлой инфекции, или в результате пассивного переноса и т.д. Хотя в ряде случаев может оказаться достаточным просто получить информацию относительно присутствия антитела, в других случаях бывает желательно иметь возможность определить, действительно ли антитела-мишени быстро синтезированы лимфоцитами во время тестирования, например, в процессе вакцинации или при диагностике инфекции у новорожденных, чтобы отличить их от пассивно перенесенных материнских антител. Такой результат нельзя получить с помощью классического метода ELISA.
Поэтому были разработаны другие методы, которые обеспечили возможность детектирования синтезируемых в настоящее время антител. В этой связи следует конкретно упомянуть иммуноферментный спот-анализ (ELISPOT) (известный также как спот ELISA или ELISA-анализ бляшек), обзор которого приведен, например, у Czerkinsky et al. в ELISA and other Solid Phase Immunoassay, Ed. D.M.Kemeny and S.J.Challacombe, 1988, Chapter 10, 217-239. Эта методика, основанная на использовании метода ELISA, позволяет количественно определять секретируемые лимфоцитами антитела против одного или более из антигенов-мишеней. В основном ELISPOT является вариантом метода ELISA, с помощью которого клетки, секретирующие антитела (ASC), можно выявить, культивируя лимфоциты в специально модифицированных ELISA-лунках, покрытых антигеном-мишенью, и заменяя стандартные ELISA-реагенты комплексами фермент-субстрат, что приводит к получению окрашенного осадка (бляшек), которые расположены рядом с секретирующими клетками. Затем бляшки можно подсчитать, получая меру числа клеток, продуцирующих антитела. В культуральную среду можно включить ингибиторы синтеза белка для подтверждения того, что детектируемые бляшки связаны с de novo синтезом антител во время периода инкубирования in vitro.
Хотя, как было показано, метод ELISPOT является весьма полезным при изучении динамики гуморальных иммунных реакций и был использован для определения спонтанных АSС, которые кратковременно появляются в периферической циркуляции иммунизированных субъектов, некоторые особенности этого способа налагают ограничения на его использование в клинической диагностике. Во-первых, так как необходимо подсчитывать отдельные бляшки для каждого из отдельных образцов, что является трудоемким и может потребовать много времени, этот способ практически не пригоден для анализа большого числа образцов, что необходимо в клинической диагностической лаборатории. Во-вторых, подсчитывается только число клеток, секретирующих антитела в каждом образце, и вообще говоря, это требует достаточно больших объемов образцов, например несколько мл. Кроме того, планшеты для ELISPOT достаточно дороги, а анализ не так просто автоматизировать.
В патенте WO 96/26443 раскрыто использование модифицированного ELISA-теста, который можно использовать для определения происходящего в настоящее время синтеза антител. В этом анализе лимфоциты культивируют после выделения и определяют уровни содержания антител, продуцируемых за время культивирования. В этом способе необходимо проводить инкубирование лимфоцитов в тестируемом образце при температуре около 37°С, для того чтобы можно было определить антитела, секретированные во время периода инкубирования. В среднем период инкубирования составляет от 2 до 5 часов, что выдвигает значительные ограничения в отношении скорости анализа. Для инкубирования необходимо предусмотреть соответствующее оборудование там, где проводится тестирование, чтобы его можно было бы осуществить непосредственно перед процедурой анализа. Обычно это означает, что анализ лимфоцитов необходимо осуществлять как можно быстрее после получения образца от пациента, так как хранение образца, например, используя замораживание, неприемлемо, так как приводит к снижению жизнеспособности клеток. Жизнеспособность очищенных клеток можно поддерживать лишь в течение относительно короткого промежутка времени, сохраняя их на льду при 0°С или менее, предпочтительно при 4°С.
Поэтому очевидно, что несмотря на достижения в области методик определения антител все еще сохраняется необходимость в более усовершенствованном способе анализа, который был бы простым, быстрым и экономичным для осуществления, который давал бы возможность надежно количественно определять спонтанно секретируемые антитела, который позволял бы различать синтез антител de novo и который можно было бы осуществлять на образцах, например образцах крови, для диагностических целей. Настоящее изобретение именно к этому и относится.
В описанной выше методике используют период культивирования, определяя который необходимо учитывать, что он должен быть достаточным для достижения достаточного титра антител для получения результатов анализа для иммунодиагностических целей.
В литературе было установлено, что биосинтез антител (иммуноглобулинов) происходит в В лимфоцитах (см. Roitt I., Brostoff J., Male D. "Immunology", 4 th Edition published by Mosby, London 1996, 6.12-6.13), после чего они секретируются в кровоток для борьбы с инфекцией. Если они секретируются секретирующими антитела клетками (ASC), молекулы оказываются полностью собранными (например, в молекуле IgG две тяжелые цепи и две легкие цепи соединены дисульфидными связями) и гликозилированы. Считают, что стадией, ограничивающей скорость биосинтеза антител, является внутриклеточный транспорт и гликозилирование за счет эндоплазматического ретикулума и комплекса Гольджи (что занимает 1 час или более), тогда как биосинтез различных тяжелых и легких цепей иммуноглобулинов требует всего лишь нескольких минут для завершения. Обычно время, необходимое для процесса синтеза и секретирования, оценивается примерно равным 2 часам (Melchers, 1971, Histochemical, J., 3, р.389-397). Как следствие быстрой секреции иммуноглобулинов из клеток, ранее никогда не предполагалось, что функциональные антитела или даже частично синтезированные антитела (например, до гликозилирования) могут присутствовать внутри клеток лимфоцитов в сколько-нибудь заметном количестве. Кроме того, не предполагалось, что разрушение лимфоцитов в образце может привести к появлению значительных количеств "свежесинтезированных антител", позволяя осуществить детектирование с целью иммунодиагностики.
Однако было неожиданно обнаружено, что содержащиеся в лимфоцитах клетки содержат достаточное количество антител, чтобы обеспечить детектирование и даже количественное определение острого синтеза антител у субъекта, если образцы для анализа отбирают в острой фазе иммунной реакции. Обычно это соответствует такому же временному интервалу, который предполагается и для появления секретирующих антитела клеток в периферической крови. Таким образом обеспечивается необходимая для диагностики информация.
Удобно то, что это позволяет избежать необходимости длительного инкубирования образца, например препарата очищенных лимфоцитов, до анализа, так как этот анализ не требует какого-либо инкубирования лимфоцитов.
Способ анализа согласно изобретению обеспечивает также надежный анализ, при котором образцы можно хранить до осуществления анализа, например, в охлажденном виде (предпочтительно около 4°С) или в замороженном виде, например, при температуре ниже 0°С. Специалистам должно быть очевидно, что цельную кровь предпочтительнее охлаждать (например, как будет описано далее), нежели замораживать, так как замораживание цельной крови приведет к лизису клеток. Однако такие образцы, как очищенные лимфоциты, можно замораживать или охлаждать до осуществления анализа, что не приведет к искажению результатов тестов. Такие образцы можно хранить в течение длительного промежутка времени до анализа даже такими способами, которые могут повлиять на жизнеспособность клеток (например, так же, как при хранении образцов сыворотки или плазмы). Как следствие, способ анализа согласно изобретению обеспечивает значительные преимущества для отбора образцов, их хранения и обработки, и особенно в том, что позволяет значительно отложить осуществление анализа, что может быть крайне необходимым при лабораторном тестировании образцов, полученных в полевых условиях.
Поэтому в одном из аспектов в настоящем изобретении предложен способ определения в образце количества свежесинтезированных антител в реакции на иммуноген, который включает в себя
получение образца, содержащего лимфоциты;
разрушение указанных лимфоцитов, в результате чего выделяются антитела или их части, связанные с указанными лимфоцитами;
детектирование выделенных антител или их частей, тем самым детектирование присутствия или количества свежесинтезированных антител в указанном образце.
В том смысле, как здесь использован термин "свежесинтезированное антитело", он относится к антигенно активному антителу (т.е. способному распознавать и связываться с антигеном, соответствующим иммуногену), которое было продуцировано или синтезировано клетками лимфоцитов и внутри них в ответ на присутствие иммуногена in vivo, как часть происходящей в рассматриваемое время иммунной реакции. Таким образом, антитела синтезируются лимфоцитами во время иммунной реакции, стимулируемой появлением иммуногена in vivo, то есть синтезируются до и во время отбора у подопытного животного образца, содержащего лимфоциты.
Ссылки на антитела или их части, связанные с указанными лимфоцитами, относятся к свежесинтезированным антителам или их частям, которые антигенно активны (т.е. способны распознавать иммуноген и связываться с ним), которые еще не были секретированы из клеток. Как было указано выше, это обычно соответствует антителам, продуцированным в предшествующие 2 часа (что может происходить исключительно in vivo или по крайней мере частично in vivo, до разрушения клеток, если эти клетки хранят в соответствующих условиях), хотя время, необходимое для секретирования, может меняться. Хотя антитела могут быстро продуцироваться внутри клеток (например, за 1-2 минуты, хотя секретирование происходит значительно медленнее), свободные цепи, которые составляют антитела, или негликозилированные или частично гликозилированные антитела, или цепи антител могут присутствовать в лимфоцитах и, следовательно, выделяться при их разрушении. В соответствующих случаях эти "части" могут определяться и могут быть включены в измерения присутствия или определения количества свежесинтезированных антител при условии, что они антигенно активны в указанном выше смысле. Антитела или их части, выделенные из лимфоцитов, включают в себя свежесинтезированные антитела. Оценка уровней содержания таких свежесинтезированных антител предоставляет соответствующую информацию о количестве активных антител, продуцированных в ответ на конкретный иммуноген, то есть антител, которые продуцированы, например, в процессе хронического или острого иммунного ответа. Таким образом, в настоящем изобретении предложен также способ определения присутствия или количественного определения продуцируемых активных антител путем коррелирования с уровнями свежесинтезированных антител при сравнении с соответствующими контрольными образцами.
Образец, содержащий лимфоциты, можно отобрать у любого животного, предпочтительно млекопитающего, например человека, на которого можно воздействовать иммуногеном перед отбором образца. Обычно, если необходимо определить иммунный ответ по способу настоящего изобретения, его вызывают свежей инфекцией или вакцинацией, и желательно произвести отбор образцов в течение нескольких недель или нескольких дней экспонирования этого иммуногена. Оптимальное время отбора образца у субъекта зависит от природы инфекции или типа использованной вакцины и, кроме того, определяется эффективностью механизма иммунного ответа субъекта, а это может варьировать у различных индивидуумов. Однако необходимо, чтобы образец был отобран в то время, когда лимфоциты иммунной системы субъекта находятся в фазе острого синтеза антител в ответ на представляющий интерес иммуноген. Так вообще было обнаружено, что образцы отбирают в течение 3 недель представления субъекта действию иммуногена, более предпочтительно в течение 8-12 дней после инфицирования или вакцинации, но в некоторых случаях происходит продуцирование достаточного количества антител в течение 1-5 дней или более конкретно 2-3 дней после инфицирования или вакцинации для получения значимых результатов с помощью анализа в соответствии с настоящим изобретением.
Образец может быть образцом крови или образцом, полученным из лимфатической системы субъекта. Обычно пригодны любая жидкость организма или образец ткани, которые содержат лимфоциты из иммунной системы субъекта. В частности, в клинике или в экспериментальных условиях удобно отобрать лимфу или периферическую кровь субъекта, но равным образом подходит любая лимфатическая или лимфоидная ткань или любой источник крови, включающий в себя лимфоциты, включая образцы, полученные из лимфатических узелков или желез или лимфатических узлов, например миндалин. Были разработаны методики хирургического вмешательства, которые позволяют получать материал биопсии от субъекта, и такую процедуру можно использовать при необходимости для получения образцов для использования в способе настоящего изобретения. В зависимости от источника лимфоцитов может оказаться необходимым (а может, и нет) выделить и очистить лимфоциты перед проведением анализа по способу настоящего изобретения. Однако при необходимости или при желании лимфоциты можно очистить. Так предпочтительным образцом для использования в таком анализе является препарат лимфоцитов, подготовленный из одного из вышеперечисленных источников известными специалистам способами.
Под термином "разрушение" лимфоцитов подразумевают, что содержимое клеток, включая все синтезированные антитела, выделяется за пределы клеточной мембраны и внутренних мембранных структур, так что их можно определять любым удобным биохимическим или химическим способом анализа. Известно, что иммуноглобулины синтезируются и секретируются по схеме с участием эндоплазматического ретикулума и комплекса Гольджи. Так, необходимое разрушение требует высвобождения из этих внутренних структур. Таким образом, разрушение лимфоцитов можно осуществить известными способами разрушения клеток, позволяющими выделить содержание мембранных компартментов, например, клеточным лизисом, например, используя средства физического разрушения, например циклы замораживания-оттаивания, или химическими способами, используя разрушающие клетки буферы или растворы.
В том смысле, как здесь использованы термины "детектирование" и "определение присутствия или количества", оба охватывают количественную и качественную оценку уровня продуцирования антител в смысле получения абсолютной величины количества антител, продуцируемых в образце, а также коэффициент, отношение, процент или аналогичные показатели уровня продуцирования антител, так же, как и полуколичественные или качественные оценки. Термин "определение присутствия" охватывает также ситуации, где негативный результат, указывающий на отсутствие синтезированных антител, представляет ценность для оценки иммунного ответа у субъекта. Например, негативный результат может указывать на отсутствие иммунного ответа на представляющий интерес иммуноген или может быть показателем хронической инфекции, если антитела к этому представляющему интерес иммуногену присутствуют в сыворотке.
Определение свежесинтезированных антител позволяет скорее оценивать уровни таких антител, специфических к одному или более из иммуногенов, нежели оценивать все антитела, присутствующие в клетках.
Определять синтезированные антитела можно любым способом, который позволяет идентифицировать те антитела, которые связываются с представляющим интерес иммуногеном, вызывая иммунный ответ. Так, можно использовать любой способ детектирования, который приводит к получению сигнала, который отражает присутствие антитела-мишени. Например, можно использовать связанные с ферментами анализы, в которых растворимый или нерастворимый продукт можно получить из субстрата, количество которого может быть оценено.
Обычно синтезированные антитела можно детектировать, например, с помощью анализа связывания на твердой фазе, например ELISA, где они связываются с антигеном, используемым при анализе, хотя используемый антиген может отличаться от иммуногена, стимулирующего иммунный ответ в начале. Так, хотя оба используемые в анализе антиген и иммуноген, которые стимулировали или стимулируют продуцирование антител in vivo, должны связываться с антителами, подлежащими определению за счет идентичных или очень похожих эпитопов, в других отношениях антиген и иммуноген могут не быть идентичными. Так, хотя антигеном, используемым в способе настоящего изобретения, может быть материал, содержащий все или некоторые части соответствующего иммуногена, например, полученный от инфицированных индивидуумов, или очищенных частей из того же самого материала, антиген может быть также получен синтетическим путем, например, с помощью химического синтеза или рекомбинантной экспрессии, с добавлением или удалением частей, относящихся к природному антигену. Так, можно использовать гибридные белки или молекулы, экспрессирующие только соответствующий эпитоп (эпитопы).
Настоящее изобретение предоставляет ряд преимуществ по сравнению с известными методиками анализа антител. Во-первых, в противоположность методикам, в которых определяют уровни антител в сыворотке (например ELISA сывороток), в способе анализа настоящего изобретения определяют антитела, которые являются показательными для текущей инфекции/иммунной стимуляции, или в случае новорожденных позволяют различить антитела матери и новорожденного. Это оказывается возможным, так как лимфоциты из образца используют непосредственно в способе анализа согласно настоящему изобретению без каких-либо других форм предварительной обработки или стимуляции, например in vitro стимуляции антигеном. Таким образом можно детектировать антитела, которые синтезируются лимфоцитами во время отбора образца. (Таким способом, даже используя очень маленькие объемы образцов, спонтанный протекающий в рассматриваемый промежуток времени синтез антител в ответ на представляющий интерес иммуноген можно отличить от случайной активации лимфоцитов). Кроме того, анализ проводят на лимфоцитах, которые были разрушены на стадии, когда они спонтанно продуцировали и секретировали или начинали секретировать антитела, без стимуляции клеток для проявления какой-либо памяти. Это противоположно другим опубликованным методикам, которые извлекали преимущества из in vitro стимуляции антигеном, что может повысить чувствительность теста, но что выявляет клеточную память, и поэтому не является точной или подходящей методикой для определения полученных в остром периоде или свежесинтезированных антител в ответ на текущую инфекцию или недавнюю вакцинацию.
С другой стороны, настоящее изобретение извлекает преимущество из спонтанной секреции антител, что позволяет определять антитела в крови, свидетельствующие о протекающей инфекции, с помощью тестового антигена; лимфоциты плазмы будут секретировать антитела против тестового антигена в течение нескольких первых недель после инфицирования или вакцинации и т.п. Детектирование таких антител способом настоящего изобретения позволяет диагностировать или определять инфекцию или антительный ответ на вакцинацию в процессе мониторинга и т.д.
Таким образом, в дальнейшем аспекте настоящего изобретения обеспечивается способ диагностики или мониторинга инфекции человека или животного или части указанного животного с помощью иммуногена путем осуществления способа настоящего изобретения и определения наличия или степени инфицирования указанным иммуногеном путем сравнения с соответствующими контрольными и/или сравнительными образцами.
Способ настоящего изобретения особенно полезен для младенцев и новорожденных, когда важно отличить свежесинтезированные антитела от пассивно перенесенных материнских антител. Те же самые содержащие лимфоциты образцы можно проанализировать на антитела против некоторых определенных инфекционных агентов либо в отдельном анализе, либо в том же самом анализе, используя множество соответствующих антигенов, что позволяет использовать родственные контактирующие антигены, соответствующие клиническим синдромам, присутствующим у пациента.
При диагностике инфекции важно также иметь возможность отличать протекающий в рассматриваемое время синтез антител от антител, которые уже присутствуют, как результат предшествующих инфекций. Вызов иммунологической памяти путем антигенной стимуляции in vitro несовместим с анализом, предназначенным для идентификации протекающей в рассматриваемое время инфекции, и поэтому известные ранее способы, основанные на антигенной стимуляции, не имеют такого преимущества. Кроме того, включение стадии антигенной стимуляции снижает благоприятный временной фактор анализа по способу настоящего изобретения, который осуществляется очень быстро по сравнению с известными ранее способами.
Во-вторых, в противоположность методикам, в которых определяют клетки, секретирующие антитела, или активно секретируемые антитела, в способе настоящего изобретения, хотя формы острого синтеза антител и являются основным параметром для определения, нет необходимости поддерживать образец в состоянии, которое промотирует синтез и/или секрецию антител. Это существенно упрощает тест и особенно выгодно по сравнению с известными ранее способами анализа, раскрытыми в WO/26443, где требуется инкубирование лимфоцитов после отбора образца, а также требуется поддержание во время анализа условий, которые позволили бы лимфоцитам продолжать секретирование антител.
Особенно неожиданным преимуществом настоящего изобретения является отсутствие какой-либо стадии инкубирования или специальных условий для анализа, а это означает, что после отбора образцов их удобно обрабатывать для эффективного разрушения или лизиса клеток, и полученный лизат можно затем хранить, например, при охлаждении или замораживании в течение некоторого промежутка времени перед осуществлением стадии анализа.
В другом варианте, как было указано ранее, образец, например, цельной крови или очищенный препарат можно хранить, например, охлажденным или замороженным (в зависимости от обстоятельств) в течение некоторого промежутка времени, например вплоть до нескольких часов или дней, например в течение более 4 часов, перед разрушением клеток. Например, при необходимости или при желании препарат очищенных лимфоцитов можно в течение некоторого времени хранить замороженным, например в течение нескольких часов или дней, или охлажденным, например в течение нескольких часов, перед тем, как образец обрабатывают с целью разрушения или лизиса клеток.
Однако было неожиданно обнаружено, что некоторые образцы, например препараты цельной крови, можно хранить охлажденными в течение более длительного времени без каких-либо вредных воздействий на клетки и искажений результатов тестов. Например, было обнаружено, что образцы цельной крови можно хранить охлажденными (например, при 4°С) в течение по меньшей мере 6 дней, и при желании образцы могут храниться периодически при комнатной температуре (18-25°С) в течение по меньшей мере 6 часов перед началом процедуры очистки лимфоцитов без какого-либо вредного влияния на результаты тестов. Это особенно полезно, если образцы крови находятся на хранении в лаборатории и хранятся охлажденными в ожидании рутинных или дополнительных процедур тестирования плазмы/сыворотки. Это удивительно и неожиданно, так как предполагает, что физическая целостность лимфоцитов сохраняется при хранении, что позволяет осуществлять последующее выделение лимфоцитов из хранящейся крови (при необходимости), и разрушение лимфоцитов происходит без значительного уменьшения определяемых антител.
Таким образом, в предпочтительном варианте перед разрушением лимфоцитов, например, в случаях, когда образцом является кровь, образец может храниться в течение нескольких дней, например вплоть до около 6 дней или более, особенно если он хранится при охлаждении примерно до 4°С, даже может оставаться вынутым из холодильника на прерываемые промежутки времени, например от 4 до 6 часов, например, при комнатной температуре два или несколько раз на протяжении периода хранения без вредного воздействия на результаты анализа. Это особенно полезно, когда образцы крови хранят охлажденными, но при этом нельзя избежать ситуации, когда образец должен оставаться на столе при комнатной температуре в течение короткого промежутка времени. Неожиданно оказалось, что жизнеспособность клеток при этом не изменяется настолько сильно, чтобы исказить результаты или предотвратить получение приемлемых результатов при использовании способа анализа согласно изобретению.
В другом предпочтительном варианте, если используют препараты очищенных лимфоцитов, эти образцы можно хранить при температуре ниже 4°С (например, в течение нескольких дней или дольше) или хранить примерно при 4°С (вплоть до 6 часов). Возможность хранения различных образцов для использования в анализе делает способ настоящего изобретения особенно подходящим для крупных диагностических лабораторий, когда дорогое автоматизированное лабораторное оборудование, например оборудование для ELISA, можно использовать наиболее эффективно, обрабатывая значительное количество образцов одновременно. Это также означает, что образцы можно отобрать во многих различных местах и послать по почте или доставить в центральную диагностическую лабораторию для анализа, осуществляемого таким же образом, как и процедуры, установленные для анализа образцов сыворотки в тестах других типов.
Таким образом в альтернативном аспекте в настоящем изобретении предложен способ определения присутствия или количественного определения свежесинтезированных антител в образце в ответ на иммуноген, включающий в себя
детектирование выделенных антител или их частей в образце, содержащем лимфоциты, которые были разрушены, в результате чего высвободились синтезированные антитела или их части, связанные с указанными лимфоцитами, за счет чего происходит определение присутствия или количественное определение свежесинтезированных антител в указанном образце.
Основным преимуществом настоящего изобретения является то, что требуется лишь небольшой объем образца. Всего 100000 лимфоцитов или даже менее 50000 лимфоцитов могут привести к получению детектируемого сигнала при использовании способа настоящего изобретения. Так как, например, 1 мл крови содержит 1·106 лимфоцитов, при использовании настоящего изобретения для анализа лимфоцитов, полученных из крови, необходимо лишь 50 или 100 мкл крови для получения достаточного количества лимфоцитов для осуществления способа настоящего изобретения. Даже учитывая соответствующие контрольные тесты (например, слепые тесты и позитивные тесты), для получения диагностических результатов достаточно всего 150-300 мкл. Очевидно, что по крайней мере несколько контрольных образцов придется отбросить, если тест стандартизован. Так, обычный тест по способу настоящего изобретения требует, например, 50-500 мкл, предпочтительно 100-300 мкл и обычно 100-200 мкл содержащего лимфоциты образца в объеме, сравнимом со всем образцом. Таким образом, в способе настоящего изобретения можно использовать, например, 5·104-5·105, предпочтительно 1-2·105 лимфоцитов. Это противоположно классическим диагностическим тестам, которые обычно основаны на объемах в несколько мл сыворотки или другой жидкости. Это особенно применимо в случае образцов крови, когда доступны лишь маленькие объемы проб, например, от новорожденных, так как способ настоящего изобретения требует лишь микролитровые объемы, которые можно отобрать, например, капиллярной трубочкой из подходящего места, например мочки уха, кончика пальца или из пятки.
Таким образом, способ настоящего изобретения позволяет использовать маленькие объемы образцов крови (например, мкл объемы менее 1 мл, предпочтительно менее 500 мкл, например менее 100 мкл) непосредственно для детектирования спонтанного продуцирования антител или de novo продуцирования антител за счет нестимулированных лимфоцитов без предварительной стадии прекультивирования лимфоцитов перед анализом.
Антигены или иммуногены, на которые направлены антитела, для детектирования по способу настоящего изобретения включают в себя как бактериальные, так и вирусные антигены. Клинически важные антигены включают в себя (но ими не ограничиваются) те, которые получены, например, из вируса простого герпеса, цитомегаловируса, вируса иммунодефицита человека (HIV) и любого из вирусов гепатита, а также токсоплазм и вируса Эпштейна-Барр (EBV). Вообще, однако, способом настоящего изобретения можно определить любой иммуноген, полученный в результате инфицирования или вакцинации, вызывающий четкую реакцию антител (например, во время острой фазы). В случаях, когда хроническая инфекция приводит к детектируемым уровням антител-мишеней в лимфоцитах, анализ этих антител можно также осуществить в соответствии со способом настоящего изобретения. Так, например, антитела к любому иммуногену, которые можно детектировать, используя обычный метод ELISA, можно детектировать способом настоящего изобретения. Детектирование антител к такому антигену можно использовать для быстрого определения того факта, инфицирован ли пациент, например, с целью скринирования крови или для установления и/или контроля за инфекцией.
Таким образом, в настоящем изобретении предложен способ диагностики или контроля за инфекцией у человека или животного или частей указанного животного, вызванной бактерией или вирусом, причем указанный способ включает в себя получение содержащего лимфоциты образца от указанного животного, определение присутствия или количества свежесинтезированных антител или их частей, связанных с указанными лимфоцитами, направленных против указанной бактерии или вируса, в соответствии с раскрытым здесь способом и определение наличия или степени инфицирования указанной бактерией или вирусом путем сравнения с соответствующими контрольными и/или сравнительными образцами.
Способ особенно полезен благодаря его простоте и может быть использован в случаях, когда недоступно сложное оборудование, например в полевых условиях. Так как не требуется инкубирования как части аналитического метода, он легко может быть автоматизирован, но также относительно быстро и просто осуществить клеточный лизис и детектировать антитела в ситуации, когда сложное оборудование недоступно.
Далее способ настоящего изобретения будет раскрыт более подробно. Предпочтительно, чтобы первая стадия способа включала в себя выделение лимфоцитов из образца. Однако, как было указано выше, препарат очищенных лимфоцитов вовсе не необходим и вместо него можно использовать препарат, из которого удалена основная часть плазменных антител. Предпочтительно, чтобы такой препарат содержал менее 15% антител, соответствующих антителам плазмы, присутствующим в образце, например, менее 5%, предпочтительно менее 1%. Обычно этого можно достичь, используя препарат, который практически не содержит плазмы (например, менее 5% (об./об.), например, препарат, который не содержит плазмы). Препарат лимфоцитов можно приготовить, используя стандартные методики, хорошо известные специалистам, например, используя способы фильтрования, или способы с использованием абсорбентного материала, или препаративный набор для лимфоцитов. Так, например, обычно удобно использовать различные препараты цельной крови для получения лимфоцитов, например, из гепаринизированной крови, EDTA-крови и т.д., такие как те, которые обычно приготавливают в клинических лабораториях. Следует учитывать, что все обогащенные или очищенные препараты должны содержать лимфоциты, присутствующие в том образце, из которого получен препарат, для того чтобы можно было определить спонтанную или de novo продукцию антител.
Лимфоциты предпочтительно выделить, например, используя стандартную среду для выделения лимфоцитов, например Lymphoprep (Nycomed Pharma AS, Oslo, Norway), или используя иммуномагнитное выделение (IMS), или аналогичную систему выделения с использованием твердой фазы, или другие обычные методики. В случае IMS или аналогичных методик выделения твердую фазу, например магнитные шарики, покрытые антителом, специфичным для определенных наборов лейкоцитов, можно использовать для селективного выделения нужных лимфоцитов. Если используют выделенные лимфоциты, клетки можно промыть перед использованием, используя стандартные способы промывки. Предпочтительно, чтобы лимфоциты были промыты для удаления всех плазменных антител, которые могут присутствовать после выделения клеток. Обычно для осуществления изобретения примесь плазменных антител в клетках лимфоцитов поддерживают на минимальном уровне, предпочтительно менее 20 нг плазменного IgG на 100 мкл образца, что соответствует коэффициенту конечного разбавления плазмы примерно 1:50000, например ниже, чем около 0,5 нг сывороточного IgG на 100 мкл образца. Однако было отмечено, что для достижения этого не требуется избыточной или интенсивной промывки клеток. Например, было обнаружено, что просто центрифугируя цельную кровь, трижды разбавленную буферами примерно в тех же условиях вращения, можно получить препарат лимфоцитов, достаточно свободный от загрязняющих антител сыворотки/плазмы. Для более подробного изложения см. пример 3.
Вообще говоря, способ настоящего изобретения позволяет избежать необходимости инкубирования лимфоцитов из образца перед осуществлением анализа. Однако следует учитывать, что если клетки содержать в течение короткого промежутка времени в условиях, которые позволяют продолжить продуцирование или секрецию антител, перед разрушением лимфоцитов, способ настоящего изобретения все еще позволяет произвести оценку свежесинтезированных антител, связанных с лимфоцитами.
Подлежащие анализу образцы, которые были обработаны, как указано выше, если это требовалось для выделения лимфоцитов, затем разрушают для выделения свежесинтезированных антител. Это можно осуществить любым удобным известным специалистам способом, который эффективно разрушает внешние и внутренние мембранные структуры, не влияя на способность выделившихся антител связываться с их комплементарными эпитопами, например, в результате использования детергентов, хаотропных агентов, разрушающих буферов, например буферов, содержащих EDTA, или других альтернативных способов разрушения, таких как обработка ультразвуком или физическое разрушение в результате создания усилия сдвига. Однако предпочтительно использовать разрушающий буфер, так как это наиболее простой и удобный способ, например, как это описано далее в примерах, т.е. буфер, содержащий детергент, такой как 0,5% дезоксихолат. Подходящие разрушающие буферы можно использовать для стабилизации выделенных антител, например для контроля рН или разложения. Так, например, при необходимости можно использовать буферы, содержащие ингибиторы протеазы. Альтернативные способы разрушения включают в себя, например, использование циклов замораживания/оттаивания или даже использование жидкого азота. Это приводит к получению лизата, в котором выделившиеся антитела находятся в растворе, который и используют на последующих стадиях. Следует учитывать, что для получения достаточных количеств свежесинтезированных антител в подлежащем определению образце желательно, чтобы было разрушено как можно больше клеток лимфоцитов для выделения антител. Затем предпочтительно, чтобы средства для разрушения были для этого приспособлены и чтобы в образце было разрушено, по меньшей мере, 40% или 50%, более предпочтительно по меньшей мере 60%, 70% или 80% и наиболее предпочтительно по меньшей мере 90% или 95% лимфоцитов. После разрушения лимфоцитов определяют содержание антител в образце с помощью соответствующих методик, которые позволяют детектировать антитела-мишени. Для достижения этого удобно осуществить контактирование образца с твердой фазой, содержащей связывающий партнер, для иммобилизации антитела или антител, подлежащих определению. Удобно, чтобы связывающим партнером был антиген (иммуноген) или антигены (т.е. один или более), распознаваемые подлежащим определению антителом или антителами, или их частями. Таким образом в одном из вариантов настоящего изобретения предложен способ определения присутствия или количества свежесинтезированных антител в образце, причем указанный способ включает в себя осуществление контактирования аликвот указанного образца, или необязательно лимфоцитов, непосредственно выделенных из указанного образца, где указанные лимфоциты были разрушены, чтобы выделились антитела или их части, связанные с указанными лимфоцитами, с одним или более из антигенов, предпочтительно нанесенных на твердую фазу, распознаваемых подлежащим определению антителом или антителами; детектирование связывания антитела с указанным антигеном (антигенами); и сравнение указанного связывания антител с контрольными и/или сравнительными образцами, в результате чего достигают определения присутствия или количества свежесинтезированных антител в ответной реакции на указанный антиген (антигены). В вышеуказанном способе контрольные или сравнительные образцы могут быть как негативными, так и позитивными контрольными образцами, например слепыми, нормальными образцами или spiked образцами.
Можно также использовать альтернативные связывающие партнеры, например белок А, белок G, или антитела, которые распознают и связываются с подлежащим определению антителом.
В последнем случае не требуется высокой специфичности связывания, так как специфичность привносится в этом варианте способа анализа последующим связыванием антигенов, которые специфически связываются с подлежащими определению антителами. Так, во всех вариантах образуется специфический комплекс антиген-антитело. Присутствие таких комплексов, предпочтительно иммобилизованных на твердой подложке, устанавливается на стадии детектирования в способе настоящего изобретения. Так, в предпочтительном варианте стадия детектирования в способе настоящего изобретения включает в себя детектирование выделившихся антител или их частей за счет образования комплекса антитело-антиген, где указанный антиген (который предпочтительно не является антителом) включает в себя или содержит иммуноген или его часть, содержащую по крайней мере эпитоп иммуногена.
Твердой фазой (если ее используют) может быть любой из хорошо известных носителей или матриц, которые в настоящее время широко используются или предлагаются для иммобилизации, выделения и т.д. Они могут принимать форму частиц, листов, гелей, фильтров, мембран или микротитровальных полосок, ампул или планшетов и т.д. и обычно изготавливаются из полимерных материалов. Однако для облегчения работы можно использовать и простые стандартные микротитровальные планшеты и лунки, предпочтительно стандартные планшеты для ELISA.
Твердую фазу можно также модифицировать, чтобы обеспечить возможность определения антител, специфических для ряда различных антигенов. Так, например, диски или полоски и т.д. подходящего твердофазного материала, например нитроцеллюлозы или чего-либо подобного, можно покрыть различными антигенами и добавить одновременно в лунки микротитровальных планшетов или в другие подходящие объемы, которые не содержат каких-либо контактирующих антигенов. Методы определения связывания антител могут быть использованы затем для установления различий между разными антителами. Если используют анализы типа сэндвич-анализа, удобно, чтобы твердая фаза содержала один или более антигенов (антигены твердой фазы), распознаваемых антителом, или антителами, или их частями, подлежащими детектированию (антитела-мишени). В другом варианте твердая фаза может содержать одно или более из антител (антитела твердой фазы), которые распознают антитело, или антитела, или их части, подлежащие детектированию (антитела-мишени). Чтобы обеспечить возможность определения в соответствии со способом настоящего изобретения, соответствующим образом (в зависимости от того, нанесены ли на указанную твердую подложку антитела или антигены, как указано выше) один или более из антигенов, распознаваемых антителами-мишенями, иммобилизованными на указанной твердой фазе, подвергают контактированию с указанной твердой фазой или альтернативно одно или более антител, которые узнают антитела-мишени, иммобилизованные на указанной твердой фазе, приводят в контакт с указанной твердой фазой. Эти антигены или антитела, которые затем оказываются связанными с твердой подложкой, можно соответствующим образом пометить, чтобы обеспечить детектирование, как будет раскрыто далее.
Наборы дисков, каждый из которых покрыт соответствующими антигенами, соответствующими некоторым клиническим состояниям или синдромам, можно использовать для определения того, который из предполагаемых агентов является причиной заболевания. Затем диски индивидуально должны быть обработаны в отдельных лунках. Такая процедура позволяет существенно сэкономить материалы, так как тесты можно осуществлять для одновременного тестирования множества различных антигенов (либо от того же самого инфекционного агента или различных агентов, соответствующих в каждом случае клиническому синдрому или состоянию), используя те же самые маленькие объемы крови. Альтернативный подход состоит в использовании множества образцов разрушенных лимфоцитов, т.е. в отдельных лунках, каждая из которых покрыта различными связывающими партнерами, например антигенами или антителами, и в проведении теста соответствующим образом.
Способы связывания связывающих партнеров, например антигена с твердой фазой, также широко известны и подробно описаны в литературе. Многие стандартные процедуры нанесения антигенов раскрыты, например, для ELISA и других твердофазных иммуноанализов (Theoretical and Practical Aspects; 1988, ed. D.M.Kemeny & S.J.Challacombe, John Wiley & Sons). При желании планшеты можно промыть и блокировать, снова используя стандартные методики. Так, например, стандартные микротитровальные планшеты, например планшеты для ELISA, можно просто покрыть связывающим партнером, путем инкубирования планшетов в течение ночи при 4°С в подходящем буфере, например в забуференном фосфатом физиологическом растворе (PBS), содержащем связывающий партнер, например, в концентрации от 0,01 до 150 мкг/мл белка, с последующим блокированием, используя соответствующую блокирующую среду (обычно нейтральный буфер, такой как PBS, содержащий блокирующий белок, например сыворотку теленка или белки из сухого молока) и инкубируя, например, при 37°С в течение 1-5 часов. После удаления блокирующего раствора планшеты готовы к использованию.
Однако удобно, чтобы материалы, необходимые для осуществления способа настоящего изобретения, были в виде набора, в котором твердая подложка поставляется с уже нанесенным связывающим партнером и соответствующим образом блокированным.
Может оказаться желательным разбавить суспензию образца с разрушенными лимфоцитами перед стадией осуществления контактирования, и при этом используют обычный интервал разбавлении клеток в образце. Разбавления обычно осуществляют, используя в качестве разбавителя буфер, в котором лимфоциты разрушаются.
Затем определяют связывание антитела с его антигеном. Стадию детектирования в единицах считываемого сигнала удобно вести в растворе. Однако можно создать нерастворимый продукт или сигнал, который не считывают в растворе. Можно использовать любые известные средства детектирования связывания антител, если только при этом создается считываемый сигнал, например в зависимости от реакции флуоресценции, хемилюминесценции, с помощью колориметрии или ферментативной реакции, когда возникает детектируемый сигнал. Если не используют твердую фазу, выделившиеся антитела можно детектировать любым другим чувствительным серологическим способом, таким как рассеяние света (например, нефелометрия) и резонансными методами. Обычно можно использовать иммуноанализ в качестве способа детектирования и предпочтительно твердофазный иммуноферментный анализ (ELISA). Однако в рамках настоящего изобретения для определения антител можно использовать тестовые процедуры, отличные от ELISA. Могут оказаться подходящими методики, в которых используют диски или стеклянные планшеты с нанесенным покрытием, например, заполненные суспензией разрушенных лимфоцитов. Любые стандартные методики для детектирования антител, известные специалистам, такие как методики, приводящие к получению нерастворимого или растворимого продукта, можно адаптировать для использования в способе настоящего изобретения, либо для количественного анализа, либо для качественного (например, да/нет) теста.
Иммуноанализ, и в частности ELISA, хорошо известен специалистам и описан в литературе (см., например, ELISA и другие твердофазные методы иммуноанализа Theoretical and Practical Aspects; 1988, ed. D.M.Kemeny & S.J.Challacombe, John Wiley & Sons).
После контактирования образца разрушенных лимфоцитов можно добавить конъюгат фермент-антитело, например, в способе детектирования ELISA, который связывает антитело, связанное с антигеном на твердой фазе. Аналогично, если подлежащее определению антитело связано с твердой фазой неспецифично, за счет связывающего партнера, например антителом против антител отличающихся видов, можно добавить конъюгат фермент-антиген, который специфично связывается с подлежащим определению антителом. Затем добавляют ферментный субстрат для создания детектируемого сигнала. В способе настоящего изобретения обычно используют растворимый субстрат, получая сигнал, определяемый в растворе. Это выгодно, так как облегчает и упрощает манипуляции и обработку большого числа образцов и позволяет оценить продуцирование антител, хотя, как было указано выше, необязательно получают количественный или полуколичественный результат. Для удобства можно выбрать такой субстрат, чтобы получить сигнал, детектируемый спектрофотометрически, который можно было бы считывать, просто считывая поглощение, например, используя стандартное считывающее устройство для ELISA планшетов. Действительно, можно использовать стандартные реагенты для ELISA, что определяет то преимущество, что обеспечивает совместимость анализа настоящего изобретения с существующими рутинными способами и методиками, используемыми в клинических лабораториях. Однако можно использовать и другие системы, продуцирующие сигналы, детектируемые с помощью флуоресценции, хемилюминесценции и т.д.
Возможно также использование методик иммуноферментной амплификации для усиления сигнала и повышения чувствительности, например, с использованием методов авидин-биотина, таких как система Extravidin, доступная от Sigma. Биотинилированные вторичные антитела используют в качестве ELISA-реагентов в сочетании с пероксидазным авидиновым комплексом. Так как одна молекула авидина способна связывать несколько молекул биотина, использование авидин-биотиновых пероксидазных комплексов повышает поверхностную концентрацию молекул пероксидазы, еще более, таким образом, повышая чувствительность метода.
Материалы и средства, необходимые для стадии разрушения лимфоцитов и стадии детектирования связывания антител, можно с удобством поставлять в форме набора вместе с твердой фазой, покрытой связывающим партнером.
Информация, полученная с помощью анализа настоящего изобретения, может быть дополнена с помощью других методов анализа. Дополнительные и полезные данные о существовавших ранее в сыворотке/плазме антителах можно получить в классическом ELISA тесте. Кроме того, после выделения лимфоцитов из образца крови оставшуюся плазменную жидкость можно использовать для определения существовавших ранее антител, используя ту же самую твердую фазу, покрытую связывающим партнером, которую используют в анализе по способу настоящего изобретения.
Для того чтобы удостовериться в том, что способ анализа согласно изобретению работает надежно, можно включить соответствующие контрольные образцы и использовать их для определения присутствия или количества свежесинтезированных антител. Например, для того чтобы удостовериться, что регистрируемый сигнал из тестовых ячеек не связан со спорадически и неспецифически (побочно) активированными лимфоцитами, используют негативный контрольный антиген. Этот антиген должен быть получен от инфекционного агента, который наименее всего мог бы быть ответственным за острое заболевание пациента, например токсоид столбняка. Количество таких побочных активированных лимфоцитов во всяком случае будет значительно меньше, чем необходимо для позитивных результатов теста, проводимого по способу согласно изобретению. Этот момент учитывается в настоящем изобретении.
Как было указано выше, благодаря легкости и скорости выполнения операций, а также их простоте, анализ по способу настоящего изобретения пригоден для диагностических или других клинических или ветеринарных применений, например при разведении рыб. Помимо небольших объемов образцов другим преимуществом является то, что требуется только один образец, а не пара образцов сыворотки, полученных с 2-3-недельными интервалами, что требуется для большинства обычных серологических тестов. Трудоемкая инструментальная обработка не нужна, и анализ легко автоматизировать. Кроме того, возникает возможность при необходимости тестировать на предмет различных иммунологических изотипов.
Вышеуказанный способ анализа согласно изобретению обеспечивает один способ для оценки наличия или степени существующей инфекции с помощью анализа спонтанной экспрессии специфических антител к определенному антигену. Такой способ легко применим для оценки степени заболевания, которое известно и для которого доступны антигены, родственные соответствующему иммуногену, и таким образом обеспечивают специфический маркер инфекции. Однако в некоторых клинических ситуациях специфическое заболевание или инфекцию нельзя идентифицировать и/или соответствующий антиген недоступен для проведения анализа. В таких случаях анализ можно модифицировать, чтобы оценить наличие или степень неспецифических индикаторов инфекции. Так, например, содержащие лимфоциты образцы, например цельная кровь или полученные из нее обогащенные лимфоцитами препараты, можно исследовать в отношении продуцирования ими инфекционных маркеров, например цитокинов или интерферонов, например IL-2, IL-4 или интерферона-γ.
Так, в еще одном аспекте настоящего изобретения предложен способ определения присутствия или количества индикаторов инфекции в образце в ответной реакции на иммуноген, включающий в себя
получение образца, содержащего лимфоциты;
разрушение указанных лимфоцитов, за счет чего выделяются подлежащие определению индикаторы инфекции;
детектирование выделенных индикаторов инфекции, в результате чего определяют присутствие или количество индикаторов инфекции в указанном образце.
Для осуществления этого способа можно выбрать твердую фазу с соответствующими захватывающими молекулами, например антителами к индикаторам инфекции, для детектирования. Для определения присутствия указанных индикаторов инфекции, иммобилизованных на твердой фазе, можно использовать способы, изложенные ранее, например, используя меченные антитела или лиганды. В этом способе можно идентифицировать специфические маркеры за счет соответствующего выбора иммобилизующего фрагмента или молекулы для детектирования. Так, например, все белки в образце можно иммобилизовать на твердом носителе и детектирование можно осуществить, используя меченное специфическое антитело или лиганд. В другом варианте можно использовать специфический связывающий партнер для иммобилизации соответствующих индикаторов инфекции, которые затем можно соответствующим образом пометить, либо позитивно, либо негативно, например, в первом случае связывая с доменом, присутствующим на индикаторе инфекции, но не исключительно с этой молекулой, или во втором случае вводя метку в несвязанный связывающий партнер на твердой фазе. Наборы для осуществления этого способа также составляют часть настоящего изобретения.
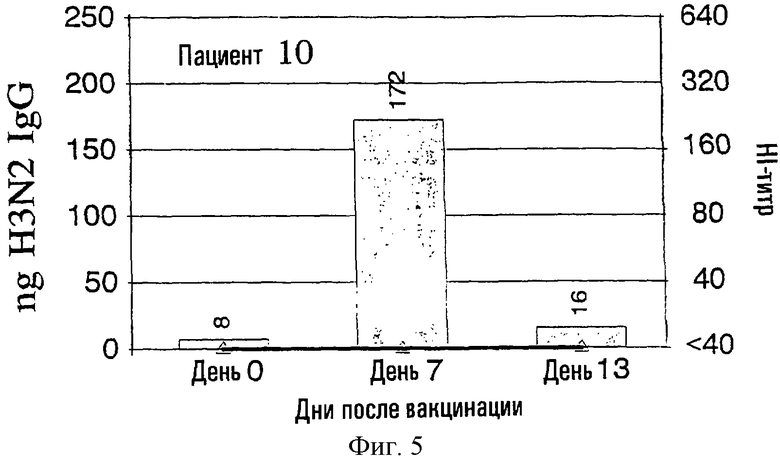
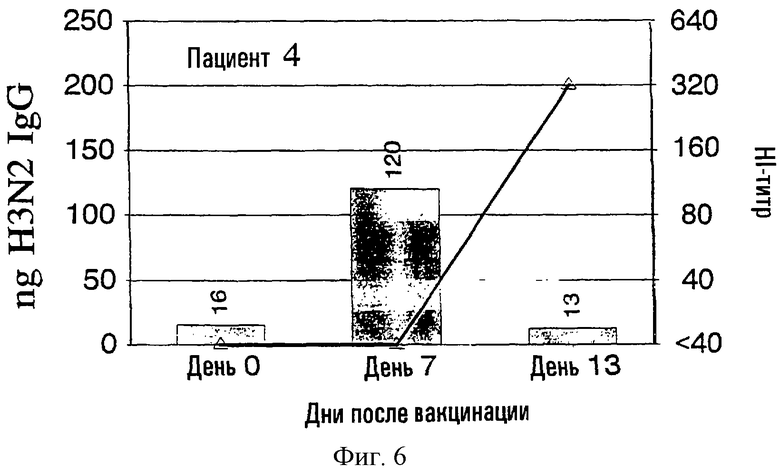
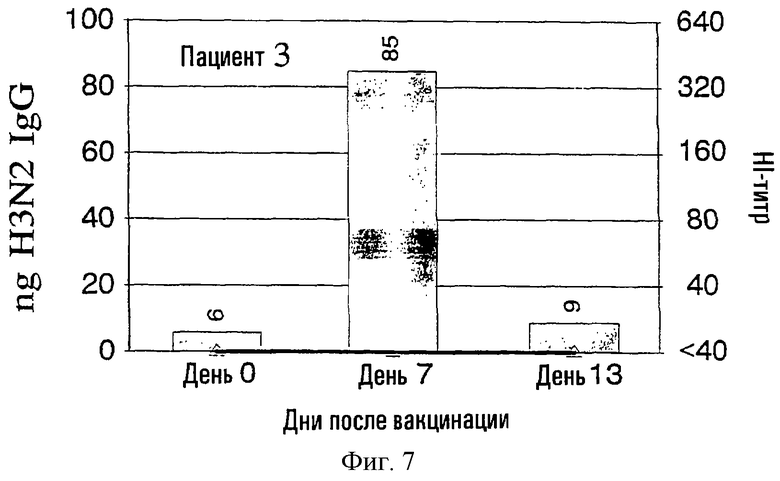
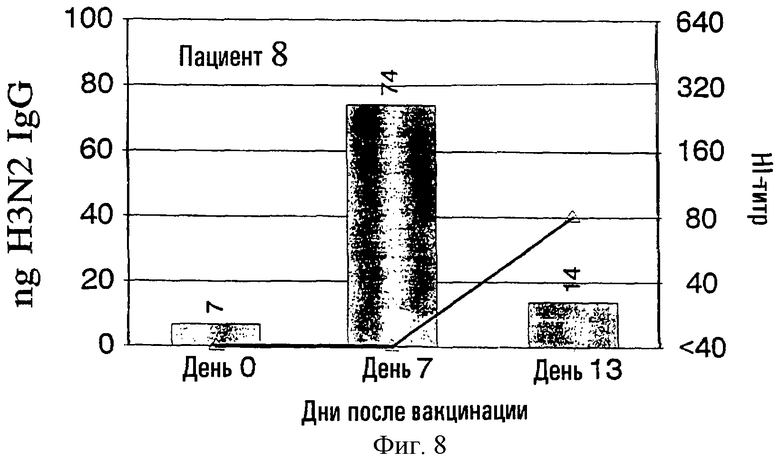
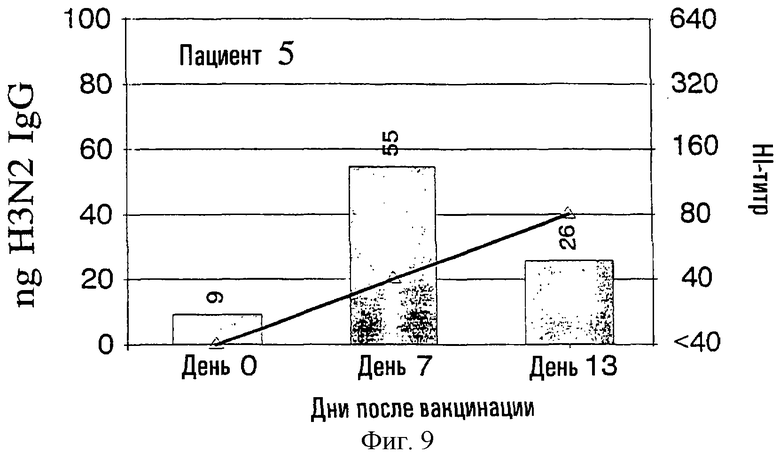
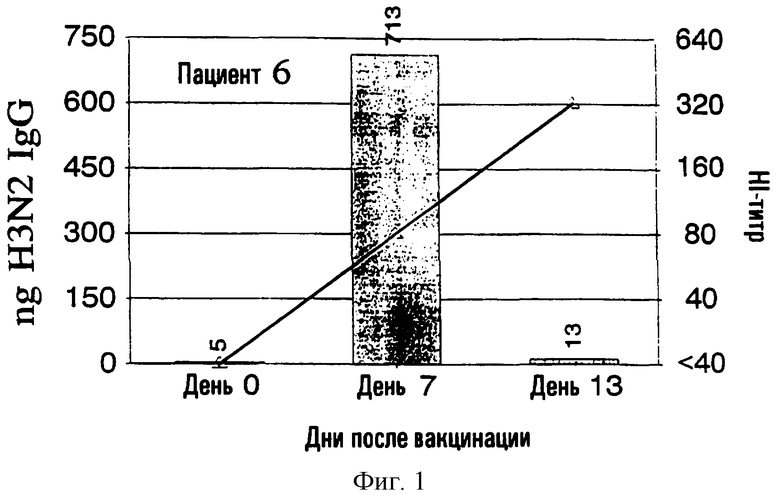
На фиг.1-9 показаны результаты клинических испытаний вакцины гриппа, в которых образцы от 9 субъектов (пациенты 2-10) были тестированы с использованием метода разрушения лимфоцитов. На левой шкале (ось ординат) каждого графика показана величина H3N2 IgG в нанограммах в зависимости от дней, прошедших после вакцинации, отложенных на горизонтальной шкале (ось абсцисс). На каждый из прямоугольников графика наложена пунктирная линия, демонстрирующая HI-титр на правой шкале для вируса A/Nanchong. См. примеры 1 и 2 для выяснения дополнительных подробностей.
Далее настоящее изобретение будет раскрыто более подробно со ссылкой на следующие нелимитирующие примеры.
Пример 1
Специфичность
Пациент: Инициалы LOH, мужчина, 25 лет. Образец крови взят через 9 дней после первого дня классического клинического гриппоподобного заболевания. В локальном окружении зарегистрирована смешанная эпидемия, вызываемая вирусами гриппа А и В.
Выделение лимфоцитов: Получают образец гепаринизированной периферической венозной крови. Лимфоциты выделяют, используя Lymphoprep (Nycomed Pharma AS, Oslo) в соответствии с инструкциями изготовителя, за исключением того, что образец гепаринизированной крови смешивают с двойньм (вместо равного) объемом физиологического солевого раствора, забуференного фосфатом (PBS, рН 7,2), перед первой стадией центрифугирования. Осуществляют два дополнительных цикла промывки осадка клеток. Число лимфоцитов подсчитывают с помощью гемоцитометра, используя метод исключения Blue Dextrane.
Разрушение лимфоцитов: Определенные количества лимфоцитов разрушают с помощью разрушающего буфера DISRUPTION BUFFER 10 мМ Tris HCl (рН 7,4), содержащего 0,5% дезоксихолата, 2 мкг/мл пепстатина A (Sigma. P-4265, lot 18H0551), 2 мкг/мл лейпептина (Sigma L-0649, lot 77H86221), 0,5% апротинина (Sigma A-6279, lot 87H7010), 1 мМ PMSF (Sigma P-7626, lot 48Н1265) (на основании ссылки: Spector DL, Goldman RD, Leinwand LA. Cells. A Laboratory Manual. Cold Spring Harbor Laboratory Press, New York, 1998, Vol.1:74.6) и подвергают тестированию с помощью ELISA (см. таблицу 1).
Нанесение покрытия и блокирование планшетов ELISA:
Greiner-микропланшет F-формы со средней связывающей способностью. Cat №655001 (lot 98 26 01 48), D-72636 Frickenhausen, Germany. Вирусные антигены (подарок Solvay-Duphar, Holland) для тестирования на гриппозные антитела: поверхностные антигены A/Nanchang/933/95 (H3N2), 10 мкг/мл в PBS, 100 мкл/лунку.
Поверхностные антигены B/Harbin/07/94, 10 мкг/мл в PBS, 100 мкл/лунку. Для тестирования на все антитела IgG: козий античеловеческий IgG (специфический для γ-цепей) Sigma I-7883 (lot 76H8895) используют в разбавлении 1:500 в PBS, 100 мкл/лунку. Покрытие в течение ночи при 4°С. Блокирование осуществляют, используя PBS с 10% фетальной телячьей сывороткой (FCS) в течение 1 часа при комнатной температуре. Между всеми последующими стадиями иммунопланшеты промывают по 5 раз PBS, 0,05% Tween-20.
Выкладка образцов на планшеты: Тесты на гриппозные IgG-антитела и IgG-антитела вообще осуществляют на тех же самых иммунопланшетах, так же, как и стандартах - человеческих IgG. Все образцы тестируют в дубликатах.
Тестируемые образцы: Подлежащие тестированию образцы:
LOH "сыворотка" (разбавление плазмы 1:3). Чистый и 10-кратно разбавленный в PBS, 0,05% Tween-20 и 5% FCS (разбавитель), 100 мкл/лунку. IgG-стандарт: Sigma 1-4506 (lot 96H8840): 10 мкг IgG/мл, 10-кратные разбавления в PBS 0,05% Tween-20 и 5% FCS, 100 мкл/лунку.
Конечный объем осадка клеток 300 мкл был в растворе PBS, разбавленном сывороткой 1:9368. К этому осадку добавляют 700 мкл PBS (разбавление = 1:3,33). Конечный осадок содержит 2,0·107 клеток и содержит сывороточную примесь 1:31200. Конечная тестированная надосадочная жидкость была эквивалентна разбавлению сывороткой 1:9370.
Клеточные лизаты: Лизаты устанавливают эквивалентными 800000, 200000 и 50000 клеток/лунку, 100 мкл/лунку.
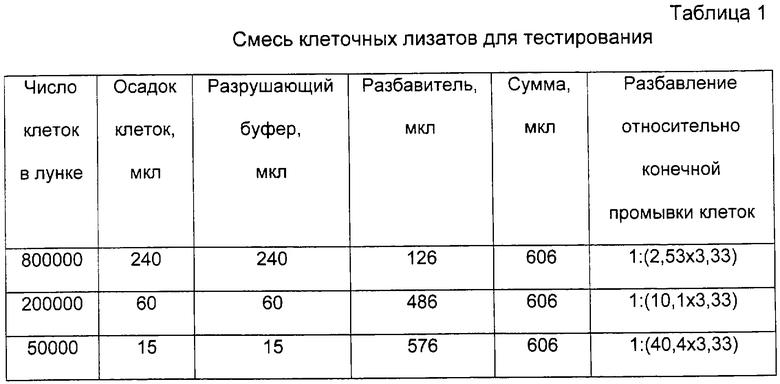
Примесь сывороточных антител относительно конечной промывки клеток в клеточных препаратах рассчитана как:
1:8,4 (10,6%) для 800000 клеток,
1:33,7 (2,9%) для 200000 клеток,
1:134,8 (0,7%) для 50000 клеток.
Все образцы антител инкубируют в течение 90 минут при комнатной температуре.
Вторичное антитело: Меченный биотином козий античеловеческий IgG (специфический для γ-цепи), Sigma B-1140 (lot 96Н8886), используют при 1:500 в PBS с 0,05% Tween-20 и 5% FCS, 100 мкл/лунку. Инкубируют в течение 60 минут при комнатной температуре.
Конъюгат: Extravidin пероксидазный конъюгат, Sigma E-2886 (lot 28Н4824), разбавленный 1:1000 в PBS с 0,05% Tween-20 и 5% FCS, 100 мкл/лунку. Инкубируют в течение 60 минут при комнатной температуре.
Проявление: Таблетки субстрата (о-фенилендиаминдигидрохлорид), Sigma P-8287 (lot 88H8250). Одну таблетку (10 мг) растворяют в 25 мл 0,1 М фосфат-цитратном буфере, рН 5,0, дополненном 20 мкл пергидроля (30% Н2O2). Добавляют 100 мкл/лунку раствора субстрата и реакцию останавливают через 10 минут, добавляя 50 мкл/лунку 1 М H2SO4. Оптическую плотность считывают при 492 нм, используя считывающее устройство Titertek Multiskan PLUS (Flow Laboratories).
Результаты
Оценка количества IgG основана на интерполяции стандартной кривой, полученной при разбавлении IgG-стандарта. Все тестовые образцы тестировали в дубликате и значения оптической плотности использовали для последующих расчетов.
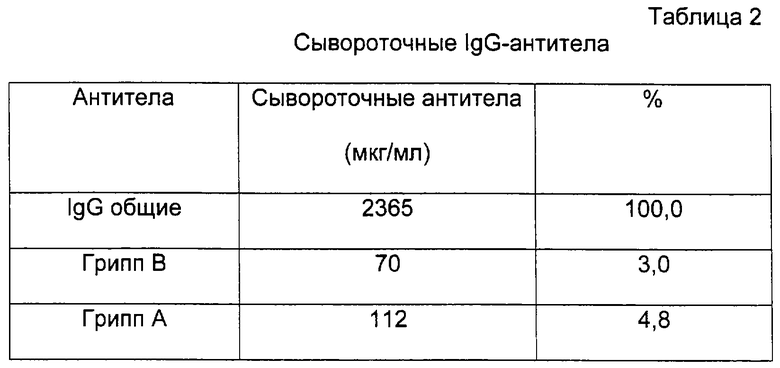
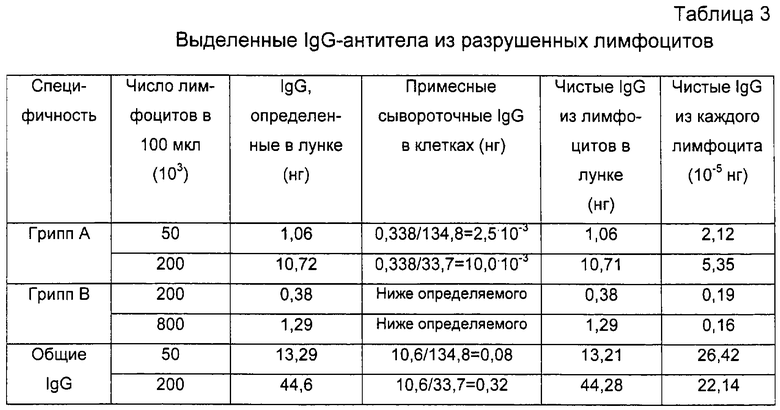
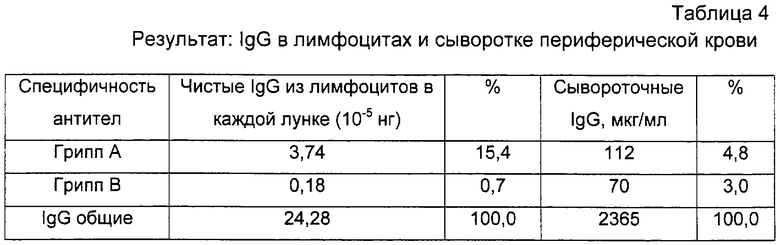
Вывод: Пациент LOH был инфицирован вирусом гриппа А, что очевидно из таблицы 3. Используя эти данные, можно предположить, что 100000 лимфоцитов/лунку должны соответствовать примерно 20 нг/мл антител IgG гриппа А, в противоположность примерно 2 нг/мл для антител гриппа В. Первая концентрация клеток для практических целей дает сигнал ELISA для антител, специфических для гриппа А, который удобно измерить, но это не происходит для антител для гриппа В. Все происходит наоборот для уровней гриппозных антител, измеренных в сыворотке (таблица 2), где уровни антител для гриппа А и В очень похожи. Такие сывороточные антитела, наиболее вероятно, являются существовавшими перекрестно-реактивными антителами от прежних экспонирований. Было известно и продемонстрировано в течение многих лет, что "гриппозная память" может быть реактивирована при последующем экспонировании гетерологичным вирусам, так называемый "антигенный след", наиболее вероятно за счет локальных побочных эффектов в лимфоидных тканях, где происходит начальный иммунный процессинг.
Причина, по которой в нашем тесте антитела из разрушенных лимфоцитов также дали измеряемый слабый сигнал ELISA для антигена гриппа В, т.е. вируса, который не был причиной заболевания пациента LOH, может быть следствием такой неспецифичной реактивации памяти лимфоцитов, как следствие иммунной атаки вируса гриппа А. Однако такая неожиданная реактивация клеток памяти, как считают, является связанным с гриппом явлением и не будет сопровождать другие инфекционные агенты. Так, следует ожидать, что можно будет наблюдать еще более четкое различие между сигналами, полученными для антигенов из рассматриваемого инфекционного агента и других агентов.
Рассматриваемый способ требует около 100 мкл гепаринизированной крови (что соответствует 100000 лимфоцитов) для каждого антиген-специфического подлежащего тестированию антитела, что позволяет использовать образцы крови из капилляров.
Пример 2
Кинетика
Это клиническое испытание вакцины против гриппа. Были зарегистрированы девять здоровых пациентов: 6 женщин в возрасте 24-27 лет (среднее 26,2) и 3 мужчин в возрасте 24-31 год (среднее 28,3). Лечащий врач информировал их о существующих противопоказаниях для вакцинации, и все они сообщили врачу, что не имеют никаких противопоказаний. Ни один из них не был вакцинирован против гриппа ранее. Все вакцины были использованы в испытаниях и позволили отобрать образцы крови, как это указано далее. Пациентам была введена лицензированная тройная вакцина из инактивированных цельных вирусов (Vaxigrip), содержащая:
A/Sydney/5/97H3N2)-подобный вирус, содержащий 15 мкг гемагглютинина/дозу;
A/Beijing/262/95(H1N1)-подобный вирус, содержащий 15 мкг гемагглютинина/дозу;
B/Beijing/I84/93-подобный вирус, содержащий 15 мкг гемагглютинина/дозу,
от Meriex Serums & Vaccines (Франция).
Гепаринизированные образцы крови отбирали, как указано в примере 1. Все процедуры проводили по способу примера 1, за исключением того, что лимфоциты разрушали в циклах замораживания/оттаивания (дважды), погружая ампулы с лимфоцитами в жидкий азот и выдерживая в проточной водопроводной воде.
Дополнительно был проведен тест гемагглютинирования-ингибирования (HI) с образцами плазмы, обработанными разрушающим рецепторы ферментом, в соответствии со стандартными процедурами Kendal et al., 1982, в "Concepts and Procedures for Laboratory-Based Influenza Surveillance", Viral Disease Unit, WHO, Geneva, используя 4 гемагглютинирующие единицы вируса A/Nanchang и 0,7% эритроцитов индейки. Плазму тестировали на стадиях с двукратным разбавленем, и титры подсчитывали как обратную величину высшего разбавления, обеспечивающего полное ингибирование вирусной гемагглютинации. Использовали образцы, полученные в день вакцинации, через 7 дней и через 13 дней.
Результаты
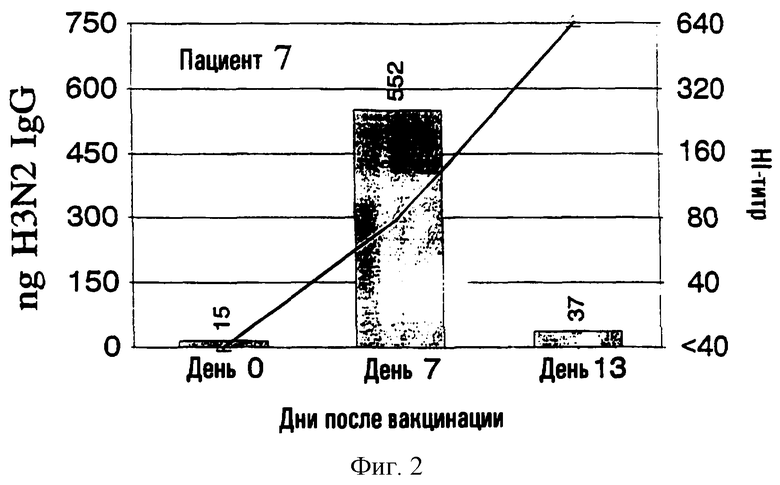
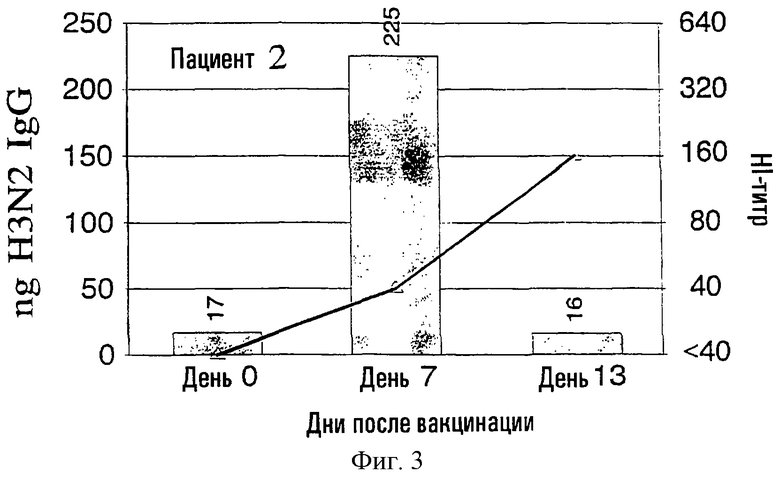
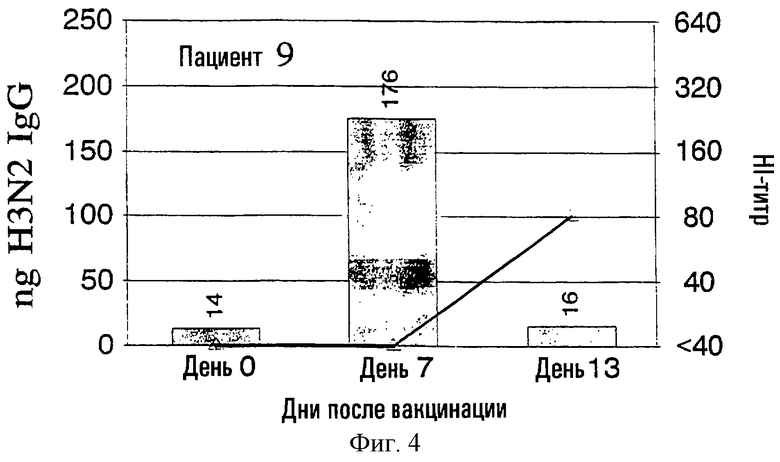
На фиг.1 представлено количество (в нг) IgG в зависимости от поверхностных антигенов из родственных A/Nanchang/933/-95(H3N2) (см. пример 1) с использованием растворов, полученных из 300К разрушенных лимфоцитов для каждого из девяти вакцинированных пациентов (прямоугольники). Они расположены в соответствии с количеством гриппозных специфических IgG-антител, полученных из разрушенных лимфоцитов. Шкала слева для нг IgG не одинакова для всех пациентов. Путем наложения представлены HI-титры (пунктирная линия) против вируса A/Nanchang. Титр, больший или равный 40, по международному соглашению считается защитным.
Выводы
Классически HI-антитела рассматриваются как "золотой стандарт" антител против гриппа наряду с нейтрализующими вирус антителами. HI-титры, равные или большие 40, рассматриваются как защитные на основании международных соглашений. На фиг.1 показано, что четверо из девяти пациентов (пациенты 2, 5-7) обрели такие антитела на 7 день, и у всех пациентов, кроме пациентов 3 и 10, такие HI-титры были на 13 день. У всех пациентов наблюдались высокие уровни специфических для гриппа IgG, определенные в разрушенных лимфоцитах уже на 7 день, а для пяти пациентов (пациенты 3, 4, 8-10) только антитела из разрушенных лимфоцитов, и никакой уровень защитных HI-антител не определялся на 7 день.
Кроме того, специфичность гриппозных IgG-антител была очевидна по появлению таких антител на 7 день и исчезновению тех же антител на 13 день, так как на 13 день у большинства пациентов были значительные уровни сывороточных антител.
Пример 2 четко показывает, что детектируемые антитела из разрушенных лимфоцитов не имеют примеси сывороточных антител, заключенных в осадке лимфоцитов, что было также четко продемонстрировано в примере 1.
Пример 3
Упрощенный способ очистки лимфоцитов от примесей антител сыворотки/плазмы
Обычно лимфоциты, достаточно свободные от примесных антител из сыворотки/плазмы, можно выделить на трех последовательных стадиях центрифугирования. 300 мкл цельной крови смешивают с 10 мл разбавителя, состоящего из 2 частей PBS и одной части дистиллированной воды. Эту смесь центрифугируют в течение 20 минут при комнатной температуре и 400·g. Надосадочную жидкость сливают и к осадку добавляют 10 мл PBS. Суспензию центрифугируют в указанных выше условиях и цикл повторяют еще раз. Конечный осадок, суспендированный в 100 мкл PBS, используют в качестве источника лимфоцитов для последующего анализа.
Пример 4
Хранение крови перед выделением лимфоцитов
Пациенту-мужчине (EJAa, 20 лет) провели вакцинацию лицензированной тройной инактивированной вакциной против гриппа в соответствии с рекомендациями изготовителя (см. пример 2). 5 мл образцы гепаринизированной крови отобрали в день вакцинации (день 0) и на 9 день после вакцинации. Немедленно после отбора 300 мкл крови подвергли трем циклам промывки/центрифугирования, как указано выше в примере 3, и лимфоциты разрушили по способу примера 1. Оставшийся образец крови хранили при 4°С в течение 4 дней, а затем хранили при комнатной температуре в течение 4 часов до начала нового цикла выделения лимфоцитов (таблица 5). Все последующие тесты ELISA осуществляли по способу примера 1. Тесты гемагглютинации-ингибирования (HI) осуществляли со штаммами гомологичных вакцин по способу примера 2.
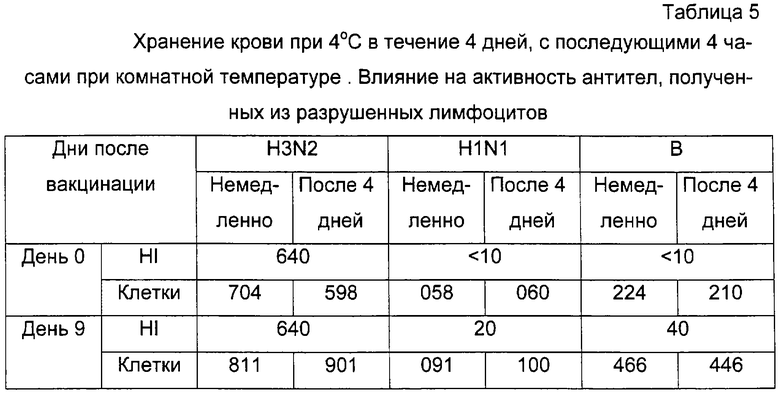
Все цифры представляют собой показатели оптической плотности при 492 нм · 1000 и HI-титры антител плазмы. "Клетки" означают антитела, полученные из разрушенных лимфоцитов, полученных из 100 мкл крови.
Результаты
Было обнаружено, что у этого пациента были значительные HI-титры против вакцинного компонента A/Sydney/5/97(H3N2) уже до вакцинации, и количество выделенных из лимфоцитов антител заметно не увеличилось с дня 0 до дня 9, не увеличился и их HI-титр. Реакция HI-вакцины в ответ на HlNl-компонент A/Beijing/262/95 была слабой, и это видно также из результатов клеточного анализа. Наиболее выраженным был ответ против компонента B/Beijing/184/93 гриппа В, где HI-титры возросли с величины менее 10 до 40. Это было отражено также в результатах клеточного анализа.
То, что кровь выдерживали в течение 4 дней при 4°С, а затем в течение 4 часов при комнатной температуре, не повлияло на зарегистрированную активность антител из разрушенных лимфоцитов. Результаты, полученные немедленно, и те, которые получили после хранения в течение 4 дней, не отличались в какой-либо значительной степени.
Другие эксперименты также показали, что даже после шести дней в аналогичных условиях хранения (охлаждение, прерываемое 6 часами при комнатной температуре) не повлияло на последующие измерения антител из разрушенных лимфоцитов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ ИММУННОГО ОТВЕТА (ВАРИАНТЫ) | 1996 |
|
RU2197733C2 |
| ВАКЦИНЫ С АДЪЮВАНТОМ LTB | 1998 |
|
RU2211050C2 |
| ВИРУС КОЗЬЕГО АРТРИТА-ЭНЦЕФАЛИТА, ОБЕСПЕЧИВАЮЩИЙ ИММУННУЮ ЗАЩИТУ ОТ ИНФЕКЦИИ ВИЧ-1 | 1997 |
|
RU2194529C2 |
| СПОСОБЫ И УСТРОЙСТВА ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 1999 |
|
RU2225197C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ Bordetella bronchiseptica | 2012 |
|
RU2554480C2 |
| УСТРОЙСТВО ДЛЯ ИММУННОГО АНАЛИЗА С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА К ВИРУСУ ГРИППА ТИПА B | 2004 |
|
RU2366663C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ВИРУСУ ТИПА А ГРИППА И УСТРОЙСТВО ДЛЯ ИММУННОГО АНАЛИЗА С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА | 2004 |
|
RU2366662C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ КОМПЛЕКСА РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ СОБАК | 2012 |
|
RU2553222C2 |
| МУКОЗАЛЬНАЯ ВАКЦИНА | 2011 |
|
RU2570394C2 |
| АНТИПНЕВМОКОККОВЫЙ ГИПЕРИММУННЫЙ ГЛОБУЛИН ДЛЯ ЛЕЧЕНИЯ И ПРЕДОТВРАЩЕНИЯ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ | 2018 |
|
RU2795769C1 |
Изобретение относится к медицине. Предложен способ определения присутствия или количества свежесинтезированных антител в образце в ответной реакции на иммуноген путем детектирования выделившихся антител или их частей в образце, содержащем лимфоциты, которые были разрушены, чтобы высвободились синтезированные антитела или их части, связанные с указанными лимфоцитами, в результате чего определяют присутствие или количество свежесинтезированных антител в указанном образце, способы диагностики, использующие этот способ, и наборы для осуществления этого способа. Способ обеспечивает детектирование неспецифических инфекционных индикаторов в ответ на инфицирование или вакцинацию. 3 с. и 21 з.п. ф-лы, 5 табл., 9 ил.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Иммуноглобулины | |||
| Под ред | |||
| Г | |||
| Литмена и Р | |||
| Гуди | |||
| - М.: Мир, 1981, с.453 | |||
| ATKINSON P | |||
| et al | |||
| J | |||
| Immunol | |||
| Meth | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| Р.С | |||
| Незлин | |||
| Биохимия антител | |||
| - М.: Наука, 1966, с.261-262. | |||
Авторы
Даты
2004-08-20—Публикация
2000-06-14—Подача