Предшествующий уровень техники
1. Область изобретения
Изобретение в общем относится к областям фармакологии и иммунологии. Более точно, изобретение направлено на новые соединения для селективного активирования Т-клеток (ФГА-бластов (Т-клеток, активированных фитогемагглютинином)) и снижения активирования естественных киллерных (“NK”) клеток. Новые соединения включают варианты соединений семейства цитокинов, в частности человеческого интерлейкина-2 (“IL-2”).
2. Описание области техники
Интерлейкин 2 (IL-2) является эффективным стимулятором иммунитета, активирующим различные клетки иммунной системы, включая Т-клетки, В-клетки и моноциты. IL-2 является также потенциальным и критическим фактором роста Т-клеток. Благодаря этим активностям IL-2 исследовали на возможность применения в лечении рака. Человеческий IL-2 является одобренным FDA (Управление по контролю за продуктами и лекарствами (США)) лекарством для лечения метастазирующей почечной карциномы и метастазирующей меланомы. Использование IL-2 у нуждающихся в нем пациентов ограничено из-за высокой токсичности, связанной с лечением Интерлейкином-2; по оценкам, в лучшем случае 20% пациентов хорошо переносят лечение. Токсичность, связанная с лечением IL-2, включает сильную лихорадку, тошноту, рвоту, сосудистую проницаемость и серьезную гипотензию. Несмотря на токсичность, IL-2 эффективен по своим показателям (объективный уровень ответа ~17%).
Несмотря на то, что проводился широкий структурный и функциональный анализ мышиного IL-2 (Zurawski, S. M. and Zurawski, G. (1989) Embo J 8: 2583-90; Zurawski, S. M, et al., (1990) Embo J 9: 3899-905; Zurawski, G. (1991) Trends Biotechnol 9: 250-7; Zurawski, S. M. and Zurawski, G. (1992) Embo J 11: 3905-10; Zurawski, et al., EMBO J, 12: 5113-5119 (1993)), анализ человеческого IL-2 проводился ограниченно. Большинство исследований с мутантными белками IL-2 человека проводилось на мышиных клетках; однако ограниченное число исследований было проведено с использованием человеческих ФГА-бластов (Т-клетки, обработанные фитогемагглютинином), экспрессирующих высоко аффинный IL-2 рецептор IL-2Rαβγ. Исследования с использованием ФГА-бластов подтвердили значимость остатков Asp-20 и D-спирали человеческого IL-2. Было показано, что положения Asp-20 и Gln-126 являются основными остатками, отвечающими за взаимодействие с β- и γ-субъединицами рецептора IL-2 соответственно (описано в Theze, et al., Immunol. Today, 17,481-486 (1996)). Хотя было показано, что остатки в С-спирали мышиного IL-2 участвуют во взаимодействии с мышиным IL-2R ((Zurawski, et al., EMBO J, 12 5113-5119 (1993)), не было показано, что эквивалентные остатки в человеческом IL-2 обладают такими же свойствами (эти остатки в человеческом IL-2 соответствуют Asp-84 и Asn-88). Так как показана значительная видоспецифичность для человеческого и мышиного IL-2 (активность человеческого IL-2 в мышиных клетках снижена ~ в 100 раз), сложно предсказать, происходят ли сходные взаимодействия в пределах вида. Ничего не известно об исследованиях с использованием клеток, экспрессирующих только человеческий рецептор IL-2Rβγ со средней аффинностью.
Была исследована активность некоторых мутантных белков IL-2 человека на человеческих ФГА-бластах (Xu, et al., Eur. Cytokine Netw, 6, 237-244 (1995)). Было показано, что мутантные белки, содержащие замены Asp-20 на лейцин (D20L), а также аргинин, аспарагин и лизин, сильно дефектны по способности индуцировать пролиферацию ФГА-бластов. Таким образом следует, что замена Asp-20 приведет к образованию мутантных белков с ограниченной активностью. Кроме того, в работе Xu et al. утверждается, что к 1995 г. не было идентифицировано мутантных белков IL-2, полезных для клинического или исследовательского применения.
Мутантный белок человеческого IL-2 Q126D, полученный Buchli и Ciardelli, Arch. Biochem. Biophys, 307(2): 411-415, (1993), обладает значительно сниженной активностью как по основному свойству, так и в агонизме; в эксперименте с Т-клетками человека он проявил активность, в 1000 раз меньшую, чем IL-2, и вел себя как частичный агонист. В эксперименте с мышиными Т-клетками мутантный белок был почти неактивен. Обе исследованные клеточные линии экспрессируют высокоаффинную форму рецептора IL-2. В клетках обоих типов была показана способность Q126D быть антагонистом IL-2-опосредованной активности, хотя в эксперименте с человеческими Т-клетками - только частично.
Zhi-yong, W., et al., Acta Biochimica et Biophysica Sinica 25(5): 558-560 (сентябрь 1993 г.) провели эксперименты по замене в IL-2 в положениях 62, 69, 99 и 126, демонстрирующие 20- и 30-кратное снижение активности 62-Leu-IL-2 и 126-Asp-IL-2 соответственно по сравнению с IL-2 дикого типа в эксперименте с мышиными Т-клетками (CTLL-2). Однако не сделано вывода или предположения о том, что замены по положению 126 могут обусловить активность, селективную к Т-клеткам по сравнению с NK клетками, или показать, будут ли такие замены иметь сходный эффект в человеческих Т-клетках.
В работе Collins, L., et al., PNAS USA 85:7709-7713 (1988) сообщается, что замена Asp в положении 20 на Asn (D20N) или Lys (D20K) приводит к потере связывания как с рецептором высокой (IL-2Rαβγ, обозначенным в работе Collins et. аl. р55/р70), так и (промежуточной) средней аффинности (IL-2Rβγ, обозначенным р70) в 100-1000 раз по сравнению с человеческим IL-2. Связывание с IL-2Rα оказалось неизмененным для обоих мутантных белков. Из этой работы следует, что нарушение связывания с IL-2-рецептором промежуточной (средней) аффинности (IL-2Rβγ) приведет к нарушению связывания и с высокоаффинным IL-2- рецептором (IL-2Rαβγ), при этом предполагается, что раздельное связывание или активация между IL-2Rβγ или IL-2Rαβγ недостижимы путем замены Asp в положении 20.
Brendt, W.G., et al., Biochemistry 33 (21):6571-6577 (1994) использовали комбинаторный кассетный мутагенез для одновременной замены положений 17-21 в природном IL-2, предполагается, что эти положения взаимодействуют с IL-2-рецептором промежуточной (средней) аффинности. Из 2610 проанализированных клонов только 42 были активны. Было обнаружено, что положения 20 и 21 имеют первостепенное значение для биологической активности. Не сделано предположений или выводов об индивидуальных заменах, за исключением L21V.
В патенте США №5229109 (Grimm et al.) утверждается низкая токсичность аналогов IL-2 при использовании в иммунотерапии и лечении рака. Свойства двух аналогов IL-2 с заменами в положениях Arg38 (на аланин) и Phe42 (на лизин) были изучены и сравнены со свойствами природного IL-2. Было обнаружено, что аналоги способны поддерживать способность связываться с промежуточным рецептором IL-2 при минимальном связывании с так называемым “высокоаффинным” рецептором. В то же время предполагалось, что рецептор с промежуточной (средней) аффинностью состоит только из р75 (IL-2Rβ), а рецептор с высокой аффинностью состоит только из рецепторного комплекса р55+р75 (IL-2Rαβ). Также аналоги поддерживали способность стимулировать мононуклеарные клетки периферийной крови к производству лимфокин-активированных киллеров (LAK). Следует отметить, что секреция IL-1β и TNFα в ответ на аналоги была значительно снижена по сравнению с природной молекулой IL-2, В этом патенте описаны аминокислотные остатки, которые будут специфически взаимодействовать с IL-2Rα (р55); исключение взаимодействия с IL-2Rα приведет к снижению активности на клетках, несущих высокоаффинный IL-2 рецептор, и не повлияет на активность клеток, несущих IL-2 рецептор с промежуточной активностью. Таким образом, продукция LAK клеток (предполагается, что они являются производньми NK-клеток) будет поддерживаться. Мутации в белках, описанные здесь, направлены на аминокислотные положения 20, 88 и 126; считается, что эти положения специфически взаимодействуют с IL-2Rβ (р75; положения 20 и 88) и IL-2Rγ (на момент подачи патента Grimm et аl. неизвестно; положение 126). Как следствие, взаимодействие с IL-2Rα остается неизменным. С механистической точки зрения мутантные белки, описанные Grimm et аl., будут характеризоваться сниженным взаимодействием с высокоаффинным рецептором IL-2, но не повлияют на активность IL-2-рецептора с промежуточной (средней) аффинностью; мутантные белки, описанные в данной работе, обладают противоположными характеристиками, они характеризуются значительным дефектом по способности к взаимодействию с IL-2-рецептором с промежуточной аффинностью IL-2Rβγ, и очень слабо или совсем не дефектны по функциональным взаимодействиям с высокоаффинным IL-2-рецептором, IL-2Rαβγ.
В патенте США №5206344 (Gordon et al.) описаны мутантные белки IL-2, в которых одна из аминокислот зрелой нативной последовательности IL-2 заменена на цистеиновый остаток, затем эти белки обрабатывали и через замещенный цистеиновый остаток конъюгировали с полимером, выбираемым из ряда гомополимеров полиэтиленгликоля или полиоксиэтилированных полиолов, где гомополимеры не замещены или замещены с одного конца алкильной группой. Эти мутантные белки получают экспрессией в хозяине мутантных генов, эти гены были поставлены вместо генов, кодирующих белки хозяина, методом сайт-направленного мутагенеза. Кроме того, другие виды IL-2 могут быть конъюгированы через цистеиновый остаток в положении 125 зрелого IL-2, которое не является необходимьм для биологической активности IL-2. Мутации, обусловливающие пониженную токсичность, не описаны.
В патенте США №4959314 (Lin et al.) описаны мутанты биологически активных белков, таких как IFN-β и IL-2, в которых цистеиновые остатки, не важные для биологической активности, были удалены или замещены на другие аминокислотные остатки для исключения сайтов межмолекулярного кросслинкинга или образования незаконных дисульфидных мостиков. Такие мутантные белки получают экспрессией в бактериях мутантных генов, эти гены были синтезированы из генов, кодирующих белки хозяина, методом олигонуклеотид-направленного мутагенеза. Мутации, обусловливающие пониженную токсичность, не описаны.
В патенте США №5116943 (Halenbeck et al.) описано, что биологически активный стандартный терапевтический белок защищают от окисления способом, включающим замещение каждого метионинового остатка, подверженного окислению хлорамином Т или пероксидом, на консервативную аминокислоту, причем дополнительные, невосприимчивые к окислению метиониновые остатки не замещают. Устойчивым к окислению мутантным белком, получаемым таким образом, является предпочтительно мутантный белок интерлейкина-2 или интерферона-β человека, а консервативной аминокислотой - наиболее предпочтительно аланин. Мутации, обусловливающие пониженную токсичность, не описаны.
Патент США №4853332 (Mark et al.) описывает мутантные белки IFN-γ и IL-2, в которых цистеиновые остатки, не важные для биологической активности, были удалены или замещены другими аминокислотами для исключения сайтов межмолекулярного кросслинкинга или образования незаконных дисульфидных мостиков. В патенте заявлено, что замена в IL-2 цистеина в положении 125 на серин приводит к образованию мутантного белка с активностью, сравнимой с нативным IL-2.
Патент США №5696234 (Zurawski et al.) описывает мутантные белки цитокинов млекопитающих и способы поиска агонистов и антагонистов цитокинов млекопитающих. В частности показано, что двойной мутант человеческого IL-2, P82A/Q126D, обладает антагонистической активностью на мышиных клетках Baf3, котрансфицированных α- и β-субъединицами IL-2R человека. Показано наличие небольшой агонистической активности. Также показано, что мутанты мышиного IL-2 демонстрируют частичную агонистическую и антагонистическую активность на НТ2 клетках, в частности это мутанты Q141D, Q141K, Q141V и Q141L. Активности мутантных белков, подтверждающие или предполагающие избирательный агонистический эффект мутаций по положениям 20, 88 и 126, не описаны.
Zurawski et al, описывает мутантные белки мышиного IL-2, которые активны на клетках, экспрессируюших IL-2Rαβγ, и неактивны на клетках, экспрессирующих IL-2Rβγ (Zurawski.G., Trends Biotechnol. 9: 250-257 (1991); Zurawski, S.M. and Zurawski. G.Embo. J. 11:3905-3910 (1992)). Мутантные мышиные белки IL-2, обладающие такими свойствами, имеют замены Asp-34 на Ser или Thr, и Gin-141 на Lys. Asp-34 и Gln-141 мышиного IL-2 эквивалентны Asp-20 и Gln-141 человеческого IL-2 соответственно. Хотя эти ссылки относятся к мутантным белкам IL-2 - “селективным агонистам”, преимущественно описывается потенциал этих белков как антагонистов эндогенного IL-2, но не потенциал их более низкой токсичности.
В ЕР 0267795 А2 (Zurawski et al.) описан ряд мутантных белков мышиного IL-2 по последовательности, включая мутанты, содержащие делеции и/или замены внутри первой трети биологически важных N-концевых аминокислотных остатков, но туда не включены, не обсуждаются и не предлагаются аминокислотные замены, предлагаемые в настоящей работе на эквивалентных остатках мышиного IL-2. Существует потребность в улучшенной молекуле IL-2 с пониженной токсичностью и большей общей переносимостью.
Патент США №4738927 (Taniguchi et al.) описывает рекомбинантную ДНК, включающую рекомбинантную ДНК, кодирующую полипептид с биологической активностью IL-2, причем указанная активность - это стимулирование роста клеточной линии цитотоксических Т-лимфоцитов, и векторную ДНК, способную реплицироваться в прокариотических и эукариотических клетках; кодирующая последовательность указанного гена расположена в направлении вниз от промоторной последовательности, причем указанный полипептид в общем представляет собой от 132 до 134 аминокислот в аминокислотной последовательности полипептида. В работе также описаны ген, рекомбинантные ДНК векторы, клетки хозяина и способы рекомбинантного получения нативного IL-2. Taniguchi et al. не описывают варианты мутантных белков и не указывают положения в белке, отвечающие за сигнальную и связывающую активности.
Ясно, что мутантные белки IL-2, не обладающие ограничивающей дозу токсичностью получаемых ранее рекомбинантных белков IL-2, необходимы для использования терапевтических преимуществ этого цитокина.
Краткое изложение изобретения
Изобретение описывает полипептид, включающий мутантный белок человеческого IL-2, нумерованный согласно IL-2 дикого типа, где указанный человеческий IL-2 замещен по крайней мере по одному из положений 20, 88 или 126, посредством чего указанный мутантный белок активирует Т-клетки предпочтительно перед NK-клетками. Данное изобретение представляет менее токсичный мутантный белок IL-2, дающий возможность более широкого использования этого интерлейкина.
Кроме того, изобретение включает мутантные белки IL-2, содержащие единичные мутации по положениям Аспартат 20, Аспарагин 88 и Глутамин 126. Специфические мутантные белки обозначены D20X, N88X и Q126X, где X - специфическая аминокислота, которая, будучи замещенной в человеческий IL-2, обусловливает избирательную активность клеток, экспрессирующих IL-2Rαβγ рецептор (например. Т-клеток), преимущественно перед клетками, экспрессирующими IL-2Rβγ рецептор (например, NK-клетками). Мутантные белки, обладающие более чем 1000-кратной селективностью, включают D20H, D20I, N88G, N88I, N88R и Q126L. В частности, эти белки демонстрируют также существенную активность IL-2 дикого типа на Т-клетках. Также идентифицированы другие мутации, обеспечивающие менее чем 1000-, но более чем 10-кратную селективность. Изобретение включает также полинуклеотиды, кодирующие входящие в изобретение мутантные белки, векторы, содержащие полинуклеотиды, трансформированные клетки хозяина, фармацевтические композиции, включающие мутантные белки, и терапевтические способы лечения с использованием этих белков.
Изобретение также включает способ отбора мутантных белков IL-2 по результатам анализов с использованием IL-2Rαβγ в сравнении с IL-2Rβγ, где активность мутантного белка IL-2 в одном анализе по сравнению с другим возрастает по отношению к IL-2 дикого типа. IL-2Rαβγ и IL-2Rβγ представляют собой индивидуальные рецепторные субъединичные эктодомены в соответствующей конфигурации и используются для прямого измерения связывания мутантных белков IL-2 с каждым рецепторным комплексом. Анализ с использованием IL-2αβγ учитывает ответ от IL-2αβγ-несущих клеток, а анализ с использованием IL-2βγ - ответ от IL-2βγ-несущих клеток. IL-2αβγ-несущими клетками являются ФГА-бласты, а IL-2βγ-несущими - NK-клетки. В анализе исследуется пролиферация и IL-2αβγ-, и IL-2βγ-несущих клеток.
Изобретение также относится к вектору, включающему полинуклеотид, кодирующий указанный в этом изобретении мутантный белок, вектору, обусловливающему экспрессию мутантного белка человеческого IL-2, обладающего способностью активировать ФГА-бласты и сниженной способностью активировать NK-клетки, вектору, способному обеспечить трансфекцию организма-мишени и последующую экспрессию in vivo мутантного белка человеческого IL-2, кодируемого указанным полинуклеотидом.
Изобретение относится также к способу лечения больных, пораженных IL-2-излечиваемым заболеванием, путем назначения терапевтически эффективных количеств мутантного белка человеческого IL-2, нумерованного в соответствии с IL-2 дикого типа, обладающего способностью активировать ФГА-бласты и сниженной способностью активировать NK-клетки. Этот способ применим при состояниях, поддающихся лечению IL-2, таких как ВИЧ, рак, аутоиммунное заболевание, инфекционное заболевание; как адъювант при противораковой вакцине и обычной вакцинотерапии, для иммунной стимуляции в преклонном возрасте или при иммунитете, ослабленном другим образом, а также у пациентов с ГКИ (глубокий комбинированный иммунодефицит) и для других терапевтических целей, требующих стимуляции иммунной системы.
Краткое описание чертежей
Фиг.1-7 показывают кривые зависимости от доз для человеческого IL-2 дикого типа (IL-2) и D20H (фиг.1), IL-2 и D20I (фиг.2), IL-2 и N88G (фиг.3), IL-2 и N88I (фиг.4), IL-2 и N88R (фиг.5), IL-2 и Q126E (фиг.6), IL-2 и Q126L (фиг.7). А: Индивидуальный ответ на дозу IL-2 (закрашенные кружки) и мутантного белка (незакрашенные кружки) в исследовании пролиферации первичных Т-клеток человека (ФГА-бластов). В: Индивидуальный ответ на дозу IL-2 (закрашенные кружки) и мутантного белка (незакрашенные кружки) в исследовании пролиферации первичных NK-клеток.
Фиг.8А-8D. Токсичность пролейкина PROLEUKIN™ у шимпанзе оценивалась на двух животных (Х-159, треугольники, и Х-124, квадраты) по сравнению с наполнителем в качестве контроля (Х-126, ромбы). Токсичность оценивали по почечным параметрам (азот мочевины крови (BUN), А; креатинин, В) и функции печени (общий билирубин, С; аланин аминотрансфераза (ALT), D).
Фиг.9. График процентного изменения массы тела в течение 30 дней. Масса тела животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялась в указанные дни.
Фиг.10А-10D. Количество лимфоцитов (А), общих лейкоцитов (В), нейтрофилов (С) и тромбоцитов (D) у животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялось в указанные дни.
Фиг.11А-11D. Показатели азота мочевины крови (A, BUN), креатинина (В), фосфора (С) и времени активированного протромбина (D) у животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялись в указанные дни.
Фиг.12А-12D. Показатели общего билирубина (A), ALT (В), фибриногена (С) и времени активированного протромбина (D) у животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялись в указанные дни.
Фиг.13А-13D. Уровни натрия (А), хлорид-ионов (В), кальция (С) и калия (D) в крови у животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялись в указанные дни.
Фиг.14А-14С. Уровни альбумина (А), гематокрита (В) и гемоглобина (С) в крови у животных, которым давали IL-2/N88R (треугольники), пролейкин (квадраты) или наполнитель (ромбы), измерялись в указанные дни.
Фиг.15А-15С. Действие IL-2/N88R (квадраты), пролейкина (ромбы) и наполнителя (треугольники) указано для общей популяции Т-клеток (A, CD3+ клеток), популяции CD4+ Т-клеток (В) и CD8+ Т-клеток (С).
Фиг.16А-16С. Действие IL-2/N88R (квадраты), пролейкина (ромбы) и наполнителя (треугольники) указано для общей популяции Т-клеток (А, CD3+ клеток), популяции CD4+ Т-клеток (В) и CD8+ Т-клеток (С).
Фиг.17. Действие IL-2/N88R и пролейкина на активацию Т-клеток по отношению к значению флуоресценции CD25-положительных клеток. Действие IL-2/N88R (квадраты), пролейкина (ромбы) и наполнителя (треугольники) указано для популяции CD3+CD4+ Т-клеток. Было получено недостаточное количество CD3+/CD8+ клеток для оценки значения флуоресценции на этой популяции.
Фиг.18А-18D. Действие IL-2/N88R (квадраты), пролейкина (ромбы) и наполнителя (треугольники) указано для популяции CD4+ Т-клеток (A, CD3+/CD4+ клетки), популяции CD8+ Т-клеток (В, CD3+/CD8+ клетки), общей популяции Т-клеток (С, CD3+ клетки) и популяции NK-клеток (D, CD3-/CD16+ клетки).
Фиг.19. График количества метастазов в легких по отношению к дозе у мышей, которым давали пролейкин (незакрашенные кружки) или IL-2/N88R (закрашенные кружки). Метастазы в легких подсчитывали по окончании исследования.
Фиг.20. Плазмидная карта IL-2/Н88К-вектора pBC1IL2SA.
Описание предпочтительных вариантов осуществления
А. Предшествующий уровень техники
Действие IL-2 на Т-клетки опосредуется связыванием с IL-2-рецепторными белками. Определенные белки на поверхности Т-клеток связывают IL-2. Первым был идентифицирован единичный белок, называемый IL-2Rα, составляющий 55 kD (p55), он появляется при активации Т-клеток и был первоначально назван Тас-антигеном (от слов Т activation). IL-2Rα связывается с IL-2 с константой Кd, равной приблизительно 10-8М, он также известен как “низкоаффинный” рецептор. Связывание IL-2 с клетками, экспрессирующими только IL-2Rα, не приводит к какому-либо различимому биологическому ответу.
Второй IL-2-рецептор - это связывающий комплекс, состоящий из IL-2Rb и IL-2Rg; IL-2Rg - это 64kD полипептид, известный также как общая γ (γс) цепь, так как он обнаруживается у ряда цитокиновых рецепторов. IL-2Rb составляет от 70 до 75 kD (называется либо р70, либо р75) и является членом семейства рецепторов цитокинов типа I, которые характеризуются наличием двух участков цистеин/WSXWS. IL-2Rβ экспрессируется координированно с γс. Аффинность связывания IL-2 с IL-2Rβγc выше, чем с IL-2Rα, константа Kd составляет приблизительно 10-9М; IL-2Rβγc известен также как IL-2-рецептор “с промежуточной аффинностью”. IL-2 вызывает рост клеток, экспрессирующих IL-2Rβγс, причем полумаксимальная стимуляция роста наблюдается при концентрации IL-2, приводящей к полумаксимальному связыванию (т.е. 1×10-9М). IL-2Rβγс является тем же сигнальным рецепторным комплексом, который может связываться с IL-15.
Третьим известным IL-2-рецепторным комплексом является комплекс IL-2Rαβγc. Клетки, экспрессирующие и IL-2Rα, и IL-2Rβγс, способны связывать IL-2 значительно прочнее с константой Кd, равной приблизительно 10-11М, таким образом IL-2Rαβγс известен также как “высокоаффинный” комплекс. Стимуляция роста таких клеток происходит соответственно при низких концентрациях IL-2. И связывание с IL-2, и стимуляция роста могут быть заблокированы антителами к IL-2Rα, IL-2Rβ или γс и более эффективно комбинацией антител к нескольким субъединицам рецептора. Эти наблюдения позволяют предположить, что IL-2Rα образует комплекс с IL-2Rβγс, увеличивающий сродство сигнального рецептора к IL-2 и обеспечивающий таким образом доставку сигнала роста при значительно более низких концентрациях IL-2. Полагают, что сначала IL-2 быстро связывается с IL-2Rα, и это способствует ассоциации с IL-2Rβγс. Покоящиеся Т-клетки экспрессируют IL-2Rβγс и только небольшое количество IL-2Rα; увеличение поверхности, на которой экспрессирован IL-2Rα, может быть стимулировано IL-2. При активации Т-клеток, опосредованной рецептором антигена, быстро экспрессируется IL-2Rα, таким образом снижается концентрация IL-2, необходимая для стимуляции роста. Связывание IL-2 с комплексом IL-2Rαβγс приводит к передаче сигнала по сигнальному пути Jac/STAT.
Авторами были обнаружены мутантные белки человеческого IL-2, которые активируют Т-клетки (ФГА-бласты; клетки, экспрессирующие высокоаффинный IL-2-рецептор IL-2Rαβγ) предпочтительно перед естественньми киллерными (NK) клетками (клетками, экспрессирующими IL-2-рецептор с промежуточной аффинностью IL-2Rβγ). Мутантные белки, в которых Asp-20 заменен на гистидин (D20H) или изолейцин (D20I), Asn-88 заменен на аргинин (N88R), глицин (N88G) или изолейцин (N88I), или Gln-126 заменен на лейцин (Q126L) или глутамат (Q126E), демонстрируют неожиданно полную IL-2-активность на ФГА-бластах, и низкую активность (или ее отсутствие) на NK-клетках. Предыдущие исследования мутантных белков человеческого IL-2 основывались на мышиных клеточных системах анализа, а при исследованиях на клетках человека не использовались клетки, экспрессирующие только IL-2Rβγ (такие, как NK-клетки). Кроме того, исследования с использованием человеческих ФГА-бластов показали, что замены Asp-20 (на Leu, Arg, Asp или Lys; Xu, et al., Eur. Cytokine Netw, 6, 237-244 (1995)) или Gln-126 (на Asp; Buchli and Ciardelli, Arch. Biochem. Biophys, 307(2): 411-415, (1993)) приводят к мутантным белкам человеческого IL-2 со значительно сниженной активностью. В предыдущих исследованиях с использованием мышиного IL-2 были идентифицированы мутантные белки IL-2 мыши с различными активностями (Zurawski, et al., EMBO J, 12, 5113-5119 (1993)), но ни одна из мутаций, приведших к этим результатам, не предполагала мутаций, идентифицированных в предлагаемой работе. Мутантные белки человеческого IL-2, содержащие идентичные замены в положениях, синонимичных положениям в мутантных белках мышиного IL-2, не обнаруживают схожей активности, таким образом, можно предположить, что примеры на мышах не могут предсказывать функциональности в человеческой системе. Авторам не известны исследования мутантных белков IL-2 человека, сравнивающие относительные активности в клетках, экспрессирующих IL-2-рецептор IL-2Rαβγ (например, ФГА-бластах) и в клетках, экспрессирующих IL-2-рецептор IL-2Rβγ (например, NK-клетках). Ожидается, что анализ in vivo подтвердит, что описанные мутантные белки обладают улучшенным терапевтическим индексом по сравнению с человеческим IL-2 дикого типа благодаря снижению токсичности и обеспечивают терапевтически полезные соединения для лечения заболеваний, требующих стимуляции иммунной системы.
Интерлейкин 2 (IL-2) используется в настоящее время в клинической практике для лечения метастатического рака почки. Однако его сильная токсичность ограничивает его применение группой наиболее здоровых пациентов, а ограничивающая дозу токсичность снижает его общую эффективность. Предполагают, что острая токсичность IL-2 обусловливается активацией NK-клеток, тогда как эффективность обусловлена прямой активацией Т-клеток (Jacobson, et al., Proc Natl Acad Sci USA (United States), Sep. 17, 1996, 93(19) p. 10405-10; Smith KA, Blood 1993, 81(6), р. 1414-23; Kaplan, et al., Biotechnology, 10 (2), p. 157-62). Т-клетки и NK-клетки экспрессируют различные рецепторы для IL-2 (Т-клетки: IL-2Rαβγ, высокоаффинный IL-2-рецептор; NK-клетки: IL-2Rβγ, IL-2-рецептор с промежуточной активностью). Описанные в данной работе мутантные белки человеческого IL-2 активируют IL-2-рецептор Т-клеток и не активируют IL-2-рецептор NK-клеток.
Для того чтобы избежать активации NK-клеток с некоторым успехом применялась терапия низкими дозами IL-2 (Jacobson, et. еl. (1996). Proc Natl Acad Sci USA 93: 10405-10). Эта стратегия основывалась на концепции о том, что при низких дозах IL-2 будет активироваться только высокоаффинный IL-2-рецептор и не будет активироваться IL-2-рецептор с промежуточной активностью. Форма IL-2-рецептора с промежуточной активностью, IL-2Rβγ, экспрессирована на NK-клетках, в то время как Т-клетки экспрессируют высокоаффинную форму, IL-2Rαβγ.
Однако авторы подошли к проблеме токсичности с другой позиции. Было сделано предположение, что нарушение взаимодействия IL-2 с IL-2Rβ и/или с IL-2Rγ путем определенных модификаций специфических связывающих остатков на связывающей поверхности IL-2 предотвратит эффективное связывание (и таким образом активацию) с клетками, экспрессирующими только IL-2Rβγ. Однако на клетках, экспрессирующих IL-2Rαβγ, первоначально связывается IL-2Rα, таким образом, связывание с клеткой все равно будет происходить и терапия низкими дозами, предложенная Jacobs et al., может давать токсические побочные эффекты. Благодаря связыванию с IL-2α на поверхности клетки может происходить эффективное использование IL-2Rβ и IL-2Rγ. несмотря на ослабленное взаимодействие модифицированного IL-2 с IL-2Rβ и/или IL-2Rγ. Таким образом, может образоваться способный к сигнализации комплекс IL-2/IL-2Rαβγ. Мы полагаем, что вариант IL-2, способный селективно активировать высокоаффинные IL-2-рецепторы на Т-клетках предпочтительно по отношению к IL-2-рецепторам с промежуточной активностью на NK-клетках, будет обладать повышенным терапевтическим индексом по сравнению с IL-2 дикого типа благодаря сниженному профилю токсичности. Вариант IL-2 с повышенным терапевтическим индексом будет обладать значительно более широкой областью применения как в лечении рака (при прямой и/или вспомогательной терапии), так и иммунодефицита (например, ВИЧ и туберкулез). Другие возможные применения IL-2 обусловлены его иммуностимулирующей активностью и включают, кроме того, прямое лечение рака, иммунодефицита у пациентов с ВИЧ или ГКИ человека; инфекционных заболеваний типа туберкулеза; применение в качестве адъюванта в методах “раковой вакцины” и при показанной стимуляции иммунной системы, например при совершенствовании стандартных процедур вакцинации или для лечения пожилых людей.
Соответствующие замены в положениях Asp-20, Asn-88 или Gln-126 снижали связывающие взаимодействия либо для IL-2Rβ (Asp-20 и Asn-88), либо для IL-2Rγ (Gln-126). Общий эффект таких замен привел к получению мутантных белков IL-2, которые сохраняли активность на Т-клетках человека и обладали сниженной активностью на NK-клетках человека.
Так как не представлялось возможным предсказать результат данной замены до исследования на Т- и NK-клетках, были сделаны замены на все возможные природные аминокислоты (кроме Cys) в положениях Asp-20, Asn-88 и Gln-126 и ограниченный, но разнообразный набор мутаций по положению Asp-84 для проверки их взаимодействия с IL-2Rβ. Если бы наблюдалось видимое взаимодействие с IL-2Rβ, были бы сделаны дополнительные мутации по положению Asp-84. Данные по 46 отдельным заменам в указанных положениях приведены в табл. 1.
Мутации были внесены методом сайт-направленного мутагенеза на кДНК IL-2 дикого типа. Нужные клоны были субклонированы в экспрессионный вектор, подходящий для экспрессии в гетерологичной системе (например, Е.coli, бакуловирус, дрожжевые клетки или клетки млекопитающих, такие как клетки яичников китайских хомячков (СНО)). Очищенные белки проверяли в исследованиях пролиферации Т-клеток (ФГА-бластов) и NK-клеток. Различные ответы, которые давали индивидуальные белки между этими исследованиями, т.е. ЕС50, указывают мутации, влияющие на эти активности. Конкретно, мутантные белки, стимулирующие относительно более сильный ответ в исследовании на ФГА-бластах (Т-клетках) (по отношению к IL-2 дикого типа) по сравнению с ответом в исследовании на NK-клетках (по отношению к IL-2 дикого типа) соответствуют заменам, обеспечивающим клеточную специфичность, основанную на способности специфических мутантов связываться и активировать IL-2Rαβγ, экспрессированный на этих клетках, но отсутствии способности связываться и таким образом активировать клетки, экспрессирующие только IL-2Rβγ. Мутантные белки IL-2, обладающие этим свойством, in vivo будут обладать иммуностимулирующими свойствами IL-2 с пониженной токсичностью, проявляющейся в сосудистой проницаемости и гипотензии, связанной с лечением IL-2.
В. Определения
Клетки линии СНО, использованные для получения описанного здесь рекомбинантного белка, были заложены в АТСС (American Type Culture Collection), 12301 Paraklawn Drive, Rockville, MD, 20852, USA, 5 мая 1999 года, депозит №РТА-8. Так как данный штамм относится к штаммам, зарегистрированным согласно условиям Будапештского соглашения, он будет доступен патентному ведомству государства, подписавшего Будапештское соглашение.
В данной работе “IL-2 дикого типа” означает IL-2, природный или рекомбинантный, содержащий последовательность 133 нормально встречающихся аминокислот, соответствующих природному IL-2 человека (за вычетом сигнального полипептида, состоящего из 20 дополнительных N-концевых аминокислот), аминокислотная последовательность которого описана у Fujita, et al., Pnas USA, 80, 7437-7441 (1983), с или без дополнительного N-концевого метионина, который обязательно содержится, когда белок экспрессируется как внутриклеточная фракция Е.coli.
В данной работе “мутантный белок IL-2” означает полипептид, в котором сделаны специфические замены по отношению к зрелому белку интерлейкина-2 человека. В табл. 1 описаны 46 полученных мутантных белков с индивидуальными заменами и соответствующие данные их относительной активности. Предпочтительными продуктами являются мутантные белки, обладающие по крайней мере 100-кратной относительной активностью. Наиболее предпочтительными являются следующие белки, обладающие более чем 1000-кратной относительной активностью: остаток (Asp) аспартата (D) в положении 20 (“D20”), при нумерации согласно IL-2 дикого типа, замещен на изолейцин (“D20I”) или гистидин (“D20H”); остаток аспарагина (Asn) в положении 88 (N88) замещен на изолейцин (N88I) или аргинин (N88R) и остаток глутамина (Gln) в положении 126 (Q126) замещен на лейцин (Q126L), глутамат (Q126E) или аспартат (Q126D). По остальным, не замещенным, положениям предпочтительные мутантные белки IL-2 имеют аминокислотную последовательность, идентичную IL-2 дикого типа. Однако мутантные белки IL-2, описанные в данной работе, могут характеризоваться также аминокислотньми вставками, делениями, заменами и модификациями в одном или нескольких сайтах по этим или другим остаткам полипептидной цепи нативного IL-2. В соответствии с этим изобретением любые подобные вставки, делеции, замены и модификации могут приводить к мутантным белкам IL-2, сохраняющим ФГА-бласт-селективную активность при сниженной способности к активации NK-клеток, и составляют сущность данного изобретения.
Комбинирование предпочтительных или особо предпочтительных замен, описанных выше, в одной рекомбинантной молекуле IL-2 может привести к комбинации мутантов, обладающих активностью, аналогичной описанной для одиночных мутантов. Например, можно ожидать, что молекула IL-2, содержащая комбинацию двух или более мутаций, выбираемых из табл. 1, может привести к IL-2-агонисту, селективному по отношению к Т-клеткам, с относительной активностью, аналогичной относительной активности молекул с единичными заменами, описанными здесь. Комбинационные мутанты составляют объем и сущность данного изобретения.
Авторы предпочитают консервативные модификации и замены по другим положениям IL-2 (т.е. такие, которые оказывают минимальное влияние на вторичную или третичную структуру мутантного белка). Такие консервативные замены включают замены, описанные Dayhoff в The Atlas of Protein Sequence and Structure 5. (1978) и Argos в ЕМВО J., 8:779-785 (1989). Например, аминокислоты, принадлежащие одной группе, представляют консервативные замены:
- ala, pro, gln, asn, ser, thr;
- cys, ser, tyr, thr;
- val, ile, leu, met, ala, phe;
- lys, arg, his;
- phe, tyr, trp, his;
asp, glu.
Авторы также предпочитают модификации или замены, которые не вносят сайты для дополнительного межмолекулярного кросслинкинга или образования незаконных дисульфидных связей. Например, известно, что IL-2 содержит три цистеиновых остатка, в диком типе это положения 58,105 и 125 зрелой последовательности.
Под “нумерацией согласно IL-2 дикого типа” авторы понимают идентификацию выбранной аминокислоты в соответствии с положением, в котором эта аминокислота нормально встречается в зрелой последовательности IL-2 дикого типа. Если произведены вставки или делеции, то специалистам в данной области техники будет понятно, что Asp, нормально находящийся в положении 20, может быть сдвинут по положению в мутантном белке. Однако положение сдвинутого Asp можно легко определить сверкой и сопоставлением фланкирующих аминокислот с аминокислотами, фланкирующими Asp в IL-2 дикого типа.
Термин “типы клеток, несущих IL-2Rαβγ рецептор” означает клетки, наличие этого типа рецепторов у которых известно, т.е. Т-клетки, активированные Т-клетки, В-клетки, активированные моноциты и активированные NK-клетки. Термин “типы клеток, несущих IL-2Rβγ рецептор” означает клетки, наличие этого типа рецепторов у которых известно, т.е. В-клетки, покоящиеся моноциты и покоящиеся NK-клетки.
Мутантные белки IL-2, представленные в данном изобретении, можно получить любым подходящим методом, известньм в данной области техники. Такие методы включают конструирование последовательности ДНК, кодирующей мутантные белки IL-2, и экспрессию этих последовательностей в соответственно трансформированном хозяине. Этим методом можно получить мутантные белки, представленные в данном изобретении. Однако такие мутантные белки можно также получить, хотя это и менее предпочтительно, химическим синтезом или комбинацией химического синтеза и метода рекомбинантной ДНК. Методы серийного производства или перфузионного производства в общем соответствуют данной области техники. См. Freshey, R.I. (ed), “Animal Cell Culture: A Practical Approach”, 2nd ed., 1992, IRL Press, Oxford, England; Mather, J.P. “Laboratory Scaleup of Cell Cultures (0,5-50 liters)”, Methods Cell Biology 57: 219-527 (1998); Hu, W.S., and Aunins, J.G., “Large-scale Mammalian Cell Culture”, Curr Opin Biotechnol 8: 148-153 (1997); Konstantinov, K.B., Tsai, Y., Moles, D., Matanguihan, R., “Control of long-term perfusion Chinese hamster ovary cell culture by glucose auxostat”, Biotechnol Prog 12:100-109 (1996).
В одном из вариантов осуществления рекомбинантного способа получения мутантного белка, описанного в изобретении, последовательность ДНК конструируют путем выделения или синтеза последовательности ДНК, кодирующей IL-2 дикого типа, и последующего изменения кодона Asp20 на кодон изолейцина (I) сайт-специфическим мутагенезом. Этот метод хорошо известен. См., например. Mark et al., “Site-specific Mutagenesis Of The Human Fibroblast Interferon Gene”, Proc. Natl. Acad. Sci. USA 81, p. 5662-66 (1984); и патент США №4588585, включенный в данное описание путем ссылки.
Другим способом конструирования последовательности ДНК, кодирующей мутантные белки IL-2, описанные в данном изобретении, является химический синтез. Он включает, например, прямой химический синтез белковой последовательности, кодирующей мутантный белок IL-2, обладающий свойствами, описанными в данном изобретении. Этим способом можно включать как природные, так и неприродные аминокислоты в положения, влияющие на взаимодействия IL-2 с IL-2Rγ или IL-2Rγ. Альтернативно ген, кодирующий требуемый мутантный белок IL-2, можно синтезировать химическим способом с использованием олигонуклеотидного синтезатора. Такие олигонуклеотиды конструируют, основываясь на аминокислотной последовательности требуемого мутантного белка IL-2 и выбирая те кодоны, которые предпочтительны в клетках хозяина, в которых будет получен рекомбинантный мутантный белок. В этом аспекте учитывается тот факт, что генетический код вырожден - одна аминокислота может кодироваться более чем одним кодоном. Например, Phe (F) кодируется двумя кодонами, ТТС или ТТТ, Туr (Y) кодируется ТАС или TAT, a His (Н) кодируется САС или CAT. Trp (W) кодируется единственным кодоном, TGG. Соответственно следует учитывать, что для данной последовательности ДНК, кодирующей конкретный мутантный белок IL-2, существует несколько вырожденных последовательностей ДНК, кодирующих этот белок. Например, следует учитывать, что в дополнение к последовательности ДНК для белка D20I, приведенной в SEQ ID NО:1, существует несколько вырожденных последовательностей, кодирующих указанный белок. Такие вырожденные ДНК рассматриваются в области данного изобретения. Таким образом, термин “вырожденные варианты” в контексте данного изобретения означает все последовательности ДНК, кодирующие и позволяющие экспрессию конкретного мутантного белка.
Последовательность ДНК, кодирующая мутантный белок IL-2, описываемый в данном изобретении, полученная сайт-направленным мутагенезом, химическим синтезом или другими методами, может включать или не включать ДНК, кодирующую сигнальную последовательность. Такая сигнальная последовательность, если она присутствует, должна узнаваться клеткой, выбранной для экспрессии мутантного белка IL-2. Последовательность может быть прокариотической, эукариотической или комбинацией этих двух типов. Она может быть также сигнальной последовательностью природного IL-2. Включение сигнальной последовательности зависит от того, предполагается ли секреция требуемого мутантного белка IL-2 из рекомбинантных клеток, в которых он был получен. Если выбраны прокариотические клетки, обычно предпочтительно, чтобы последовательность ДНК не кодировала сигнальную последовательность. Если выбраны эукариотические клетки, обычно предпочтительно, чтобы кодировалась сигнальная последовательность, и наиболее предпочтительно, чтобы использовалась сигнальная последовательность IL-2 дикого типа.
Для синтеза гена, кодирующего мутантный белок IL-2, соответствующий данному изобретению, можно применять стандартные способы. Например, можно использовать полную аминокислотную последовательность для конструирования обратно транслируемого гена. Можно синтезировать олигомер ДНК, содержащий нуклеотидную последовательность, кодирующую мутантный белок IL-2. Например, можно синтезировать несколько небольших олигонуклеотидов, кодирующих части требуемого полипептида, и затем лигировать их. Отдельные олигонуклеотиды содержат обычно перекрывающиеся 5’ или 3’ участки для комплементарной сборки.
Будучи собранной (синтезом, сайт-направленным мутагенезом или другим способом), последовательность ДНК, кодирующая мутантный белок IL-2, должна быть введена в вектор для экспрессии и связана с контролирующей экспрессию последовательностью, подходящей для экспрессии мутантного белка в требуемом трансформированном хозяине. Правильность сборки может быть подтверждена нуклеотидным секвенированием, рестрикционным картированием и экспрессией биологически активного полипептида в подходящем хозяине. В данной области техники известно, что для получения высоких уровней экспрессии трансфицированного гена в хозяине ген должен быть связан с контролирующими транскрипционную и трансляционную экспрессию последовательностями, функционирующими в выбранном хозяине.
Выбор контролирующей экспрессию последовательности и вектора для экспрессии зависит от выбора хозяина. Может быть задействован широкий набор комбинаций хозяин/вектор для экспрессии. Векторы, используемые для экспрессии в эукариотических хозяевах, включают, например, векторы, содержащие контролирующие экспрессию последовательности из SV40, вируса папилломы крупного рогатого скота, аденовируса или цитомегаловируса. Векторы, используемые для экспрессии в бактериальных хозяевах, включают известные бактериальные плазмиды, такие как плазмиды из Е.coli, включающие col E1, pCR1, pER32z, pMB9 и их производные, плазмиды с широкой видоспецифичностью, такие как RP4, фаговые ДНК, например многочисленные производные фага лямбда, например NM989, и других ДНК-фагов, таких как М13 и нитчатых фагов с одноцепочечной ДНК. Векторы, используемые для экспрессии в клетках дрожжей, включают плазмиду 2μ и ее производные. Векторы, используемые в клетках насекомых, включают pVL 941. Мы предпочитаем pFastBac™ 1 (GibcoBRL, Gaithersburg, MD). Gate et al., “Isolation Of The Bovine And Human Genes For Mullerian Inhibiting Substance And Expression Of The Human Gene In Animal Cells”, Cell, 45, p.685-98 (1986).
Кроме того, в этих векторах можно использовать любую из широкого набора контролирующих экспрессию последовательностей. Используемые контролирующие экспрессию последовательности включают последовательности, ассоциируемые со структурными генами вышеупомянутых векторов для экспрессии. Примерами используемых контролирующих экспрессию последовательностей являются, например, ранние и поздние промоторы SV40 или аденовируса, lac система, trp система, ТАС или TRC система, участки главного оператора и промотора фага лямбда, например PL, контрольные участки fd оболочечного белка, промотор 3-фосфоглицерат киназы или других гликолитических ферментов, промоторы кислой фосфатазы, например PhoA, промоторы дрожжевой системы α-спаривания, полиэдрический промотор Бакуловируса и другие известные последовательности, контролирующие экспрессию генов прокариотических или эукариотических клеток или вирусов, и различные комбинации этих последовательностей.
Для получения мутантных белков IL-2, описанных в данном изобретении, можно использовать любого подходящего хозяина, включая бактериальные клетки, клетки грибов (включая дрожжи), растений, насекомых, млекопитающих или другие подходящие клетки или клеточные линии животных; а также трансгенных животных или растения. Более подробно, эти хозяева могут включать хорошо известных эукариотических и прокариотических хозяев, таких как штаммы Е. coli, Pseudomonas, Bacillus, Streptomyces, грибы, дрожжи, клетки насекомых, таких как Spodoptera frugiperda (Sf9), клетки животных, такие как клетки яичников китайских хомячков и мышиные клетки, такие как NS/О, клетки африканской зеленой мартышки, такие как COS 1, COS 7, BSC 1, BSC 40 и BNT 10, и клетки человека, а также клетки растений в клеточной культуре. Для экспрессии в клетках животных мы предпочитаем культуры клеток СНО и COS 7, а особенно - линии СНО клеток СНО (DHFR-) или НКВ.
Следует учитывать, что не все векторы и контролирующие экспрессию последовательности будут функционировать одинаково хорошо при экспрессии описанных здесь последовательностей ДНК. И также не все хозяева одинаково хорошо подойдут для одной системы экспрессии. Однако специалист в данной области техники может сделать выбор между этими векторами, контролирующими экспрессию последовательностями и хозяевами без лишнего экспериментирования. Например, при выборе вектора следует учитывать хозяина, так как вектор должен в нем реплицироваться. Следует учитывать также копийность вектора и возможность контролировать копийность и экспрессию каких-либо других белков, кодируемых этим вектором, таких как маркеры антибиотиков. Например, векторы, предпочтительные для осуществления данного изобретения, включают такие, которые позволяют кодирующей мутантный белок ДНК амплифицироваться с определенным количеством копий. Такие амплифицируемые векторы хорошо известны в данной области техники. Они включают, например, векторы, которые можно накапливать DHFR амплификацией (см., например, Kaufman, United States Patent 4470461, Kaufman and Sharp, “Construction Of A Modular Dihydrafolate Reductase cDNA Gene: Analysis Of Signals Utilized For Efficient Expression”, Mol. Cell. Biol, 2, p.1304-19 (1982)) или амплификацией с глутамин синтетазой (“GS”) (см., например, патент США 5122464 и опубликованную европейскую заявку 338841).
При выборе последовательности, контролирующей экспрессию, следует учитывать разнообразные факторы. Эти факторы включают, например, относительную силу последовательности, ее контролируемость и совместимость с последовательностью ДНК, кодирующей мутантный белок IL-2, особенно это касается возможных вторичных структур. Хозяев следует выбирать с учетом их совместимости с выбранным вектором, токсичности продукта, кодируемого описанными в изобретении последовательностями ДНК, характеристик их секреции, их способности правильно складывать полипептиды, требований к их ферментации или культивированию и легкостью очистки продуктов, кодируемых последовательностями ДНК.
Учитывая указанные параметры, специалист в данной области техники может подобрать различные комбинации вектор/последовательность контроля экспрессии/хозяин, которые позволят экспрессировать требуемые последовательности ДНК при ферментации или крупномасштабном использовании животной культуры, например, при использовании клеток СНО или COS 7.
Получаемые согласно данному изобретению мутантные белки IL-2 могут быть гликозилированы или дегликозилированы в зависимости от организма хозяина, использованного для получения белка. Если в качестве хозяина выбраны бактерии, то мутантные белки IL-2 будут негликозилированы. С другой стороны, эукариотические клетки будут гликозилировать мутантные белки IL-2, хотя, возможно, не совсем так, как гликозилирован природный IL-2. Мутантный белок, производимый трансформированным хозяином, можно очистить любым подходящим методом. Известны различные методы для очистки IL-2. Смотри, например, Current Protocols in Protein Science, v. 2. Eds: John E. Coligan, Ben M. Dunn, Hidde L. Ploehg, David W. Speicher, Paul T. Wingfield, Unit 6.5 (Copyright 1997, John Wiley and Sons, Inc.). Авторы предпочитают переосаждение из тел включения, образуемых в E. coli, или из кондиционированной среды культур клеток дрожжей или млекопитающих, продуцирующих данный белок, с использованием катионного обмена, гель-фильтрации и/или обращеннофазовой жидкостной хроматографии. Смотри ниже примеры 1 (Е.coli) и 10 (перфузия СНО клеток).
Биологическая активность описываемых в изобретении мутантных белков IL-2 может быть исследована любым подходящим методом, известным в данной области техники. Такие исследования включают пролиферацию ФГА-бластов и NK-клеток. Мутантные белки с подходящей активностью, т.е. полностью активные по отношению к IL-2Rαβγ, с пониженной активностью на клетках, несущих IL-2Rβγ, определяют по результатам двух анализов. “Относительная активность” мутантного белка измеряется по отношению к IL-2 дикого типа и, как описано далее в примерах, представляет отношение активности пролиферации ФГА-бластов к активности пролиферации NK-клеток.
Описываемый в изобретении мутантный белок IL-2 следует назначать в дозе, примерно соответствующей или превышающей дозу, применяемую при лечении природным или рекомбинантным IL-2 дикого типа. Предпочтительно назначать эффективное количество мутантного белка IL-2. “Эффективное количество” означает количество, способное предотвратить или снизить тяжесть или распространение состояния или показания, при котором требуется лечение. Специалистам в данной области техники будет понятно, что эффективное количество мутантного белка IL-2 зависит от заболевания, дозы, графика приема мутантного белка IL-2, от того, назначается ли мутантный белок IL-2 один или в комплексе с другими лекарственными средствами, от времени полужизни состава в сыворотке и от общего состояния здоровья пациента.
Мутантный белок IL-2 предпочтительно вводят в составе, включающем фармацевтически приемлемый носитель. Термин “фармацевтически приемлемый носитель” означает носитель, который не оказывает неблагоприятного действия на пациентов, которым его назначают. Такие фармацевтически приемлемые носители хорошо известны в данной области техники. Мы предпочитаем 2% HSA/PBS при рН 7,0.
Мутантные белки IL-2 могут быть введены в состав фармацевтических композиций хорошо известными методами. Например, в Remington’s Pharmaceutical Science by E.W. Martin, включенной в описание изобретения в качестве ссылки, описаны подходящие составы. Фармацевтическая композиция с мутантным белком IL-2 может быть приготовлена в различных формах, включая жидкость, гель, лиофилизированное вещество или другую подходящую форму. Предпочтительная форма зависит от конкретного показания к применению и будет очевидна специалисту в данной области техники.
Фармацевтическая композиция с мутантным белком IL-2 может назначаться перорально, в аэрозоле, внутривенно, внутримышечно, внутрибрюшинно, внутрикожно или подкожно или другим приемлемым способом. Предпочтительный способ введения зависит от конкретного показания к применению и будет очевиден специалисту в данной области техники. Фармацевтическая композиция, содержащая мутантный белок IL-2, может назначаться совместно с другими лекарственными средствами. Эти средства могут быть введены в состав данной фармацевтической композиции или применяться отдельно от мутантного белка IL-2, либо одновременно, либо согласно другому графику приема. Кроме того, фармацевтическая композиция с мутантным белком IL-2 может применяться в качестве вспомогательного средства при других видах лечения.
Таким образом, данное изобретение обеспечивает составы и способы лечения ВИЧ, рака, аутоиммунного заболевания, инфекционных заболеваний, для применения в качестве адъюванта раковой вакцины и при обычной вакцинной терапии, для стимуляции иммунитета у пожилых людей или других пациентов с ослабленным иммунитетом, а также у больных ГКИ, или для других терапевтических методов, требующих общей стимуляции иммунной системы животных, предпочтительно млекопитающих, наиболее предпочтительно человека. Как было отмечено ранее, IL-2 обладает разными активностями. К ним относятся стимуляция ФГА-бластов, покоящихся Т-клеток, В-клеток, моноцитов и NK-клеток и т.д.; мутантные белки, описанные в данной работе, обладают активностью на клетках, экспрессирующих только высокоаффинный IL-2-рецептор, таких как покоящиеся Т-клетки, но не на тех, которые эксдрессируют рецептор с промежуточной активностью, таких как NK-клетки или моноциты.
Также предполагается использование последовательностей ДНК, кодирующих мутантные белки IL-2, в генной терапии. Применение в генной терапии включает лечение тех заболеваний, при которых ожидается, что IL-2 обеспечит терапевтический эффект благодаря активации Т-клеток, например, при ВИЧ, раке, аутоиммунном заболевании, инфекционных заболеваниях, для применения в качестве адъюванта раковой вакцины и при обычной вакцинной терапии, для стимуляции иммунитета у пожилых людей или других пациентов с ослабленным иммунитетом, а также у больных ГКИ, и при других заболеваниях или инфекционных агентах, восприимчивых к IL-2 опосредованному иммунному ответу.
Местная доставка мутантных белков IL-2 при использовании генной терапии может обеспечить попадание лекарственного средства в требуемую область. Рассматриваются методики применения генной терапии как in vitro, так и in vivo. Известно несколько методов доставки потенциально терапевтических генов к определенным клеточным популяциям. Смотри, например, Mulligun, “The Basic Science Of Gene Therapy”, Science, 260: 926-31 (1993). Эти методы включают:
1) прямой перенос генов. Смотри, например, Wolff et al., “Direct Gene transfer Into Mouse Muscle In Vivo”, Science, 247:1465-68 (1990);
2) доставка ДНК через липосомы. Смотри, например, Caplen et al., “Liposome-mediated CFTR Gene Transfer To The Nasal Epithelium Of Patients With Cystic Fibrosis”, Nature Med. 3: 39-46 (1995); Crystal, “The Gene As A Drug”, Nature Med. 1:15-17 (1995); Gao and Huang, “A Novel Cationic Liposome Reagent For Efficient Transfection Of Mammalian Cells”, Biochem. Biophvs. Res. Comm., 179:280-85 (1991);
3) перенос ДНК посредством ретровирусов. См., например, Кау et al., “In Vivo Gene Therapy Of Hemophilia В: Sustained Partial Correction In Factor IX-Deficient Dogs”, Science, 262:117-19 (1993); Anderson, “Human Gene Therapy”, Science, 256:808-13 (1992);
4) перенос ДНК посредством ДНК-содержащих вирусов. Такие ДНК-вирусы включают аденовирусы (предпочтительны векторы на основе Ad-2 или Ad-5), герпес вирусы (предпочтительны векторы на основе герпес симплекс вируса) и парвовирусы (предпочтительны векторы на основе “дефектных” или неавтономных парвовирусов, более предпочтительны векторы на основе аденоассоциированых вирусов, наиболее предпочтительны - на основе AAV-2). См., например, Аli et al., “The Use Of DNA Viruses As Vectors For Gene Therapy”, Gene Therapy, 1:367-84 (1994); патент США 4797368, включенный в описание в качестве ссылки, и Патент США 5139941, включенный в описание в качестве ссылки.
Выбор конкретной векторной системы для переноса требуемого гена зависит от различных факторов. Одним из важных факторов является природа популяции клеток-мишеней. Хотя ретровирусные векторы интенсивно изучались и использовались при применении генной терапии, они, в общем, не подходят для инфицирования неделящихся клеток. Кроме того, ретровирусы обладают онкогенным потенциалом.
Преимущества аденовирусов состоят в том, что они обладают более широкой видоспецифичностью, могут инфицировать молчащие и окончательно дифференцированные клетки, такие как нейроны и гепатоциты, и по существу неонкогенны. См., например, Ali et al., “The Use Of DNA Viruses As Vectors For Gene Therapy”, Gene Therapy, 1:367 (1994). Аденовирусы, по-видимому, не интегрируют в геном хозяина. Так как они существуют экстрахромосомно, значительно снижается риск инсерционного мутагенеза. Аli et al., “The Use Of DNA Viruses As Vectors For Gene Therapy”, Gene Therapy, 1:373 (1994).
Аденоассоциированные вирусы (ААВ) обладают теми же преимуществами, что и векторы на основе аденовирусов. Однако ААВ демонстрируют способность к сайт-специфической интеграции в хромосому человека 19. Ali et al., “The Use Of DNA Viruses As Vectors For Gene Therapy”, Gene Therapy, 1:377 (1994).
В предпочтительном варианте осуществления изобретения ДНК, кодирующая мутантный белок IL-2, используется в генной терапии иммунодефицитных заболеваний, таких как ВИЧ; инфекционных заболеваний, таких как туберкулез; и раковых заболеваний, таких как карцинома почки.
Согласно этому варианту осуществления генная терапия при помощи ДНК, кодирующей мутантные белки IL-2, описанные в данном изобретении, при необходимости назначается пациенту параллельно или сразу после постановки диагноза.
Этот подход обладает преимуществом селективной активности мутантных белков IL-2 и предотвращает токсичность и неблагоприятные воздействия. Специалисту в данной области техники будет понятно, что согласно этому способу осуществления изобретения можно использовать любой подходящий вектор для генной терапии, включающий ДНК, кодирующую мутантный белок IL-2. Методы для конструирования таких векторов известны. См., например, Anderson, W.F., Human Gene Therapy, Nature, 392 25-30 (1998); Verma, I.M., and Somia, N., Gene Therapy - Promises, Problems, and Prospects, Nature, 389 239-242 (1998). Введение вектора, содержащего ДНК, кодирующую мутантный белок IL-2, в требуемый сайт можно осуществить при использовании известных методик.
Для лучшего понимания изобретения ниже приведены примеры. Эти примеры служат только иллюстрацией и не рассматриваются как ограничивающие объем и сущность изобретения каким-либо образом.
С. Примеры
Пример 1. Получение мутантных белков в Е.coli. Мутантные белки были получены сайт-направленным мутагенезом при использовании праймеров, содержащих кодоны, относящиеся к требуемой мутации, как это описано Kunkel ТА, Roberts JD, and Zokour RA, “Rapid and efficient site-specificmutagenesis without phenotypic selection” (1987), Methods Enzymol 154:367-382. Кратко, человеческую кДНК IL-2, содержащую сайты рестрикционных ферментов Ваm HI и Хbа I, субклонировали в фаговый вектор М13 mp19 (New England Biolabs, Beverly, MA) с использованием этих сайтов. кДНК IL-2 дикого типа была получена при использовании полимеразной цепной реакции (ПЦР) с пула кДНК образованных из мРНК, выделенной из лимфоцитов периферийной крови человека, индуцированных за 24 часа 12-муристат-13-ацетатом форбола (10 нг/мл). В ПЦР использовались праймеры: для 5’ конца открытой рамки считывания IL-2:
5’-CCT CAA CTC CTG AAT TCA TGT АСА GGA TGC-3’ (SEQ ID NO: 3);
и для 3’ конца открытой рамки считывания IL-2:
5’-GGA AGC GGA ТСС ТТА TCA AGT CAG TGT TGA G-3’ (SEQ ID NO: 4).
В каждый олигонуклеотид были включены сайты ферментов рестрикции Eco RI (5’ конец) и Barn HI (3’ конец), они выделены курсивом. ПЦР проводили в следующих условиях: 1 минута при 94°С, 1 минута при 58,7°С и 1 минута при 72°С в течение 25 циклов. Правильность полученной таким способом IL-2кДНК подтверждали секвенированием с использованием набора Sequenase® (Amersham Life Sciences, Arlington Heights, IL) согласно протоколу, указанному производителем. Содержащая урацил одноцепочечная ДНК (U-ДНК) была получена трансформацией штамма CJ236 Е. coli (Bio-Rad Laboratories, Hercules, СА) вектором М13 mp19, содержащим U-2кДНК. Для сайт-направленного мутагенеза использовали праймеры, содержащие 15 нуклеотидов, гомологичных матричной U-ДНК с 5’ стороны от кодонов, предназначенных для мутагенеза, нуклеотиды, включающие требуемую замену, и 10 нуклеотидов, гомологичных матричной U-ДНК с 3’ конца от последнего измененного нуклеотида. Первоначально сайт-направленный мутагенез использовали для введения сайта рестрикции NcoI в начало зрелой последовательности человеческого IL-2. Внесение этого сайта включает N-концевой остаток метионина, который направляет экспрессию в цитоплазматическом пространстве Е.coli при использовании, например, вектора для экспрессии pET3d. Праймер, использованный для этой цели представлял собой:
5’-GCA CTT GTC АСА AAC ACC ATG GCA CCT ACT TCA AGT-3’ (SEQ ID NO: 5)
Специфические праймеры, использованные для внесения мутаций в положения D20, N88 и Q126, представляли собой:
D20X: 5’-GGA GCA TTT ACT GCT GNN NTT АСА GAT G-3’ (SEQ ID NO:6)
N88X: 5’-GGG ACT TAA TCA GCN NNA TCA ACG TAA TAG-3’ (SEQ ID NO:7)
Q126X 5’-GGA TTA CCT TTT GTN NNA GCA TCA TCT С-3’ (SEQ ID NO:8)
где NNN заменяли на соответствующие кодоны гистидина (САС) или изолейцина (АТС) (в положении D20), аргинина (CGT), глицина (GGT), или изолейцина (АТС) (в положении N88), или лейцина (CTG) (в положении Q126). Другие мутации вносили с применением аналогичной стратегии и соответствующего кодона для данной мутации. Праймеры фосфорилировали Т4 полинуклеотид киназой (New England Biolabs, Beverly, MA) согласно протоколу, указанному производителем. После отжига праймера на матричной U-ДНК и амплификации с помощью Т7 ДНК полимеразы (Bio-Rad Laboratories, Hercules, CA) клетки Е. coli штамма DH5α™ (GibcoBRL, Gaithersburg, MD) трансформировали 5 мкл реакционной смеси и высевали на среду LB, содержащую 0,7% агара. После инкубации при 37°С материал колоний размножали отбором единичных колоний и переносом их в 2 мл среды LB, с последующей инкубацией при 37°С в течение ночи. Одноцепочечную ДНК получали с использованием набора для выделения М13 (Quiagen, Inc., Chatsworth, CA) согласно протоколу, указанному производителем, а клоны, содержащие требуемую мутацию, идентифицировали секвенированием одноцепочечной ДНК с использованием набора для секвенирования Sequenase® (Amersham Life Sciences, Arlington Heights, IL) согласно протоколу, указанному производителем. кДНК мутантного белка IL-2 из репликативной формы ДНК, соответствующей колониям, содержащим корректно мутированную последовательность, выделяли с использованием Nco I и Хbа I и субклонировали в плазмидный вектор рЕТ3а (Stratagene, San Diego, CA) (Strat). Штамм Е.coli BL21 трансформировали содержащим мутантный белок вектором рЕТ3а, растили до показателя ABS280 (оптической плотности при 280 нм) 0,60-1,0, и в этот момент добавляли 0,4 мМ ИПТГ (изопропилтиогалактозид) для индукции продукции мутантного белка IL-2.
Пример 2. Экстракция и очистка мутантных белков IL-2 из E.coli
Через три часа после индукции клетки собирали центрифугированием при 10,000×g. Для ренатурации и очистки рекомбинантных мутантных белков IL-2 клетки сначала диспергировали в 10-кратном объеме (объем/влажная масса) буфера сахароза/Трис/ЭДТА (0,375 М сахарозы, 10 мМ Трис НСl рН 8,0, 1 мМ ЭДТА). Диспергированные клетки озвучивали ультразвуком при 300 W с 30-секундными интервалами в ледяной бане на приборе Missonix модель XL2020, оснащенном 1-дюймовым стандартным электродом. Затем озвученный материал центрифугировали при 17,000×g в течение 20 минут при 4°С. Осадок, который на этом этапе должен быть белого цвета, промывали ресуспендированием и центрифугированием один раз в буфере сахароза/Трис/ЭДТА, дважды в буфере Трис/ЭДТА (50 мМ Трис НСl, рН 8,0,1 мМ ЭДТА), затем ресуспендировали в 10-кратном объеме буфера 0,1 М Трис НСl, рН 8,0 (на этом этапе отбирали образец для анализа в геле) и центрифугировали в течение 20 минут при 17,000×g.
Осадок растворяли добавлением 3-кратного объема 8 М гуанидин хлорида в 0,1 М Трис НСl (рН 8,0) и 0,1% (объем/объем) 2-меркаптоэтанола. После инкубации в течение 2 часов при комнатной температуре материал центрифугировали в течение 20 минут 17,000×g. Полученный раствор диализовали в течение приблизительно 20 часов против 20-кратного объема 10 мМ Трис НСl, рН 8,0, 1 мМ ЭДТА при 4°С. Раствор центрифугировали при 17,000×g в течение 20 минут, доводили трифторуксусной кислотой до концентрации 0,1% и фильтровали через фильтр 0,22 мкм. Раствор немедленно переносили в силиконизированный флакон и загружали на колонку С8 (Vydac 208TP54). Мутантные белки IL-2 очищали, применяя 20-тиминутный линейный градиент с использованием 45-85% ацетонитрила в 0,1% ТФУ. Концентрацию элюированного белка определяли по показателю А280 и аминокислотным анализом. Затем белок разделили на аликвоты (100 мл) в силиконизированные пробирки и хранили при -20°С. Таким образом, очищенный мутантный белок представлял собой единичную полосу в SDS-полиакриламидном геле (SDS-ПААГ) (SDS - додецилсульфат натрия) (окрашивание серебром) и оценивался аминокислотным анализом (типичная точность >90%).
Пример 3. Исследование пролиферации Т-клеток
Моноядерные клетки периферийной крови (РВМС) выделяли из приблизительно 100 мл нормальной крови человека (Irwin Memorial Blood Bank, San Francisco, CA), разведенной в соотношении 1:2 холодным фосфатным буфером Dulbecco (свободный от Са2+ и Mg2+, DPBS). Материал центрифугировали на подложке Ficoll-Paque (Pharmacia) для отделения клеток РВМС, которые затем промывали большим количеством холодного DPBS. ФГА-бласты (активированные Т-клетки) получали ресуспендированием клеток в среде RPMI 1640, содержащей 10% эмбриональной бычьей сыворотки (Hyclone), к которой добавляли до 1% (вес/объем) каждого из компонентов: L-глутамин; заменимые аминокислоты; пируват натрия; и антибиотик - противомикозное вещество (среда RPMI) при плотности 1×106 клеток/мл. Добавляли фитогемагглютинин (ФГА-Р; Sigma) до конечной концентрации 10 мкг/мл и инкубировали клетки при 37°С, 5% CO2 в течение 3 дней. Клетки собирали и промывали дважды DPBS, ресуспендировали в среде RPMI и высевали на 96-луночные планшеты с плоским дном с плотностью 1×106 клеток/лунку в 200 мкл с различными концентрациями IL-2 или мутантного белка в среде RPMI. Планшеты инкубировали в течение 48 часов при 37°С, обрабатывали 1 мкКю 3H-тимидина (DuPont NEN®, Boston, МА)/лунку в течение 6 часов, собирали и измеряли радиоактивность после сбора клеток на фильтры из стекловолокна.
Пример 4. Исследование пролиферации NK-клеток
Моноядерные клетки периферийной крови (РВМС) выделяли из приблизительно 100 мл нормальной крови человека (Irwin Memorial Blood Bank, San Francisco, СА), разведенной в соотношении 1:2 холодным фосфатным буфером Dulbecco (свободный от Са2+ и Mg2+, DPBS). Материал центрифугировали на подложке Ficoll-Paque (Pharmacia) для отделения клеток РВМС, которые затем промывали большим количеством холодного DPBS. Отделяли NK-клетки от остальных клеток. Для этих целей предпочтителен набор для выделения NK-клеток Miltenyi Biotec (Bergisch Gladbach, Germany; Cat# 465-01). Набор состоит из двух реактивов, колонок для разделения и очень мощного магнитного штатива для колонки. Первый реактив - это смесь конъюгированных с гаптеном моноклональных антител CD3, CD4, CD19, CD33 изотипа IgG1 мыши. Этот реактив предназначен для отделения клеток РВМС от Т-клеток, В-клеток и миелоидных клеток. Судя по всему, можно использовать любой подходящий набор антител, распознающих эти типы клеток. Второй реактив состоит из коллоидных суперпарамагнитных микробусин MAC, конъюгированных с антигаптеновым антителом. Клетки ресуспендировали в PBS, содержащем 0,5% бычьего сывороточного альбумина и 2 мМ ЭДТА (PBS/EDTA). Объем суспензии зависит от количества клеток и приводится в графике Miltenyi Biotec. Обычно 2-5×108 клеток РВМС ресуспендировали в 800 мкл буфера и затем использовали по 200 мкл каждого реагента. После инкубации с реагентами клетки (ресуспендированные в 2 мл буфера) наносили на колонку. Все клетки, кроме NK-клеток, связываются с магнитом, a NK-клетки отделяются и собираются на выходе. Клетки промывали, ресуспендировали в среде RPMI (содержит: RPMI 1640, к которой добавлены до 1% каждого из компонентов: L-глутамин; заменимые аминокислоты; пируват натрия; и антибиотик - противомикозное вещество (все компоненты от GibcoBRL, Gaithersburg, MD); 10% эмбриональную бычью сыворотку (Hyclone)) и высевали на 96-луночные планшеты с плоским дном с плотностью 1×105 клеток/лунку в 200 мкл. Клетки собирали и промывали дважды в DPBS, ресуспендировали в среде RPMI и высевали на 96-луночные планшеты с плоским дном с плотностью 1х105 клеток/лунку в 200 мкл с различными концентрациями IL-2 или мутантного белка в среде RPMI. Планшеты инкубировали в течение 48 часов при 37°С, обрабатывали 1 мкКю 3H-тимидина (DuPont NEN®, Boston, МА)/лунку в течение 6 часов, собирали и измеряли радиоактивность после сбора клеток на фильтры из стекловолокна.
Пример 5. Мутантные белки, активирующие Т-клетки предпочтительно перед NK-клетками
Мутантные белки получали, используя сайт-направленный мутагенез (Kunkel et al. (1987), Methods Emzymol 154: 367-382) в положениях Asp-20, Asn-88 и Gln-126, и экспрессировали в Е.coli с использованием системы для экспрессии рЕТ-3а согласно описанию, предлагаемому производителем (Stratagene). Мутантные белки очищали восстановлением тел включения в гуанидин-HCl, переосаждали и подвергали ВЭЖХ как описано ранее. Полученный белок характеризовался чистотой >95% согласно анализу в окрашенном серебром SDS-ПААГ; концентрация и чистота белка определялись аминокислотным анализом (ААА) (точность ААА обычно >90%). Последовательность мутантных белков с подходящей активностью подтверждали масс-спектрометрическим анализом. Очищенные таким образом белки подвергали описанным выше исследованиям на Т- и NK-клетках. Относительные активности мутантных белков IL-2 в этих исследованиях приведены в табл. 1.
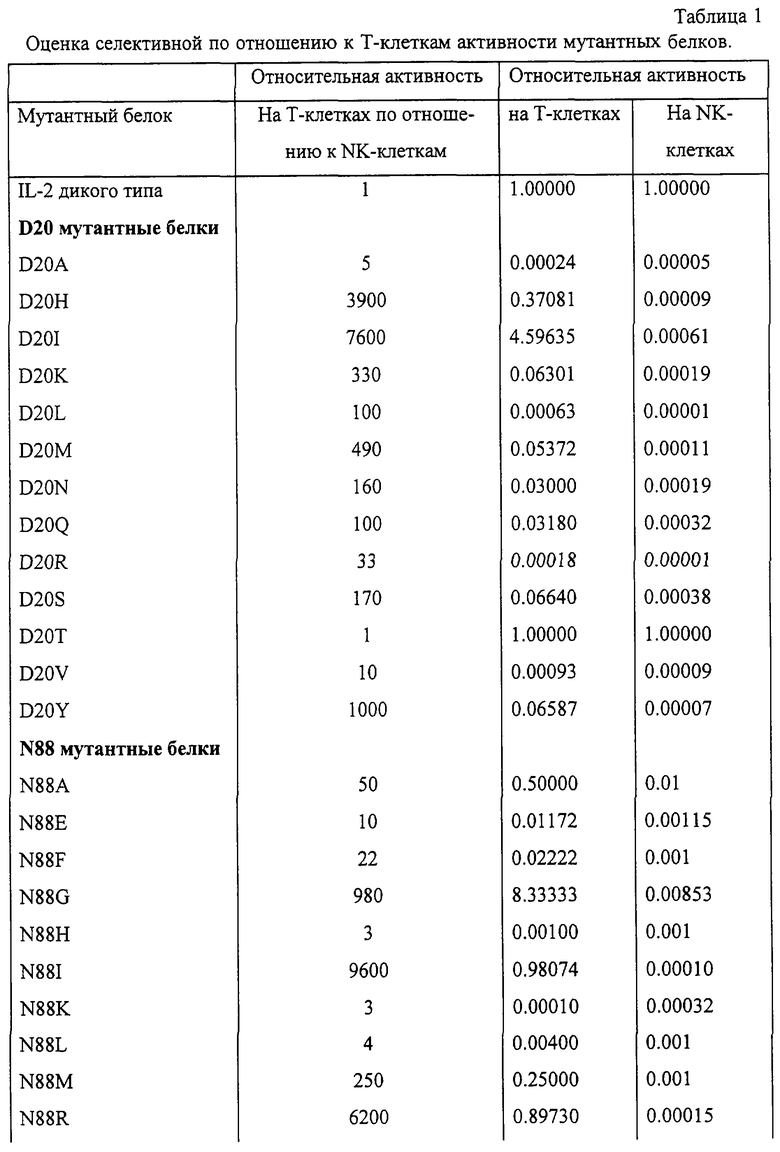
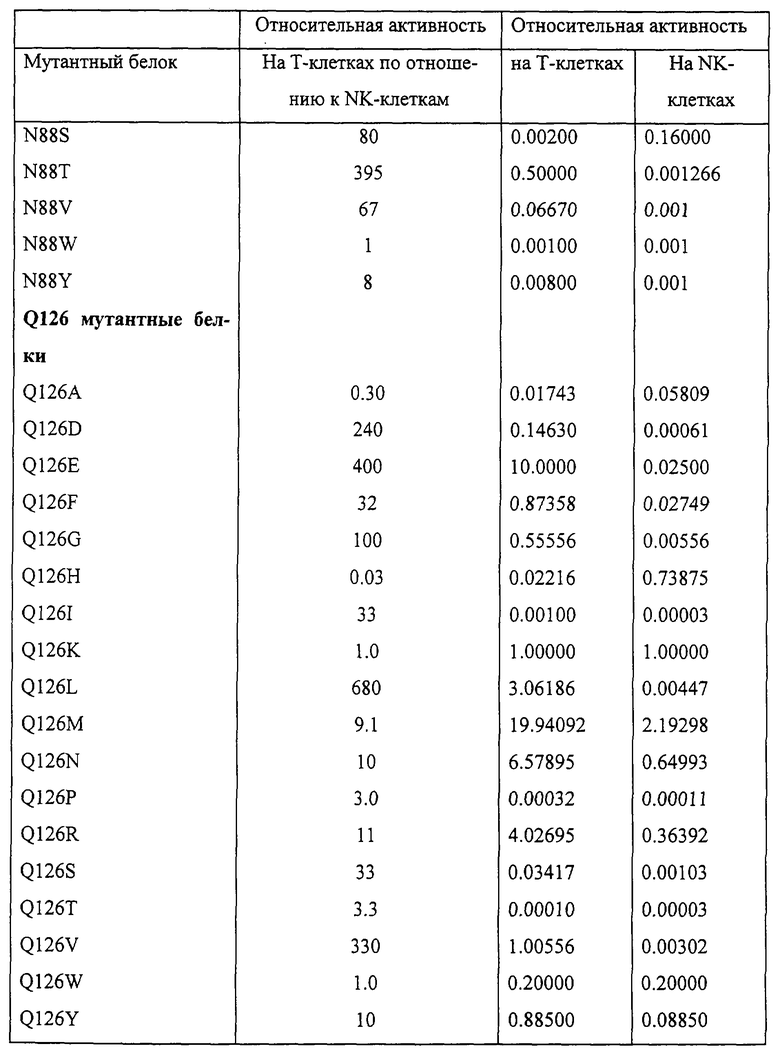
Активности мутантных белков описываются как относительная концентрация мутантного белка, требуемая для получения 50% от максимального ответа (ЕС50), в сравнении с EC50 для IL-2 дикого типа в том же исследовании; в случае проведения нескольких анализов одного мутантного белка приводится среднее геометрическое полученных величин. Значения ЕС50 для IL-2 дикого типа лежат в пределах между -10 и 150 рМ в исследовании на Т-клетках, и -50 и -200 рМ в исследовании на NK-клетках. Это соотношение вычисляется для каждого мутантного белка с учетом активности, определяемой в исследованиях на Т- и NK-клетках, полученных от одного донора.
Активности мутантных белков можно разделить на 6 обширных категорий: 1) 1000-кратная селективность по отношению к Т-клеткам; 2) 100- <1000-кратная Т-клеточная селективность; 3) 10- <100-кратная селективность по отношению к Т-клеткам; 4) активность по отношению к Т-клеткам, повышенная по сравнению с IL-2; 5) селективность по отношению к NK-клеткам; 6) 10-кратная селективность либо к Т-, либо к NK-клеткам.
Класс 1: D20H, I и Y; N88G, I и R.
Класс 2: D20K, L, М, N, Q и S; N88M и Т; Q126D, Е, G, L и V.
Класс 3: D20R; N88A, Е, F, S и V; Q126F, I, N, R и S.
Класс 4: D20I; N88G; Q126E, L, M, N и R.
Класс 5: Q126A, Н.
Класс 6: D20A, Т и V; N88H, К, L, W и Y; Q126K, Р, Т, W и Y.
Внутри классов 1-3 предпочтительными являются мутантные белки, обладающие на Т-клетках активностью, близкой или превышающей активность IL-2 дикого типа. В классе 1 это белки D20H и I; N88G, I и R; в классе 2 - N88M и Т, Q126D, Е, G, L и V; в классе 3 - N88A, Q126F и G. Предсказано, что мутантные белки Класса 4 обладают большей, чем IL-2 дикого типа, потенциальной активностью in vivo.
По табл. 1 можно заметить, что ни одна единичная мутация не привела к инактивации мутантного белка IL-2 в обоих исследованиях. Однако можно заключить, что комбинация мутаций по отдельным положениям, приведших к значительному снижению активности, потенциально может привести к антагонистической активности IL-2 на Т-клетках или других типах клеток, несущих высокоаффинный IL-2-рецептор. Получение такого антагониста предсказывается на основании этих данных, так как мутации вносились только для изменения взаимодействия с IL-2Rβ и IL-2Rγ. Одним из таких примеров может быть двойной мутант D20R/Q126T. Предполагается, что сочетание слабоактивных мутаций в одной молекуле будет обладать комбинаторньм эффектом, то есть активность D20R на Т-клетках - 0,00018, активность Q126T - 0,0001, и ожидается, что активность двойного мутанта D20R/Q126T будет составлять 0,000000018 активности IL-2 дикого типа на Т-клетках. Согласно приведенным данным можно составить и другие комбинации мутаций.
Пример 6. Биологическая активность IL-2 дикого типа и мутантных белков IL-2
На фиг.1-7 показаны кривые зависимости от дозы для IL-2 дикого типа (IL-2) и D20H (фиг.1), IL-2 и D20I (фиг.2), IL-2 и N88G (фиг.3), IL-2 и N88I (фиг.4). IL-2 и N88R (фиг.5), IL-2 и Q126E (фиг.6) и IL-2 и Q126L (фиг.7). А: Индивидуальный ответ на дозу IL-2 (закрашенные кружки) и мутантного белка (незакрашенные кружки) в исследовании пролиферации первичных Т-клеток (ФГА-бластов) человека. В: Индивидуальный ответ на дозу IL-2 (закрашенные треугольники) и мутантного белка (незакрашенные треугольники) в исследовании пролиферации первичных NK-клеток человека.
В частности, согласно графику приведенного на фиг.1 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~1,5×10-10 М в исследовании на Т-клетках (А) и ~1×10-10 М - на NK-клетках (В). Величина ЕС50 для D20H составила ~2×10-10 М в исследовании на Т-клетках и оценивалась >1×10-5 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности D20H на Т-клетках над активностью на NK-клетках составляет >50,000 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.2 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет -1,5×10-10 М в исследовании на Т-клетках (А) и ~3×10-10 М - на NK-клетках (В). Величина ЕС50 для D20I составила также -1,5×10-10 М в исследовании на Т-клетках и оценивалась ~5×10-6 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности D20I на Т-клетках над активностью на NK-клетках составляет ~16,000 раз.
Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.3 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~4×10-11 М в исследовании на Т-клетках (А) и ~2×10-10 М - на NK-клетках (В). Величина ЕС50 для N88G составила ~5×10-12 М в исследовании на Т-клетках и оценивалась ~3×10-8 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности N88G на Т-клетках над активностью на NK-клетках составляет ~1,200 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.4 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~1,5×10-10М в исследовании на Т-клетках (А) и ~1×10-10 М - на NK-клетках (В). Величина EC50 для N88I составила ~4×10-10 М в исследовании на Т-клетках и оценивалась ~5×10-6 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности N88I на Т-клетках над активностью на NK-клетках составляет ~18,000 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.5 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~1,5×10-10 М в исследовании на Т-клетках (А) и ~1×10-10 М - на NK-клетках (В). Величина EC50 для N88R составила ~9×10-11 М в исследовании на Т-клетках и оценивалась ~3×10-7 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности N88R на Т-клетках над активностью на NK-клетках составляет ~5,000 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.6 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~8×10-12 М в исследовании на Т-клетках (А) и ~5×10-11 М - на NK-клетках (В). Величина ЕС50 для Q126E составила ~8×10-13 М в исследовании на Т-клетках и оценивалась ~2×10-9М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности Q126E на Т-клетках над активностью на NK-клетках составляет ~400 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Согласно графику приведенного на фиг.7 эксперимента доза IL-2 дикого типа, дающая 50% максимальной пролиферации (ЕС50), составляет ~5×10-11 М в исследовании на Т-клетках (А) и ~8×10-11 М - на NK-клетках (В). Величина EC50 для Q126L составила ~2×10-11 М в исследовании на Т-клетках и оценивалась ~2×10-8 М на NK-клетках. Таким образом, в этом исследовании конечное превышение активности Q126L на Т-клетках над активностью на NK-клетках составляет ~625 раз. Аналогичные результаты были получены при использовании крови других доноров (данные не приведены).
Пример 7. Исследование токсичности на шимпанзе
Из мутантных белков IL-2, приведенных в табл. 1, был выбран IL-2/N88R из-за его выраженной избирательной агонистической активности по отношению к Т-клеткам в исследованиях на первичных Т- и NK-клетках человека. По сравнению с IL-2 дикого типа он в -6,000 раз более активен на Т-клетках, чем на NK-клетках, а по отношению к Т-клеткам обладает активностью, по существу равной активности IL-2 дикого типа. IL-2/N88R получали в клетках СНО, очищали и оценивали активность и токсичность на модели шимпанзе. На этой модели in vivo у белка обнаружена активность, сравнимая с активностью коммерчески доступного рекомбинантного варианта IL-2 (PROLEUKIN™, Chiron Corporation, Emeryville, CA), в отличие от которого мутантный белок обладает только мягкими побочными эффектами (как по объективным, так и по клиническим параметрам).
А. Экспериментальная работа
1. Материалы и методы
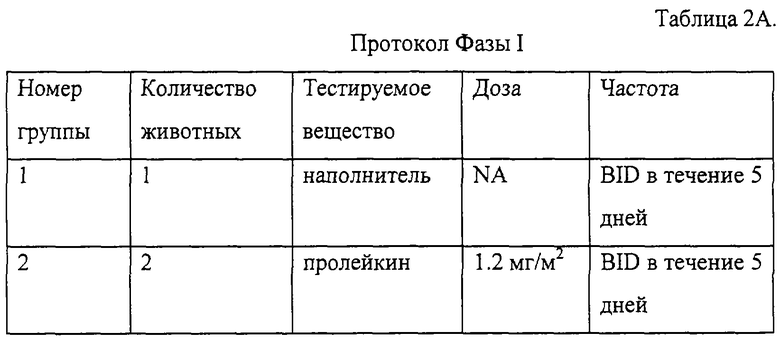
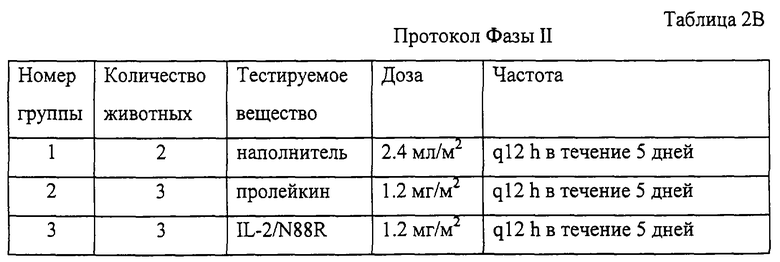
Часть исследования, включающая работу с животными, проводилась в исследовательском центре New Iberia Research Center (New Iberia, LA, Sponsor Bayer Corporation, Berkeley, CA) и включала две фазы исследований и 11 самцов шимпанзе от молодого до взрослого возраста, с массой тела в пределах от 45 до 70 кг.
Фаза I являлась стадией определения дозы и включала подкожное введение дозы наполнителя или подкожное введение дозы пролейкина, составлявшей 1,2 мг/м2, дважды в день (BID) в течение 5 дней. Фаза II заключалась в сравнении действия наполнителя, пролейкина и IL-2/N88R, введенных подкожно, каждые 12 часов (ql2h) в течение 5 дней. Дозу IL-2/N88R подбирали таким образом, чтобы его воздействие было сравнимо с пролейкином, исходя из анализа фармакокинетики. Образцы крови отбирали для анализа химического состава крови, СВС, гематологии/коагуляции и для ФСК-анализа (ФСК - флуоресцентная сортировка клеток) популяций Т- и NK-клеток, как подробно описано в разделах 5 и 6.
2. Процедура введения дозы
В дни, когда отбирали кровь, перед введением исследуемого вещества или наполнителя животным давали общую анестезию с применением кетамина IM в количестве приблизительно 10 мг/кг. В дни, когда отбор проб крови не требовался, перед введением исследуемого вещества или наполнителя животных физически иммобилизовали в тесной клетке. Дозу вводили подкожно каждые 12 часов в течение 5 дней, шерсть в районе инъекций состригали в первый день исследования. Место и время инъекции записывали при введении каждой дозы.
3. Клинические наблюдения
(a) Ежедневные наблюдения и потребление пищи. Каждое животное наблюдалось дважды в день, и о любом отклонении сообщалось руководителю исследования. Животные, выглядевшие больными, брались под наблюдение руководителя исследования, ветеринара проекта и представителя спонсора. Потребление пищи подтверждалось и фиксировалось дважды в день методом визуального наблюдения.
(b) Масса тела. Массу тела определяли до исследования, перед введением дозы в первый день и каждый раз при усыплении животного для отбора крови.
(c) Наблюдение мест инъекций. Места инъекций осматривались ежедневно. Любые отклонения, такие как покраснение или набухание, фиксировались.
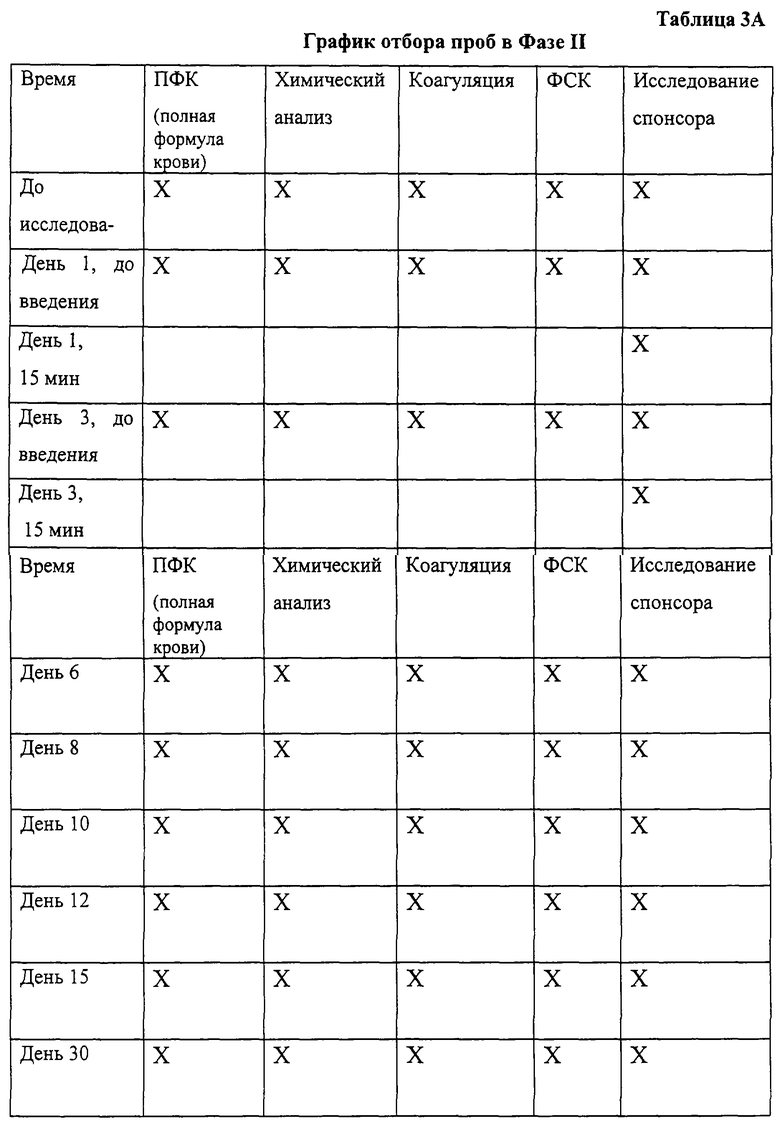
4. Работа с пробами
(а) Химический анализ сыворотки. От каждого животного в указанные выше сроки собирали приблизительно по 2 мл крови в пробирки без антикоагулянта. Документировали время отбора пробы и оставляли кровь при комнатной температуре для свертывания. Затем образцы центрифугировали, собирали сыворотку и отправляли ее в лабораторию NIRC Clinical Pathology Laboratory. Стандартная панель исследования сыворотки лаборатории NIRC представлена в табл. 4.
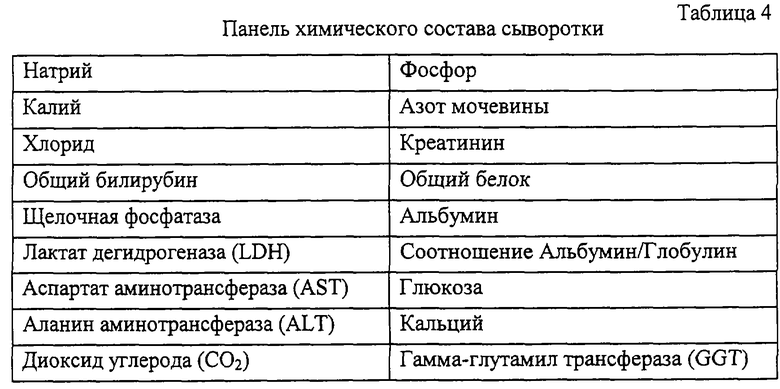
(b) Гематология. От каждого животного в указанные выше сроки собирали приблизительно по 2 мл крови в пробирки с ЭДТА и отправляли в лабораторию NIRC Clinical Pathology Laboratory. Проводили стандартное для NIRC гематологическое исследование всех образцов, включавшее полную формулу крови, дифференциальную и тромбоцитарную формулу.
(c) Исследования спонсора. В указанные выше сроки собирали приблизительно по 6 мл крови в пробирки с ЭДТА в качестве антикоагулянта. Документировали время отбора крови. Образцы центрифугировали, плазму отделяли и разносили аликвоты по трем отдельньм пробиркам. Плазму хранили замороженной (-60°С или ниже) и по окончании исследования отправили в Bayer Corporation, Berkeley, CA.
5. Исследование ФСК
(а) Методика. Примерно 5 мл крови отбирали в натрий гепариновый антикоагулянт в сроки, указанные для ФСК-анализа.
Полный образец крови был получен либо в ЭДТА, либо в ACD, либо в гепарине. Количество клеток доводили до уровня 2-20 тысяч в мм3.
Для проведения исследования на антитела помечали соответствующим образом 12×75 стеклянных или пластиковых пробирок. В каждую пробирку добавляли антитело или смесь антител в объеме, предлагаемом производителем.
В каждую пробирку добавляли по 100 мкл хорошо перемешанного образца крови и смесь инкубировали в течение 30 минут при комнатной температуре в защищенном от света месте.
После инкубации добавляли по 2 мл лизирующего раствора (Becton Dickinson FACS brand lysing solution, BD# 92-0002), аккуратно перемешивали и оставляли на 10 минут при комнатной температуре. Затем пробирки центрифугировали при комнатной температуре в течение 5 минут при 300×g. Декантировали супернатанты, удаляли излишки жидкости и к каждому клеточному осадку добавляли по 1 мл буфера PBS (Gibco 14190-144). После аккуратного перемешивания пробирки центрифугировали при комнатной температуре в течение 5 минут при 300×g. Декантировали супернатанты, удаляли излишки жидкости и к каждому клеточному осадку добавляли по 1 мл фиксирующего раствора (0,5% раствор формальдегида, полученный разведением 10% формальдегида (Polyscience, Inc. #0418) буфером PBS в соотношении 1:20) и аккуратно ресуспендировали перемешиванием. Затем образцы анализировали в цитометре Coulter EPICS SL Flow Cytometer.
В исследовании использовали следующие антитела: изотипный контроль MigGl/MigG1 (Becton Dickinson, Cat. # 349526), CD45-PerCP (Becton Dickinson, Cat. # 347464), CD8-FITC (Becton Dickinson, Cat. # 347313), CD25-PE (Becton Dickinson, Cat. # 30795X), CD4-FITC (Becton Dickinson, Cat. # 340133), CD16-PE (Becton Dickinson, Cat. # 347617), CD3-PerCP (Becton Dickinson, Cat. # 347344).
6. Профиль коагуляции
В указанные выше сроки отбирали приблизительно по 2 мл полной крови в пробирки с цитратом натрия в качестве антикоагулянта. Профиль коагуляции состоял из времени протромбина (РТ), времени активированного неполного тромбопластина (АРТТ) и фибриногена.
В. Результаты и обсуждение
1. Определение дозы пролейкина
Первичной целью этой фазы было определение оптимальной дозы пролейкина для сравнения с IL-2/N88R. Эта доза пролейкина должна быть переносимой (меньшей максимальной переносимой дозы) и в идеале должна вызывать клинически достоверный, но умеренный и обратимый токсический эффект. Доза пролейкина, составляющая 1,2 мг/м2 дважды в день, была определена в качестве начальной на основании кросс-экстраполяции требований к дозам пролейкина, их токсичности и ответа на пролейкин содержащихся в неволе обезьян Cynomolgus.
Двум шимпанзе вводили пролейкин указанным способом. На протяжении курса у животных наблюдалось значительное снижение активности, обеспокоенность и обезвоживание. У обоих животных на 3 или 4 день развились тяжелые желудочно-кишечные симптомы, включавшие снижение аппетита, диарею, рвоту. Введение препарата одному из животных (номер Х-159) было прекращено после 3 дней из-за сильной почечной (фиг.8А и В) и умеренной печеночной (фиг.8С и D) дисфункции, отраженной в химических показателях крови. Эти показатели включали повышение уровня азота мочевины крови (BUN), креатинина и общего билирубина, ALT (аланин-аминотрансферазы) (SGPT (сывороточная глутамопировиноградная трансаминаза). Животному Х-159 на 3 и 4 день, а животному Х-124 только на 4 день ввели внутривенно раствор лактата Рингера в качестве восстанавливающего средства и для предотвращения дальнейшей дегидратации. На 8 день животное Х-159 исключили из исследования из-за почечной дисфункции и возможного тромба на правой ноге, на что указывал очень слабый пульс (бедренный) и то, что вся икра была холодная и увеличенная. Хотя значительная токсичность наблюдалась в одном животном, у другого наблюдались менее тяжелые симптомы, и профиль неблагоприятных эффектов у обоих животных был обратим. Основываясь на этих данных, в качестве подходящих для сравнения препаратов доз были выбраны 1,2 мг/м2 пролейкина и эквивалентная (по воздействию) доза IL-2/N88R, каждые 12 часов.
2. Сравнение IL-2/N88R и пролейкина
Клинические наблюдения. В табл. 5 приведены клинические наблюдения, сделанные в течение исследования. Величины оцениваются по шкале от 0 до 5, где 5 означает “тяжелое”. Все животные, которым вводили пролейкин, были тяжело больны; наблюдалась одна смерть, связанная с введением пролейкина. Величины, приведенные после 6 дня, для группы пролейкина отражают данные, полученные от оставшихся двух животных. Наиболее очевидным побочным эффектом применения IL-2/N88R было умеренное желудочно-кишечное расстройство (рвота), хотя введение препарата индуцировало условную токсичность, оцениваемую параметрами, приведенными в табл. 4. Масса тела животных группы, которым вводили пролейкин, снизилась на 6% на 6 день и на 10% на 10 день, после этого медленно восстановилась (фиг.9). Напротив, у животных из групп IL-2/N88R и Наполнитель максимальное наблюдавшееся снижение массы составляло 1-3%.
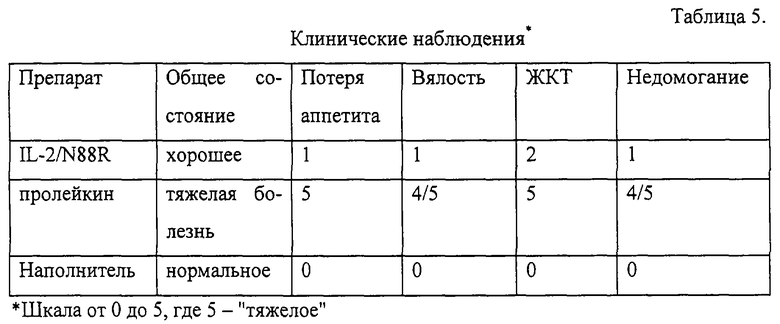
(a) Гематология. IL-2/N88R вызывал клеточные эффекты, согласующиеся с активацией пролейкина, в частности лимфоцитоз (фиг.10А), также наблюдалось увеличение количества лейкоцитов (фиг.10В) и нейтрофилов (фиг.10С). В течение исследования IL-2/N88R вызывал незначительную тромбоцитопению (низшая точка ~15%) по сравнению с пролейкином (низшая точка ~50%) (фиг.10D).
(b) Функция почек. На 6 и 8 дни уровни BUN были заметно выше у животных, которым вводили пролейкин (фиг.11А). Уровни BUN составляли более 130 мг/дл у двух из этих животных; также у двух животных резко повысились уровни креатинина на 6 и 8 дни (фиг.11В), что указывает на полное прекращение работы почек. Кроме того, у животных, которым вводили пролейкин, сильно возрос дефицит как фосфора сыворотки, так и анионов на 6 и 8 дни. Напротив, у всех животных, которым вводили IL-2/N88R, эти параметры работы почек оставались в основном в норме на протяжении исследования (фиг.11С и D).
(с) Функция печени. У животных группы, которой вводили пролейкин, общий билирубин более чем утроился на 6 день и оставался высоким до 10 дня (фиг.12А). Напротив, только у одного животного группы IL-2/N88R наблюдалось временное незначительное повышение этого параметра на 3 и 6 день. Уровень SGPT сыворотки резко повысился и достиг более 100 ед/л у всех животных группы, которой вводили пролейкин, на 6 день (фиг.12В). Уровень SGPT у животного А199 достиг 651 ед/л, а уровень SGOT (сывороточная глутамощавелевоуксусная трансаминаза) - 2789 ед/л (Лабораторный Журнал: NIRС#8754-9852-Фаза II, Таблица 1. Индивидуальные и групповые средние химические показатели, стр.17 из 21 в табл. ), что указывает на тяжелую печеночную недостаточность.
(d) Коагуляция. Уровень фибриногена более чем удвоился у животных как группы, которой вводили пролейкин, так и группы IL-2/N88R и достиг максимума на б день (фиг.12С). Увеличение уровня у животных группы, которой водили пролейкин, произошло раньше, чем у животных группы IL-2/N88R. Это отражено показателями 51% против 5% на 3 день. Изменения уровня фибриногена являются скорее результатом острого белкового ответа, чем дефектов коагуляции, так как в этот период не наблюдалось значительных изменений уровня АРТТ или РТ (фиг.12D). Однако, начиная с 10 дня, у животных группы, которой вводили пролейкин, наблюдалась явная тенденция к увеличению уровня АРТТ, хотя его абсолютные значения оставались в пределах нормы. Такая же тенденция, хотя и в меньшей степени, наблюдалась у животных группы IL-2/N88R. Интересным оказался тот факт, что в соответствующий период времени уровень фибриногена снижался в обеих группах.
(e) Гомеостаз. У двух из трех животных группы, которой вводили пролейкин, уровень натрия в сыворотке снизился до значения меньше 135 мэкв/л на 8 день, но оставался в норме у остальных животных (фиг.13А). Уровень хлорида у животных группы, которой вводили пролейкин, также снизился до значения меньше 95 мэкв/л на 3 день и оставался низким до 15 дня (фиг.13В). Уровень кальция был ниже у двух из трех животных группы, которой вводили пролейкин, на 6 и 8 дни и достиг значений 4,9 и 3,1 мг/дл у животного А199 (фиг.13С). Уровень калия снижался до значений меньше 3 мэкв/л с 3 по 12 дни у животных группы, которой вводили пролейкин, кроме животного А 199, у которого уровень калия фактически снизился до уровня токсичности 7,2 мэкв/л перед исключением его из исследования (фиг.13D).
(f) Признаки проницаемости сосудов. Уровень альбумина сыворотки снижался как в группе, которой вводили (37%), так и в группе IL-2/N88R (19%) (фиг.14А). Повышение уровня гематокрита наблюдалось в группе, которой вводили пролейкин, на 3 и 6 дни (фиг.14В). Напротив, как в группе, получавшей наполнитель, так и в группе IL-2/N88R уровень гематокрита снижался в соответствующий период и оставался низким, указывая на среднюю анемию, которая и ожидалась из-за многократного отбора проб крови (фиг.14В и С). Повышение уровня гематокрита в группе, которой вводили пролейкин, совместно со снижением альбумина согласуется с развитием синдрома проницаемости капилляров.
3. Активация клеток
Эффективность пролейкина и IL-2/N88R отслеживали по различию в процентном содержании CD25-положительных лимфоцитов (движение + пролиферация) и по значению флуоресценции CD25 или количеству СВ25-антигенов, экспрессированных на поверхности данной Т-клетки (CD25=низкоаффинному IL-2R). Экспрессию CD25 отслеживали на общей популяции Т-клеток (CD3+ клетки), а также на популяциях CD3+CD4+ и CD3+CD8+.
Активность IL-2 на NK-клетках отслеживали по анализу движения CD3-CD16+ и CD3-CD25+CD16+NK-клеток. Абсолютное количество CD3+, CD4+, CD8+, NK-клеток определяли умножением процентного содержания клеток на количество лимфоцитов в мм, данные получали во время гематологического анализа.
(а) СР25-регуляция экспрессии на поверхности Т-клеток. Согласно уровню CD25-положительных клеток процентное содержание активированных Т-клеток регулировалось в сторону увеличения на 6 день исследования, в основном на CD3+CD4+ популяции Т-клеток. Оказалось, что пролейкин индуцирует экспрессию CD25 в более высоком проценте общей популяции CD3+, CD3+CD4+ и CD3+CD8+ субпопуляций Т-клеток на 6 день. Однако на 8 день процент клеток, экспрессирующих CD25-антиген, был идентичен в лимфоцитах шимпанзе, которым вводили пролейкин, и шимпанзе, которым вводили IL-2/N88R (фиг.15А, В и С). Ни у шимпанзе, которым вводили пролейкин, ни у тех, которым вводили IL-2/N88R, не наблюдалось окрашивания CD25 на поверхности популяции NK-клеток. Предполагается, что этот результат объясняется недостатком экспрессии IL-2Rα (антигена, на который направлено окрашивание CD25 на клеточной поверхности) на поверхности выбранной популяции NK-клеток (CD3-/CD16+).
Абсолютное количество CD3+CD25+ Т-клеток определяли так же, как и процентное содержание CD3+CD25+ Т-клеток, причем оказалось, что пролейкин более активен, чем IL-2/N88R (фиг.16А). Обнаружено, что IL-2/N88R обладает потенциалом активации Т-клеток, сходным с потенциалом пролейкина на CD3+CD4+ Т-клеточной популяции, так как увеличение абсолютного количества CD3+CD4+CD25+ лимфоцитов, вызываемое IL-2/N88R, идентично такому же эффекту, вызываемому пролейкином (фиг.16 В). Обнаружено, что пролейкин увеличивает количество CD3+CD8+CD25+ Т-клеток в большей степени, чем IL-2/N88R (фиг.16С).
При введении как пролейкина, так и IL-2/N88R наблюдалась идентичная кинетика количества молекул CD25 (по значению флуоресценции), экспрессированных на CD3+CD4+ субпопуляции Т-клеток (фиг.17).
(b) Движение лимфоцитов: влияние введения пролейкина и IL-2/N88R
Активность пролейкина и IL-2/N88R на популяциях Т- и NK-клеток определяли по анализу различий в абсолютном количестве циркулирующих лимфоцитов до, во время и после введения (фиг.18). Обнаружено, что IL-2/N88R обладает большей, чем пролейкин, активностью по увеличению абсолютного количества циркулирующих CD3+CD4+ лимфоцитов (фиг.18А) и несколько сниженной по сравнению с пролейкином активностью по увеличению абсолютного количества циркулирующих CD3+CD8+ лимфоцитов (фиг.18В). Оба соединения обладают сравнимым, хотя и умеренным эффектом на увеличение общего количества CD3+ лимфоцитов (фиг.18С). Ни пролейкин, ни IL-2/N88R не влияют на движение NK-клеток (фиг.18D).
С. Выводы
IL-2/N88R был выбран путем анализа мутантных белков IL-2 в исследованиях на первичных Т- и NK-клетках человека. Он обладает 6,000-кратной селективностью in vitro по отношению к Т-клеткам по сравнению с NK-клетками. С учетом этого клеточного профиля было постулировано, что IL-2/N88R будет вызывать только слабые побочные эффекты при дозировке, которая вызовет значительную активацию Т-клеток. Эксперименты на шимпанзе, сравнивавшие пролейкин и IL-2/N88R, подтвердили, что IL-2/N88R обладает значительно лучшим профилем безопасности, чем пролейкин при сохранении сравнимой способности вызывать активацию Т-клеток.
Пример 8. Эффективность IL-2-селективного агониста N88R на модели мышиной метастазирующей в легкие опухоли СТ-26.
Методика: Мышам (Balb/c, самки, возраст 6-8 недель) в 0 день вводили внутривенно (IV) в боковую хвостовую вену 1×105 клеток СТ-26 (карцинома толстой кишки мыши) в 0,2 мл PBS. Лечение проводили пролейкином или IL-2/N88R в различных дозах (растворитель: 5% раствор декстрозы в воде (D5W)) или D5W, введением внутривенно, один раз в день в течение 8 дней (QD×8), начиная с 1 дня после имплантации. IL-2/N88R готовили при комнатной температуре разведением в D5W, используя силиконизированные ампулы и туберкулиновые шприцы, и вводили животным в течение 2 часов после приготовления. Пролейкин готовили добавлением в каждую ампулу 0,7 мл стерильной воды для инъекций (SWFI) (до конечной концентрации 1,86 мг/мл). Разведения готовили так же, как описано для IL-2/N88R в D5W (табл. 6). Животных забивали на 11 день. Легкие удаляли и взвешивали, промывали в PBS и переносили ткань в раствор Боуэна (Bouin). Через 24 часа ткань переносили в 10% формалин. Количество метастатических колоний в легких подсчитывали под микроскопом для препарирования.
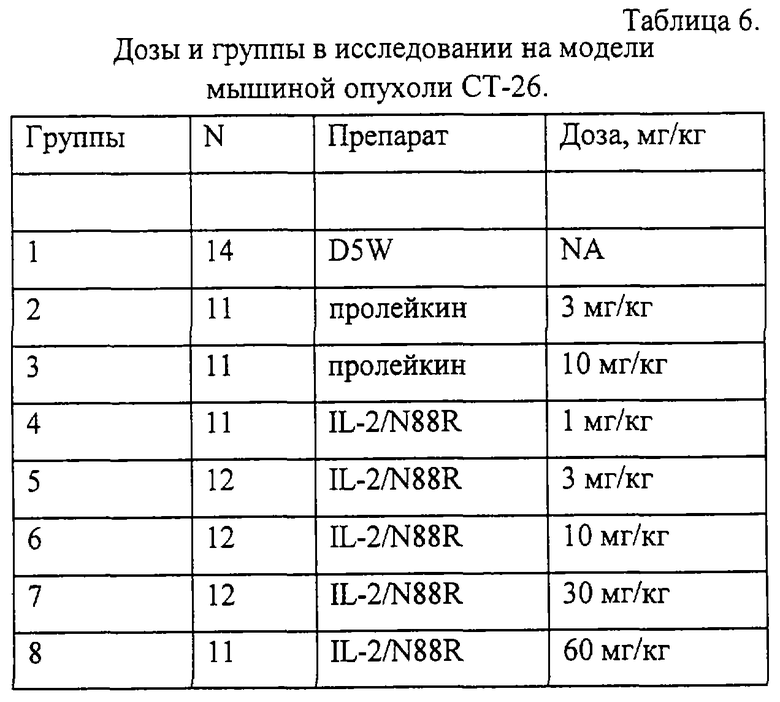
В табл. 7 приведено количество метастаз, подсчитанное в каждой мыши. При введении пролейкина и IL-2/N88R наблюдалась сравнимая эффективность. При введении высоких доз IL-2/N88R (группа 8, 60 мг/кг) у всех мышей, кроме одной, наблюдалось 12 метастаз или меньше. Этот результат контрастирует с результатом применения высшей дозы пролейкина, при которой у всех выживших мышей наблюдалось 12 метастаз или больше.
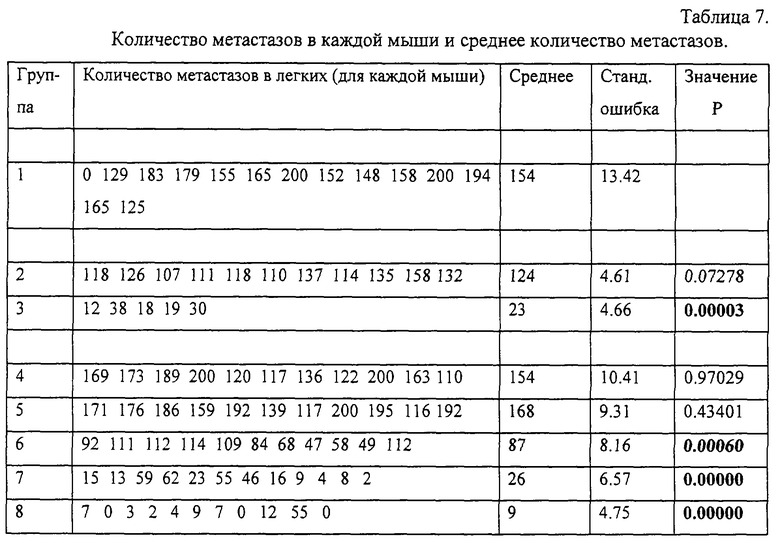
Значительное снижение количества метастазов наблюдалось у мышей, которым вводили IL-2/N88R в дозах 10,30 и 60 мг/кг (группы 6, 7 и 8 соответственно) и у мышей, которым вводили пролейкин в дозе 10 мг/кг (группа 3). Эти результаты отображены графически На фиг.19. График строили, используя логарифм дозы: для пролейкина дозы были 3 и 10 мг/кг; для IL-2/N88R - 1,3, 10, 30 и 60 мг/кг. Согласно кривой, построенной по нелинейному закону (по 4 параметрам), величины IС50 составили 5,2 мг/кг для пролейкина и 10,9 мг/кг для IL-2/N88R.
По данным этого эксперимента были вычислены величины IС50 по отношению к снижению количества метастазов, для IL-2/N88R - 10,9 мг/кг (8,6 - 13,9 мг/кг при достоверности 95%) и для пролейкина - 5,2 мг/кг (3,5 - 7,7 мг/кг при достоверности 95%).
Данные по выживанию мышей представлены в табл. 8. В группе мышей, которым вводили 10 мг/кг пролейкин, одна (1) мышь умерла на 7 день и еще пять (5) - на 8 день. По одной (1) мыши пало на 8 день в группах, которым вводили 3 или 10 мг/кг IL-2/N88R, и не отмечалось смертей у мышей, которым вводили 1, 30 или 60 мг/кг IL-2/N88R. Кроме того, большинство мышей, которым вводили 3 или 10 мг/кг пролейкина, были умирающими, среди мышей, которым вводили IL-2/N88R, умирающих не наблюдалось.
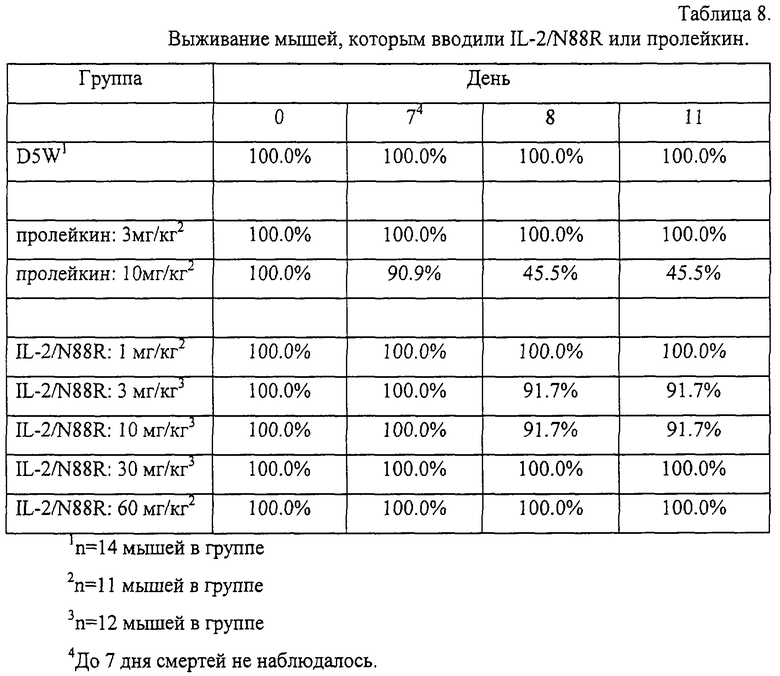
Животные обеих групп, которым вводили пролейкин, были умирающими. Среди животных, которым вводили IL-2/N88R, умирающих не наблюдалось.
Итак, в этих исследованиях показано, что IL-2/N88R так же эффективен в снижении тяжести опухолевого заболевания, как и пролейкин (согласно подсчету метастазов в легких на модели СТ-26). Кроме того, было показано, что IL-2/N88R значительно менее токсичен, чем пролейкин.
Пример 9. Получение стабильных, высокопродуктивных клеточных линий СНО, экспрессирующих IL2N88R
Клеточные линии со стабильной продукцией, секретирующие большие количества мутантного белка IL2N88R, были получены трансфекцией клеток CHO(dhfr-) вектором для экспрессии, приведенным на фиг.20 (АТСС Депозит №_РТА-8). Отдельные элементы вектора для экспрессии IL2N88R указаны на плазмидной карте (фиг.20). Обозначения: CMV е/р=цитомегаловирусный ранний промотор; РА=сигнал полиаденилирования из SV40; DHFR=кассета экспрессии дигидрофолат редуктазы.
Вектор сконструирован при использовании стандартных методик рекомбинантной ДНК. Общие ссылки: Sambrook et al., Molecular Cloning, 2d ed., 1989, Cold Spring Harbor Press; Short Protocols in Molecular Biology, 2d ed., 1992, John Wiley & Son; Methods in Enzymologv, v. 185, Ed. Goeddel et al. Academic Press, Inc., London, 1991. Экспрессионный вектор содержит отдельные кассеты для экспрессии гена IL2N88R и амплифицируемого и селективного гена DHFR (дигидрофолат редуктазы). Около 1×106 клеток СНО (яичников китайских хомячков) трансфицировали 10 мкг PBC1IL2SA при использовании реактивов Lipofectin (Life Technology Inc., Bethesda, Maryland) согласно указаниям производителя. Затем клетки отбирали в присутствии 50 нМ метотрексата и растили в среде DME/F12, дефицитной по тимидину и гипоксантину, с добавлением 5% диализованной эмбриональной бычьей сыворотки. Клеточные популяции анализировали на продукцию IL2N88R с использованием коммерческого набора для ELISA (R&D Systems). Затем высокопродуцирующие популяции отбирали в среды, содержащие возрастающие концентрации метотрексата (от 100 до 400 нМ метотрексата) и анализировали на продукцию IL2N88R. Затем применяли клонирование с ограниченным разведением для получения клонов с высокой и стабильной продуктивностью. Клонирование проводили в отсутствие метотрексата с использованием стандартных методик работы с культурами клеток.
Пример 10. Получение IL2N88R без использования сыворотки в перфузионном биореакторе
Непрерывное производство IL2N88R было организовано с применением непрерывной перфузионной ферментации. В 19-литровый ферментер Уитона (Wheaton) загрузили клетки стабильной линии СНО из примера 9 в концентрации 2×106 клеток/мл и инкубировали при уровне обмена среды 5 л/день. Использовали среду на основе среды DME/F12 (Life Technologies, Inc., Rockville, MD) с добавлением рекомбинантного человеческого инсулина (10 мкг/мл) (HUMULIN™, Еli Lilly, Inc., Indianapolis, IN) и FeSO4 ЭДТА (50 мкМ). Плотность клеток поддерживали на уровне 4×106 клеток/мл. Средний дневной выход ферментера составлял ~200 мг/день. Продукция IL2N88R стабильно поддерживалась в течение 30 дней.
Пример 11. Очистка IL-2/N88R, полученного в клетках СНО
Перфузионный элюат, описанный выше, обрабатывали следующим образом. Перфузионную среду собирали и наносили на колонку с S-сефарозой. Колонку уравнивали 20 мМ фосфатным буфером с 5 мМ NaCl при рН 7,0. Проводимость исходного материала (“TCF”) доводили до 4 мСм добавлением воды, а рН доводили до указанного значения фосфорной кислотой.
После загрузки TCF колонку промывали тем же буфером, который использовали, уравнивания. Элюирование осуществляли сдвигом рН. Мутантные белки элюировали 20 мМ этаноламином, рН 10,5, с образованием S-элюата.
Анионный обмен проводили пропусканием S-элюата через колонку QAE Fast Flow™ (Pharmacia), уравненную 10 мМ бикарбонатным буфером при рН 10,5. Скорость прохождения поддерживали на уровне 250 см/ч. После промывания до линии основания IL-2SA элюировали 20 мМ фосфатом рН 4,0.
Хроматографию на гидроксиапатите (НАР) проводили пропусканием разбавленного элюата QAE (1:1 WFI (вода для инъекций)) через колонку, заполненную керамическим гидроксиапатитом (Тип П, BioRad, Hercules, CA), уравненную 10 мМ фосфатом при рН 7,0. Скорость прохождения поддерживали на уровне 250 см/час. После промывания до линии основания IL-2SA элюировали 100 мМ фосфатом рН 7,0.
Элюат с гидроксиапатита подвергали ультрафильтрации до объема 300 мл с использованием устройства Millipore Pelicon-2 с тремя картриджами PES 5K (Millipore Corporation, Bedford, MA).
Элюат НАР после ультрафильтрации очищали пропусканием через гель-фильтрационную колонку S100HR (Pharmacia) при скорости 35 см/ч. Колонку уравнивали 10 мМ фосфатом и 150 мМ NaCl pH 7,0.
Фракцию после гель-фильтрации разводили WFI до достижения проводимости 4,0 мСм/см и повторно наносили на S-сефарозу в описанных выше условиях. IL2SA элюировали 10 мМ Фосфатньм буфером с 1М NaCl при pH 7,0.
Конечную фракцию после катионного обмена диализовали против фосфатного буфера PBS в течение ночи и разводили стерильным PBS до концентрации 6 мг/мл. Итоговый раствор стерильно фильтровали, разделяли на аликвоты и замораживали при -70°С. Общий выход составил 65%.
Специалист в данной области техники может разработать и другие варианты осуществления изобретения. Из изобретения следует способ получения мутантных белков, не обязательно специально описанных в данной работе, но обладающих способностью активировать Т-клетки, что подтверждается пролиферацией ФГА-бластов и сниженной пролиферацией NK-клеток, и, таким образом, эти белки составляют объем и сущность данного изобретения. Концепция и экспериментальный подход, описанные в данной работе, применимы к другим цитокинам, использующим гетерологичные многомерные рецепторные системы, в частности это относится к цитокинам IL-7, IL-9 и IL-15, IL10, интерферону α и интерферону γ.
ПОСЛЕДОВАТЕЛЬНОСТИ
В данной заявке содержатся следующие последовательности:
SEQ ID NO: 1: аминокислотная последовательность интерлейкина-2 человека (hIL-2)
SEQ ID NO: 2: последовательность кДНК IL-2
SEQ ID NO: 3: 5’ Праймер для ПЦР IL-2
SEQ ID NO: 4: 3’ Праймер для ПЦР IL-2
SEQ ID NO: 5: Праймер для мутагенеза для IL-2 экспрессионного вектора
SEQ ID NO: 6: Праймер для мутагенеза для мутаций D20X
SEQ ID NO: 7: Праймер для мутагенеза для мутаций N88X
SEQ ID NO: 8: Праймер для мутагенеза для мутаций Q126X
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ АУТОИММУННОГО ЗАБОЛЕВАНИЯ И ДЛЯ ОБРАЗОВАНИЯ РЕГУЛЯТОРНЫХ Т-КЛЕТОК | 2009 |
|
RU2531936C2 |
| ИММУНОЦИТОКИНЫ С МОДУЛИРОВАННОЙ СЕЛЕКТИВНОСТЬЮ | 2002 |
|
RU2312677C9 |
| КОМПОЗИЦИИ И СПОСОБЫ ДОСТИЖЕНИЯ ИММУННОЙ СУПРЕССИИ | 2001 |
|
RU2270691C2 |
| КОНЪЮГАТЫ ЦИТОКИНОВ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ И ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2786116C2 |
| КОНЪЮГАТЫ ЦИТОКИНОВ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2787201C2 |
| УСЛОВНО АКТИВНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ МОДИФИЦИРОВАННЫХ Т-КЛЕТОК | 2015 |
|
RU2764074C2 |
| ВАРИАНТ ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-2 ИЛИ ЕГО ПРОИЗВОДНОЕ | 2019 |
|
RU2799437C2 |
| ГОМОГЕННЫЕ ПРЕПАРАТЫ IL-28 И IL-29 | 2004 |
|
RU2518324C2 |
| ПОЛИПЕПТИД С АНТИВИРУСНОЙ АКТИВНОСТЬЮ, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2004 |
|
RU2372356C2 |
| КОМПОЗИЦИИ Т-КЛЕТОК С НЕДОСТАТОЧНОСТЬЮ РЕЦЕПТОРОВ Т-КЛЕТОК | 2013 |
|
RU2653761C2 |
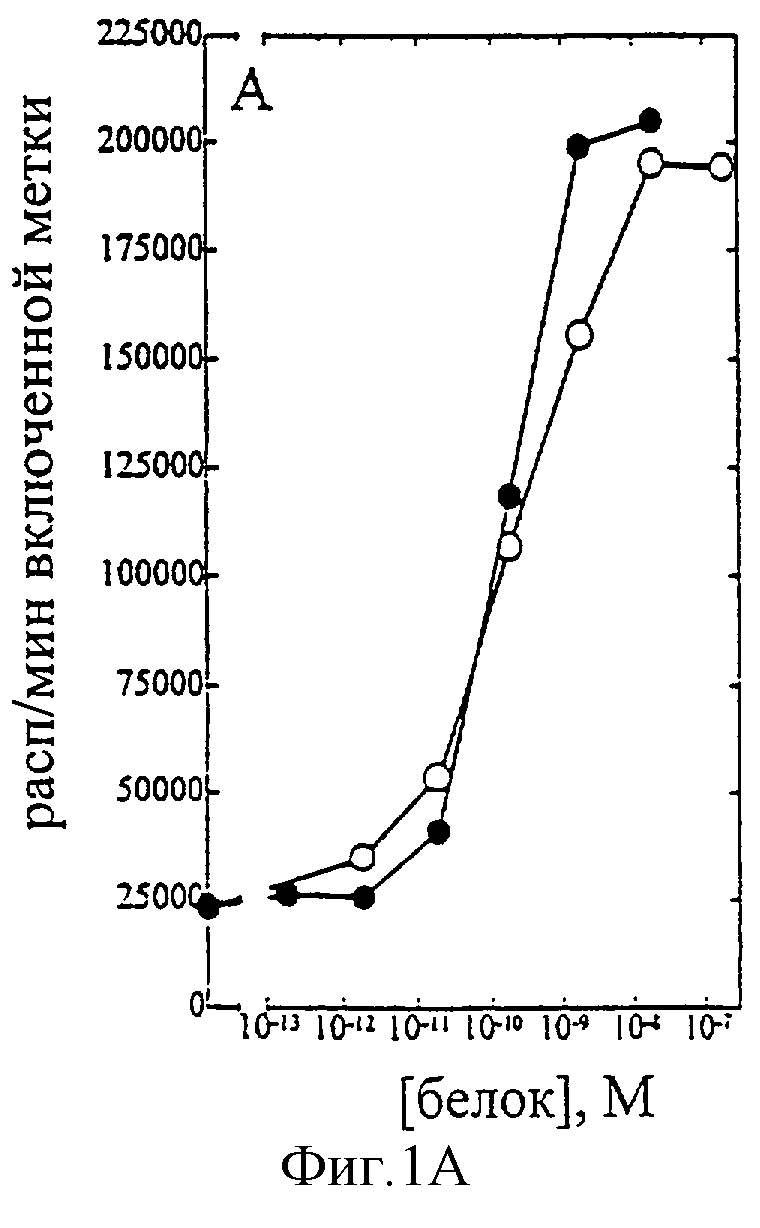






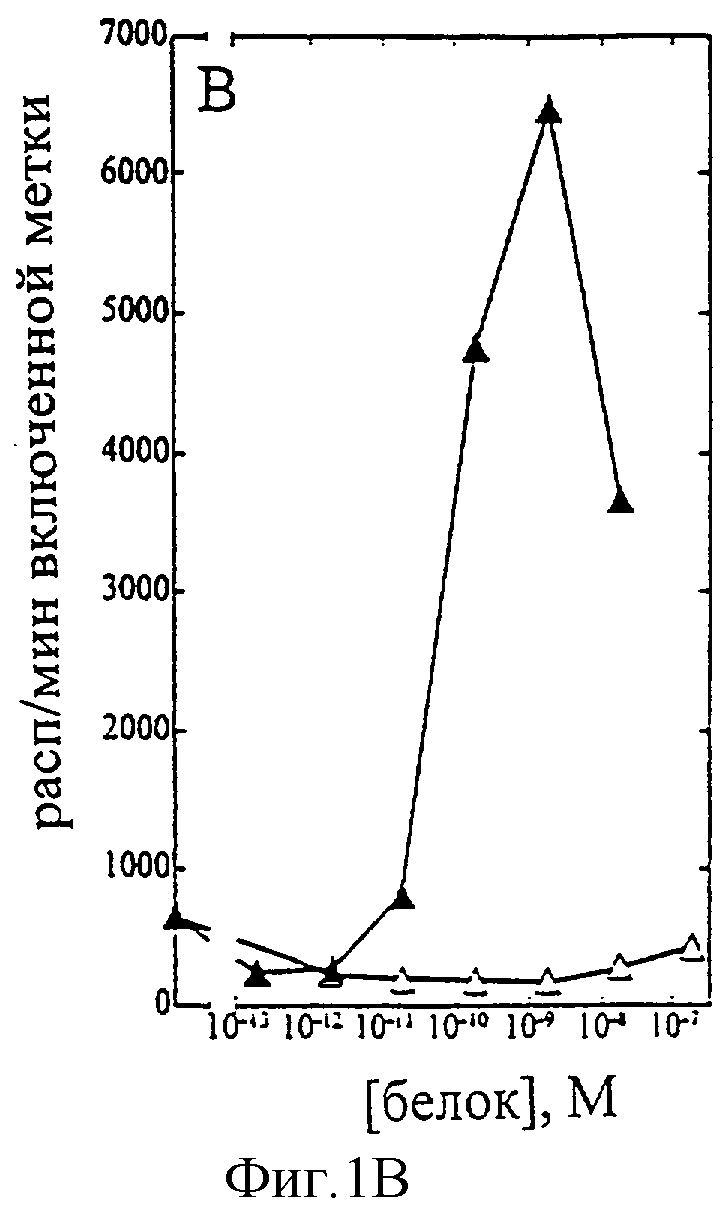
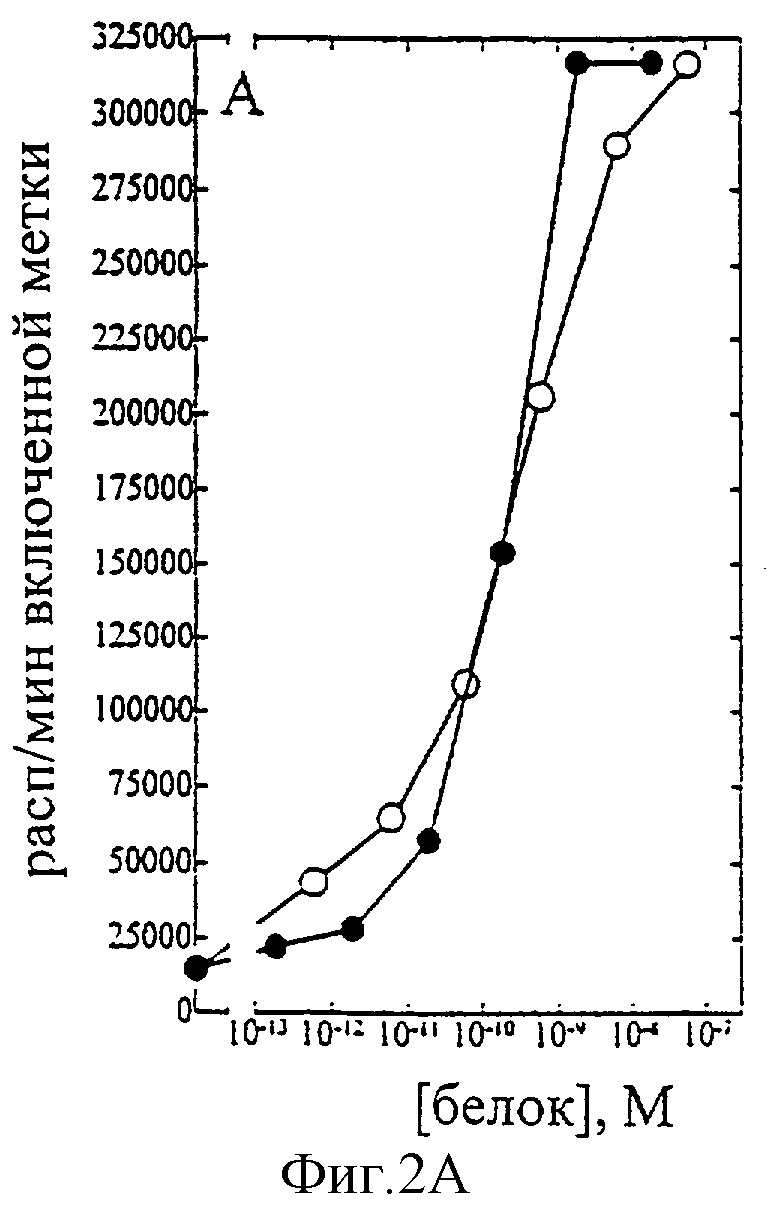
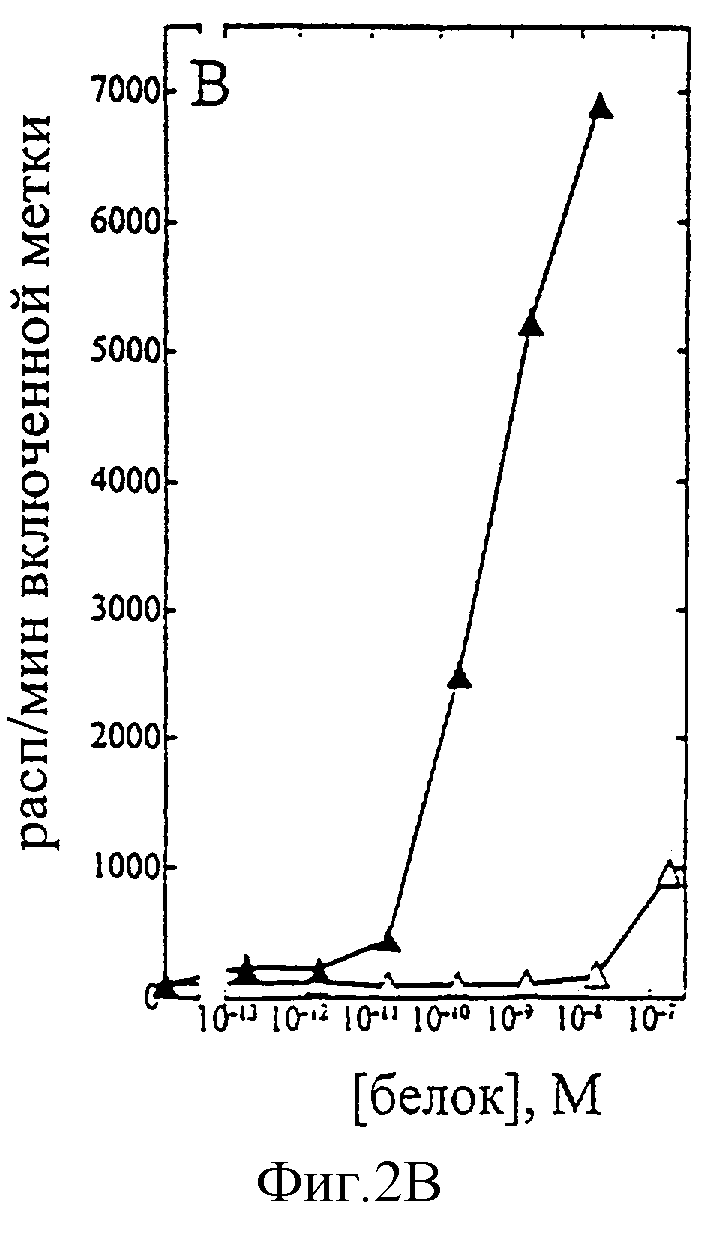
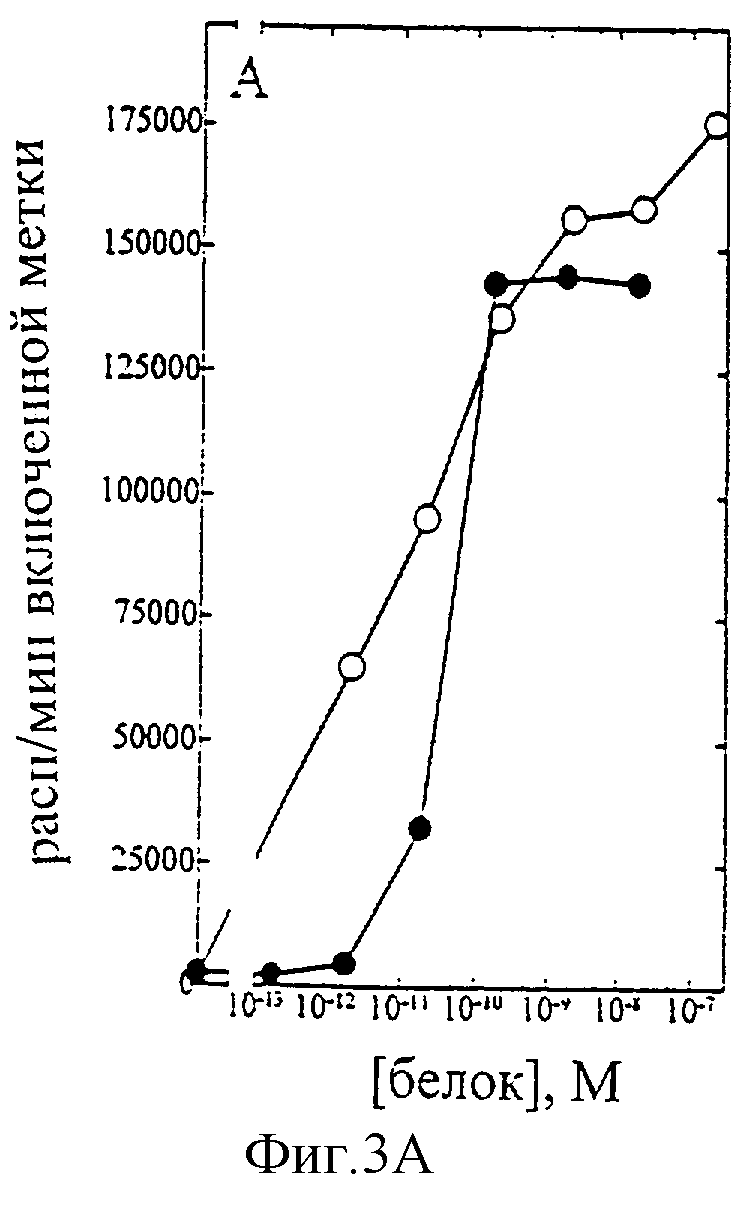
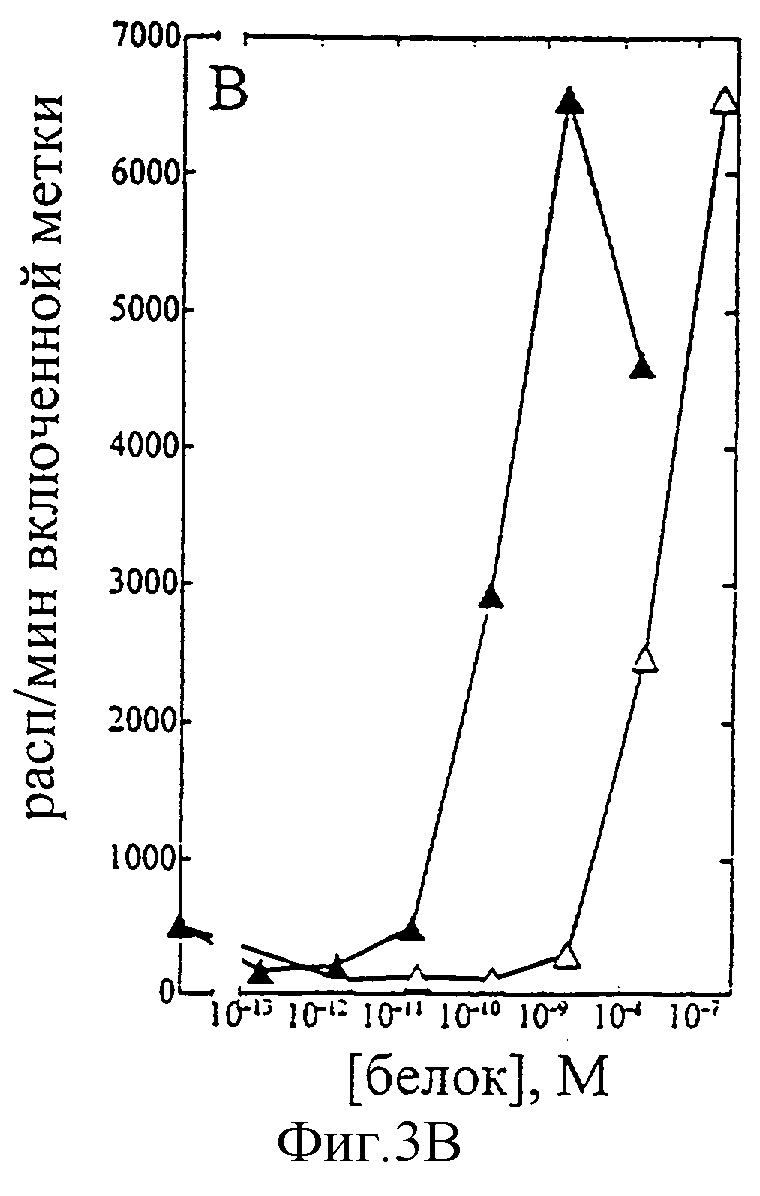
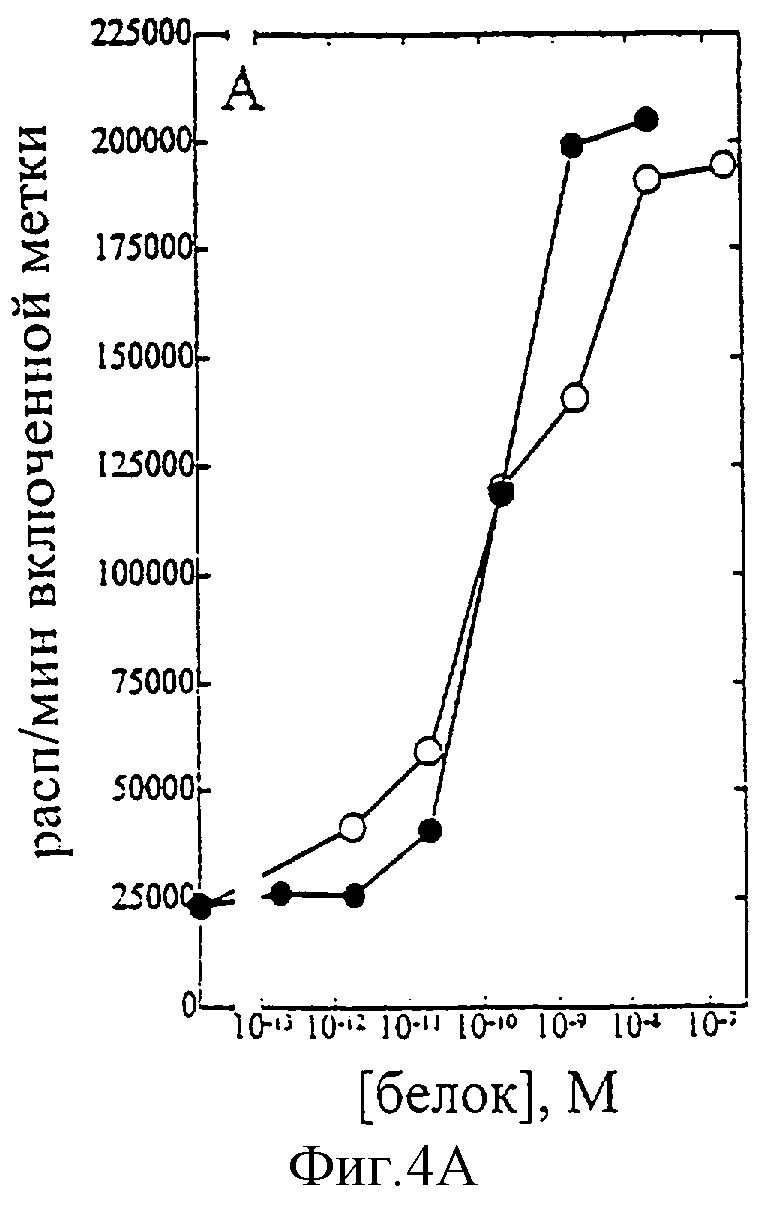
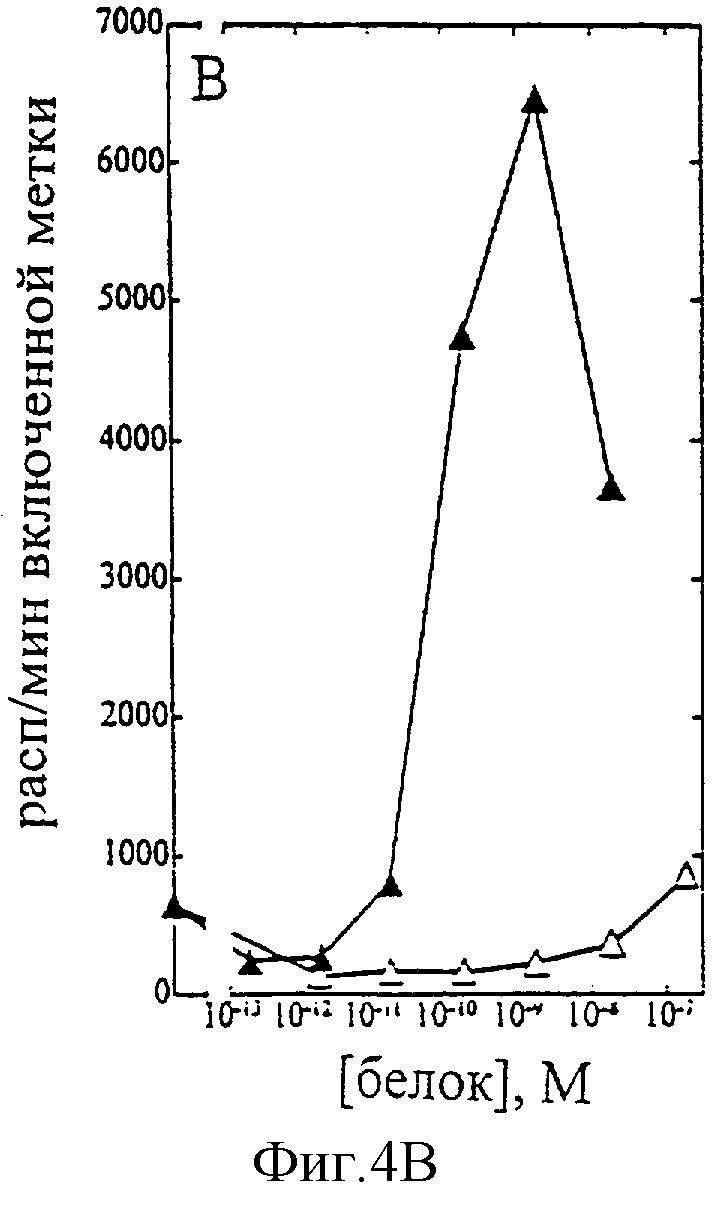
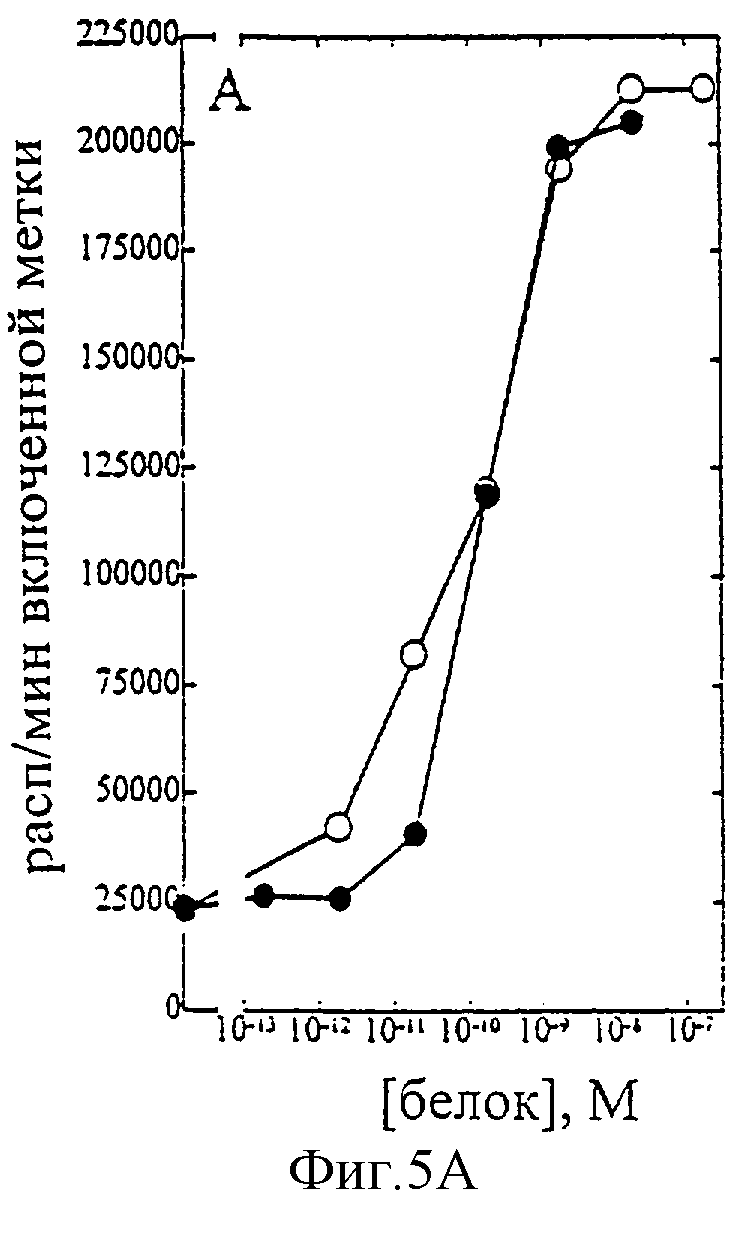
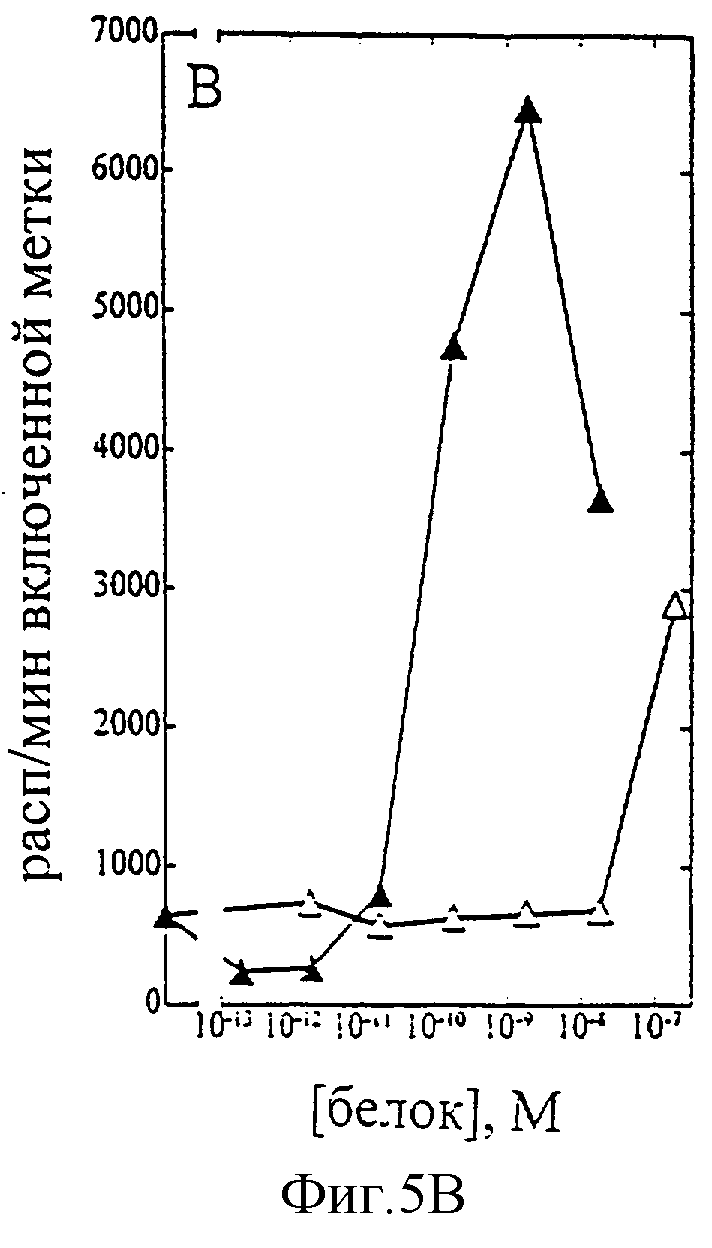
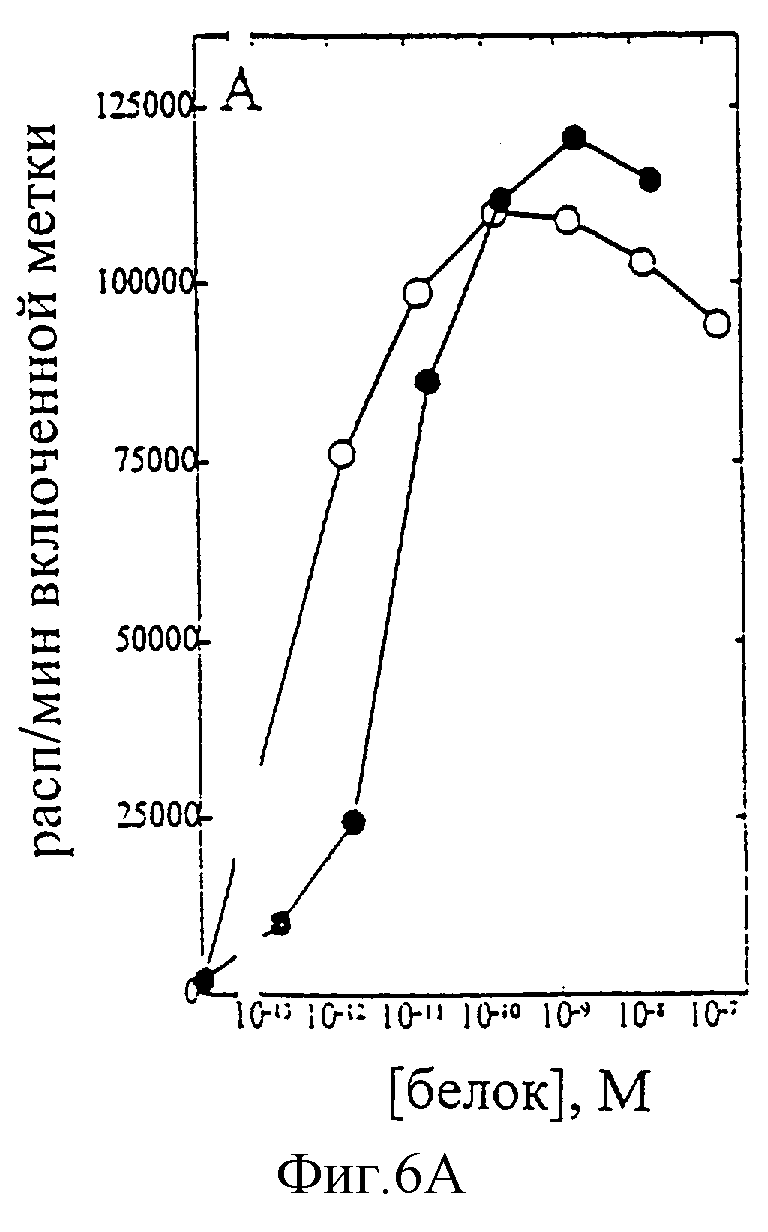
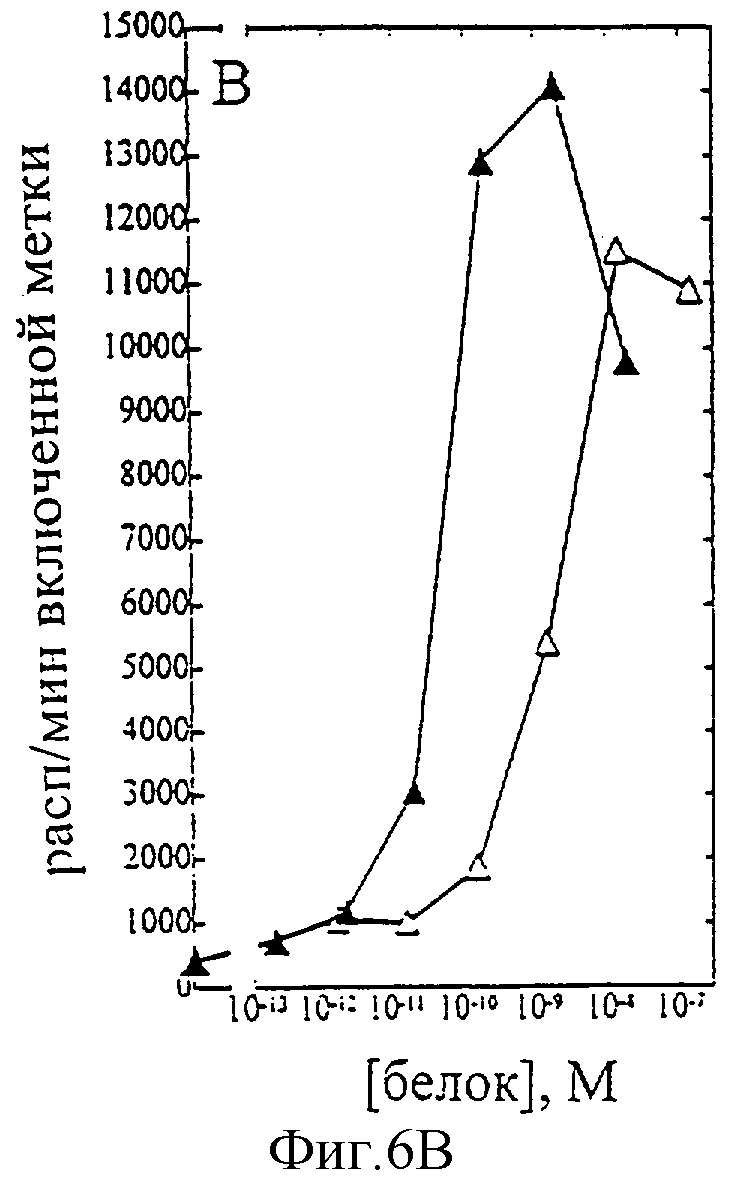
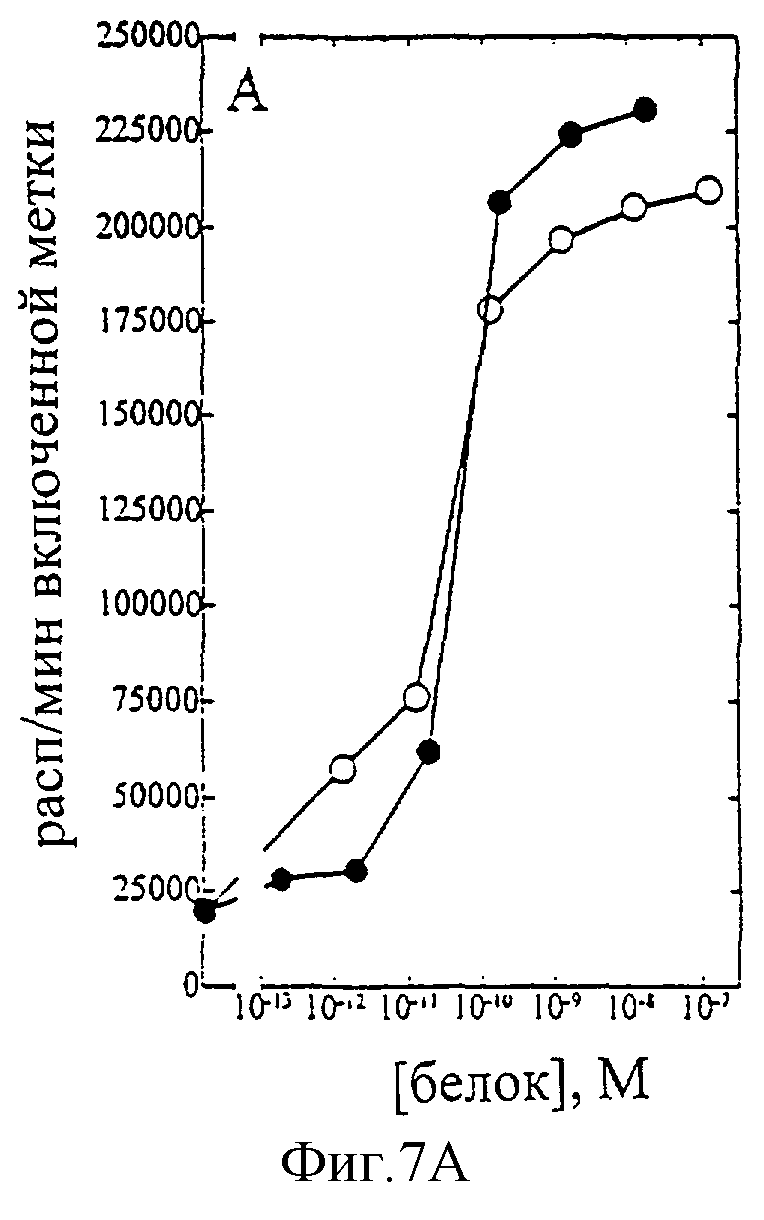
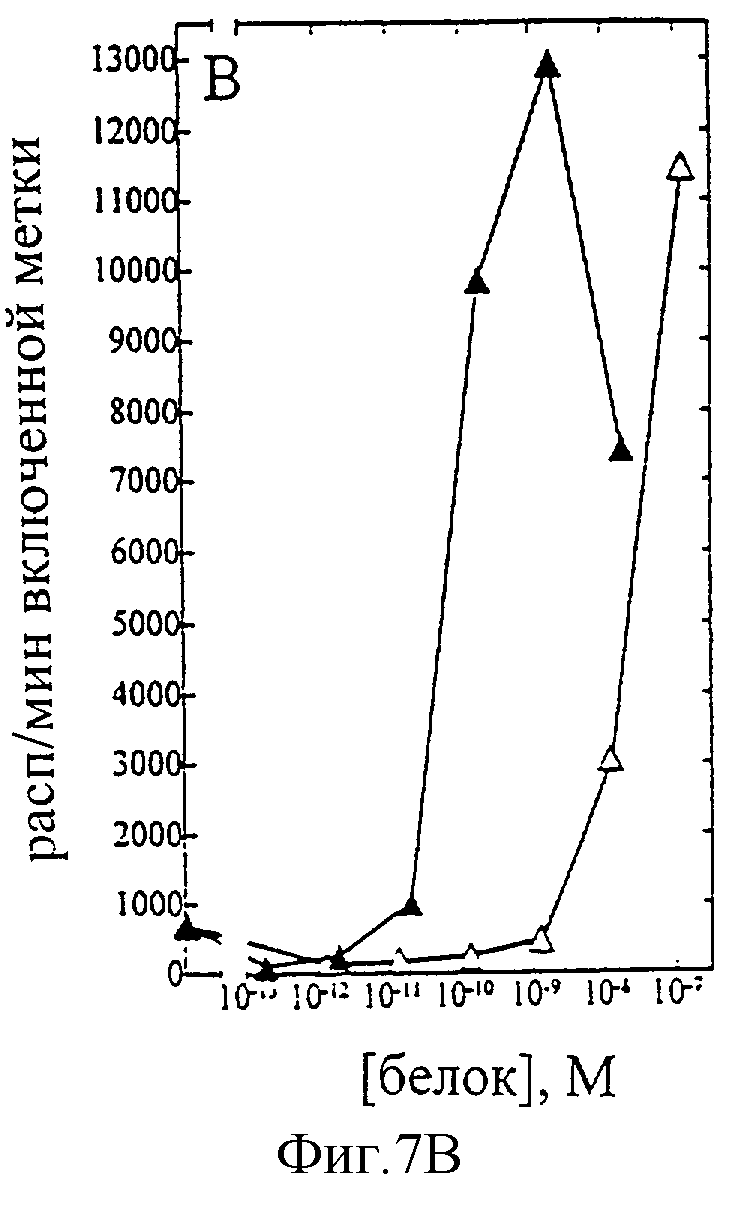
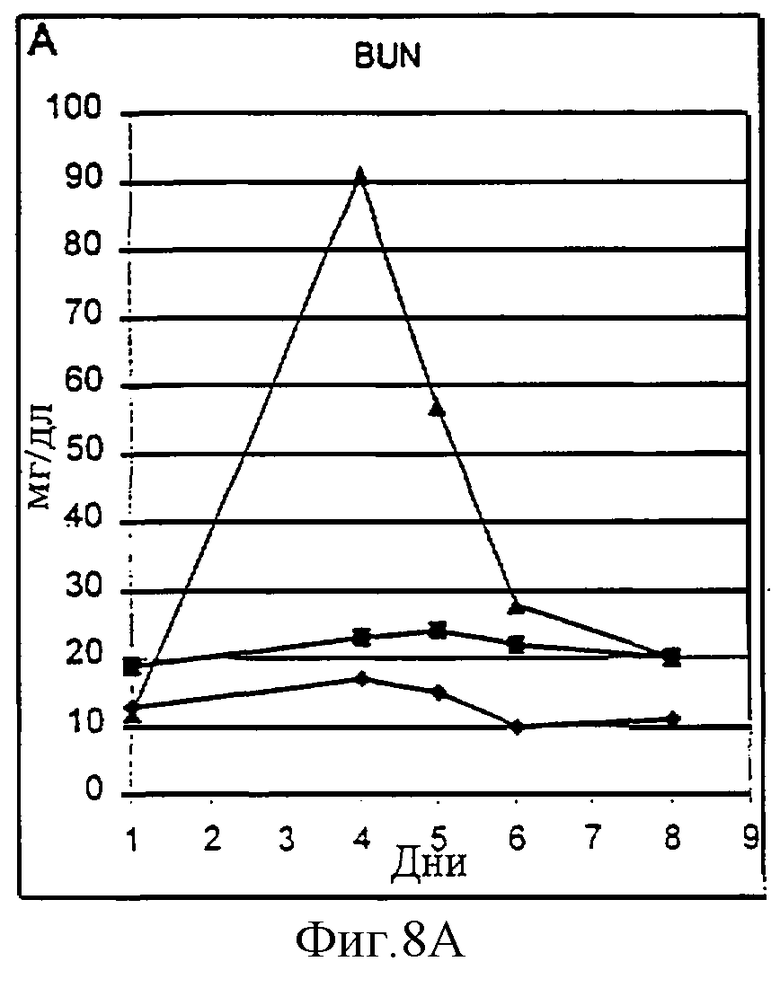
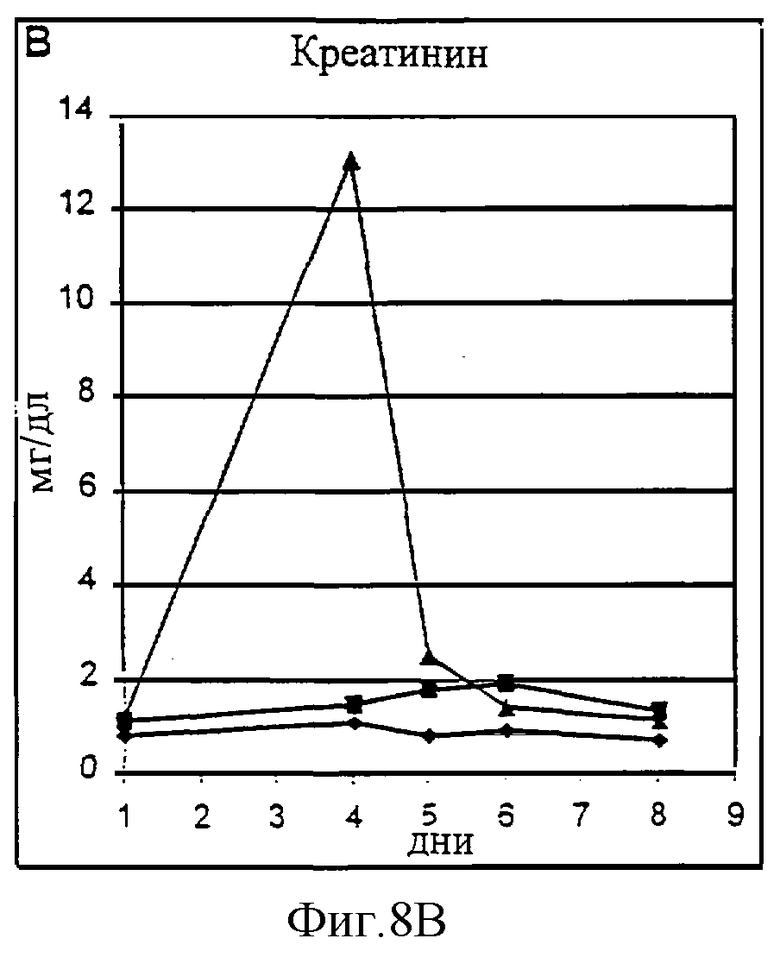
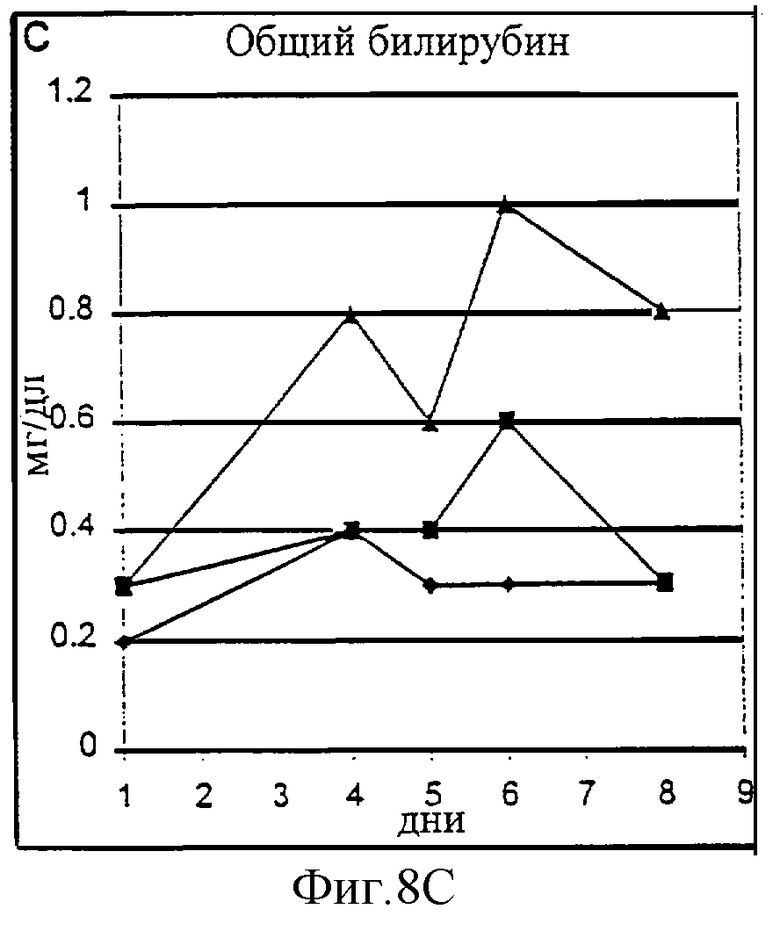
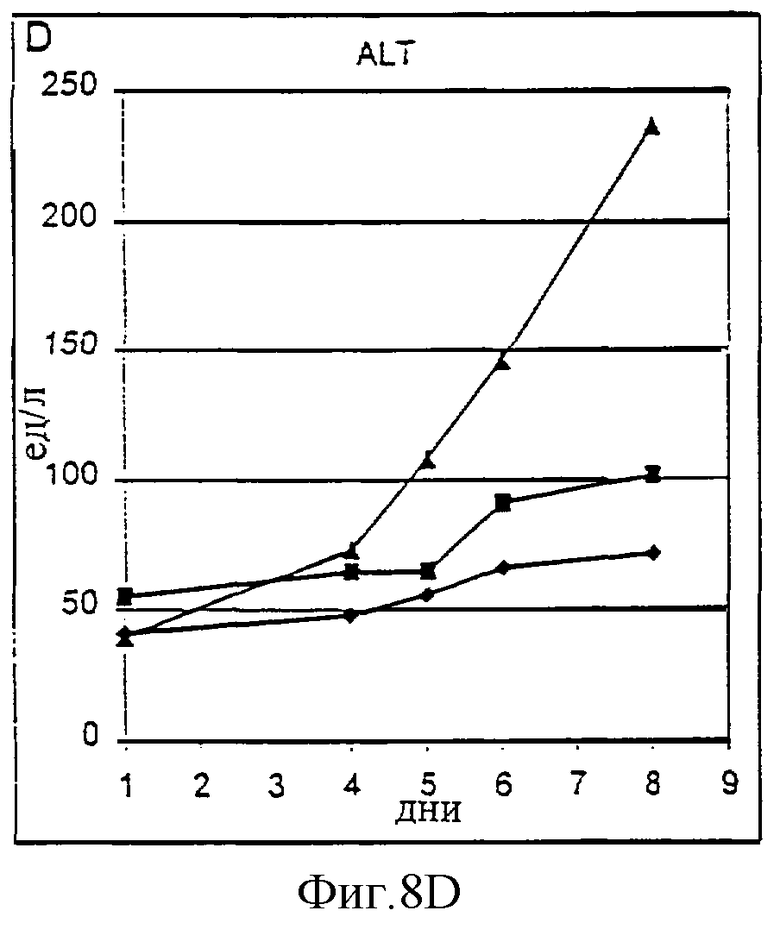
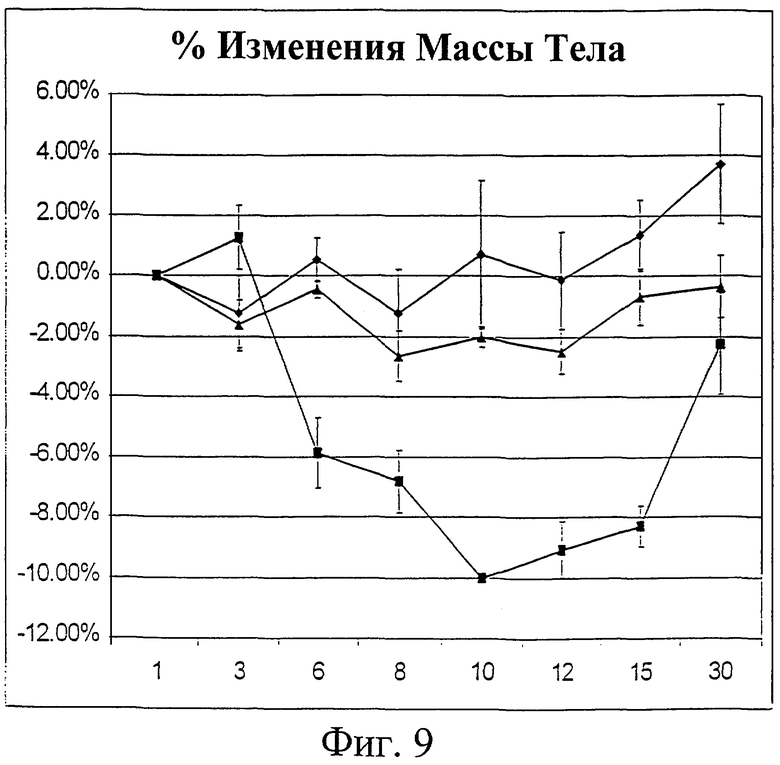
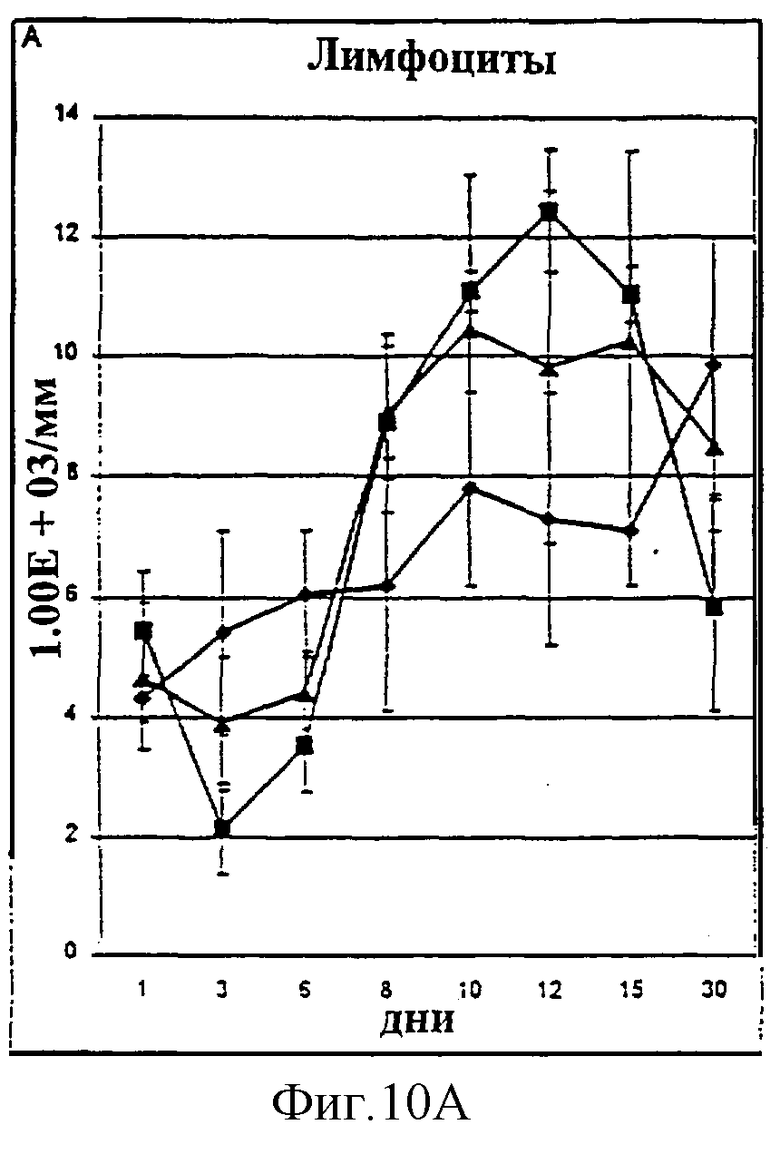
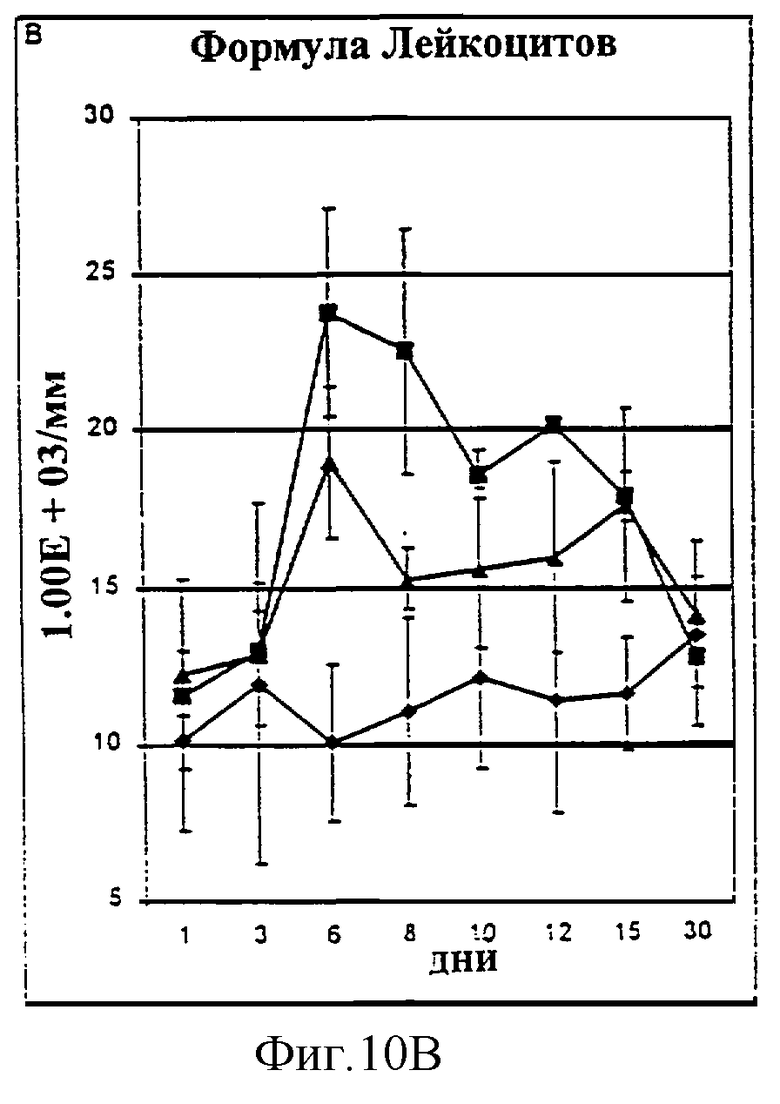
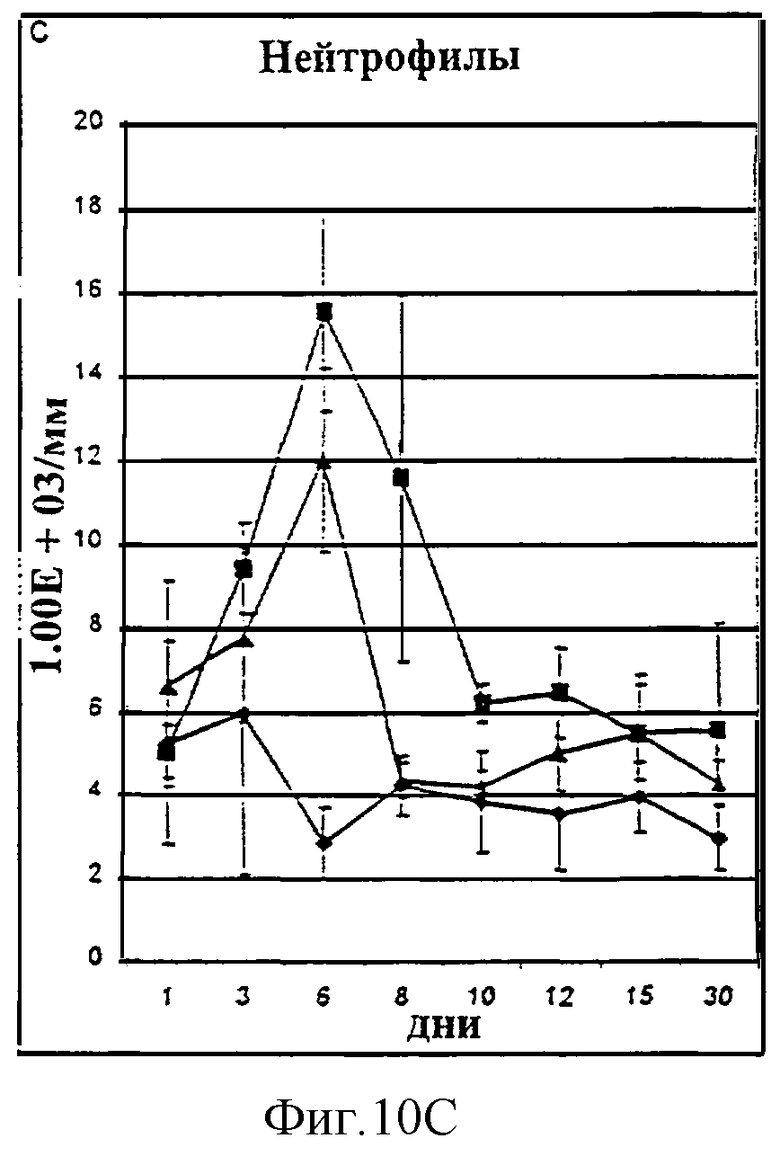
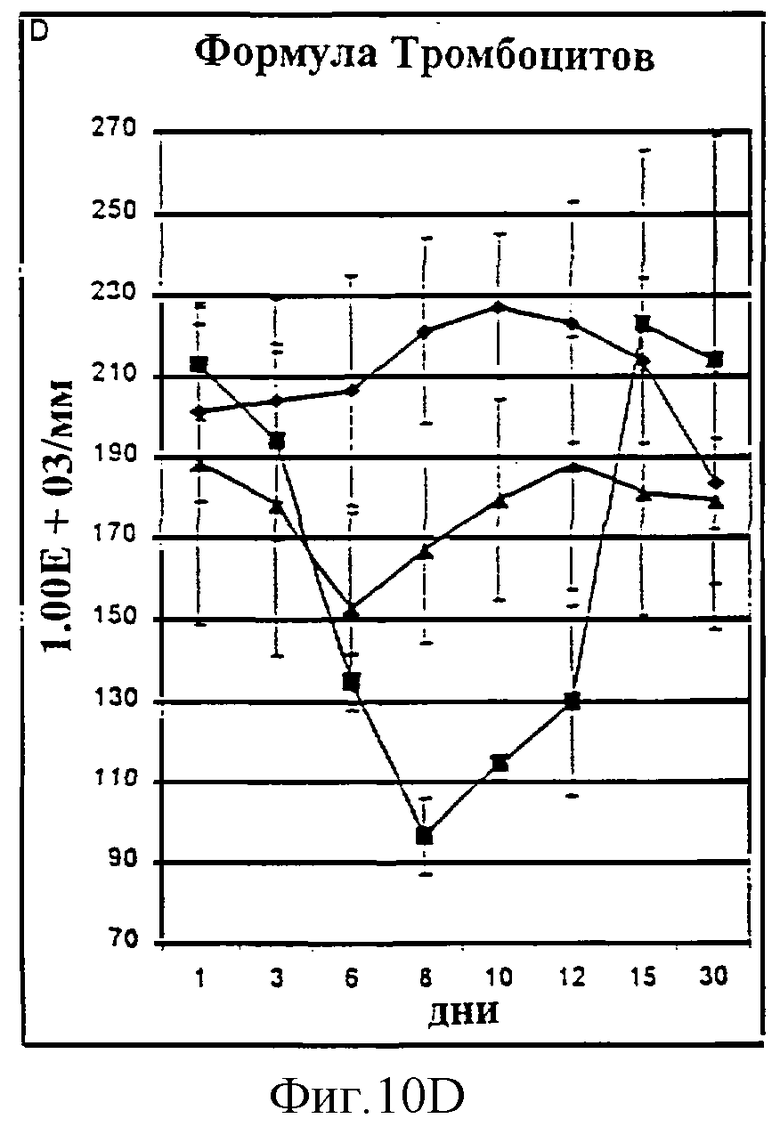
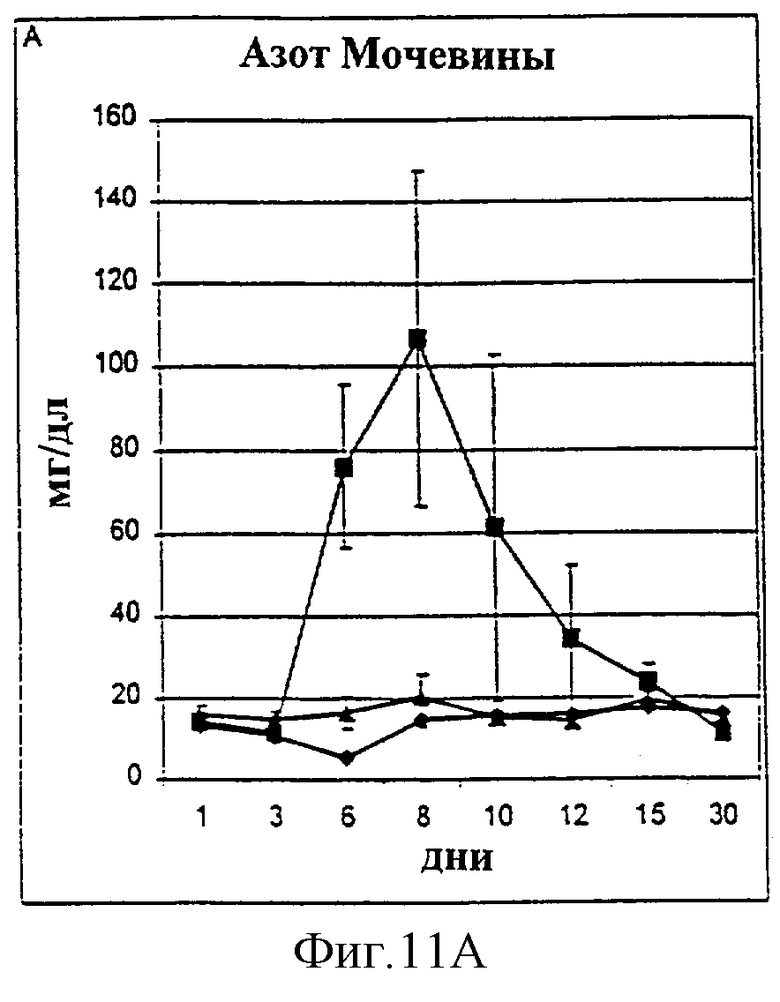
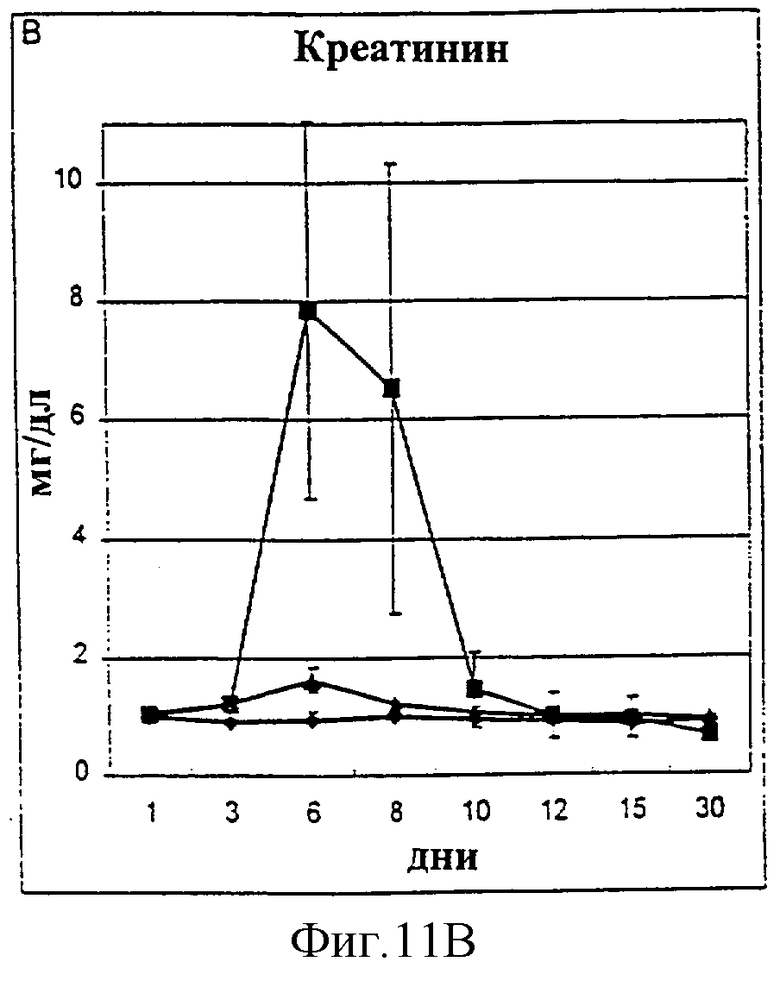
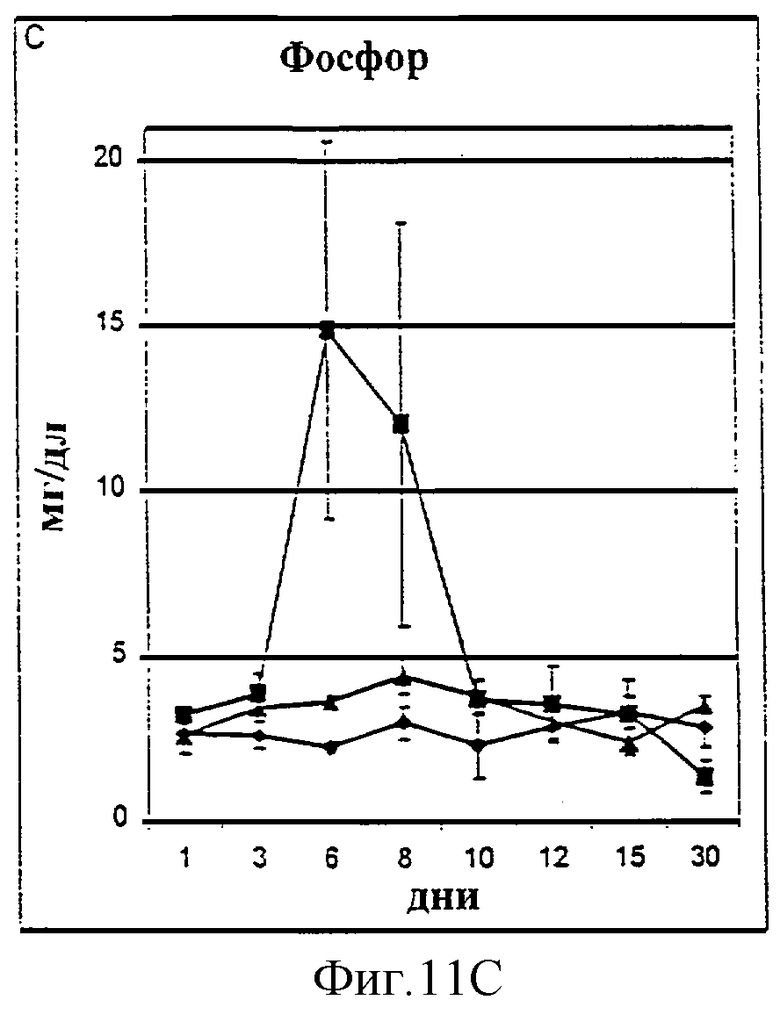
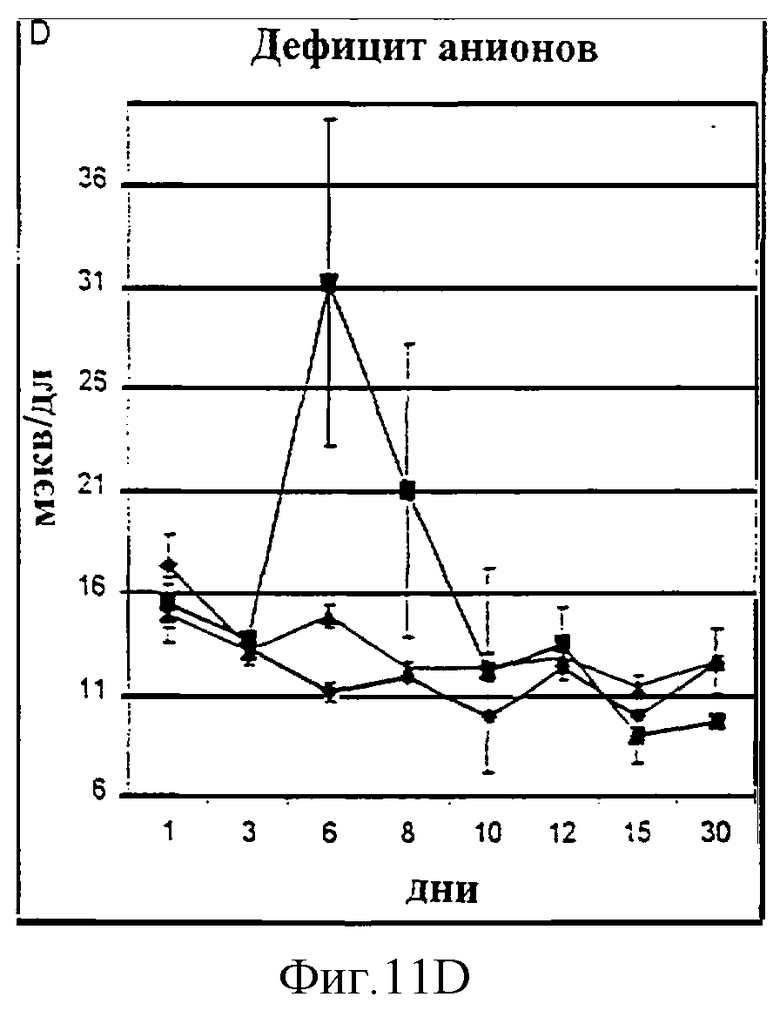
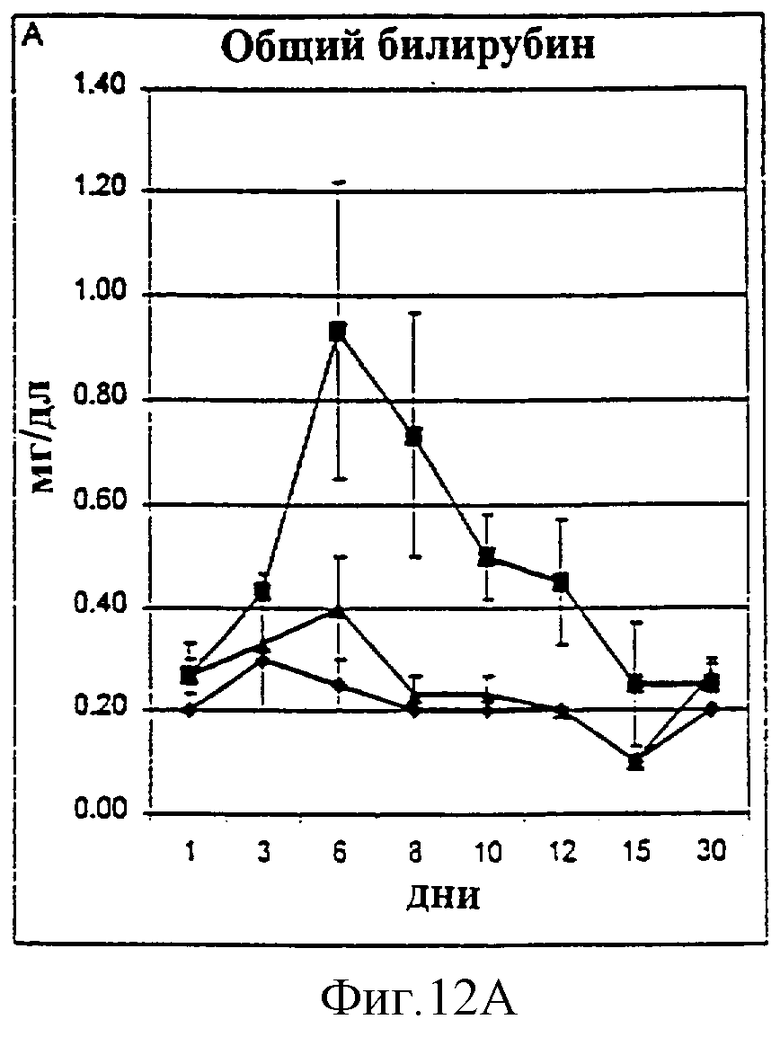
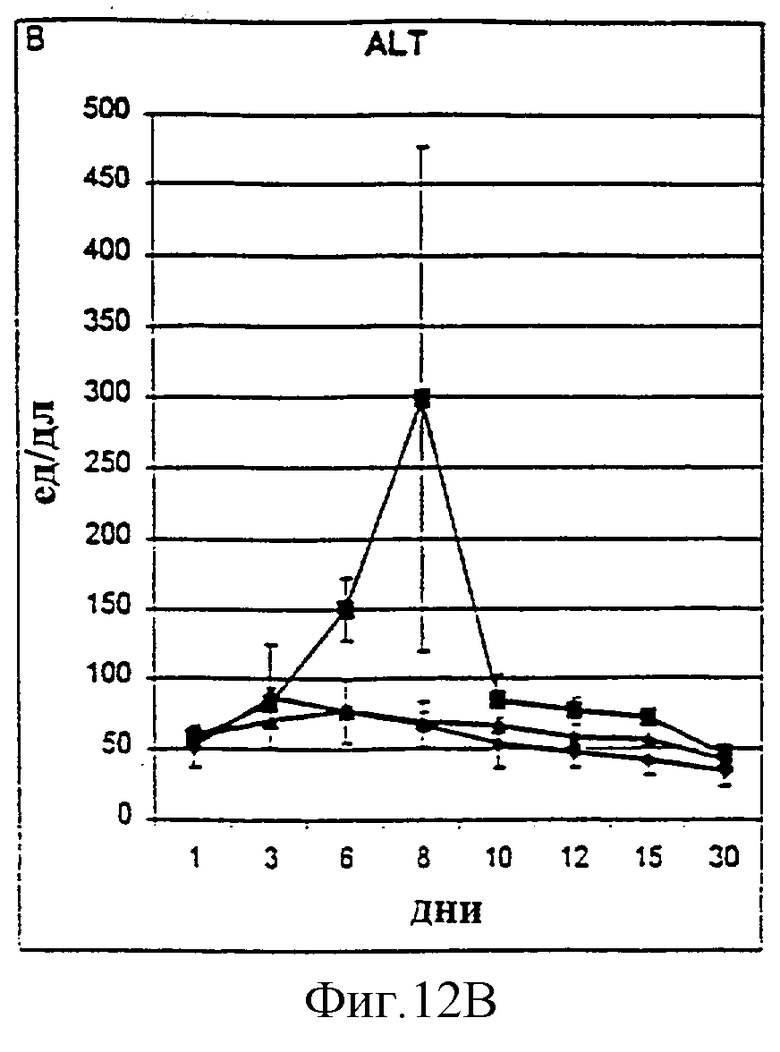
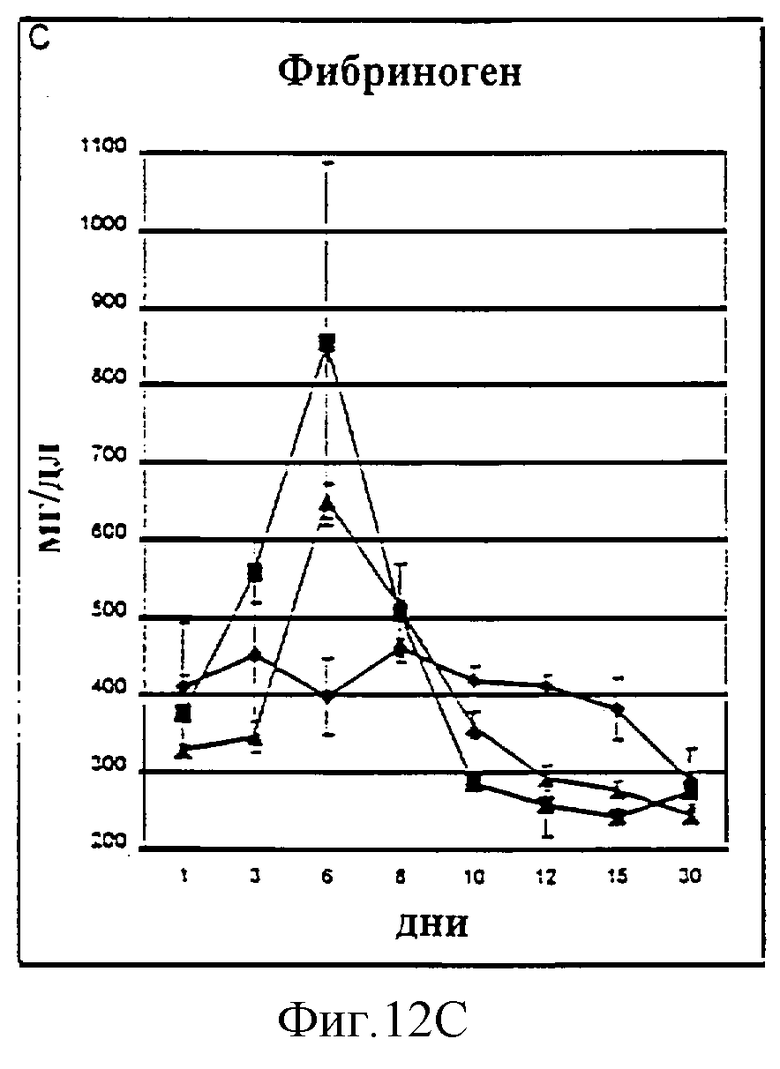
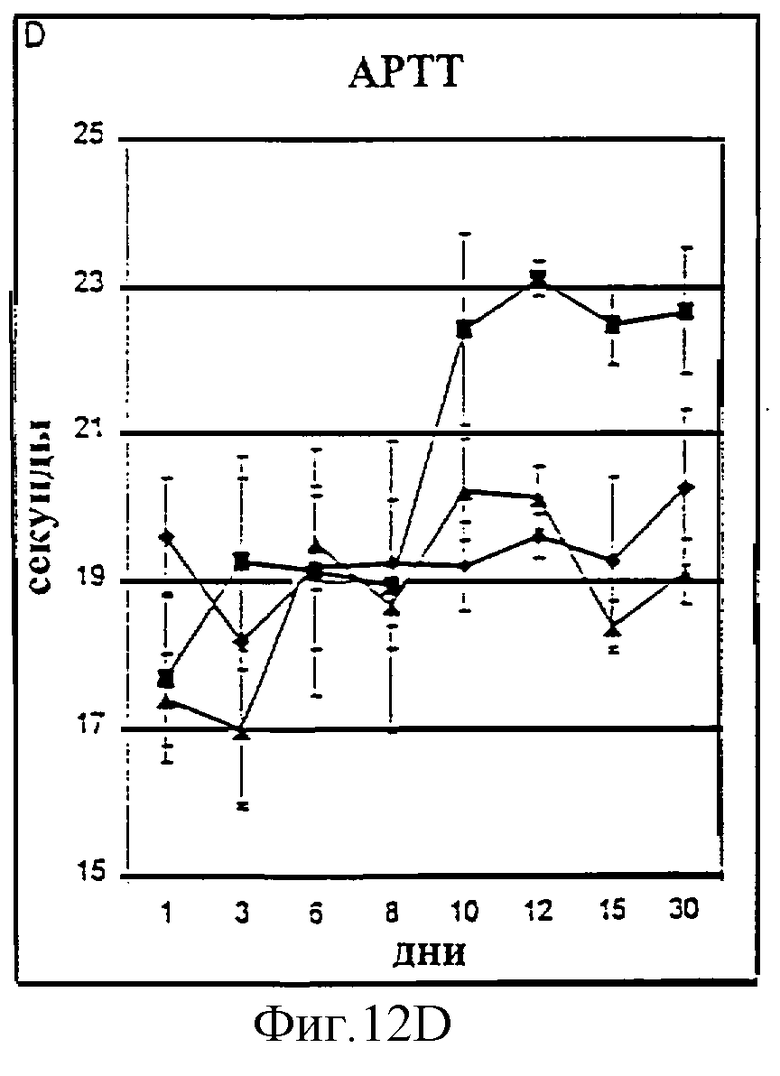
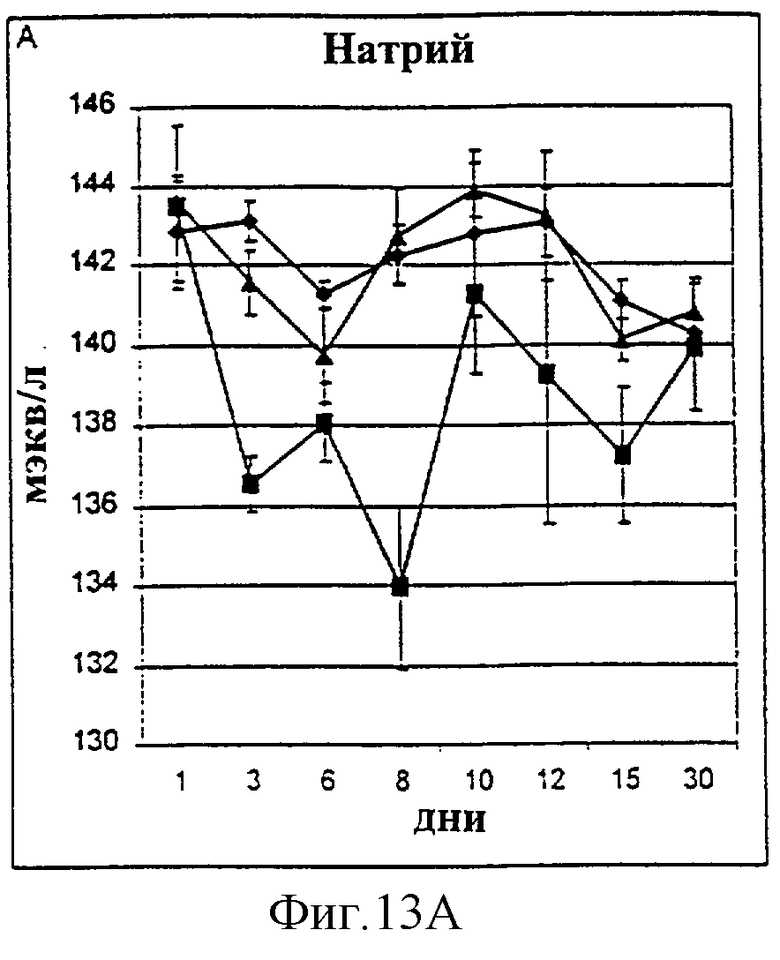
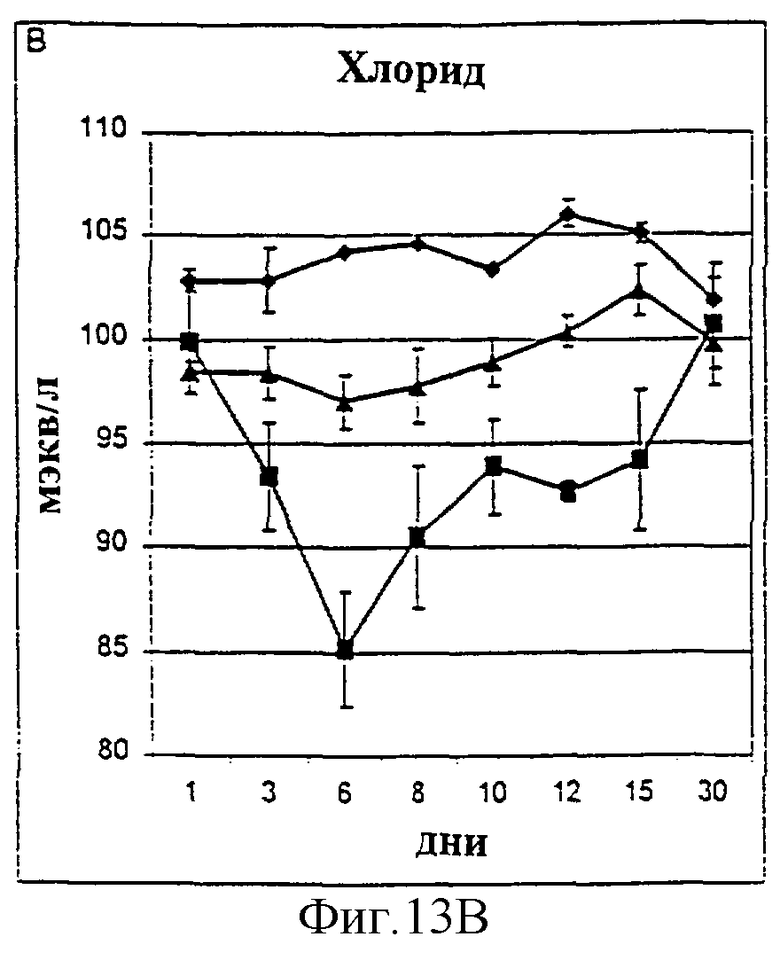
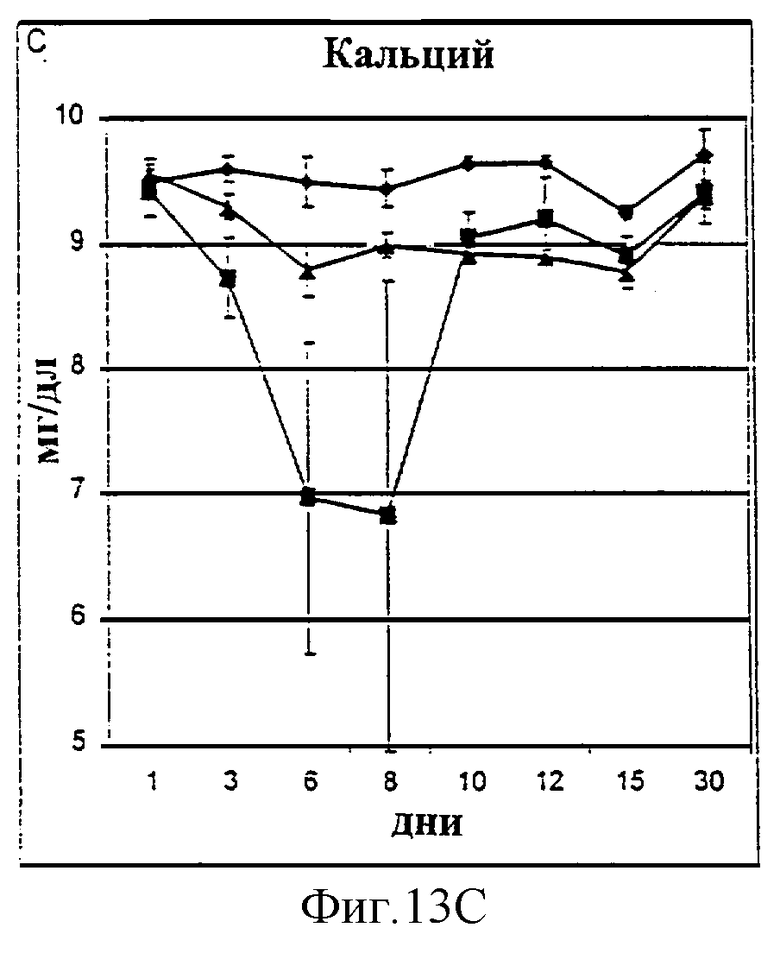
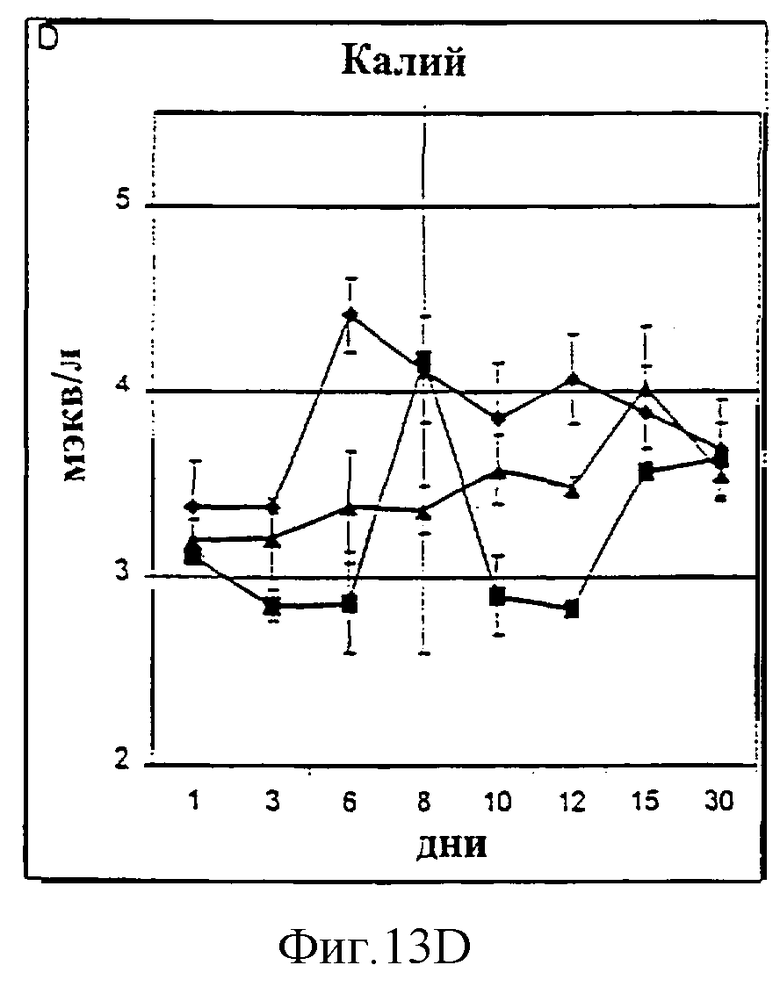
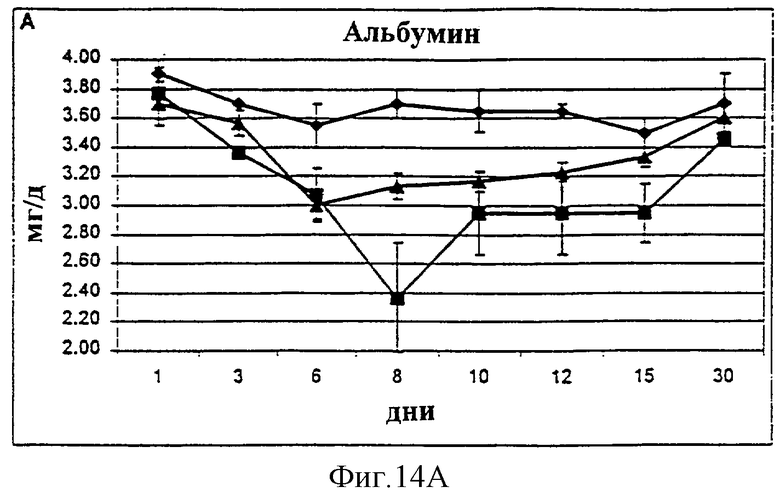
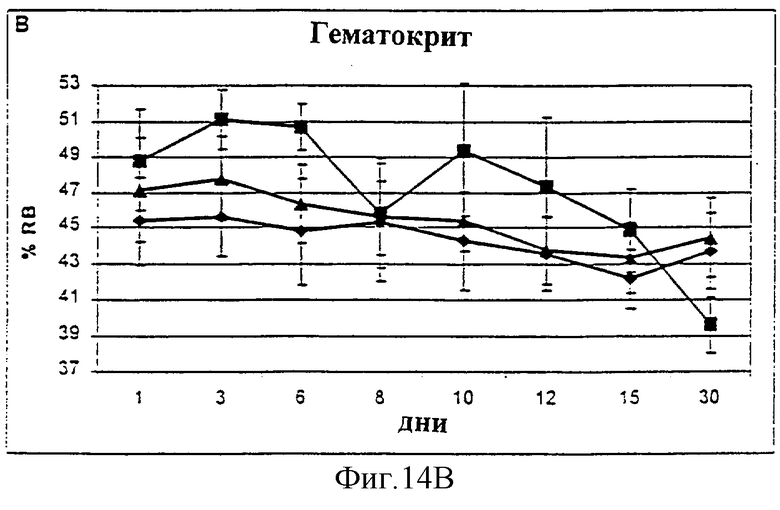
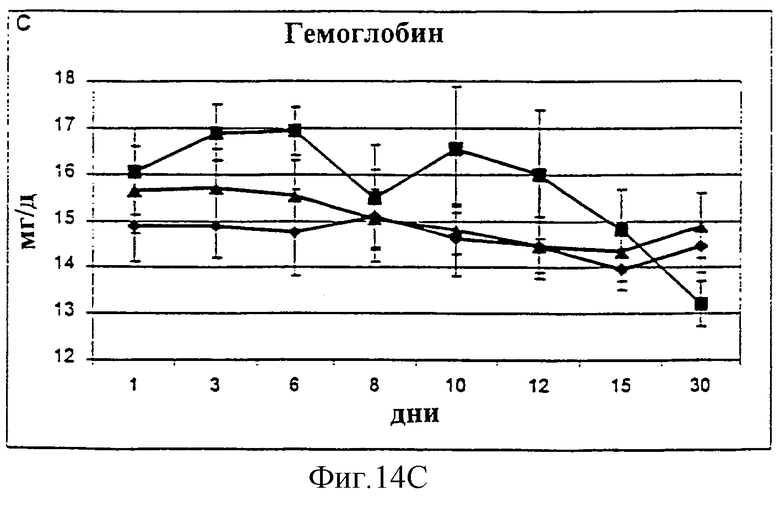
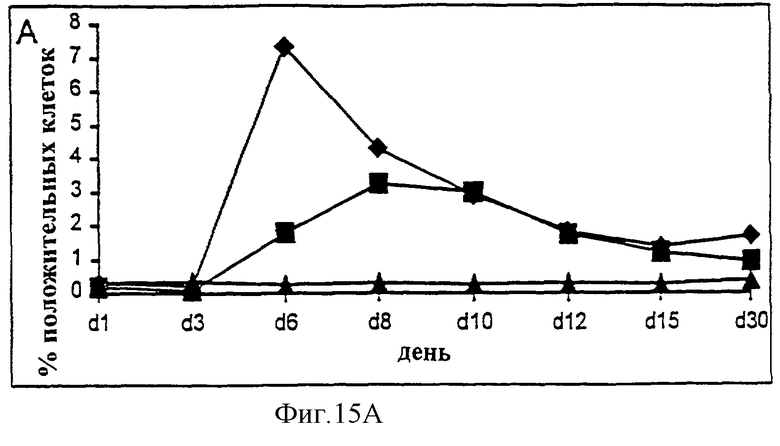
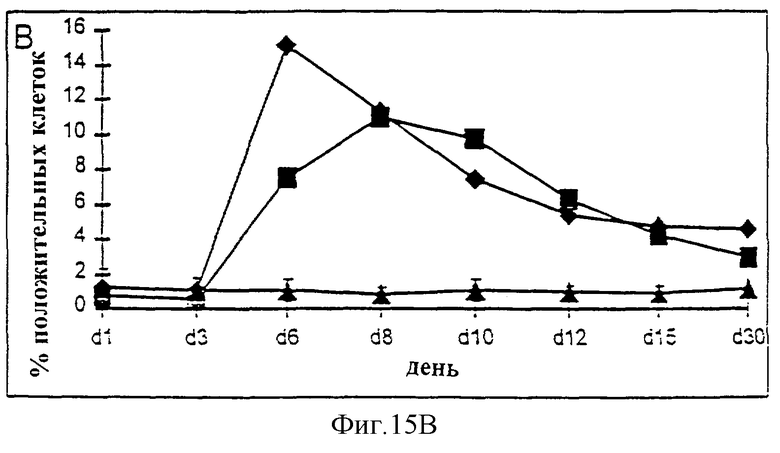
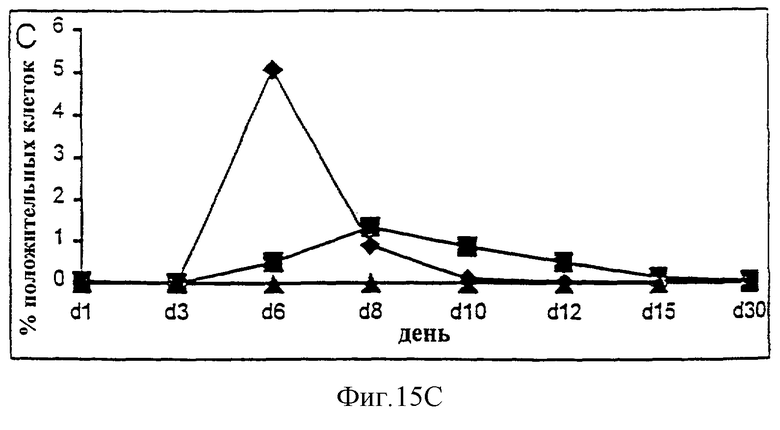
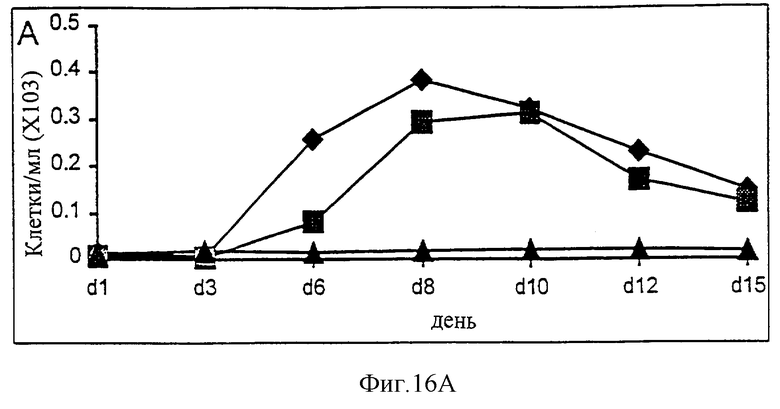
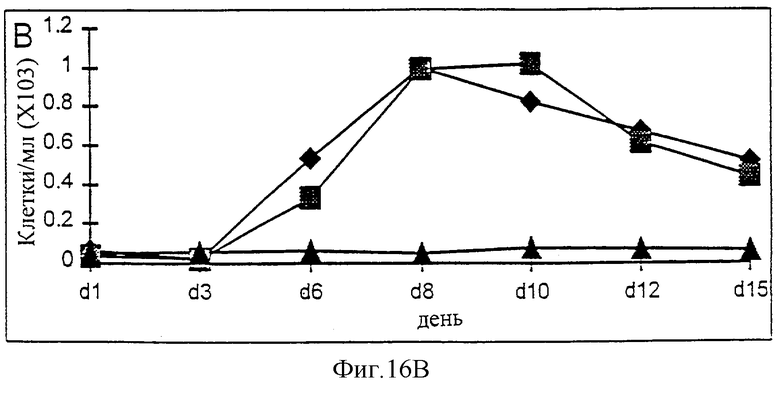
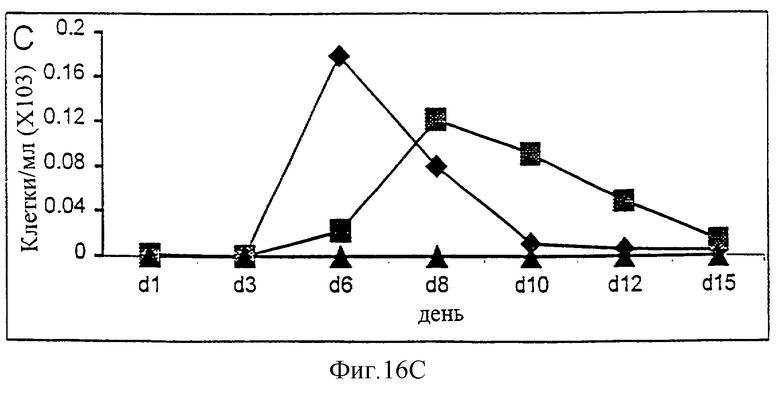
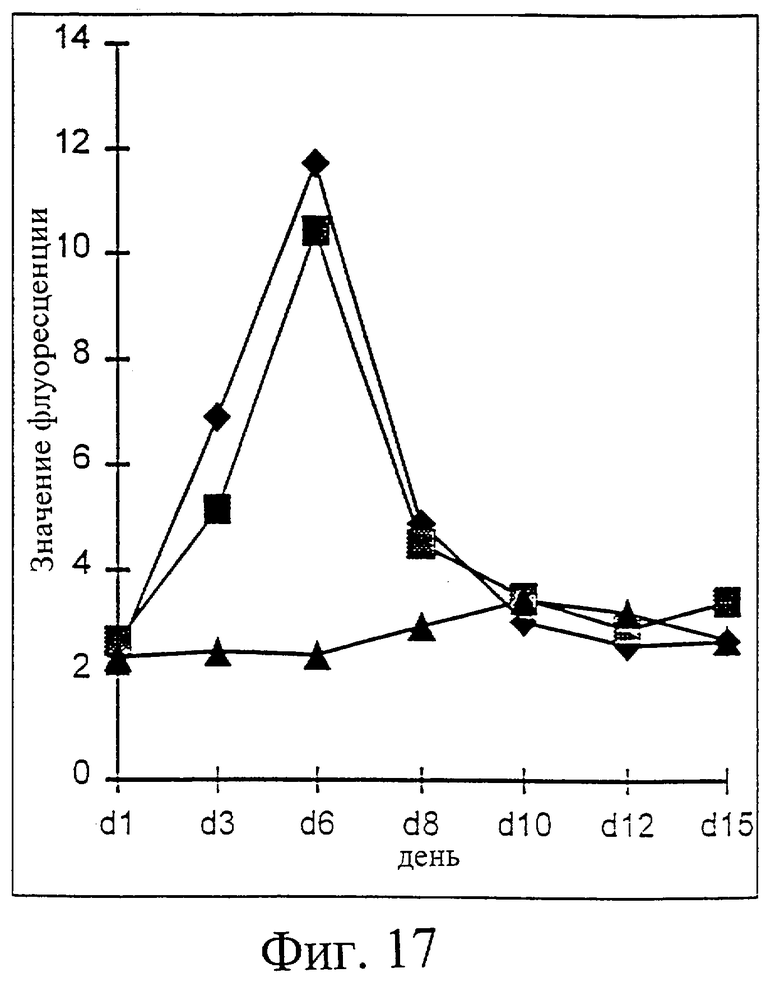
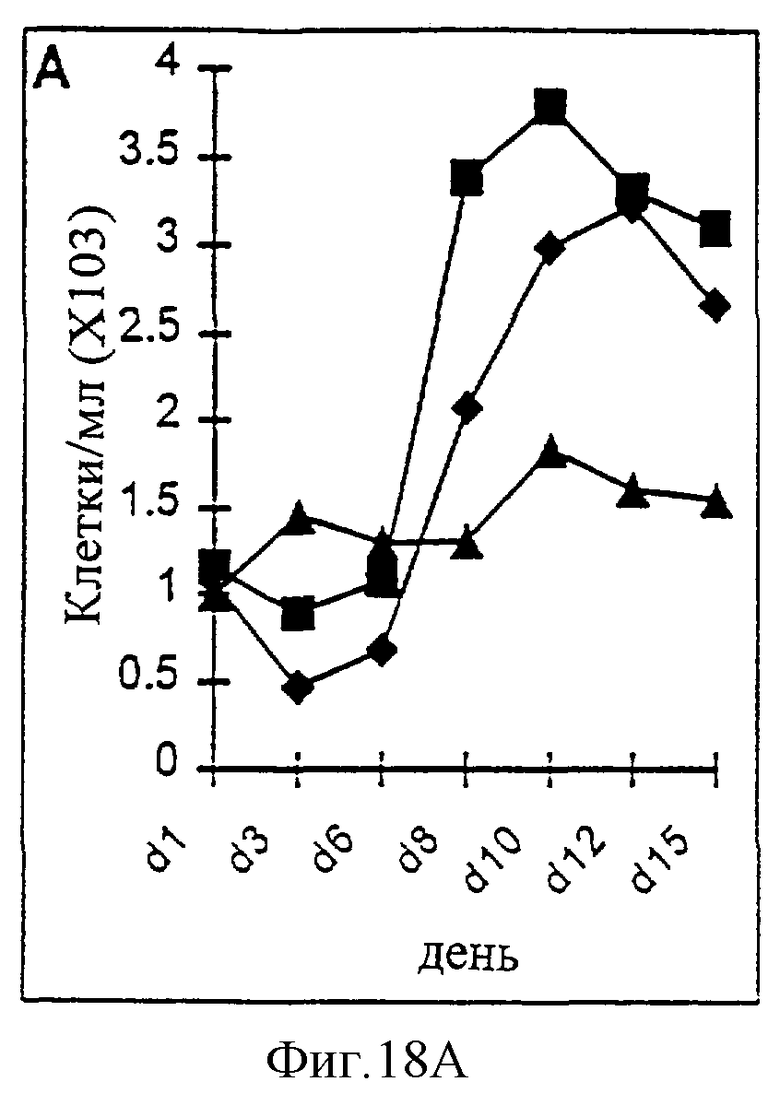
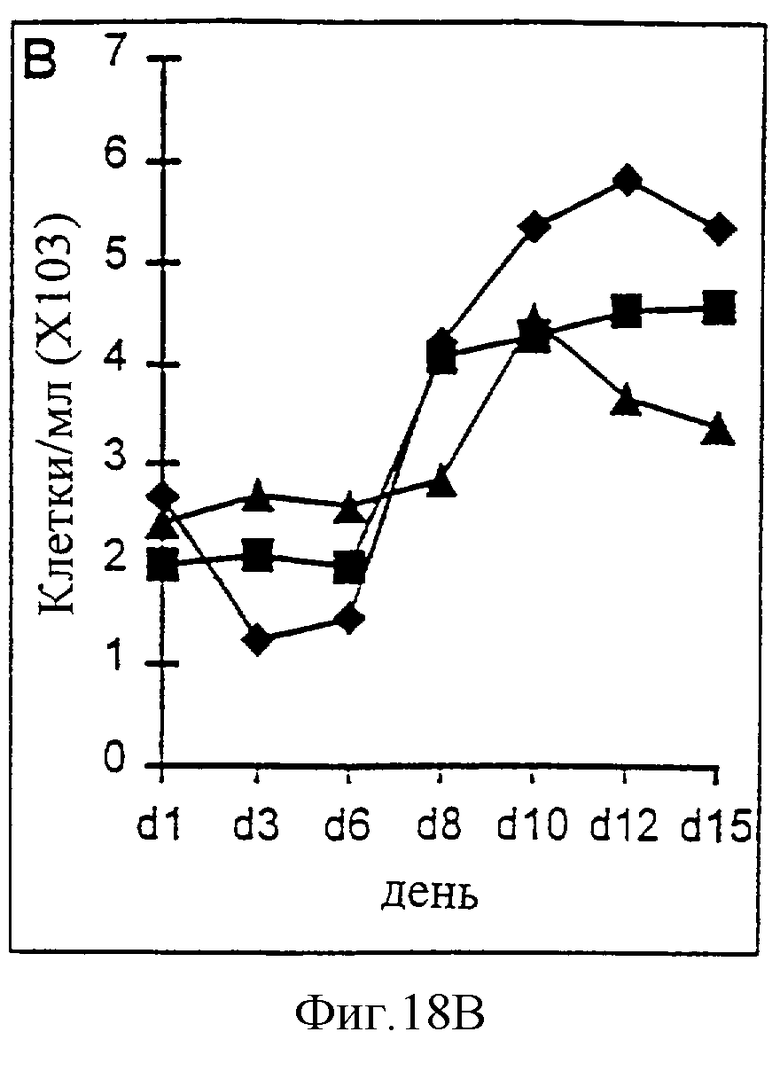
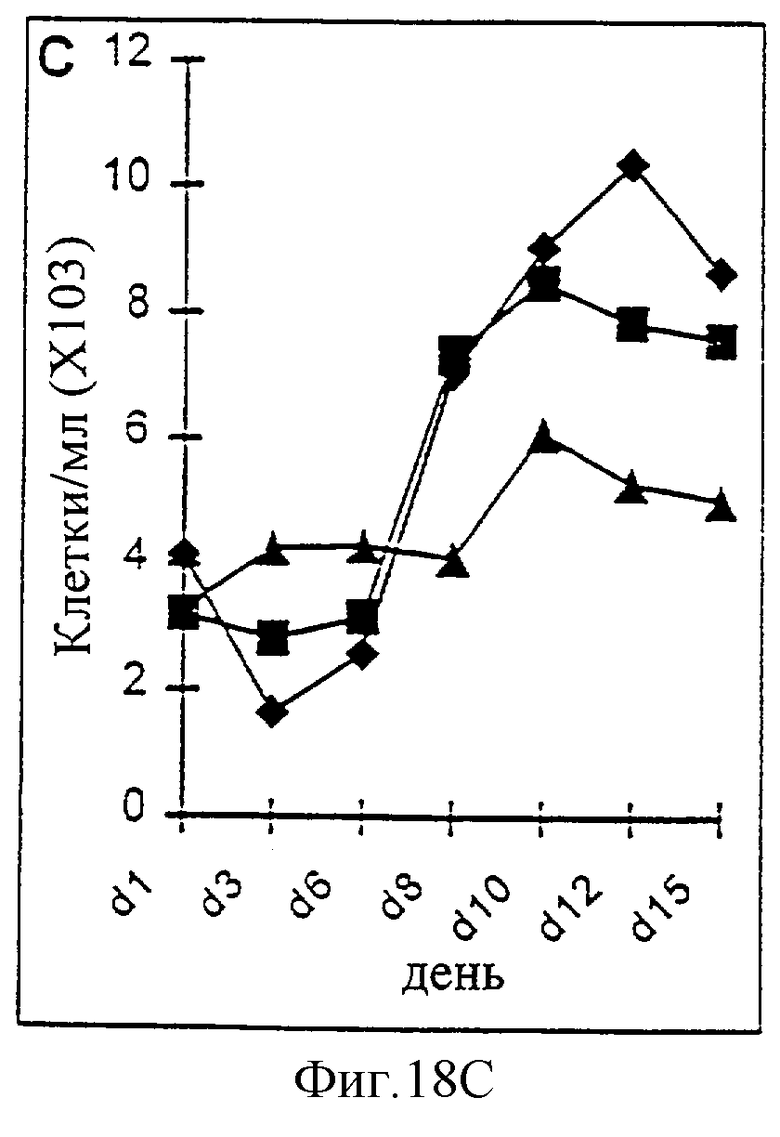
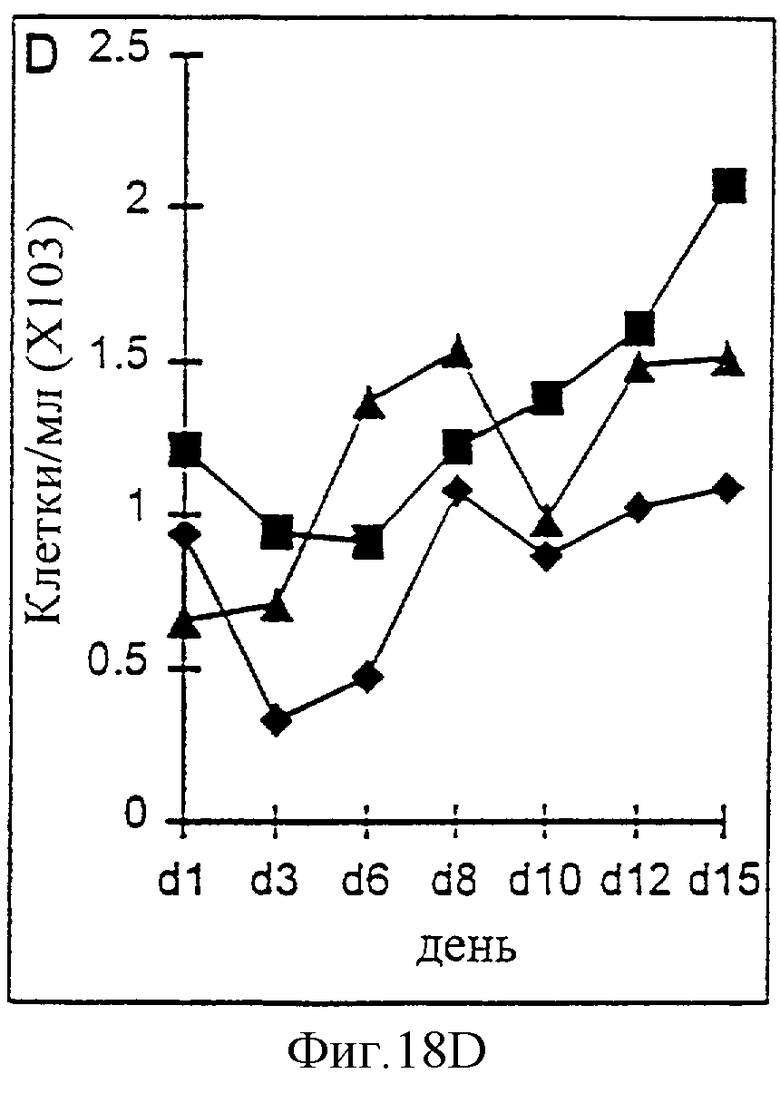
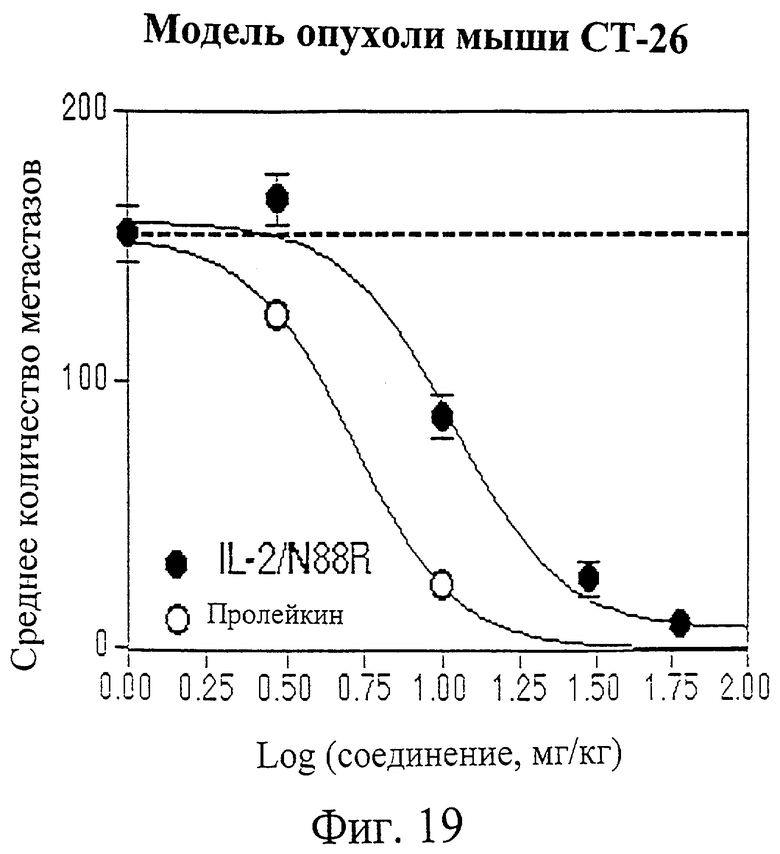
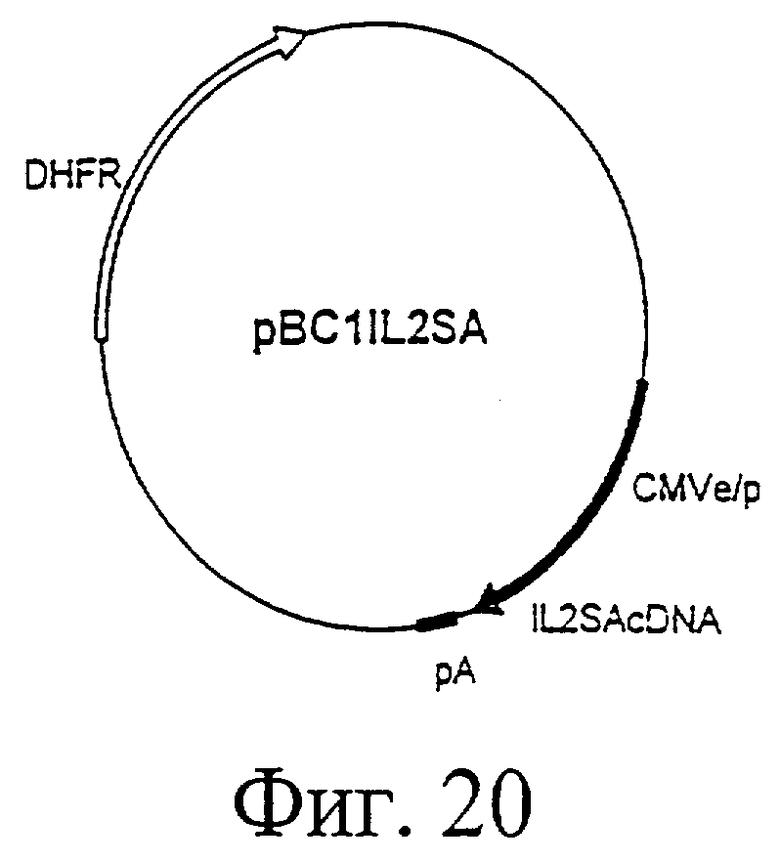
Изобретение относится к полипептиду (I), представляющему собой мутантный белок IL-2 человека с нумерацией согласно IL-2 дикого типа, где человеческий IL-2 замещен по крайней мере по одному положению, 20, 88 или 126, благодаря чему указанный мутантный белок активирует Т-клетки предпочтительно перед естественными киллерными (NK) клетками; фармацевтической композиции, обладающей иммуностимулирующей активностью, включающей полипептид I; полинуклеотиду, представляющему собой последовательность ДНК, кодирующую мутантный белок IL-2 человека; вектору pBC1IL 2SA для экспрессии мутантного белка IL-2 человека; линии клеток яичников китайских хомячков; линии клеток африканской зеленой мартышки, штамму E.coli, линии клеток Spodoptera fugiperda, трансформинированных вектором pBC1IL 2SA, которые продуцируют мутантный белок IL-2 человека; способу лечения млекопитающих, страдающих онкологическими заболеваниями, а также к способу отбора мутантных белков IL-2 по оценке их в исследованиях с применением IL-2Rαβγ в сравнении с IL-2Rβγ, где активность мутантного белка IL-2 повышается по отношению к IL-2 дикого типа в одном из исследований предпочтительно перед другим. 10 н. и 16 з.п.ф-лы, 8 табл., 20 ил.
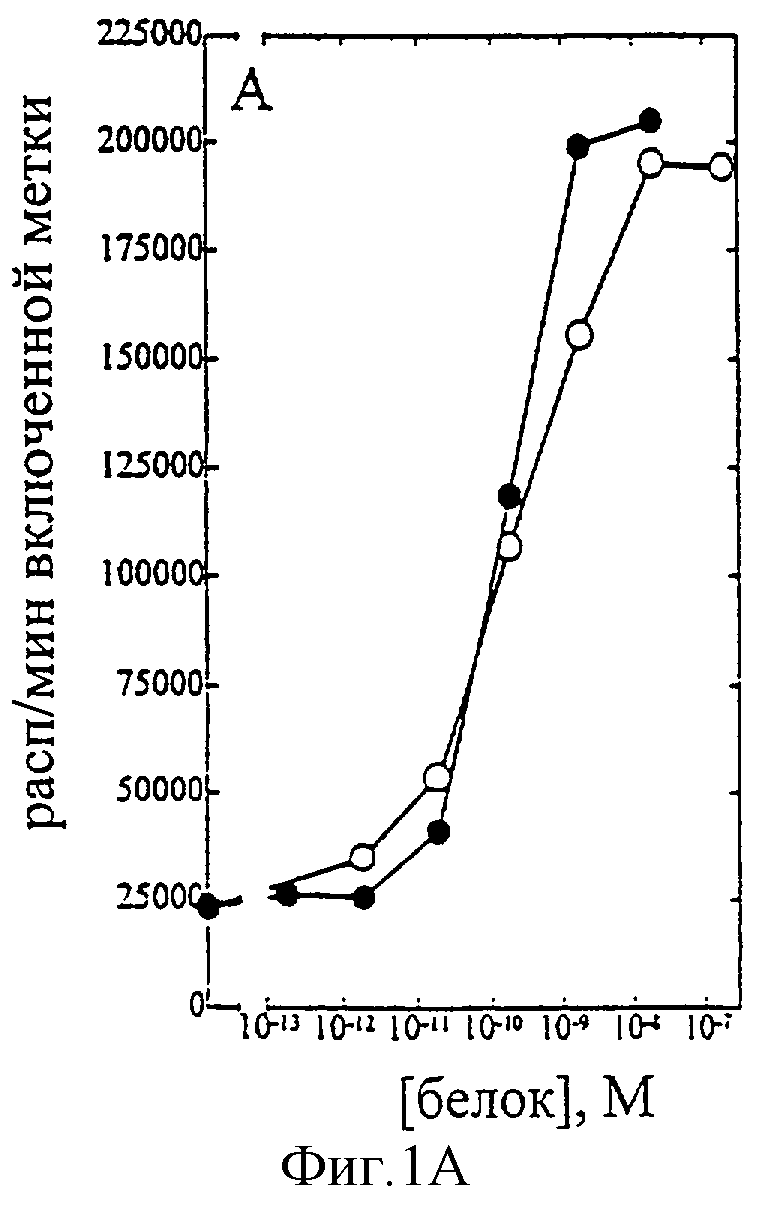
| XU D | |||
| et | |||
| al | |||
| European cytokine NETWORK | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Прибор для корчевания пней | 1921 |
|
SU237A1 |
| ZURAWSKI S.M | |||
| et | |||
| al | |||
| EMBO journal | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| WO 9604306 A, 15.02.1996 | |||
| СТАБИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ РЕКОМБИНАНТНОГО НЕГЛИКОЗИЛИРОВАННОГО ИНТЕРЛЕЙКИНА ЧЕЛОВЕКА В ВОССТАНОВЛЕННОМ ВИДЕ IL-2 И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2107511C1 |
| Способ лечения больных с опухолями | 1988 |
|
RU2003334C1 |
Авторы
Даты
2004-09-10—Публикация
1999-05-13—Подача