Настоящее изобретение относится к агонистам меди, которые связываются с сайтом связывания меди амилоидного протеина-предшественника (АРР) и/или оказывают ингибирующее действие на высвобождение амилоид-Аβ-пептида, который участвует в возникновении болезни Альцгеймера. Кроме того, настоящее изобретение относится к содержащему эти агонисты меди лекарственному средству, предназначенному для предупреждения и/или лечения болезни Альцгеймера. Настоящее изобретение относится также к способу выявления агонистов меди, обладающих действием, необходимым для осуществления изобретения.
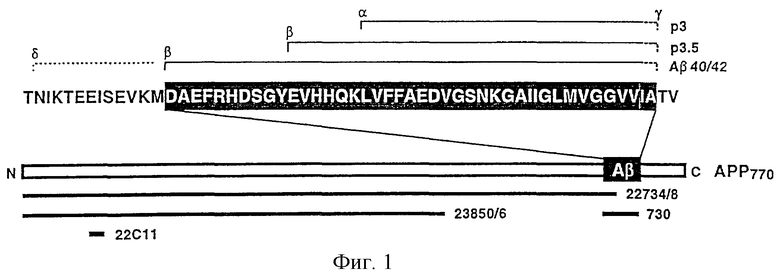
При болезни Альцгеймера β-амилоидный пептид (βА4, Аβ), являющийся основной составляющей старческих бляшек, и цереброваскулярный амилоид образуются в результате последовательных протеолитических расщеплений β-секретазой и γ-секретазой большого интегрального связанного с мембраной амилоидного протеина-предшественника (АРР), основные изоформы которого содержат аминокислоты: 695 (АРР695), 751 (АРР751) или 770 (АРР770) (J. Hardy, Trends Neurosci., 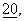 с. 154-159 (1997)). АРР-процессирование в Аβ-домене в результате действия α-секретазы препятствует образованию амилоида и приводит к высвобождению пептида р3, который содержит остатки 17-40/42 Аβ (фиг.1). Расщепление АРР с помощью α-секретазы или β-секретазы приводит к образованию растворимых АРР-фрагментов (sAPPα и sAPPβ), представляющих собой эктодомены АРР, которые выделяются во внеклеточное пространство.
с. 154-159 (1997)). АРР-процессирование в Аβ-домене в результате действия α-секретазы препятствует образованию амилоида и приводит к высвобождению пептида р3, который содержит остатки 17-40/42 Аβ (фиг.1). Расщепление АРР с помощью α-секретазы или β-секретазы приводит к образованию растворимых АРР-фрагментов (sAPPα и sAPPβ), представляющих собой эктодомены АРР, которые выделяются во внеклеточное пространство.
Несмотря на то, что физиологическая роль АРР выявлена еще неокончательно, АРР обладает некоторыми особенностями, сходными с молекулами клеточной адгезии и молекулами, участвующими в заживлении ран. К ним относятся, например, сайты связывания АРР с сульфатом гепарина, коллагеном, ламинином, протеазами, лектином и ионами металлов.
Предпринимающиеся в настоящее время попытки лечения болезни Альцгеймера направлены на то, чтобы блокировать образование амилоид-Аβ-пептида путем введения соединений, блокирующих β-секретазу или γ-секретазу, выделить которые до сих пор не удалось (Hooper и др., Biochem. J., 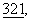 с. 265-279 (1997)). Однако ингибирование этих протеаз приводит к нежелательным побочным действиям, поскольку эти протеазы участвуют в процессировании различных трансмембранных протеинов. До настоящего времени основные усилия по лечению болезни Альцгеймера и других форм деменции концентрировались в основном на улучшении процессов обмена веществ в головном мозге и на замещении определенных дефицитных нейромедиаторов или на ингибировании воспалительных процессов, сопровождающих болезнь. Однако эти лекарственные средства не учитывают различий между различными формами деменции, а нацелены на наблюдающиеся при всех формах деменции вторичные сопутствующие проявления.
с. 265-279 (1997)). Однако ингибирование этих протеаз приводит к нежелательным побочным действиям, поскольку эти протеазы участвуют в процессировании различных трансмембранных протеинов. До настоящего времени основные усилия по лечению болезни Альцгеймера и других форм деменции концентрировались в основном на улучшении процессов обмена веществ в головном мозге и на замещении определенных дефицитных нейромедиаторов или на ингибировании воспалительных процессов, сопровождающих болезнь. Однако эти лекарственные средства не учитывают различий между различными формами деменции, а нацелены на наблюдающиеся при всех формах деменции вторичные сопутствующие проявления.
Таким образом, в основу настоящего изобретения была положена задача разработать средства, которые можно было бы использовать для предупреждения или лечения болезни Альцгеймера.
Указанная задача решается с помощью отличительных признаков, представленных в формуле изобретения.
Было установлено, что АРР специфично взаимодействуют с Zn (II) и Cu (II) в двух определенных сайтах. Связывание с Cu(II) вызывает окисление двух цистеинов АРР, что приводит к образованию дополнительного цистина. Один из двух высвободившихся в результате этого электронов восстанавливает связанную медь (II) до меди (I), судьба же второго электрона до настоящего времени не выяснена.
Было установлено далее, что добавление меди (II) в клетки млекопитающих приводит к увеличению высвобождения АРР-продуктов α-секреторного пути обмена веществ (sAPPα и р3) и к уменьшению высвобождения продуктов β-секреторного пути обмена веществ (р3.5 и Аβ, участвующего в возникновении болезни Альцгеймера). Таким образом, можно эффективно и избирательно ингибировать или лечить болезнь Альцгеймера путем введения соединений, которые действуют в качестве агонистов меди, т.е. которые связываются с сайтом связывания меди в АРР и/или могут ослаблять ее физиологическое действие, т.е. уменьшать или ингибировать образование амилоид-Аβ-пептида. Поскольку при связывании меди с помощью АРР также образуются очень токсичные ионы Cu(I), то такие действующие в качестве агонистов молекулы обладают тем дополнительным свойством, что в результате связывания АРР с Cu (II) они предохраняют клетки от повреждения и тем самым могут ингибировать возникновение реакционноспособных форм кислорода, которые образуются в результате взаимодействия меди и пероксида водорода.
Таким образом, один из объектов настоящего изобретения относится к агонисту меди, отличающемуся тем, что он связывается с сайтом связывания меди амилоидного протеина-предшественника (АРР) и/или уменьшает или ингибирует высвобождение амилоид-Аβ-пептида.
В контексте настоящего изобретения понятие “агонист меди” относится к любой субстанции, например к неорганическому или органическому соединению, которое может связываться с сайтом связывания меди АРР и/или уменьшать либо ингибировать высвобождение амилоид-Аβ-пептида. Предпочтительными агонистами меди являются двухвалентные ионы металлов, которые в физиологически высоких концентрациях могут конкурировать с медью за сайты связывания на молекуле АРР, например, 20-200 мМ Mg(II), предпочтительно 100 мМ Mg(II); 20-200 мМ Са(II), предпочтительно 100 мМ Са(II); 0,05-20 мМ Zn(II), предпочтительно 100 мкМ-1 мМ Zn(II) и т.д. Другими предпочтительными агонистами меди являются олигопептиды, олигонуклеотиды, олигосахариды или нуклеотидные аналоги, которые в основном благодаря своей трехмерной структуре схожи с молекулой меди и связываются с сайтом связывания меди по принципу ключ-замок. В предпочтительном варианте осуществления олигопептиды могут содержать также последовательность, соответствующую сайту связывания меди, и благодаря этому связываться с ним. Другие предпочтительные агонисты меди получают из имеющихся в продаже библиотек химических веществ, или же они представляют собой новые химические соединения (комбинационная химия) либо низкомолекулярные природные соединения, выделенные из микроорганизмов, соответственно из растений. Эти соединения благодаря их трехмерной структуре по характеристикам и размеру также напоминают молекулу меди, но не обладают ее негативными свойствами.
Таким образом, действие в качестве агониста меди предпочтительно основано на том, что субстанция специфично и с более высокой аффинностью, чем ионы меди, связывается с сайтом связывания меди АРР или специфично связывается с той областью последовательности АРР, которая ответственна за связывание с медью, и, присутствуя в сайте (стерически), препятствует дальнейшему связыванию меди, соответственно вытесняет ионы меди. Агонисты меди представляют собой такие конкурентно (за сайты связывания меди) и неконкурентно связывающие лиганды, которые могут имитировать физиологическое действие меди. В контексте настоящего изобретения агонисты меди представляют собой и такие субстанции, которые не связываются с сайтами связывания меди, но, например, стабилизируют конформацию АРР, характерную для комплекса медь-АРР, т.е. могут имитировать физиологическое действие меди на другие сайты связывания (помимо непосредственного сайта связывания меди).
В контексте настоящего описания понятие “уменьшать или ингибировать высвобождение амилоид-Аβ-пептида” относится к действию агониста меди, которое может считаться достаточным для достижения профилактического или терапевтического действия в отношении болезни Альцгеймера.
Специалист может на основе обычных стандартных для данной области методов идентифицировать и получить соединения, обладающие описанным выше действием в качестве агонистов меди. В случае агонистов, которые не встречаются в естественных условиях (например, для небольших синтезированных методами органической химии веществ, которые представлены в виде так называемых библиотек), олигонуклеотидов, олигопептидов и нуклеотидных аналогов, синтез осуществляют согласно обычным методам, которые хорошо известны специалисту. Субстанции, которые могут служить в качестве потенциальных агонистов, можно выявлять с помощью аффинной хроматографии, например, с использованием метода “BIAcore-Technik”. При этом указанные выше соединения тестируют в отношении связывания с АРР, прежде всего с доменами АРР, которые содержат сайты связывания меди. Затем выявленные лиганды тестируют в отношении действия на АРР-процессирование в системе клеточной культуры, например, с помощью анализа конкурентного связывания с соответствующими антителами. На основе этого специалист также с помощью обычных методов, например, аналогичных методам, описанным в примерах 4 и 5, может определить, являются ли выявленные агонисты переносимыми для пациентов, и при необходимости установить зависимость действия от дозы. Таким образом, предлагаемый в изобретении способ выявления агонистов меди, которые связываются с сайтом связывания АРР и/или оказывают ингибирующее действие на высвобождение амилоид-Аβ-пептида, отличается тем, что
(а) АРР или один из его фрагментов, несущий сайт связывания меди, вводят в контакт с различными концентрациями соединения, которое может обладать указанным выше действием, и
(б) выявляют уменьшение количества Аβ-протеина.
В предпочтительном варианте осуществления этот способ отличается тем, что
(а) АРР или один из его фрагментов, несущий сайт связывания меди, вводят в контакт с находящейся в растворе или иммобилизованной библиотекой субстанций, соответственно с низкомолекулярными субстанциями, выделенными из микроорганизмов и/или растений,
(б) с использованием находящейся в растворе библиотеки субстанций или жидких низкомолекулярных субстанций проводят иммунопреципитацию комплекса сайт связывания меди/лиганды из раствора, содержащего антитела, которые являются специфичными для АРР или его фрагмента, или с использованием иммобилизованной библиотеки субстанций высвобождают лиганды из комплекса сайт связывания меди/лиганды путем добавления солей меди,
(в) выявляют лиганды и
(г) отбирают лиганды, которые в результате конкурентного или неконкурентного связывания с сайтами связывания меди АРР или другими сайтами АРР оказывают ингибирующее действие на высвобождение амилоид-Аβ-пептида, при этом стадия (г) при необходимости может предшествовать стадии (в).
В контексте настоящего изобретения понятие “лиганд” означает любую субстанцию, которая при осуществлении указанных выше способов связывается с сайтами связывания меди или другими сайтами АРР.
Указанные выше антитела представляют собой, например, моноклональные или поликлональные антисыворотки, которые распознают АРР и пригодны для иммунопреципитации. Они имеются в продаже, например производятся фирмой Boehringer Mannheim, фирмой Dianova, фирмой Sigma. Другие антитела, пригодные для выявления АРР, комплексов АРР и Aβ40 (изоформа Аβ, содержащая 40 аминокислот; см. фиг.1), соответственно Аβ42 (изоформа Аβ, содержащая 42 аминокислоты; см. фиг.1), описаны у Ida и др., J. Biol. Chem., 271, с. 22908-22914 (1996), а также у Weidemann и др., Cell, 57, с. 115-126 (1989).
В качестве библиотек субстанций используют банки органических химических соединений, которые в результате случайного синтеза образуются вокруг “лидерной” субстанции. Такие библиотеки могут быть получены на коммерческой основе (например, от фирмы Morphosys, Мюнхен; фирмы Analytikon, Берлин) или могут быть получены в результате сотрудничества с химическими лабораториями (например, новые химические соединения, получаемые с использованием комбинационной химии). Низкомолекулярные субстанции можно выделять из микроорганизмов и растений с помощью BIAcore-метода.
Контактирование осуществляют либо с находящимися в растворе, либо с иммобилизованными АРР, соответственно фрагментами АРР. Образовавшиеся комплексы осаждают из раствора с помощью антител и затем выявляют с помощью флуоресценции, радиоактивности или аналитическими методами, такими как масс-спектроскопия, газовая хроматография и т.д.
Для выявления соответствующего фрагмента АРР сначала определяют связывание тестируемых субстанций со всем АРР, а затем выявляют все более и более короткие фрагменты, которые обладают такими же способностями к связыванию, что и полноразмерная молекула.
Еще одной возможностью осуществления стадии (б) является использование метода аффинной хроматографии, например BIAcore, при котором либо молекулу АРР, либо ее лиганды иммобилизуют на поверхности носителя. Затем на эту поверхность наносят путем инъекции соответствующую молекулу и, если происходит связывание, то вводят соль меди для того, чтобы снова разорвать связь. За этим процессом можно осуществлять непосредственное наблюдение с помощью биосенсорного метода.
В предпочтительном варианте осуществления способ идентификации по изобретению включает стадию (г) инкубации клеток млекопитающего, стабильно трансфектированных человеческим АРР695, с полученными на стадиях (а)-(в) лигандами и выявление продуцирования амилоид-Аβ-пептида с помощью поликлональных или моноклональных антител. Для анализа могут использоваться при этом иммунопреципитация с последующим гель-электрофорезом в присутствии ДСН, ELISA (твердофазный иммуноферментный анализ) и Вестерн-блоттинг с иммунопреципитацией.
В альтернативном варианте на стадии (г) полученный на стадиях (а)-(в) лиганд вводят трансгенной мыши, которая экспрессирует человеческий амилоид-Аβ-пептид. Затем получают образец из ЦНС или из крови из хвостовой вены и выявляют продуцирование амилоид-Аβ-пептида с помощью поликлональных или моноклональных антител (например, фирмы Dianova, фирмы Boehringer Mannheim, фирмы Sigma и разработанных заявителем антител [Ida и др., J. Biol. Chem., 271, с. 22908-22914, 1996]. Этот альтернативный метод представляет собой тест для выявления лигандов in vivo. При этом процедура опыта (включая используемые методы) в многом схожа с описанными выше экспериментами с использованием клеточных культур. Вместо выявления образовавшихся АРР-фрагментов в супернатанте культуры клеток или внутри клеток выявляют эти фрагменты в сыворотке мышей. Методы выявления при этом аналогичны методам, применяемым в экспериментах с клеточными культурами.
Кроме того, настоящее изобретение относится к лекарственным средствам, которые содержат агонисты меди по изобретению. При необходимости эти лекарственные средства дополнительно содержат фармацевтически приемлемый носитель. Специалистам известны пригодные носители и составы таких лекарственных средств. Пригодные носители включают, например, забуференные фосфатом растворы поваренной соли, воду, эмульсии, например эмульсии типа масло в воде, смачиватели, стерильные растворы и т.д. Вводить лекарственное средство можно перорально или парентерально. Методы парентерального введения включают местное, внутриартериальное, внутримышечное, подкожное, интрамедуллярное, интратекальное, интравентрикулярное, внутривенное, внутрибрюшинное или интраназальное введение. Соответствующая доза назначается лечащим врачом и зависит от различных факторов, например от возраста, пола, веса пациента, стадии болезни, методики и формы введения и т.д.
Таким образом, настоящее изобретение относится к применению описанных выше агонистов меди для изготовления лекарственного средства, предназначенного для предупреждения или лечения болезни Альцгеймера.
Ниже изобретение более подробно описано со ссылкой на прилагаемые чертежи.
На фиг.1 представлено процессирование амилоидного протеина-предшественника (АРР770) с образованием Аβ, р3.5 и р3.
На чертеже используется однобуквенный код; белые буквы обозначают аминокислотную последовательность Аβ1-40/42. Примерное положение эпитопа антитела показано черной полосой под последовательностью.
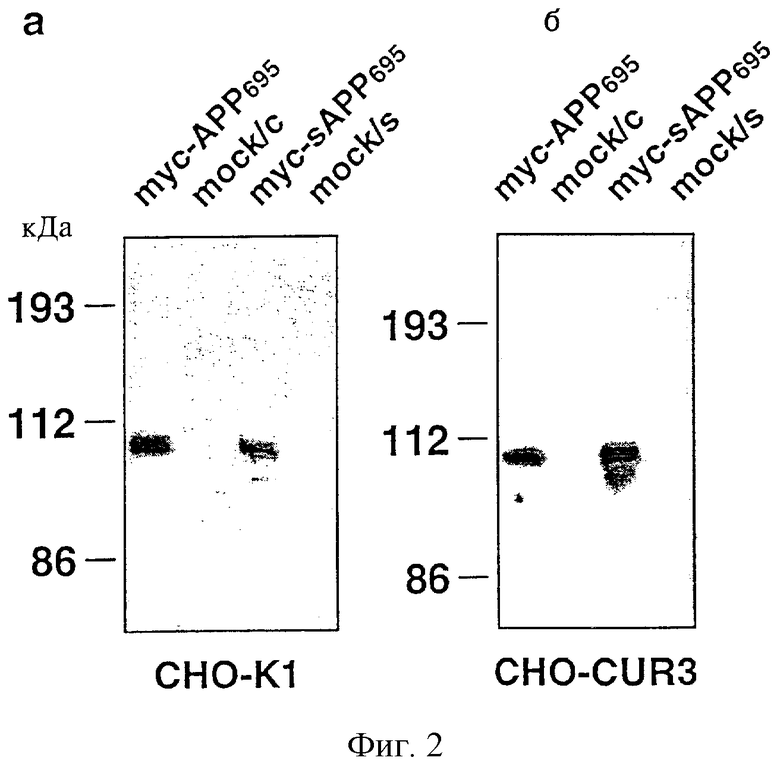
На фиг.2 представлена иммунопреципитация меченного с помощью с-mус АРР695.
С помощью поликлональных антител 18/47 к с-mус проводили иммунопреципитацию в лизате (mус-АРР695) и в кондиционированной среде (myc-sAPP695) с клетками дикого типа (фиг.2а, СНО-К1) и с устойчивыми к меди клетками СНО (фиг.2б, CHO-CUR3). Осажденные образцы после переноса на нитроцеллюлозную мембрану подвергали иммуноблоттингу с использованием моноклонального антитела 22С11 к АРР. Контроль: среда (“mock/s”) и лизат (“mock/c”) “mock”-трансфектированных клеток.
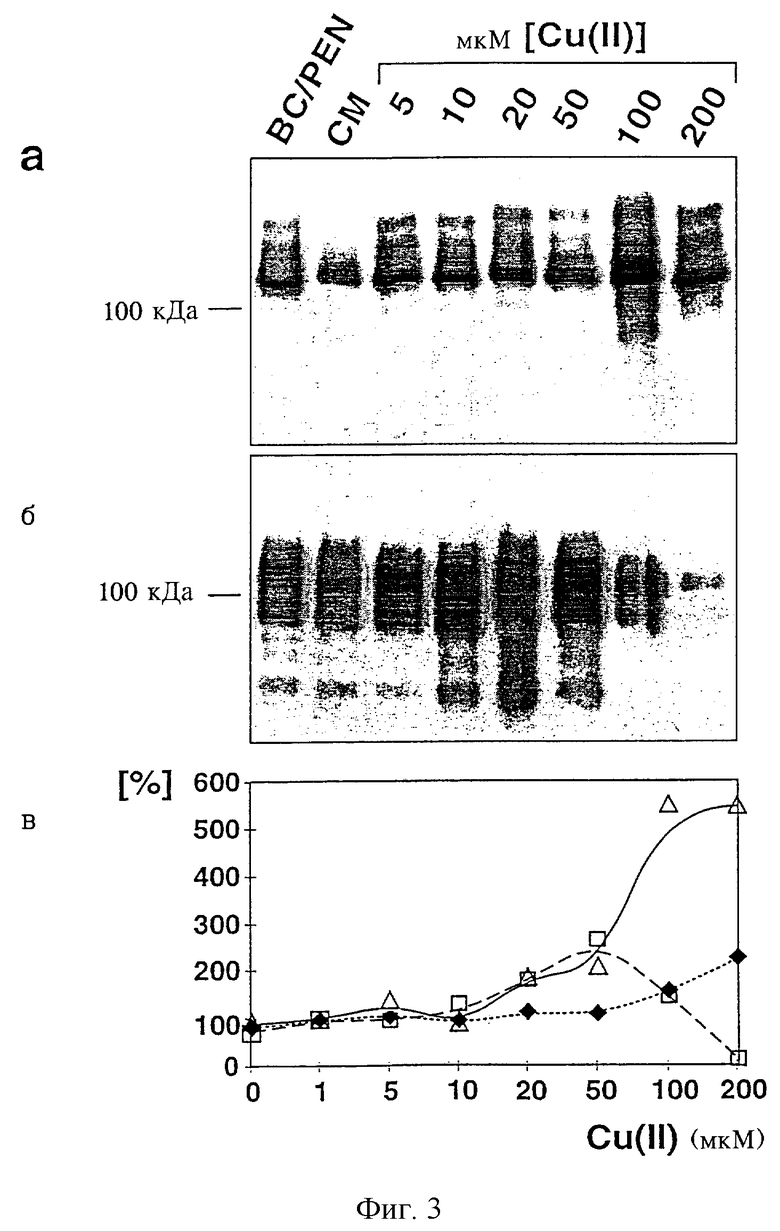
На фиг.3 представлена иммунопреципитация Ноlо-АРР695 в лизате (фиг.3а), растворимого АРР695 (фиг.3б) и Аβ и р3 в среде (фиг.3г) с имеющими метаболическую метку CUR3-клетками с помощью антител к АРР (22734/6; поликлональная кроличья сыворотка, полученная в результате иммунизации АРР, продуцируемым бактериями, см. фиг.1) или антитела к Аβ(730; поликлональная кроличья сыворотка, полученная в результате иммунизации Аβ40-пептидом, полученным синтетическим путем) после инкубации в течение четырех часов в присутствии соединения, образующего хелатный комплекс с медью, батокупроина (ВС) и D-пеницилламина (PEN), в нормальной среде (СМ; основная среда, содержащая медь) или в среде, содержащей медь в указанных концентрациях.
Проявление sAPP695 в виде дуплета (фиг.3б) при высоких концентрациях меди обусловлено различным содержанием в нем сиалиновой кислоты. Фрагмент (фиг.3г), находящийся несколько выше полосы, соответствующей Аβ, проявляется при небольших концентрациях меди и предположительно образуется в результате расщепления δ- и γ-секретазами (см. фиг.1).
Измеренные в этом эксперименте относительные количества сАРР (незаштрихованные треугольники), sAPP (незаштрихованные квадраты) и общего секретированного протеина (черные ромбы) количественно оценивали в виде процента радиоактивности при определенной концентрации меди в основной среде, указанной на фиг.3в; величины Аβ (незаштрихованные квадраты), р3 (незаштрихованные треугольники) и sAPP (черные ромбы), полученные в таком же эксперименте, что и уровни, приведенные на фиг.3в, представлены на фиг.3д для более наглядного сравнения. Данные представляют собой средние значения по трем независимым экспериментам. “0” мкМ и “1” мкМ меди на фиг.3д обозначают условия инкубации в случае отсутствия меди (PEN/BC) и присутствия меди в основной среде (СМ; 0,8 мкМ).
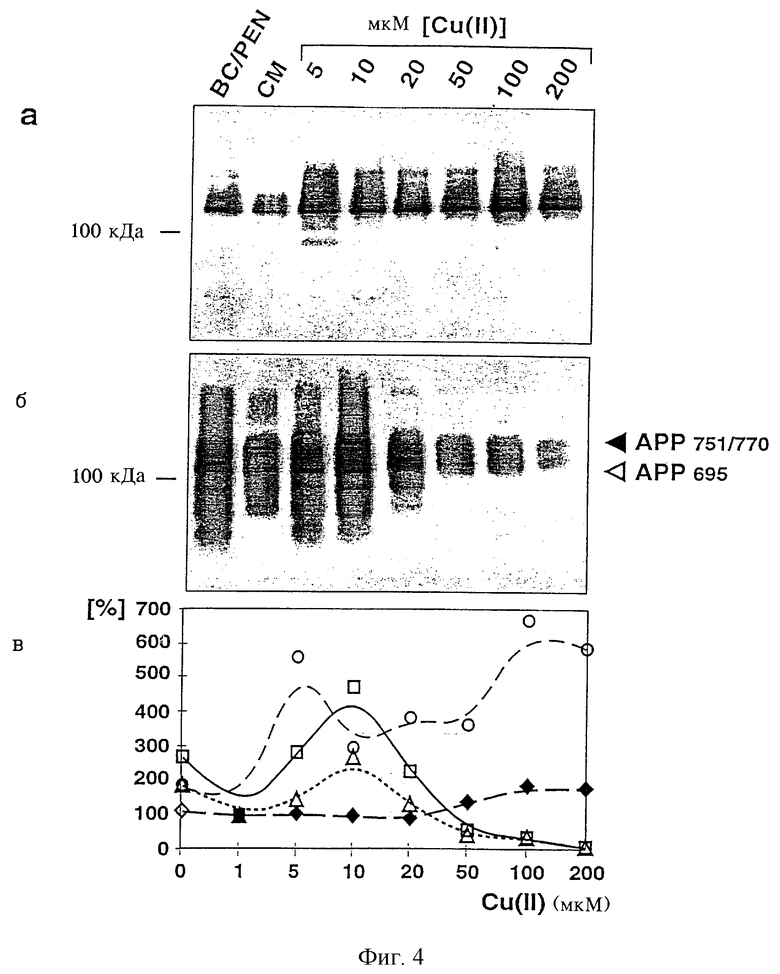
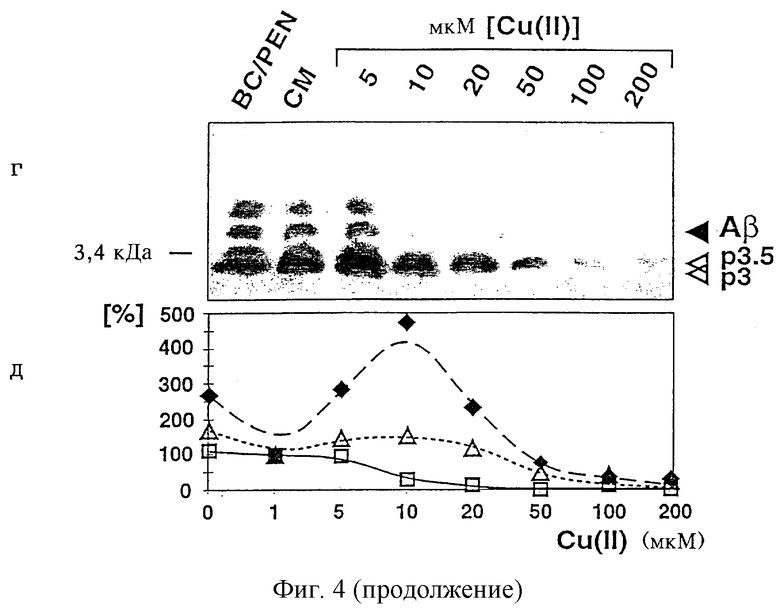
На фиг.4 представлена иммунопреципитация Ноlо-АРР695 в лизате (фиг.4а), растворимого АРР695 (фиг.4б) и Аβ и р3 в среде (фиг.4г) с метаболически меченными К1-клетками с помощью антител к АРР (22734/6) или антител к Аβ(730) после инкубации в течение четырех часов в присутствии соединения, образующего хелатный комплекс с медью, батокупроина (ВС) и D-пенициллинамина (PEN), в нормальной среде (СМ; основная среда, содержащая медь) или в среде, которая содержит медь в указанных концентрациях; количественную оценку проводили так же, как и для фиг.3.
Эндогенный уровень sAPP751/770 в К1-клетках выше, чем в CUR3-клетках (см. фиг.2), и зависит от концентрации меди, поэтому его оценивали количественно. Данные представляют собой средние значения по двум независимым экспериментам. Численные значения измеренных в этом опыте относительных количеств сАРР (незаштрихованные кружки), sAPP695 (незаштрихованные квадраты), sAPP751/770 (незаштрихованные треугольники) и общего секретированного протеина (черные ромбы) приведены на фиг.4в. На фиг.4д представлены данные такого же эксперимента, что и для фиг.4в, при этом Аβ обозначены незаштрихованными квадратами, р3 - незаштрихованными треугольниками и sAPP - черными ромбами. “0” мкМ и “1” мкМ меди на фиг.4д обозначают условия инкубации в случае отсутствия меди (PEN/BC) и присутствия меди в основной среде (СМ; 0,8 мкМ). Фрагмент (фиг.4г), находящийся несколько выше полосы, соответствующей Аβ, проявляется при небольших концентрациях меди и предположительно образуется в результате расщепления δ- и γ-секретазами (см. фиг.1).
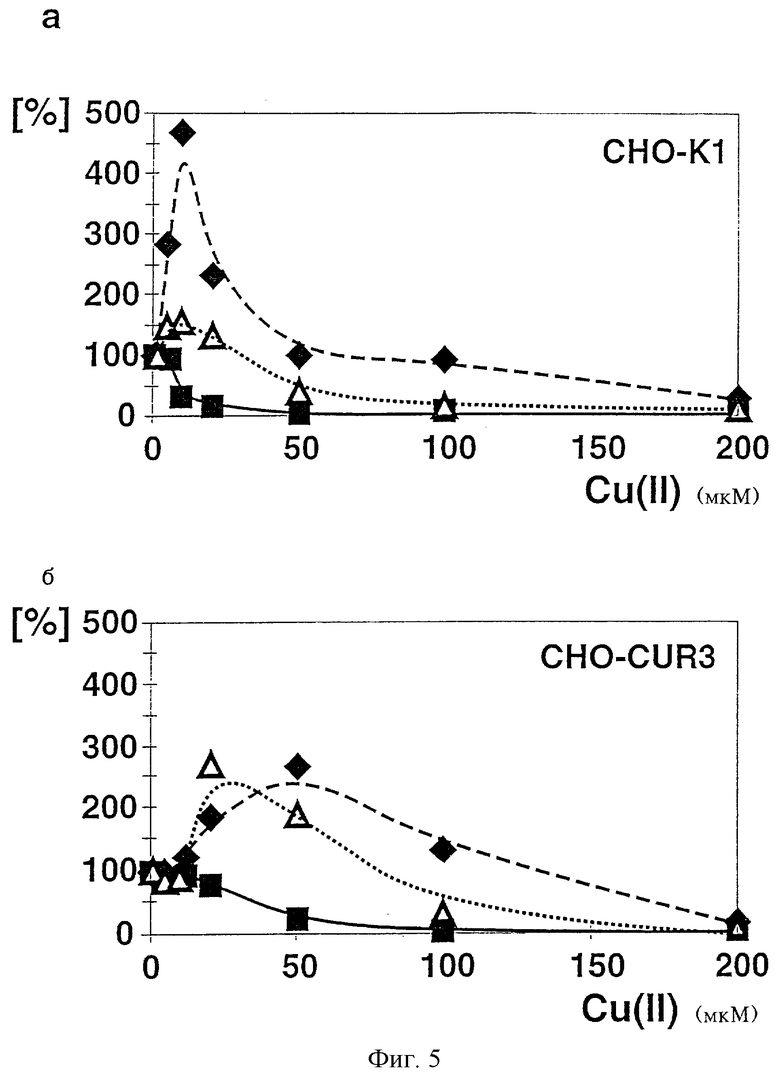
На фиг.5 представлена количественная оценка относительных уровней sAPP695, р3 и Аβ, выпавших в результате иммунопреципитации в осадок в кондиционированной среде с СНО-К1-клетками (фиг.5а) и CHO-CUR3-клетками (фиг.5б).
Увеличение уровня sAPP695 (черные ромбы) достигало максимума в К1-клетках при 10 мкМ Cu(II) (фиг.5а), а в CUR3-клетках при 50 мкМ Cu(II) (фиг.5б); после чего его уровень опять снижался. Изменение уровня sAPP (незаштрихованные треугольники) начиналось позднее по сравнению с изменениями уровня протеина р3, максимальный уровень которого достигался при несколько меньших дозах Cu(II), что, по всей вероятности, обусловлено большим временем полужизни по сравнению с sAPP. В противоположность этому уровни Аβ (черные квадраты) в обеих линиях клеток резко уменьшались по сравнению с исходным уровнем по мере увеличения концентрации Сu(II). Первая точка на графике соответствует исходной концентрации меди (0,8 мкМ Сu(II)).
Ниже изобретение проиллюстрировано на примерах.
Пример 1: Общие методы
Клеточные линии и трансфекция
Клетки СНО трансфектировали несущим с-mус-метку вектором АРР695 (Peraus и др., J. Neurosci., 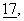 с. 7714-7724 (1997)) или экспрессионным вектором (pcDNA3) с помощью высокоэффективного метода трансфекции с использованием фосфата кальция (Chen и др., Biotechniques,
с. 7714-7724 (1997)) или экспрессионным вектором (pcDNA3) с помощью высокоэффективного метода трансфекции с использованием фосфата кальция (Chen и др., Biotechniques, 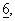 с. 632-638 (1988)). ДНК APP695-N-tag плазмиды pSP65 (фирма Invitrogen) клонировали в векторе pcDNA3 (фирма Invitrogen/ITC Biotechnology, Гейдельберг) с использованием сайтов клонирования Smal, соответственно EcoRV. Эффективность трансфекции проверяли с помощью иммунопреципитации АРР с использованием поликлонального кроличьего антитела к с-mус (18/47; созданного к аминокислотной последовательности EQKLISEEDL, т.е. последовательности с-mус; фирма Eurogentec, Серен, Бельгия) и иммуноблоттинга с использованием моноклонального мышиного антитела 22С11 (фирма Boehringer Mannheim) с помощью системы анализа "ECL" (фирма Amersham, Брауншвейг). Родительские СНО-К1-клетки, а также устойчивый к меди вариант клеток CUR3 выращивали при 37°С в среде Игла (ВМЕ), дополненной 2 мМ L-глутамином, 0,1 мМ пролином, 20 мМ HEPES и 10% фетальной телячьей сыворотки (фирма Boehringer Mannheim). Основная концентрация меди составляла 0,8 мкМ. CUR3-клетки выращивали в среде, содержащей 200 мкМ меди.
с. 632-638 (1988)). ДНК APP695-N-tag плазмиды pSP65 (фирма Invitrogen) клонировали в векторе pcDNA3 (фирма Invitrogen/ITC Biotechnology, Гейдельберг) с использованием сайтов клонирования Smal, соответственно EcoRV. Эффективность трансфекции проверяли с помощью иммунопреципитации АРР с использованием поликлонального кроличьего антитела к с-mус (18/47; созданного к аминокислотной последовательности EQKLISEEDL, т.е. последовательности с-mус; фирма Eurogentec, Серен, Бельгия) и иммуноблоттинга с использованием моноклонального мышиного антитела 22С11 (фирма Boehringer Mannheim) с помощью системы анализа "ECL" (фирма Amersham, Брауншвейг). Родительские СНО-К1-клетки, а также устойчивый к меди вариант клеток CUR3 выращивали при 37°С в среде Игла (ВМЕ), дополненной 2 мМ L-глутамином, 0,1 мМ пролином, 20 мМ HEPES и 10% фетальной телячьей сыворотки (фирма Boehringer Mannheim). Основная концентрация меди составляла 0,8 мкМ. CUR3-клетки выращивали в среде, содержащей 200 мкМ меди.
Введение метаболической метки и иммунопреципитация
Стабильно трансфектированные СНО-клетки, находящиеся в чашке для выращивания культуры (60 мм), обрабатывали в течение 4 ч 2 мл минимальной поддерживающей среды (MEM), которая не содержала метионина (фирма Sigma, Мюнхен) и была дополнена [35S] метионином (220 мкКи) (фирма Amersham, Брауншвейг) и 5% N2. Кондиционированную среду (СМ) и клетки собирали и подвергали иммунопреципитации. Перед этим определяли концентрации протеина анализом протеина по методу фирмы “BioRad” (Bradford и др., Anal. Biochem., 72, с. 248-254 (1976)) или несущие радиоактивную метку протеины осаждали с помощью 10%-ной трихлоруксусной кислоты (ТХК) и измеряли уровни включенного [35S] метионина (прибор типа Beckman LS 6000IC). Клетки лизировали в буфере для экстракции, который содержал 50 мМ Трис-НСl (значение рН 7,5), 150 мМ NaCl, 2 мМ ЭДТК, 2% тритона Х-100, 2% NP40, 10 мкг/мл апротинина и 10 мкг/мл лейпептина. Для отделения клеточного дебриса лизат и среду центрифугировали в течение 10 мин при 13000×g и состав среды регулировали таким образом, чтобы она содержала 25 мМ Трис-НСl (значение рН 8,5), 1 мМ фенилметилсульфонилфторид (ФМСФ), 10 мкг/мл апротинина, 10 мкг/мл лейпептина, 0,5% тритона Х-100 и 0,5% NP40. Солюбилизированные протеины разбавляли в 100 мМ Трис-НСl (значение рН 7,5), 300 мМ NaCl и 4 мМ ЭДТК в соотношении 1:2. Супернатант инкубировали в течение ночи при 4°С с антителом к АРР на качалке с переворачиванием пробирки вокруг поперечной оси. В некоторых экспериментах полученные супернатанты затем анализировали с использованием антисыворотки к Аβ. Иммунные комплексы получали с помощью протеин-А-сефарозы и анализировали согласно методу, описанному у Weidemann и др., Cell,  с. 115-126 (1989).
с. 115-126 (1989).
Антитела и электрофорез
При выявлении АРР поликлональные кроличьи антитела к рекомбинантному Fd-APP770 (антисыворотка 22734/6 к аминокислотным остаткам 18-687 АРР770 или антисыворотка 23850/6 к аминокислотным остаткам 18-491 ААР (фиг.1)) для осаждения разбавляли в соотношении 1:500. Антисыворотки получали в лаборатории известными специалистам стандартными методами. Аβ, р3.5 и р3 распознаются поликлональным антителом 730 (разбавление 1:50; Аβ, р3.5 и р3 осаждаются одинаковым образом), которое вырабатывалось к синтетическому пептиду, соответствующему аминокислотным остаткам 1-40 Аβ (фиг.1). Аβ и его производные разделяли с помощью 10-20%-ного трис-трицинполиакриламидного геля, а АРР с помощью 7%-ного трис-глицин-, соответственно 7%-ного трис-трицинполиакриламидного геля. Для иммуноблоттинга клеточные экстракты и внеклеточную среду осаждали с помощью 10%-ной ТХК, промывали ацетоном и разбавляли в буфере для анализа. После проведения гель-электрофореза гели подвергали дальнейшей обработке согласно методу, описанному у Simons и др., J. Neurosci,  с. 899-908 (1996), и количественно оценивали с помощью системы “Fuji-Bas-Phosphorlmager”. Данные выражали в виде среднего значения±стандартное отклонение и, если не указано иное, они представляли собой результаты по крайней мере по двум независимым опытам.
с. 899-908 (1996), и количественно оценивали с помощью системы “Fuji-Bas-Phosphorlmager”. Данные выражали в виде среднего значения±стандартное отклонение и, если не указано иное, они представляли собой результаты по крайней мере по двум независимым опытам.
Обработка действующим веществом и анализ на основе LHD
Во время фазы внесения метки к культуральной среде добавляли хлорид меди или хлорид цинка (концентрации: от 5 мкМ до 200 мкМ). D-(-)-пеницилламин (PEN; фирма Sigma), батокупроиндисульфонат (ВС; фирма Aldrich) и 1,10-фенантролин (PEN; фирма Sigma) добавляли в среду до получения конечной концентрации 100 мкМ (PEN и ВС), соответственно 200 мкМ (PEN). Жизнеспособность клеток оценивали по выходу лактатдегидрогеназы (LDH) (41). Выход LDH оценивали на основе измерений ферментативной активности (в ед./л) через 2 и 4 ч в среде, состоящей из 70% конфлюэнтных монослоев СНО-клеток, находящихся в модифицированной по методу Дульбекко среде Игла (среда DMEM).
Пример 2: Экспрессия АРР в клетках, которые трансфектированы кДНК, кодирующей АРР695
Для исследования влияния меди на процессирование АРР при уменьшающихся концентрациях меди, соответственно увеличивающихся концентрациях меди (0-200 мкМ), использовали родительскую линию СНО-К1-клеток и устойчивых к меди CUR3-клеток. CUR3-клетки использовали для исследования влияния внутриклеточной меди на процессирование АРР. По сравнению с СНО-К1-клетками в CUR3-клетках присутствует более низкая концентрация внутриклеточной меди, что вызвано усиленным оттоком меди вследствие увеличенной в 70 раз концентрации откачивающего медь “АТФ-азного насоса типа Menkes P” (внутриклеточный насос меди/внутриклеточная система экспорта меди).
После трансфекции СНО-К1-клеток и CUR3-клеток с помощью кДНК, кодирующей АРР695, содержащий N-концевой с-mус-эпитоп (фиг.1), оказывалось возможным легко выявить экспрессию АРР с помощью иммунопреципитации с использованием поликлональной антисыворотки к c-myc и последующего иммуноблоттинга с использованием моноклонального антитела 22С11 (фиг.2а, б). Поликлональное антитело к c-mус вызывало иммунопреципитацию меченного с помощью с-mус АРР695 с относительной молекулярной массой 105 кДа в клеточном лизате (сАРР695) и кондиционированной среде (sAPP695). Как и ожидалось, c-myc APP695 не был обнаружен ни в лизате, ни в среде клеток, которые были трансфектированы только pcDNA3.
Пример 3: Уменьшение концентрации Аβ в зависимости от возрастающих концентраций меди
Для исследования регуляции метаболизма АРР с помощью ионов меди СНО-клетки, стабильно трансфектированные с помощью APP695, маркировали в течение 4 ч меченным с помощью 35S метионином в присутствии различных концентраций меди и после иммунопреципитации с помощью поликлональных антител (730), которые распознают АРР (22734/6), соответственно Аβ и р3, оценивали экспрессию эктодоменов АРР из Аβ и р3. В лизатах CUR3-клеток была обнаружена полоса продукта с молекулярной массой 105 кДа, соответствующая незрелому сАРР695-голопротеину (фиг.3а). В кондиционированной среде выделенные производные АРР695 были выявлены в виде полос, соответствующих продуктам с молекулярными массами 105 и 97,5 кДа (фиг.3б), причем, по-видимому, они различались тем, что верхняя полоса соответствовала высокому содержанию сиалиновой кислоты. На протяжении всего эксперимента не было обнаружено уменьшения жизнеспособности клеточных линий.
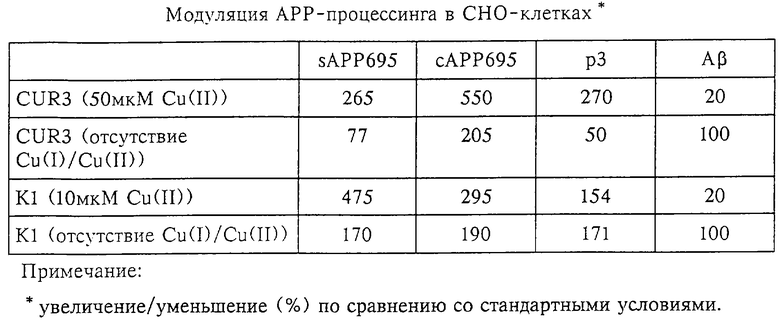
При инкубации CUR3-клеток с возрастающими концентрациями меди концентрация голопротеина АРР и растворимого АРР существенно возрастала. По сравнению с основной средой максимум sAPP, составлявший 265%, достигался при 50 мкМ Cu (II), после чего индуцировалось общее продуцирование секретируемых протеинов (фиг.3в; таблица 1). Секретирование р3, С-концевого фрагмента секреторного АРР, образующегося в результате расщепления с помощью α-секретазы, в диапазоне концентраций от 20 мкМ до 50 мкМ увеличивалось в среде на 270% (фиг.3г; таблица 1). Иммунопреципитацию происходящего из Аβ-области АРР радиоактивномеченного пептида осуществляли с помощью кроличьей антисыворотки 730, которая распознает Аβ (4,5 кДа), р3.5 (3,5 кДа) и р3 (3 кДа) (фиг.1). Если концентрация меди в среде превышала 50 мкМ, то это влияло на общий метаболизм протеина и процент сАРР существенно возрастал (до 550%) (фиг.3в; таблица 1). В отличие от этого концентрация Аβ значительно снижалась, при концентрации меди 50 мкМ она составляла при этом лишь 20% от исходной концентрации, а при 100 мкМ концентрация Аβ была близка к пределу обнаружения в CUR3-клетках (фиг.3г, д). Это также было обнаружено и для р3.5 (фиг.3г), что подтверждает более раннее наблюдение того, что р3.5 представляет собой продукт альтернативного пути метаболизма с участием β-секретазы.
Пример 4: Стимуляция продуцирования Аβ-пептида с помощью образования комплекса ионов меди (I) с батокупроином, соответственно ионов меди (II) с пенициламином
Для проверки, можно ли осуществлять созданием дефицита меди модуляцию сАРР, sAPP и дальнейших продуктов разложения, проводили следующие эксперименты. Для исследования, необходима ли медь (II) для экспрессии и процессинга АРР, медь (II) удаляли с помощью образующего хелатный комплекс с медью (II) D-пеницилламина (PEN), а медь (I) - с помощью батокупроиндисульфоновой кислоты, образующей хелатный комплекс с медью (I), который не может проникать внутрь клетки. Было установлено, что это не влияет на продуцирование Аβ и р3.5, однако в то же время концентрация sAPP и р3 снижалась на 77%, соответственно на 50% (фиг.3г, д; таблица 1). Это свидетельствует о том, что индуцируемые медью (II) изменения основаны на специфической модуляции метаболизма АРР медью.
Пример 5: Исследование АРР751/770-изоформ, содержащих эндогенно экспрессируемый KPI, в CHO-Kl-клетках
Изоформы АРР751/770, содержащие эндогенно экспрессируемый KPI (ингибирующий протеазу домен типа Кунитца, который встраивают путем альтернативного сплайсинга в АРР751 и АРР770), исследовали в CHO-Kl-клетках путем иммунопреципитации протеинов, меченных с помощью [35S]метионина, в клеточном лизате и кондиционированных средах с использованием поликлональной антисыворотки 22734 к АРР (фиг.1; фиг.4а,б).
Высвобождение КР1-АРР соответствовало высвобождению c-myc-APP695 (фиг.4). Две основные полосы, которые относятся к относительным молекулярным массам 130 кДа и 105 кДа, соответствуют sAPP751/770, соответственно sAPP695. Последняя изоформа может быть также осаждена с помощью антисыворотки к с-mус. При инкубации CHO-Kl-клеток с возрастающими концентрациями меди существенно возрастают уровни АРР и р3 (АРР: сАРР на 295%, sAPP695 на 475% и sAPP751/770 на 275% при концентрации меди 10 мкМ, а р3 на 154% при концентрации меди 10 мкМ; фиг.4а-д; таблица 1). Одновременно резко уменьшается продуцирование Аβ до уровня ниже предела обнаружения (фиг.4г, д). В присутствии соединений, образующих хелатный комплекс с медью, секреция sAPP695 составляет 170% (фиг.4б, в), секреция sAPP751/770 составляет 190% (фиг.4 б, в; таблица 1), а секреция р3 составляет 171% (фиг.4г, д; таблица 1).
Кроме того, проводили количественную оценку относительных уровней sAPP695, р3 и Аβ, которые подвергали иммунопреципитации в кондиционированной среде, содержащей CHO-Kl-клетки (а) и CHO-CUR3-клетки (б). Результаты приведены на фиг.5. Увеличение уровня sAPP695 (черные ромбы) достигало в К1-клетках максимума при 10 мкМ Сu (II) (а), в CUR3-клетках - при 50 мкМ Сu (II) (б); после этого их уровень вновь начинал снижаться. Изменение уровня sAPP (незаштрихованные треугольники) по сравнению с изменениями уровня протеина р3, который достигает максимального значения при относительно низких концентрациях Сu(II), происходил позднее, что по всей вероятности обусловлено более продолжительным временем его полужизни по сравнению с sAPP. В отличие от этого уровни Аβ (черные квадраты) для обеих линий клеток резко снижались по сравнению с исходным уровнем по мере увеличения концентрации Сu (II). Первая точка на графике соответствует исходной концентрации меди (0,8 мкМ Сu (II)).
Пример 6: Выявление агонистов меди для АРР, обладающих ингибирующим действием на высвобождение амилоид-Аβ-пептида
Связывающий медь пептид АРР и APLP2 (протеин, гомологичный АРР, который, также как АРР и APLP1, принадлежит к семейству АРР-генов), APPN262 (искусственно созданная укороченная на С-конце форма АРР, которая состоит из 262 N-концевых остатков АРР) и другие искусственно созданные АРР-формы, которые последовательно укорачивают на несколько доменов на С-конце варианты АРР и APLP2, несущие сайты связывания меди, а также их фрагменты вводили в контакт с различными концентрациями Zn(II). Используемые концентрации Zn2+ составляли 10 мкМ, 50 мкМ, 100 мкМ и 200 мкМ. Затем исследовали, при каких концентрациях Zn (II) может происходить ингибирование высвобождения Аβ-пептида. Для этого проводили следующие опыты:
(1) СНО-клетки, стабильно трансфектированные человеческим АРР695, инкубировали в среде MEM с указанными выше концентрациями Zn (II) (от 10 до 200 мкМ в ЗФР). В качестве контролей также инкубировали СНО-клетки в присутствии ионов меди (от 10 до 50 мкМ в ЗФР) или без них. Продуцирование Аβ (общее), Аβ40 и Аβ42 оценивали качественно и количественно с использованием поликлональных и моноклональных антител. Выявление АРР, Аβ и р3 осуществляли после введения биосинтетическим путем метки, представляющей собой 35S-метионин, следующим образом. Стабильно трансфектированные СНО-клетки, которые инкубировали, как описано выше, с соответствующими субстанциями, инкубировали в течение 4 ч с 35S-метионином (радиоактивность 220 мкКи). Кондиционированную среду и клетки собирали и растворенные протеины подвергали иммунопреципитации. Перед этим с помощью набора для анализа протеина фирмы BioRad определяли концентрацию протеина и с помощью сцинтилляционного счетчика оценивали уровень включенной радиоактивности. Клетки лизировали в буфере для экстракции (50 мМ Трис-HCl, рН 7,5, 150 мМ NaCl, 2 мМ ЭДТК, 2% тритона Х-100, 2% NP40, 1 мМ ФМСФ, 10 мкг/мл апротинина и 10 мкг/мл лейпептина). Клеточный дебрис отделяли центрифугированием в течение 10 мин при 13000×g и состав супернатанта регулировали таким образом, чтобы он содержал 25 мМ Трис-HCl, рН 8,5, 1 мМ ФМСФ, 10 мкг/мл апротинина, 10 мкг/мл лейпептина, 0,5% тритона Х-100 и 0,5% NP40. Раствор протеинов разбавляли в соотношении 1:2 с помощью 100 мМ Трис-HCl, рН 7,5, 300 мМ NaCl и 4 мМ ЭДТК. Супернатанты инкубировали в течение ночи при 4°С с указанными выше поликлональными антителами к АРР и Аβ, образовавшиеся иммунные комплексы выделяли с помощью протеин-А-сефарозы и анализировали согласно методу, описанному у Ida и др., J. Biol. Chem., 271, с. 22908-22914.
Было обнаружено, что при концентрации Zn (II) от 50 мкМ и выше продуцирование Аβ может резко уменьшаться. При концентрациях Zn (II) свыше 50 мкМ наблюдалась пониженная секреция АРР в СНО-К1-клетках и CUR3-клетках, при этом при концентрации Zn (II), равной 50 мкМ, продуцирование Аβ в CUR3-клетках понижалось на 60% (К1: 20%), при концентрации Zn (II), равной 100 мкМ, - на 90% (К1: 30%) и при концентрации Zn (II), равной 200 мкМ, - на 99% (К1: 60%). При концентрации Zn (II) свыше 200 мкМ не имелось возможности оценить дальнейшее уменьшение продуцирования Аβ, поскольку был достигнут предел обнаружения.
(2) Из трансгенных мышей, клетки которых экспрессируют Аβ-пептид, имеющий человеческую последовательность, выделяли первичные нейроны и продуцирование в них А(оценивали согласно методу, описанному в (1).
(3) Трансгенным мышам (см. (2)) вводили перорально, внутривенно, внутрибрюшинно, подкожно и внутрикожно Zn (II) в ЗФР в указанных выше концентрациях и определяли согласно методу, описанному выше в (1), продуцирование Аβ в ЦНС и крови (которую брали из хвостовой вены). Полученную из хвостовой вены мышей сыворотку (150-200 мкл) разбавляли ЗФР-буфером до объема 500 мкл и инкубировали в течение ночи при 4°С на качалке с вращением пробирок относительно поперечной оси в присутствии 5 мкг моноклонального антитела WO-2 (Ida и др., см. выше) и 20 мкл суспензии (1:1) протеин-G-сефарозы. Затем образовавшийся супернатант инкубировали в присутствии поликлональных антител (22734/6) к АРР и имунные комплексы анализировали по методу, описанному выше в (1). Аβ-иммунные комплексы разделяли с помощью 12%-ного бистрицинсодержащего геля фирмы Novex согласно инструкциям производителя и анализировали область соответствующей молекулярной массы путем переноса протеинов на нитроцеллюлозный фильтр (380 мА при 4°С в течение 40 мин) в присутствии моноклонального антитела WO-2 с помощью ECL-метода, описанного у Ida и др., см. выше. В данном случае также было обнаружено, что при концентрации Zn (II) 50 мкМ может быть достигнуто уменьшение продуцирования Аβ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2007 |
|
RU2498999C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2013 |
|
RU2668161C2 |
| АНТИТЕЛА К Aβ-ПЕПТИДУ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2341533C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К АМИЛОИДУ БЕТА | 2008 |
|
RU2567151C2 |
| ПЕПТИД И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2018 |
|
RU2679080C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К β-АМИЛОИДНОМУ ПЕПТИДУ | 2008 |
|
RU2475500C2 |
| СПОСОБ IN VITRO-ДИАГНОСТИКИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА С ПОМОЩЬЮ МОНОКЛОНАЛЬНОГО АНТИТЕЛА | 2006 |
|
RU2416619C2 |
| МОДУЛЯТОР АГРЕГАЦИИ ПЕПТИДА β-АМИЛОИДА ДЛЯ ИНГИБИРОВАНИЯ АГРЕГАЦИИ ПЕПТИДОВ ПРИРОДНОГО β -АМИЛОИДА ИЛИ ДЛЯ ЛЕЧЕНИЯ СУБЪЕКТА ОТ НАРУШЕНИЯ, АССОЦИИРОВАННОГО С β -АМИЛОИДОЗОМ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ДЕТЕКЦИИ В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ ПЕПТИДОВ ПРИРОДНОГО β -АМИЛОИДА | 2000 |
|
RU2260599C2 |
| АНТИТЕЛА К БЕТА-АМИЛОИДУ | 2013 |
|
RU2651486C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |

Изобретение относится к области медицины и касается агониста меди, который связывается с сайтом связывания меди амилоидного протеина-предшественника (АРР) и/или оказывает ингибирующее действие на высвобождение амилоид Аβ-пептида. Указанные агонисты могут применяться для лечения болезни Альцгеймера. Описаны также способы выявления агонистов меди, которые связываются с сайтом связывания меди, посредством контактирования АРР с различными концентрациями этих агонистов и выявляют уменьшение уровня Аβ-пептида в клетках млекопитающих, которые экспрессируют амилоид-Аβ-пептид. Преимущество изобретения заключается в разработке новых средств, которые могут применяться для лечения болезни Альцгеймера. 3 н. и 5 з.п. ф-лы, 1 табл., 5 ил.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| HESSE L., BEHER D., MASTERS CL | |||
| et al | |||
| The beta АЧ amyloid precursor protein binding to copper | |||
| FEBS Letter, 1994, Jul, 25, 349(1), p | |||
| Шкив для канатной передачи | 1920 |
|
SU109A1 |
Авторы
Даты
2004-09-20—Публикация
2000-03-01—Подача