Область техники, к которой относится изобретение
Предлагаемое изобретение относится к медицине, точнее к получению биологически активной субстанции из сыворотки крови и может быть использовано при лечении широкого спектра заболеваний, в том числе для коррекции явлений паркинсонизма, слуха при его снижении и пространственной памяти, а также для повышения половой активности и физической работоспособности.
Уровень техники
Широко известны способы получения биологически активной сыворотки крови, основанные на взятии крови у доноров, инкубации, отделении с последующим консервированием. Способы предполагают получение иммунной сыворотки или получение сыворотки крови, действующей помимо иммунной системы, повышающей устойчивость организма к таким экзогенным и эндогенным факторам, как атмосферное давление, температура, сила тяжести, свет, а также голод, жажда, сонная и половая потребности и другим. - Патенты ЕР 0542303, RU 2096041, RU 2120301. В указанных известных технических решениях сыворотку получают от донора, предварительно введенного в определенное функциональное состояние, при этом в зависимости от характера воздействия получают сыворотки с биологической активностью различного характера: миогенной, сомногенной офтальмогенной, аудиоактивной, термоактивной, диетактивной, сексактивной, антигипоксической, антиалкогольной и антиникотиновой. Замечательной особенностью сывороток, раскрытых в цитируемых источниках является их абсолютная безвредность, нетоксичность, сыворотки не имеют, как отмечают авторы, противопоказаний к применению.
Относительным недостатком указанных сывороток является то, что пользователь, в том числе и лечащий врач, как правило, не знает, с какой конкретно субстанцией он работает, а следовательно, оказывается в затруднении при выборе того или иного курса коррекции состояния конкретного пациента.
Задачей настоящего изобретения было выделение биологически активной субстанции из сыворотки крови и разработка нового способа ее получения.
Другой задачей изобретения было расширение спектра источников, из которых может быть выделена активная субстанция и, тем самым, получение возможности удешевления конечного продукта.
Еще одной задачей изобретения было разработка лекарственных форм активной субстанции, применимых для практического использования.
Дополнительной задачей изобретения было установление интервалов доз активной субстанции, полезных для коррекции состояния пациента при патологических состояниях.
Кратное изложение сущности изобретения
Неожиданным оказалось, что обработка сыворотки крови гамма-лучами приводит к появлению в ней ранее отсутствующих биологически активных субстанций, оказывающих полезное действие на ряд функций организма пациента. Это тем более неожиданно, что до настоящего времени являлось общепринятым мнение, что ионизирующее облучение величиной 25 кило-Грей является стерилизующей дозой. Указанная доза рекомендуется для стерилизации медицинской продукции в Российской Федерации (Государственная фармакопея СССР // 1 изд. - М., Медицина. - 1990 г. - вып.2. - С.19-24). Одновременно было известно (Мартынов В.А. и др. Влияние лучевой стерилизации на физико-химические свойства кровоостанавливающей марли и биохимическую активность белковых препаратов // Радиационная медицина. - М., Атомиздат. - 1972 г. - С.123-125; Gergely J., et al. Studies of gamma-ray-irradiated human immunoglobulin G. // Radiosterilization of Medical Products, - 1967. - Vierma. - P.115-124), что кровь и ее препараты, а также лекарственные средства пептидной природы, радиочувствительны, неустойчивы и инактивируются под влиянием ионизирующего излучения. Все это вместе взятое не позволяло ожидать того результата, что получили авторы данного изобретения.
Оказалось, что, если венозную кровь животных (в частности, лошади) и человека, а также артериальную кровь птиц проинкубировать в течение примерно суток при низкой температуре, приблизительно 4-8°С, затем после ретракции сгустка и его отделения получить сыворотку, лиофилизировать ее и облучить в режиме от около 10 до около 30 кило-Грей, можно выделить биологически активную субстанцию, полезную при лечении ряда патологий. По данным масс-спектрометрии в результате обработки заявленным способом появляются фракции пептидов с молекулярным весом 2-4 кДа, которые ранее отсутствовали в нативной сыворотке, и происходит значительное повышение уровня пептидов с указанной молекулярной массой, содержащихся в нативной сыворотке.
Таким образом, целью настоящего изобретения является разработка способа получения биологически активной субстанции из сыворотки крови.
В другом аспекте своего выполнения изобретение направлено на новую биологически активную субстанцию, полученную из сыворотки крови ряда животных и птиц.
В предпочтительном аспекте осуществления изобретение направлено на субстанцию и ее получение из сыворотки крови лошади.
В еще одном аспекте осуществления изобретение направлено на субстанцию и способ ее получения из сыворотки крови птиц.
В другом аспекте осуществления изобретение направлено на субстанцию и способ ее получения из сыворотки человека.
Еще одной целью настоящего изобретения является разработка лекарственной формы новой биологически активной субстанции. Изобретение предполагает разные лекарственные формы, в том числе для перорального, парентерального, назального, буккального, в виде суппозитариев и т.п. введения.
В изобретении предусматривается использование подходящих физиологически приемлемых носителей, например дистиллированная вода, наполнителей, например масло какао. Биологически активная субстанция может применяться как самостоятельно, так и в сочетании с другими биологически активными средствами.
Дополнительной целью изобретения является фармацевтическая композиция, в которой активным началом является субстанция согласно настоящему изобретению. При этом фармацевтическая композиция должна содержать активный ингредиент в количестве, достаточном для оказания благоприятного воздействия на организм пациента, т.е. содержать его в эффективном количестве.
Еще одной целью изобретения является определение эффективной дозы активной субстанции согласно данному изобретению. Полагается, что эта доза находится в интервале от 0,15 до 1000 мг/кг веса пациента, преимущественно от 15 до 120 мг/кг. Очевидно, что конкретная доза будет определяться лечащим врачом в зависимости от состояния пациента, его возраста, веса и курса лечения.
Подробное раскрытие изобретения
Далее изобретение подробно раскрывается в предпочтительных вариантах конкретного выполнения, при этом приводимые примеры активных субстанций, способов их получения, фармацевтических композиций, лекарственных форм не должны стать основанием для ограничения притязаний, а предназначены исключительно лишь для демонстрации осуществимости изобретения и реализации указанных назначений. Каждый специалист в данной области безусловно убедится, что могут быть предложены многочисленные модификации приводимых вариантов выполнения изобретения, которые подпадают под притязания, отраженные далее в формуле изобретения.
1. Способ получения биологически активной субстанции сыворотки крови
Для получения сыворотки использовали кровь птиц, лошадей и человека. Кровь собирают из пунктируемых вен (лошади, человек) и артерий (птица). Кровь собирают в стеклянные флаконы и затем инкубируют при температуре при низкой температуре, предпочтительно при 4-8°С примерно в течение 18-24 часов, преимущественно 24 часа. После ретракции сгустка флаконы центрифугируют при 3000 об/мин примерно в течение 20-30 минут, сыворотку отделяют от сгустков крови и лиофилизируют в обычном режиме. Флаконы с лифилизированной сывороткой облучают на установке РЦ-100М (Биотехнология, Россия) в режиме 10, 20, 30 кило-Грей с использованием Со60. Полученную таким образом субстанцию хранят при 4-8°С.
2. Доказательства стимулирующего действия гамма-облучения на сыворотку птиц, лошадей и человека
2.1. Сыворотка птиц.
Эксперименты проводились на крысах линии WISTAR, самцах, массой 220-240 г. В первой серии экспериментов животные разделены на 6 групп по 20 крыс в каждой: 1 группа - крысам вводили физиологический раствор; 2 группа - крысам вводили не облученную сыворотку: 3 группа - крысам вводили сыворотку, облученную в режиме 10 кило-Грей. 4 группа - крысам вводили сыворотку, облученную в режиме 20 кило-Грей. 5 группа - крысам вводили сыворотку, облученную в режиме 30 кило-Грей.
Физиологический раствор, не облученную сыворотку и субстанцию вводили внутрибрюшинно в объеме 1 мл. Сыворотка и субстанция 1 растворялась в данном объеме в дозах 15, 60, 100 и 120 мг/кг массы крыс. Все вещества вводились за 30 минут до начала опытного тестирования. Предварительное тестирование проводилось за 48 часов до начала опытного тестирования.
Исследовалось влияние субстанции на физическую выносливость, определяемую по времени плавания животных с нагрузкой в виде прикрепленного на хвост груза, составляющего 10% от весы крыс. Для этого крысы помещались попарно в термостатический сосуд с водой, разделенный на 2 части. Температура воды была +25°С. Температура воздуха была +20°С.
Определялось время плавания животных до появления у них судорог и окончательного отказа от плавания и погружения на дно сосуда.
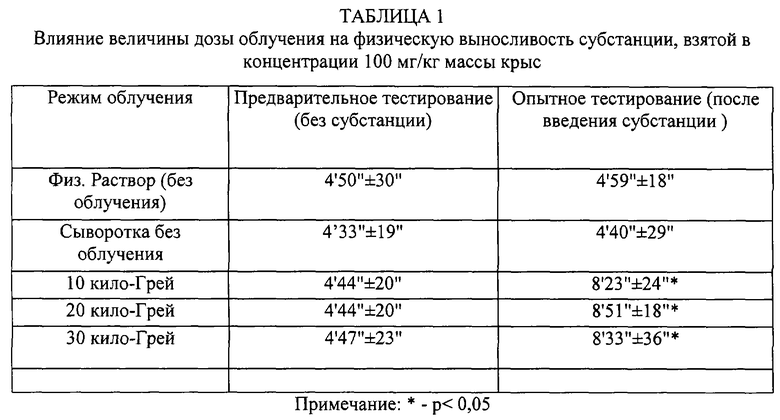
Как следует из таблицы 1, введение активной субстанции в дозе 100 мг/кг массы крыс при режиме облучения в 10 кило-Грей уже вызывает статистически достоверное увеличение физической выносливости животных. Исследование зависимости доза-эффект при различных режимах облучения (таблицы 2, 3, 4) показало, что статистически достоверный положительный эффект наблюдается начиная с дозы менее 15 мг/кг.
2.2. Сыворотка лошади
Эксперименты проводились по технологии раскрытой в пункте 2.1, за исключением режима гамма-облучения. Радиационная обработка осуществлялась в режиме 20 кило-Грей. Сыворотка не облученная и субстанция применялись внутрибрюшинно в дозе 100 мг/кг массе крыс.
2.3. Сыворотка человека
Эксперименты проводились по технологии, раскрытой в пункте 2. 1. Сыворотка без облучения и субстанция применялись в дозе 100 мг/кг массы крыс.
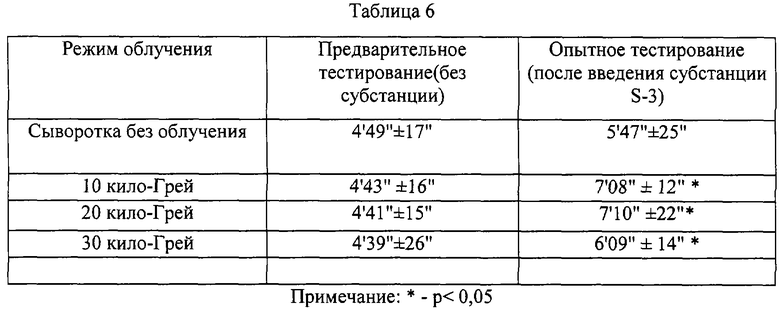
Данные таблиц 5 и 6 позволяют определенно утверждать наличие положительного эффекта от введения субстанций крови лошади и человека на физическую выносливость крыс, как и в случае субстанции птиц.
2.4. Стимуляция пролиферации эмбриональных клеток мозга человека субстанцией птиц
Средства и реактивы. Ростовая среда: среда Игла модифицированная Дульбекко (DMEM) или RPMI-1640 (Gribco, Grand Island), 10% эмбриональной сыворотки коров (Sigma, USA). Маточный раствор субстанции S-1 20,0 мг/мл приготавливается растворением в DMEM и вносят в различных концентрациях в -ростовую среду или среду эксперимента с клетками на 96-луночный культурный планшет.
Среда эксперимента. Игла модифицированного Дульбекко, содержащая 0,58 г/л глютамина, 50 мкг/л гентамицина и 0,2% бычьего сывороточного альбумина.
Извлечение органов. Эмбрион 10-12 недель гистации, извлеченный кюреткой обычной процедурой аборта, помещается в стерильную емкость с раствором Хэнкса, содержащей 200 мкг/мл гентамицина, емкость закрывается, помещается в холодильник и хранится на +4°С не более 24 часов. Эмбрион, хранившийся при +4°С в емкости с жидкостью, вынимают и помещают на чашку Петри в ламинарном шкафу, предварительно обработанному ультрафиолетовым облучением в течение 60 мин. Используют инструменты, стерилизованные либо кипячением, либо обработкой 70% этиловым спиртом. Мозг помещают в стерильную пробирку с охлажденным до +4°С гибернационным раствором (270 мМ КН2РО, 975 мМ D-сорбитол, 25 мМ D-глюкозы, 100 мМ лактат натрия, 100 мкг/мл гентамицин). Пробирку с органом хранят в холодильнике при +4°C до следующего этапа обработки не более 8-9 часов.
Выделение клеток мозга. Мозг в пробирке ресуспензируется пипетированием и грубую суспензию выливают на нейлоновое сито с порами 80-100 мкм, через которое протирают пестиком или плунжером от шприца на 10 мл с постоянной промывкой сита гибернационным раствором. Суспензию центрифугируют при +4°С, 1500 об/мин, 5 мин и ресуспензируют в гибернационном растворе. Подсчитывают количество живых клеток по исключению Трипановым синим. Суспензию центрифугируют при +4°С, 1500 об/мин, 5 мин и ресуспензируют в среде для культивирования (DMEM + 10% эмбриональной сыворотки коров + 10,0 мкг/мл гентамицина) в концентрации 3.10 кл/мл. Суспензию вносят по 100 мкл в лунки 96-луночного культурального планшета, предварительно покрытого коллагеном. Культуральный планшет помещают в СО2-инкубатор при 37°С, 5% CO2 и 90% влажности на 24 часа. Через 24 часа в лунки 96-луночного культурального планшета добавляют по 100 мкл среды для культивирования.
Измерение митохондриального дыхания по методу Мосмана и Монкса. В 96-луночный культуральный планшет вносят анализируемые клетки в ростовой среде и к ним добавляют 50 мкл 1 мг/мл раствора МТТ в ЗФР до конечной концентрации 200 мкг/мл. Через 2-4 часа, в зависимости от активности митохондриального дыхания анализируемых клеток, на дне лунок образуются фиолетовые не растворимые в воде кристаллы. 96-луночный культуральный планшет с выпавшими кристаллами центрифугируют 10 мин при 1500 об/мин, надосадочную жидкость аккуратно удаляют отсасыванием и вносят 200 мкл ДМСО для растворения кристаллов и образования окрашенного раствора. Значения оптической плотности снимают при длине волны 540 нм, что служит показателем активности митохондриального дыхания клеток.
Условия эксперимента. Клеточную культуру выращивают на ростовой среде при 37°С в СО2 - инкубаторе, атмосфере с 5% СО2 и 95% влажности. При постановке эксперимента суспензию клеток сливают в центрифужные пробирки, центрифугируют 5 мин при 1500 об/мин в бакет-роторе, надосадочную жидкость сливают, а осадок клеток ресуспензируют пипетированием в среде эксперимента. Затем клеточную суспензию раскапывают по лункам 96-луночного культурального планшета, в которые перед этим добавляют анализируемое вещество в нужных концентрациях. Инкубируют культуральные планшеты 24-48-72 часа или более в объеме 200 мкл/лунку. К клеткам добавляют раствор МТТ (3-(4,5-диметилтиазол-2-ел)-2,5-дифенилтетра золиум бромид; тиазолил голубой) по методу Мосмана, для измерения митохондриального дыхания. При прямом подсчитывании количества клеток с окрашиванием трипановым синим ошибка счета составляет +/-10-15%, в то время как определение митохондриального дыхания имеет разброс +/-1,5-2,0%. Поэтому за показатель количества клеток в пробе обычно принимают количественную оценку уровня митохондриального дыхания, что более точно измеряется. Для достоверного измерения промеры проводятся по 3-4 лункам на каждую точку измерения.
Результаты исследований.
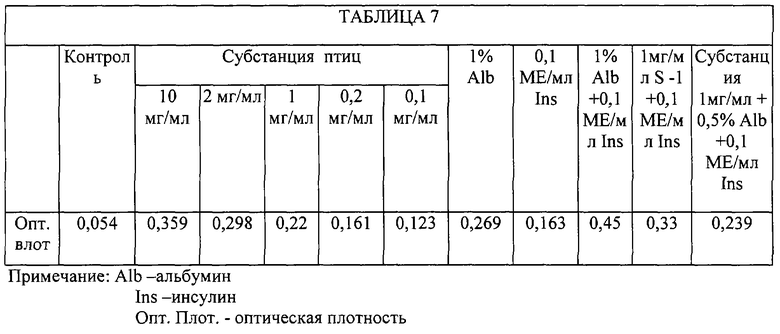
Во всех испытанных концентрациях биологически активной субстанции птиц (0,1-10,0 мг/мл) стимулировали пролиферативную активность сложной системы эмбриональных клеток мозга человека (Таблица 7). Стимулирующий эффект субстанции в концентрации 0,2 мг/мл был сопоставим со стимулирующим эффектом 0, 1 МЕ/мл инсулина, а в концентрации 1,0 мг/мл - близок с эффектом 1% раствора альбумина.
Такая реакция эмбриональных клеток мозга человека на воздействие субстанции свидетельствует о том, что на данном этапе цитогенеза клеток мозга субстанция выступает в качестве трофического фактора. Причем цитоморфологическая характеристика исследуемой ткани указывает на преимущественную чувствительность астроцитарных клеток к этому воздействию.
Вместе с тем, анализ комбинаторного воздействия субстанции с альбумином и инсулином свидетельствует о том, что у данных веществ существуют конкурентные взаимоотношения с клеточными рецепторами, поскольку совместное воздействие всех трех препаратов в концентрациях, оптимальных при раздельном использовании, не дает ожидаемого эффекта.
Более того, совместное использование 1,0 мг/мл субстанции и 0,1 МЕ/мл инсулина вызывает более выраженную пролиферацию, чем добавление к этой смеси 0,5% раствора альбумина.
Эти данные указывают на то, что субстанция птиц оказывает существенное влияние на рост и жизнедеятельность клеток, вероятно, воздействуя на регуляторные и трофические механизмы. При этом в качестве трофических агентов пептидные компоненты субстанции могут быть использованы в качестве составляющих аминокислот (как и аминокислоты альбумина), в то время как регуляторные эффекты могут быть реализованы на уровнях рецепторов внешних клеточных мембран и митохондрий, воздействуя на энергетический обмен.
Методика приготовления образцов для масс-спектрометрии
Сухую навеску образцов растворяли в 0,1% трифторуксусной кислоте (TFA) в концентрации 10 мг/мл, центрифугировали при 13000 об/мин в течение 10 мин (радиус ротора 20 см).
Экстракт пропускали через обращенно-фазовую колонку с 1 мл LiChrosorb С18( 10 мкм). Далее следовала ступенчатая элюция по 1 мл последовательно: 10%, 30%, 80%, 100% ацетонитрилом (AN), содержащим 0,1% TFA. Полученные фракции подвергали масс-спектрометрическому анализу методом MALDI TOF.
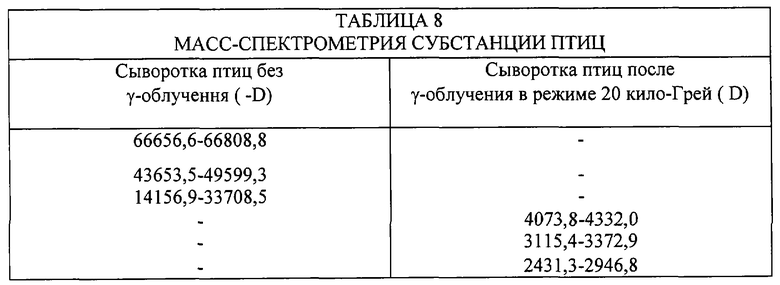
После γ-облучения в сыворотке птиц отчетливо выявляется повышенный уровень низкомолекулярных пептидов.
Различия основных пиков масс-спектриметрии сыворотки птиц до и после γ’-облучения представлены в таблице 8.
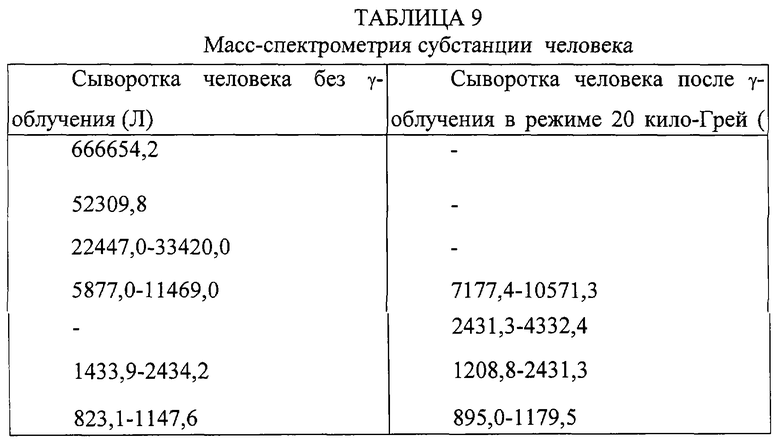
В образце сыворотки человека до γ-облучения в заметном количестве присутствуют белки с молекулярной массой 33.4, 52. 3. 66.6 кДа - по-видимому, первый и последний из них соответствует не сорбировавшемуся на колонку альбумину. После облучения эти пики отсутствуют.
Значительные различия наблюдаются и в диапазоне молекулярных масс от 2,0 до 4.0 кДа, когда после облучения отчетливо выявляются низкомолекулярные пептиды.
Особенности масс-спектрометрии субстанции человека представлены в таблице 9.
ТЕРАПЕВТИЧЕСКОЕ ДЕЙСТВИЕ СУБСТАНЦИИ ПТИЦ
А. ПРОСТРАНСТВЕННАЯ ПАМЯТЬ
В эксперименте использовали крыс линии Wistar, самцы массой 220-240 мг.
Субстанция вводится внутрибрюшинно в дозе 100 мг/кг массы животных за 30 минут до начала тестирования.
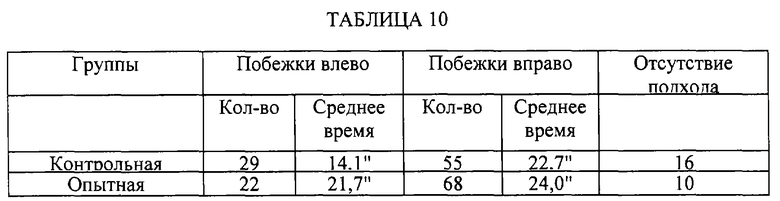
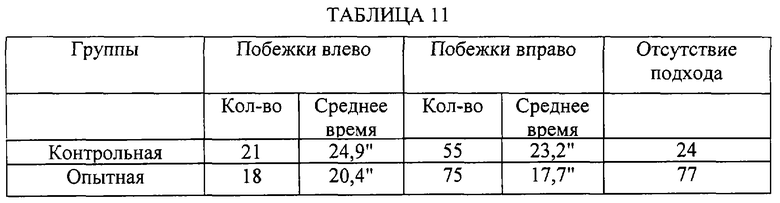
Исследовалось действие субстанции на пространственную память в Т-образном лабиринте. За 2 дня до тестирования проводилось приучение крыс к лабиринту - животные помещались в лабиринт и имели возможность обследовать его в течение 3 минут. Ни одна из крыс не выказала резкого предпочтения какой-либо из сторон. Крысы не получали еды в течение 1,5 суток до эксперимента, вода имелась по потребности. В эксперименте использована простая схема - корм всегда находился справа. Крыса помещалась в стартовый отсек в течение 1 минуты регистрировались перемещения по лабиринту. Возвращение в стартовый отсек было возможным. В опыте проводилось 10 предъявлений. Через 2 суток проводилось повторное тестирование.
Из исследованных 20 крыс (10 контрольных и 10 опытных) у 10 крыс наблюдалась первая побежка в левую сторону, а у 10 - в правую. Впоследствии побежки распределялись следующим образом (Таблица 10).
Критерия "3" правильных подхода подряд" во время повторного тестирования достигали 8 из 10 контрольных крыс и все 10 опытных.
Таким образом, можно говорить о стимулирующем действии субстанции S-1 на выработку и сохранность пространственного навыка в Т-образном лабиринте, то есть пространственной памяти.
КОРРЕКЦИЯ ЯВЛЕНИЙ ПАРКИНСОНИЗМА
Эффективность биологически активной субстанции оценивалась на экспериментальной модели Паркинсона. Для моделирования болезни Паркинсона применялся нейротоксин 6-гидроксидофамин (6-ГД), деструктурирующий катехоламинергические терминали.
6-ГД (6-Hedroxydopamin, 6-HODA) - 10 мкг в объеме 10 мкл стериотаксически по координатам атласа мозга крысы Фифковой, Маршал вводили в течение 10 мин в компактную часть черной субстанции (SN). 6-ГД растворяли в физиологическом растворе, содержащем 1% аскорбиновой кислоты. Вводимый раствор доводили до рН 7 раствором бикарбоната натрия. Аппликация вещества осуществлялась под эфирным наркозом дважды по одному разу в сутки для получения устойчивых поведенческих эффектов.
В опыте использованы крысы-самцы линии Wistar массой 250-300 г. Наблюдения осуществляли в течение 17 дней с момента первой инъекции. Все животные были разделены на 2 группы, по 20 крыс в каждой. Животным первой группы через 1 час после второй аппликации 6-ГД вводили внутрибрюшинно субстанцию, растворенную в дистиллированной воде для инъекций в дозе 100 мг/кг. Животным контрольной (2-й) группы вводился 1 мл дистиллированной воды, содержащей 100 мг/кг обычно (не облученной) сыворотки.
Симптомы болезни Паркинсона: тремор, пилоэрекция, инсилатеральные циркуляторные вращательные движения, оценивались экспертным методом. Эти эффекты обнаруживаются на протяжении 3-х суток после последней аппликации раствора 6-ГД у животных контрольной группы. Кроме того, описанные эффекты провоцируются насильственно (тактильное воздействие) на животных еще на протяжении 12-14 суток.
Введение субстанции существенно изменяло проявления болезни Паркинсона. Положительное влияние субстанции на признаки Паркинсона представлены в таблице 12.
ТЕРАПЕВТИЧЕСКАЯ АКТИВНОСТЬ СУБСТАНЦИИ ЛОШАДИ
В экспериментах использовались крысы линии "Вистар": половозрелые самцы и самки весом 220-240 г.
Внутрибрюшинное введение субстанции
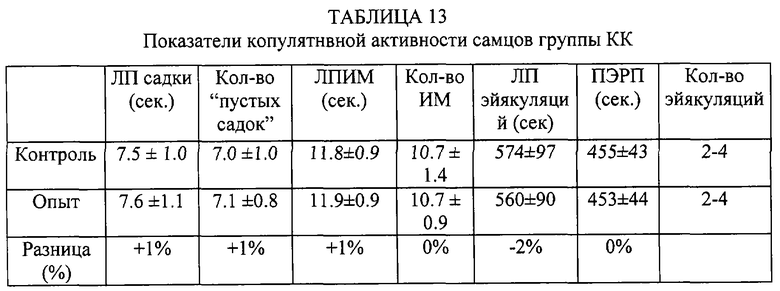
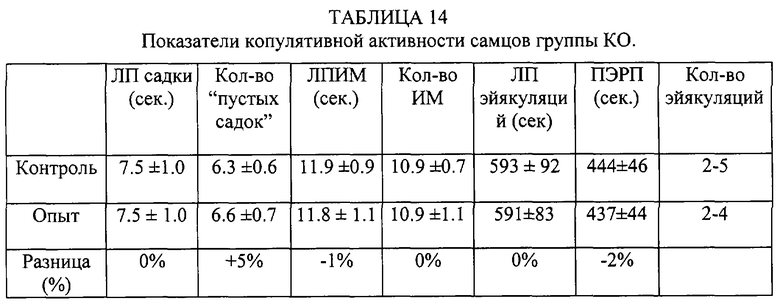
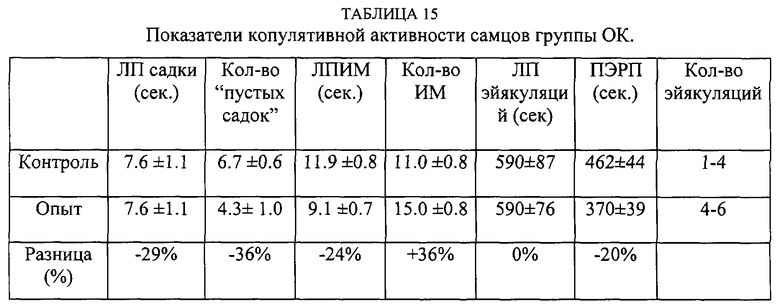
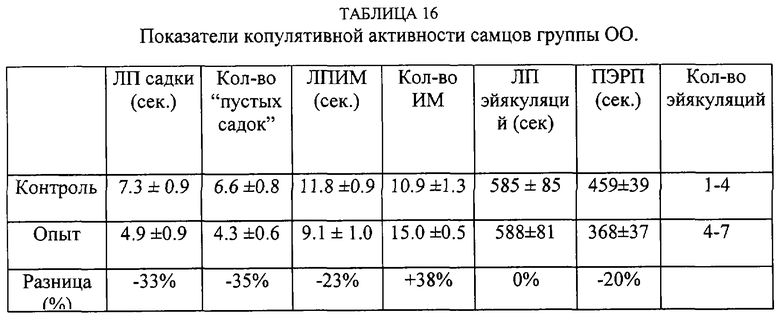
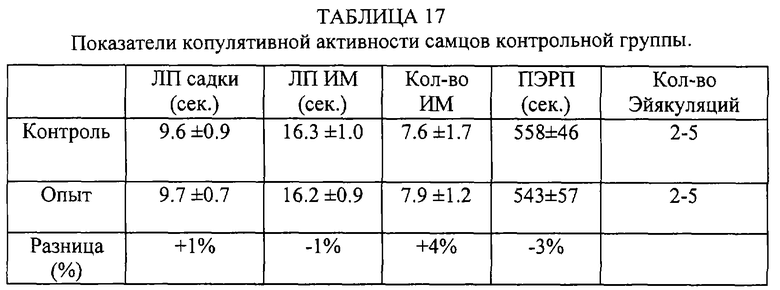
Самцы были разделены на 4 группы по 10 крыс. Из комбинации этих групп сформированы 4 группы - КК (контрольные самцы и контрольные самки), КО (контрольные самцы и опытные самки), ОК (опытные самцы и контрольные самки), 00 (опытные самцы и самки). Вначале проводилось предварительное тестирование. После этого самцам предоставляли 15 дней отдыха. Самки вторично не использовались. Субстанцию вводили за 30 минут до начала опытного тестирования. Контрольным особям вводился 1 мл обычной сыворотки лошадей.
Самца помещали на 15 минут в отдельную клетку, после чего подсаживали к нему самку, находящуюся в состоянии эструса (определялось по состоянию внешних половых органов).
В эксперименте регистрировались следующие показатели:
- латентный период первой садки (ЛП садки),
- латетный период первой интромиссии (ЛПИМ),
- количество интромиссии (Кол-во ИМ),
- количество садок без интромиссии (Кол-во "пустых садок"),
- латентный период эйякуляции (ЛП эйякуляции),
- постэйякуляционный рефракторный период (ПЭРП),
- количество эйякуляции в опыте (Кол-во эйякуляции).
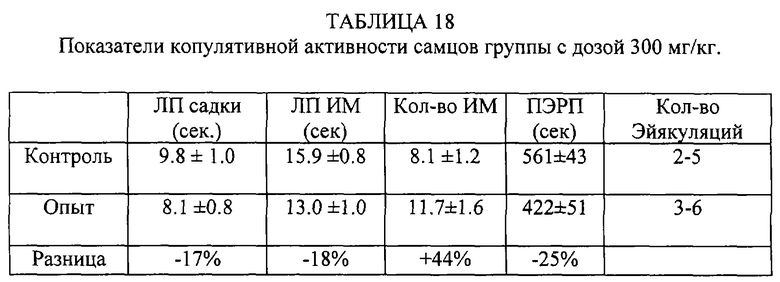
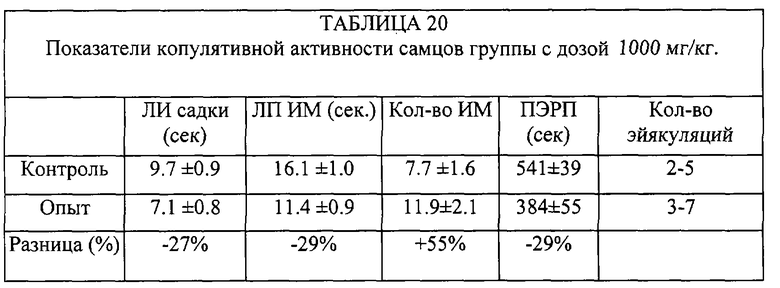
Таким образом, внутрибрюшинное введение субстанции жеребцов самке практически не влияет на копулятивную активность самца, а введение субстанции самцу увеличивает количество интромиссий, количество эйякуляций в опыте, сокращает постэйякуляционный рефракторный период.
Внутрижелудочное введение субстанции
Самцы были разделены на 4 группы по 10 крыс. Вначале проводилось предварительное тестирование (контроль). После этого самцам предоставляли 15 дней отдыха.
Самки вторично не использовались. Субстанция вводилась за 60 минут до начала опытного тестирования. Использованы следующие дозы: 300 мг/кг, 500 мг/кг, 1000 мг/кг. Контрольным особям вводилось 2 мл физраствора.
Самца помещали на 15 минут в отдельную клетку, после чего подсаживали к нему самку, находящуюся в состоянии эструса (определялось по состоянию внешних половых органов).
В эксперименте регистрировались следующие показатели:
- латентный период первой садки (ЛП садки),
- латетный период первой интромиссий (ЛПИМ),
- количество интромиссий (Кол-во ИМ),
- постэйякуляционный рефракторный период (ПЭРП),
- количество эйякуляций в опыте (Кол-во эйякуляций).
Таким образом, внутрижелудочковое введение субстанции увеличивает количество интромиссий, количество эйякуляций в опыте, сокращает латентный период садок и интромиссий, а также ПЭРП.
Заключение. Субстанция стимулирует половую активность экспериментальных крыс - самцов. Данная субстанция не влияет на половую активность самок.
ТЕРАПЕВТИЧЕСКАЯ АКТИВНОСТЬ СУБСТАНЦИИ ЧЕЛОВЕКА
В эксперименте использованы крысы Wistar, самцы весом 240-260 г.
Крысы помещались по одной в экспериментальные камеры "shuttle-box", разделенные пополам перегородкой. Имеющийся звукогенератор давал возможность предъявления звукового раздражителя с частотой 7 кГц и мощностью от 1 до 10 ДБ.
84 крысы были представлены в камерах в течение 10 опытов по 20 предъявлении в каждом. В каждом предъявлении включался звуковой раздражитель мощностью 2 дБ и длительностью 5 сек. Продолжительность одного предъявления - 30 с, продолжительность опыта - 10 минут.
Контрольным крысам (43 крысы) в течение 5 дней вводилась по 1 мл обычная донорская сыворотка, а опытным (42 крысы) в течение 5 дней ежедневно вводился стрептомицин (стрептомицина сульфат производства Киевского завода медпрепаратов), растворенный в воде для инъекций, в дозе 400000 ед. на 1 кг веса животного.
После тестирования опытной группе крыс с нарушением слуха внутрибрюшинно вводили субстанцию (облучение в режиме 20 кило-Грей) в дозе 10 мг/100 г массы животных. Реакцию на звуковой раздражитель мощностью в 2,0 дБ оценивали через 30 мин после введения субстанции. Результаты представлены в таблице 21.
Таким образом, субстанция оказывает коррегирующее действие на снижение слуха, вызванное применением стрептомицина в эксперименте.







Изобретение относится к медицине и может быть использовано для получения биологически активной субстанции из сыворотки крови животных и птиц, полезной для лечения или коррекции расстройств слуха, половой активности, пространственной памяти; а также для повышения физической выносливости, стимуляции пролиферации эмбриональных клеток мозга; полезной при болезни Паркинсона. Активная субстанция представляет собой фракцию относительно низкомолекулярных пептидов (М.м. 2-4 тыс.дальтон), получаемую путем обработки (in vitro) крови рентгеновским излучением, с последующим отделением целевого продукта. Технический результат: способ обеспечивает получение биологически активной субстанции, полезной при лечении широкого спектра заболеваний. 9 н. и 20 з.п. ф-лы, 21 табл.
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ СЫВОРОТКИ КРОВИ | 1996 |
|
RU2120301C1 |
| Ротор синхронной электрической машины | 1974 |
|
SU542303A1 |
| СПОСОБ ОБЛУЧЕНИЯ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ, В ЧАСТНОСТИ КРОВИ И ЕЕ КОМПОНЕНТОВ | 1994 |
|
RU2097072C1 |
| Способ получения эмбриональной сыворотки крови | 1981 |
|
SU1015894A1 |
| RU 97119627 А, 27.08.1999 | |||
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ МЕНЬЕРА | 1996 |
|
RU2104044C1 |
| ЖАРОПРОЧНЫЙ СПЛАВ НА ОСНОВЕ НИКЕЛЯ | 1997 |
|
RU2130088C1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
2004-09-20—Публикация
2000-02-29—Подача