Изобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано для моделирования острого деструктивного панкреатита у крыс.
Близким решением является способ моделирования, разработанный Aho HJ, Koskensalo SM, и Nevalainen TJ, описанный в статье Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol 15: 411-416, 1980. Который заключается в трансдуоденальной катетеризации общего желчного протока и введение таурохолата натрия (0,4 мл 4% раствора) в общий желчный проток и протоки поджелудочной железы.
При использовании данного способа моделирования острого деструктивного панкреатита патогенетические механизмы, лежащие в основе большого количества летальных исходов, отличаются от таковых при развитии острого панкреатита в клинике. Так, таурохолат, являясь гемолитическим ядом, при применении в вышеуказанных концентрациях вызывает внутрисосудистый гемолиз. Другим отрицательным свойством данной модели является невозможность влияния на площадь панкреонекроза. Немаловажным фактором, влияющим на интрапанкреатическую активацию ферментов поджелудочной железы, является уровень рН в ее протоковой системе, что никак не учитывается в данной модели.
Задачей изобретения является разработка модели острого панкреатита, наиболее оптимально соответствующей патогенетическим механизмам, имеющим место при развитии острого панкреатита у человека, позволяющей регулировать площадь панкреонекроза, а также снижение летальности, обусловленной гемолитическим действием вводимого в протоки раствора.
Поставленная задача решаются тем, что для моделирования острого деструктивного панкреатита вместо раствора таурохолата натрия мы используем трансдуоденальное внутрипротоковое введение специальной буферной системы, содержащей соль желчной кислоты при оптимальной для интрапанкреатической активации ферментов рН. Для возможности управления площадью панкреонекроза мы используем различное наложение (дистальнее или проксимальнее места впадения добавочного протока поджелудочной железы в общий желчный проток) лигатуры, что обеспечивает развитие тотального или субтотального панкреонекроза.
Изобретение поясняется фигурами:
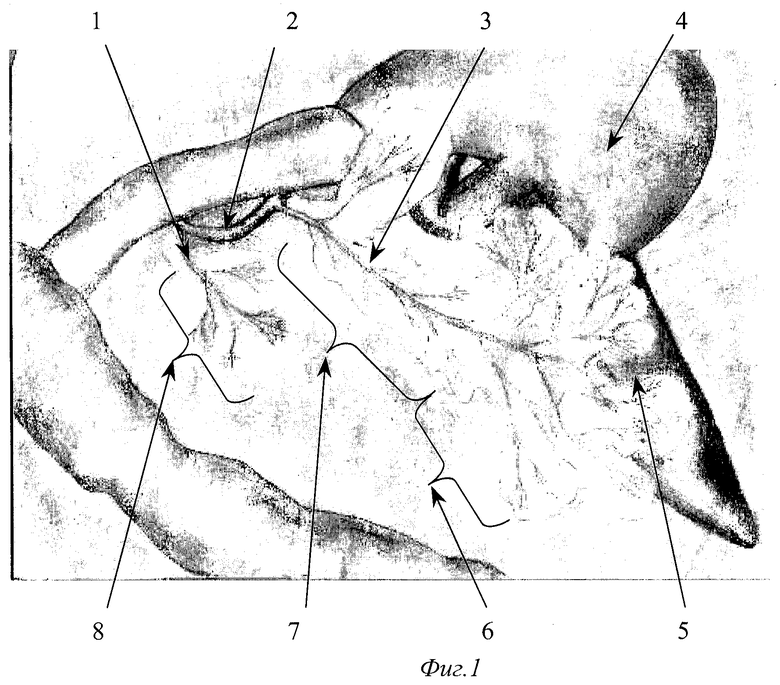
- на фиг.1 изображено строение протоковой системы крысы (1);
- на фиг.2 изображено строение протоковой системы крысы (2);
- на фиг.3 изображен первый этап моделирования (срединная лапаротомия);
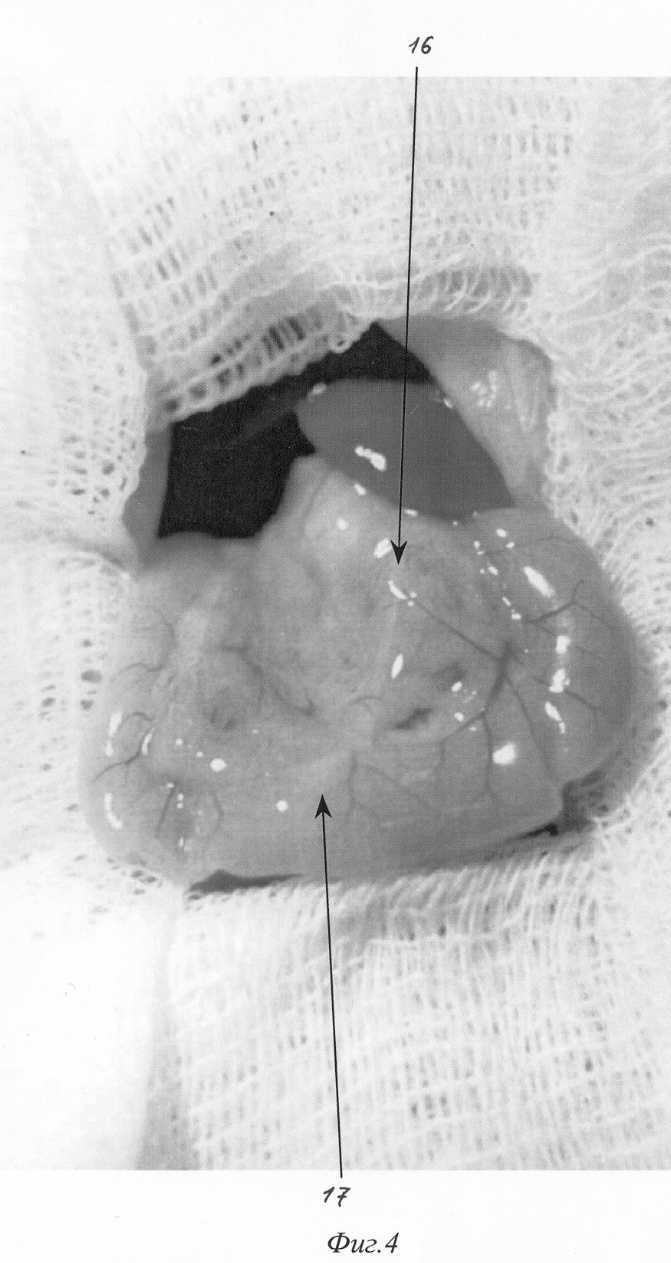
- на фиг.4 изображен второй этап моделирования (выведение органов в рану);
- на фиг.5 изображен третий этап моделирования (пункция двенадцатиперстной кишки и катетеризация общего желчного протока);
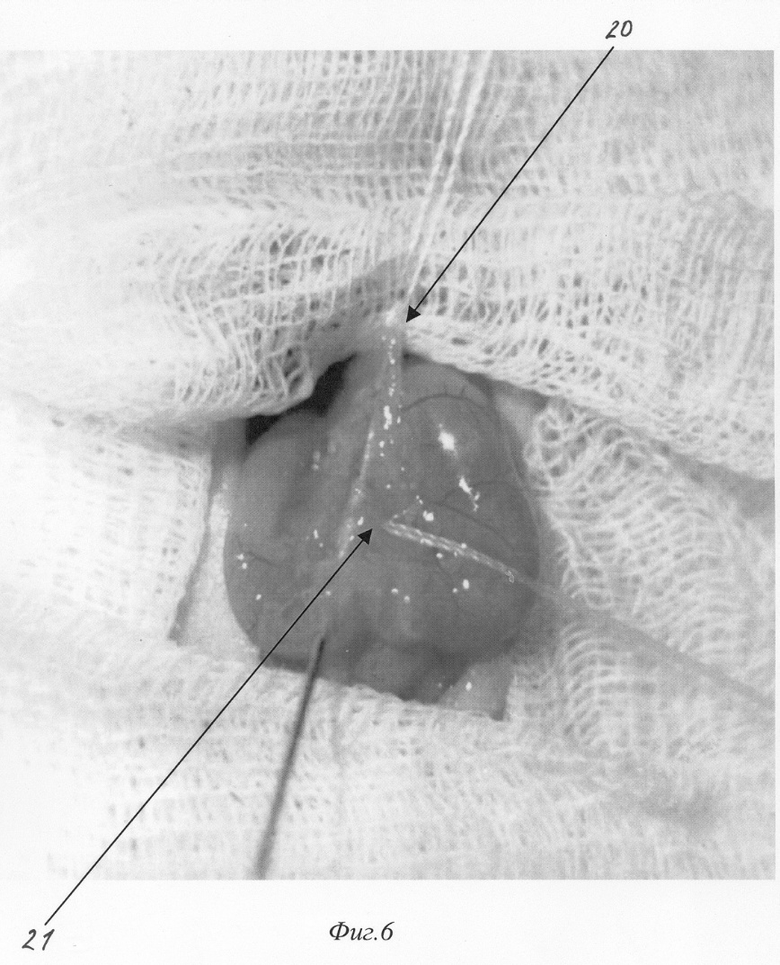
- на фиг.6 изображен пример наложения турникетов для воспроизведения субтотального панкреонекроза;
- на фиг.7 изображен пример наложения турникетов для воспроизведения тотального панкреонекроза;
- на фиг.8 изображен пятый этап моделирования - ушивание лапаротомной раны.
Способ осуществляется следующим образом.
Операция проводится с соблюдением правил асептики и антисептики под эфирным наркозом. После обработки операционного поля послойно вскрывается брюшная полость (верхнесрединная лапаротомия) на протяжении 2-3 см (фиг.3). Операционное поле отгораживается стерильными салфетками.
При вскрытии брюшной полости в рану выводится петля двенадцатиперстной кишки (фиг.2. 12, фиг 4). В гепатодуоденальной связке определяется общий желчный проток крысы диаметром 0,3-0,5 мм (фиг.2. 11, фиг.4. 16 ). На расстоянии приблизительно 1,5 см от ворот печени (фиг.2. 10) в общий желчный проток по задней поверхности впадает главный панкреатический проток (фиг.2. 9), который собирает секрет от желудочной и селезеночной частей поджелудочной железы и имеет диаметр приблизительно около 0,2-0,3 мм, что лучше видно при рассечении связки аналоги lig. gastrocolicum и отведении желудка кверху (фиг.1). При этом мы увидим дистальную часть общего желчного протока (фиг.1. 2), впадающий в него главный панкреатический проток (фиг.1. 3), желудочную часть поджелудочной железы (фиг.1. 7), прилежащую к задней стенке желудка (фиг.1. 4), и селезеночную часть поджелудочной железы (фиг.1. 6), прилежащую к воротам селезенки (фиг.1. 5). Также при этом доступе можно увидеть и дуоденальную часть поджелудочной железы (фиг.1. 8), дренирующуюся дополнительным протоком (фиг.1. 1), который впадает в общий желчный проток по задней его поверхности на расстоянии около 0,5 см от места вхождения общего желчного протока в стенку двенадцатиперстной кишки. Место впадения дополнительного панкреатического протока в общий желчный проток можно увидеть и при выведении ДПК, как это показано на фиг.2. 19. Интрамуральный отдел общего желчного протока (фиг.2. 14) открывается в просвет ДПК, что можно увидеть через стенку кишки (фиг.2. 14, фиг.4. 17). Найдя место впадения общего желчного протока от него отступают около 0,5 см в этом месте производят пункцию двенадцатиперстной кишки зондом, диаметром 0,3 мм (фиг.5. 19), который через большой дуоденальный сосочек проводится в общий желчный проток до середины расстояния между местами впадения панкреатических протоков (фиг.5. 19). После этого на общий желчный проток накладывается два турникета. Один выше места впадения основного панкреатического протока (фиг.6. 20, фиг.7. 22), второй, в зависимости от того, какую форму панкреатита необходимо воспроизвести (тотальную или субтотальную), выше (фиг.6. 21) или ниже (фиг.7. 23) места впадения добавочного протока поджелудочной железы. Турникеты затягивают. В проток при помощи насоса для микроинфузий вводят 0,3 мл буфера (содержащего 0,3 г трис-гидроксиметил-аминометана и 0,6 г дезоксихолата натрия в 100 мл при рН 8,8) при скорости потока 0,07 мл в минуту. Турникеты с протоков снимают спустя минуту после прекращения введения буфера и удаляют катетер из протока.
После создания модели органы погружаются в брюшную полость. Убираются отгораживающие салфетки. Брюшная полость послойно ушивается отдельными шелковыми швами (фиг.8). Рана обрабатывается раствором антисептика.
Пример конкретного применения.
Исследование проведено на 100 самках крыс линии Вистар массой 200 г. С целью подтверждения наличия острого деструктивного панкреатита производилось морфологическое исследование образцов поджелудочной железы на сроке 12 часов (как наиболее информативного срока). Образцы поджелудочной железы забирались, фиксировались в 10% растворе нормального формалина, обезвоживались, заливались в парафин, готовились парафиновые срезы, которые затем окрашивались гематоксилин-эозином. Также производилось исследование активности амилазы в сыворотке крови и перитонеальном экссудате амилокластическим методом со стойким крахмальным субстратом по Каравею. Кроме этого оценивалась летальность за первые сутки с момента моделирования. Полученные данные сравнивали с данным контрольной группы (интактные животные).
Так, нормальные значения активности амилазы, вычисленные для нашей лаборатории, - 61,76 г/ч/л.
После моделирования острого панкреатита описанным выше методом через 12 часов с момента моделирования активность амилазы сыворотки крови при тотальном панкреонекрозе достигает уровня 144,77±3,2 г/ч/л (р<0,01), а перитонеального экссудата 1237,36±7,4 г/ч/л (р<0,01) г/ч/л, при субтотальном панкреонекрозе 160,56±4,3 г/ч/л (р<0,01) и 1548,21±8,3 г/ч/л (р<0,01) - соответственно.
При морфологическом исследовании получены следующие результаты:
Макроскопическая картина при вскрытии брюшной полости и грудной клетки крысы после моделирования тотального панкреонекроза.
При вскрытии в брюшной полости до 5 мл серозно-геморрагического выпота во всех отделах, гиперемия париетальной и висцеральной брюшины брыжейка тонкой кишки отечна, с множественными мелкими очагами стеатонекроза.
Печень не увеличена, темно-вишневого цвета, поверхность ее гладкая, края долей заострены. Почки без видимой макроскопической патологии. Селезенка умеренно увеличена в размерах, темно-вишневого цвета. При вскрытии просвета желудка и ДПК определяются множественные мелкие (точечные) эрозии шоколадного цвета.
Поджелудочная железа резко отечна с участками стеатонекроза размерами от 0,3 до 0,5 см в диаметре. В области желудочно-дуоденальной части имеются участки геморрагического панкреонекроза размерами до 0,3 см в диаметре. Отмечается отек забрюшинной клетчатки.
При вскрытии грудной клетки определяется гиперемия плевры и небольшое количества светлого выпота. Поверхность легких гладкая, буроватого цвета с множественными точечными кровоизлияниями. Сердце без видимых макроскопических изменений.
Морфологическое исследование поджелудочной железы (окраска гематоксилин-эозином увеличение 20×15) при моделировании субтотального панкреонекроза.
В дуоденальной части определяется зона тотального некроза с участками геморрагии, массивной нейтрофильно-макрофагальной инфильтрацией. Структура ацинусов не сохранена.
В желудочной части имеет место крупноочаговый панкреонекроз с единичными участками геморрагии, клеточными структурами разрушенных панкреатоцитов, нейтрофильно-макрофагальной инфильтрацией. В зонах, удаленных от очагов некроза, структура ацинусов сохранена. В участках, примыкающих к зонам некроза, панкреатоциты имеют вакуолизированную цитоплазму, ядра неправильной формы.
В селезеночной части определяются множественные центролобулярные некрозы. Имеется значительное количество ацинусов с сохраненной структурой, встречаются интактные островки Лангерганса.
Макроскопическая картина при вскрытии брюшной полости и грудной клетки крысы после моделирования субтотального панкреонекроза.
При вскрытии брюшной полости определяется до 3-4 мл серозно-геморрагического выпота. Париетальная и висцеральная брюшина гиперемирована во всех отделах. Брыжейка тонкой кишки отечна, с умеренным количеством мелких очагов стеатонекроза. Печень не увеличена, темно-вишневого цвета, поверхность ее гладкая, края долей заострены. На разрезе структура паренхемы не изменена, сосуды полнокровны. Селезенка умеренно увеличена в размерах, темно-вишневого цвета. Почки увеличены серовато-бурого цвета, на разрезе отчетливо просматривается кортикальный слой, темно-вишневого цвета с серым оттенком. При вскрытии просвета желудка и ДПК определяются множественные мелкие эрозии шоколадного цвета.
Поджелудочная железа резко отечна с участками стеато и геморрагического панкреонекроза в желудочной части до 0,3 см в диаметре и участками стеатонекроза в парапанкреатической клетчатке. Дуоденальная часть железы отечна.
При вскрытии грудной клетки определяется гиперемия плевры и небольшое количества светлого выпота. Поверхность легких гладкая, буроватого цвета с множественными точечными кровоизлияниями.
Сердце без видимых макроскопических изменений.
Морфологическое исследование поджелудочной железы (окраска гематоксилин-эозином увеличение 20×15) при моделировании субтотального панкреонекроза.
В дуоденальной части определяется интерстициальный отек с геморрагическим пропитыванием. Структура ацинусов сохранена. В желудочной части имеет место крупноочаговый панкреонекроз с единичными участками геморрагий, клеточными структурами разрушенных панкреатоцитов, нейтрофильно-макрофагальной инфильтрацией. В зонах, удаленных от очагов некроза, структура ацинусов сохранена. В участках, примыкающих к зонам некроза, панкреатоциты имеют вакуолизированную цитоплазму, ядра неправильной формы.
В селезеночной части определяются множественные центролобулярные некрозы. Имеется значительное количество ацинусов с сохраненной структурой, встречаются интактные островки Лангерганса.
При моделировании острого панкреатита летальность к первым суткам составила 80,6% при тотальном панкреонекрозе и 56,3% при субтотальном панкреонекрозе.
В образцах крови, взятых при тотальном и при субтотальном панкреонекрозе, гемолиза не выявлено.
Таким образом, поставленная задача достигнута, во первых, за счет уменьшения количества желчной кислоты в водимом в протоки растворе, во вторых, за счет поддержания рН вводимого раствора на оптимальном для активации ферментов уровне, в третьих, за счет наложения турникета до или после места впадения дополнительного протока поджелудочной железы в общий желчный проток и управления площадью некроза.
В результате применения данного способа моделирования острого панкреатита развивается крупноочаговый некроз поджелудочной железы (тотальный или субтотальный), что, в свою очередь, приводит к:
1. Выявлению достоверных признаков развития острого панкреатита (морфологических и биохимических).
2. Возможности управления площадью некроза.
3. Снижению уровня летальности, связанной с гемолитическим действием солей желчных кислот.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования острого панкреатита различной степени тяжести у крыс | 2018 |
|
RU2709220C1 |
| СПОСОБ СОЗДАНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ПАНКРЕОНЕКРОЗА У КРЫС | 2008 |
|
RU2400820C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПАНКРЕОНЕКРОЗА У КРЫС | 2007 |
|
RU2388063C2 |
| Способ моделирования панкреатита | 1988 |
|
SU1642501A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПАНКРЕАТИТА | 1999 |
|
RU2224298C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПАНКРЕОНЕКРОЗА | 2000 |
|
RU2199153C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРИЧИНЫ СМЕРТИ | 2001 |
|
RU2193339C1 |
| Способ верификации деструктивного панкреатита | 2018 |
|
RU2672911C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ЭКСПЕРИМЕНТАЛЬНОГО ПАНКРЕАТИТА | 2001 |
|
RU2219948C2 |
| СПОСОБ ЛЕЧЕНИЯ ДЕСТРУКТИВНОЙ ФОРМЫ ПАНКРЕАТИТА | 2001 |
|
RU2196587C1 |




Изобретение относится к области медицины, в частности к экспериментальной хирургии. Способ позволяет разработать модель, наиболее оптимально соответствующую патогенетическим механизмам развития острого деструктивного панкреатита у человека. Вводят в общий желчный проток соли желчных кислот, при этом в него 0,3 мл буферного раствора, содержащего 0,3 г трис-гидроксиметил-аминометана и 0,6 г дезоксихолата натрия в 100 мл с рН 8,8, со скоростью потока 0,07 мл в минуту и регулируют площадь панкреонекроза наложением лигатур выше или ниже места впадения дополнительного протока поджелудочной железы. 8 ил.
Способ моделирования острого деструктивного панкреатита у крыс, включающий введение в общий желчный проток соли желчных кислот, отличающийся тем, что в общий желчный проток вводят 0,3 мл буферного раствора, содержащего 0,3 г трис-гидроксиметил-аминометана и 0,6 г дезоксихолата натрия в 100 мл с рН 8,8, со скоростью потока 0,07 мл в минуту и регулируют площадь панкреонекроза наложением лигатур выше или ниже места впадения дополнительного протока поджелудочной железы в общий желчный проток.
| АНО H.J | |||
| et al | |||
| Experimental pancreatitis in the rat | |||
| Sodium taurocholate-induced acute haemorrahagie pancreatitis | |||
| Scand J | |||
| Gastroenterol, 1980, 15, p | |||
| Способ укрепления электродов в катодных лампах | 1923 |
|
SU411A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПАНКРЕАТИТА | 2000 |
|
RU2174259C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ЭКСПЕРИМЕНТАЛЬНОГО ПАНКРЕАТИТА | 1992 |
|
RU2042359C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ОРГАНОВ МОЧЕПОЛОВОЙ СИСТЕМЫ | 2000 |
|
RU2166800C1 |
Авторы
Даты
2004-09-20—Публикация
2002-11-15—Подача