Изобретение относится к молекулярной биологии и медицине и может быть использовано для установления идентичности геномов микобактерий туберкулезного комплекса в эпидемиологических исследованиях и клинической медицине.
Генетическое типирование микобактерий туберкулезного комплекса позволяет осуществлять наблюдение за динамикой активности эпидемического процесса, устанавливать источник инфицирования при расследовании отдельных локальных вспышек туберкулезной инфекции, выявлять случаи лабораторной кросс-контаминации, проводить дифференциальную диагностику суперинфекции и реактивации туберкулеза.
Микобактерии туберкулеза отличаются высокой консервативностью генома. Значимый для молекулярно-эпидемиологических исследований полиморфизм ДНК выявлен для повторяющихся элементов генома, таких как совершенные и несовершенные повторы, транспозируемые элементы.
Известны способы генетического типирования микобактерий внутри рода и вида для целей молекулярной эпидемиологии путем анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) [1], сполиготипирования [2], путем типирования диспергированных микобактериальных элементов MIRU (mycobacterial interspread repeat units) [3].
Наиболее длительное время для целей молекулярной эпидемиологии применяют способ определения полиморфизма длин рестрикционных фрагментов с использованием гибридизационного зонда на инсерционную последовательность IS 6110 (IS 6110 RFLP) [1]. Этот способ в данный момент является стандартом дискриминирующей способности. Недостатком способа IS 6110 RFLP является многостадийность, необходимость получения значительного количества чистой культуры для выделения ДНК и сложного оснащения лаборатории. Способ ретроспективен, результаты сложны для учета и интерпретации, которую невозможно провести без специального программного обеспечения (Gelcompar, Taxotron и т.п.), для сравнительного анализа распределения электрофоретических паттернов гидролиза ДНК в геле и поиска совпадающих генотипов в базе данных. Особенность используемой мишени - инсерционной последовательности IS 6110 состоит в том, что этот инсерционный элемент имеет предпочтительные сайты интеграции в геноме, что приводит к возникновению одинаковых генотипов при отсутствии клональных связей между ними и ложным выводам при эпидемиологическом анализе. Кроме того, штаммы, циркулирующие на некоторых территориях, имеют единичные копии последовательности в геноме, что критически снижает дискриминирующую способность способа.
Способы на основе полимеразной цепной реакции (ПЦР)-сполиготипирование и VNTR-типирование (анализ варьирующих по числу тандемных повторов) [4] и диспергированных микобактериальных элементов (MIRU) [3] существенно проще для использования, биологически безопасны, т.к. не требуют культивирования микобактерий, могут быть использованы как экспресс-методы. Результаты легко интерпретировать, хранение в удобном формате облегчает создание баз данных.
Наиболее близким к заявляемому способу - прототипом, является способ VNTR-типирования с использованием для анализа точных тандемных повторов ETR А, В, С, D, Е в геноме микобактерий туберкулезного комплекса [4]. В данном способе используют систему из пяти пар праймеров, отжигающихся ниже и выше каждого тандемного повтора:
ETR-A1 AAATCGGTCCCATCACCTTCTTAT;
ETR-A2 CGAAGCCTGGGGTGCCCGCGATTT;
ETR-B1 GCGAACACCAGGACAGCATCATG;
ETR-B2 GGCATGCCGGTGATCGAGTGG;
ETR-C1 GTGAGTCGCTGCAGAACCTGCAG;
ETR-C2 GGCGTCTTGACCTCCACGAGTG;
ETR-D1 CAGGTCACAACGAGAGGAAGAGC;
ETR-D2 GCGGATCGGCCAGCGACTCCTC;
ETR-E1 CTTCGGCGTCGAAGAGAGCCTC;
ETR-E2 CGGAACGCTGGTCACCACCTAAG.
ПЦР проводят отдельно для каждой пары праймеров в конечном объеме 25 мкл, содержащем 2,5 мкл. 10х GeneAmp ПЦР - буфера II (Perkin-Elmer Cetus) 2 мМ MgCl2; 100 нМ каждого праймера, 200 мкМ дНТФ и 0,625 Ед AmpliTaq Gold DNA Polymerase (Perkin-Elmer Cetus). Начальная денатурация при 95°С 12 мин, далее в течение 35 циклов с денатурацией при 94°С 30 сек, отжигом при 60°C 1 мин и синтезом при 72°С 2 мин. Финальную элонгацию приводят при 72°С 10 мин. Размер ПЦР-продукта определяют в агарозном геле в ТВЕ буфере с последующей окраской бромистым этидием и документируют как пятизначный номер, представляющий аллельный профиль ETR A, B, C, D, E.
Однако способ VNTR-типирования с использованием данных полиморфных сайтов обладает меньшей дискриминирующей способностью в сравнении с классическим методом RFLP и не всегда позволяет дифференцировать близкородственные клонально-диссеменированные варианты штаммов микобактерий, циркулирующие на определенных географических территориях.
Технической задачей изобретения является повышение дифференцирующей способности способа за счет использования новых полиморфных локусов ДНК микобактерий туберкулезного комплекса.
Предлагаемый способ заключается в следующем:
Геномную ДНК микобактерий туберкулезного комплекса выделяют из клинических образцов и объектов внешней среды кипячением без последующей очистки по стандартной методике. Далее для дифференциации, либо установления идентичности изолятов микобактерий туберкулезного комплекса, проводят амплификацию полиморфных локусов ДНК с подобранными парами праймеров в отдельных реакционных смесях. Предварительно проведен поиск полиморфных локусов в геноме штамма М.tuberculosis H37Rv, нуклеотидная последовательность которого ранее полностью определена Cole S.T et al. (5). Для анализа используют следующие локусы и фланкирующие их праймеры:
1. V1 Локус 2531891-2532207 в геноме штамма М.tuberculosis H37Rv (в промоторе гена adhE2, кодирующего алкогольдегидрогеназу)
Повтор размером 53 п.о.
Прямой праймер: V1u GAATTCTTCGGTGGTCTCGAGTG
Обратный праймер: V1r CTACGGTGTAGCGTCGCTGAC
2. V2 Локус 4052968-4053546 в геноме штамма М.tuberculosis H37Rv (в составе кодирующей последовательности гена гипотетического белка Rv3611.
Повтор размером 111 п.о.
Прямой праймер: V2u TACACGCAGCTGGAAAGTCCAG
Обратный праймер: V2r GGTCGTTGGTCTAGCCAGTGG
3. V3 Локус 1882885-1983323 в геноме штамма М.tuberculosis H37Rv (в составе кодирующей последовательности генов семейства РЕЕ (белки, богатые Gly-, Asn-).
Повтор размером 78 п.о.
Прямой праймер: V3u ACGGAAGGAATACTCAGCGGAG
Обратный праймер: V3r CTTCAGTCTGCCGGCAATAACG
4. V4 Локус 2163729-2164083 в геноме штамма М.tuberculosis H37Rv (в составе кодирующей последовательности генов семейства MPTR (РРЕ) (белки, богатые Gly-, Asn-).
Повтор размером 69 п.о.
Прямой праймер: V4u CGGTATCCTGATGTTAATCGTAAGG
Обратный праймер: V4r CCATCCCACTGAGCGTCGAAG
Используемая реакционная смесь в объеме 20 мкл, содержит 67 мМ трис-НСl (рН 8,9), 16 мМ сульфат аммония; 1,5 мМ MgCl2; 0,01% Твин 20; 0,2 мM дНТФ; 0,5 мкМ растворы прямого и обратного олигонуклеотидных праймеров и фермент Taq-полимеразу (рекомбинатную) 1 ED. Используемый режим амплификации включает стадии: начальной денатурацией при 96°С 2 мин, далее в течение 39 циклов с денатурацией при 95°С 1 мин, отжигом при 64°С 1 мин и синтезом при 72°С 2 мин. Финальную элонгацию проводят при 72°С 10 мин. Продукты ПЦР фракционируют в 1,5% агарозном геле с последующим окрашиванием бромистым этидием.
Определение аллелей проводят путем определения размера ПНР-фрагмента с последующим расчетом числа копий каждого тандемного повтора в соответствии с формулой расчета и документируют как четырехзначный номер, представляющий аллельный профиль в соответствии с числом тандемных повторов в локусах V1, V2, V3, V4. Используют следующие формулы расчета номеров аллелей:
V1: (размер фрагмента (п.о.) - 51):53
V2: (размер фрагмента (п.о.) - 93):111
V3: (размер фрагмента (п.о.) - 63):78
V4: (размер фрагмента (п.о.) - 100):69
Заявляемым способом проанализировано 100 штаммов микобактерий туберкулезного комплекса, изолированных в Новосибирской области и других регионах мира. Предложенный способ позволяет различать не только штаммы с высокой степенью эволюционной дивергенции, но и близкородственные изоляты. Например, 16 изолятов, принадлежащих к семейству Пекинских штаммов, имеющих идентичный генотип при анализе с использованием прототипа, разделились на 10 генетических вариантов.
Определяющим существенным отличием заявляемого способа, по сравнению с прототипом, является то, что для анализа использованы четыре новых полиморфных локуса V1, V2, V3, V4 в геноме микобактерий туберкулезного комплекса, амплификацию которых с использованием ПЦР проводят с подобранными четырьмя парами фланкирующих их прямых и обратных праймеров, что позволяет повысить дифференцирующую способность способа, обеспечить возможность дифференцирования близкородственных изолятов в пределах клонально-диссеменированных вариантов возбудителя, циркулирующих на данной территории. Кроме того, два вида полиморфных локусов, описанных в прототипе, не проявляют полиморфизма в геноме штаммов микобактерий, циркулирующих в Западно-Сибирском регионе и бесполезны для их типирования. Таким образом, использование предлагаемого способа позволит, по сравнению с прототипом, существенно повысить дискриминирующую способность последнего, значительно превосходя технологичностью лабораторных исследований, способом хранения и обработки результатов.
Предлагаемый способ позволит выявлять таксономические различия внутри рода и видов микобактерий туберкулезного комплекса, имеющих незначительную эволюционную дивергенцию, т.к. использует быстроэволюционирующие полиморфные локусы в геноме возбудителя туберкулеза. В практике эпидемиологического надзора данный способ позволит дифференцировать близкородственные штаммы, имеющие эндемическое распространение на определенных территориях.
Способ позволяет сократить количество анализируемых полиморфных локусов с 5 до 4, что позволяет экономить материальные ресурсы. Изменена в сторону повышения и дифференцирующая способность, т.к. два вида полиморфных локусов, описанных в прототипе не проявляют полиморфизма в геноме штаммов микобактерий туберкулезного комплекса, циркулирующих на территории Западно-Сибирского региона.
Изобретение иллюстрируется следующим примером конкретного выполнения.
Пример.
В клинических испытаниях для дифференциации близкородственных изолятов семейства Пекинских штаммов геномную ДНК из клинических образцов выделяли кипячением без последующей очистки стандартным методом. Далее для дифференциации, либо установления идентичности изолятов проводили амплификацию четырех полиморфных локусов ДНК: V1, V2, V3, V4 с подобранными парами праймеров в отдельных реакционных смесях.
Используемая реакционная смесь в объеме 20 мкл, содержала 67 мМ трис-НСl (рН 8,9), 16 мМ сульфат аммония; 1,5 мМ MgCl2; 0,01% Твин 20; 0,2 мM дНТФ; 0,5 мкМ растворы олигонуклеотидных праймеров и фермент Taq-полимеразу (рекомбинатную) 1 ED. Для каждого анализируемого штамма составляли 4 реакционные смеси, отличающиеся содержанием соответствующей пары праймеров, фланкирующих один из четырех анализируемых локусов. Нуклеотидные последовательности для 22-звенных прямых (u) и 21 звенных обратных (r) праймеров для локусов V1, V2, V3, V4 следующие:
V1u GAATTCTTCGGTGGTCTCGAGTG,
V1r CTACGGTGTAGCGTCGCTGAC;
V2u TACACGCAGCTGGAAAGTCCAG
V2r GGTCGTTGGTCTAGCCAGTGG
V3u ACGGAAGGAATACTCAGCGGAG
V3r CTTCAGTCTGCCGGCAATAACG
V4u CGGTATCCTGATGTTAATCGTAAGG
V4r CCATCCCACTGAGCGTCGAAG
Использовали режим амплификации, единый для всех пар праймеров. Он включал следующие стадии: начальная денатурация при 96°С 2 мин, далее в течение 39 циклов с денатурацией при 95°С 1 мин, отжигом при 64°С 1 мин и синтезом при 72°С 2 мин. Финальная элонгация проводилась при 72°С 10 мин. Продукты ПЦР фракционировали в 1,5% агарозном геле в течение 30 мин при напряжении 300 В. Гель окрашивали бромистым этидием, визуализировали в ультрафиолетовом свете с длиной волны 260 нм.
Определение аллелей для изолятов семейства Пекинских штаммов проводили путем сравнения размера амплифицированного фрагмента ДНК с маркером молекулярного веса. Далее расчет числа копий каждого тандемного повтора проводили в соответствии с формулой для каждой пары праймеров:
V1: (размер фрагмента (п.о.) - 51):53
V2: (размер фрагмента (п.о.) - 93):111
V3: (размер фрагмента (п.о.) - 63):78
V4: (размер фрагмента (п.о.) - 100):69
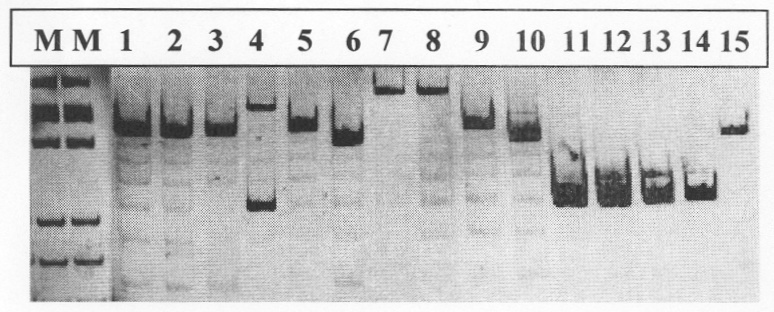
На чертеже приведен пример амплификации локуса V1, где М - маркер молекулярного веса - ДНК плазмиды pBlueScript, гидролизованной Нае III. 1-15 продукты амплификации с использованием праймеров на локус V1. На дорожках 6, 10, 15 размер амплифицированного фрагмента соответствует содержанию 6 тандемных повторов (обозначается как цифра 6 в четырехзначном описании генотипа штамма); 1, 2, 3, - размер амплифицированного фрагмента соответствует содержанию 7 тандемных повторов; в геноме изолятов 4, 11, 12, 13 локус содержит 3 тандемных повтора; в геноме изолятов 5 и 9 - восемь тандемных повторов; в геноме изолятов 7 и 8 по десять тандемных повторов в изучаемом локусе (V1).
Генотип, полученный сходным образом при анализе 4-х локусов, документировали как четырехзначный номер, представляющий аллельный профиль в соответствии с числом тандемных повторов в локусах V1, V2, V3, V4. Например: 3544, где 3 это число тандемных повторов в локусе V1, 5 - число тандемных повторов в локусе V2, 4 - число тандемных повторов в локусе V3 и 4 - число тандемных повторов в локусе V4.
При испытаниях предлагаемого способа генетического типирования микобактерий туберкулезного комплекса были генотипированы 16 клинических изолятов близкородственных микобактерий семейства Пекинских штаммов и 3 референтных лабораторных штамма H37Rv, BCG, Академия. В результате выявлено, что все из вновь предлагаемых локусов V1, V2, V3, V4, проявляли полиморфизм в геноме изученных штаммов. Предлагаемый способ с использованием найденных локусов V1, V2, V3, V4 позволил разделить 16 близкородственных штаммов на восемь типов. Генотипирование с использованием точных тандемных повторов ETR А, В, С, D, Е - прототип [4] не позволяет дифференцировать данные варианты, так как точные тандемные повторы не являются полиморфными в геномах этих штаммов.
Таким образом, дискриминирующая способность заявляемого способа генетического типирования на основе предложенных локусов сравнима с классическим стандартом в молекулярной эпидемиологии - способом IS 6110 RFLP для дифференциации штаммов внутри семейства Пекинских штаммов, но выгодно отличается простотой лабораторной техники и способом обработки и хранения результатов.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. van Embden J.D., Crawford J.Т., Dale J.W. et al.// J.Clin. Microbiol. - 1993. - Vol. 31. - P.406-409.
2. Kamerbeek J., Schouls L., Kolk A. et al.// J.Clin. Microbiol. - 1997. - Vol. 35. - P.907-914.
3. Mazars E., Lesjean S., Gilbert M et al.// PNAS.- 2001.-V. 98. - №4. - P.1901-1906.
4. Frothingham R. and Meeker-O'Connell W.A.// Microbiology. - 1998. - Vol. 144. - P.1189-1196.
5. Cole S.Т., Brosch R., Parkhill J. et al.// Nature. - 1998. - Vol. 393. - P.537-544.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ УСТОЙЧИВЫХ К РИФАМПИЦИНУ ИЗОЛЯТОВ Mycobacterium tuberculosis | 2012 |
|
RU2485177C1 |
| БИОЧИП И СПОСОБ ТИПИРОВАНИЯ ПАТОГЕНОВ I ГРУППЫ, ОТНОСЯЩИХСЯ К СЕМЕЙСТВАМ АРЕНА- И ФИЛОВИРУСОВ | 2014 |
|
RU2562117C1 |
| СПОСОБ ВЫЯВЛЕНИЯ УСТОЙЧИВЫХ К ПИРАЗИНАМИНУ ИЗОЛЯТОВ Mycobacterium tuberculosis | 2013 |
|
RU2552214C2 |
| Способ выявления ДНК бактерии Mycobacterium tuberculosis для диагностики туберкулеза | 2021 |
|
RU2770803C1 |
| СПОСОБ ОБНАРУЖЕНИЯ МИКОБАКТЕРИЙ ТУБЕРКУЛЁЗА ГЕНЕТИЧЕСКОГО КЛАСТЕРА Beijing B0/W148 | 2013 |
|
RU2551764C2 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ ШТАММОВ Mycobacterium tuberculosis | 2013 |
|
RU2547598C1 |
| БИОЧИП И СПОСОБ ТИПИРОВАНИЯ ГЕНОВ ГЕМАГГЛЮТИНИНА И НЕЙРАМИНИДАЗЫ ВИРУСА ГРИППА А | 2013 |
|
RU2560591C2 |
| Способ выявления микобактерий туберкулеза генотипа Beijing В0-кластер в формате реального времени | 2017 |
|
RU2684314C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБЛИНИЙ ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА ЛИНИИ L2 Beijing НА БИОЛОГИЧЕСКИХ МИКРОЧИПАХ | 2022 |
|
RU2790296C1 |
| Способ выявления микобактерий туберкулеза Центрально-Азиатского эпидемического кластера генотипа Beijing | 2019 |
|
RU2735415C1 |
Изобретение относится к молекулярной биологии и может найти применение в медицине. Для осуществления способа после выделения геномной ДНК проводят амплификацию полиморфных локусов ДНК с фланкирующими их праймерами в отдельных реакционных смесях с последующей детекцией ПЦР-продуктов и определением номера аллеля в соответствии с формулой, учитывающей размер ПЦР-продукта, число и размер тандемных повторов, при этом в качестве анализируемых полиморфных локусов ДНК используют локусы V1 (позиция 2531891-2532207 в геноме штамма M.tuberculosis H37Rv), V2 (позиция 4052968-4053546 в геноме штамма M.tuberculosis H37Rv), V3 (позиция 1882885-1983323 в геноме штамма M.tuberculosis H37Rv), V4 (позиция 2163729-2164083 в геноме штамма M.tuberculosis H37Rv), а фланкирующие их прямые (u) и обратные (r) праймеры имеют следующие нуклеотидные последовательности:
V1u GAATTCTTCGGTGGTCTCGAGTG,
V1r CTACGGTGTAGCGTCGCTGAC,
V2u TACACGCAGCTGGAAAGTCCAG,
V2r GGTCGTTGGTCTAGCCAGTGG,
V3u ACGGAAGGAATACTCAGCGGAG,
V3r CTTCAGTCTGCCGGCAATAACG,
V4u CGGTATCCTGATGTTAATCGTAAGG,
V4r CCATCCCACTGAGCGTCGAAG.
Способ позволяет устанавливать идентичность геномов микобактерий туберкулезного комплекса в эпидемиологических исследованиях и клинической медицине, отличается повышенной дифференцирующей способностью, простотой в исполнении и обработке результатов анализа. 3 з.п. ф-лы, 1 ил.
V1u GAATTCTTCGGTGGTCTCGAGTG,
V1r CTACGGTGTAGCGTCGCTGAC,
V2u TACACGCAGCTGGAAAGTCCAG,
V2r GGTCGTTGGTCTAGCCAGTGG,
V3u ACGGAAGGAATACTCAGCGGAG,
V3r CTTCAGTCTGCCGGCAATAACG,
V4u CGGTATCCTGATGTTAATCGTAAGG,
V4r CCATCCCACTGAGCGTCGAAG.
| FROTHINGHAM R | |||
| et al | |||
| Mycrobiology | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Аппарат для электрической передачи изображений без проводов | 1920 |
|
SU144A1 |
| Нефтяная калильная печь | 1924 |
|
SU1189A1 |
| СПОСОБ ОБНАРУЖЕНИЯ ДНК МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗНОГО КОМПЛЕКСА С ДИФФЕРЕНЦИАЛЬНЫМ ВЫЯВЛЕНИЕМ ДНК MYCOBACTERIUM TUBERCULOSIS И НАБОР РЕАГЕНТОВ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2163638C1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 5562106, 29.07.1997 | |||
| US 5582969, 10.12.1996. | |||
Авторы
Даты
2004-09-27—Публикация
2003-04-24—Подача