Изобретение относится к молекулярной биологии, генетической инженерии, медицине (фтизиатрии), ветеринарии и предназначено для обнаружения микобактерий туберкулезного комплекса (МТК), в который входят М.tuberculosis, М. bovis, М. microti и М.africanum. Изобретение позволяет осуществить дифференциальное выявление микобактерий, относящихся к виду М.tuberculosis, среди остальных видов МТК. На территории России и стран СНГ, где распространены преимущественно два патогенных для человека вида МТК - М.tuberculosis и M. bovis - использование изобретения позволяет провести дифференциальное выявление микобактерий человеческого и бычьего типов.
Изобретение может быть использовано для выявления вышеуказанных микобактерий в биологических образцах, полученных от людей, сельскохозяйственных и диких животных.
Изобретение позволяет выявить микобактерий в клинических образцах (мокрота, моча, соскоб эпителиальных клеток, спинномозговая жидкость, промывные воды бронхов и желудка, кровь, биопсийный материал), а также в других образцах (смывы с инструментов, поверхности стен, пола помещений; в мясных и молочных продуктах и т.п.).
Изобретение может быть использовано для оценки эффективности терапии и дезинфекционных мер.
Изобретение можно использовать в научных исследованиях, например, при изучении лекарственной устойчивости микобактерий, определении ростовых качеств твердых и жидких сред, для определения бактерицидного действия на микобактерий различных физических и химических факторов и т.д.
Известен "Способ индикации возбудителей туберкулеза M.tuberculosis и M. bovis" (заявка на изобретение N 94017389/13, МПК 6 C 12 Q 1/68, А 61 К 39/04, опубл. 10.06.96 г.). Сущность способа заключается в том, что обнаружение возбудителей туберкулеза осуществляют путем последовательной двухстадийной (двухраудовой) амплификации участка гена, кодирующего 64-килодальтонный белок M.bovis BCG, специфичного для видов M.tuberculosis и M. bovis, причем в полимеразной цепной реакции используют две пары праймеров, одна из которых фланкирует участок амплификации другой пары праймеров, и вынесения суждения о наличии возбудителей в образце при выявлении на электрофореграмме в агарозном геле полос, характерных для ампликонов, синтезируемых с использованием обеих пар праймеров.
Относительно этого способа можно отметить следующие (недостатки):
1) во-первых, при проведении ПЦР последовательно, в две стадии, значительно возрастает вероятность контаминации реакционной смеси ампликонами, полученными на первой стадии реакции;
2) во-вторых, проведение ПЦР в две стадии увеличивает продолжительность анализа;
3) в-третьих, поскольку ген, кодирующий 64-килодальтонный белок характерен и для ряда вакцинных штаммов M.bovis BCG, то способ, построенный на детекции этого гена, не позволяет дифференцировать людей и животных больных туберкулезом от индивидуумов недавно вакцинированных или ревакцинированных M.bovis BCG;
4) в-четвертых, метод не позволяет дифференцировать два вида возбудителей туберкулеза M.tuberculosis и M.bovis, преимущественно распространенных на территории России и стран СНГ, что представляется важным как для рациональной терапии больных, так и для оценки и прогнозирования эпидемиологической обстановки;
5) в-пятых, поскольку способ не предусматривает использование внутреннего стандарта при проведении ПЦР, то не представляется возможным отслеживать ложноотрицательные результаты анализа, обусловленные присутствием в некоторых анализируемых образцах ДНК ингибиторов термостабильной ДНК-полимеразы;
6) в-шестых, метод не позволяет дать относительную количественную оценку содержания возбудителей туберкулеза в анализируемом образце;
За прототип способа принят способ, описанный в статье "Дифференциальное выявление возбудителей туберкулеза в клиническом материале с использованием двухстадийной полимеразной цепной реакции" авторов А.Б.Беклемишева и Е.М. Хорошевой (Бюллетень СО РАМН, 1998, N 3, стр.76-85).
В статье описан способ выявления возбудителей туберкулеза (МТК) с дифференциальным выявлением M.tuberculosis, который так же, как и предлагаемый способ, позволяет проводить дифференциальную детекцию M.tuberculosis и M. bovis на территории РФ и СНГ. Способ основан на использовании двухстадийной ПЦР с одновременной (в одной реакционной смеси) амплификацией двух мишеней. Одна из них представляет собой достоверный специфический генетический маркер вида M. tuberculosis - это последовательность гена mtp40. Другая - фрагмент последовательности инсерционого элемента IS6110, специфичный для МТК.
Недостатки способа аналогичны изложенным в п.п. 1,2,3,5,6 первого аналога.
За прототип набора принят набор "Политуб", представляющий собой набор реагентов для обнаружения ДНК микобактерий туберкулезного комплекса в биологических пробах методом ПЦР (ТУ 9398-410-17253567-97). В состав набора входят:
1) реакционная смесь, содержащая раствор дНТФ, раствор специфичных праймеров, ПЦР-буфер, краситель (крезоловый красный);
2) термостабильная ДНК-полимераза (Taq-полимераза);
3) вода деионизованная;
4) минеральное масло;
5) ДНК-контрольная (ДНК M.tuberculosis).
Способ обнаружения МТК с использованием набора "Политуб" также основан на амплификации участка гена белка МРВ 64.
Недостатки данного набора и способа обнаружения ДНК МТК аналогичны описанным для первого аналога.
1. СУЩНОСТЬ ИЗОБРЕТЕНИЙ
Задачей заявляемых изобретений является создание высокоспецифичного, чувствительного, но более простого и быстрого метода и соответствующего набора реагентов для обнаружения геномных ДНК представителей четырех видов МТК (M. tuberculosis, M.bovis, M.microti, M.africanum) с дифференциальной идентификацией M.tuberculosis, дающих возможность не выявлять вакцинный штамм M. bovis BCG и позволяющих осуществить визуальную полуколичественную оценку числа возбудителей туберкулеза в анализируемом материале.
Предлагаемый способ и набор основаны на однораундовой мультипраймерной многоцикловой амплификации методом ПЦР в общей реакционной смеси, в состав которой введен, в частности, глицерин, двух участков (мишеней) геномной ДНК и нуклеотидной последовательности, служащей внутренним стандартом и позволяющей судить об эффективности прохождения ПЦР на ДНК анализируемого образца и вычленять ложноотрицательные результаты анализа. В качестве одной из мишеней выбран характерный для всех видов МТК, за исключением M.bovis BCG, фрагмент (Области RDI геномов МТК, включающий участок гена белка ESAT-6 (Harboe М., Oettinger T.,Wiker H.G.,Rosenkrands I., and Andersen P. Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG// Infect, lmmun/ -1996. V.64.-P. 16-22), в качестве второй - специфичный для вида М. tuberculosis фрагмент гена mtp 40 (Portillo P.D., Murillo L.A., Patarroyo M.E.Amplification of species-specific DNA fragment of Mycobacterium tuberculosis and its possible use in diagnosis //J.Clin. Microbiol. -1991/ -V.29. -P.2163-2168).
Предлагаемый набор содержит: 1) концентрированную реакционную смесь ("кРС"-концентрированная реакционная смесь), в которую входят: по 0,10 mM каждого из 4-х dNTP (dATP, dGTP, dCTP, dTTP), 33,2 mM (NH4)2SO4, 134 mM Tris-HCl (pH 8,8), 3,0 mM MgCl2, 0,02% Tween 20, 20% (объем/объем) глицерина, по 0,4 мкМ каждого из праймеров P90, P92, P93 и P94, подобранных к нуклеотидным последовательностям-мишеням геномов МТК, т.е. к фрагменту области RDI геномов МТК, включающему участок гена белка ESAT-6 и к фрагменту гена mtp-40, а также ДНК ВС (N 1 или N 2 или N 3) в концентрации по 5·102-2,5·103 копий/мл кРС и краситель крезоловый красный (1 мг/мл кРС);
2) термостабильную ДНК-полимеразу (5 ед./мкл);
3) воду деионизованную, стерильную;
4) минеральное масло;
5) (+)-контроль-контрольную ДНК (ДНК M.tuberculosis).
- количества которых указаны в п.2.2.
1. 1. Характеристика мишеней, выбранных для амплификации
В данном изобретении в качестве мишеней для амплификации в системе ПЦР выбраны две нуклеотидных последовательности геномов МТК. Обе мишени используются для одновременной амплификации в общей реакционной смеси. Первая мишень (мишень М) представляет собой фрагмент нуклеотидной последовательности гена белка MTP 40, который является видоспецифичным для M.tuberculosis и присутствует в подавляющем большинстве его изолятов, а также в некоторых изолятах нераспространенного на территории России и стран СНГ вида M.africanum. Второй мишенью (мишень Е) является фрагмент нуклеотидной последовательности RDI геномов МТК, включающий участок гена белка ESAT-6. Данный белок является специфичным для всех видов МТК, за исключением M.bovis BCG. Такой подбор мишеней дает возможность по результатам ПЦР в каждом положительном образце судить о принадлежности микобактерий к виду M.tuberculosis или о его не принадлежности к данному виду, т.е. о принадлежности к другим видам МТК. Поскольку на территории России и стран СНГ распространены, в основном, два вида возбудителей туберкулеза, M.tuberculosis и M.bovis, то использование предлагаемого способа и набора позволяет дифференцировать эти виды между собой, т.е. определять оба эти вида, что может быть полезно для оценки эпидемиологической ситуации по туберкулезу. То, что данный подбор мишеней исключает возможность определения вакцинного штамма M.bovis BCG, также является его дополнительным преимуществом, особенно, учитывая вакцинацию большей части населения.
1.2. Структуры праймеров, используемых для амплификации мишеней М и E и ДНК различных моделей внутреннего стандарта
Выбор праймеров проводили при помощи программы "Oligo".
Праймеры подобрали (разработали) таким образом, чтобы:
1) температуры их отжига (гибридизации) с соответствующими им нуклеотидными последовательностями мишеней и ДНК внутреннего стандарта были одинаковыми или близкими, т.к. ПЦР по предлагаемому способу осуществляют в одну стадию в одной реакционной смеси (и в одной емкости),
2) все три ампликона отличались по размерам, а следовательно и по электрофоретической подвижности, и, таким образом, отчетливо дискриминировались после электрофореза в геле.
Структуры некоторых из возможных праймеров, используемых в предлагаемом способе и наборе, приведены в таблице 1. Праймеры к мишени E, как видно из таблицы, используют и для амплификации ДНК внутреннего стандарта модели N 1 (клонированной нуклеотидной последовательности) и модели N 3. К модели N 2 внутреннего стандарта была подобрана отдельная пара праймеров.
1.3. Разработка и получение ДНК внутреннего стандарта (ВС)
Как уже упоминалось, приблизительно в 10% образцов при анализе их на присутствие ДНК МТК выявляются ингибиторы ПЦР. В предлагаемом способе и тест-системе для решения проблемы отслеживания ложноотрицательных результатов в реакционную смесь вводится ДНК внутреннего стандарта, предназначенного для коамплификации с ДНК анализируемого клинического образца.
Внутренний стандарт (ВС), используемый в ПЦР - это препарат специфической ДНК, содержащей амплифицируемый в процессе ПЦР фрагмент, размер ампликона которого отличается от размеров ампликонов, синтезируемых на нуклеотидных последовательностях-мишенях детектируемого генома. ДНК ВС вносят в состав реакционной смеси и, таким образом, ВС, присутствующий как в опытных так и в контрольных пробах, амплифицируется в них в процессе ПЦР-анализа совместно с мишенями анализируемой ДНК или контрольной ДНК. Если в препарате анализируемой ДНК имеются примеси, ингибирующие активность термостабильной ДНК-полимеразы, то это, в свою очередь, приводит к полному или частичному подавлению амплификации как ДНК исследуемого образца, так и ДНК ВС. Результаты анализа образцов, в которых не наблюдается амплификация как исследуемой ДНК, так и ДНК ВС, следует учитывать как ложноотрицательные.
В качестве ДНК ВС можно применять одну из нуклеотидных последовательностей-мишеней, у которой методами генной инженерии делегирован внутренний участок нуклеотидной цепи, либо наоборот встроен фрагмент любой ДНК. Модифицированную таким образом мишень можно использовать непосредственно как ВС, либо предварительно клонировать ее в составе плазмидного вектора и, в таком случае, в качестве ВС используется уже рекомбинантная плазмида. Амплификацию модифицированной мишени ВС осуществляют с использованием той же пары праймеров, которая применяется для амплификации исходной мишени в геноме детектируемого возбудителя. Во избежание конкуренции между анализируемой ДНК и ДНК ВС за одни и те же праймеры, которая может отразиться на результатах анализа, а также во избежание формирования гибридных ДНК между цепочками ампликонов ВС и мишени, в качестве ВС можно использовать гетерологичную ДНК, но уже с соответствующей парой праймеров (модель ВС N 2) либо парой праймеров, используемых для амплификации одной из мишеней (модель ВС N 3).
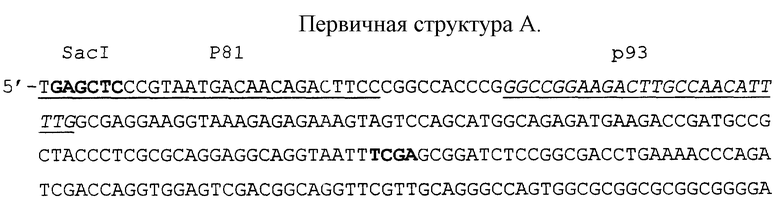
Модель N 1 ВС сконструирована таким образом, что ВС как и одна из ДНК-мишеней (мишень Е) амплифицируется в присутствии праймеров p93 и p94. При этом нарабатывается ампликон размером 231 п.н. (см. табл.1).
Получение ВС модели N 1 осуществляют по следующей схеме:
1. На первой ступени амплифицируют фрагмент нуклеотидной последовательности RDI генома M.tuberculosis, первичная структура A которого (позиции с 1914 по 2554 нуклеотидный остаток области RDI) представлена в конце описания. Участки фрагмента, к которым подобраны праймеры p80 и p81 (см. табл.2) подчеркнуты. Размер синтезируемого ампликона составляет 641 п.н. Подчеркнутым курсивом отмечены последовательности, соответствующие праймерам N93 и N94 (см. табл. 1), используемым как для амплификации фрагмента RDI при детекции ДНК микобактерий в данной тест-системе (размер синтезируемого ампликона составляет 545 п.н.) так и для амплификации ДНК ВС N 1 и N 3. Сайты узнавания рестриктазами SacI, PstI и TaqI отмечены жирным шрифтом.
2. На втором этапе ампликон подвергают перевариванию сначала рестриктазами SacI и PstI, а затем рестриктазой TaqI. Рестрикты разделяют электрофорезом в 5% ПААГ и 5' - и 3' - концевые фрагменты ампликона элюируют из геля и лигируют с помощью ДНК-лигазы фага T4.
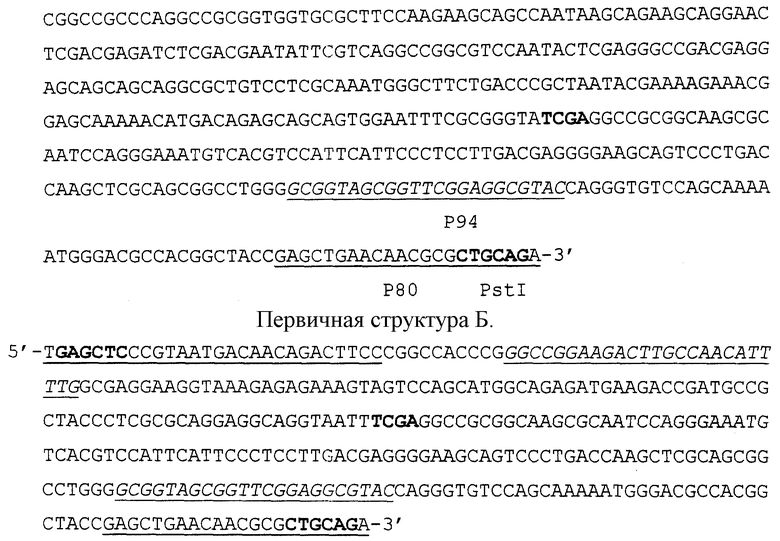
3. На третьем этапе смесь лигированных фрагментов вносят в качестве матричных ДНК в систему ПЦР, содержащую праймеры p80 и p81. Ампликон размером 327 п. н. очищают с помощью электрофореза в 5% ПААГ с последующей элюцией. Первичная структура Б этого ампликона показана в конце описания.
4. На заключительном этапе к 3'-концам ампликона с помощью терминальной дезоксинуклеотидилтрансферазы достраивают коннекторы (dC)15-20 и клонируют в составе плазмидного вектора pBluescript II SK(+) в клетках Е.coli. Вектор предварительно гидролизуют рестриктазой PstI и затем к 3'-концам достраивают коннекторы (dG)15-30.
Рекомбинантную плазмиду, содержащую ампликон размером 327 п.н., разводят до концентрации 10-100 копий в 5 мкл и используют в ПЦР в качестве ВС модели N 1. При амплификации ДНК ВС N 1 с праймерами p93 и p94 синтезируется ампликон размером 231 п.н.
ДНК ВС модели N 2 получают следующим образом:
1. На первом этапе фрагмент неструктурной области (NS) РНК-генома вируса гепатита С человека (позиции с 43 по 339 нуклеотидный остаток генома) подвергают обратной транскрипции с помощью ревертазы M-MLV в присутствии праймеров p60 и p61 (см. табл. 2).
2. На втором этапе проводят амплификацию, синтезированных на первом этапе кДНК, в системе ПЦР в присутствии праймеров p60 и p61. Синтезируемый ампликон размером 297 п.н. после соответствующего разведения ТЕ-буфером до конечной концентрации (10-100 молекул в 5 мкл раствора) используют в тест-системе в качестве ВС модели N 2. Структура ДНК ВС N 2 представлена в конце описания (участки фрагмента генома, к которым подобраны праймеры p60 и p61 подчеркнуты).
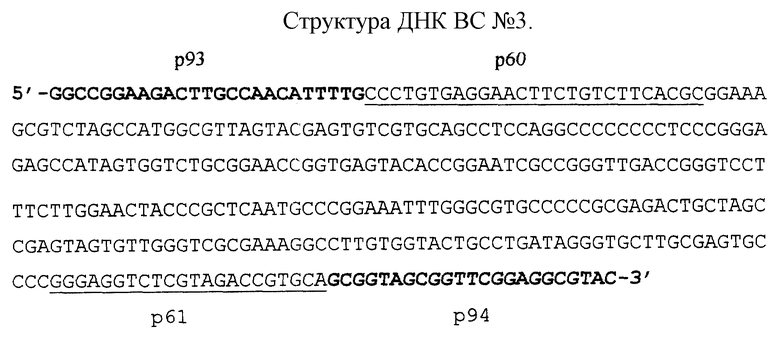
ДНК ВС модели N 3 получают на основе ДНК ВС N 2 следующим образом:
1. На первом этапе ДНК ВС N 2 амплифицируют в системе ПЦР в присутствии праймеров p116 и p117 (см. табл. 2) с получением ампликона размером 324 п.н. (пвс3).
2. На втором этапе проводят амплификацию синтезированного на первом этапе ампликона пвс3 в присутствии праймеров p93 и p94 (см. табл.2). Синтезируемый ампликон размером 345 п. н. после соответствующего разведения ТЕ-буфером до конечной концентрации (10-100 молекул в 5 мкл раствора) используют в тест-системе в качестве ВС модели N 2. Структура ДНК ВС N 3 представлена в конце описания (участки фрагмента генома, к которым подобраны праймеры p60 и p61 подчеркнуты, а области соответствующие праймерам p93 и p94 отмечены жирным шрифтом).
Ампликон, соответствующий по размеру используемой в тест- системе ДНК ВС (N 1, N 2 или N 3), должен наблюдаться после проведения ПЦР во всех образцах, включая образец, содержащий отрицательный контроль. Отсутствие продуктов амплификации ДНК ВС является свидетельством ингибирования ПЦР и, следовательно, того, что отрицательный результат может быть ложным. Амплификацию известных разведении ВС любой модели можно использовать для полуколичественной оценки числа возбудителей туберкулеза в анализируемом материале.
1.4. Условия проведения ПЦР для выявления ДНК МТК и дифференциального выявления ДНК М.tuberculosis
Условия проведения ПЦР (температура, время, количество циклов, количество глицерина и внутреннего стандарта) были оптимизированы (взаимно подобраны) таким образом, чтобы получить однопробирочную мультипраймерную многоцикловую амплификацию обоих диагностических мишеней (E и М) совместно с ДНК одной из моделей ВС и без неспецифических продуктов амплификации. Использование в реакционной смеси 10% глицерина позволило снизить температуру денатурации ДНК и отжига праймеров на 4 градуса и таким образом продлить "жизнь" фермента. Это, в свою очередь, позволило: а) увеличить чувствительность метода за счет увеличения количества циклов амплификации, а следовательно и количества ампликонов, без дополнительного введения фермента в реакционную смесь, б) проводить ПЦР в одну стадию, что важно для предотвращения кросс-контаминации анализируемых проб наработанными ампликонами.
Количество ВС в реакционной смеси подбиралось таким образом, чтобы оно не оказывало существенного влияния на амплификацию мишеней вследствие конкуренции за дНТФ.
2. СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Способ осуществляется следующим образом:
Набором можно анализировать следующие виды биологического материала: мокрота, моча, лаважная жидкость, плевральная и спинномозговая жидкости, различные экссудаты, кровь. По способу обработки клинические образцы подразделяют на три группы: кровь, жидкие образцы, содержащие слизь, прочие жидкие образцы.
2.1. Проведение анализа
2.1.1. Подготовка образцов к выделению ДНК
А) Подготовка образцов крови.
Периферическую кровь из пальца в количестве 80 мкл собирают в пластиковую пробирку объемом 1,5 мл, содержащую 30 мкл 3.8%-ного цитрата натрия, перемешивают и хранят не более 3 суток при +4oC. К раствору цитратной крови добавляют 900 мкл дистиллированной воды, затем 300 мкл 2М NaOH перемешивают и выдерживают 30 мин при комнатной температуре.
Б) Подготовка жидких образцов, содержащих слизь.
Если моча, лаважная жидкость или еще какой-либо образец содержит слизь, то ее разжижают добавлением нескольких капель концентрированной щелочи NaOH и суспендированием.
К образцу мокроты добавляют приблизительно 1/4 объема раствора 2М NaOH и суспендируют до жидкого состояния. Если после этого осталась слизь, то ее разжижают добавлением нескольких капель концентрированной щелочи NaOH и повторным суспендированием.
2.1.2. Выделение ДНК из образцов.
После проведения стадий, описанных в п. 2.1.1. все три группы образцов обрабатывают одинаково. Образцы центрифугируют при 3500gx20 мин. и удаляют супернатант. Добавляют к осадкам по 1 мл ТЕ-буфера (10 mM Tris-HCl, pH 8,0, 1mM EDTA), суспендируют и переносят материал в пластиковые пробирки объемом 1,5 мл.
Суспензию осадка в ТЕ-буфере центрифугируют при 10000xg, осадок повторно 2 раза промывают ТЕ-буфером и используют для выделения ДНК
К осадку добавляют 1 мл хлороформа и перемешивают на встряхивателе для микропробирок 3 минуты. Затем к суспензии добавляют микропипеткой 100 мкл ТЕ-буфера и вновь перемешивают 3 минуты. Полученную суспензию центрифугируют при 8000-10000 оборотов 5 минут, в результате чего она разделяется на две фазы, в верхней (водной) из которых содержится ДНК.
2.1.3. Проведение ПЦР-анализа
1. Вносят в пластиковые пробирки емкостью 0,5 мл по две капли минерального масла (30 мкл) из наконечника на 1-200 мкл.
2 Готовят реакционную смесь из расчета на 1 пробу: вода - 10 мкл, кРС- 15 мкл, термостабильная ДНК-полимераза - 0,4 мкл. Полученную реакционную смесь тщательно перемешивают. Эта реакционная смесь имеет следующий состав: 16,6 mM (NH4)2SO4, 67 mM Tris-HCl (pH 8,8), 1,5 mM MgCl2, 0,01% Tween 20, по 0,05 mM каждого из 4-х dNTP (dATP, dGTP, dCTP, dTTP), по 0,2 мкМ каждого из праймеров P90, P92, P93 и P94, 10% (объем/объем) глицерина, по 10-100 копий ДНК ВС и по 2,5 ед. Taq- или Tet-Z - ДНК-полимеразы.
3. 5 мкл препарата ДНК, выделенного из клинической пробы, вносят в отдельную пробирку под слой минерального масла.
4. В две отдельные пробирки вносят:
а) положительный контроль- 3 мкл контрольной ДНК, (ДНК M.tuberculosis), с концентрацией 5-200 геномов M.tuberculosis на 1 мкл.
б) отрицательный контроль - 3 мкл деионизованной воды.
5. Пробирки центрифугируют в течение при 10000g х 5 сек.
6. Пробирки инкубируют при 100o 3 минуты, после чего помещают в ледяную ванну.
7. Вносят в каждую из пробирок с денатурированной ДНК, включая и контрольные пробирки, по 25 мкл реакционной смеси.
8. Пробирки центрифугируют в течение 2-3 сек при 5-10 тыс.об/мин и помещают в амплификатор с установленным режимом "Пауза" при +80oC. Проводят ПЦР в следующем температурном режиме*:
94oC, 2 мин; 65oC, 40 сек; 72oC, 40 сек - 1-й цикл; 94oC, 40 сек; 65oC, 40 сек; 72oC, 40 сек - до 7 цикла; 90oC, 30 сек; 65oC, 40 сек; 72oC, 40 сек - до 50 цикла; 90oC, 30 сек; 65oC, 2 мин; 72oC, 9 мин - 51-й цикл.
*ПЦР проводят на амплификаторе МС-2 фирмы "ДНК-технология" (г.Москва), в режиме "быстрого активного регулирования".
2.1.4. Регистрация и интерпретация результатов анализа
После завершения реакции 10 мкл реакционной смеси анализируют электрофорезом в 5% ПААГ, либо в 1,5-2% агарозном геле при напряжении 10 В/см 1 час с последующим окрашиванием ДНК в геле бромистым этидием.
Интерпретация результатов анализа
Полоса размером 231 п.н. соответствует продуктам амплификации искусственно введенной в реакционную смесь ДНК ВС модели N 1. В случае использования в тест-системе ДНК ВС моделей N 2 или N 3 на геле будут выявляться полосы, соответствующие по своей подвижности ДНК с размерами 297 п.н. или 345 п.н., соответственно.
Полоса размером 402 п.н. соответствует продуктам амплификации генетического маркера, характерного только для вида M.tuberculosis.
Полоса размером 545 п.н. соответствует продуктам амплификации генетического маркера, строго специфичного для всех патогенных микобактерий туберкулезного комплекса (отсутствует в вакцинном штамме M.bovis BCG).
1. Отрицательный контроль - на геле должна присутствовать только одна полоса, соответствующая ампликону с ДНК ВС (размером 231 п.и. для ВС модели N 1, 297 п.н. для ВС модели N 2, или 345 п.н. для ВС модели N 3)
2. Положительный контроль - должны присутствовать три полосы, соответствующие ампликонам (545 п. н. и 402 п.н.) с генетических маркеров геномной ДНК микобактерий и ампликону с ДНК одной из моделей ВС.
3. Анализируемые пробы:
а) наличие только одной полосы, соответствующей по размеру ампликону с ДНК одной из моделей ВС и отсутствие на геле полос размером 545 п.н. и 402 п. н. , свидетельствует об отсутствии ДНК возбудителя туберкулеза в анализируемом образце (отрицательный результат);
б) наличие на геле полос размером 544 п.н. и 401 п.н., наряду с полосой, соответствующей по размеру ампликону с ДНК одной из моделей ВС, свидетельствует о присутствии ДНК возбудителя M.tuberculosis в клинической пробе (положительный результат);
в) если на геле обнаруживаются только полоса размером 544 п.н, наряду с полосой, соответствующей по размеру ампликону с ДНК одной из моделей ВС, то это означает, что в образце присутствует ДНК возбудителя M.bovis (положительный результат);
г) отсутствие всех полос на геле, в том числе и полосы, соответствующей по размеру ампликону с ДНК одной из моделей ВС, свидетельствует о присутствии ингибиторов ПЦР в препарате ДНК образца; этот результат следует трактовать как ложноотрицательный (нет достоверного результата).
4. Появление полосы 401 п.н. или 544 п.н. в отрицательном контроле свидетельствует о перекрестной контаминации проб или контаминации компонентов набора.
2.2. Пример конкретного состава набора.
Набор для проведения полимеразной цепной реакции (на 100 определений)
1) Реакционная смесь ("кРС") - 1500 мкл
2) Термостабильная ДНК-полимераза (5 ед/мкл) - 40 мкл
3) Вода бидистиллированная - 1500 мкл
4) Минеральное масло - 3000 мкл
5) Препарат ДНК M. tuberculosis с концентрацией 200 геномов/мкл в качестве положительного контроля ("К+") - 50 мкл
2.3. Результаты применения предлагаемого способа и набора.
Предлагаемые изобретения были применены для анализа клинических образцов (мокрота, кровь, моча, промывные воды желудка) от 22 пациентов. Образцы были получены из ЦКБ СО РАН.
Все образцы исследовались параллельно тремя методами: методом микроскопии мазков, методом культивирования на селективной среде Левенштейна-Йенсена и с помощью предлагаемых изобретений.
Методом культивирования возбудитель туберкулеза был обнаружен через 8-10 недель в 5 образцах (в 17-ти образцах - не было). В этих же образцах методом ПЦР была обнаружена ДНК возбудителя туберкулеза. Причем в одном из них - ДНК M.bovis (метод селективных сред не позволяет дифференцировать M.tuberculosis и M.bovis).
Методом микроскопии бациллы возбудителя были обнаружены только в трех образцах, давших положительные результаты методом культивирования и ПЦР.
Таким образом, предлагаемый метод, осуществляемый с помощью предлагаемого набора, не уступает по чувствительности методу культивирования, но, в отличие от него, является значительно более быстрым методом (8 часов вместо 8-10 недель) и позволяет дифференцировать виды М.tuberculosis и М.bovis.






Изобретение относится к молекулярной биологии, генетической инженерии, медицине (фтизиатрии), ветеринарии и предназначено для обнаружения микобактерий туберкулезного комплекса (МТК), в который входят M. tuberculosis, M. bovis, M. microti и M. africanum. Предлагаемый способ и набор основаны на однораундовой мультипраймерной многоцикловой амплификации методом полимеразной цепной реакции (ПЦР) в общей реакционной смеси, в состав которой введен, в частности, глицерин, двух участков (мишеней) геномной ДНК и нуклеотидной последовательности, служащей внутренним стандартом и позволяющей судить об эффективности прохождения ПЦР на ДНК анализируемого образца и вычленять ложноотрицательные результаты анализа. В качестве одной из мишеней выбран характерный для всех видов МТК, за исключением M. bovis BCG, фрагмент области RD1 геномов МТК, включающий участок гена белка ESAT-6, в качестве второй - специфичный для M. tuberculosist фрагмент гена mtp 40. Предлагаемый набор содержит концентрированную реакционную смесь, термостабильную ДНК-полимеразу (5 ед. /мкл), воду деионизованную. Стерильную, минеральное масло, -(+)- контроль - контрольную ДНК (ДНК M. tuberculosis). Изобретение позволяет осуществить дифференциальное выявление микробактерий, относящихся к виду M. tuberculosis, среди остальных видов МТК, а также позволяет выявить вышеуказанные микробактерии в биологических образцах, полученных от людей, сельскохозяйственных и диких животных, оценить эффективность терапии и дезинфекционных мер. 2 с. и 8 з.п.ф-лы, 2 табл.
| Беклемишев А.Б., Хорошева Е.М | |||
| Дифференциальное выявление возбудителей туберкулеза в клиническом материале с использованием двухстадийной полимеразной цепной реакции | |||
| Бюллетень СО РАМН, 1998, N3, с.76-85 | |||
| RU 94017389 A1, 10.06.1996 | |||
| Цифровой вероятностный фильтр | 1972 |
|
SU479117A1 |
| RU 2000331 C, 07.09.1993 | |||
| RU 97100857 A1, 27.02.1999 | |||
| WO 8803957 A1, 02.06.1988 | |||
| WO 8402721 A1, 19.07.1984 | |||
| JP 03164199 A, 16.07.1991 | |||
| JP 05245000 A, 24.09.1993. | |||
Авторы
Даты
2001-02-27—Публикация
1999-12-06—Подача