Настоящее изобретение относится к более эффективному способу получения L-фенилэфрина гидрохлорида путем катализированного родием асимметрического гидрирования в промышленном масштабе.
Технологические предпосылки создания изобретения
L-фенилэфрин относится к числу часто применяемых в фармацевтике аналогов адреналина и представляет значительный интерес с коммерческой точки зрения. L-фенилэфрин применяют в фармацевтике в виде его гидрохлорида, при этом он действует в качестве симптомиметика при терапии гипотонии и в качестве сосудосуживающего средства в офтальмологии и ринологии. Химическую структуру α-аминоспирта L-фенилэфрина можно представить следующей формулой I:

Уровень техники
К известным из уровня техники способам получения L-фенилэфрина гидрохлорида относится асимметрическое гидрирование прохирального N-бензил-N-метил-2-амино-м-бензилоксиацетофенонгидрохлорида формулы II согласно Tetrahedron Letters 30 (1989), стр.367-370, соответственно Chem. Pharm. Bull. 43 (5) (1995), стр.738-747.
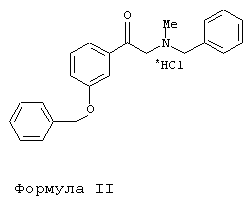
Achiwa и др. описывают в Tetrahedron Letters 30 (1989), стр.367-370 асимметрическое гидрирование 3-бензилокси-2-(N-бензил-N-метил)аминоацетофенонгидрохлорида в качестве субстрата под действием водорода в присутствии [Rh(COD)Cl]2/(2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинопирролидина в качестве катализатора. Непосредственно после фильтрации и концентрирования реакционной смеси бензильную азотную защитную группу отщепляют и в качестве целевого продукта получают фенилэфрин. При этом наряду с L-энантиомером образуется D-энантиомер, представляющий собой нежелательную примесь в количестве по меньшей мере 7,5% [85% ее (энантиомерный избыток)]. При осуществлении этой реакции катализатор, в пересчете на субстрат, необходимо использовать в молярном соотношении 1:2000. Главный недостаток указанного способа состоит в невозможности очищать полученный L-фенилэфрин экономичным образом до той степени чистоты, по меньшей мере 98% ее, которая требуется для его применения в качестве лекарственного средства.
В другой из вышеназванных публикаций - Chem. Pharm. Bull. 43 (5) (1995), стр.738-747 - указывается, что предпочтительным для асимметрического гидрирования является молярное соотношение между субстратом и катализатором порядка 1000:1.
Однако для получения L-фенилэфрина в промышленном масштабе описанный в уровне техники способ в силу ряда присущих ему недостатков непригоден. Во-первых, несмотря на использование на стадии асимметрического гидрирования больших количеств катализатора не удается получать продукт в виде только L-энантиомера с достаточной степенью чистоты, который можно было бы непосредственно применять в фармацевтических целях без проведения дорогостоящих операций по его очистке, а получают смесь требуемого продукта с относительно высокой долей загрязняющего его D-энантиомера.
Во-вторых, именно для получения L-фенилэфрина в промышленном масштабе неприемлемо с экономической точки зрения относительно продолжительное время реакции асимметрического гидрирования порядка 20 ч, поскольку это связано с очень высокими материально-техническими затратами и довольно значительным риском касательно безопасности.
Описание изобретения
Как указывалось выше, настоящее изобретение относится к новому, более эффективному способу получения L-фенилэфрина путем асимметрического гидрирования, при этом предусматривалось устранение известных из уровня техники соответственно вышеназванных трудностей и недостатков.
Одной из важных принципиальных целей изобретения является разработка способа, который обеспечивал бы возможность получения L-фенилэфрина гидрохлорида с высокой степенью оптической и химической чистоты. Тем самым предполагалось, в частности, минимизировать опасность загрязнения лекарственных средств, содержащих L-фенилэфрин гидрохлорид в качестве активного вещества, нежелательным D-энантиомером.
Еще одной целью изобретения является разработка способа, с помощью которого L-фенилэфрин можно было бы получать практически в виде чистого энантиомера простым путем.
Другая цель изобретения состоит в том, чтобы обеспечить возможность получения L-фенилэфрина с помощью стереоселективного способа с целью исключить необходимость в проведении операций, при которых хиральные промежуточные соединения, соответственно хиральный конечный продукт L-фенилэфрин, получают в виде рацемата примерно в том же количестве, что и соответствующий антипод.
Еще одной целью способа по изобретению является существенное сокращение продолжительности гидрирования, необходимого для получения L-фенилэфрина гидрохлорида, в частности, с целью существенно снизить затраты и опасности, связанные с использованием водорода под высоким давлением.
Еще одна цель настоящего изобретения состоит в том, чтобы предложить специалистам такой способ получения L-фенилэфрина, с помощью которого это требуемое в больших количествах активное вещество можно было бы получать, исходя из получаемых простым путем эдуктов по рентабельной технологии.
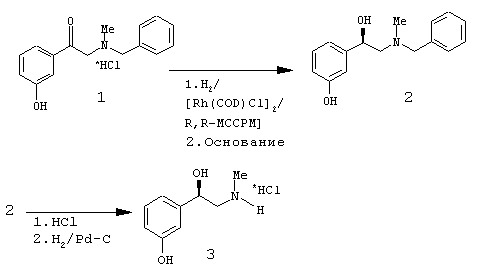
Неожиданным образом было установлено, что L-фенилэфрин гидрохлорид можно получать с исключительно высокой оптической чистотой из N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида 1 путем асимметрического гидрирования в присутствии [Rh(СОD)Сl]2/(2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидина в качестве каталитической системы при предусмотренной соответственно последовательности проводимых операций. Используемое в вышеприведенной общей формуле каталитической системы сокращение COD обозначает циклооктадиен.
При молярном соотношении между катализатором и субстратом порядка 1:1000 по способу согласно изобретению, исходя из бензиладрианона (N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида) 1, получают бензиладрианолгидрохлорид 2 уже с оптической чистотой 92% ее (реакционная схема 1). В результате перевода этого бензиладрианолгидрохлорида 2 в свободное основание и последующего осаждения этого основания из смеси аммиака, метанола и воды оптическую чистоту таким простым и очевидным путем удается повысить даже до более чем 99% ее. Затем это обладающее достаточной для применения в фармацевтических целях оптической чистотой промежуточное соединение переводят на последующей стадии в L-фенилэфрин гидрохлорид 3.
Точный механизм катализируемого родием асимметрического гидрирования до настоящего времени не известен. Сказанное относится прежде всего к взаимодействию N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида 1 с водородом при катализе с использованием каталитической системы, состоящей из [Rh(COD)Cl]2 и (2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидина.
Реакционная схема 1
Далее было установлено, что вопреки существующему подходу, согласно которому при асимметрическом гидрировании для достижения высокого выхода, соответственно высокой степени оптической чистоты, предусматривается использовать катализатор и субстрат - как это очевидно из уровня техники - в соотношении порядка 1:1000, такое соотношение является далеко не оптимальным. В способе по изобретению это соотношение можно резко снизить в 10-100 раз. Несмотря на такое значительное уменьшение количества катализатора, образующийся при асимметрическом гидрировании промежуточный продукт 2 и тем самым в конечном счете L-фенилэфрин удается получать тем не менее с заметно более высоким оптическим выходом по сравнению со способом, известным из уровня техники. Так, например, даже при концентрации катализатора 1:10000 L-фенилэфрин можно получать с оптическим выходом 88% ее. Благодаря снижению количества катализатора существенно упрощается очистка продукта. Кроме того, уменьшение количества катализатора и использование коммерчески доступного N-бензил-N-метил-2-амино-м-гидроксиацетофенона 1 в качестве эдукта позволяют заметно снизить затраты при получении L-фенилэфрина по новому способу.
Помимо этого благодаря новому способу продолжительность реакции асимметрического гидрирования удается снизить по сравнению с уровнем техники практически на 75%. Этот фактор особенно важен, учитывая материально-технические затраты и технику безопасности, предусматриваемые для получения L-фенилэфрина в промышленном масштабе.
К преимуществам предлагаемого в изобретении способа следует отнести и возможность отказаться от необходимости защищать фенольную гидроксильную группу в 2-аминокетоне 1 и тем не менее успешно превращать последний в хиральный 2-аминоспирт 2 путем асимметрического гидрирования с использованием одной из каталитических систем по изобретению.
Кроме того, предлагаемый способ благодаря очистке на стадии бензиладрианола 2 дает возможность получать L-фенилэфрин с высокой степенью чистоты.
Согласно реакционной схеме 1 коммерчески доступный N-бензил-N-метил-2-амино-м-гидроксиацетофенон 1 на первой стадии в присутствии хирального родиевого катализатора подвергают взаимодействию с водородом при давлении в пределах от 10 до 100 бар, предпочтительно от 10 до 50 бар и наиболее предпочтительно при давлении 20 бар с получением N-бензил-L-фенилэфрина гидрохлорида 2.
Согласно изобретению в качестве катализатора применяют [Rh(COD)Cl]2 и хиральный, бидентатный фосфиновый лиганд. Предпочтительно применять в качестве катализатора (2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидин (RR-МССРМ). Получение этого катализатора известно из уровня техники (см. заявки ЕР-А 0251164 и ЕР-А 0336123). Катализатор может быть представлен и в иммобилизованном на полимере виде, например в случае, когда хиральный лиганд (2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидин иммобилизован, например, на полимере через фенильные группы. При этом использование таких иммобилизованных на полимере лигандов не исключает вместе с тем возможности применять и не иммобилизованные на полимере лиганды. В отношении иммобилизованных на полимере катализаторов следует отметить, что они являются предпочтительными, поскольку прежде всего обеспечивают беспроблемную очистку продукта.
Катализатор применяют либо в виде предварительно приготовленного, не содержащего кислород раствора [Rh(COD)Cl]2 и лиганда, либо его готовят in situ из [Rh(COD)Cl]2 и лиганда в присутствии N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида 1 без доступа кислорода в атмосфере защитного газа или в атмосфере водорода.
Молярное соотношение между N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлоридом 1 и катализатором в способе по изобретению составляет от 5000:1 до 100000:1, предпочтительно от 5000:1 до 20000:1 и особенно предпочтительно примерно 10000:1.
Гидрирование осуществляют при температуре реакции в интервале от примерно 40 до 100°С. Предпочтителен интервал температур от 40 до 60°С и особенно предпочтителен интервал от 50 до 55°С.
В качестве реакционной среды могут использоваться как протонные растворители, такие, например, как спирты и/или вода, так и апротонные полярные растворители, такие, например, как простые эфиры и/или амиды, соответственно лактамы и/или их смеси. Ко всем растворителям необязательно можно добавлять воду. В качестве протонных растворителей предпочтительно применять разветвленные или неразветвленные С1-С8алканолы. Особенно предпочтительны низшие спирты, такие как метанол, этанол, н-пропанол и изопропанол либо их смеси. Особенно предпочтительно в качестве реакционной среды использовать метанол, при этом метанол либо другие спирты или растворители необязательно могут содержать воду. В качестве апротонных растворителей пригодны простые полярные эфиры, такие, например, как тетрагидрофуран или диметоксиэтиловый эфир, или амиды, такие, например, как диметилформамид, или лактамы, такие, например, как N-метилпирролидон. Предпочтительно применять такие растворители, которые проявляют минимальную способность к воспламеняемости.
Поскольку эдукт 1 представлен в виде гидрохлорида, его за счет добавления основания in situ сначала переводят в свободное основание с целью повысить растворимость. В качестве основания могут использоваться органические либо неорганические основания как в виде твердых веществ, так и в виде растворов, например в виде водных растворов. В качестве неорганических оснований пригодны способные к щелочной реакции соли щелочных металлов или гидроксиды щелочных металлов. Наряду с гидроксидами щелочных металлов предпочтительно применять гидрокарбонаты либо карбонаты щелочных металлов. Наиболее предпочтительными для этих целей являются NаСО3, K2CO3, LiOH, NaOH, КОН и NaHCO3. Изобретение включает также применение других способных к щелочной реакции веществ, равно как и других веществ, с помощью которых гидрохлорид 1 можно переводить в свободное основание и которые известны из уровня техники.
В качестве органических оснований пригодны прежде всего трет-алкиламины либо трет-алкилариламины. Предпочтительно применять триалкиламины с разветвленными или неразветвленными С1-С5алкильными остатками. В качестве наиболее предпочтительных зарекомендовали себя среди прочих триэтиламин и диизопропилэтиламин. При определенных условиях реакцию можно проводить также в присутствии основных полимеров, содержащих, например, трет-амипофункциональные группы.
Асимметрическое гидрирование осуществляют при давлении в диапазоне от более 1 до максимум 100 бар, предпочтительно от 10 до 50 бар и наиболее предпочтительно при давлении порядка 20 бар.
Реакцию целесообразно проводить в условиях, исключающих доступ кислорода, предпочтительно в атмосфере инертного газа, в частности в атмосфере водорода. При этом отбор водорода для гидрирования не обязательно производить из этой атмосферы, в которой протекает реакция. Водород можно получать также in situ в растворенном виде из соответствующих источников. К таким источникам водорода относятся, например, формиат аммония, муравьиная кислота и другие формиаты, гидразины в присутствии ионов металла, таких как Fe2+/Fe3+, а также иные источники водорода, известные из уровня техники.
Продолжительность реакции по осуществлению асимметрического гидрирования вплоть до ее завершения составляет от 2 до 8 ч, предпочтительно от 4 до 6 ч и наиболее предпочтительно 4 ч.
Превращение N-бензил-L-фенилэфрина 2 в фенилэфрин гидрохлорид 3 осуществляют путем катализируемого палладием, способствующего гидрированию дебензилирования. При этом к используемой при асимметрическом гидрировании реакционной смеси без последующей переработки можно примешивать палладиевый катализатор (метод А).
Согласно этому методу к используемому при асимметрическом гидрировании раствору непосредственно после реакции примешивают активированный уголь и раствор хлорида палладия и гидрируют при давлении от выше 1 до 5 бар, предпочтительно при давлении 2-3 бара. Дальнейшую переработку проводят по методам, известным из литературы. Предпочтительно, однако, сначала из используемого при асимметрическом гидрировании раствора путем простой переработки и кристаллизации выделять бензил-L-фенилэфрин 2 в виде сырого продукта и после этого в растворенном виде вводить в реакцию катализируемого палладием дебензилирования с помощью водорода под давлением (метод Б, см. примеры). Неожиданным образом было установлено, что требуемое по завершении асимметрического гидрирования разделение энантиомеров на стадии N-бензил-L-фенилэфрина 2 удается осуществлять значительно эффективнее и более просто, чем на стадии L-фенилэфрина, соответственно гидрохлорида 3.
Ниже предлагаемый в изобретении способ более подробно поясняется на примерах его осуществления. Для специалистов совершенно очевидно, что эти примеры служат лишь для иллюстрации способа и никоим образом не ограничивают объем изобретения.
Примеры
Приготовление раствора катализатора
В 2 л дегазированного метанола в атмосфере защитного газа вводят 4,3 г дихлоро-бис[(циклоокта-1,5-диен)родия(1)] и 9,4 г RR-MCCPM (2R,4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонил-пирролидина и в течение 30 мин перемешивают при комнатной температуре.
Асимметрическое гидрирование N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида 1 с получением N-бензил-L-фенилэфрина 2
В автоклав объемом 500 л предварительно загружают 80 кг N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорида 1, 0,58 кг триэтиламина и 240 л метанола, дегазируют и смешивают с вышеописанным раствором катализатора. Затем нагревают до 50-55°С и за счет водорода создают давление в 20 бар. По истечении примерно 4 ч гидрирование полностью завершается.
Последующее превращение N-бензил-L-фенилэфрина 2 в L-фенилэфрин гидрохлорид 3
Метод А
К вышеописанному гидрируемому раствору в другой емкости объемом 500 л примешивают 0,8 кг активированного угля и приблизительно 69 г палладия в виде раствора его хлорида и гидрируют при давлении Н2 2 бара. По завершении реакции смесь растворителей отгоняют под вакуумом и смешивают с примерно 80 л воды. После этого с помощью 50%-ного раствора карбоната калия при температуре порядка 65°С устанавливают на рН примерно 9,5 и раствор охлаждают до 10-15°С. Кристаллический осадок отделяют и промывают приблизительно 100 л Н2О. Сырое основание вводят в примерно 120 л воды, с помощью концентрированной соляной кислоты (приблизительно 18 л) рН устанавливают на значение порядка 6,5 и нагревают до 50-60°С. Затем к раствору примешивают активированный уголь (2,4 кг) и фильтруют. После этого рН устанавливают равным 2,5-3,0 и основную часть воды отгоняют под вакуумом. Остаток растворяют сначала в примерно 145 л изопропанола, после чего концентрируют до объема порядка 100 л и охлаждают до 10-15°С. Выпавший в виде кристаллов L-фенилэфрин гидрохлорид 3 отделяют и путем центрифугирования и сушки из него удаляют изопропанол. В результате получают L-фенилэфрин гидрохлорид 3 с выходом около 40 кг (приблизительно 71% в пересчете на N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидро-хлорид 1) и с химической чистотой >99% и оптической чистотой >96% ее.
Метод Б
Вышеописанный гидрируемый раствор отгоняют под вакуумом, затем примешивают 118 л воды, нагревают до 50-60°С и смешивают с активированным углем. После отделения активированного угля добавляют приблизительно 80 л воды и 235 л метанола и нагревают до 35-45°С. После этого к раствору примешивают примерно 57 л концентрированного раствора аммиака и охлаждают до температуры в интервале 15-25°С. Образующийся кристаллический осадок отделяют, промывают примерно 100 л воды и сушат. В результате получают около 57 кг N-бензил-N-метил-2-амино-м-гидроксиацетофенона в виде свободного основания. К этому основанию примешивают примерно 114 л воды, 18 л концентрированной соляной кислоты (рН приблизительно 5,5-6,5) и примерно 57 г палладия (в виде палладия на угле) и гидрируют при 55-65°С и при давлении Н2 2 бара. По завершении реакции (1-2 ч) образовавшийся толуол подвергают азеотропной перегонке с использованием воды. Затем раствор смешивают с активированным углем, фильтруют и устанавливают на рН 3,4-3,6, после чего отгоняют приблизительно 110 л воды. Остаток растворяют в примерно 150 л изопропанола и охлаждают до 15-20°С. Выпавший в виде кристаллов продукт отделяют и сушат. После сушки получают около 38 кг L-фенилэфрина гидрохлорида 3. Маточный раствор отгоняют под вакуумом вплоть до образования остатка, затем растворяют в приблизительно 20 л воды, с помощью концентрированной соляной кислоты устанавливают на рН 6,2-6,5, смешивают с активированным углем, фильтруют и затем устанавливают на рН 3,4-3,6. После этого растворитель удаляют перегонкой, остаток растворяют в примерно 15 л изопропанола и повторно кристаллизуют. После отделения и сушки получают около 4,5 кг L-фенилэфрина гидрохлорида 3. Общий выход последнего составляет приблизительно 42,5 кг (76% в пересчете на N-бензил-N-метил-2-амино-м-гидроксиацетофенонгидрохлорид 1). Химическая чистота продукта превышает 99%, а его оптическая чистота превышает 99% ее.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРИРОВАНИЕ ИМИНОВ | 2009 |
|
RU2476422C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ИСПОЛЬЗУЕМЫХПРИ ПОЛУЧЕНИИИНГИБИТОРОВ NEP | 2011 |
|
RU2573824C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИАРИЛЗАМЕЩЕННОЙ 4-АМИНОМАСЛЯНОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ И ИХ ПРИМЕНЕНИЕ В ИЗГОТОВЛЕНИИ ИНГИБИТОРОВ НЭП | 2007 |
|
RU2469019C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛАМИДИНИОФЕНИЛАЛАНИЛЦИКЛОГЕКСИЛГЛИЦИЛПИРИДИНИОАЛАНИНАМИДОВ | 2001 |
|
RU2250212C2 |
| ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРИМИДИНА И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2015 |
|
RU2703300C2 |
| СПОСОБ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-БИФЕНИЛ-4-ИЛ-2-МЕТИЛПЕНТАНОВОЙ КИСЛОТЫ | 2009 |
|
RU2513521C2 |
| СПОСОБ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-БИФЕНИЛ-4-ИЛ-2-МЕТИЛПЕНТАНОВОЙ КИСЛОТЫ | 2013 |
|
RU2636936C2 |
| СПОСОБ ПОЛУЧЕНИЯ (1R,2R)-3-(3-ДИМЕТИЛАМИНО-1-ЭТИЛ-2-МЕТИЛ-ПРОПИЛ)-ФЕНОЛА | 2007 |
|
RU2466124C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО И ДИАСТЕРЕОМЕРНО ОБОГАЩЕННЫХ ЦИКЛОБУТАНАМИНОВ И -АМИДОВ | 2018 |
|
RU2793738C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОПИОНОВОЙ КИСЛОТЫ | 2010 |
|
RU2544989C2 |
Изобретение относится к более эффективному по сравнению с уровнем техники способу получения L-фенилэфрина гидрохлорида в промышленном масштабе. Способ заключается в том, что прохиральный гидрохлорид N-бензил-N-метил-2-амино-м-гидроксиацетофенона в качестве эдукта на первой стадии подвергают а) асимметрическому гидрированию с использованием каталитической системы, содержащей [Rh(COD)Cl]2 и хиральный бидентатный фосфиновый лиганд, представляющий собой (2R,4R-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидин, в присутствии растворителя, а на второй стадии б) проводят восстановительное дебензилирование с использованием палладия и водорода. В качестве лиганда может быть использован иммобилизованный на полимере (2R, 4R)-4-(дициклогексилфосфин)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидин. При этом стадию а) обычно осуществляют в присутствии основания в интервале температур от 40 до 100°С и при давлении в пределах от выше 1 до 100 бар. 22 з.п. ф-лы.
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| SHINJI SAKURABA et al | |||
| Efficient Asimmetric Hydrogenation of α-Amino Ketone Derivatives.A Highly Enantioselective Synthesis of Phenylephrine,Levamisole,Carnitine and Propanolol | |||
| Chemical Pharmaceutical Society Bull | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2004-10-10—Публикация
2000-01-11—Подача