Настоящее изобретение относится к нейротрофическому фактору, в частности к клонированию и экспрессии нового члена семейства нейротрофических факторов GDNF, получившего название "эновин" (EVN).
Предпосылки изобретения
Нейротрофические факторы участвуют в дифференцировке, развитии и обеспечении жизнеспособности нейронов. Эти белки предотвращают дегенерацию и стимулируют выживание разных типов нервных клеток, благодаря чему они являются потенциальными лекарственными средствами для лечения нейродегенеративных заболеваний. Нейротрофический фактор, выделенный из линии глиальных клеток (GDNF), был первым членом постоянно увеличивающегося подсемейства нейротрофических факторов, отличающихся в структурном отношении от нейротрофинов. GDNF является трансформирующим фактором роста β (TGF-β), входящим в суперсемейство факторов роста, характеризующихся специфической структурой семи высококонсервативных остатков цистеина в аминокислотной последовательности (Kingsley, 1994). GDNF был первоначально выделен при помощи метода на основе способности этого фактора сохранять жизнеспособность и функциональность допаминергических нейронов желудочка среднего мозга эмбриона in vitro (Lin et al., 1993). Другие типы нервных клеток в центральной (CNS) или периферической (PNS) нервной системе также реагируют на действие GDNF, направленное на сохранение их жизнеспособности (Henderson et al., 1994, Buj-Bello et al., 1995, Mount et al., 1995, Oppenheim et al., 1995). Клетки продуцируют GDNF в неактивной проформе, которая специфически расщепляется на сайте узнавания фурина RXXR с образованием активного (зрелого) GDNF (Lin et al., 1993). Экзогенное введение GDNF оказывает сильное нейрозащитное действие в животных моделях болезни Паркинсона, общего нейродегенеративного нарушения, характеризующегося утратой до 70% допаминергических клеток в черном веществе головного мозга (Beck et al., 1995, Tomac et al., 1995, Gash et al., 1996, Choi-Lundberg et al., 1997, Bilang-Bleuel et al., 1997).
Недавно были обнаружены новые нейротрофические факторы семейства GDNF. Нейротурин (NTN) выделен из кондиционированной среды, содержащей клетки яичника китайского хомячка (СНО), при помощи метода на основе способности этого фактора стимулировать жизнеспособность симпатических нейронов в культуре (Kotzbauer et al., 1996). Белок зрелого NTN на 57% гомологичен зрелому GDNF. Персефин (PSP) обнаружен в результате клонирования с использованием вырожденной затравки для полимеразной реакции синтеза цепи (PCR) с геномной ДНК в качестве матрицы. Зрелый PSP подобно зрелому GDNF способствует выживанию допаминергических нейронов желудочка среднего мозга и двигательных нейронов в культуре (Milbrandt et al., 1998). Гомология белка зрелого PSP со зрелым GDNF и NTN составляет приблизительно 50%. Артемин (ARTN) был обнаружен в результате скрининга базы данных ДНК и является фактором выживания сенсорных и симпатических нейронов в культуре (Baloh et al., 1998b).
GDNF, NTN, PSP и ARTN требуют наличия гетеродимерного рецепторного комплекса для осуществления внутриклеточной трансдукции сигнала в нижней области. GDNF связывается с субъединицей альфа 1 семейства рецепторов GDNF (GFRα-1; GFRα; Комитет по номенклатуре, 1997), мембранным белком, связанным гликозилфосфатидилинозитолом (гликозил-PtdIns) (Jing et al., 1996, Treanor et al., 1996, Sanicola et al., 1997). Комплекс GDNF/GFRα-1 затем связывается и активирует протоонкоген cRET, мембраносвязанную тирозинкиназу (Durbec et al., 1996, Trupp et al., 1996), что вызывает фосфорилирование остатков тирозина в cRET и последующую активацию путей трансдукции сигнала в нижней области (Worby et al., 1996). Были исследованы несколько других членов семейства GFRα лигандсвязывающих рецепторов (Baloh et al., 1997, Sanicola et al., 1997, Klein et al., 1997, Buj-Bello et al., 1997, Suvanto et al., 1997). GFRα-2 и GFRα-3 (Jing et al., 1997, Masure et al., 1998, Woby et al., 1998, Naveilham et al., 1998, Baloh et al., 1998a) были идентифицированы целым рядом научно-исследовательских групп. GFRα-1 и GFRα-2 широко экспрессированы почти во всех тканях, и их экспрессию можно регулировать (Sanicola et al., 1997, Widenfalk et al., 1997).
GFRα-3 отсутствует в развивающейся или зрелой центральной нервной системе, но широко экспрессирован в нескольких развивающихся и зрелых сенсорных и симпатических ганглиях периферической нервной системы (Widenfalk et al., 1998, Naveilhan et al., 1998, Baloh et al., 1998a). Четвертый член этого семейства, GFRα-4, был клонирован из кДНК цыплят (Thompson et al., 1998). GFRa-l является предпочтительным рецептором для GDNF, в то время как GFRα-2 предпочтительно связывает NTN (Jing et al., 1996, Treanor et al., 1996, Klein et al., 1997). GFRα-4 цыплят образует функциональный рецепторный комплекс для PSP в сочетании с cRET (Enokido et al., 1998). Установлено, что клетки, экспрессирующие как GFRα-3, так и cRET, не реагируют на GDNF, NTN или PSP (Worby et al., 1998, Baloh et al., 1998a). Недавно установлено, что ART передает сигнал при помощи cRET, используя GFRα-3 в качестве предпочтительного лигандсвязывающего рецептора (Baloh et al., 1998b). Сообщение между нейротрофическими факторами и рецепторами GFRα возможно in vitro, так как GDNF может связываться с GFRα-2 или GFRα-3 в присутствии cRET (Sanicola et al., 1997, Trupp et al., 1998) и NTN может связываться с GFRα-1 с низкой степенью сродства (Klein et al., 1997). Коротко говоря, GDNF, NTN, PSP и ART являются частью нейротрофической сигнальной системы, при помощи которой разные лигандсвязывающие субъединицы (GFRα-1 - GFRα-4) могут взаимодействовать с субъединицей тирозинкиназы (cRET). Физиологическая значимость этих открытий, сделанных in vitro, недавно была продемонстрирована в сенсационных исследованиях, выполненных на генетическом уровне (Rosenthal, 1999), которые совершенно четко показывают, что GDNF взаимодействует с GFRα-1 in vivo, в то время как NTN является предпочтительным лигандом для GFRα-2.
Авторы настоящего изобретения идентифицировали, клонировали, экспрессировали, локализовали в хромосоме и исследовали эновин (EVN), четвертый член семейства GDNF. Представление о белке зрелого EVN было значительно расширено благодаря открытию разных функциональных и нефункциональных сплайсированных вариантов мРНК. Кроме того, авторы этого изобретения получили данные об экспрессии, связывании EVN с GFRα-3, влиянии in vitro EVN на рост аксонов и защите от вызываемой таксолом нейротоксичности в дифференцированных стауроспорином культурах клеток нейробластомы человека SH-SY5Y.
Сущность изобретения
Объектами настоящего изобретения являются молекула нуклеиновой кислоты, кодирующая новый нейротрофический фактор роста человека "эновин", экспрессирующий вектор, содержащий указанную молекулу нуклеиновой кислоты, клетка-хозяин, трансформированная указанным вектором, нейротрофический фактор роста, кодированный указанной молекулой нуклеиновой кислоты, выделенный эновин, соединения, являющиеся агонистами или антагонистами эновина, и фармацевтические композиции, содержащие эту нуклеиновую кислоту или белок эновина либо их агонисты или антагонисты.
Подробное описание изобретения
Первым объектом настоящего изобретения является молекула нуклеиновой кислоты, кодирующая нейротрофический фактор роста человека, именуемый здесь эновином, который имеет аминокислотную последовательность, показанную на фиг.21, или кодирующая функциональный эквивалент, производное или биологический предшественник указанного фактора роста. Указанная молекула нуклеиновой кислоты предпочтительно является ДНК и еще более предпочтительно молекулой кДНК.
Нуклеиновая кислота по этому изобретению предпочтительно имеет последовательность, соответствующую положениям 81-419 в последовательности, показанной на фиг.1, более предпочтительно положениям 81-422 и еще более предпочтительно непроцессированную последовательность, показанную на фиг.1.
Считается, что молекула нуклеиновой кислоты, соответствующая положениям 81-419, кодирует последовательность белка зрелого эновина после процессирования проформы этого белка на сайте процессинга RXXR, имеющемся в устойчивой проформе указанного белка эновина.
Это изобретение относится также к антисмысловой молекуле, способной гибридизовать с любыми последовательностями нуклеиновых кислот по этому изобретению в очень строгих условиях, которые должны быть хорошо известны специалистам в этой области.
Строгие условия гибридизации в используемом здесь значении означают условия, в которых полинуклеиновые кислоты являются устойчивыми. Стабильность гибридов выражается в температуре плавления (Tm) гибридов. Tm можно приблизительно представить формулой
81,5°С-16,6(log10[Na+]+0,41(%G&C)-600/l
где l означает длину гибридов в нуклеотидах. Tm понижается примерно на 1-1,5°С с каждым 1% уменьшения гомологии последовательностей.
Молекулу нуклеиновой кислоты по этому изобретению можно успешно использовать для экспрессии нейротрофического фактора роста человека по этому изобретению в клетке-хозяине или подобном микроорганизме с использованием приемлемого экспрессирующего вектора.
Экспрессирующий вектор по этому изобретению представляет собой вектор, способный экспрессировать ДНК, оперативно связанную с регуляторными последовательностями, такими как промоторные области, которые способны экспрессировать такие фрагменты ДНК.
Необходимыми для экспрессии регуляторными элементами являются промоторные последовательности, которые связывают полимеразу РНК и последовательности, инициирующие транскрипцию, предназначенные для связывания рибосом. Например, бактериальный экспрессирующий вектор может содержать такой промотор, как lac-промотор, последовательность Shine-Dalgarno для инициации транскрипции и инициирующий кодон AUG. Аналогичным образом, эукариотический экспрессирующий вектор может содержать гетерологичный или гомологичный промотор для полимеразы II РНК, сигнал полиаденилирования в нижней области, инициирующий кодон AUG и терминирующий кодон для отделения рибосомы. Такие векторы можно приобрести коммерческим путем или собрать из последовательностей при помощи методов, хорошо известных в этой области.
Таким образом, экспрессирующий вектор является рекомбинантной векторной ДНК или РНК, такой как плазмида, фаг, рекомбинантный вирус или другой вектор, который при введении в приемлемую клетку-хозяина вызывает экспрессию фрагментов ДНК или РНК. Приемлемые экспрессирующие векторы хорошо известны специалистам в этой области и включают векторы, реплицирующиеся в эукариотических и/или прокариотических клетках, векторы, которые остаются эписомными, или векторы, которые внедряются в геном клетки-хозяина.
Антисмысловую молекулу, способную гибридизовать с нуклеиновой кислотой по этому изобретению, можно использовать в качестве зонда, лекарственного средства или в фармацевтической композиции.
Молекулы нуклеиновой кислоты по этому изобретению можно ввести в векторы, имеющие антисмысловую ориентацию, для продуцирования антисмысловой РНК. Антисмысловую РНК или другие антисмысловые нуклеиновые кислоты можно продуцировать синтетическими средствами.
Другим объектом этого изобретения является клетка-хозяин, трансформированная, трансфицированная или инфицированная экспрессирующим вектором по этому изобретению, которая предпочтительно является эукариотической клеткой и более предпочтительно клеткой млекопитающего.
Введение клонированной ДНК в приемлемый экспрессирующий вектор с целью последующей трансформации указанной клетки и отбора трансформированных клеток хорошо известно в этой области и описано в справочнике Sambrook et al. (1989), Molecular Cloning, A Laboratory Manual, Cold Spring Harbour Laboratory Press.
Другим объектом настоящего изобретения является молекула нуклеиновой кислоты, имеющая по крайней мере 15 нуклеотидов, предпочтительно от 15 до 50 нуклеотидов.
Эти последовательности можно успешно использовать в качестве зондов или затравок для инициации репликации или тому подобного. Такие молекулы нуклеиновой кислоты можно получить методами, хорошо известными в этой области, такими как метод рекомбинантных ДНК или метод синтеза. Их можно также использовать в диагностических наборах, устройствах или тому подобных приспособлениях для обнаружения нуклеиновой кислоты по этому изобретению. Эти испытания обычно включают контактирование зонда с образцом в условиях гибридизации и обнаружение любого дуплекса, образующегося между зондом и любой нуклеиновой кислотой в образце.
В соответствии с настоящим изобретением эти зонды могут быть связаны с твердым носителем. Они предпочтительно находятся на матрице, поэтому несколько зондов можно одновременно гибридизовать с одним биологическим образцом. Эти зонды можно наносить на матрицу или синтезировать in situ на самой матрице. (См. Lockhart et al., Nature Biotechnology, vol. 14, December 1996 "Expression monitoring by hybridisation into high density oligonucleotide arrays". Одна матрица может содержать более 100, 500 и даже 1000 разных зондов в разных местах.
Молекулы нуклеиновой кислоты по этому изобретению можно также продуцировать при помощи методов рекомбинантных ДНК или методов синтеза, таких как, например, механизмы клонирования при помощи полимеразной реакции синтеза цепи (PCR), которые обычно включают получение двух затравок, содержащих примерно 10-50 нуклеотидов в области гена, предназначенного для клонирования, контактирование этих затравок с мРНК, кДНК или геномной ДНК из клетки человека, выполнение полимеразной реакции синтеза цепи в условиях, обеспечивающих амплификацию целевой области, выделение амплифицированной области или фрагмента и получение амплифицированной ДНК. Такие методы хорошо известны в этой области и описаны в справочнике Sambrook et al. (Molecular Cloning: a Laboratory Manual, 1989).
Нуклеиновые кислоты или олигонуклеотиды по этому изобретению могут иметь метку, облегчающую их обнаружение. Приемлемыми метками являются радиоизотопы, такие как 32Р или 35S, ферментативные метки или другие белковые метки, в частности биотиновые или флуоресцентные маркеры. Такие метки можно вводить в нуклеиновые кислоты или олигонуклеотиды по этому изобретению и детектировать при помощи известных методов.
Аллельные варианты или полиморфизмы молекулы ДНК человека по этому изобретению можно успешно идентифицировать, например, путем зондирования библиотеки кДНК или геномной библиотеки, созданной с привлечением целого ряда субъектов, например разных популяций. Кроме того, нуклеиновые кислоты и зонды по этому изобретению можно использовать для секвенирования геномной ДНК у пациентов методами, хорошо известными в этой области, такими как метод терминации дидезоксицепи Сангера, при помощи которого можно успешно выявить любую предрасположенность пациента к конкретным нарушениям, обусловленным фактором роста по этому изобретению.
Другим объектом настоящего изобретения является трансгенная клетка, ткань или организм, содержащие трансген, способный экспрессировать нейротрофический фактор человека "эновин" по этому изобретению.
Термин "трансген, способный экспрессировать" в используемом здесь значении означает любую приемлемую последовательность нуклеиновых кислот, которая вызывает экспрессию нейротрофического фактора, выполняющего ту же функцию и/или обладающего той же активностью, что и нейротрофический фактор по этому изобретению. Этот трансген может содержать, например, геномную нуклеиновую кислоту, выделенную из клеток человека, или синтетическую нуклеиновую кислоту, включая кДНК, интегрированную в хромосому или внехромосомное пространство.
Трансген предпочтительно имеет вектор по этому изобретению, который содержит молекулу нуклеиновой кислоты, кодирующую указанный нейротрофический фактор, или функциональный фрагмент указанной молекулы нуклеиновой кислоты. "Функциональный фрагмент" указанной нуклеиновой кислоты означает фрагмент гена или кДНК, кодирующий указанный нейротрофический фактор или его функциональный эквивалент, который может быть экспрессирован с целью продуцирования функционального нейротрофического фактора роста по этому изобретению. Таким образом, фрагменты нейротрофического фактора роста по этому изобретению, которые соответствуют специфическим аминокислотным остаткам, взаимодействующим с соответствующим рецептором, также являются объектом настоящего изобретения и могут служить в качестве агонистов, активирующих соответствующий рецептор фактора роста по этому изобретению, что позволяет выявить его постоянное влияние на рост и жизнеспособность клеток. Объектом этого изобретения являются также дифференциально сплайсированные изоформы и сайты инициации транскрипции нуклеиновых кислот по этому изобретению.
В соответствии с настоящим изобретением указанная нуклеиновая кислота включает не только идентичную нуклеиновую кислоту, но и нуклеиновую кислоту с любыми незначительными изменениями оснований, включающими, в частности, замену оснований, ведущую к образованию тождественного кодона (другого кодона, определяющего тот же аминокислотный остаток), благодаря вырожденному коду в заменяемых консервативных аминокислотах. Термин молекула нуклеиновой кислоты означает также комплементарную последовательность к любой одноцепочечной последовательности, полученную в результате замены оснований.
Другим объектом этого изобретения является выделенный нейротрофический фактор роста человека, кодированный вышеуказанной молекулой нуклеиновой кислоты. Этот фактор роста предпочтительно содержит аминокислотную последовательность, соответствующую положениям 27-139, аминокислотной последовательности, показанной на фиг.1, ее функциональный эквивалент, производное или биологический предшественник.
Термин "функциональный эквивалент" в используемом здесь значении означает фактор роста, который обладает всеми свойствами и функциональными признаками, характериными для фактора роста, именуемого эновином. "Производное" эновина в используемом здесь значении означает полипептид, в котором некоторые аминокислоты изменены, удалены или заменены другими аминокислотами, при этом указанный полипептид сохраняет биологическую активность эновина и/или может взаимодействовать с антителами, полученными с использованием эновина по этому изобретению в качестве стимулирующего антигена.
В объем настоящего изобретения входят гибридные и модифицированные формы эновина, в том числе слитые белки и их фрагменты. Гибридные и модифицированные формы получают, модифицируя или заменяя некоторые аминокислоты, например, при помощи точковой мутации, причем указанные модификации все же позволяют получить белок, который сохраняет биологическую активность эновина по этому изобретению. Специфические последовательности нуклеиновых кислот можно изменить с получением фактора роста, обладающего такими же или практически такими же свойствами, что и эновин.
Как известно в этой области, многие белки продуцируются in vivo при помощи (пре)сигнальной последовательности у N-конца белка. Кроме того, такие белки могут содержать еще одну пропоследовательность, которая является устойчивым предшественником зрелого белка. Такие пре- и пропоследовательности обычно не нужны для достижения биологической активности. Молекула эновина по этому изобретению содержит не только непроцессированную последовательность, показанную на фиг.21, но и последовательность, занимающую положение 27-139, которая соответствует протеолитическому сайту процессинга RXXR, имеющемуся в факторах роста этого типа, и представляет собой зрелую последовательность эновина.
К указанным белковым, полипептидным или аминокислотным последовательностям по этому изобретению относятся не только идентичные аминокислотные последовательности, но и их изомеры, а также последовательности с незначительным изменением аминокислот, полученные из природной аминокислотной последовательности, допускающей замену консервативных аминокислот (замена аминокислотой, родственной ее боковым цепям). В объем этого изобретения входят также аминокислотные последовательности, которые отличаются от природной аминокислоты, но позволяют получить полипептид, который в иммунологическом отношении идентичен или подобен полипептиду, кодированному природной последовательностью.
Белки или полипептиды по этому изобретению далее включают варианты таких последовательностей, в том числе природные аллельные варианты, которые по существу гомологичны указанным белкам или полипептидам. В этом описании изобретения термин "существенная гомология" относится к последовательности, которая обладает по крайней мере 70%, предпочтительно 80%, 90% или 95% гомологией аминокислот с белками или полипептидами, кодированными молекулами нуклеиновых кислот по этому изобретению.
Нейротрофические факторы роста, экспрессированные клетками-хозяевами по этому изобретению, также входят в объем настоящего изобретения.
Настоящее изобретение далее относится к ингибированию нейротрофического фактора роста по этому изобретению in vivo методом антисмысловых молекул. Метод антисмысловых молекул можно использовать для контроля экспрессии генов путем создания тройной спирали или антисмысловой ДНК или РНК, причем оба эти метода основаны на связывании полинуклеотида с ДНК или РНК. Например, часть последовательности ДНК, кодирующей зрелый белок по настоящему изобретению, используют для конструирования олигонуклеотида антисмысловой РНК длиной от 10 до 50 пар оснований. Олигонуклеотид ДНК конструируют так, чтобы он был комплементарен области гена, участвующего в транскрипции (тройная спираль - см. Lee et al. Nucl. Acids. Res., 6:3073 (1979); Cooney et al., Science, 241:456 (1988); and Dervan et al., Science, 251:1360 (1991), что позволяет предотвратить транскрипцию и продуцирование эновина. Олигонуклеотид антисмысловой РНК гибридизует с мРНК in vivo и блокирует трансляцию молекулы мРНК с образованием эновина.
Благодаря сходству последовательностей у описанного фактора роста и ранее идентифицированных факторов роста семейства GDNF, считается, что эновин также способен стимулировать жизнеспособность и рост клеток и устранять нарушения, возникающие вследствие дефектов функционирования или экспрессии указанного нейротрофического фактора.
Поэтому молекулы нуклеиновых кислот или нейротрофический фактор по этому изобретению можно использовать для лечения или профилактики нарушений нервной системы у нуждающегося субъекта путем введения указанному субъекту молекулы нуклеиновой кислоты или фактора роста по этому изобретению в достаточной концентрации для ослабления симптомов указанного нарушения. Таким образом, молекулы нуклеиновых кислот по этому изобретению можно использовать для сохранения и улучшения жизнеспособности нервных клеток, а также для лечения заболеваний нервной системы или нейродегенеративных нарушений, включая болезнь Паркинсона, болезнь Альцгеймера, периферическую невропатию, боковой амиотрофический склероз, травму периферической и центральной нервной системы или поражение нейротоксинами.
Нейротрофический фактор роста по этому изобретению оказывает нейротрофическое или нейрозащитное действие на нервные клетки или популяции клеток, в частности на нервные клетки или популяции клеток, подвержденные апоптозу. Нуклеиновая кислота или фактор роста, именуемый эновином, по этому изобретению можно дополнительно использовать для лечения нейродегенеративных нарушений, таких как инсульт, болезнь Хантингтона, периферическая невропатия, острое поражение мозга, опухоли нервной системы, рассеянный склероз, боковой амиотрофический склероз, травма периферической нервной системы, поражение нейротоксинами, множественная неоплазия эндокринной системы, врожденная болезнь Гиршспрунга, прионассоциированные болезни, болезнь Крейтцфельда-Якоба, путем введения нуждающемуся субъекту указанной нуклеиновой кислоты или эновина в достаточной концентрации для ослабления или профилактики симптомов описанных здесь заболеваний нервной системы.
Кроме того, как подробно описано в нижеследующем примере, эновин ускоряет восполнение дефицита сенсорных нейронов, что предполагает возможность его использования для лечения или облегчения болевых синдромов, обусловленных нейрогенными нарушениями периферической или центральной нервной системы, ревматических/воспалительных заболеваний, а также нарушений проводимости путем введения эновина нуждающемуся субъекту в достаточной концентрации для ослабления или профилактики симптомов этих нарушений.
Альтернативный метод лечения вышеописанных нарушений нервной системы включает имплантацию в клетки субъекта, экспрессирующие нейротрофический фактор роста человека по этому изобретению, такие как описанные здесь трансгенные клетки.
Молекулы нуклеиновых кислот и нейротрофический фактор роста по этому изобретению могут также входить в состав фармацевтической композиции вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
Антитела к нейротрофическому фактору по настоящему изобретению можно получить методами, хорошо известными в этой области. Например, поликлональные антитела можно получить, инокулируя животное-хозяина, такое как мышь, фактором роста или его эпитопом, что дает иммунную сыворотку. Моноклональные антитела можно получить известными методами, в частности такими, которые описаны Kohler R. and Milstein С., Nature (1975) 256, 495-497.
Антитела по этому изобретению можно успешно использовать при осуществлении метода обнаружения фактора роста по этому изобретению, который включает взаимодействие антитела с образцом и идентификацию белка, связанного с указанным антителом. В объем этого изобретения входит набор для выполнения указанного метода, который включает антитело по этому изобретению и устройство для осуществления взаимодействия антитела с указанным образцом.
В объем настоящего изобретения входит также набор или устройство для обнаружения в образце нейротрофического фактора роста по этому изобретению, который включает вышеописанное антитело и приспособление для осуществления взаимодействия указанного антитела с указанным образцом.
Белки, взаимодействующие с нейротрофическим фактором по этому изобретению, например соответствующий клеточный рецептор, можно идентифицировать путем исследования белок-белкового взаимодействия, используя систему с двумя гибридными векторами, которая хорошо известна специалистам в области молекулярной биологии (Fields & Song, Nature 340:245, 1989). В основе этого метода лежит функциональное восстановление in vivo фактора транскрипции, активирующего репортерный ген. В частности, этот метод включает получение соответствующей клетки-хозяина с векторной ДНК, содержащей репортерный ген, под контролем промотора, регулируемого фактором транскрипции, имеющим ДНК-связывающий домен и активирующий домен, экспрессирующий в клетке-хозяине последовательность первой гибридной ДНК, кодирующей первое слияние фрагмента или всей последовательности нуклеиновой кислоты по этому изобретению, и указанный ДНК-связывающий домен или активирующий домен фактора транскрипции, экспрессирующий в клетке-хозяине по крайней мере одну последовательность второй гидрибной ДНК, имеющуюся в библиотеке или подобном хранилище, кодирующую предполагаемые исследуемые связывающие белки вместе с ДНК-связывающим или активирующим доменом фактора транскрипции, который не был включен в первое слияние; обнаружение связывания исследуемых белков с белком по этому изобретению путем выявления продукта репортерного гена в клетке-хозяине; необязательное выделение последовательностей второй гидрибной ДНК, кодирующей связывающий белок.
Примером осуществления такого метода является использование белка GAL4 в дрожжах. GAL4 является транскрипционным активатором галактозного обмена в дрожжах и имеет отдельный домен для связывания с активаторами вверху от генов, регулирующих галактозный обмен, а также связывающий белок домен. Можно сконструировать нуклеотидные векторы, один из которых содержит нуклеотидные остатки, кодирующие ДНК-связывающий домен GAL4. Эти остатки связывающего домена могут быть слиты с образованием известной кодирующей белок последовательности, такой как, например, нуклеиновые кислоты по этому изобретению. Другой вектор содержит остатки, кодирующие связывающий белок домен GAL4. В результате слияния этих остатков получают остатки, кодирующие испытуемый белок, предпочтительно на пути трансдукции сигнала рассматриваемого позвоночного животного. Любое взаимодействие между нейротрофическим фактором, кодированным нуклеиновой кислотой по этому изобретению, и испытуемым белком активирует транскрипцию ре-портерной молекулы в дрожжевой клетке GAL-4 с транскрипционной недостаточностью, в которой векторы были трансформированы. Репортерную молекулу, такую как β-галактозидаза, предпочтительно активируют путем восстановления транскрипции генов галактозного обмена в дрожжах.
Авторы настоящего изобретения установили, что рецептором эновина является GFRα3. Поэтому можно выполнять анализы, позволяющие выявить агонистов или антагонистов эновина. Этот анализ применим также к другим нейротрофическим факторам роста и соответствующим им рецепторам. Идентифицированные соединения можно использовать для лечения или профилактики таких заболеваний, как болезнь Паркинсона, болезнь Альцгеймера, нейродегенеративные нарушения, обусловленные увеличением последовательностей полиглутамина, такие как болезнь Хантингтона, периферическая невропатия, острое поражение головного мозга, опухоли нервной системы, рассеянный склероз, боковой амиотрофический склероз, травма периферической нервной системы, поражение нейротоксинами, множественная неоплазия эндокринной системы, врожденная болезнь Гиршспрунга, прионассоциированные болезни, болезнь Крейтцфельда-Якоба, инсульт, болевые синдромы с выраженными нейрогенными нарушениями периферической или центральной нервной системы, ревматические/воспалительные заболевания, а также нарушения проводимости, путем введения нуждающемуся субъекту указанного агониста или антагониста в достаточной концентрации для профилактики или лечения указанных заболеваний нервной системы. Такие соединения могут также входить в состав фармацевтических композиций вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
Агонисты или антагонисты фактора роста (такого как, например, эновин) можно идентифицировать в соответствии с одним вариантом осуществления изобретения, осуществляя контактирование клеточной ткани или организма, экспрессирующего приемлемый рецептор и cRET, с испытуемым соединением в присутствии данного фактора роста, и сравнивая степени активизации RET в указанной клетке, ткани или организме с контрольным образцом, который не подвергали контактированию с указанным испытуемым соединением.
Альтернативный способ осуществления этого изобретения относится к способу идентификации агонистов или антагонистов нейротрофического фактора роста, который включает контактирование клеточной ткани или организма, экспрессирующего соответствующий вектор указанного фактора роста и cRET, с испытуемым соединением в присутствии указанного фактора роста, измерение степени активации сигнальной киназы на пути трансдукции сигнала, составляющим элементом которого является указанный рецептор, после добавления антитела, специфичного к указанной сигнальной киназе, конъюгированной с репортерной молекулой, и сравнение с клеточной тканью или организмом, который не подвергали контактированию с указанным соединением.
Другим объектом этого изобретения является использование соединения, которое, как установлено, является антагонистом по этому изобретению, для изготовления лекарственного средства, предназначенного для лечения заболеваний желудочно-кишечного тракта или нарушений, обусловленных повышенной перистальтикой кишечника.
Соединения, идентифицированные при выполнении анализов по настоящему изобретению, можно успешно использовать для усиления моторики желудочно-кишечного тракта, поэтому они могут быть полезны для лечения заболеваний, обусловленных затрудненным или нарушенным прохождением содержимого по желудочно-кишечному тракту.
Кроме того, такие соединения можно эффективно использовать для лечения теплокровных животных, включая человека, страдающих затрудненным или нарушенным опорожнением желудка и в более широком смысле затрудненным или нарушенным прохождением содержимого по желудочно-кишечному тракту. Таким образом, настоящее изобретение относится к способу лечения таких заболеваний, как гастроэзофагальный рефлюкс, диспепсия, гастропарез, послеоперационная непроходимость кишечника и псевдонепроходимость кишечника.
Диспепсия означает нарушение функции пищеварения, которое может сопровождаться симптомом первичной дисфункции желудочно-кишечного тракта, в частности дисфункции желудочно-кишечного тракта, обусловленной повышенным мышечным тонусом, или осложнением, вызванным другими нарушениями, такими как аппендицит, заболевания желчного пузыря или неправильное питание. Симптомами диспепсии являются, например, отсутствие аппетита, ощущение тяжести, быстрое насыщение, тошнота, рвота и вздутие живота.
Гастропарез может возникнуть в результате неправильного функционирования желудка или в виде осложения вследствие таких заболеваний, как сахарный диабет, прогрессирующий системный склероз, анорексия, повышенная нервная возбудимость и миотоническая дистрофия.
Послеоперационная непроходимость кишечника означает закупорку или кинетическую недостаточность перистальтики кишечника вследствие нарушения мышечного тонуса после хирургического вмешательства.
Псевдонепроходимость кишечника означает состояние, характеризующееся запором, коликами и рвотой при отсутствии физической непроходимости.
Соединения по настоящему изобретению можно использовать для устранения фактической причины заболевания или ослабления его симптомов.
Кроме того, некоторые соединения, являющиеся стимуляторами кинетической активности толстого кишечника, можно использовать для нормализации или улучшения прохождения содержимого через кишечник у субъектов с симптомами нарушения перистальтики, например уменьшения перистальтики только тонкого и толстого кишечника или в сочетании с медленным опорожнением желудка.
С учетом способности соединений по настоящему изобретению усиливать кинетическую активность толстого кишечника объектом этого изобретения является способ лечения теплокровных животных, включая человека, страдающих нарушениями перистальтики кишечника, такими как запоры, псевдонепроходимость, атония кишечника, послеоперационная атония кишечника, синдром раздраженной толстой кишки (IBS) и вызванное лекарственными средствами медленное прохождение содержимого через кишечник.
Соединения, являющиеся антагонистами, как это установлено в результате выполнения анализов по настоящему изобретению, можно также использовать для лечения и профилактики заболеваний желудочно-кишечного тракта, возникающих вследствие повышенной перистальтики кишечника, таких как диарея (включая секреторную диарею, бактериальную диарею, холерную диарею, диарею путешественников и психогенную диарею), болезнь Крона, слизистый колит, синдром раздраженной толстой кишки (IBS), диарея, вызванная синдромом раздраженной толстой кишки, повышенная чувствительность желудочно-кишечного тракта.
Учитывая полезность соединений по этому изобретению, можно сделать вывод о том, что настоящее изобретение относится также к лечению теплокровных животных, включая человека, страдающих заболеваниями желудочно-кишечного тракта, такими как синдром раздраженной толстой кишки (IBS), в частности диарея, обусловленная IBS. Кроме того, это изобретение относится к способу облегчения симптомов у нуждающихся субъектов, страдающих такими заболеваниями, как синдром раздраженной толстой кишки (IBS), диарея, вызванная синдромом раздраженной толстой кишки, повышенная чувствительность кишечника, и болевой синдром, обусловленный повышенной чувствительностью желудочно-кишечного тракта.
Соединения по настоящему изобретению можно также использовать для лечения других нарушений желудочно-кишечного тракта, например, обусловленных моторикой верхнего отдела кишечника, а также в качестве противорвотных средств, цитотоксических средств и противорвотных средств при облучении.
К воспалительным заболеваниям кишечника относятся, например, неспецифический язвенный колит, болезнь Крона и тому подобные.
Другим объектом этого изобретения является способ лечения нарушения, обусловленного экспрессией эновина по настоящему изобретению, путем введения нуждающемуся субъекту антисмысловой молекулы или ее антагониста в достаточном количестве для устранения или облегчения симптомов указанного нарушения.
Нарушения, обусловленные инактивацией или подавлением экспрессии эновина, можно также успешно лечить введением нуждающемуся субъекту соединения, являющегося агонистом эновина, в достаточном количестве для ослабления или устранения симптомов этого нарушения.
Другим объектом этого изобретения является способ получения фармацевтического препарата для лечения болезней, обусловленных нейротрофическим фактором роста человека "эновином", причем указанный способ включает выбор приемлемого соединения, являющегося агонистом или антагонистом эновина по этому изобретению, получение указанного соединения в необходимых количествах и введение этого соединения в фармацевтически приемлемый носитель.
Как будет более подробно описано в нижеследующих примерах, эновин позволяет успешно восстанавливать недостаток сенсорных нейронов, образующийся под воздействием таксола. Поэтому эновин способствует устранению болевых симптомов в случае нейрогенных нарушений периферической и центральной нервной системы, ревматических заболеваний, а также нарушений проводимости, и может модулировать процессы, происходящие в сенсорных нейронах, в результате чрескожного, местного и центрального применения (такого как эпидуральное, внутриоболочечное, ICV, внутрь сплетения, внутрь нервной клетки), обеспечиваемого пероральным, ректальным и системным введением. Поэтому аналогично другим нарушениям, обусловленным эновином, эти заболевания можно лечить и даже предотвращать путем введения антисмысловой молекулы, нуклеиновой кислоты, белка эновина, фармацевтической композиции или соединения, являющегося агонистом или антагонистом, в зависимости от потребности, по этому изобретению в достаточных количествах для облегчения или устранения симптомов указанного заболевания.
Лечебные или фармацевтические композиции по настоящему изобретению можно вводить любым приемлемым способом, известным в этой области, включая, например, внутривенное, подкожное, внутримышечное, чрескожное, внутриоболочечное или интрацеребральное введение или введение в клетки методом ех vivo. Введение может быть быстрым в виде инъекции или в течение достаточно продолжительного времени в виде медленного вливания или препарата пролонгированного действия. Для лечения тканей в центральной нервной системе соединение по этому изобретению можно вводить путем инъекции или вливания в цереброспинальную жидкость (CSF).
Эновин может быть также связан или конъюгирован со средствами, обладающими необходимыми фармацевтическими или фармакодинамическими свойствами. Например, его можно соединить с любым веществом, которое, как известно, стимулирует проникновение или перенос через гемато-энцефалический барьер, таким как антитело к рецептору трансферина, и вводить путем внутривенной инъекции.
Эновин, антисмысловые молекулы или соединения, являющиеся агонистами или антагонистами эновина по этому изобретению, можно использовать в виде фармацевтической композиции, которая может быть получена методами, хорошо известными в этой области. Предпочтительные композиции содержат фармацевтически приемлемый носитель, разбавитель или наполнитель, такой как, например, физиологический раствор. Можно также использовать другие фармацевтически приемлемые носители, в том числе нетоксичные соли, стерильную воду или тому подобные. В состав композиции может также входить приемлемый буфер, позволяющий лиофилизовать данную композицию и хранить в стерильных условиях до восстановления путем добавления стерильной воды для последующего введения. Эновин можно вводить в твердую или полутвердую биологически совместимую матрицу, которую затем имплантируют в ткани, подлежащие лечению.
Носитель может также содержать другие фармацевтически приемлемые наполнители, изменяющие такие показатели, как рН, осмотическое давление, вязкость, стерильность, липофильность, растворимость или тому подобные. Композиция может также содержать фармацевтически приемлемые наполнители, делающие возможным длительное или отсроченное высвобождение лекарственного средства.
Белок эновина, молекулы нуклеиновой кислоты или соединения по этому изобретению можно вводить перорально. В соответствии с этим вариантом осуществления изобретения лекарственные вещества можно инкапсулировать и смешивать с приемлемыми носителями в твердых лекарственных формах, которые хорошо известны специалистам в этой области.
Как хорошо известно специалистам в этой области, схему приема лекарственного средства можно определить с учетом площади поверхности или объема тела пациента и конкретного способа введения. Количество вводимой композиции, однако, должен определить лечащий врач в зависимости от таких факторов, как серьезность симптомов, форма вводимой композиции, возраст, масса и реакция нуждающегося субъекта, а также выбранный способ введения.
Настоящее изобретение описано далее со ссылкой на нижеследующие примеры, имеющие только иллюстративный характер, и прилагаемые чертежи.
На фиг.1 показана частичная последовательность кДНК нейротрофического фактора по этому изобретению, именуемого эновином. Согласованную последовательность получают амплификацией разных кДНК и геномной ДНК при помощи PCR с использованием затравок PNHsp3 и PNHap1, после чего производят клонирование, анализ последовательности и сравнение полученных последовательностей. Предполагаемая аминокислотная последовательность, обозначенная однобуквенным кодом, показана над последовательностью ДНК. Число нуклеотидных остатков указано справа от последовательности ДНК, и число аминокислотных остатков указано справа от транслированной белковой последовательности. Предполагаемый сайт расщепления RXXR для продомена напечатан жирным шрифтом и подчеркнут. Предполагаемое начало зрелого белка обозначено стрелкой. Семь консервативных остатков цистеина, характерных для всех членов семейства TGF-β, показаны жирным шрифтом. Возможный сайт N-гликозилирования подчеркнут двумя линиями.
На фиг.2 показан сравнительный анализ первичной структуры предполагаемых последовательностей зрелого белка GDNF, NTN, PSP и EVN человека. Эти последовательности анализируют в соответствии с программой сравнительного анализа ClustalW. Аминокислотные остатки, являющиеся консервативными во всех трех белках, расположены на участках черного цвета. Остатки, являющиеся консервативными в двух или трех последовательностях, окрашены серым цветом. Семь консервативных остатков цистеина, характерных для всех членов семейства TGF-β, отмечены звездочками над последовательностью. Число аминокислотных остатков указано справа. Пуктирными линиями обозначены разрывы, введенные в последовательность для оптимизации сравнительного анализа.
На фиг.3 показана частичная последовательность кДНК эновина. Согласованную последовательность получают амплификацией разных кДНК при помощи PCR (первичная PCR выполнена с использованием затравок PNHsp1 и PNHap1 и вложенная PCR выполнена с использованием затравок PNHsp2 и PNHap2), после чего производят клонирование, анализ последовательности и сравнение полученных последовательностей. Транслированная аминокислотная последовательность нуклеотидов 30-284 (рамка считывания А), обозначенная однобуквенным кодом, показана над этой последовательностью, и число остатков указано справа (А1-А85). Эта рамка считывания содержит предполагаемый кодон инициации трансляции ATG. Транслированная аминокислотная последовательность нуклеотидов 334-810 (рамка считывания В), обозначенная однобуквенным кодом, показана над этой последовательностью, и число остатков указано справа (В1-В159). Эта рамка считывания содержит область гомологии с GDNF, NTN и PSP. Число нуклеотидных остатков показано справа от последовательности ДНК. Предполагаемый сайт расщепления RXXR для продомена напечатан жирным шрифтом и подчеркнут. Предполагаемое начало зрелого белка обозначено стрелкой. Семь консервативных остатков цистеина, характерных для всех членов семейства TGF-β, напечатаны жирным шрифтом. Вероятный сайт N-гликозилирования подчеркнут двумя линиями.
На фиг.4 показана локализация в хромосоме эновина человека. (А) Схема результатов картирования эновина методом FISH. Каждая точка представляет собой два сигнала FISH, обнаруженных в хромосоме человека 1, область р31.3-р32. (В) Пример картирования эновина методом FISH. На левом снимке показаны сигналы FISH в хромосоме 1. На правом снимке показано то же митотическое изображение, окрашенное 4',6-диамидино-2-фенилиндолом для идентификации хромосомы 1.
На фиг.5 проиллюстрирована экспрессия эновина в разных тканях человека. (А), (В), (С) Нозерн-блоттинг экспрессии эновина в тканях. Экспрессию мРНК эновина в разных тканях человека определяют при помощи зонда, соответствующего части кодирующей области эновина (включая область, кодирующую белок зрелого эновина), анализируя блоты поли(А)-богатой РНК человека. (А) Нозерн-блот нескольких тканей (MTN); (В) блот MTN II) блот II MTN плода. На снимке (D) показаны результаты авторадиографии основного блота РНК человека, зондированного тем же фрагментом кДНК эновина. На снимке (Е) показано положение образцов мРНК из тканей человека на основном блоте РНК, изображенном на снимке (D).
На фиг.6 графически проиллюстрирована общая выживаемость клеток SH-SY5Y после 72-часовой обработки 10-6М таксола и влияние увеличения доз эновина на выживаемость клеток, нормализованных до состояния раствора. Клетки SH-SY5Y дифференцируют в течение 5 дней 25 нМ стауроспорина до нанесения таксола. Данные получены в результате выполнения двух независимых экспериментов с использованием шести одинаковых образцов. На фиг.6 показаны средние значения и стандартные отклонения.
На фиг.7 дано графическое изображение влияния увеличения концентраций эновина в течение 48 часов на рост аксонов дифференцированных стауроспорином клеток SH-SY5Y, нормализованных до состояния раствора. Клетки SH-SY5Y дифференцируют в течение 5 дней 25 нМ стауроспорина до начала 48-часового эксперимента. В качестве положительного контрольного результата служит дифференцирующий эффект, достигаемый 25 нМ стауроспорина. Длину аксонов высчитывают, используя по крайней мере 5000 клеток. Данные получены в результате выполнения экспериментов с использованием двух одинаковых образцов. На этом чертеже показаны средние значения и стандартные отклонения.
На фиг.8-18 дано графическое изображение влияния эновина на пролиферацию разных типов клеток.
На фиг.19 дано графическое изображение результатов влияния эновина на обусловленный таксолом дефицит сенсорных нейронов, полученных методом иглоукалывания. На этой фигуре показаны средние (±1 стандартная ошибка средней) совокупные оценки, полученные на протяжении всего эксперимента, для крыс, которым после введения таксола вводят или 2 разные дозы эновина (23 или 130 мкг/мл; n=10 крыс/группа), или наполнитель/физиологический раствор (n=20 крыс). Эновин или физиологический раствор/наполнитель вводят в виде инъекции в объеме 75 мкл в подошву правой задней лапы.
На фиг.20 дано графическое изображение результатов влияния эновина на обусловленный таксолом дефицит сенсорных нейронов, полученных методом иглоукалывания. На этом чертеже показаны средние (±1 стандартная ошибка средней) совокупные оценки, полученные на протяжении всего эксперимента, для крыс, которым до введения таксола вводят или 2 разные дозы эновина (23 или 130 мкг/мл; n=10 крыс/группа), или наполнитель/физиологический раствор (n=20 крыс). Эновин или физиологический раствор/наполнитель вводят в виде инъекции в объеме 75 мкл в подошву правой задней лапы.
На фиг.21 показана последовательность ДНК эновина. Согласованную последовательность получают амплификацией кДНК лобной доли коры головного мозга человека и геномной ДНК человека при помощи PCR с использованием затравок PNHsp5 и PNHap1, после чего производят клонирование, анализ последовательности и сравнение полученных последовательностей. Предполагаемая аминокислотная последовательность показана над последовательностью ДНК только для сплайсированного варианта, дающего после трансляции функциональный белок эновина. Число нуклеотидных остатков указано слева от последовательности ДНК, и число аминокислотных остатков указано справа от транслированной белковой последовательности. 5'- и 3'-концевые сайты сплайсинга, обнаруженные в результате сравнения фрагментов секвенированной кДНК с геномной последовательностью, обозначены вертикальными линиями, загнутыми соответственно влево или вправо, и последовательно пронумерованы. Предполагаемый сайт расщепления фурина RXXR для продомена обозначен жирным шрифтом и подчеркнут. Предполагаемое начало зрелого белка обозначено стрелкой. Семь консервативных остатков цистеина, характерных для всех членов семейства TGF-β, напечатаны жирным шрифтом. Предполагаемый N-связанный сайт гликозилирования подчеркнут двумя линиями. 5'- и 3'-концевые сайты сплайсинга пронумерованы и обведены кружком.
На фиг.22 проиллюстрирована экспрессия разных сплайсированных вариантов эновина в тканях человека. (А) Схематическое изображение сплайсированных вариантов эновина, идентифицированных при помощи RT-PCR с использованием эновинспецифических затравок на РНК, выделенной из разных тканей человека, с последующим клонированием и анализом последовательности в продуктах PCR. Верхняя линия показывает длину последовательности (в виде пар оснований). Вторая линия изображает геномную последовательность эновина. На этой линии показано положение инициирующего и терминирующего трансляцию кодона, начала кодирующей последовательности зрелого эновина и 5'- и 3'-концевых сайтов сплайсинга (см. фиг.21). С правой стороны фигуры показаны продукты PCR, полученные в результате выполнения RT-PCR в отношении РНК яичника и лобной доли коры головного мозга вместе с лэддером ДНК длиной 100 пар оснований. Положение разных вариантов мРНК показано с указанием их длины (от инициирующего до терминирующего кодона). Транслированные белки показаны с левой стороны. Прямоугольниками очерчены области, представленные в кДНК. Пунктирными линиями обозначена сплайсированная геномная ДНК. Заштрихованная область обозначает кодирующую последовательность зрелого эновина. Точечной линией отмечено начало кодирующей последовательности зрелого эновина. Два транскрипта, способные давать функциональный белок эновина, отмечены звездочкой с левой стороны. (В) Распределение по тканям основных сплайсированных вариантов. На фотографии показаны фрагменты PCR, полученные в результате выполнения RT-PCR с использованием эновинспецифических затравок в отношении разных кДНК человека. Четыре основных сплайсированных варианта (А-D) показаны стрелками с левой стороны. Длины указаны с правой стороны, при этом в качестве эталонной длины в геле принята длина лэддера ДНК, равная 100 п.о.
На фиг.23 показана предполагаемая белковая последовательность длинного сплайсированного варианта эновина, полученного сплайсированием двух интронов из последовательности ДНК, изображенной на фиг.21. Сайты сплайсинга 5'-1 и 3'-1 использованы для удаления первого интрона и сайты сплайсинга 5'-2 и 3'-3 использованы для удаления второго интрона. Это позволяет получить последовательность кДНК, имеющую открытую рамку считывания, кодирующую вышеуказанный белок, состоящий из 228 аминокислотных остатков.
На фиг.24 показана предполагаемая белковая последовательность альтернативного (короткого) сплайсированного варианта эновина, полученного сплайсированием двух интронов из последовательности ДНК, изображенной на фиг.21. Сайты сплайсинга 5'-1 и 3'-2 использованы для удаления первого интрона и сайты сплайсинга 5'-2 и 3'-3 использованы для удаления второго интрона. Это позволяет получить последовательность кДНК, имеющую открытую рамку считывания, кодирующую вышеуказанный белок, состоящий из 220 аминокислотных остатков. В этой белковой последовательности отсутствуют 8 аминокислотных остатков по сравнению с последовательностью, изображенной на фиг.23.
На фиг.25 дано графическое изображение результатов, полученных при выполнении экспериментов по сравнению уровней экспрессии эновина в здоровой и пораженной болезнью ткани. Экспрессия эновина и GAPDH показана в ткани головного мозга, пораженной рассеянным склерозом и болезнью Альцгеймера.
На фиг.26 дано графическое изображение результатов, показывающих уровни экспрессии эновина и GAPDH в тканях, пораженных болезнью Паркинсона и раком.
Депонирование
Плазмида EVNmat/pRSETB, включающая последовательность ДНК, кодирующую эновин, задепонирована 6 мая 1999 г. под № доступа LMBP3931 в банк данных Бельгийской координированной коллекции микробиологических культур (ВССМ) по адресу Laboratorium voor Moleculaire - Plasmidencollectie (LMBP) B9000, Ghent, Belgium, в соответствии с положениями Будапештского договора от 28 апреля 1997 г.
Материалы и методы
Материалы
Нативная Taq-полимераза, ампициллин, IPTG (изопропил-β-D-тиогалактозид), X-gal (5-бром-4-хлор-3-индолил-β-D-галактопиранозид) и все рестрикционные ферменты предоставлены фирмой Boegringer Mannheim (Mannheim, Германия). Смесь 10 мМ dNTP приобретена у фирмы Life Technologies (Gaithersburg, MD, США). Набор для клонирования ТОРО-ТА приобретен у фирмы Invitrogen BV (Leek, Нидерланды). Набор для очистки плазмидной мини- или мидиДНК Qiagen, набор Qiaprep Spin Miniprep и набор для экстракции в геле Qiaquick приобретены у фирмы Qiagen GmbH (Dusseldorf, Германия). Библиотеки кДНК, наборы готовых кДНК Marathon™, панели I и II кДНК нескольких тканей человека (МТС™), нозерн-блоты нескольких тканей и набор для PCR с использованием кДНК Advantage-GC преобретены у фирмы Clontech Laboratories (Palo Alto, CA, США). Все полимеразные реакции синтеза цепи (PCR) выполнены в термоблоке 9600 системы GeneAmp PCR (Perkin Elmer, Foster City, CA, США). Среда LB (Luria-Bertani) содержит 10 г/л триптона, 5 г/л дрожжевого экстракта и 10 г/л NaCl. Планшены с двукратным объемом YT/ампициллина содержат 16 г/л триптона, 10 г/л дрожжевого экстракта, 5 г/л NaCl, 15 г/л агара и 100 мг/л ампициллина.
Поиск гомологичных последовательностей в базе данных и сравнение последовательностей
Поиск производят путем ежедневного обновления метки экспрессированной последовательности человека (EST) в библиотеке EMBL/GenBank и геномных базах данных, используя непроцессированный нейротрофический фактор, выделенный из линии глиальных клеток человека (GDNF; № доступа Q99748), нейротурин (NTN; № доступа Р39905), персефин (PSP; № доступа AF040962), выделенные из кДНК белковые последовательности в качестве эталонных последовательностей и устройство для выполнения сравнительного анализа первичных структур BLAST (Basic Local Alignment Search Tool; Altschul et al., 1990).
Дополнительные исследования при помощи BLAST выполняют, используя геномную последовательность с № доступа АС005038 и несколько EST, имеющихся в базе данных GenBank, и ведут поиск последовательностей, гомологичных этой геномной последовательности.
Процентное значение идентичности и сходства между членами семейства GDNF высчитывают путем попарного сравнения последовательностей при помощи программы BESTFIT (программное обеспечение для анализа последовательностей Genetics Computer Group, версия 8.0, Висконсинский университет, Мэдисон, шт. Висконсин, США). Сравнительный анализ ДНК или белковых последовательностей выполняют при помощи программы сравнительного анализа ClustalW (EMBL, Heidelberg, Германия).
Синтез олигонуклеотидов для PCR и секвенирования ДНК
Все олигонуклеотидные затравки приобретены у фирмы Eurogentec (Seraing, Бельгия). Специфические для вставки секвенирующие затравки (15- и 16-меры) и затравки, используемые при выполнении полимеразных реакций синтеза цепи, созданы вручную. ДНК получают на анионообменных колонках Qiagen-tip 20 или -100 или центробежных колонках Qiaquick (Qiagen GmbH, Dusseldorf, Германия) и выделяют из колонок в 30 мкл ТЕ-буфер (10 мМ трис-HCl, 1 мМ EDTA (натриевая соль), рН 8,0).
Реакции секвенирования выполняют на обеих цепях, используя набор для секвенирования ABI prism BigDye Terminator Cycle, в секвенаторе Applied Biosystems 377XL (Perkin Elmer, ABI Division, Foster City, CA, США). Сборку последовательности и ручное редактирование (GeneCodes, Ann-Arbor, MI, США) выполняют при помощи программного обеспечения Sequencher™.
Клонирование нового гомолога GDNF
Нуклеотиды 67411-68343, охватывающие область ДНК, из базы данных EMBL под № доступа АС005038, в которых транслированная белковая последовательность гомологична зрелому NTN и PSP, используют для создания олигонуклеотидных затравок для амплификации при помощи PCR. Разные используемые затравки приведены в таблице 1.

Затравки PNHsp3 и PNHap1 используют для амплификации фрагмента длиной 502 п.о. на кДНК, выделенной разных тканей человека (кДНК головного мозга плода, всего плода, предстательной железы или легкого Marathon-Ready™ (Clontech Laboratories), кДНК лобной доли коры головного мозга, гиппокампа и мозжечка), и на геномной ДНК человека. На основании геномной последовательности из базы данных EMBL/GenBank (№ доступа АС005038) установлено, что амплифицируемый фрагмент должен содержать G+C в количестве 76%. Поэтому амплификацию производят при помощи набора для PCR кДНК Advantage-GC (Clontech Laboratories, Palo Alto, CA, США), который оптимизирован для амплификации последовательностей ДНК с большим содержанием GC. Полимеразные реакции синтеза цепи выполняют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера для PCR с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT, 200 нМ затравок PNHsp3 и PNHap1, 1 мкл полимеразной смеси Advantage KlenTaq и 1-5 мкл кДНК или 0,5 мкг геномной ДНК. Образцы нагревают до 95°С в течение 5 минут и подвергают тепловой обработке, выполняемой 45 секунд при 95°С, 1 минуту при 58°С и 40 секунд при 72°С в течение 35 циклов с конечной стадией продолжительностью 7 минут при 72°С. Наконец образцы обрабатывают 2,5 ед. нативной Taq-полимеразы ДНК с целью добавления удлиняющего сегмента А. Продукты PCR анализируют в 1% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ (40 мМ трис-ацетата, 1 мМ EDTA (натриевая соль), рН 8,3). Фрагменты PCR предполагаемой длины (495 п.о.) вырезают из геля и очищают при помощи набора для экстрации в геле Qiaquick. Фрагменты PCR секвенируют, чтобы подтвердить их идентичность, и клонируют в плазмидном векторе pCR2.1-TOPO с использованием набора для клонирования ТОРО ТА в соответствии с инструкциями изготовителя. Примерно 20 нг очищенного фрагмента смешивают с 1 мкл вектора pCR2.1-TOPO в общем объеме 5 мкл. Реакционные смеси инкубируют при комнатной температуре (20°С) в течение 5 минут. Реакционную смесь (2 мкл) трансформируют в компетентных клетках TOP 1 OF' (Invitrogen BV) под действием температурного шока и культивируют на планшетах, содержащих двукратный объем YT/ампициллина с 10 мМ IPTG и 2% (в отношении веса к объему) X-gal, для скрининга сине-белых колоний. Белые колонии после выращивания в течение ночи снимают с планшетов, выращивают в 5 мл среды LB, содержащей 100 мг/л ампициллина и плазмидную ДНК, полученную при помощи набора Qiaprep Spin Miniprep. Наличие вставки предполагаемой длины подтверждают рестрикционным расщеплением при помощи EcoRI. Плазмидную вставку нескольких положительных клонов секвенируют и полученные последовательности сравнивают при помощи программы сравнительного анализа ClustalW.
Чтобы получить дополнительную кодирующую последовательность для нового гомолога GDNF, фрагмент предполагаемой длины, содержащий 931 п.о., высчитанный на основе последовательности из базы данных EMBL/GenBank (№ доступа АС005038), амплифицируют при помощи PCR, используя затравки PNHsp1 и PNHap1. Полимеразные реакции синтеза цепи выполняют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера для PCR с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT™, 200 нМ затравок PNHsp1 и PNHap1, 1 мкл полимеразной смеси Advantage KlenTaq и 1-5 мкл кДНК из мозжечка, лобной доли коры головного мозга или гиппокампа или 0,5 мкг геномной ДНК. Образцы нагревают до 95°С в течение 5 минут и подвергают тепловой обработке, выполняемой 45 секунд при 95°С, 1 минуту при 58°С и 1 минуту 30 секунд при 12°С в течение 35 циклов с конечной стадией продолжительностью 7 минут при 72°С. Продукты PCR анализируют в 1% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ (40 мМ трис-ацетата, 1 мМ EDTA (натриевая соль), рН 8,3). Вторую амплификацию выполняют с использованием вложенных затравок (PNHsp2 и PNHap2). Продукт первой амплификации (1 мкл) используют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера для PCR с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT™, 200 нМ затравок PNHsp2 и PNHap2, 1 мкл полимеразной смеси Advantage KlenTaq. Образцы нагревают до 95°С в течение 5 минут и подвергают тепловой обработке, выполняемой 45 секунд при 95°С, 1 минуту при 58°С и 1 минуту 30 секунд при 72°С в течение 35 циклов с конечной стадией продолжительностью 7 минут при 72°С. Образцы анализируют в 1% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ. Фрагменты PCR предполагаемой длины (870 п.о.) вырезают из геля и очищают при помощи набора для экстракции в геле Qiaquick. Фрагменты PCR секвенируют для подтверждения их идентичности, обрабатывают 2,5 ед. Taq-полимеразы и клонируют в плазмидном векторе pCR2.1-TOPO при помощи набора для клонирования ТОРО ТА в соответствии с инструкциями изготовителя. Примерно 20 нг очищенного фрагмента смешивают с 1 мкл вектора pCR2.1-TOPO в общем объеме 5 мкл. Реакционные смеси инкубируют при комнатной температуре (20°С) в течение 5 минут. Реакционные смеси (2 мкл) трансформируют в компетентных клетках TOP1OF' под действием температурного шока и культивируют на планшетах, содержащих двукратный объем YT/ампициллина с 10 мМ IPTG и 2% (в отношении веса к объему) Х-gal, для скрининга сине-белых колоний. Белые колонии после выращивания в течение ночи снимают с планшетов, выращивают в 5 мл среды LB, содержащей 100 мг/л ампициллина и плазмидную ДНК, полученную при помощи набора Qiaprep Spin Miniprep. Наличие вставки предполагаемой длины подтверждают рестрикционным расщеплением при помощи EcoRI. Плазмидную вставку нескольких положительных клонов секвенируют и полученные последовательности сравнивают при помощи программы сравнительного анализа ClustalW.
Анализ экспрессии гена эновина при помощи RT-PCR
Олигонуклеотидные затравки PNHsp3 и PNHap1 (см. таблицу 1) используют для специфической амплификации при помощи PCR фрагмента длиной 502 п.о., выделенного из эновина. Амплификации при помощи PCR выполняют с использованием панелей кДНК нескольких тканей человека (МТС™), нормализованных до уровней экспрессии мРНК шести разных обязательных генов. Полимеразные реакции синтеза цепи с использованием эновинспецифических затравок выполняют в среде общим объемом 50 мкл, содержащей 5 мкл кДНК, однократный объем реакционного буфера для PCR с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT TM, 400 нМ затравок PNHsp3 и PNHap1 и 1 мкл полимеразной смеси Advantage KlenTaq. Образцы нагревают до 95°С в течение 30 секунд и подвергают тепловой обработке, выполняемой 30 секунд при 95°С и 30 секунд при 68°С в течение 35 циклов. Образцы анализируют в 1,2% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ (40 мМ трис-ацетат, 1 мМ EDTA (натриевая соль), рН 8,3) и получают изображения гелей, окрашенных бромидом этидия, при помощи видеосистемы Eagle Eye II (Stratagene, La Jolla, CA, США).
В результате поиска подобия ежедневно обновляемой базы данных EMBL/GenBank с использованием белковых последовательностей нейротурина и персефина человека получают последовательность геномной ДНК, кодирующую предполагаемый новый белок, подобный нейротрофическим факторам GDNF, NTN и PSP, который получил название "эновин" (EVN). Поиск дополнительных гомологичных последовательностей в базе данных с использованием последовательности геномной ДНК, окружающей область, кодирующую эновин, дает несколько клонов меток экспрессированных последовательностей (EST), выделенных из разных тканей человека (эпителий предстательной железы [№ доступа АА533512 (ID 1322952)], карцинома легкого [№ доступа АА931637] и опухоль паращитовидной железы [№ доступа АА844072]). Эти клоны содержат последовательность ДНК, находящуюся за пределами области гомологии с GDNF, PSP или NTN, но подтверждают, что мРНК эновина экспрессирована в здоровых и опухолевых тканях.
Первоначальная ампликация при помощи PCR с использованием затравок (PNHsp3 и PNHap1) на основе геномной последовательности позволяет получить фрагмент длиной 500 п.о. из кДНК плода, головного мозга плода, предстательной железы, лобной доли коры головного мозга, гиппокампа, мозжечка и из геномной ДНК, причем этот фрагмент нельзя получить из кДНК легкого. Клонирование и анализ последовательности этих фрагментов дает последовательность ДНК длиной 474 п.о., которая транслируется в предполагаемую белковую последовательность, содержащую 139 аминокислотных остатков, включая семь консервативных остатков цистеина, характерных для всех членов семейства белков трансформирующего фактора роста β (TGF-β) (Kingsley, 1994) (фиг.1). Эта последовательность содержит также мотив RXXR для расщепления продомена (RAAR, положение аминокислот 23-26) (Barr, 1991). Подобный сайт расщепления имеется в белковых последовательностях GDNF, NTN и PSP в аналогичном положении последовательности продомена. Если предположить, что расщепление продомена эновина происходит на этом сайте in vivo, то последовательность зрелого белка EVN содержит 113 аминокислотных остатков (остатки 27-139 на фиг.1), имеет высчитанную молекулярную массу, равную 11965 Да, и изоэлектрическую точку, соответствующую 11,8. В зрелой последовательности (NST в положении аминокислот 121-123) имеется один предполагаемый сайт N-гликозилирования. Кроме того, эновин имеет также несколько областей, законсервированных в зрелых формах известных нейротрофических факторов GDNF, NTN и PSP (фиг.2). В таблице 2 показаны результаты сравнения зрелых белковых последовательностей членов семейства GDNF при помощи программы BESTFIT. В этой таблице приведены процентные значения идентичности и сходства. Зрелые последовательности GDNF, NTN, PSP и EVN, используемые в этом сравнении, начинаются с первого аминокислотного остатка, следующего за сайтом расщепления RXXR.
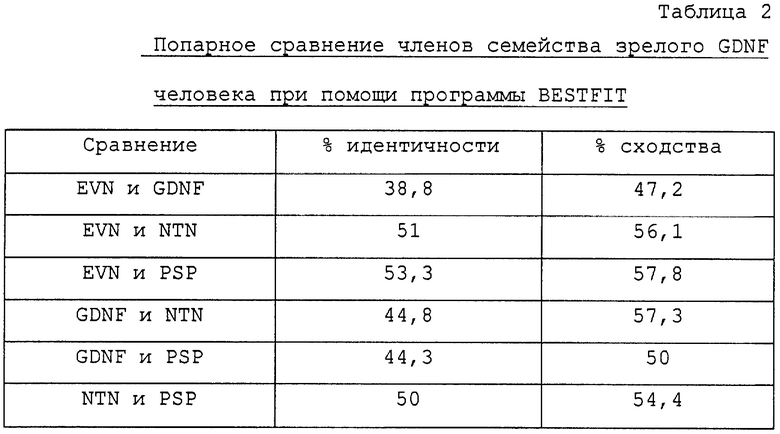
Эти сравнения показывают, что зрелый белок эновина находится в более тесном родстве с персефином и нейротурином, чем с GDNF.
В результате амплификации, клонирования и анализа последовательности более крупного фрагмента последовательности ДНК эновина, выделенной из кДНК лобной доли коры головного мозга с использованием затравок на основе геномной последовательности из базы данных EMBL/GenBank (№ доступа АС005038), получают последовательность, состоящую из 819 п.о. (фиг.3). Эта последовательность содержит предполагаемый инициирующий кодон ATG в положениях нуклеотидов 30-32 и дает открытую рамку считывания (рамка считывания А на фиг.3), которая доходит до терминирующего кодона в положениях нуклеотидов 285-287. Транслированная белковая последовательность этой области не обладает сходством с каким-либо известным белком в этих базах данных. Трансляция последовательности кДНК во второй рамке считывания (рамка считывания В на фиг.3) дает предполагаемую белковую последовательность, состоящую из 159 аминокислотных остатков. Эта последовательность содержит сайт расщепления RXXR (положение В43-В46; положение нуклеотидов 460-471) и последовательность, соответствующую последовательности зрелого эновина (положение В47-В159; положение нуклеотидов 472-810). Открытая рамка считывания, включающая сайт расщепления RXXR и кодирующую последовательность зрелого эновина, идет от положения нуклеотида 334 (которому предшествует находящийся в рамке терминирующий кодон) до терминирующего кодона в положении 811-813, но не содержит кодон ATG для инициирующего остатка метионина. По аналогии с персефином (Milbrandt et al., 1998) авторы этого изобретения выдвинули гипотезу о том, что в большинстве транскриптов мРНК из гена EVN имеется несплайси-рованный интрон. GDNF и NTN также имеют интрон в соответствующих кодирующих областях продомена (Matsushita et al., 1997, Heuckeroth et al., 1997).
Чтобы установить наличие разных транскриптов мРНК для эновина, выполняют эксперименты на основе RT-PCR, используя затравки, расположенные у 5'-конца кодирующей последовательности эновина, 5'-конца предполагаемого верхнего инициирующего кодона ATG (затравка PNHsp5 [5' - GCA AGC TGC CTC AAC AGG AGG G - 3']), и вложенную затравку PNHsp6 [5' - GGT GGG GGA АСА GCT CAA CAA TGG -3'] и у 3'-конца (затравка PNHap1 и вложенная затравка PNHap2 [см. таблицу 1]). Эксперименты выполняют на панелях кДНК нескольких тканей человека (панели I и II Clontech МТС) с использованием библиотеки кДНК, выделенной из сердца плода (Clontech), и кДНК, выделенной из мозжечка, гиппокампа или лобной доли коры головного мозга человека (Masure et al., 1998). Первоначальные полимеразные реакции синтеза цепи выполняют, используя затравки PNHsp5 и PNHap1, в условиях с большим содержанием GC (набор Advantage GC-PCR, Clontech) в течение 30 циклов (95°С - 30 секунд, 60°С - 30 секунд, 72°С - 1 минута) в соответствии с описанием. Вложенные полимеразные реакции синтеза цепи выполняют, используя 1 мкл первичного продукта PCR, при помощи затравок PNHsp6 и PNHap2 в тех же условиях на протяжении 30 циклов. Полученные продукты PCR анализируют в 1,5% агарозном геле и распределяют по длине от ±350 п.о. до ±800 п.о. Несколько полос очищают от геля и фрагменты PCR подвергают прямому секвенированию. Некоторые очищенные продукты PCR также клонируют в векторе pCR2.1-TOPO (набор для клонирования ТОРО-ТА, Invitrogen) и затем секвенируют. Анализ последовательности подтверждает наличие других молекул мРНК, содержащих последовательность эновина. Последовательности полученных фрагментов сравнивают с геномной последовательностью эновина. Это позволяет идентифицировать несколько возможных 5'- и 3'-концевых сайтов сплайсинга в геномной последовательности (фиг.21). Все эти сайты сплайсинга соответствуют согласованным последовательностям для донорных и акцепторных сайтов сплайсинга (Senapathy, P., Shapiro, M.B. & Harris, N.L. (1990)), границ сплайсинга, сайтов акцепторных точек сплайсинга и экзонов (Sequence Statistics, Identification, and Application to Genome Project. Methods Enzymol, 183, 252-278). Разные идентифицированные сплайсированные варианты эновина и их наличие в разных тканях человека показаны на фиг.22. Только два из 5 секвенированных транскриптов дают функциональный белок эновина при трансляции из инициирующего кодона ATG. Эти два транскрипта кодируют белки 228 или 220 аминокислот, имеющих соответственно предполагаемые сигнальные пептиды, состоящие из 47 и 39 аминокислотных остатков. Предполагаемые белковые последовательности этих двух вариантов показаны на фиг.23 (длинный вариант) и на фиг.24 (короткий вариант). Длинный вариант можно вычленить из последовательности ДНК, показанной на фиг.21, сплайсируя первый интрон в положениях 5'-1 и 3'-1 и второй интрон в положениях 5'-2 и 3'-3. После трансляции открытой рамки считывания получают предполагаемую белковую последовательность, показанную на фиг.23. Более короткий вариант можно вычленить из последовательности ДНК, показанной на фиг.21, сплайсируя первый интрон в положениях 5'-1 и 3'-2 и второй интрон в положениях 5'-2 и 3'-3. После трансляции открытой рамки считывания получают предполагаемую белковую последовательность, показанную на фиг.24.
Самый длинный транскрипт, по-видимому, наиболее часто встречается в большинстве тканей, о чем можно судить по интенсивности полос на фиг.22В. Более короткие транскрипты вызывают сдвиги рамки считывания, что дает транслированный белок, у которого отсутствует аминокислотная последовательность зрелого эновина, гомологичная GDNF, NTN и PSP. У двух наименьших транскриптов отсутствует даже часть зрелой кодирующей последовательности, включающая два из семи высококонсервативных остатков цистеина. На фиг.22В показано распределение основных сплайсированных вариантов в разных тканях человека. Функциональная мРНК эновина экспрессирована почти во всех испытанных тканях, включая головной мозг, сердце, почку, печень, легкое, поджелудочную железу, скелетную мышцу, толстую кишку, тонкую кишку, лейкоциты периферической кровеносной системы, селезенку, тимус, предстательную железу, яичко, яичник, плаценту и сердце плода. В некоторых тканях человека (например, мозжечок, гиппокамп) при помощи PCR можно амплифицировать только нефункциональные транскрипты. Насколько известно авторам этого изобретения, присутствие нефункциональных транскриптов мРНК в таком количестве до сих пор не было описано. Необходимо изучить биологическую значимость этого открытия. Хотя экспрессия NTN и PSP в разных тканях не исследована полностью, уровни их экс-прессии, по-видимому, являются гораздо ниже, и сама экспрессия в большей степени ограничена конкретными тканями (Kotzbauer et al., 1996, Milbrandt et al., 1998).
Экспрессия рекомбинантов эновина в экспрессирующей эновин плазмиде, сконструированной в Е. coli
Фрагмент длиной 414 п.о., полученный при помощи PCR, амплифицируют из геномной ДНК человека с использованием затравок PNHsp4 и PNHap2 (таблица 1) и клонируют в векторе pCR2.1-TOPO методом ТА-клонирования (Invitrogen). Структуру последовательности вставки подтверждают анализом последовательности. Один клон, содержащий вставку с согласованной последовательностью эновина (клон 36), используют для последующего создания экспрессирующей плазмиды. Получают две затравки, содержащие соответствующие сайты рестрикции у 5'-концов. Верхняя затравка PNHexp-sp1 (5' - GC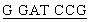 GCT GGG GGC CCG GGC A - 3') содержит сайт рестрикции BamHI (подчеркнут), и нижняя затравка PNHexp-apl (5' - GC
GCT GGG GGC CCG GGC A - 3') содержит сайт рестрикции BamHI (подчеркнут), и нижняя затравка PNHexp-apl (5' - GC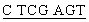 CAG CCC AGG CAG CCG CAG G - 3') содержит сайт рестрикции XhoI (также подчеркнут). Используя эти затравки, из клона 36 амплифицируют фрагмент, кодирующий зрелый эновин (положение 81-422 на фиг.1). Полимеразную реакцию синтеза цепи выполняют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT™, 200 нМ затравок PNHexp-sp1 и PNHexp-ap1, 1 мкл полимеразной смеси Advantage KlenTaq и 10 нг плазмидной ДНК из клона 36. Образцы нагревают до 94°С в течение 5 минут и подвергают тепловой обработке, выполняемой 45 секунд при 94°С, 1 минуту при 58°С и 30 секунд при 72°С на протяжении 25 циклов с конечной стадией продолжительностью 7 минут при 72°С. Полученные 50 мкл продукта очищают при помощи набора для очистки продуктов PCR Qiaquick (Qiagen) и ДНК, элюированной в 30 мкл. Этот очищенный продукт (25 мкл) гидролизуют в 30 мкл реакционной смеси с 10 ед. BamHI и 10 ед. XhoI в однократном объеме буфера В (Boehringer Mannheim) в течение 1 часа при 37°С. После выполнения электрофореза в 1% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ (40 мМ трис-ацетата, 1 мМ EDTA (натриевая соль), рН 8,3) искомую полосу длиной 353 п.о. вырезают из геля и очищают при помощи набора для экстракции геля Qiaquick. Полученный фрагмент лигируют с вектором pRSET В (Invitrogen) и линеаризуют при помощи BamHI и XhoI. Структуру вставки полученной конструкции на основе плазмидного вектора (hEVNmat/pRSETB) подтверждают, выполняя анализ всей последовательности. Полученная конструкция кодирует белок, состоящий из 146 аминокислот, с предполагаемой молекулярной массой 15704 Да, включая NН2-концевую His-метку из 6 элементов, слитую в рамке с кодирующей последовательностью зрелого эновина. NH2-концевая аминокислотная последовательность полученного белка имеет структуру
CAG CCC AGG CAG CCG CAG G - 3') содержит сайт рестрикции XhoI (также подчеркнут). Используя эти затравки, из клона 36 амплифицируют фрагмент, кодирующий зрелый эновин (положение 81-422 на фиг.1). Полимеразную реакцию синтеза цепи выполняют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера с GC кДНК, 0,2 мМ dNTP, 1 M GC-MELT™, 200 нМ затравок PNHexp-sp1 и PNHexp-ap1, 1 мкл полимеразной смеси Advantage KlenTaq и 10 нг плазмидной ДНК из клона 36. Образцы нагревают до 94°С в течение 5 минут и подвергают тепловой обработке, выполняемой 45 секунд при 94°С, 1 минуту при 58°С и 30 секунд при 72°С на протяжении 25 циклов с конечной стадией продолжительностью 7 минут при 72°С. Полученные 50 мкл продукта очищают при помощи набора для очистки продуктов PCR Qiaquick (Qiagen) и ДНК, элюированной в 30 мкл. Этот очищенный продукт (25 мкл) гидролизуют в 30 мкл реакционной смеси с 10 ед. BamHI и 10 ед. XhoI в однократном объеме буфера В (Boehringer Mannheim) в течение 1 часа при 37°С. После выполнения электрофореза в 1% (в отношении веса к объему) агарозном геле в однократном объеме буфера ТАЕ (40 мМ трис-ацетата, 1 мМ EDTA (натриевая соль), рН 8,3) искомую полосу длиной 353 п.о. вырезают из геля и очищают при помощи набора для экстракции геля Qiaquick. Полученный фрагмент лигируют с вектором pRSET В (Invitrogen) и линеаризуют при помощи BamHI и XhoI. Структуру вставки полученной конструкции на основе плазмидного вектора (hEVNmat/pRSETB) подтверждают, выполняя анализ всей последовательности. Полученная конструкция кодирует белок, состоящий из 146 аминокислот, с предполагаемой молекулярной массой 15704 Да, включая NН2-концевую His-метку из 6 элементов, слитую в рамке с кодирующей последовательностью зрелого эновина. NH2-концевая аминокислотная последовательность полученного белка имеет структуру
MRGS GMASMTGGQQMGRDLYDDDDKDP
GMASMTGGQQMGRDLYDDDDKDP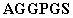 (последовательность зрелого эновина напечатана жирным шрифтом, и His-метка из 6 элементов подчеркнута).
(последовательность зрелого эновина напечатана жирным шрифтом, и His-метка из 6 элементов подчеркнута).
Экспрессия эновина в клетках BL21 (DE3) Е. coli
Рекомбинант белка эновина продуцируют в соответствии со способом, описанным для нейротурина Кридоном и др. (Creedon et al., 1997), в который вносят модификации. Чтобы получить рекомбинантный белок эновина, плазмиду hEVNmat/pRSETB трансформируют в штамме BL21 (DE3) Е. coli (Novagen) и выращивают в среде с двукратным объемом YT/ампициллина (16 г/л триптона, 10 г/л дрожжевого экстракта, 5 г/л NaCl и 100 мг/л ампициллина) при 30°С (225 оборотов/мин) или 37°С (300 оборотов/мин) до оптической плотности OD600, равной примерно 0,5, после чего добавляют IPTG до конечной концентрации 0,2 мМ, чтобы индуцировать экспрессию. Клеточный дебрис собирают центрифугированием после трехчасовой индукции, промывают физиологическим раствором с фосфатным буфером, центрифугируют и хранят в замороженном виде. Для очистки и повторной укладки клеточный дебрис вновь суспендируют в буфере для обработки ультразвуком (20 мМ трис-HCl, рН 8,0, 300 мМ NaCl, 1 мМ 2-меркаптоэтанола, ингибиторы протеазы (смешанные таблетки ингибитора протеазы Complete™ (Boehringer Mannheim, 1 таблетка на 50 мл буфера) и 1 мг лизоцима на 500 мг клеточного дебриса)). Клетки разрушают ультразвуком и внутриклеточные тельца собирают центрифугированием. Внутриклеточные тельца растворяют и инкубируют в буфере А (8 М мочевины, 20 мМ трис-HCl, рН 7,6, 200 мМ NaCl, 1 мМ 2-меркаптоэтанола) в течение 30 минут при 37°С и добавляют смолу Ni-NTA (никельнитрилотриуксусная кислота, Qiagen). Смесь встряхивают в течение 40 минут при 37°С, образцы промывают один раз буфером А и вводят в колонку с 5 мл Ni-NTA. Колонку последовательно промывают 10 объемами буфера А, 10 объемами буфера А при рН 7,2 и 10 объемами буфера А при рН 7,2 + 10 мМ имидазола. Эновин элюируют из колонки в 4 объема буфера А при рН 7,2 + 200 мМ имидазола.
Повторную укладку эновина выполняют при помощи постадийного диализа в течение ночи при 4°С в буфере для ренатурации (0,1 М фосфата натрия, 0,15 М NaCl, 3 мкМ цистеина, 0,02% Tween-20, 10% глицерина, 0,01 М трис-HCl, рН 8,3), содержащего мочевину, количество которой уменьшается на каждой стадии (от 6 М до 4 М, 3 М, 2 М, 1 М, 0,5 М и 0 М мочевины). Отбирают аликвоту очищенного белка, хранят ее при -20°С и затем используют для выполнения функциональных анализов.
Локализация гена эновина в хромосомах
Фрагмент гена эновина длиной 3,3 т.п.о. амплифицируют из кДНК мозжечка, используя затравки EVN(7)-spl (5' - ТТС GCG TGT СТА САА ACT САА СТС СС - 3') и PNHapl (5' - GCA GGA AGA GCC ACC GGT AAG G - 3'), полученные на основе последовательности EMBL с № доступа АС005038. Полимеразную реакцию синтеза цепи выполняют в среде общим объемом 50 мкл, содержащей однократный объем реакционного буфера Expand Long Template (Boehringer Mannheim), 0,5 мМ dNTP, 1 M GC-MELT (Clontech Laboratories), 400 нМ затравок EVN(7)-spl и PNHapl и 1 мкл кДНК из мозжечка. Смесь выдерживают в течение 2 минут при 94°С, добавляют 0,75 мкл полимеразы Expand Long Template (Boehringer Mannheim) и подвергают тепловой обработке, выполняемой 10 секунд при 94°С, 30 секунд при 58°С и 3 минуты при 68°С на протяжении 10 циклов. Затем выполняют еще 20 дополнительных циклов тепловой обработки, увеличивая время обработки в каждом цикле при 68°С на 20 секунд. Тепловую обработку завершают циклом продолжительностью 7 минут при 68°С. Полученный фрагмент длиной 3,3 т.п.о. очищают после электрофореза в 0,8% агарозном/ТАЕ геле и клонируют в векторе pCR2.1-ТОРО методом ТА-клонирования (Invitrogen). Анализ всей последовательности вставки длиной 3,3 т.п.о. одного клона подтверждает, что полученная последовательность кДНК соответствует геномной последовательности в базе данных ENBL (№ доступа АС005038). В результате сплайсинга кДНК, полученной из кДНК мозжечка, не были выделены интроны.
Хромосомное картирование осуществляют методом флуоресцентной гибридизации in situ (FISH) (Heng et al., 1992, Heng & Tsui, 1993). Лимфоциты человека культивируют при 37°С в течение 68-72 часов и обрабатывают 0,18 мг/мл 5-бром-2'-дезоксиуридином (BrdU), чтобы синхронизировать циклы клеток в популяции клеток. Синхронизированные клетки промывают и повторно культивируют при 37°С в течение 6 часов. Клетки собирают и получают микроскопические препараты стандартными методами, такими как гипотоническая обработка, фиксация или естественная сушка. Зонд длиной 3,3 т.п.о. для эновина обрабатывают биотином и используют для детектирования методом FISH. Микроскопические препараты обжигают при 55°С в течение 1 часа, обрабатывают РНКазой, денатурируют в 70% формамиде и двукратном объеме смеси NaCl/Cit (20-кратный объем смеси NaCl/Cit содержит 3 М NaCl, 0,3 М динатрийцитрата, рН 7,0) в течение 2 минут при 70°С и дегидратируют этанолом. Зонд денатурируют и наносят на денатурированные хромосомные микроскопические препараты. Микроскопические препараты гибридизуют в течение ночи, промывают, и на фотографической пленке по отдельности регистрируют сигналы FISH и картину полос, окрашенных 4',6-диамидино-2-фенилиндолом, при этом данные картирования методом FISH совмещают с окрашенными полосами хромосом путем наложения сигналов FISH на хромосомы, окрашенные 4',6-диамино-2-фенилиндолом (Heng & Tsui, 1993). В применяемых условиях эффективность гибридизации составляет примерно 72% для этого зонда (из 100 проверенных митотических фигур сигналы в одной паре хромосом были обнаружены на 72 фигурах). Поскольку окрашивание полос 4',6-диамидино-2-фенилиндолом использовано для идентификации специфической хромосомы, было достигнуто соответствие между сигналом зонда и коротким плечом хромосомы 1. Точное положение далее определяют на основе суммирования данных, полученных на 10 фотографиях (фиг.4А). Так как в применяемых условиях методом FISH не обнаружен дополнительный локус, можно сделать вывод о том, что эновин находится в хромосоме 1 человека, область р31.3-р32. Пример результатов картирования приведен на фиг.4В.
На основании данных генетической карты, представленных в Национальном центре биотехнологической информации (NCBI, http://www.ncbi.nlm.nih.gov/genemap), можно заключить, что геномный клон, содержащий последовательность эновина (EMBL № доступа АС005038), находится в хромосоме 1 между маркерами D1S2843 и D1S417. Это положение соответствует хромосоме 1, область р31.1-р32.3, подтверждая данные, полученные методом FISH.
Распределение эновина в тканях, определяемое при помощи нозерн-блоттинга и дот-блоттинга
Нозерн-блоты, содержащие 2 мкг поли(А)-богатой РНК, выделенной из разных тканей человека (Clontech Laboratories, Palo Alto, CA, США; блот MTN™, блот II MTN™ и блот II MTN™ из плода), гибридизуют в соответствии с инструкциями изготовителя с фрагментом эновина длиной 897 п.о., меченным произвольным примированием α-32P-dCTP (набор HighPrime, Воеhringer Mannheim). Этот фрагмент получают амплификацией кДНК лобной доли коры головного мозга при помощи PCR с использованием затравок PNHsp1 и PNHap1 и последующим клонированием в векторе pCR2.1-ТОРО. Этот фрагмент содержит 897 п.о. последовательности эновина до терминирующего кодона и включает непроцессированную кодирующую последовательность для зрелого белка эновина.
мРНК эновина обнаружена в виде главного транскрипта длиной около 4,5 т. п.о. (фиг.5А-С). мРНК эновина экспрессирована в ряде тканей, при этом она наиболее часто встречается в сердце, скелетных мышцах, поджелудочной железе и предстательной железе. Некоторые транскрипты меньшей длины присутствуют, например, в плаценте (4 т.п.о., 2,4 т.п.о. и 1,6 т.п.о.) и предстательной железе (4 т.п.о. и 1,6 т.п.о.). В тканях плода выраженный транскрипт длиной 2,4 т.п.о. обнаружен в печени и в меньшей степени в легком. Другие транскрипты обнаружены также в почке, печени, легком и головном мозге плода.
Помимо основного блота РНК (Clontech Laboratories), содержащего поли(А)-богатую РНК из разных тканей человека, с зондом эновина длиной 897 п.о. гибридизовали также ткани, находящиеся в стадии развития. Образцы поли(А)-богатой РНК, использованные для получения этого блота, нормализовали до уровней экспрессии мРНК восьми разных обязательных генов, предоставленных производителем. мРНК эновина экспрессирована во всех образцах, но самые высокие уровни мРНК обнаружены в предстательной железе, гипофизе, трахее, плаценте, легком плода, поджелудочной железе и почке (фиг.5D-E).
Конструирование векторов слияния GFRα-IgG-Fc
Области кДНК рецепторов GFRα-1, GFRα-2 и GFRα-3 (кодирующих соответственно аминокислоты 27-427, 20-431 и 28-371) за исключением последовательностей, кодирующих сигнальный пептид и СООН-концевую гидрофобную область, участвующую в связывании GPI, клонируют в рамке считывания в экспрессирующем векторе Signal pIg plus (R&D Systems Europe Ltd.). Полученные белки, экспрессированные из этих конструкций, содержат NН2-концевой сигнальный пептид CD33, состоящий из 17 аминокислот, область белка GFRα и СООН-концевой домен слияния IgG1-Fc человека, состоящий из 243 аминокислот. Клетки яичника китайского хомячка трансфицируют слитыми конструкциями GFRα и выбирают устойчиво трансфицированные клетки, используя 500 мкг G418. Постоянные клоны выбирают при помощи антитела против Fc. Для очистки слитых белков GFRα клетки выращивают в среде без сыворотки, которую собирают через каждые 3 дня. Среду центрифугируют и вводят в колонку с белком А (белок А "сефароза", Pharmacia Biotech). Связанный белок элюируют 0,1 М Na-цитрата, рН 3,0 и собирают в 1 М трис-буфере, рН 8,4. Концентрацию белка определяют по оптической плотности при 280 нм, используя коэффициент экстинкции, равный 1,5. Три очищенных растворимых слитых белка GFRα-1 - GFRα-3 используют в последующих исследованиях связывания.
Анализ резонанса поверхностного плазмона
Эксперименты по исследованию резонанса поверхностного плазмона (SPR) выполняют при 25°С в аппарате BIAcore 3000. Анализы выполняют с использованием эновина и NGF в качестве иммобилизованных лигандов. Карбоксилированную матрицу сенсорного чипа F1 сначала активируют смесью 400 мМ N-этил-N-(диметиламинопропил)карбодиимида и 100 мМ N-гидроксисукцинимида с отношением 1:1 в течение 10 минут. Затем рекомбинантный эновин и NGF наносят на активированную поверхность в 10 мМ ацетатного буфера, рН 4,5, со скоростью потока 5 мкл/мин. Незанятые реакционноспособные группы инактивируют 1 М гидрохлорида этаноламина. Для выполнения экспериментов по связыванию растворимые белки GFRα1-3-Fc подвергают сверхслиянию при концентрациях 10-100 нМ в забуференном физиологическом растворе, содержащем HEPES (150 мМ NaCl, 3,5 мМ EDTA, 0,05% Р-20, 10 мМ HEPES, pH 7,4), со скоростью потока 10 мкл/мин. Ассоциацию контролируют в течение 3 минут и диссоциацию - в течение 1 минуты, после чего осуществляют регенерацию, используя 5 мМ NaOH. Диссоциацию инициируют сверхслиянием с использованием забуференного физиологического раствора, содержащего HEPES. Скорость ассоциации (ka), скорость диссоциации (kd) и константы равновесной диссоциации (КD, высчитанной как kd/ka) высчитывают при помощи программы BIAcore, версия 3.0.
Результаты
Резонанс поверхностного плазмона (SPR) используют для измерения связывания растворимых белков GFRα-1-3 с иммобилизованным эновином. Специфическое связывание с эновином можно обнаружить только при помощи растворимого белка GFRα3. GFRα1 и GFRα2 не связываются с иммобилизованным эновином. Наблюдаемое связывание GFRα3 является специфическим, так как не обнаружено связывание с NGF. В отдельном контрольном эксперименте обнаружено специфическое связывание TrkA-Fc (рецептор NGF) с иммобилизованным NGF при отсутствии связывания с иммобилизованным эновином.
На основании кривых связывания, полученных с использованием трех разных концентрацией GFRα, выведены нижеследующие константы, приведенные в таблице 3. Эти результаты показывают, что GFRα3 специфически связывается с эновином.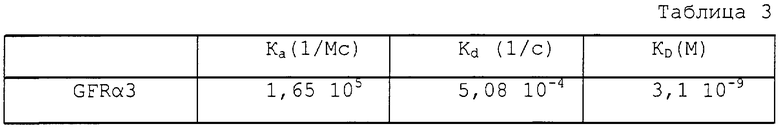
Так как GDNF, NTN и PSP способствуют сохранению и выживанию разных типов нейронов, можно предположить, что эновин оказывает такое же биологическое действие на нервные клетки и, возможно, на клетки других типов. Из вышеизложенного следует, что белок эновина может быть полезен для лечения заболеваний нервной системы, включая болезнь Паркинсона, болезнь Альцгеймера, периферическую невропатию, боковой амиотрофический склероз (ALS), болезнь Хантингтона, острое поражение головного мозга, опухоли нервной системы, рассеянный склероз, травму или повреждение периферической нервной системы и поражение нейротоксинами.
Эновин может быть также полезен для нейрозащиты в разных ситуациях. Учитывая его влияние на выживаемость разных популяций нейронов и удлинение аксонов в рассмотренной модели клеток SHSY5Y, можно предположить, что это соединение оказывает нейрозащитное и нейродегенеративное действие.
Этот вывод сделан на основе следующих наблюдений. Таксол вызывает апоптоз нейронов в NGF-дифференцированных клетках феохромоцитомы крыс PC 12 (Nuydens et al., научная работа представлена). Поэтому цитотоксичность, вызываемая таксолом, характеризуется апоптозом нейронов, о чем свидетельствует фрагментация ДНК, мечение аннексином V и защита bcl-2. На этом основании можно сделать вывод о том, что таксол вызывает апоптоз в дифференцированных клетках SHSY5Y. Установлено, что эновин способен уменьшить гибель клеток и воспрепятствовать апоптозу нейронов.
Поэтому это соединение является полезным при лечении нижеследующих нейродегенеративных заболеваний, в которых наблюдается апоптоз клеток; к таким заболеваниям относятся инсульт (Hakim, 1998), болезнь Паркинсона (Marsden et al., 1998), болезнь Альцгеймера (Nagy et al., 1998), болезнь Хантингтона (Wellington et al., 1997), травма нервной системы (Smirnova et al., 1998), периферическая невропатия (Srinivisan et al., 1998).
В качестве примера последнего клинического показания авторы этого изобретения установили, что этот нейротрофический фактор фактически защищает дифференцированные клетки SHSY5Y нейробластомы человека от токсического поражения клеток, вызванного таксолом.
Методика измерения жизнеспособности
Жизнеспособность клеток определяют, добавляя в каждую лунку 100 мкл раствора (1 мг/мл) 2,3-бис[2-метокси-4-нитро-5-сульфофенил]-2Н-тетразолий-5-карбоксанилида (ХТТ, Sigma) в DMEM (37°С), содержащем 0,02 мМ метосульфата феназина (PMS, Sigma). Планшеты инкубируют при 37°С в течение 2,5 часов. Оптические плотности измеряют (молекулярными устройствами) при 450 нм, используя в качестве эталона оптическую плотность при 650 нм. Этот анализ с использованием ХТТ основан на превращении соли тетразолия ХТТ в продукт формазана красного цвета. Эту реакцию выполняют, используя митохондриальные ферменты.
Методика дифференциации нейронов
1. Дифференциация клеток SHSY5Y нейробластомы человека
Клетки SHSY5Y дифференцируют в течение 5 дней при помощи 25 нМ стауроспорина. Влияние эновина измеряют через 72 часа после начала эксперимента (см. Jalava et al., "Protein Kinase inhibitor staurosporine induces a nature neuronal phenotype in SHSY5Y human neuroblastoma cells through an a,b,z PKC independent pathway" Journ. cell Physiol. 155, 301-312 (1993)).
2. Измерение удлинения аксонов
Морфологические изменения нейронов определяют автоматически в количественном отношении следующим образом. Коротко этот метод можно описать так: в соответствующие периоды времени в среду добавляют глутаральдегид и оставляют на 30 минут при комнатной температуре. Это гарантирует, что морфология клеток в данный момент времени отражает действительное состояние. Клетки исследуют в режиме проходящего света под микроскопом Axiovert (Zeiss Oberkochen, Германия), оснащенным устройством сканирования Marzhauser, приводимым в действие рабочей станцией Indy (Silicon Graphics, Mountain View, США). Изображения фотографируются видеокамерой МХ5 (HCS). Было изучено 3000 клеток на 64 совмещенных изображениях, образующих квадратную матрицу изображений 8х8. Точное совмещение изображений гарантирует возможность наблюдать аксоны на следующих друг за другом изображениях. Автоматическое обнаружение удлинений аксонов, меченных поликлональным tau-антителом, выполняют, используя несмещаемый детектор криволинейных структур (Steger, 1998). Программа анализа автоматически высчитывает общую площадь клеточного тела, количество клеточных тел и общую длину аксона.
Для исследования влияния эновина на другие типы клеток было выполнено два анализа, в частности анализ синтеза ДНК и анализ хемотаксиса.
Анализ синтеза ДНК
Клетки, включающие фибробласты кожи человека (39SK), эндотелиальные клетки пупочной вены человека (HUVEC), клетки гладкой мышцы человека (HSMC), хондроциты человека и остеобласты крыс, выдерживают в среде DMEM, содержащей 10% FBS (39-SK, HSMC, остеобласты крыс), или в среде определенного состава (хондроциты и HUVEC) при 37°С в атмосфере с 5% СО2 и 95% воздуха. Для анализа синтеза ДНК клетки высевают в 96-луночный планшет для культуры ткани с плотностью 5000 клеток/лунку в среде DMEM, содержащей 10% FBS, и инкубируют в течение 24 часов. Затем эту культуральную среду заменяют средой DMEM, содержащей разные концентрации эновина и 0,1% BSA (для 39-SK, остеобластов, HSMC, хондроцитов), или средой DMEM, содержащей разные концентрации эновина и 0,5% FBS (для HUVEC), и инкубируют клетки в течение 24 часов. Затем эту культуральную среду заменяют 100 мкл среды DMEM, содержащей 5% FBS и 0,1 мкCi [3H]-тимидина. Через 2 часа импульсного мечения клетки фиксируют метанолом/уксусной кислотой (3:1, в объемном отношении) в течение 1 часа при комнатной температуре. Фиксированные клетки дважды промывают 80% метанолом. Клетки солюбилизируют в 0,05% трипсина (100 мкл/лунку) в течение 30 минут и затем в 0,5% SDS (100 мкл/лунку) еще в течение 30 минут. Аликвоты клеточных лизатов (180 мкл) смешивают с 2 мл коктейля для сцинтилляционного счета и измеряют радиоактивность клеточных лизатов при помощи сцинтилляционного счетчика (Wallac 1409).
Анализ хемотаксиса
Клетки выдерживают так, как описано в разделе "Анализ синтеза ДНК". Хемотактическую активность эновина анализируют, используя 12-луночную камеру Бойдена (McQuillan, D.J., Handley, C.J., Campbell, M.A., Bolis, S., Milway, V.E., Herington, A.C., (1986), "Stimulation of Proteoglycan biosynthesis by serum and insulin-like growth factor-I in cultured bovine articular cartilage", Biochem. J. 240:423-430). Клетки обрабатывают 0,05% трипсина и 0,5 мМ EDTA и повторно суспендируют в DMEM. В нижние лунки камеры Бойдена добавляют аликвоты 150 мкл среды, содержащей разные концентрации эновина. Поликарбонатную мембрану (8 мкм), покрытую 0,1 мг/мл коллагена типа I, вводят сверху нижних лунок и производят подготовку верхних лунок. В верхние лунки добавляют аликвоты 100 мкл клеток (70000 клеток/мл). Клетки инкубируют в течение 6 часов, после чего аппарат разбирают. Клетки, оставшиеся на верхней стороне мембраны, удаляют. Мембрану фиксируют 10% формальдегидом в течение 15 минут и окрашивают гемотоксилином с интенсивностью по Гиллу. Клетки считают под микроскопом (250-кратное увеличение) и используют среднее значение подсчетов клеток с пяти участков каждой лунки. Каждый эксперимент повторяют по крайней мере четыре раза. Результаты выражены в виде числа, кратного контрольному образцу (среда DMEM, содержащая 0,1% BSA).
Как показано на фиг.8-18, эновин не влияет на пролиферацию всех использованных типов клеток и на миграцию клеток HUVEC (фиг.14), как указано выше. При этом эновин влияет на клетки нейробластомы SHSY5Y. Это свидетельствует об избирательном воздействии эновина на нейроны.
Установлено, что GDNF и NTN передают сигнал через сигнальный комплекс, содержащий лигандсвязывающую субъединицу GFRα-1 или GFRα-2 и сигнальную субъединицу, такую как тирозинкиназа белка cRET. Предполагается, что эновин оказывает биологическое действие через подобный сигнальный комплекс, включающий GFRα-связывающий партнер (GFRα-1, GFRα-2, недавно исследованный рецептор GFRα-3 или другие еще не исследованные члены семейства GFRα) в сочетании с cRET или другой сигнальный партнер. Действительно, данные связывания, полученные авторами этого изобретения, показывают, что эновин может специфически связываться с GFRα-3.
У человека мутации линии патогенных микроорганизмов в GDNF или cRET могут привести к возникновению нескольких фенотипов заболеваний, включая множественную неоплазию эндокринной системы и врожденную болезнь Гиршспрунга (HSCR) (Romeo et al., 1994, Edery et al., 1994, Angrist et al., 1996). Оба заболевания обусловлены плохой перистальтикой кишечника, причем болезнь Гиршспрунга является наиболее распространенной причиной врожденного стеноза кишечника у детей младшего возраста. Интересно отметить, что у мышей, которым вводили GDNF и cRET, наблюдаются аналогичные патологии, сопровождающиеся почечной недостаточностью и ганглионозом кишечника (Sanchez et al., 1996; Moore et al., 1996; Pichel et al., 1996). Эновин может иметь отношение к аналогичным заболеваниям кишечника или почек, и, поскольку эновин экспрессирован в разных тканях, он может иметь важное значение для развития других периферических органов в организме.
Взаимодействие лигандов с их рецепторами обычно достигается в результате установления специфических связей между конкретными остатками в обоих белках. Фрагменты белка могут служить в качестве агонистов, активирующих рецептор, в результате чего он стимулирует рост и выживаемость клеток. Поэтому части эновина или синтетические пептиды на основе белковой последовательности эновина могут быть полезными агонистами или антагонистами, регулирующими активность рецептора GFRα3. При помощи пептидного синтеза или метода рекомбинантных ДНК можно продуцировать гибридные факторы роста, состоящие из частей GDNF, NTN, PSP или любого другого нейротрофического фактора или фактора роста с частями эновина, которые позволяют получить новый синтетический фактор роста с новыми свойствами.
Были выполнены два предварительных испытания для исследования способности эновина изменять обусловленный таксолом дефицит сенсорных нейронов у крыс после инъекций в подошву лап. В первом эксперименте исследовали, может ли однократное введение эновина устранить обусловленный таксолом дефицит сенсорных нейронов, и во втором эксперименте исследовали, может ли эновин предотвратить развитие обусловленного таксолом дефицита.
Восстановление обусловленной таксолом дисфункции сенсорных нейронов
Методика
В этом эксперименте использовали самцов крыс Sprague-Dawley массой 300-340 граммов. Животных помещали в отдельные клетки, где они получали неограниченное количество пищи и воды. Перед началом эксперимента животных помещали в стандартные клетки для наблюдения и после периода адаптации, равного 15 минутам, определяли рефлекс на иглоукалывание. Для этого подошву правой лапы животного раздражали иглой и оценивали реактивность на иглоукалывание следующим образом: наличие реактивности (оценка=1) или отсутствие реактивности (оценка=0). В ходе эксперимента эту процедуру повторяли трижды с промежутками в 1 минуту между двумя последовательными раздражениями; таким образом, испытание на иглоукалывание состояло из 3 измерений реактивности в ответ на укол иглой. В эксперименте использовали только тех крыс, у которых наблюдалась нормальная реакции на 3 иглоукалывания.
Утром в течение трех последующих дней животным ежедневно инъецировали в подошву правой задней лапы 50 мкл таксола (3 мг/мл паклитаксела, растворенного в кремофоре и дегидратированном спирте с водой). На следующее утро производили повторную проверку рефлекса на иглоукалывание и отбирали животных, у которых отсутствовала реактивность на 3 раздражения. Этих животных произвольно делили на подгруппы (n=10/группу), в каждой из которых животным инъецировали в подошву правой задней лапы 75 мкл наполнителя, физиологического раствора либо 23 или 130 мкг/мл эновина. Поскольку не наблюдалось никаких различий между результатами при введении животным наполнителя и физиологического раствора, обе группы были объединены в одну (контрольная группа). На 1, 4, 5 и 7-й день после последней инъекции испытание на иглоукалывание выполняли утром (между 8:00 и 9:00 часами) и вечером (между 15:30 и 16:30 часами). На 8-й день утром выполняли последнее испытание на иглоукалывание. Для каждого животного определяли совокупную оценку, полученную в зависимости от реакции на иглоукалывание на протяжении всего эксперимента. Так как в общей сложности было выполнено 9 испытаний на иглоукалывание (каждое из которых состояло из 3 иглоукалываний) после последнего введения лекарственного средства, то максимальная оценка, которую можно было получить за все время эксперимента, равнялась 27.
Результаты
Повторное инъецирование таксола в подошву в течение 3 последовательных дней вызывает острую воспалительную реакцию и отсутствие реакции на раздражение иглоукалыванием у большинства животных. Инъецирование в подошву физиологического раствора или наполнителя не влияет на обусловленный таксолом дефицит нейронов. Во время первого измерения только у 4 из 20 контрольных животных наблюдалась по крайней мере 1 реакция на три иглоукалывания, и средняя оценка (±стандартная ошибка средней) у контрольных животных во время первого измерения равнялась 0,25 (±0,12); этот показатель отличается от оценки, полученной в начале эксперимента, когда средняя оценка была равна 3,0 (±0,0), так как все животные реагировали на иглоукалывание. После выполнения измерений в течение 8 дней реактивность у контрольных животных была нарушена в такой степени, что лишь 11 из 20 крыс по крайней мере один раз реагировали на укол иглой, при этом средняя оценка иглоукалывания была равна 0,75 (±0,18). В этой контрольной группе у всех крыс отсутствовала нормальная реактивность на все 3 раздражения. Совокупная оценка иглоукалывания у контрольных животных за все время эксперимента представлена на фиг.19. Так как животных испытывали 9 раз на протяжении 8 дней, то максимальная оценка, которая могла быть получена при выполнении 3 иглоукалываний в каждом испытании, равнялась 27. Как показано на графике, инъецирование физиологического раствора или наполнителя в подошву не вызывало восстановления обусловленного таксолом дефицита нейронов на протяжении всего времени эксперимента. Средняя совокупная оценка контрольных животных в конце эксперимента была равна 5,10 (±0,87); что составляет 18,9% от максимальной оценки, которая могла быть получена.
В результате однократного инъецирования в подошву 75 мкл раствора, содержащего 23 мкг/мл эновина, после первого измерения было установлено, что у 4 из 10 крыс наблюдается по крайней мере одна реакция, при этом средняя оценка иглоукалывания составила 0,70 (±0,33). На 8-й день все 10 животных по крайней мере один раз реагировали на иглоукалывание, и нормальная реактивность наблюдалась у 5 из 10 крыс. Средняя оценка иглоукалывания в этой группе на 8-й день была равна 2,20 (±0,29). По сравнению с контрольными животными средняя совокупная оценка в конце восьмидневного периода измерения значительно увеличилась (U-критерий Манна-Витнея, двусторонний критерий, р<0,01), при этом средняя оценка иглоукалывания была равна 14,50 (±1,96) (фиг.19). Это составляет 53,7% от максимальной оценки.
При инъецировании в подошву 130 мкг/мл эновина также были получены лучшие результаты по сравнению с контрольными животными. Во время первого измерения после введения 130 мкг/мл эновина у 6 из 10 крыс наблюдалась по крайней мере одна реакция, и средняя оценка иглоукалывания равнялась 1,10 (±0,35). На 8-й день все 10 животных реагировали по крайней мере на один угол иглой, при этом средняя оценка была равна 2,60 (±0,22). Нормальная реактивность на 3 иглоукалывания наблюдалась у 8 из 10 крыс. Средняя совокупная общая оценка иглоукалывания в конце эксперимента в этой группе равнялась 17,20 (±1,94). Это составляет 63,7% от общей возможной оценки и представляет собой значительное улучшение по сравнению с контрольной группой (р<0,01).
Профилактика возникновения обусловленной таксолом дисфункции сенсорных нейронов
Методика
В этом эксперименте использовали самцов крыс Sprague-Dawley массой 300-340 граммов. Животных помещали в отдельные клетки, где они получали неограниченное количество пищи и воды. Перед началом эксперимента животных помещали в стандартные клетки для наблюдения и после периода адаптации, равного 15 минутам, определяли рефлекс на иглоукалывание. Для этого подошву правой лапы животного раздражали иглой и оценивали реактивность на иглоукалывание следующим образом: наличие реактивности (оценка=1) или отсутствие реактивности (оценка=0). В ходе эксперимента эту процедуру повторяли трижды с промежутками в 1 минуту между двумя последовательными раздражениями; это испытание на иглоукалывание состояло из 3 измерений реактивности в ответ на угол иглой. В эксперименте использовали только тех крыс, у которых наблюдалась нормальная реакции на 3 укола иглой (оценка иглоукалывания=3). После выполнения этого контрольного измерения животных произвольно делили на подгруппы (n=10/группу), в каждой из которых животным инъецировали в подошву правой задней лапы 75 мкл наполнителя, физиологического раствора либо 23 или 130 мкг/мл эновина. Поскольку не наблюдалось никаких различий между результатами при введении животным наполнителя и физиологического раствора, обе группы были объединены в одну (контрольная группа). В течение трех последующих дней животным ежедневно инъецировали в подошву правой задней лапы 50 мкл таксола (3 мг/мл паклитаксела, растворенного в кремофоре и дегидратированном спирте с водой). На 1, 4, 5 и 7-й день после инъекции таксола испытание на иглоукалывание выполняли утром (между 8:00 и 9:00 часами) и вечером (между 15:30 и 16:30 часами). На 8-й день утром выполняли последнее испытание на иглоукалывание. Для каждого животного определяли совокупную оценку, полученную в зависимости от реакции на иглоукалывание на протяжении всего эксперимента. Так как в общей сложности было выполнено 9 испытаний на иглоукалывание (каждое из которых состояло из 3 иглоукалываний) после введения таксола, то максимальная оценка, которую можно было получить за все время эксперимента, равнялась 27.
Результаты
Инъецирование в подошву физиологического раствора или наполнителя не влияет на обусловленный таксолом дефицит нейронов при испытании на иглоукалывание. Во время первого испытания после введения таксола 8 из 20 крыс по крайней мере один раз реагировали на иглоукалывание, при этом средняя оценка иглоукалывания равналась 0,60 (±0,18). На 8-й день все еще имел место обусловленный таксолом дефицит нейронов, при этом реакция наблюдалась только у 8 из 20 животных, и средняя оценка составила 0,8 (±0,25). У двух животных имел место нормальный рефлекс на иглоукалывание. В конце экспермента совокупная оценка иглоукалывания уменьшилась, и средняя оценка была равна 6,55 (±1,08), что составляет 24,3% от максимальной оценки (фиг.20).
Предварительное инъецирование 23 мкг/мл эновина уменьшает обусловленный таксолом дефицит нейронов при испытании на иглоукалывание. В 1-й день 8 из 10 животных реагировали по крайней мере один раз, при этом средняя оценка иглоукалывания равнялась 1,70 (±0,40). На 8-й день реакция наблюдалась у всех животных, и средняя оценка составила 2,50 (±0,27). У 7 животных была обнаружена нормальная реактивность на все раздражения иглоукалыванием. Что касается совокупной реакции на протяжении всего эксперимента (фиг.20), то средняя общая оценка значительно улучшилась (р<0,01) по сравнению с контрольной группой и была равна 18,40 (±1,73); это составляет 68,1% от максимального значения.
Сравнимые результаты были получены после предварительного инъецирования 130 мкг/мл эновина. В данном случае у 6 из 10 животных наблюдалась реакция во время первого испытания, при этом средняя оценка иглоукалывания равнялась 1,70 (+0,31). На 8-й день все животные по крайней мере один раз реагировали на раздражение иглоукалыванием, при этом средняя оценка была равна 2,40 (+0,22), и все три реакции были нормальными у половины животных. Что касается совокупной оценки, то средняя оценка, полученная на 8-й день, равнялась 17,70 (±1,92), что составляет 65,5% от общей оценки.
Данная серия экспериментов показывает, что даже одна инъекция эновина в подошву может уменьшить обусловленный таксолом дефицит сенсорных нейронов, о чем свидетельствуют результаты испытания на иглоукалывание. Улучшение наблюдается при инъецировании лекарственного средства как до, так и после введения таксола.
Эновин является приемлемым лекарственным средством для лечения болевых синдромов, обусловленных главным образом нейрогенными нарушениями периферической и центральной нервной системы, ревматических/воспалительных заболеваний, а также нарушений проводимости и может модулировать процессы, протекающие в сенсорных нейронах, в случае чрескожного, местного, центрального (такого как эпидуральное, внутриоболочечное и тому подобное) и системного применения.
Кроме того, эновин можно использовать в качестве диагностического средства для исследования физиопатологических изменений в вышеуказанной области.
Сравнение экспрессии мРНК эновина в здоровых и пораженных болезнью тканях
Экспрессию мРНК эновина анализируют в количественном отношении при помощи системы обнаружения последовательностей ABI Prism 7700 (TaqMan; Perkin Elmer) в соответствии с патентованным методом, разработанным и осуществляемым фирмой Pharmagene Laboratories Ltd., Royston, Соединенное Королевство Великобритании. В этой системе использован флуорогенный зонд, генерирующий специфические для последовательности флуоресцентные сигналы во время PCR. Этот зонд представляет собой олигонуклеотид с флуоресцентным репортером, на который нанесены гасящие флуоресценцию красители, и расположен между верхней и нижней затравками для PCR. В интактном состоянии интенсивность флуоресценции репортера подавляется гасителем флуоресценции. Как только зонд становится частью реплицирующего комплекса, флуоресцентный репортер отщепляется от гасителя 5'- и 3'-концевой экзонуклеазой, имеющейся в Taq-полимеразе. Усиление сигнала флуоресцентного репортера в реакционной смеси является прямым свидетельством накопления продукта PCR. Исходное число копий последовательности-мишени мРНК (Cn) устанавливают, определяя количество циклов фракционирования PCR (Ct), когда впервые обнаруживают продукт PCR, то есть точку, в которой флуоресцентный сигнал превышает пороговое значение. Количественное определение содержания мРНК-мишени в каждом образце производят путем сравнения экспериментальных значений Ct со стандартной кривой.
Получение РНК и контроль качества
Непроцессированную РНК выделяют из целой и иссеченной ткани, используя реагент Tri-Zol (Life Technologies, Gaithersburg, MD, США) в соответствии с указаниями поставщика. Контроль качества для всех образцов РНК включает оценку целостности (интактная 18S и 28S рибосомная РНК) и определение наличия транскриптов с высоким содержанием (актин) и низким содержанием (рецептор трансферрина).
Конструирование затравок/зонда
Две затравки и зонд TaqMan конструируют с возможностью амплификации специфической последовательности из эновина.
Затравка 1: 5' ACGGTTCTCCAGGTGCTGT 3'
Затравка 3: 5' TGCTGCCGACCCACG 3'
Зонд 5: 5' CTACGAAGCGGTCTCCTTCATGGACG 3'
Кроме того, конструируют две затравки и зонд TaqMan, которые соединяют интрон и амплифицируют часть гена GAPDH человека.
Затравка 2: 5' CAGAGTTAAAAGCAGCCCTGGT 3'
Затравка 4: 5' GAAGGTGAAGGTCGGAGTCAAC 3'
Зонд 6: 5' TTTGGTCCGTATTGGGCGCCT 3'
Зонд 5 метят флуоресцентным FAM, и зонд 6 метят флуоресцентным VIC.
Обработка ДНКазой непроцессированной РНК
Для каждой испытуемой ткани 2,2 мкг непроцессированной РНК расщепляют 2 единицами ДНКазы, не содержащей РНКазу (Gibco BRL), в течение 15 минут при комнатной температуре в 20 мкл однократного объема буфера с ДНКазой (Gibco BRL). Реакцию прекращают, добавляя 2 мкл раствора 25 мМ EDTA. Образцы инкубируют при 65°С в течение 10 минут, чтобы инактивировать фермент.
Синтез одноцепочечной кДНК
Для каждой испытуемой ткани 100 нг непроцессированной РНК используют в качестве матрицы для синтеза одноцепочечной кДНК. РНК в объеме 4 мл, 50 нМ затравок 1 и 2, однократный объем буфера II для PCR (Perkin Elmer) и 5 мМ MgCl2 нагревают до 72°С в течение 5 минут и медленно охлаждают до 55°С. Добавляют все другие реагенты и 6 мл реакционной смеси инкубируют при 48°С в течение 30 минут, после чего фермент инактивируют при 90°С в течение 5 минут. Конечными условиями реакции являются: однократный объем буфера II для PCR, 5 мМ MdCl2, 1 мМ dATP, dTTP, dGTP, dCTP, 12,5 единицы обратной транскриптазы MuLV (Gibco BRL).
Амплификация продуктов одноцепочечной кДНК при помощи PCR
кДНК, выделенную из 100 нг непроцессированной РНК для каждого образца, амплифицируют, выполняя одну полимеразную реакцию синтеза цепи, чтобы идентифицировать транскриптмишень и транскрипт GAPDH. Затравки/зонд используют в нижеследующих конечных концентрациях для транскрипта-мишени: 300 нМ затравки 1, 300 нМ затравки 3 и 200 нМ зонда 5, и для транскрипта GAPDH: 20 нМ затравки 2, 20 нМ затравки 4 и 100 нМ зонда 6. Другие реагенты в реакционной смеси использованы в нижеследующей конечной концентрации: 4,5% глицерина, однократный объем буфера А с TaqMan (Perkin Elmer), 6,25 мМ MgCl2, 430 M dATP, dUTP, dGTP, dCTP, 2,5 единицы AmpliTaq Gold. Амплификацию при помощи PCR выполняют в системе обнаружения последовательностей ABI 7700, при этом начальную стадию активации фермента осуществляют при 94°С в течение 12 минут с последующим выполнением 45 циклов при 94°С в течение 15 секунд, при 60°С в течение 1 минуты (минимальное время линейного изменения).
Заболевания и испытуемые ткани
Экспрессию мРНК эновина сравнивают в тканях, полученных у больных субъектов и здоровых контрольных субъектов (фиг.25 и 26). В нижеследующей таблице указаны заболевания и соответствующие исследованные ткани. Для каждого заболевания анализировали три пораженных болезнью образца и три контрольных образца.
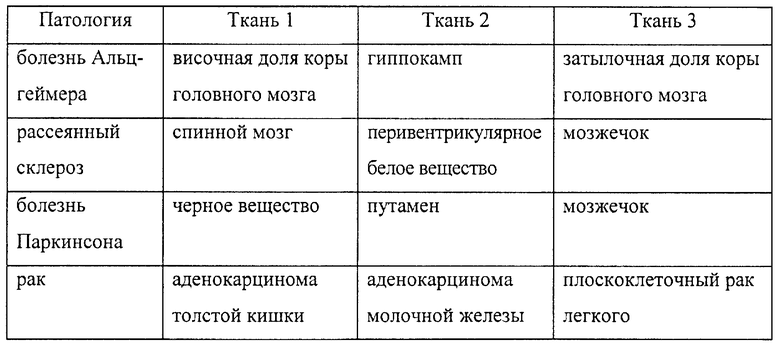
Статистический анализ
Для каждой группы из трех тканей высчитывают среднее значение и стандартное отклонение на основании значений Ct (которые нормально распределены), после чего их преобразуют в значения Cn по формуле Cn=10((Ct-40,007)/-3,623. Кроме того, выполняют дисперсионный анализ (ANOVA) значений Ct, чтобы сравнить средние уровни экспрессии мРНК эновина в здоровых и пораженных болезнью тканях.
На фиг.25 и 26 указано среднее число копий мРНК эновина. (± стандартное отклонение; n=3) в пораженных болезнью и контрольных тканях. Результаты статистического анализа показывают значительное увеличение уровня экспрессии эновина в перивентрикулярном белом веществе субъектов, страдающих рассеянным склерозом (р=0,013). В контрольном образце внутреннего GAPDH не обнаружено существенного отличия (р=0,79). Уровень экспрессии эновина в перивентрикулярном белом веществе является довольно низким в здоровой ткани (в среднем 270 копий на 100 нг непроцессированной РНК по сравнению с 200000 копий GAPDH), и этот уровень в три раза выше (825) у субъектов, страдающих рассеянным склерозом.
Обнаружено только одно отличие пораженной болезнью ткани от здоровой контрольной ткани: в аденокарциноме молочной железы уровень экспрессии мРНК эновина в 6 раз выше (6000 по сравнению с 1000; р=0,007), причем контрольное значение GAPDH также значительно увеличено (165000 по сравнению с 44000; р=0,03), что, вероятно, свидетельствует об общем увеличении уровней мРНК.
Таким образом, авторы этого изобретения обнаружили, что уровни мРНК эновина повышены в перивентрикулярном белом веществе у субъектов, страдающих рассеянным склерозом.
Применение клеточного анализа ELISA на основе фосфоспецифического антитела для скрининга миметической формы эновина в рецепторном комплексе GFRα3/cRET
Этот метод можно также использовать для идентификации агониста или антагониста других рецепторов нейротрофина, таких как GFRα1, GFRα2, GFRα4, TrkA, TrkB и TrkC.
Анализ
При помощи этого анализа можно идентифицировать агонистические или антагонистические соединения нейротрофических факторов роста, для чего измеряют активацию основных сигнальных киназ, активированных в нейротрофическом пути, или активацию киназы рецептора cRET. Активацию измеряют, детектируя количество фосфорилированной киназы или киназы рецептора при помощи фосфоспецифических антител. С этой целью можно использовать клетки NIH 3Т3, временно или постоянно экспрессирующие TrkA, TrkB, TrkC, GFRa1/cRET, GFRa2/cRET, GFRa3/cRET или GFRa4/cRET.
Активацию МАР-киназы р42/р44, РКВ-киназы, c-jun, CREB, JNK/SAPK-киназы и других киназ детектируют при помощи коммерческих фосфоспецифических антител. Кроме того, cRET можно дезактивировать, используя фосфоспецифическое антитело к cRET.
Этот анализ выполняют в соответствии с нижеследующей процедурой:
- Клетки NIH 3Т3 культивируют на 96-луночном планшете в 10% телячьей сыворотке, причем эти клетки должны быть на 80% конфлюэнтными до стимуляции.
- На следующий день используемую среду заменяют средой, не содержащей сыворотки, и выращивают клетки на минимальной среде в течение 18-24 часов.
- После выращивания на минимальной среде клетки стимулируют соединениями и нейротрофическими факторами, используемыми в качестве положительного контрольного образца (10 нг/мл для нейротрофических факторов).
- Клетки фиксируют 4% формальдегидом в PBS при 4°С в течение 20 минут.
- Клетки трижды промывают 200 мкл РВS/0,1% тритона в течение 5 минут.
- Рост клеток прекращают 100 мкл 0,6% H2O2 в PBS/0,1% тритона в течение 20 минут.
- Клетки трижды промывают 200 мкл РВS/0,1% тритона в течение 5 минут.
- Клетки блокируют 100 мкл 10% фетальной телячьей сывороткой в PBS/0,1% тритона в течение 60 минут.
- Клетки инкубируют с фосфоспецифическим антителом в 50 мкл 5% BSA//PBS/0,1% тритона в течение ночи при 4°С. Степень разведения антитела необходимо определить экспериментально в предлагаемом диапазоне 1:100-1:250.
- Клетки трижды промывают 200 мкл PBS/0,1% тритона в течение 5 минут.
- Клетки инкубируют со вторичным антителом, связанным пероксидазой хрена (HRP), со степенью разведения 1:100 в 50 мкл 5% BSA/PBS/0,1% тритона в течение 1 часа при комнатной температуре.
- Клетки трижды промывают 200 мкл РВS/0,1% тритона в течение 5 минут.
- Одну таблетку OPD (Sigma) растворяют в 25 мл буфера (3,65 г лимонной кислоты - Н2О и 5,9 г Na2HPO4-2H2O в 0,51 H2O, pH 5,6) и добавляют 12,5 мкл Н2О2. В каждую лунку добавляют 50 мкл и инкубируют в течение 15 минут на шейкере (200 оборотов/минуту), покрытом алюминиевой фольгой.
- Реакцию прекращают 25 мкл Н2SO4.
- Оптическую плотность OD490-650 измеряют в аппарате для чтения планшетов ELISA.
Культура допаминергических нейронов среднего мозга
Культура нейронов
Культуры нейронов получают из желудочка среднего мозга плода крысы ферментативным и механическим диспергированием. Ткань собирают, промывают в охлаждаемом льдом физиологическом растворе с фосфатным буфером без Са2+ и Mg2+, содержащем 0,6% глюкозы (PBSG), и инкубируют в течение 30 минут с PBSG, содержащим 0,1% трипсина, при 37°С. Клеточную взвесь культивируют с плотностью 2,5·105 клеток/см2 на 96-луночных планшетах для культуры ткани NUNC. Культуральные планшеты предварительно покрывают поли-L-орнитином и средой определенного химического состава (CDM), содержащей 10% фетальную телячью сыворотку. Культуры помещают в среду определенного химического состава (CDM), состоящую из смеси (1:1) модифицированной по способу Дульбекко среды Игла и питательного вещества F12, содержащего глюкозу (0,6%), глутамин (2 мМ), бикарбонат натрия (3 мМ), HEPES (5 мМ), инсулин (25 мкг/мл), трансферин человека (100 мкг/мл), путресцин (60 мкг/мл), селенит натрия (30 нМ), стрептомицин (100 мкг/мл) и пенициллин (100 м.ед/мл).
Обработка нейротрофическими факторами
Нейротрофины растворяют в 0,5% бычьем сывороточном альбумине, используемом в качестве исходного раствора. Нейротрофины добавляют через 3 часа после начала культивирования и через 5 дней нахождения в культуре. Такое же количество 0,5% бычьего сывороточного альбумина добавляют в контрольные лунки.
Поглощение высокоаффинного допамина
Поглощение допамина измеряют через 10 дней. Для этого клетки дважды промывают предварительно подогретым PBS, содержащим глюкозу (5 мМ), аскорбиновую кислоту (100 мМ) и паргилин (100 мМ), и предварительно инкубируют в течение 10 минут с таким же раствором. Раствор для предварительной инкубации заменяют таким же раствором, содержащим 50 нМ [3Н] DA, и продолжают инкубировать в течение 15 минут при 37°С. Поглощение прекращают тремя быстрыми промывками охлаждаемого льдом PBS. Накопленный [3Н] допамин удаляют в процессе инкубации с подкисленным этанолом в течение 30 минут при комнатной температуре. Радиоактивность определяют после добавления 4 мл сцинтилляционной жидкости (Packard ultima gold MV) при помощи сцинтилляционного счетчика. Неспецифическое поглощение определяют, добавляя 20 мкМ кокаина.
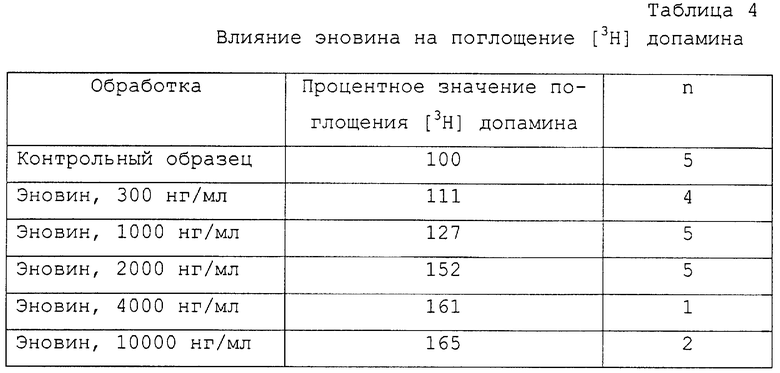
Клетки выращивают в течение 10 дней в присутствии эновина или без него. Результаты, полученные для необработанных контрольных образцов, принимают за 100%. Эти результаты получены при выполнении 1-5 независимых экспериментов.
Ссылки
Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D.J. (1990) Basic, local alignment search tool, J. Mol. Biol. 215, 403-410.
Angrist, M., Bolk, S., Halushka, M., Lapchak, P.A. & Chakravarti, A. (1996) Germline mutations in glial cell line-derived neurotrophic factor (GDNF) and RET in a Hirschsprung disease patient. Nature Genetics 14, 341-344.
Baloh, R.H., Tansey, M.G., Golden, J.P., Creedon, D.J., Heuckeroth, R.O., Keck, C.L., Zimonjic, D.B., Popescu, N.C., Johnson, E.M. & Milbrandt, J. (1997) TrnR2, a novel receptor that mediates neurturin and GDNF signaling through Ret. Neuron 18, 793-802.
Baloh, R.H., Gorodinsky, A., Golden, J.P., Tansey, M.G., Keck, C.L., Popescu, N.C., Johnson, E.M. & Milbrandt, J. (1998) GFRα3 is an orphan member of the GDNF/neurturin/persephin receptor family. Proc. Natl. Acad. Sci. USA 95, 5801-5806.
Barr, P.J. (1991) Mammalian subtilisins: the long-sought dibasic processing endoproteases. Cell. 66, 1-3.
Beck, K.D., Valverde, J., Alexi, Т., Poulsen, K., Moffat, В., Vandlen, R.A., Rosenthal, A. & Hefti, F. (1995) Mesencephalic dopaminergic neurons protected by GDNF from axotomy-induced degeneration in the adult brain. Nature 373, 339-341.
Bilang-Bleuel, A., Revah, F., Colin, P., Locquet, I., Robert J.J., Mallet, J. & Horellou, P. (1997) Intrastriatal injection of an adenoviral vector expressing glial-cell-line-derived neurotrophic factor prevents dopaminergic neuron degeneration and behavioral impairment in a rat model of Parkinson disease. Proc. Natl. Acad. Sci. USA 94, 8818-8823.
Buj-Bello, A., Buchman, V.L., Horton, A., Rosenthal, A. & Davies A.M. (1995) GDNF is an age-specific survival factor for sensory and autonomic neurons. Neuron 15, 821-828.
Buj-Bello, A., Adu, J., Pinon, L.G.P., Horton, A., Thompson, J., Rosenthal, A., Chinchetru, M., Buchman, V.L. & Davies, A.M. (1997) Neurturin responsiveness requires a GPI-linked receptor and the Ret receptor tyrosine kinase. Nature 387, 721-724.
Choi-Lundberg, D.L., Lin, Q., Chang, Y.N., Chiang, Y.L., Hay, C.M., Mohajeri, H., Davidson, B.L. & Bonn, M.C. (1997) Dopaminergic neurons protected from degeneration by GDNF gene therapy. Science. 275, 838-841.
Creedon, D.J., Tansey, M.G., Baloh, R.H., Osborne, P.A., Lampe, P.A., Fahrner, T.J., Heuckeroth, R.O., Milbrandt, J. & Johnson, E.M. (1997) Neurturin shares receptors and signal transduction pathways with glial cell line-derived neurotrophic factor in sympathetic neurons. Proc. Natl. Acad. Sci. USA 94, 7018-7023.
Durbec, P., Marcos-Gutierrez, C.V., Kilkenny, C., Grigoriou, M., Wartiowaara, K., Suvanto, P., Smith, D., Ponder, В., Costantini, F., Saarma, M., Sariola, H. & Pachnis, V. (1996) GDNF signalling through the RET receptor tyrosine kinase. Nature 381, 789-793.
Edery, P., Lyonnet, S., Mulligan, L.M., Pelet, A., Dow, E., Abel L., Holder S., Nihoul-Fekete, C., Ponder, B.A. & Munnich, A. (1994) Mutations of the RET proto-oncogene in Hirschsprung's disease. Nature 367, 378-380.
Gash, D.M., Zhang, Z., Ovadia, A., Cass, W.A., Yi, A., Simmerman, L., Russell, D., Martin, D., Lapchak, P.A., Collins, F., Hoffer, B.J. & Gerhardt, G.A. (1996) Functional recovery in parkinsonian monkeys treated with GDNF. Nature 380, 252-255.
GFRα Nomenclature Committee (1997) Nomenclature of GPI-linked receptors for the GDNF ligand family. Neuron 19, 485.
Hakim A. "Ischemic penumbra: the therapeutic window." Neurology. 1998 Sep; 51 (3 Suppi 3): S44-6.
Henderson, C.E., Phillips, H.S., Pollock, R.A., Davies, A.M., Lemeulle, C., Armanini, M., Simmons, L., Moffet, В., Vandlen, R.A., Koliatsos, V.E. & Rosenthal, A. (1994) GDNF: a potent survival factor for motoneurons present in peripheral nerve and muscle. Science 266, 1062-1064.
Heng, H.H.Q., Squire, J. & Tsui, L.-С. (1992) High resolution mapping of mammalian genes by in situ hybridization to free chromatin. Proc. Natl. Acad. Sci. USA 89, 9509-9513.
Heng, H.H.Q. & Tsui, L.-C. (1993) Modes of DAPI banding and simultaneous in situ hybridization. Chromosoma 102, 325-332.
Heuckeroth, R.O., Kotzbauer, P., Copeland, N.G., Gilbert, D.J., Jenkins, N.A., Zimonjic, D.B., Popescu, N.C., Johnson, E.M. & Milbrandt, J. (1997) Neurturin, a novel neurotrophic factor, is localized to mouse chromosome 17 and human chromosome 19pl3.3. Genomics 44, 137-140.
Jing, S., Wen, D., Yu, Y., Holst, P.L., Luo, Y., Fang, M., Tamir, R., Antonio, L., Hu, Z., Cupples, R., Louis, J.-C., Hu, S., Altrock, B.W. & Fox, G.M. (1996) GDNF-induced activation of the ret protein tyrosine kinase is mediated by GDNFR-a, a novel receptor for GDNF. Cell 85, 1113-1124.
Jing, S., Yu, Y., Fang, M., Hu, Z., Holst, P.L., Boone, Т., Delaney, J., Schultz, H., Zhou, R. & Fox, G.M. (1997) GFRα-2 and GFRα-3 are two new receptors for ligands of the GDNF family. J. Biol. Chem. 272, 33111-33117.
Kingsley, D.M. (1994) The TGF-beta superfamily: new members, new receptors, and new genetic tests of function in different organisms. Genes & Development 8, 133-146.
Klein, R.D., Sherman, D., Ho, W.-H., Stone, D., Bennett, G.L., Moffat, B., Vandlen, R., Simmons, L., Gu, Q., Hongo, J.-A., Devaux, В., Poulsen, K., Armanini, M., Nozaki, C., Asai, N., Goddard, A., Phillips, H., Henderson, C.E., Takahashi, M. & Rosenthal, A. (1997) A GPI-linked protein that interacts with Ret to form a candidate neurturin receptor. Nature 387, 717-721.
Kotzbauer, P.Т., Lampe, P.A., Heuckeroth, P.O., Golden, J.P., Creedon, D.J., Johnson, E.M. & Milbrandt, J. (1996) Neurturin, a relative of glial-cell-line-derived neurotrophic factor. Nature 384, 467-470.
Lin, L.-F.H., Doherty, D.H., Lile, J.D., Bektesh, S. & Collins, F. (1993) GDNF: a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons. Science 260, 1130-1132.
Mandel, R.J., Spratt, S.K., Snyder, R.O. & Leff, S.E. (1997) Midbrain injection of recombinant adeno-associated virus encoding rat glial cell line-derived neurotrophic factor protects nigral neurons in a progressive 6-hydroxydopamine-induced degeneration model of Parkinson's disease in rats. Proc. Natl. Acad. Scl. USA 94, 14083-14088.
Marsden et al. "The causes of Parkinson's disease are being unraveled and rational neuroprotective therapy is close to reality." Ann Neurol. 1998 Sep; 44 (3 Suppi 1): S189-96.
Masure, S., Cik, M., Pangalos, M.N., Bonaventure, P., Verhasselt, P., Lesage, A.S., Leysen, J.E. & Gordon R.D. (1998) Molecular cloning, expression and tissue distribution of glial-cell-line-derived neurotrophic factor family receptor α-3 (GFRα-3). Eur. J. Blochem. 251, 622-630.
Matsushita, N., Fujita, Y., Tanaka, M., Nagatsu, Т. & Kiuchi, K. (1997) Cloning and structural organization of the gene encoding the mouse glial cell line-derived neurotrophic factor, GDNF. Gene 203, 149-157.
Milbrandt, J., de Sauvage, F.J., Fahrner, T.J., Baloh, R.H., Leitner, M.L., Tansey, M.G., Lampe, P.A., Heuckeroth, R.O., Kotzbauer, P.Т., Simburger, K.S., Golden, J.P., Davies, J.A., Vejsada, R., Kato, A.C., Hynes, M., Sherman, D., Nishimura, M., Wang, L.C., Vandlen, R., Moffat, В., Klein, R.D., Poulsen, K., Gray, C., Garces, A., Henderson, C.E., Phillips, H.S. & Johnson, E.M. Jr. (1998) Persephin, a novel neurotrophic factor related to GDNF and neurturin. Neuron 20, 245-253.
Moore, M.W., Klein, R.D., Farinas, I., Sauer, H., Armanini, M., Phillips, H., Reichardt, L.F., Ryan, A.M., Carver-Moore, K. & Rosenthal, A. (1996) Renal and neuronal abnormalities in mice lacking GDNF. Nature 382, 76-79.
Mount, H.T., Dean, D.O., Alberch, J., Dreyfus, C.F. & Black, I.E. (1995) Glial cell line-derived neurotrophic factor promotes the survival and morphologic differentiation of Purkinje cells. Proc. Natl. Acad. Scl. USA 92, 9092-9096.
Nagy Z. et al. "The cell division cycle and the pathophysiology of Alzheimer's disease." Neuroscience. 1998 Dec; 87(4): 731-9.
Naveilhan, P., Baudet, C., Mikaels, A., Shen, L., Westphal, H. & Ernfors, P. (1998) Expression and regulation of GFRα3, a glial cell line-derived neurotrophic factor family receptor. Proc. Natl. Acad. Scl. USA 35, 1295-1300.
Nuydens R., Dispersyn G., Van den Kieboom G., De Jong M., Connors R., Ramaekers F., Borgers M., Geerts H. "Bcl-2 protects neuronal cells against taxol-induced apoptosis by inducing mutli-nucleation", submitted.
Oppenheim, R.W., Houenou, L.J., Johnson, J.E., Lin, L.F., Li, L., Lo, A.C., Newsome, A.L., Prevette, D.M. & Wang, S. (1995) Developing motor neurons rescued from programmed and axotomy-induced cell death by GDNF. Nature 373, 344-346.
Pichel, J.G., Shen, L., Sheng, H.Z., Granholm, A.C., Drago, J., Grinberg, A., Lee, E.J., Huang, S.P., Saarma, M., Hoffer, B.J., Sariola, H. & Westphal, H. (1996) Defects in enteric innervation and kidney development in mice lacking GDNF. Nature 382, 73-76.
Romeo, G., Ronchetto, P., Luo, Y., Barone, V., Seri, M., Ceccherini, I., Pasini, В., Bocciardi, R., Lerone, M., Kaariainen, H. et al. (1994) Point mutations affecting the tyrosine kinase domain of the RET proto-oncogene in Hirsch-sprung's disease. Nature 367, 377-378.
Sanchez, M.P., Silos-Santiago, I., Frisen, J., He, В., Lira, S.A. & Barbacid, M. (1996) Renal agenesis and the absence of enteric neurons in mice lacking GDNF. Nature 582, 70-73.
Sanicola, M., Hession, C., Worley, D., Carmillo, P., Ehrenfels, C., Walus, L., Robinson, S., Jaworski, G., Wei, H., Tizard, R., Whitty, A., Pepinsky, R.B. & Cate, R.L. (1997) Gliai cell line-derived neurotrophic factor-dependent RET activation can be mediated by two different cell-surface accessory proteins. Proc. Natl. Acad. Scl. USA 94, 6238-6243.
Smirnova et al. "Thrombin is an extracellular signal that activates intracellular death protease pathways inducing apoptosis in model motor neurons". J Neurobiol. 1998 Jul; 36(l): 64-80.
Srinivisan et al. "Serum from patients with type 2 diabetes with neuropathy induces complement-independent, calcium-dependent apoptosis in cultured neuronal cells." J. Clin. Invest. 1998 Oct 1; 102 (7): 1454-62.
Steger C. "An unbiased detector of curvilinear structures" IEEE Transactions on pattern analysis and machine intelligence, 20, 1, 113-125 (1998).
Suvanto, P., Wartiovaara, К., Lindahl, M., Arumae, U., Moshnyakov, M., Horelli-Kuitunen, N., Airaksinen, M.S., Palotie, A., Sariola, H. & Saarma, M. (1997) Cloning, mRNA distribution and chromosomal localisation of the gene for glial cell line-derived neurotrophic factor receptor β, a homologue to GDNFRa. Human Mol. Genet. 6, 1267-1273.
Tomac, A., Lindqvist, E., Lin, L.F., Ogren, S.O., Young, D., Hoffer, B.J. & Olson, L. (1995) Protection and repair of the nigrostriatal dopaminergic system by GDNF in vivo. Nature 373, 335-339.
Treanor, J.J.S., Goodman, L., de Sauvage, F., Stone, D.M., Poulsen, K.T., Beck, C.D., Gray, C., Armanini, M.P., Pollock, R.A., Hefti, F., Phillips, H.S., Goddard, A., Moore, M.W., Buj-Bello, A., Davies, A.M., Asai, N., Takahashi, M., Vandlen, R., Henderson, C.E. & Rosenthal, A. (1996) Characterization of a multicomponent receptor for GDNF. Nature 382, 80-83.
Trupp, M., Arenas, E., Fainzilber, M., Nilsson, A.S., Sieber, B.A., Grigoriou, M., Kilkenny, C., SalazarGrueso, E., Pachnis, V.,  U., Sariola, H., Saarma, M. & Ibanez, C.F. (1996) Functional receptor for GDNF encoded by the c-ret proto-oncogene. Nature 381, 785-788.
U., Sariola, H., Saarma, M. & Ibanez, C.F. (1996) Functional receptor for GDNF encoded by the c-ret proto-oncogene. Nature 381, 785-788.
Wellington et al. "Toward understanding the molecular pathology of Huntington's disease." Brain Pathol. 1997 Jul; 7 (3): 979-1002.
Widenfalk, J., Nosrat, С., Tomac, A., Westphal, H., Hoffer, B. & Olson, L. (1997) Neurturin and glial cell line-derived neurotrophic factor receptor-β (GDNFR-α), novel proteins related to GDNF and GDNFR-α with specific cellular patterns of expression suggesting roles in the developing and adult nervous system and in peripheral organs. J. Neurosci. 27, 8506-8519.
Widenfalk, J., Tomac, A., Lindqvist, E., Hoffer, В. & Olson, L. (1998) GFRα-3, a protein related to GFRα-1, is expressed in developing peripheral neurons and ensheathing cells. Eur. J. Neurosci. 10, 1508-1517.
Worby, C.A., Vega, Q.C., Zhao, Y., Chao, H. H.-J., Seasholtz, A.F. & Dixon, J.E. (1996) Glial cell line derived neurotrophic factor signals through the RET receptor and activates nitogen-activated protein kinase. J. Blol. Chem. 272, 23619-23622.
Worby, C.A., Vega, Q.C., Chao, H.H.J., Seasholtz, A.F., Thompson, R.C. & Dixon J.E. (1998) Identification and characterization of GFRα-3, a novel co-receptor belonging to the glial cell line-derived neurotrophic receptor family. J. Blol. Chem. 273, 3502-3508.
Yan, Q., Matheson, C. & Lopez, O.T. (1995) In vivo neurotrophic effects of GDNF on neonatal and adult facial motor neurons. Nature 373, 341-344.
Список аббревиатур
BLAST - устройство для поиска гомологичных последовательностей при помощи локального сравнительного анализа основных первичных структур
п.о. - пары оснований
кДНК - комплементарная ДНК
CNS - центральная нервная система
EST - метка экспрессированной последовательности
EVN - эновин
GDNF - выделенная линия глиальных клеток
GFRα - рецептор а семейства GDNF
GPI - гликозилфосфатидилинозитол
МТС - кДНК из нескольких тканей
NTN - нейротурин
PCR - полимеразная реакция синтеза цепи
PNS - периферическая нервная система
PSP - персефин
RT-PCR - полимеразная реакция синтеза цепи с обратной транскрипцией
TGF-β - трансформирующий фактор роста β
FISH - флуоресцентная гибридизация in situ
MTN - нозерн-блоттинг нескольких тканей
NGF - фактор роста нервов
SPR - резонанс поверхностного плазмона
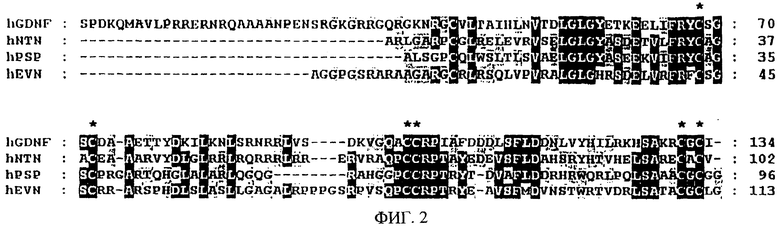


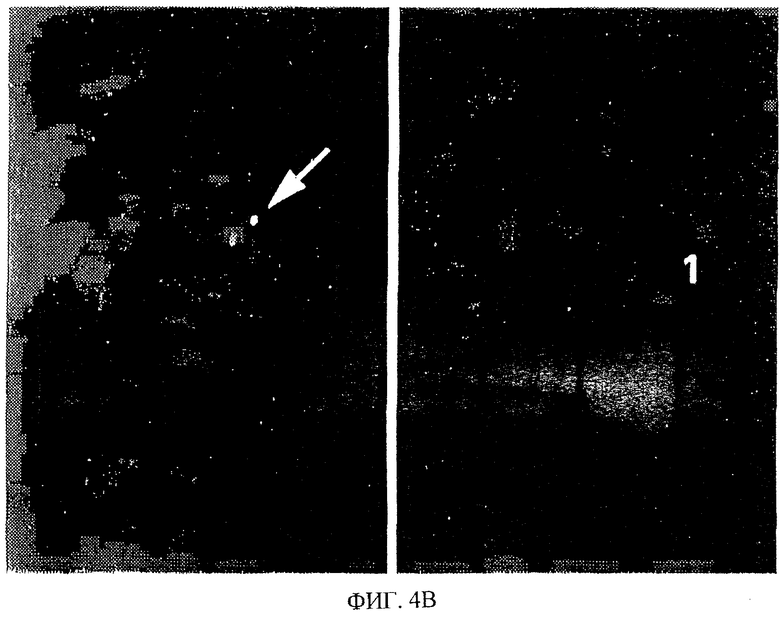
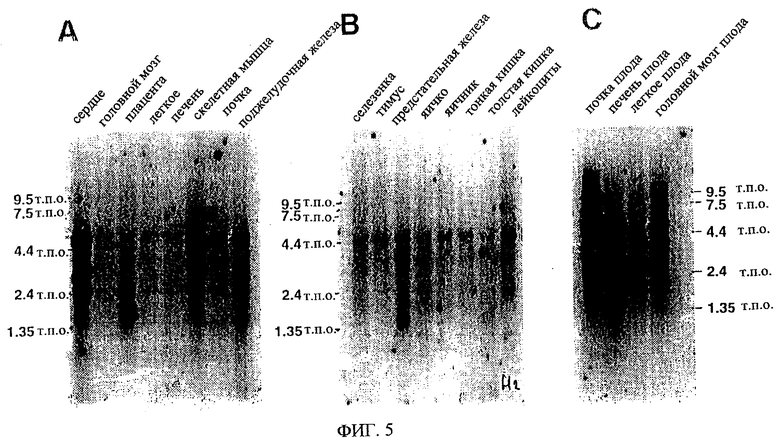
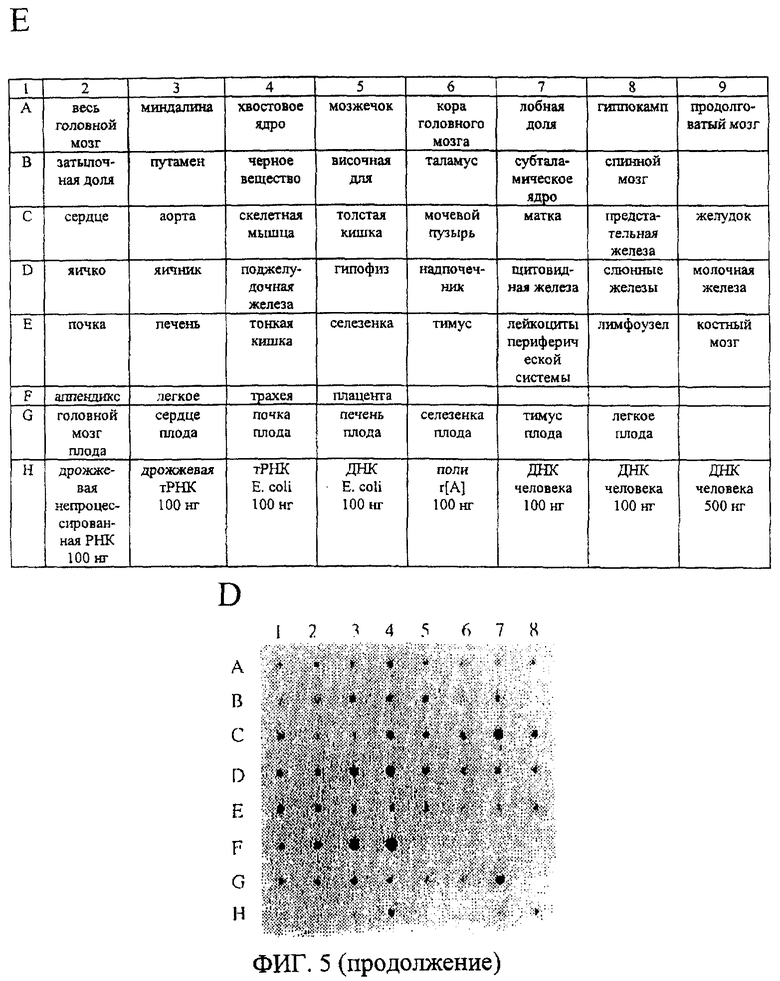
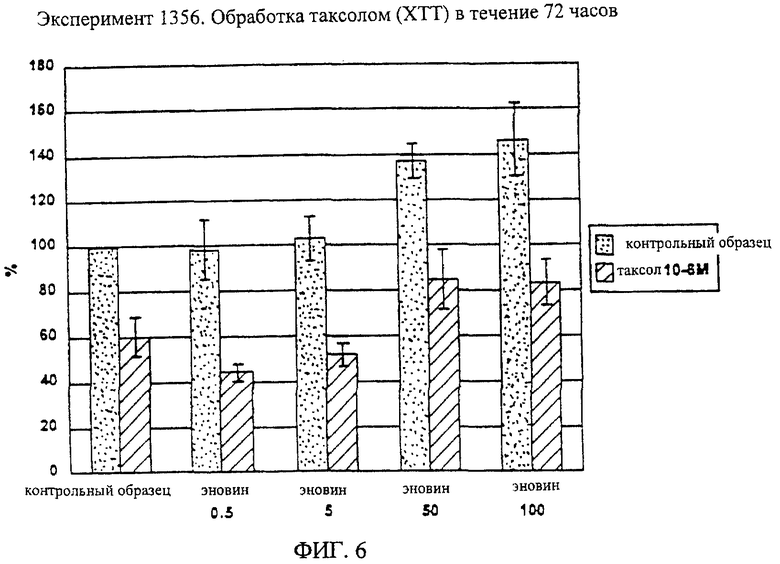
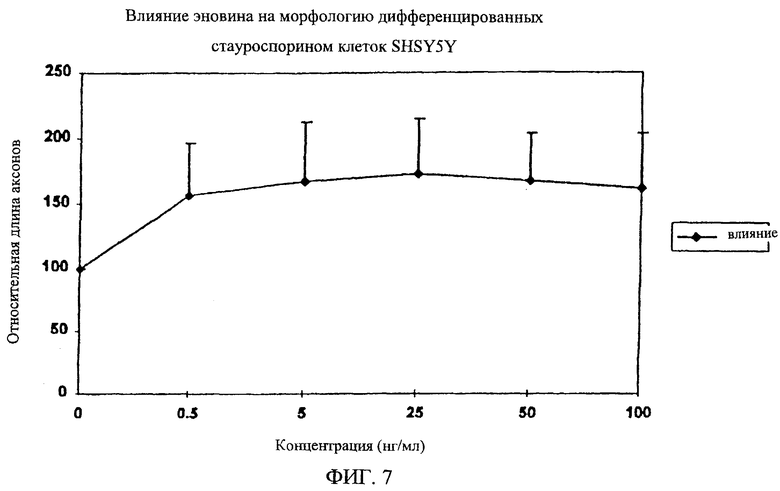
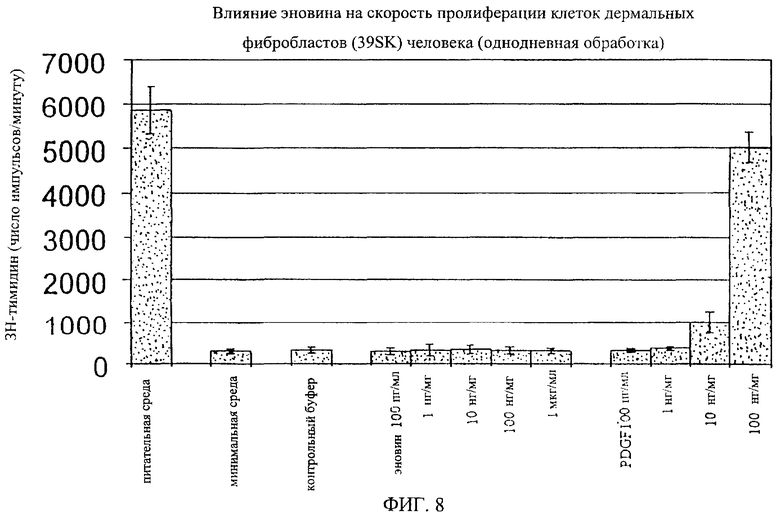
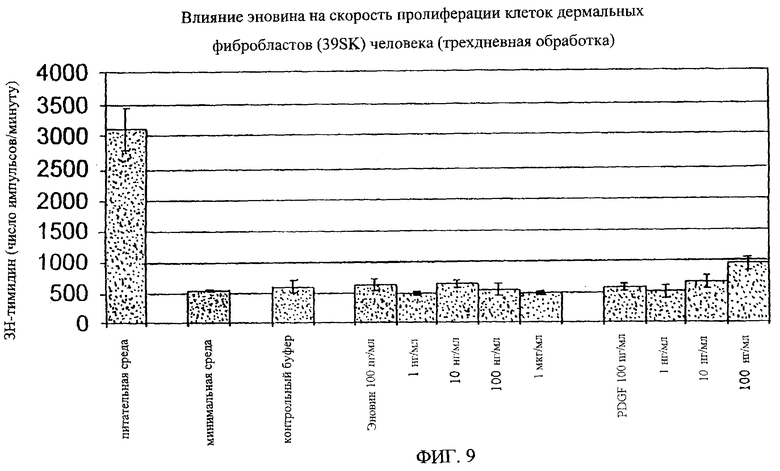
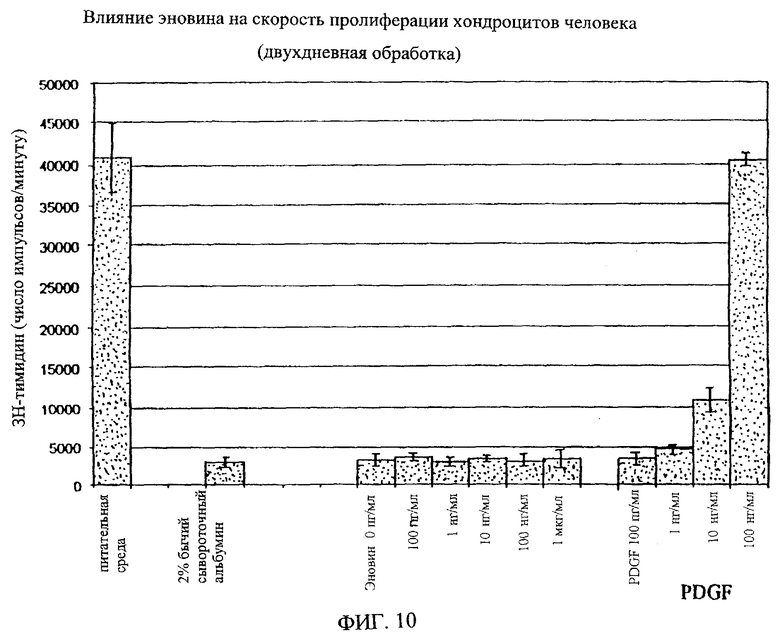
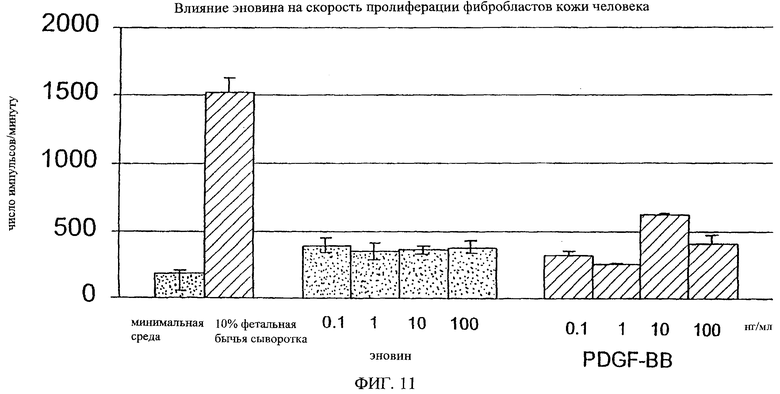
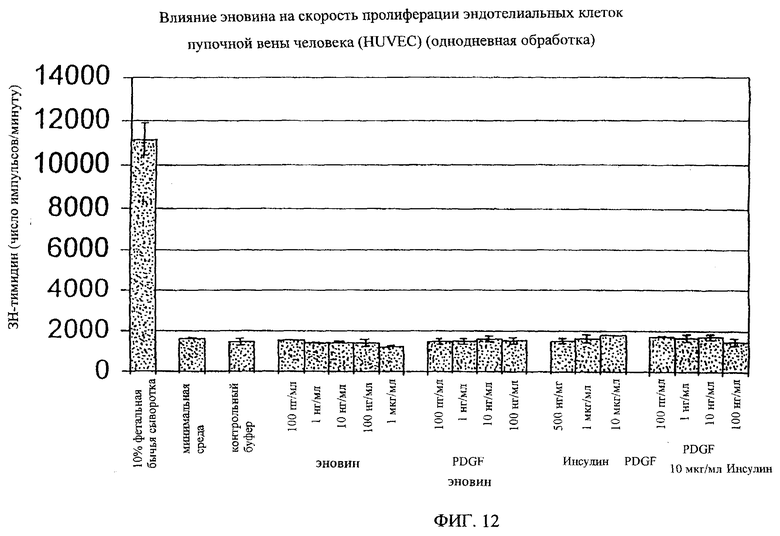
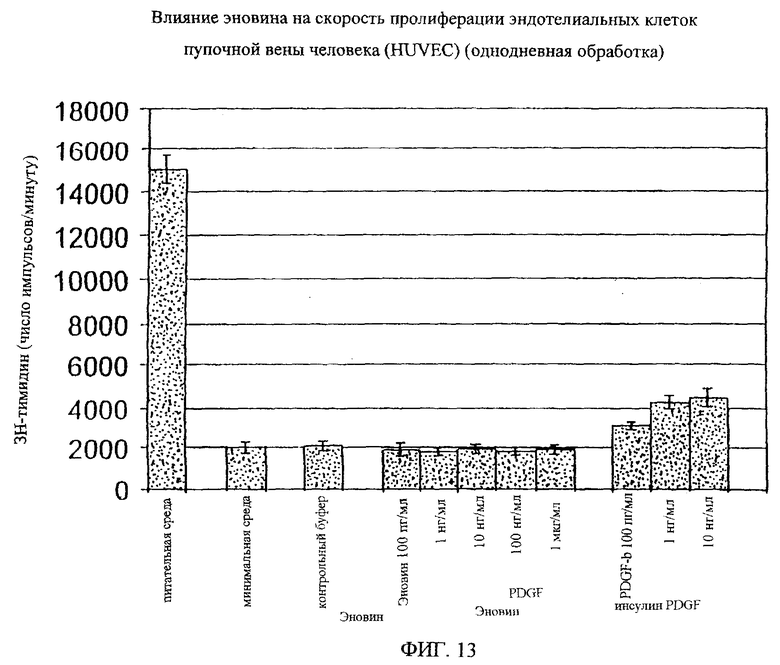
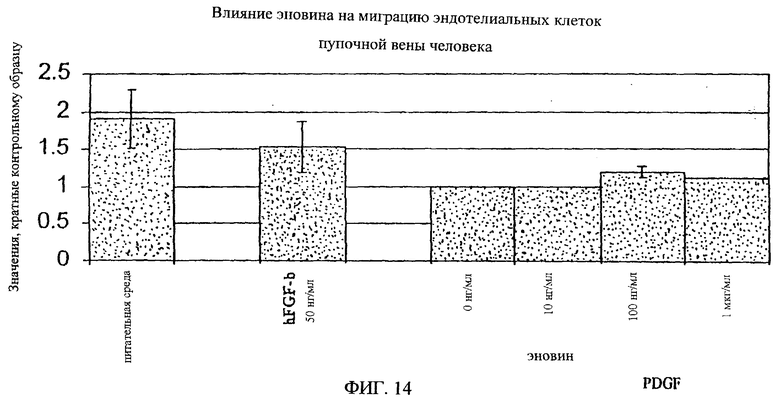
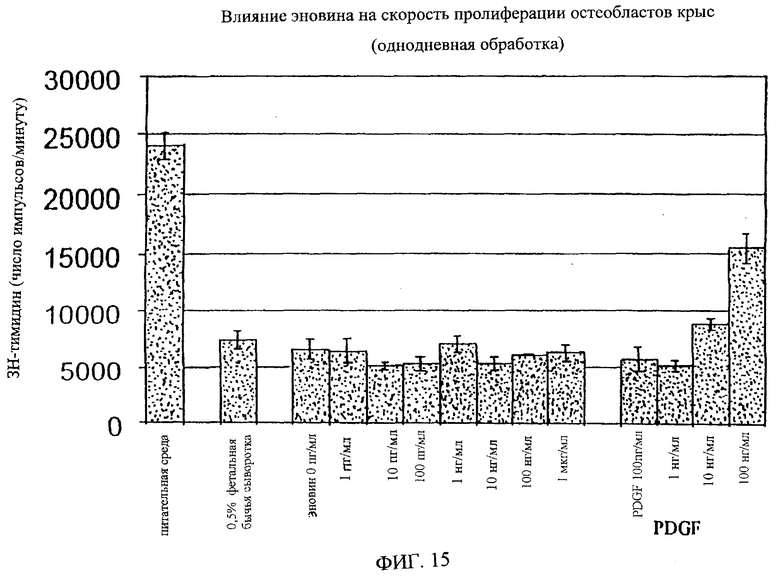
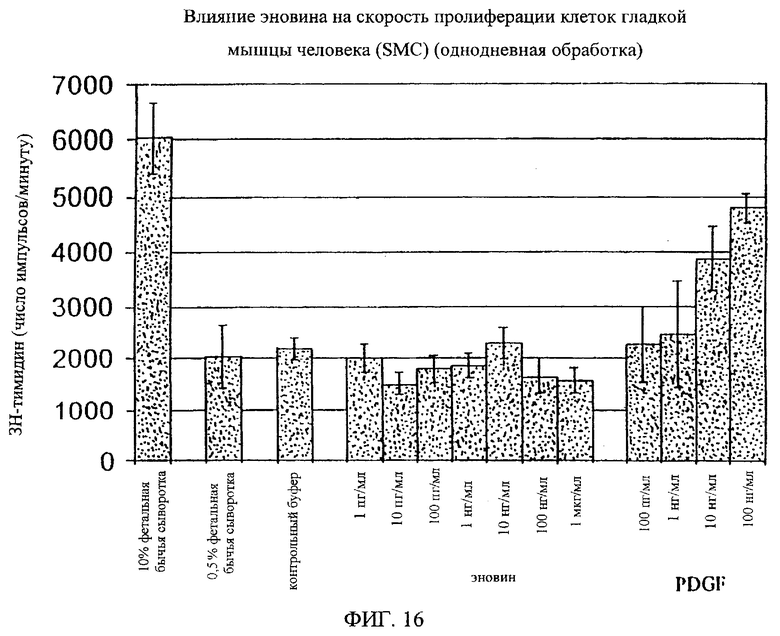
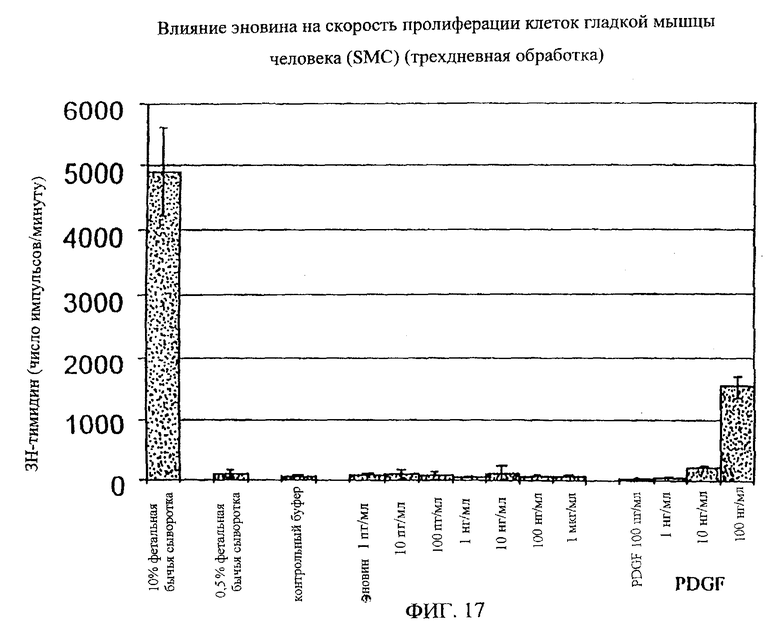
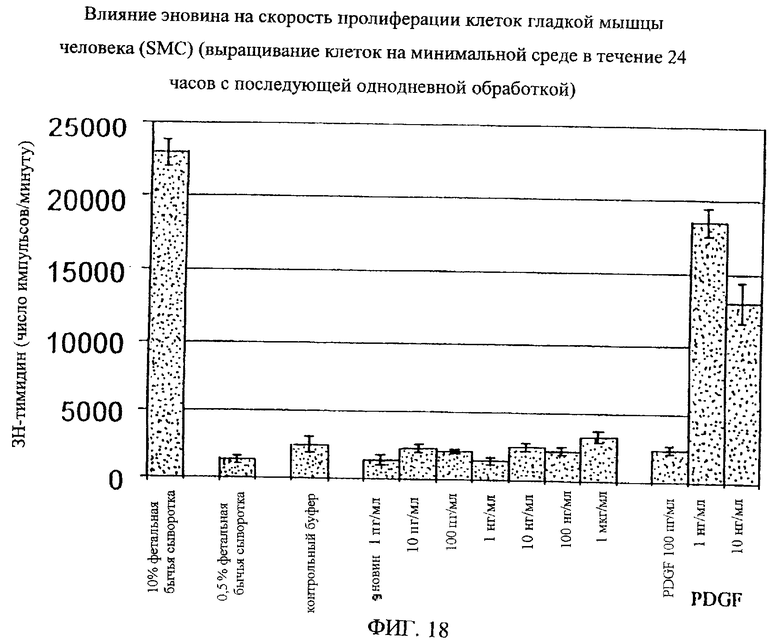
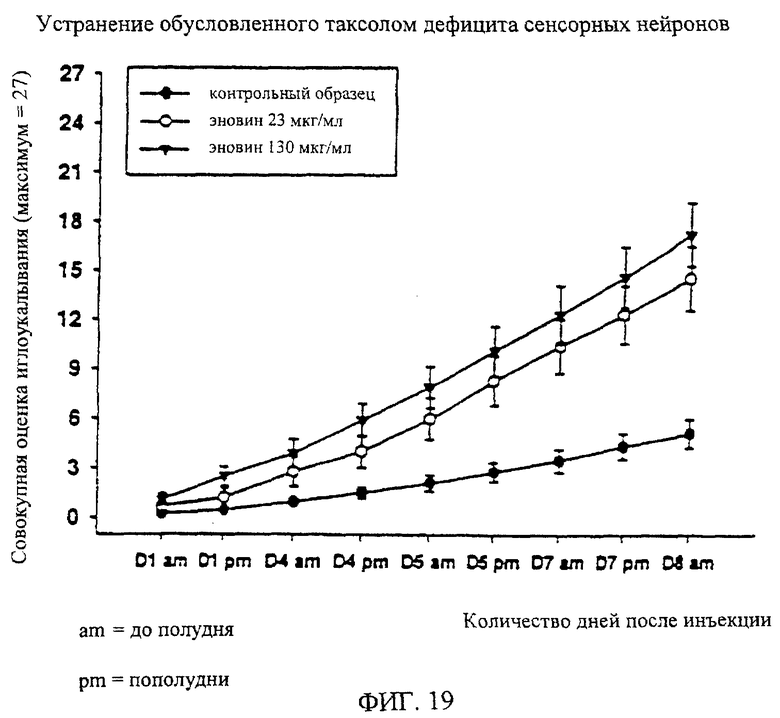
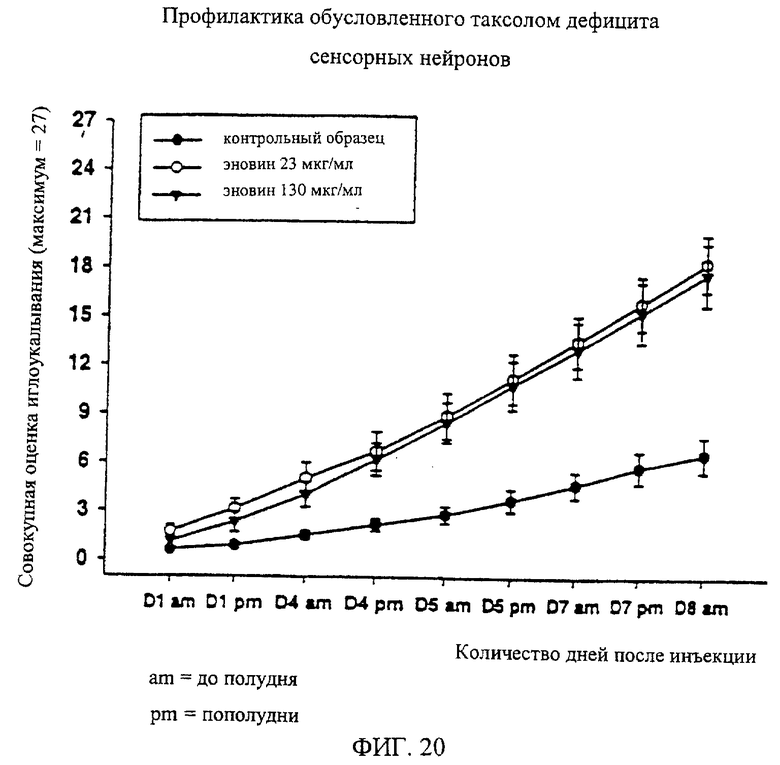
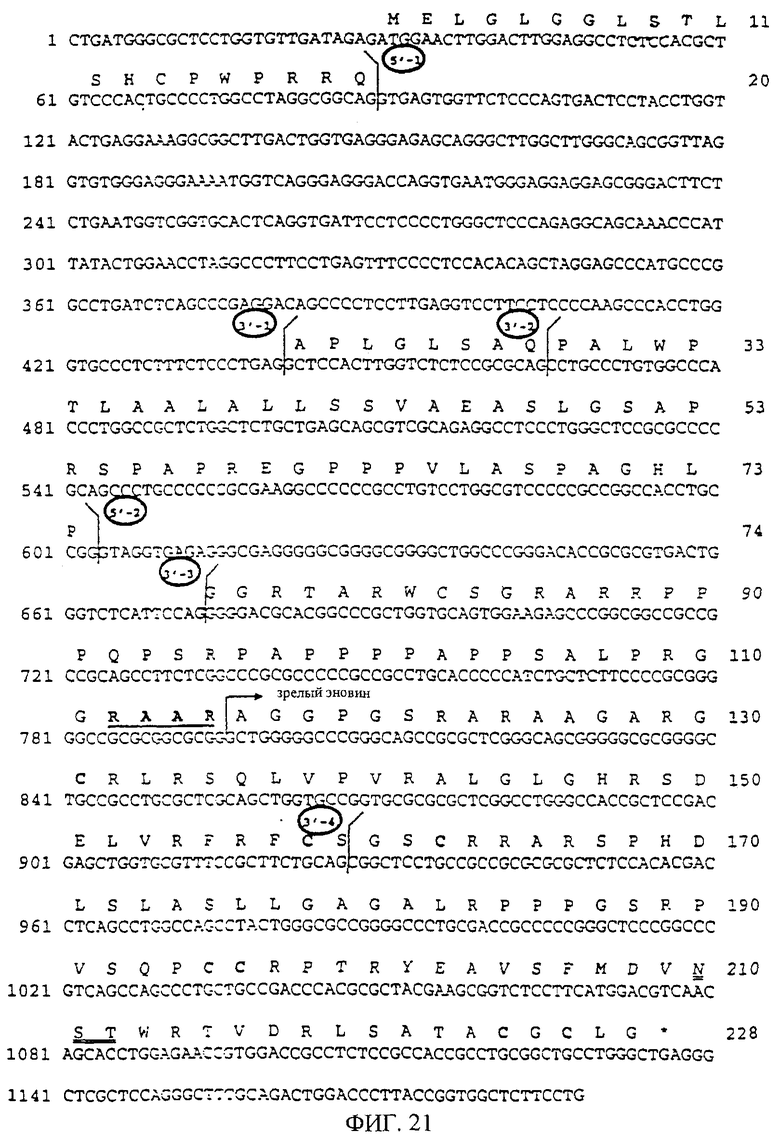
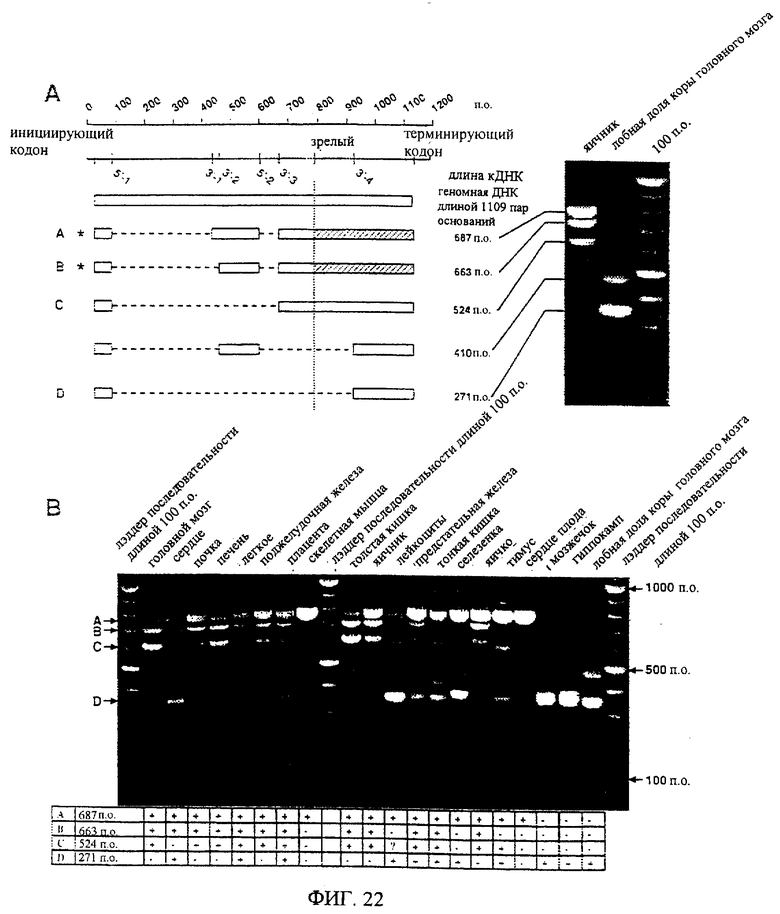


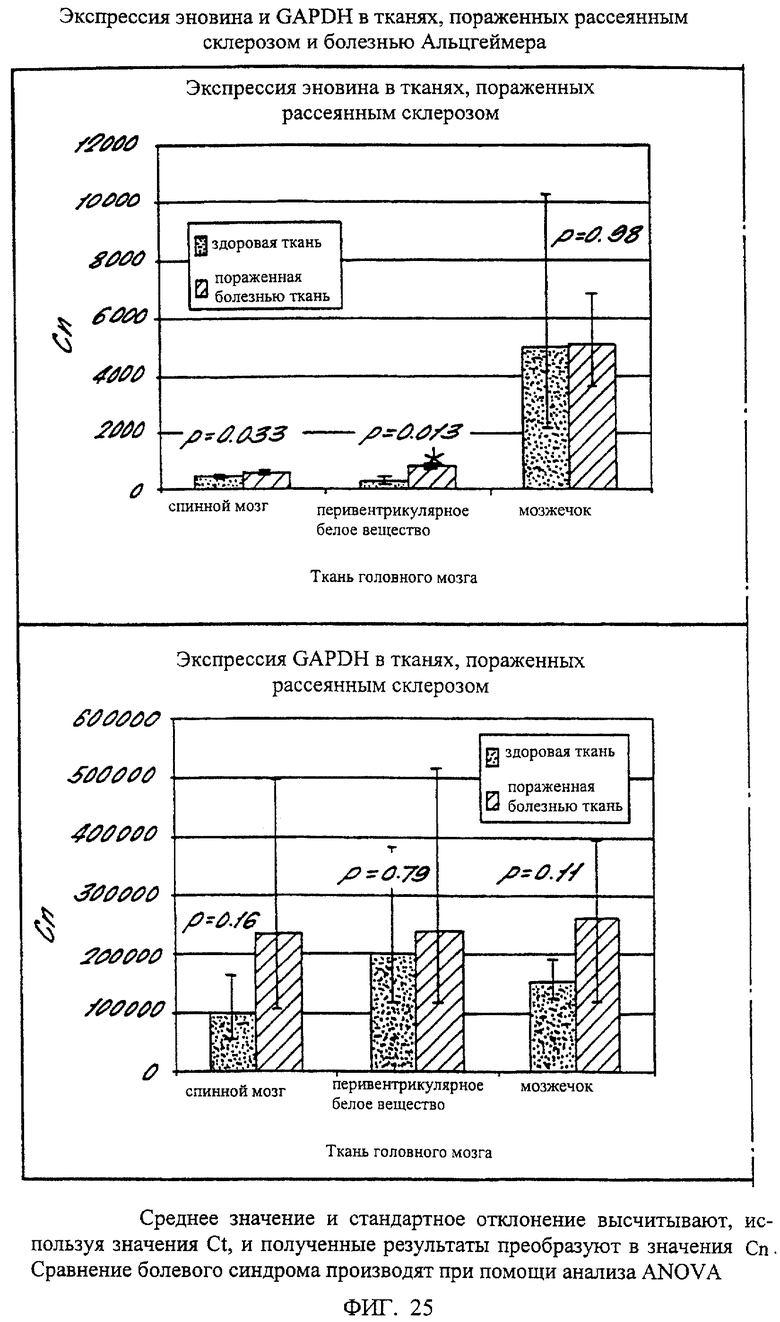


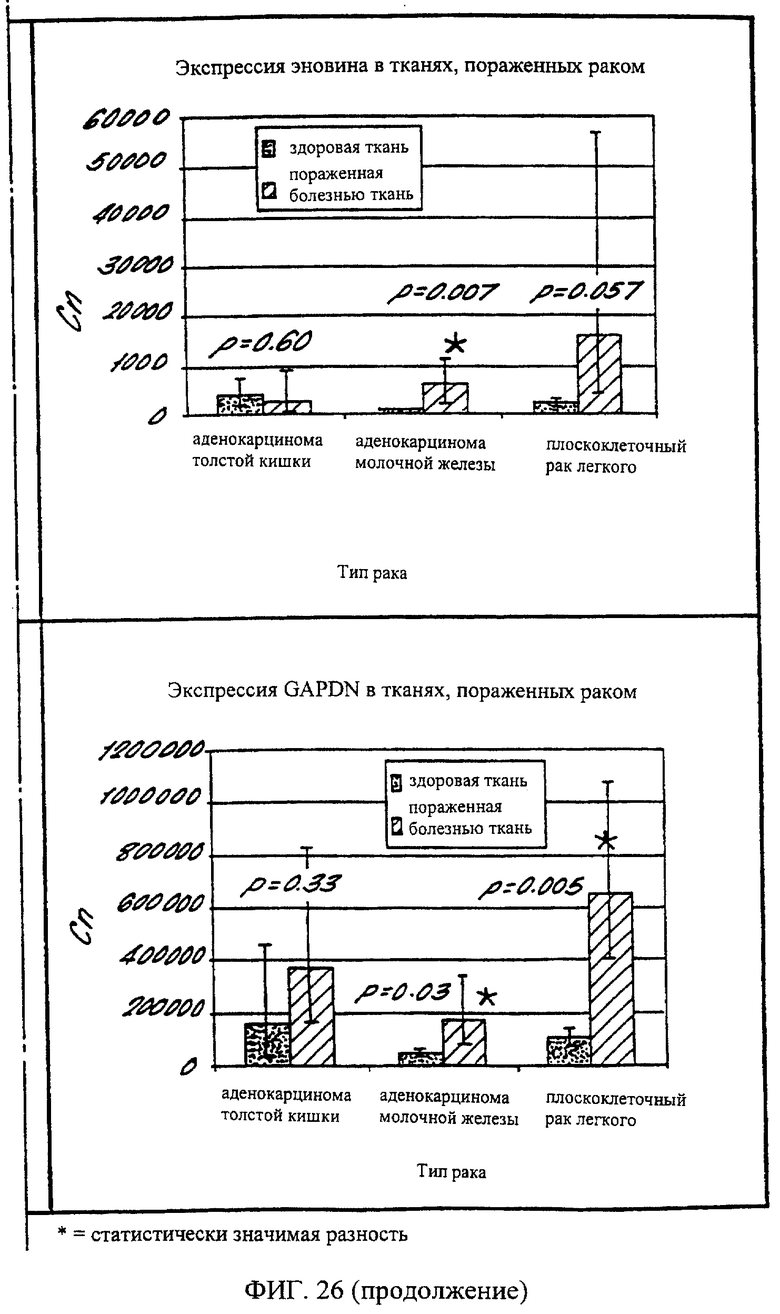
Изобретение относится к биотехнологии и может быть использовано для получения нейротрофического фактора роста человека (эновин). Выделенную молекулу нуклеиновой кислоты, кодирующую эновин, встраивают в экспрессирующий вектор. Вектор или фактор роста (эновин) используют для получения фармацевтической композиции для лечения и профилактики нарушений нервной системы. Фактор роста обнаруживают в образце с помощью антитела, способного связываться с фактором роста. Идентификацию агониста или антагониста нейротрофического фактора роста проводят путем взаимодействия биологического материала, экспрессирующего рецептор фактора роста, с испытуемым соединением в присутствии указанного фактора роста. Изобретение позволяет разрабатывать лекарственные средства для профилактики и лечения нейродегенеративных заболеваний. 11 н. и 15 з.п. ф-лы, 27 ил., 4 табл.
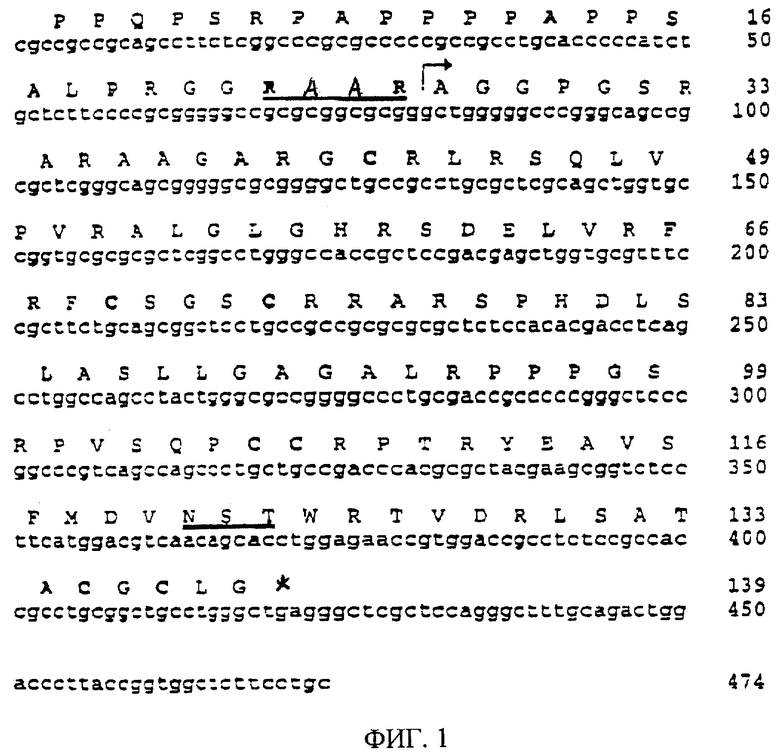
| LIN L.F | |||
| et al., GDNF: a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons | |||
| SCIENCE, 1993, v.260, р.1130-1132 | |||
| GREEDON D.J | |||
| et al., Neurturin shares receptors and signal transduction pathways with glial cell line-derived neurotrophic factor in sympathetic neurons | |||
| PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| MILBRANDT J | |||
| et al., Persephin, a novel neurotrophic factor related to GDNF and neurturin | |||
| Neuron, 1998, v.20, n.2, р.245-253 | |||
| WO 00/01815 A, 13.01.2000. | |||
Авторы
Даты
2004-10-27—Публикация
1999-07-14—Подача