Данное изобретение относится к нуклеотидным и аминокислотным последовательностям факторов яйцеклеток для изменения роста яичниковых фолликулов in vivo или in vitro. Данное изобретение относится также к новым гомодимерным и гетеродимерным полипептидам и их применению для изменения роста яичниковых фолликулов млекопитающих in vivo или in vitro. В частности, данное изобретение в широком смысле относится к активной и пассивной иммунизации против этих гомо- или гетеродимерных полипептидов или их функциональных фрагментов или вариантов для изменения фолликулярного роста in vivo или in vitro.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Молекулярная природа регуляторных молекул, ответственных за стимуляцию ранних фаз яичникового фолликулогенеза (т.е. роста и дифференцировки примордиальных фолликулов в первичные, вторичные и преантральные фолликулы), является слабо исследованной. С другой стороны, фолликулостимулирующий гормон (FSH) и лютеинизирующий гормон являются гликопротеиновыми гормонами, происходящими из гипофиза, и обычно считаются ключевыми факторами, регулирующими более поздние стадии фолликулогенеза яичников. Кроме того, FSH считается единственным наиболее важным фактором для стимуляции большего, чем нормальное, числа фолликулов для овуляции, факта, который хорошо иллюстрируется широким применением коммерческих препаратов FSH в схемах гиперстимуляции яичников как в медицине, так и в ветеринарии. Недавние исследования показали, что ранний фолликулогенез регулируется внутрияичниковыми факторами, из которых наибольшее внимание привлекли полученный из клеток гранулезы (зернистой оболочки фолликулов яичника) фактор стволовых клеток (или c-kit-лиганд) и ооцитарный фактор-9 дифференцировки роста (GDF-9), так как оба, по-видимому, являются существенными для раннего фолликулогенеза млекопитающих.
GDF-9 был впервые описан в 1993 году как новый член надсемейства трансформирующих факторов роста бета (TGF-β), который специфически экспрессируется в яичнике (McPherron and Lee, 1993). Подобно другим членам TGF-β-семейства, GDF-9 кодируется в виде препропептида, состоящего из сигнального пептида, прорайона и так называемого С-концевого зрелого района, который отщепляется от пептида-предшественника внутриклеточной протеазой, принадлежащей к группе фурин-подобных протеаз. Факторы роста TGF-β-семейства характеризуются обычным распределением остатков цистеина, обнаруживаемым в зрелом районе, которое, по-видимому, образуется во всех членах этого семейства; это жесткая внутримолекулярная структура, известная как «цистеиновый узел», которая состоит из шести остатков Cys, образующих три характерных дисульфидных мостика в мономере члена TGF-β-семейства (Daopin et al., 1993; Schlunegger and Grutter, 1992 and 1993; Griffith et al., 1996; Scheufler et al., 1999). Большинство членов TGF-β-семейства имеют консервативный седьмой остаток Cys, который является ответственным за ковалентную гомодимеризацию двух идентичных мономеров (гомодимеры) или за гетеродимеризацию конкретного члена TGF-β-семейства с другим отличающимся членом этого семейства (гетеродимеры).
В мышах GDF-9 экспрессируется в яйцеклетках из первичной стадии фолликулярного развития до овуляции (McGrath et al., 1995; Laitinen et al., 1998). С использованием мышиной последовательности GDF-9 в качестве тест-последовательности для поисков в базах данных авторы изобретения идентифицировали кДНК GDF-9-подобной маркерной экспрессируемой последовательности (EST), полученной из библиотеки 2-клеточного мышиного эмбриона (Laitinen et al., 1998). Авторы показали, что транскрипт этого нового фактора, GDF-9В, который является на 55% гомологичным GDF-9, экспрессируется в яйцеклетках мышиного яичника одновременно с GDF-9 (Laitinen et al., 1998). С использованием ПЦР и праймеров, произведенных из мышиной EST-последовательности, авторы данного изобретения амплифицировали фрагмент соответствующего гена из геномной ДНК человека, картировали этот генный локус относительно хромосомы Хр11.2 и расшифровали структуру гена GDF-9В человека из выделенных космидных клонов (Aaltonen et al., 1999). Интересно, что в яичнике человека экспрессия мРНК GDF-9 начинается в первичных фолликулах несколько раньше, чем экспрессия мРНК GDF-9В (Aaltonen et al., 1999). Мышиный и человеческий гены GDF-9В клонировали, и белок, кодируемый этим геном, был назван также костным морфогенетическим белком 15 (ВМР-15) (Dube et al., 1998).
По-видимому, GDF-9 является существенным для яичникового фолликулогенеза. Из литературы известно, что GDF-9-дефицитные мыши (GDF-9 -/-) являются бесплодными вследствие раннего прекращения фолликулогенеза (Dong et al., 1996). В яичниках GDF-9 -/- фолликулогенез останавливается на стадии первичных фолликулов, когда яйцеклетка окружает один слой кубоидальных клеток гранулезы (зернистой оболочки фолликулов яичника). Даже хотя эта яйцеклетка продолжает расти, клетки гранулезы не могут пролиферировать и никакая дифференцировка текальных клеток не связана с увеличением фолликулов.
Ген плодовитости Inverdale (FecX1) был идентифицирован как основной ген, влияющий на плодовитость овец стада Romney (Davis et al., 1991). Сегрегационные анализы определили, что этот ген находится на Х-хромосоме и что овцы (матки), несущие единственную копию этого гена (I/+), имеют размер приплода (помета) приблизительно на 0,6 ягнят больше, чем не несущие этого гена овцы (+/+). Увеличение в числе родившихся ягнят непосредственно связано с измененным характером фолликулярного развития и увеличением частоты овуляции до более высокой, чем в диком типе (˜1,0). (Shackell et al., 1993; Davis et al., 1991). В противоположность этому гомозиготные овцы-носители этого гена, имеющие две копии этого гена (I/I), являются бесплодными вследствие состояния яичниковой недостаточности (Davis et al., 1992). В яичниках овцы (I/I) фолликулогенез останавливается на первичной фолликулярной стадии, и этот фенотип не является несходным с фенотипом, наблюдаемым у GDF-9 (-/-) мышей (Braw-Tal et al., 1993; McNatty et al., 1995; Smith et al., 1997).
Было показано, что второе плодовитое стадо Romney (Hanna, 1995), без известной связи со стадом Inverdale, также несет Х-сцепленную мутацию с фенотипом, сходным с фенотипом Inverdale. Доказательство, что животные Hanna несли мутацию (FecXH) в том же самом гене, что и Inverdale, было получено, когда были получены бесплодные самки в результате спаривания несущих ген Inverdale баранов с несущими ген Hanna овцами (Davis et al., 1995). Линия Hanna поддерживалась в исследовательском центре Invermay AgResearch Centre в виде отдельной группы вместе с линией Inverdale.
В заявке на выдачу патента Новой Зеландии №500844 авторы данного изобретения идентифицировали в овце Inverdale нуклеотидную замену за сайтом процессинга зрелого пептида гена GDF-9В, которая превращает кодон GTC (аминокислоты валина (V)) в GAC (аспарагиновой кислоты (D)). Авторы показали также, что в овце Hanna нуклеотид С за сайтом процессинга зрелого пептида превращен в Т. Это превращает кодон CAG (кодирующий глутамин (Q)) в кодон TAG (кодирующий терминацию), что приводит к укороченному зрелому белку. Предполагается, что эти соответствующие мутации в Inverdale и Hanna являются причинами "полосатых" яичников и неовуляционных состояний в гомозиготных овцах Inverdale и Hanna и потомстве овец Inverdale, спаренных с овцами Hanna.
Ранее было показано, что мыши GDF-9 -/- являются бесплодными, что указывало на то, что GDF-9 является важным для нормальной фертильности у некоторых животных. Однако, благодаря обнаружению родственного специфического для яйцеклетки фактора GDF-9В авторами данного изобретения были сделаны несколько новых открытий в поддержку точки зрения, что: (1) GDF-9В является существенным для нормального фолликулогенеза в некоторых млекопитающих; (2) что GDF-9В является критически важным для определения частоты овуляции в некоторых млекопитающих и, (3) поскольку GDF-9 и GDF-9В коэкспрессируются яйцеклетками, они функционируют совместно для усиления как фолликулярного развития, так и частоты овуляции. Вместе эти новые гипотезы стали возможными только после обнаружения авторами данного изобретения мутаций Inverdale и Hanna GDF-9В в овцах.
Авторы изобретения впервые определили полную генную структуру овечьего гена GDF-9В, кодирующего белок дикого типа, и показали, что он является необходимым для поддержания нормального яичникового фолликулогенеза в овцах. Авторы данного изобретения идентифицировали также полную генную структуру вариантов GDF-9В в овцах Inverdale и Hanna, которые обусловливают более высокие, чем нормальные, частоты овуляции в гетерозиготных животных и бесплодие в гомозиготных животных. Данное изобретение в широком смысле относится к полноразмерным последовательностям GDF-9В дикого типа и мутированным последовательностям GDF-9В и их вариантам и их применению в модуляции фертильности млекопитающих.
Все ссылки, в том числе патенты и заявки на патент, цитированные в данном описании, тем самым включены в качестве ссылки. Не предполагается, что какая-либо ссылка представляет собой прототип данного изобретения. Обсуждение этих ссылок показывает, что утверждают их авторы, а авторы данного изобретения (заявители) сохраняют за собой право оспаривать точность и уместность цитированных документов. Следует ясно понимать, что, хотя ряд публикаций предыдущего уровня цитируется здесь, эта ссылка не является признанием того, что любой из этих документов образует часть обычного общего уровня знаний в данной области, в Новой Зеландии или в любой другой стране.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, в первом аспекте данное изобретение относится к выделенной молекуле нуклеиновой кислоты GDF-9В дикого типа, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из:
а) SEQ ID NO:1;
b) последовательности, способной гибридизоваться в жестких условиях с молекулой в (а);
с) последовательности, которая является функциональным вариантом или фрагментом молекулы в (а);
d) последовательности, комплементарной молекуле, определенной в (а), (b) или (с); и
е) антисмысловой последовательности, соответствующей любой из молекул в (а)-(d).
Во втором аспекте данное изобретение относится к выделенной молекуле полноразмерной мутированной нуклеиновой кислоты GDF-9В, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из:
а) SEQ ID NO:3 или SEQ ID NO:5;
b) последовательности, способной гибридизоваться в жестких условиях с молекулой (молекулами) в (а);
с) последовательности, которая является функциональным вариантом или фрагментом молекулы (молекул) в (а);
d) последовательности, комплементарной молекуле (молекулам), определенной (определенным) в (а), (b) или (с); и
е) антисмысловой последовательности, соответствующей любой из молекул в (а)-(d).
Молекулой нуклеиновой кислоты может быть молекула РНК, кРНК, геномной ДНК или кДНК, и она может быть одноцепочечной или двухцепочечной. Эта молекула нуклеиновой кислоты может необязательно содержать одно или несколько синтетических, неприродных или измененных нуклеотидных оснований или их комбинации.
В третьем аспекте данное изобретение относится к выделенному полноразмерному полипептиду GDF-9В, содержащему аминокислотную последовательность, выбранную из группы, состоящей из:
а) SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6 и
b) функционального варианта или фрагмента последовательности (последовательностей) в (а).
В четвертом варианте данное изобретение относится к гомодимерному зрелому полипептиду GDF-9В, имеющему субъединицы, содержащие аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2 или функционального фрагмента или варианта указанной последовательности.
В пятом аспекте данное изобретение относится к гетеродимерному полипептиду, имеющему субъединицы, выбранные из группы, состоящей из:
а) зрелого полипептида GDF-9В, содержащего аминокислотную последовательность, произведенную из SEQ ID NO:2, или функционального фрагмента или варианта указанной последовательности; и
b) зрелого полипептида GDF-9 или его функциональных вариантов или фрагментов.
Данное изобретение относится дополнительно в шестом аспекте к способу экспрессии биологически активного процессированного гомодимерного полипептида GDF-9В, предусматривающему стадии:
а) создания экспрессирующей конструкции, содержащей молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1 или функционального фрагмента или варианта указанной последовательности этой группы;
b) трансфицирования подходящих клеток-хозяев указанной конструкцией;
с) отбора стабильных клонов и
d) выделения и очистки экспрессированного полипептида.
В седьмом варианте данное изобретение относится к способу экспрессии биологически активных процессированных гетеродимерных полипептидов GDF-9В и GDF-9, предусматривающему стадии:
а) создания экспрессирующей конструкции, содержащей молекулу нуклеиновой кислоты, содержащую:
i) последовательность нуклеиновой кислоты, выбранную из группы, состоящей из: SEQ ID NO:1 или функционального фрагмента или варианта указанной последовательности; и
ii) молекулу нуклеиновой кислоты, кодирующую GDF-9, или ее функциональный фрагмент или вариант;
b) трансфицирования подходящих клеток указанной конструкцией;
с) отбора стабильных клонов и
d) выделения и очистки экспрессированного полипептида.
Предпочтительно, трансфицироваными клетками являются клетки позвоночных животных, однако предполагается также применение других типов клеток.
Последовательности нуклеиновой кислоты и белка GDF-9 доступны в публичных базах данных, таких как GENbank и SWISS-PROT. Номер доступа для нуклеиновой кислоты GDF-9 овцы - AFO78545, а для белка - ААС28089.
Данное изобретение относится также к рекомбинантным экспрессирующим векторам, которые содержат молекулу ДНК данного изобретения или ее функциональный вариант, и хозяевам, трансформированным вектором данного изобретения, способных экспрессировать полипептид данного изобретения.
Дополнительный аспект данного изобретения относится к лиганду, который связывается с полипептидом данного изобретения. Наиболее обычно, лигандом является антитело. Должно быть понятно, что термин "антитело" включает в себя фрагменты или аналоги антител, которые сохраняют способность связываться с полипептидом данного изобретения, в том числе, но не только, фрагменты Fv, F(ab)2, молекулы ScFv и т.п. Антитело может быть поликлональным или моноклональным, но является предпочтительно моноклональным. В некоторых вариантах лигандом может быть молекула фагового дисплея, генерируемая против полипептидов данного изобретения, одиночный рецептор поверхности клетки или комплексный рецептор поверхности клетки. Этот полипептид или пептид может присутствовать в виде мономера, димера, гетеродимера, мультимера или их варианта.
В восьмом аспекте данное изобретение относится к способу оценки активности гомодимеров GDF-9В и/или гетеродимеров GDF-9В/GDF-9, предусматривающему стадии:
а) добавления эффективного количества гомодимерного полипептида GDF-9В; и/или гетеродимерного полипептида GDF-9В/GDF-9 к культуре клеток или органа яичника с другими факторами роста яичника, такими как IGF-1 и/или другие члены надсемейства трансформирующих факторов роста (например, активин, ВМР2, TGFβ1), или без них; и
b) проведения биоанализа на указанной культуре клеток или органа для оценки биологической активности указанных гомодимерных или гетеродимерных полипептидов.
В девятом аспекте данное изобретение относится к моделям трансгенных животных, применимым для демонстрации действия системного продуцирования гомодимеров GDF-9В и гетеродимеров GDF-9В/GDF-9 на рост фолликулов.
В десятом аспекте данное изобретение относится к способу адреновирусного, ретровирусного и альфавирусного переноса экспрессионных кассет GDF-9В или экспрессионных кассет GDF-9 в клетки или организмы хозяина для выполнения посредством этого экспрессии in vivo гомодимеров GDF-9В или гетеродимеров GDF-9В/GDF-9, предусматривающему стадию переноса в культуру реципиентной клетки, культуру органа или в реципиентное животное рекомбинантного аденовируса, включающего в себя экспрессионную кассету, содержащую молекулу нуклеиновой кислоты, имеющую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1 или функционального фрагмента или варианта указанной последовательности, причем указанная молекула нуклеиновой кислоты находится в функциональной связи с регуляторной последовательностью экспрессии.
В одиннадцатом аспекте данное изобретение относится к применению агента, выбранного из группы, состоящей из:
а) гомодимерного полипептида, имеющего субъединицы, содержащие GDF-9В или его функциональный фрагмент или вариант, с гомодимерным полипептидом, имеющим субъединицы, содержащие полипептид GDF-9 или его функциональный фрагмент или вариант, или без него;
b) гетеродимерного полипептида, имеющего субъединицы, содержащие полипептиды GDF-9В и GDF-9, или функциональные фрагменты или варианты указанных полипептидов GDF-9В или GDF-9;
вместе с (или без них) дополнительными гонадотропинами (например, FSH и/или LH) и/или другими факторами роста яичников, такими как IGF-1, kit-лиганд (фактор стволовых клеток), эпидермальный фактор роста или член надсемейства TGFβ (т.е. агонистами или антагонистами) для
1) изменения фолликулярного роста в яичниках млекопитающего или другого позвоночного животного либо in vivo, либо in vitro; или
2) изменения роста/созревания выделенных клеток яичника in vitro (например, яйцеклетки - клеток кумулюса (яйцевого бугорка в полости яичникового фолликула, в которой заключено яйцо) и/или клеток гранулезы)).
В двенадцатом аспекте данное изобретение относится к композиции, содержащей эффективное количество агента, выбранного из группы, состоящей из:
а) гомодимерного полипептида, имеющего субъединицы, содержащие полипептид GDF-9В или его функциональный фрагмент или вариант, с гомодимерным полипептидом, имеющим субъединицы, содержащие полипептид GDF-9 или его функциональный фрагмент или вариант, или без него;
b) гетеродимерного полипептида, имеющего субъединицы, содержащие полипептиды GDF-9В и GDF-9, или функциональные фрагменты или варианты указанных полипептидов GDF-9В или GDF-9;
вместе с фармацевтически или ветеринарно приемлемым носителем (в том числе адъювантами) или разбавителем; и необязательно включающая в себя дополнительно гонадотропины и/или другие релевантные агонисты/антагонисты факторов роста яичников.
В тринадцатом аспекте данное изобретение относится к способу изменения роста яичниковых фолликулов у самки млекопитающего или самки другого позвоночного животного in vivo, причем указанный способ предусматривает стадию трансформации клеток-хозяев яичника млекопитающего и другого позвоночного животного экспрессионными кассетами GDF-9В и GDF-9 для обеспечения возможности сверхэкспрессии гомодимеров GDF-9В и гетеродимеров GDF-9В/GDF-9.
В четырнадцатом аспекте данное изобретение относится к способу изменения роста яичниковых фолликулов у самки млекопитающего или самки другого позвоночного животного in vitro, причем указанный способ предусматривает стадию трансформации клеток-хозяев яичника млекопитающего и другого позвоночного животного экспрессионными кассетами GDF-9В и GDF-9 для обеспечения возможности сверхэкспрессии гомодимеров GDF-9В и гетеродимеров GDF-9В/GDF-9.
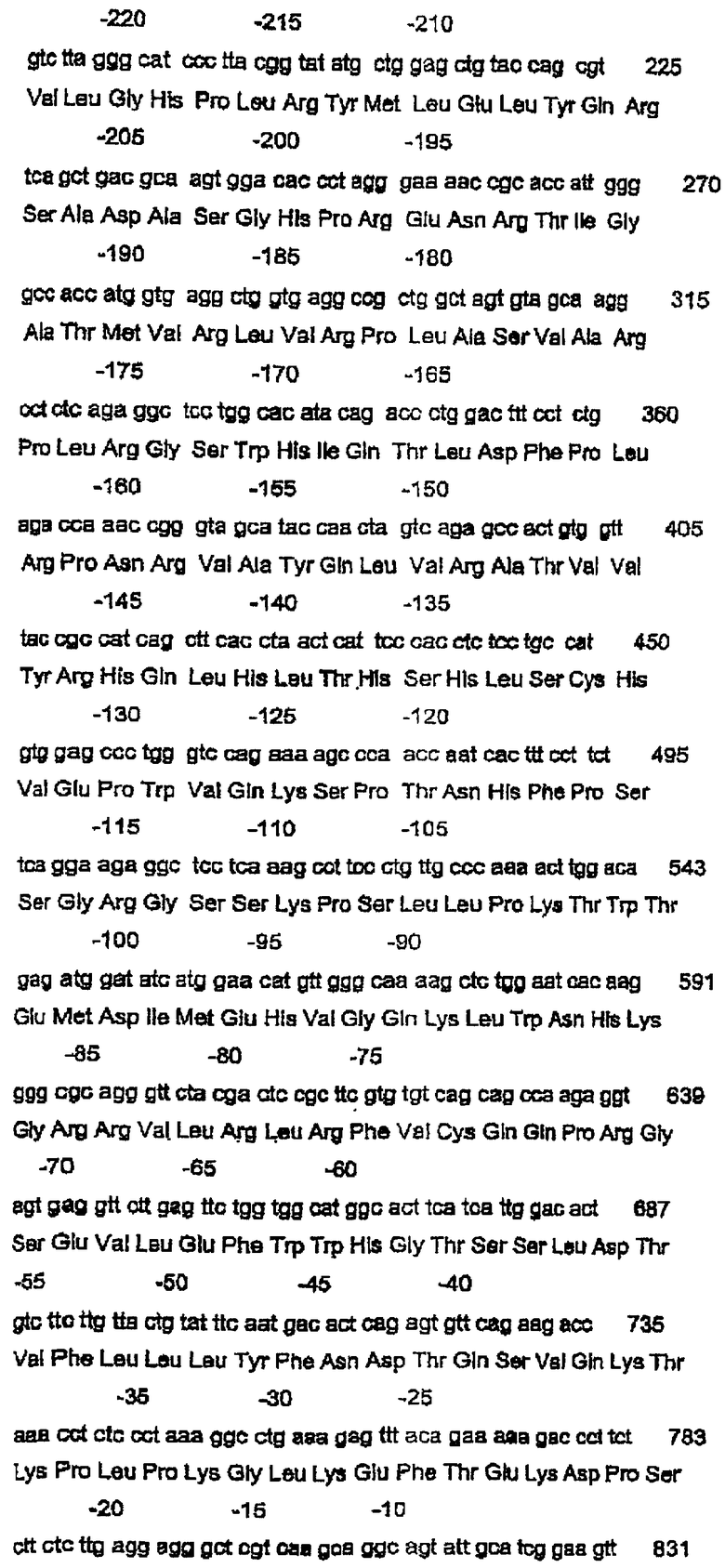
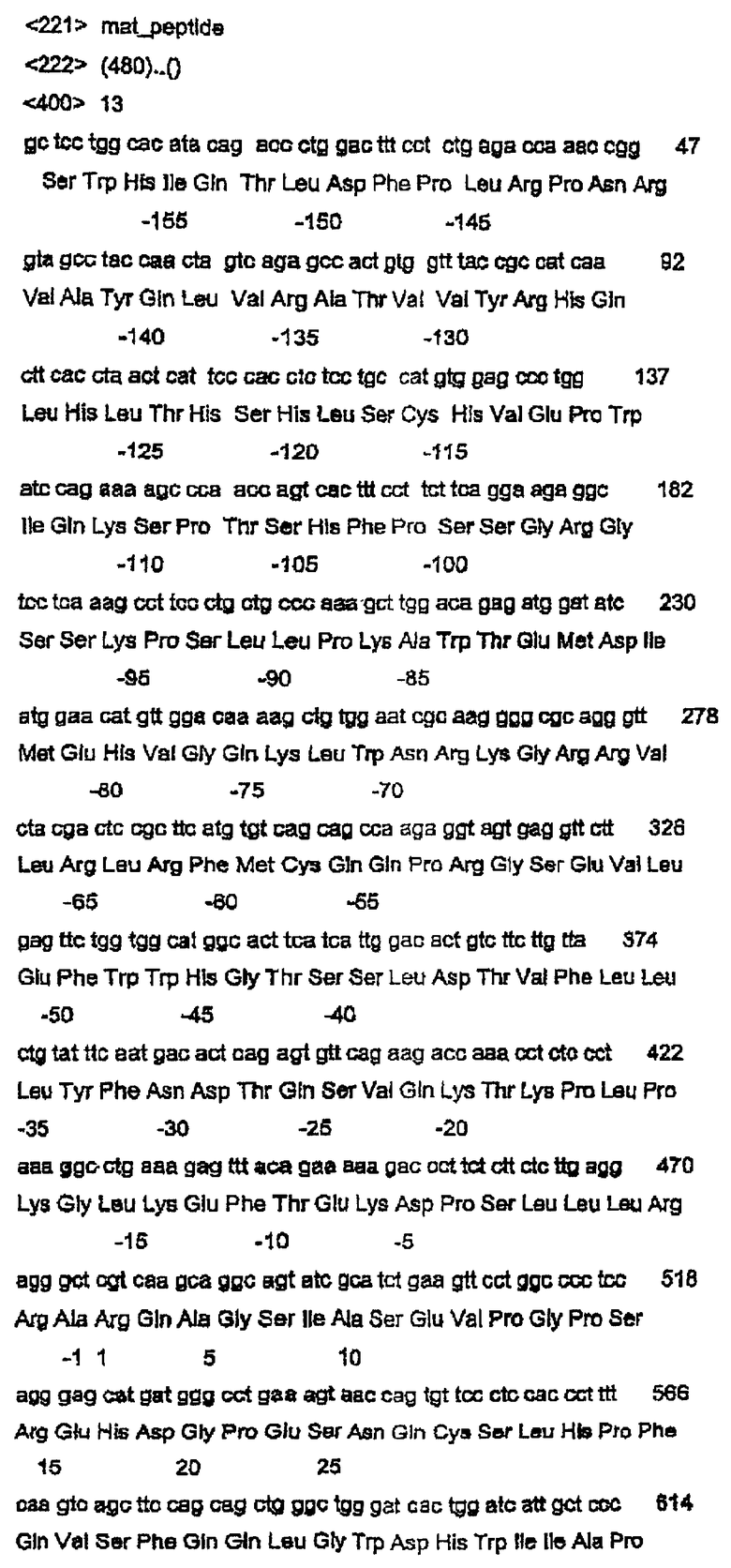
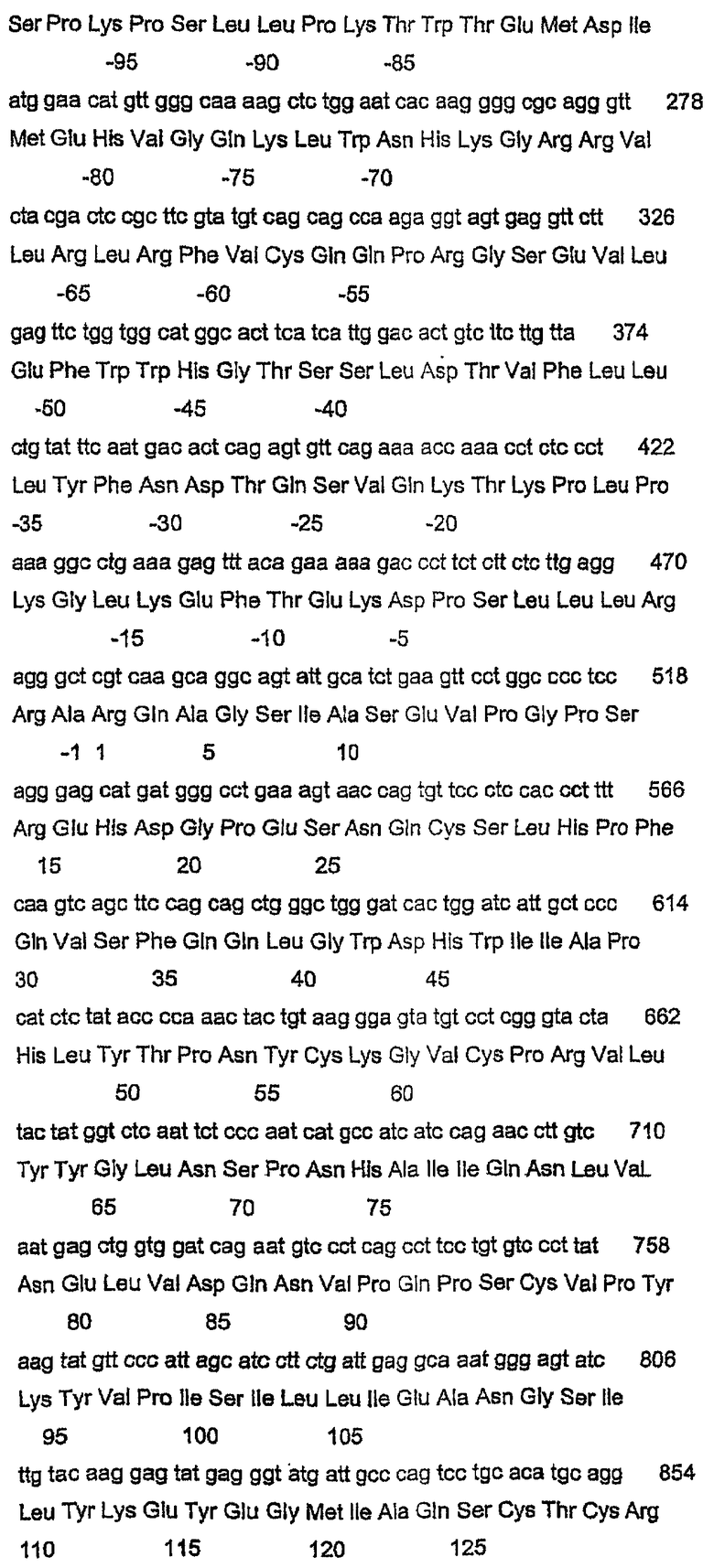
Согласно следующему аспекту данное изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:11, SEQ ID NO:13 и SEQ ID NO:15 или функционального фрагмента или варианта указанной последовательности.
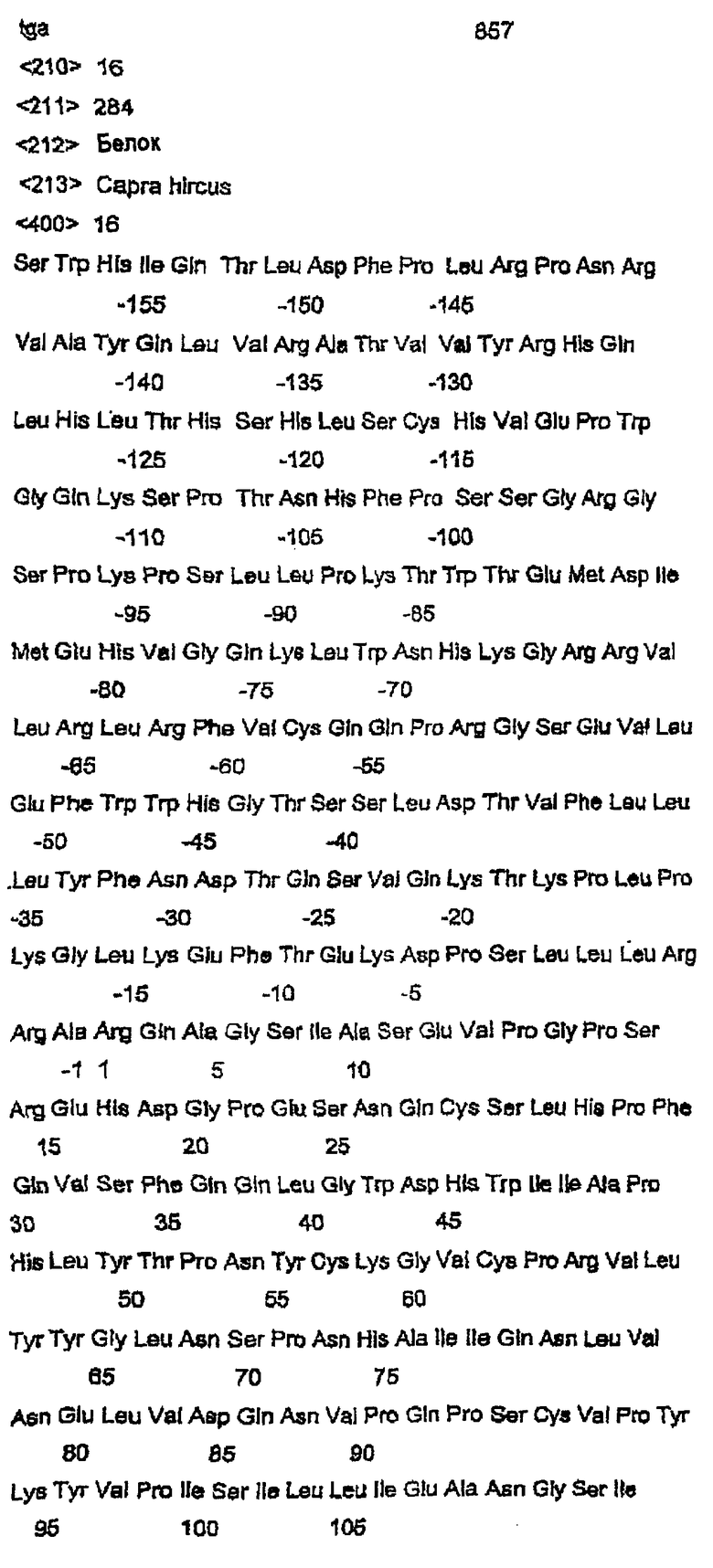
Согласно следующему аспекту данное изобретение относится к полипептиду, содержащему аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:12 и SEQ ID NO:16 или функционального фрагмента или варианта указанной последовательности.
Согласно другому аспекту данное изобретение относится к способу изменения фолликулярного роста, предусматривающему стадию введения лиганда, заявленного в любом из пунктов 9-15, для:
i) изменения фолликулярного роста в яичниках млекопитающего или другого позвоночного либо in vivo, либо in vitro; или
ii) изменения роста/созревания выделенных клеток яичника in vitro.
Предпочтительно, указанное млекопитающее выбрано из группы, состоящей из овец, крупного рогатого скота, коз, оленей, свиней, людей, лошадей, верблюдов и поссумов, кошек и собак и любых других коммерчески важных видов, имеющих ген GDF-9В, обладающий существенной идентичностью с последовательностями GDF-9В данного изобретения. Указанное позвоночное животное предпочтительно выбрано из группы, состоящей из кур, уток, гусей, лососевых и любых других коммерчески важных видов, имеющих ген GDF-9В, обладающий существенной идентичностью с последовательностями GDF-9В данного изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
В частности, предпочтительные аспекты данного изобретения будут описаны в связи с прилагаемыми чертежами, в которых:
Фигура 1 показывает нуклеотидную последовательность GDF-9В дикого типа овцы.
Фигура 2 показывает часть нуклеотидной последовательности фигуры 1 и иллюстрирует мутацию Inverdale.
Фигура 3 показывает часть нуклеотидной последовательности фигуры 1 и иллюстрирует мутацию Hanna.
Фигура 4 показывает расшифрованную аминокислотную последовательность GDF-9В дикого типа овцы.
Фигура 5 показывает часть аминокислотной последовательности фигуры 1 и иллюстрирует мутацию Inverdale.
Фигура 6 показывает аминокислотную последовательность фигуры 1 и иллюстрирует мутацию Hanna.
Фигура 7 показывает полиморфизм сигнальных последовательностей для GDF-9В овцы.
Фигура 8 показывает дополнительный кодон ATG против хода транскрипции, присутствующий у овцы.
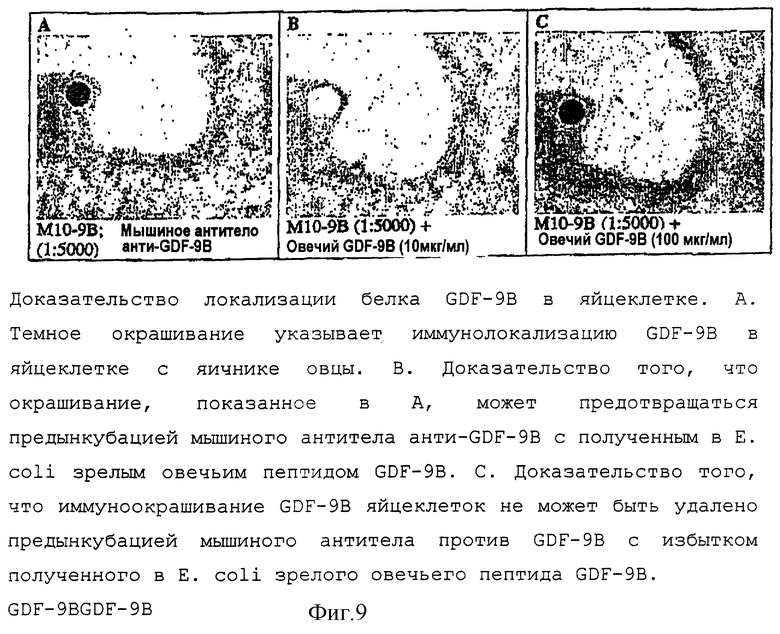
Фигура 9 показывает микрофотографию, иллюстрирующую локализацию GDF-9В в яйцеклетке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как обсуждалось выше, первичным предметом данного изобретения является модуляция фоллликулярного роста яичников через активность гомодимеров GDF-9В и гетеродимеров GDF-9В/GDF-9 in vivo и in vitro.
Термин "выделенные" означает по существу выделенные или очищенные от загрязняющих последовательностей в клетке или организме, в которой данная нуклеиновая кислота природно встречается, и включает в себя нуклеиновые кислоты, очищенные стандартными способами очистки, а также нуклеиновые кислоты, полученные рекомбинантной технологией, в том числе технологией ПЦР, и нуклеиновые кислоты, синтезированные химически.
Предпочтительно, молекула нуклеиновой кислоты SEQ ID NO:1 является выделенной из геномной ДНК овцы, а молекула нуклеиновой кислоты SEQ ID NO:3 и SEQ ID NO:5 является выделенной из ДНК овцы, экспрессирующей фенотип Inverdale или Hanna.
Отмечалось, что может встречаться полиморфизм в сигнальном пептиде GDF-9В овцы (SEQ ID NO:7, SEQ ID NO:8). Предсказанная сигнальная последовательность имеет, по-видимому, длину около 25 аминокислот, как предсказано программой Signal P (Signal P VI.1 server в http://genom.cbs.dtu.dk/services/SignalP) (Neilsen et al., 1997) от ATG (Met) до ACA (Thr) в SEQ ID NO:7 и SEQ ID NO:8. Делеция из 3 пар оснований наблюдается в некоторых овцах, где не присутствует одна из двух последовательностей СТТ. Таким образом, некоторые овцы имеют более короткую сигнальную последовательность, хотя большинство овец имеют полную длину этой последовательности. Из исследований овец Hanna, гибридов Hanna х Inverdale, овец Inverdale и дикого типа, родственного или неродственного Inverdale или Hanna, большинство были гомозиготными в отношении двух СТТ, хотя некоторые были гетерозиготными в отношении одного СТТ. Было обнаружено, что преобладание более короткого варианта сигнального пептида является более высоким в породе мериносовых овец, но низким в породах Romney, что указывает на то, что полиморфизм может быть связан с породой. Большинство овец Romney несли более длинную сигнальную последовательность независимо от их статуса в отношении Inverdale или Hanna. Хотя этот полиморфизм должен быть признан, он не влияет на формулу изобретения и не модифицирует формулу изобретения данного изобретения.
Также отмечалось, что дополнительный стартовый кодон ATG в рамке считывания присутствует в геномной последовательности ДНК овцы на 27 нуклеотидов слева от стартового кодона ATG GDF-9В (SEQ ID NO:9, SEQ ID NO:10). Эта последовательность присутствует во всех использованных для секвенирования овцах, несущих ген дикого типа, Inverdale или Hanna, и является явно независимой от мутаций Inverdale и Hanna. Неизвестно, используется ли этот левый стартовый кодон во время трансляции белка в овцах (SEQ ID NO:9, SEQ ID NO:10). Если он используется, это должно было бы приводить к сигнальной последовательности из дополнительных 9 аминокислот. Такое различие между белками GDF-9В овец и других млекопитающих вряд ли влияло бы на функцию зрелого белка, так как эта часть данной молекулы отщепляется в активном зрелом GDF-9В, но авторы упоминают эту возможность альтернативного стартового сайта трансляции, который может присутствовать в гене овцы. Программа предсказания сигнальных пептидов (Neilsen et al., 1997) показывает, что эта дополнительная аминокислотная последовательность из 9 аминокислот может функционировать в качестве сигнального пептида и что вероятным конечным сайтом для этого сигнального пептида была бы все еще аминокислота Thr (T), указанная в SEQ ID NO:7 и SEQ ID NO:8.
В следующем аспекте данное изобретение относится к выделенному полипептиду, выбранному из аминокислотных последовательностей SEQ ID NO:2, SEQ ID NO:4 и SEQ ID NO:6 или их функционального варианта, который функционирует для манипуляции фолликулярного роста яичников у самки млекопитающего.
Этот полипептид может быть получен экспрессией подходящего вектора, содержащего молекулу нуклеиновой кислоты данного изобретения или ее функциональный вариант, в подходящей клетке-хозяине, как будет понятно специалисту в данной области.
Термин "вариант" в применении здесь относится к нуклеотидным и полипептидным последовательностям, причем эта нуклеотидная или аминокислотная последовательность проявляет приблизительно 50%-ную или более высокую гомологию с нуклеотидной или аминокислотной последовательностью SEQ ID NO: 1-6, соответственно, предпочтительно 75%-ную гомологию и наиболее предпочтительно 90-95%-ную гомологию с последовательностями данного изобретения: при условии, что указанный вариант имеет определенную здесь биологическую активность. Этот вариант может быть получен модификацией нативной нуклеотидной или аминокислотной последовательности посредством таких модификаций, как инсерция, замена или делеция одного или нескольких нуклеотидов или аминокислот, или может быть встречающимся в природе вариантом. Термин "вариант" включает в себя также гомологичные последовательности, которые гибридизуются с последовательностями данного изобретения в стандартных или предпочтительно жестких условиях гибридизации, известных специалистам в данной области. Примеры обычно используемой процедуры in situ гибридизации описаны в Tisdal et al., 1999; Juengel et al., 2000. Если желателен такой вариант, нуклеотидную последовательность нативной ДНК изменяют подходящим образом. Это изменение может выполняться селективным синтезом ДНК или модификацией нативной ДНК, например, при помощи сайт-специфического или кассетного мутагенеза. Предпочтительно, если части кДНК или геномной ДНК требуют модификаций последовательности, используют управляемый сайт-специфическим праймером мутагенез с применением стандартных способов, известных в данной области.
Термин «фрагмент» нуклеиновой кислоты обозначает часть нуклеиновой кислоты, которая меньше, чем полная длина, и содержит по меньшей мере минимальную последовательность, способную гибридизоваться специфически с молекулой нуклеиновой кислоты данного изобретения или комплементарной ей последовательностью в жестких условиях, определенных ниже. «Фрагмент» полипептида является частью полипептида, которая меньше, чем полная длина, но которая все еще сохраняет биологическую активность, определенную здесь.
Термин «биологически активный» относится к полипептиду данного изобретения, который способен индуцировать измеряемый физиологический эффект в яичнике или клетке яичника млекопитающего или другого позвоночного животного. Физиологические эффекты могут измеряться такими анализами, как включение меченного тритием тимидина в клетки гранулезы. Примером такого анализа является анализ, в котором фолликулы (с диаметром 1-2,5 мм) иссекают из стромы яичника и клетки гранулезы выделяют из комплексов теки и кумулюса яйцеклеток. Эти клетки промывают и ресуспендируют в свежей среде в конечной концентрации для биоанализа 100000 жизнеспособных клеток на лунку и инкубируют с полипептидом или без полипептида в течение 48 часов. В это время измеряют включение меченного тритием тимидина.
Термин "белок (или полипептид)" относится к белку, кодируемому молекулой нуклеиновой кислоты данного изобретения, в том числе фрагментам, мутациям и гомологам, имеющим ту же самую биологическую активность, т.е. активность манипуляции овуляции. Полипептид данного изобретения может быть выделенным из природного источника, полученным экспрессией рекомбинантной молекулы нуклеиновой кислоты или может быть химически синтезированным.
Термин "лиганд" относится к любой молекуле, которая может связываться с другой молекулой, такой как полипептиды или пептид, и включает в себя, но не ограничивается ими, антитела, рецепторы поверхности клеток или молекулы фагового дисплея.
Кроме того, нуклеотиды и пептиды, имеющие существенную идентичность относительно нуклеотидных и аминокислотных последовательностей данного изобретения, могут также использоваться в предпочтительных вариантах. Здесь термин "существенная идентичность" означает, что две последовательности, при оптимальном сопоставлении, например, при помощи программ GAP или BESTFIT (пептиды) с использованием статистических весов пропуска по умолчанию или при измерении при помощи компьютерных алгоритмов BLASTX или BLASTP, имеют по меньшей мере 50%, предпочтительно 75% или наиболее предпочтительно 90-95% идентичность последовательности. Предпочтительно, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. Например, замена аминокислот, имеющих сходные химические свойства, такие как заряд или полярность, вряд ли будут влиять на свойства белка. Неограничивающие примеры включают в себя глутамин вместо аспарагина или глутаминовую кислоту вместо аспарагиновой кислоты.
В следующем аспекте данное изобретение обеспечивает реплицируемые векторы-переносчики, пригодные для применения в получении полипептида или пептида данного изобретения. Эти векторы могут быть сконструированы в соответствии со способами, хорошо известными в данной области, или могут быть выбраны из клонирующих векторов, доступных в данной области.
Клонирующий вектор может быть выбран в соответствии с используемым хозяином или клеткой-хозяином. Применимые векторы обычно будут иметь следующие характеристики:
(а) способность к саморепликации;
(b) обладание единственной мишенью для любой конкретной рестрикционной эндонуклеазы (рестриктазы) и
(с) желательно, если они несут гены для легко селектируемого маркера, например, устойчивости к антибиотику.
Двумя основными типами векторов, обладающих этими характеристиками, являются плазмиды и бактериальные вирусы (бактериофаги или фаги). Предпочтительными в настоящее время векторами являются бактериальные векторы, векторы насекомых или векторы млекопитающих и они могут включать в себя: серии pUC, pBlueScript, pGEM, pGEX, pBK-CMV, lambda ZAP, lambda GEM, pEFIRES-P, pUB6/V5/His, pBC1, pADTrack-CMV, pAdenovator, pAdEasy-1, pSFV-PD, pCA3, pBABE, pPIC9, pA0815, pET и pSP. Однако этот список не должен рассматриваться как ограничение рамок данного изобретения.
Примерами предпочтительных экспрессирующих систем являются следующие:
1. Для системы клеточной экспрессии in vitro может быть использована система клеток 293Т с вектором pEFIRES-P (Hobbs S et al., 1998), которая придает устойчивость к пуромицину. Для коэкспрессии двух генов вышеуказанный вектор может быть модифицирован для изменения гена устойчивости к антибиотику на ген устойчивости к блеомицину. Альтернативно, коэкспрессия двух генов и отбор гена могут быть достигнуты конструированием трехцистронного экспрессирующего вектора. Может быть также использована соответствующая стабильно трансфицируемая система клеток насекомых, например, система клеток S2, использующая «DES»-векторную экспрессирующую систему; www.invitrogen.com.
2. Что касается экспрессии GDF во всех тканях трансгенных животных, один из подходов состоит в применении вектора pUB6/V5-His A (www.invitrogen.com.) для получения конструкций.
Для тканеспецифической экспрессии крысиный промотор PEPCK 0,6 т.п.н. для экспрессии в печени и почках может быть включен в конструкцию посредством замены промотора Ubi-C в векторе pUB6/V5-His A промотором PEPCK. Для экспрессии GDF в ткани млекопитающего могла бы быть предпочтительной другая промоторная система. Для этой ткани одним из подходов могло бы быть применение промотора гена бычьего β-лактоглобулина и/или бычьего промотора α S1 казеина (например, вектора рВС1, www.invitrogen.com.) для регуляции экспрессии GDF в молоко. Для глобальной сверхэкспрессии в трансгенных животных может быть использован также CMV-усиленный промотор β-актина (Okabe M, et al., FEBS Letters 407: 313-319, 1997) или модифицированный α-промотор EF1 (Taboit-Dameron F, et al., Transgenic Research 8: 223-235, 1998).
Другими подходящими экспрессионными системами млекопитающих являются аденовирусы, ретровирусы и альфавирусы. Типичным подходом для специалистов в данной области является подход, описанный (ТС Не et al., 1998). Что касается экспрессии GDF, вектор pAd Track-CMV или векторы pAdenovator (www.qbiogene.com) могут быть использованы для приготовления конструкции, которую затем котрансформируют с аденовирусной плазмидой pAd Easy-1 в E. coli для получения рекомбинантного аденовирусного генома, который содержит запускаемую CMV-промотором экспрессионную кассету GDF. Затем этот рекомбинантный аденовирусный геном трансфицируют в клетки 293Т для получения исходного вируса. Альтернативные способы для генерирования аденовирусов могут быть также использованы для той же самой цели (например, перенос генов на основе плазмиды PCA3 (www.microbix.com); или способ COS-TPC (Miyake S et al., 1996).
3. Нецитопатогенные вирусы лесов Семлики, экспрессирующие GDF, могут быть получены с использованием, например, векторов pSFV-PD, как описано Lundstrom et al., Histochem Cell Biol 115: 83-91, 2001. Кроме того, ретровирусные системы экспрессии на основе, например, векторов рВАВЕ могут быть использованы для экспрессии GDF в клетках млекопитающих (Morgenstern, JP and Land, H, 1990; Nucleic Acids Res 18: 3587-3596).
4. Другой хорошо установленной экспрессионной системой для специалистов в данной области являются дрожжевые клетки (C Hadfield, et al., 1993); (MA Romanos et al., 1992). Например, вектор рРIC9 (www.invitrogen.com.) может быть использован в Pichia pastoris для экспрессии GDF. Для коэкспрессии двух генов предпочтительным кандидатом является вектор рА0815 (www.invitrogen.com).
5. Escherichia coli (E.coli) является стандартной лабораторной системой экспрессии, широко распространенной в данной области. Например, система экспрессии с рЕТ (www.novagen.com) может быть использована для экспрессии рекомбинантных GDF-9 и GDF-9В млекопитающих (steve.lawrence@agresearch.co.nz).
Молекулы ДНК данного изобретения могут быть экспрессированы помещением их в функциональную связь с подходящими регуляторными последовательностями в реплицируемом экспрессирующем векторе. Регуляторные последовательности могут включать в себя точки начала репликации, промотор, энхансер и последовательности терминации транскрипции, среди прочих элементов. Выбор регуляторной последовательности для включения в экспрессирующий вектор зависит от типа хозяина или клетки-хозяина, предназначенных для применения для экспрессии этой ДНК, как будет понятно специалисту в данной области.
Экспрессирующие векторы, применимые в данном изобретении, могут содержать по меньшей мере одну регуляторную последовательность экспрессии, которая функционально связана с экспрессируемой ДНК-последовательностью или ее фрагментом. Регуляторную последовательность инсертируют в вектор для контроля и регуляции экспрессии клонированной ДНК-последовательности. Примерами применимых регуляторных последовательностей экспрессии являются lac-система, trp-система, tac-система, trc-система, основные районы оператора и промотора фага лямбда, гликолитические промоторы дрожжевой кислой фосфатазы, например, Pho5, промоторы факторов альфа-спаривания дрожжей и промоторы, происходящие из полиомавируса, аденовируса, ретровируса, обезьяньего вируса и цитомегаловируса, например, ранний и поздний промоторы SV40, и другие последовательности, о которых известно, что они регулируют экспрессию генов прокариотических и эукариотических клеток, и их вирусы или комбинации.
В конструировании вектора предпочтительно также иметь возможность идентификации бактериального клона, несущего вектор, содержащий чужеродную ДНК. Такие анализы включают в себя измеряемые изменения цвета, устойчивость к антибиотикам и т.п. В одном предпочтительном векторе используют ген β-галактозидазы, который детектируется клонами, проявляющими синий фенотип на Х-gal-чашках. Это облегчает отбор. После отбора векторы могут быть выделены из культуры с использованием стандартных способов.
В зависимости от используемого хозяина трансформацию и трансфекцию выполняют в соответствии со стандартными способами, подходящими для таких клеток. Для прокариот или других клеток, которые содержат прочные клеточные стенки, может быть использован способ обработки кальцием (Cohen, S N Proceedings, National Academy of Science, USA 69 2110 (1972)). Для клеток млекопитающих без таких клеточных стенок предпочтительными являются способ осаждения фосфатом кальция Graeme and Van Der Eb, Virology 52: 546 (1978) или липосомные реагенты.
При трансформации выбранного хозяина подходящим вектором кодируемый полипептид может быть получен, часто в форме слитого белка, культивированием клеток-хозяев. Полипептид данного изобретения может быть обнаружен быстрыми анализами, как указано выше. Затем полипептид извлекают и очищают, если это необходимо. Извлечение и очистка могут быть достигнуты с использованием процедур, известных в данной области, например, абсорбцией на анионообменной смоле и элюцией из анионообменной смолы. Этот способ получения полипептида данного изобретения составляет следующий аспект данного изобретения.
Клетки-хозяева (в том числе целые животные-хозяева), трансформированные или инфицированные векторами данного изобретения, также образуют следующий аспект данного изобретения.
Кроме того, следующий аспект данного изобретения относится к антителу, фрагменту антитела, одиночному рецептору клеточной поверхности или комплексному рецептору клеточной поверхности или молекулам фагового дисплея, связывающимся с полипептидом или пептидом данного изобретения. Полипептид или пептид может присутствовать в виде его мономера, димера, гетеродимера, мультимера или варианта.
Более конкретно, данное изобретение относится к способам получения антител против полипептидных последовательностей GDF-9В дикого типа (SEQ ID NO:2) или мутированных полипептидных последовательностей GDF-9B (SEQ ID NO:4 и SEQ ID NO:6) в виде мономеров или гомодимеров или в виде гетеродимеров в комбинации с GDF-9. Эти антитела могут быть использованы для характеристики эндогенных белков дикого типа или пептидных фрагментов и экспрессируемых рекомбинантных белков или пептидных фрагментов и для пассивной иммунизации реципиентных млекопитающих для модуляции фолликулярного роста яичников in vivo.
Читателю будет понятно, что следующий аспект данного изобретения рассматривает применение полипептидов данного изобретения в получении антисывороток для обнаружения других GDF-9В-подобных пептидов.
Поликлональные антитела могут быть получены в соответствии со способом, используемым Koelle et al., 1991, включенным здесь в качестве ссылки. Применимые протоколы получения антител описаны в патенте США US 5514578. Моноклональные антитела могут быть получены способами, известными в данной области. Эти способы включают в себя иммунологический способ, описанный Kohler and Milstein (1975), а также способом рекомбинантных ДНК, описанным Huse et al. (1989).
В следующем варианте данное изобретение относится к способу манипуляции роста яичниковых фолликулов в клетках в культуре и/или трансгенных животных. Посредством сверхэкспрессии гомодимеров GDF-9В или гетеродимеров GDF-9В/GDF-9 в культивируемых клетках или трансгенных животных могут быть изменены тайминг и уровень экспрессии специфических генов яичникового фолликулярного белка, например, последовательности, кодирующие гомодимеры GDF-9В или гетеродимеры GDF-9В/GDF-9, могут быть инсертированы в кассету генов под контролем специфического промотора или промоторов, которая экспрессируется во всех типах клеток (см. примеры ниже) (конститутивная экспрессия). Эта кассета содержит также 3'-фланкирующую ДНК, которая могла бы стабилизировать мРНК, и может необязательно содержать расположенные по ходу транскрипции (справа) регуляторные последовательности. Эта ДНК-кассета может быть введена в геном млекопитающего микроинъекцией этой ДНК в пронуклеусы яйцеклеток (как описано в L'Huillier et al., 1996), которые затем переносят обратно в реципиентных животных и дают им развиться до нормального срока беременности. Этот способ получения трансгенных животных описан (Hogan et al., 1996). Трансгенные животные могут быть получены трансфекцией клеток в культуре, полученной из эмбрионов или фетальных тканей или тканей взрослых животных; с последующим переносом ядер и переносом зародышей в реципиентных животных. Альтернативно, эта кассета генов может быть связана со спермой млекопитающего и доставлена к яйцеклетке посредством in vitro или in vivo оплодотворения с получением трансгенного животного (не человека). Манипуляция регуляции развития или уровня экспрессии гомодимеров GDF-9В или гетеродимеров GDF-9В/GDF-9 может быть использована для изменения уровня синтеза или продуцирования белка яичниковых фолликулов.
Данное изобретение включает в себя также способы генной терапии на основе аденовирусов для экспрессии GDF-9В и GDF-9В/GDF-9 в клеточных культурах, культурах органов и целых экспериментальных животных для манипуляции синтеза или продуцирования белка яичниковых фолликулов.
Теперь будут описаны неограничивающие примеры, иллюстрирующие данное изобретение. Должно быть понятно, что приведенное выше описание приведено только в качестве примера, и предполагаются вариации как в используемых материалах, так и в способах, которые известны специалистам в данной области.
ПРИМЕРЫ
ПРИМЕР 1
Выделение ДНК овечьего GDF-9В дикого типа и идентификация мутированных ДНК-последовательностей овечьего GDF-9В
Авторы данного изобретения клонировали различные комбинации олигонуклеотидных праймеров, полученных из последовательностей GDF-9В человека/мыши/крысы ранее, с использованием в ПЦР на геномной овечьей ДНК для получения фрагментов гена овечьего GDF-9В для секвенирования. Функциональные пары праймеров использовали для получения геномных клонов овцы дикого типа из матричных библиотек и для получения кДНК-последовательности из кДНК дикого типа яичников. Последовательность из полных кодирующих районов Inverdale и Hanna получали секвенированием релевантных ПЦР-фрагментов, полученных из соответствующих геномных ДНК. Последовательность GDF-9В дикого типа описана здесь в виде SEQ ID NO:1, Inverdale в виде SEQ ID NO:3 и Hanna в виде SEQ ID NO:5.
ПРИМЕР 2
Получение специфических антител и демонстрация природных гомодимерных белков GDF-9В и гетеродимерных белков GDF-9В/GDF-9 в яичниках млекопитающих
Антигены для иммунизации млекопитающих или птиц генерировали с использованием нуклеотидных последовательностей, описанных в данном изобретении как SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:5, или их вариантов в функциональной связи с регуляторными последовательностями экспрессии белка в E.coli. В качестве другого подхода, получали антитела против пептидов, направленные против специфических пептидных последовательностей из SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6 или их вариантов. Иммунореактивность может оцениваться стандартными способами (например, ELISA) и/или для получения специфических IgG, узнающих гомодимеры белка GDF-9В и гетеродимеры белков GDF-9В/GDF-9 из природных источников и клеток/тканей, сверхэкспрессирующих соответствующие рекомбинантные белки.
Предыдущие данные группы исследователей (например, Aaltonen et al. (1999) и Jaatinen et al., 1999)) показывают присутствие мРНК и белка GDF-9 в яйцеклетках преантральных фолликулов в грызунах и приматах. Здесь авторы изобретения дают доказательство с использованием иммуноцитохимии с использованием мышиного антитела присутствия белка GDF-9В в яичниках овец (фиг.9). Иммуногистохимическая методология была сходной с методологией, описанной Tisdall et al. (1999) Stem cell factor and c-kit-gene expression and protein localisation in the sheep ovary during fetal development, J. Reprod. Fert. 116: 277-291. Единственным исключением было то, что в данном исследовании включали также стадию амплификации сигнальной последовательности тирамида (TSA Biotin System, NEN Life Science Products). Мышиное антитело М10 получали, после того как полученный в E.coli зрелый овечий пептид GDF-9В (0,2 мг) инъецировали в полном адъюванте Фрейнда (FCA) внутрибрюшинно (i.p.) и через 2 недели проводили повторную иммунизацию 0,1 мг антигена i.p. и затем 0,05 антигена в смеси Span/Tween/масло и животное умерщвляли спустя 1 неделю после конечной бустер-иммунизации и сыворотку собирали.
Эти данные вместе с другими данными показывают, что как мРНК, так и белок GDF-9 и GDF-9В присутствуют в яйцеклетках млекопитающих (Aaltonen et al., 1999; Galloway et al., 2000).
Данные, доказывающие, что антипептидные антитела, направленные против специфических пептидных последовательностей, действуют на активность яичников, показаны в таблице 1.
В данном исследовании 10 самок овец имели их циклы течки (т.е. овариальные циклы), синхронизованные при помощи простагландина F2α (Эструмата, 125 мкг i.m.). Наблюдали, что все животные обнаруживают синхронизованную течку после markings с вазэктомированными баранами. В день 5 последующей фазы лютеинизации 5 овцам вводили объединенную плазму, извлеченную из другого стада овец, которых иммунизировали последовательно 7 раз один раз в месяц 15-мерным пептидом GDF-9В, конъюгированным с гемоцианином фиссуреллы (KLH). Объединенные сыворотки содержали антитела к GDF-9В с высокими титрами, как было показано при помощи ELISA с использованием полноразмерного экспрессированного в E. coli GDF-9В в качестве антигена. Другим 5 овцам вводили объединенную плазму с антителами к KLH, извлеченную из отдельного стада овец, которых иммунизировали также последовательно 7 раз один раз в месяц. Объединенная плазма из этих животных не содержала детектируемых антител против GDF-9В.
Уровни антител измеряли при помощи процедуры ELISA после разбавления плазм овец 1:500000. Способ ELISA включал в себя покрытие 96-луночного планшета 100 нг на лунку экспрессированного в E.coli полноразмерного GDF-9В и инкубирование со 100 мкл разведенной плазмы овец и 100 мкл буфера для анализа, после подходящей обработки блокирования и последовательных промывок. После инкубирования с овечьей плазмой и нескольких промывок добавляли кроличьи антитела против овечьих антител, конъюгированные с HRP, в течение 1 часа при 37оС. Затем лунки промывали и проявляли фенилендиамином плюс пероксидом водорода с остановкой проявления серной кислотой.
Каждой из овец вводили 100 мл стерильной плазмы внутривенно и спустя 4 дня вводили вторую инъекцию простагландина F2α для синхронизации течки. Частоты овуляции исследовали лапароскопией спустя 14 дней после введения плазмы.
В предыдущем патенте авторов с номером 500844 авторы показали значительное расстройство в фолликулярном развитии яичников у мышей при иммунизации этих животных полученным в E. coli зрелым овечьим GDF-9В. В этом исследовании 10 самок мышей иммунизировали внутрибрюшинно (i.p.) полученным в E.coli зрелым овечьим белком GDF-9В (0,2 мг) в полном адъюванте Фрейнда (FCA) (0,2 мл), а 10 других самок мышей иммунизировали бычьим альфа-лактальбумином (0,2 мг) в FCA (0,22 мл) i.p. в качестве контролей. Затем проводили 3 бустер-инъекции подходящими антигенами (0,1 мг при первой бустер-инъекции и 0,05 мг при второй и третьей бустер-инъекции) при 2-недельных интервалах в смеси Span/Tween/масло и животных умерщвляли спустя 1 неделю после конечной бустер-инъекции.
Далее авторы приводят данные для этих иммунизированных GDF-9В мышей, доказывающие, что имеется действие на экзогенные биологические активности как GDF-9, так и GDF-9В, так как эти животные содержали перекрестно-реактивные антитела к обоим факторам роста (таблица 2).
Таким образом, авторы утверждают, что процедуры, которые приводят к модуляции эндогенных GDF-9 и GDF-9В, будут изменять функцию яичников.
Следующее доказательство в поддержку заявления авторов, что модуляция гомодимерного GDF-9В или GDF-9 и GDF-9В либо в гомодимерных смесях, либо в виде гетеродимеров обеспечивается новыми открытиями авторов изобретения после иммунизации овец (3-5 на группу обработки) против KLH (контроля) пептидом GDF-9В, конъюгированным с KLH, или пептидом GDF-9, конъюгированным с KLH. Животных подвергали 7 последовательным ежемесячным иммунизациям, яичники извлекали после умерщвления и после этого объемы яичников и количества фолликулов типа 1, 1а и 2 оценивали стандартными морфометрическими процедурами (Smith et al., 1997). Кроме того, отмечали присутствие или отсутствие антральных фолликулов. Эти результаты суммированы в таблице 3.
Для этих исследований последовательность пептида GDF-9В была SEVPGPSREHDGPESC (SEQ ID NO:17), а последовательность пептида GDF-9 была KKPLVPASVNLSEYFC (SEQ ID NO:18). Овец Romney инъецировали 0,4 мг на овцу KLH или KLH-GDF-9В-пептид или KLH-GDF-9-пептид в полном адъюванте Фрейнда. Затем 6 раз при месячных интервалах животным вводили бустер-инъекцию дополнительного количества антигена (0,2 мг на овцу в каждом случае) в смеси Span/Tween/масло (подкожно, s.c.).
Эти результаты показывают, что относительно контролей (иммунизаций KLH): (1) иммунизации GDF-9-KLH и GDF-9В-KLH могут ингибировать развитие антральных фолликулов, демонстрируя тем самым, что как GDF-9, так и GDF-9В являются существенными для нормального развития фолликулов в некоторых млекопитающих.
ПРИМЕР 3
Экспрессия рекомбинантного гомодимерного белка GDF-9В и гетеродимерного белка GDF-9В/GDF-9 в клетках млекопитающих in vitro и in vivo
Экспрессионные конструкции, полученные в плазмидных векторах, содержащие нуклеотидные последовательности, описанные в данном изобретении как SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:5, или их варианты, в функциональной связи с регуляторной последовательностью экспрессии (CMV, ЕF1 и специфическими промоторными последовательностями млекопитающих) трансфицируют/переносят в клетки млекопитающих и отбирают стабильные клоны с использованием маркера для отбора при помощи антибиотика. Для оптимизации процессинга экспрессируемой рекомбинантной полипептидной последовательности сайт процессинга фурина мутируют и вводят в клетки-продуценты вспомогательную экспрессионную кассету, запускающую сверхэкспрессию фуринпротеазы.
В качестве примера эффективной экспрессионной системы млекопитающего для получения гомодимерного белка GDF-9В авторы изобретения генерировали линии клеток 293Т человека, трансфицированные вектором pEFIRES-P, содержащим про-район крысиного GDF-9В (Jaatinen et al., Mol Cell Endocrinol. 156: 189-93), слитый с последовательностью зрелого района овечьего GDF-9В (SEQ ID NO:1 и NO:2). Сайт процессинга фурина был сконструирован таким образом, что он содержал эффективно расщепляемую последовательность RRRR. Клетки, отобранные по их способности выдерживать 120-150 мкг/мл пуромицина, культивировали в среде HamF12/DMEM в бессывороточных условиях в течение 4 дней для продуцирования овечьего GDF-9В в супернатант, который затем использовали в биоанализе, как описано в примере 4.
Для получения биохимического доказательства физической гетеродимеризации овечьего GDF-9В и GDF-9 использовали следующий подход. Открытую рамку считывания крыса/овца-химерного GDF-9В, подобного описанному выше, но содержащего С-концевой FLAG-эпитоп из 8 аминокислот, клонировали в вектор вируса лесов Семлики pSFV-PD и получали исходный вирус с высоким титром SFV-PD-oGDF-9B-FLAG в клетках ВНК, как описано в Lundstrom et al., Histochem Cell Biol 115: 83-91, 2001). Наблюдали, что вирус SFV-PD-oGDF-9B-FLAG очень эффективно инфицировал клетки 293Т человека и вызывал высокую экспрессию oGDF-9B-FLAG в этих клетках. После инфицирования процессированный во время 4 дней культивирования oGDF-9B-FLAG секретировался в среду и белок легко визуализировали в виде полосы 18 кД в Вестерн-блот-анализе с использованием антитела анти-FLAG M2. Для коэкспрессии овечьего GDF-9B-FLAG с овечьим GDF-9 генерировали другую линию клеток 293Т с использованием вектора pEFIRES-P, содержащего открытую рамку считывания, кодирующую препро-полипептид GDF-9. Родительские клетки 293Т и клетки 293Т, стабильно экспрессирующие oGDF-9, инфицировали равными количествами вирусов SFV-PD-oGDF-9B-FLAG и супернатанты собирали после 4 дней культивирования. Один мл супернатантов из неинфицированных и инфицированных SFV-PD-oGDF-9B-FLAG клеток подвергали иммунопреципитации 1 мкг/мл антител против FLAG M2 и комплексы извлекали при помощи белка G-агарозы. Элюаты оценивали в Вестерн-блотах с использованием антител против FLAG M2 и антител против GDF-9. Хотя антитела против FLAG M2 не реагировали с овечьим GDF-9, наблюдали иммунореактивный зрелый пептид GDF-9 20 кД в супернатантах экспрессирующих GDF-9 клеток, которые были инфицированы вирусами SFV-PD-oGDF-9B-FLAG и иммунопреципитировались антителами против FLAG M2. Эти эксперименты по ко-иммунопреципитации показывают прямое физическое взаимодействие рекомбинантно экспрессируемых овечьего GDF-9В и GDF-9 и подтверждают существование гетеродимеров GDF-9В/GDF-9.
Описаны способы для сверхэкспрессии нуклеотидных последовательностей, описанных в данном изобретении как SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:5, или их вариантов в нескольких внеяичниковых сайтах в трансгенных животных для имитации системного введения рекомбинантных белков гомодимерного GDF-9В и гетеродимерного GDF-9В/GDF-9. Релевантные кодирующие GDF последовательности либо экспрессируются раздельно, либо коэкспрессируются в функциональной связи с регуляторными последовательностями экспрессии. Действия гомодимеров GDF-9В и гетеродимеров GDF-9В/GDF-9 на фолликулярный рост яичников в этих трансгенных животных оценивали морфометрическими измерениями или гормональными анализами. Этот подход обеспечивает общий способ для изменения частоты овуляции в трансгенных животных. Продуцирование GDF в молоко, регулируемой молочными железами сверхэкспрессией, обеспечивает альтернативный способ получения больших количеств реагента для медицинских или фармацевтических целей. Этот подход является безвредным для здоровья трансгенного животного, так как не наблюдали никаких противопоказаний.
Описан способ для эффективного переноса экспрессионной кассеты, состоящей из нуклеотидных последовательностей, описанных в данном изобретении как SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:5, или их вариантов, в функциональной связи с регуляторной последовательностью экспрессии (промотором CMV) в рекомбинантном аденовирусе в культуры реципиентных клеток или органов или в реципиентных животных для изменения фолликулярного роста in vitro или in vivo. Например, эти способы делают возможным системное инфицирование реципиентных животных экспрессионными кассетами CDF-9B и CDF-9, несущими аденовирусы, концентрирующиеся в печенях хозяина, и делающими возможными высокие уровни происходящих из печени рекомбинантных белков, которые высвобождаются в кровоток. Действия на рост яичниковых фолликулов могут оцениваться с использованием одного или нескольких критериев, например, лапароскопии, морфометрических измерений или гормональных анализов. Подобный вирусный перенос in vivo последовательностей и транскрипционных единиц GDF-9В и GDF-9 может быть достигнут с альфавирусами или ретровирусами. Эти вирусные подходы предоставляют пути тестирования биоактивности различных конструкций генов GDF-9В и GDF-9 in vivo и обеспечивают также альтернативные пути иммунизации животных против GDF-9В и GDF-9.
ПРИМЕР 4
Измерение биологической активности гомодимерного белка GDF-9В и гетеродимерного белка GDF-9В/GDF-9 в культурах клеток яичников
Для оценки биологической активности белков, экспрессируемых из нуклеотидных последовательностей, описанных в данном изобретении как SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:5, или их вариантов, могут быть использованы модели культур клеток яичников или культур органов.
Пример оценки биологической активности гомодимерного GDF-9В показан в таблице 4 ниже, где экстракт частично очищенного рекомбинантного (r) овечьего (о)GDF-9В оценивают измерением включения [3H]тимидина выделенными клетками овечьей гранулезы во время 48 ч инкубирования при 37оС. Эти результаты показывают, что roGDF-9В вызывал 1,9-кратное увеличение во включении меченного тритием тимидина клетками гранулезы, что свидетельствует о том, что roGDF-9В был биологически активным. Для получения клеток гранулезы яичники извлекали из овец-маток, фолликулы (с диаметром 1-2,5 мм) иссекали для получения в свободном виде и клетки выделяли и отделяли от теки и комплексов яйцеклетка-кумулюс. Клетки промывали и ресуспендировали в свежей среде при конечной концентрации для биоанализа 1×105 жизнеспособных клеток на лунку.
RoGDF-9В продуцировался трансфицированными клетками 293Т и его частично очищали с использованием гепарин-сефарозной хроматографии и белок элюировали 0,5 М NaCl и диализовали в течение ночи против среды для культуры ткани. Контролем для этого эксперимента была среда, подвергнутая действию нетрансфицированных клеток 293Т и подвергнутая гепарин-сефарозной хроматографии, элюции NaCl и диализу.
***р<0,001, ANOVA
ОБСУЖДЕНИЕ
Известная последовательность GDF-9В человека и произведенные из нее олигонуклеотидные праймеры позволили авторам изобретения определить геномную и кДНК-последовательности овечьего GDF-9В и оценить экспрессию GDF-9В-транскриптов в яичниках овец (Galloway et al., 2000).
На основании литературы можно предположить, что GDF-9 является необходимым для митогенеза клеток гранулезы и дифференцировки текальных клеток. Действительно, рекомбинантный GDF-9 крыс способен стимулировать рост крысиных яичниковых фолликулов in vitro (Hayashi et al., 1999), а также пролиферацию клеток гранулезы крысы в культуре (Vitt et al., 2000). Рекомбинантный GDF-9 регулирует также стероидогенез и экспрессию рецептора гонадотропина в клетках мышиной и крысиной гранулезы (Elvin et al., 1999; Vitt et al., 2000). Кроме того, GDF-9 стимулирует продуцирование ингибина В в клетках гранулезы человека в культуре (Vuojolainen et al., в печати). Эти недавние исследования ясно демонстрируют, что гомодимеры GDF-9 обладают сильными действиями на рост и дифференцировку фолликулов в нескольких млекопитающих, но до изобретения, описанного здесь, ничего не было известно о возможном биологическом действии GDF-9В в яичнике.
В более ранней заявке на выдачу патента Новой Зеландии №500844 авторы изобретения показали, что ген Inverdale картирован в районе Х-хромосомы овцы, содержащем гены, обнаруживающие синтению с Хр11.2-11.4 в человеке (Galloway et al., 2000), и определили, не поврежден ли ген GDF-9В в этих животных, показав, что ген Inverdale является действительно инактивированной формой овечьего гена GDF-9В. В животных Inverdale нуклеотид Т в положении 92 нуклеотидов за сайтом процессинга зрелого пептида стал остатком А, превратив кодон GTC в GAC, что обусловило замену аминокислоты валина (V) на аспарагиновую кислоту (D). Во всех членах TGF-β-семейства та же самая аминокислота является либо валином, либо изолейцином или лейцином, которые все являются гидрофобными остатками, в противоположность отрицательно заряженной аспарагиновой кислоте. Эта аминокислотная замена вызывает изменение поверхностного заряда той самой зоны молекулы, которая участвует в процессе димеризации, как предполагается из кристаллических структур TGF-β 2, ВМР-2 и ВМР-7 (Schlunegger and Grutter, 1993; Griffith et al., 1996; Scheufler et al., 1999). Изобретение по заявке на выдачу патента Новой Зеландии №500844 обеспечивает также доказательство второй мутации гена GDF-9В, идентифицированной в другом стаде овец, Hanna, имеющих точно такие же фенотипы носителей гетерозиготных и гомозиготных генов, что и овцы Inverdale. Животные Hanna представляют точковую мутацию С в Т в положении 67 нуклеотидов за сайтом процессинга зрелого пептида в результате введения пре-зрелого стоп-кодона вместо остатка глутамина (Q). Эта замена будет вызывать большое укорочение района зрелого пептида, вызывая инактивацию белкового продукта. Скрещивания между семействами Inverdale и Hanna приводят к 50% бесплодных самок, что является доказательством, что обе мутации явно инактивируют продукт гена GDF-9В.
ССЫЛКИ:
Aaltonen J, Laitinen M, Vuojolainen K, Jaatinen R, Horelli-Kiutunen N, Seppa L, Louhio H, Tuuri T, Sjoberg J, Butzow R, Hovatta O, Dale L, Ritvos O: Human growth differentiation factor-9 (GDF-9) and its novel homolog GDF-9B are expressed during early folliculogenesis. J Clin Endocrinol Metab 84: 2744-2750, 1999.
Braw-Tal R, McNatty KP, Smith P, Heath DA, Hudson, NL, Phillips DJ, McLeod BJ, Davis GH: Ovaries of ewes homozygous for the X-linked Inverdale gene (FecXI) are devoid of secondary and tertiary follicles but contain many abnormal structures. Biol Reprod 49: 895-907, 1993.
C Hadfield, KK Raina, K Shashi-Menon, RC Mount (1993) The expression and performance of cloned genes. Yeast Mycol Res 9, 897-944.
Daopin S, Piez KA, Ogawa Y. Davies DR: Crystal structure of transforming growth factor-beta 2: an unusual fold for the superfamily. Science 257: 369-373, 1992.
Davis GH, McEwan JC. Fennessy PF, Dodds KG, Farquhar PA: Evidence for the presence of a major gene influencing ovulation rate on the X chromosome of sheep. Biol Reprod 44: 620-624, 1991.
Davis GH, McEwan JC, Fennessy PF, Dodds KG, McNatty KP, O WS: Infertility due to bilateral ovarian hypoplasia in sheep homozygous (FecXI FecXI) for the Inverdale prolificacy gene located on the X chromosome. Biol Reprod 46: 636-640, 1992.
Davis GH, McEwan JC, Fennessy PF, Dodds KG: Discovery of the Inverdale gene (FecX). Proc NZ Soc Anim Prod 95: 289-290, 1995.
Dong J, Albertini DF, Nishimori K, Kumar TR, Lu N, Matzuk MM: Growth differentiation factor-9 is required during early ovarian folliculogenesis. Nature 383: 531-535,1996.
Dube JL, Wang P, Elvin J, Lyons KM, Celeste AJ, Matzuk MM: The bone morphogenetic protein 15 gene is X-linked and expressed in oocytes. Mol Endocrinol 12: 1809-1817, 1998.
Elvin JA, Clark AT, Wang P, Wolfman NM, Matzuk MM: Paracrine actions of growth differentiation factor-9 in the mammalian ovary. Mol Endocrinol 13: 1035-1048, 1999.
Galloway SM, McNatty KP, Cambridge LM, Laitinen MPE, Juengel JL, Jokiranta TS, McLaren RJ, Luiro K, Dodds KG, Montgomery GW, Beattie AE, Davis GH, Ritvos O: Mutations in an oocyte-derived growth factor gene (BMP15) cause increased ovulation rate and infertility in a dosage-sensitive manner. Nature Genetics 25: 279-283, 2000.
Griffith DL, Keck PC, Sampath TK, Rueger DC, Carlson WD: Three-dimensional structure of recombinant human osteogenic protein 1: structural paradigm for the transforming growth factor beta superfamily. Proc Natl Acad Sci USA 93: 878-883, 1996.
Hanna MM: Living with the Inverdale gene (FecX) in a Romney flock. Proc NZ Soc Anim Prod 55: 296-297, 1995.
Hayashi M, McGee EA, Min G, Klein C, Rose UM, van Duin M, Hsueh AJ: Recombinant growth differentiation factor-9 (GDF-9) enhances growth and differentiation of cultured early ovarian follicles. Endocrinology 140: 1236-1244, 1999.
Hobbs S, Jitrapakdee S, Wallace JC (1998) Development of a bicistronic vector driven by the human polypeptide chain elongation factor 1 alpha promoter for creation of stable mammalian cell lines that express very high levels of recombinant proteins. Biochem Biophys Res Commun 252, 368-372.
Hogan et al (1; In: Manipulating the mouse embryo, Cold Spring Harbor Laboratory. Press 1996).
Huse et al, Science 246: 1275-1281 (1989).
Koelle et al., Cell 67: 59-77, 1991.
Kohler and Milstein in Nature 256: 495-497 (1975).
Juengel et al. (2000) Gene expression in abnormal ovarian structures of ewes homozygous for the Inverdale prolificacy gene, Biol Reprod, 62, 1467-1478.
Laitinen M, Vuojolainen K, Jaatinen R, Ketola I, Aaltonen J. Lehtonen E, Heikinheimo M, Ritvos O: A novel growth differentiation factor-9 (GDF-9) related factor is co-expressed with GDF-9 in mouse oocytes during follicutogenesis. Mech Dev 78: 135-140, 1998.
L`Huillier et al PNAS 93; 6698-6703 (1996).
MA Romanos, CA Scorer, JJ Clare (1992) Foreign gene expression in yeast: a review. Yeast 8, 423-488.
McGrath SA, Esquela AF, Lee SJ: Oocyte-specific expression of growth differentiation factor-9. Mol Endocrinol 9: 131-136, 1995.
McNatty KP, Smith P, Hudson NL, Heath DA, Tisdall DJ. O WS, Braw-Tal R: Development of the sheep ovary during fetal and early neonatal life and the effect of fecundity genes, J Reprod Fertil Suppl 49: 123-135, 1995.
McPherron AC, Lee SJ; GDF-3 and GDF-9: two new members of the transforming growth factor-beta superfamily containing a novel pattern of cysteines. J Biol Chem 268:3444-3449, 1993.
Miyake S, Makimura M, Kanegae Y, Harada S, Sato Y, Takamori K, Tokuda C, Saito I Efficient generation of recombinant adenoviruses using adenovirus DNA-terminal protein complex and a cosmid bearing the full-length virus genome. Proc Natl Acad Sci USA. 93: 1320-1324, 1996.
Neilsen H., Engelbrecht J, Brunak S, von Heijne G: Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites. Protein Eng 10:1-6.
Scheufler C, Sebald W, Hulsmeyer M: Crystal structure of human bone morphogenetic protein-2 at 2.7 A resolution. J Mol Biol 287: 103-115, 1999.
Schlunegger MP, Grutter MG: An unusual feature revealed by the crystal structure at 2.2 A resolution of human transforming growth factor-beta 2. Nature 358: 430-434, 1992.
Schlunegger MP, Grutter MG: Refined crystal structure of human transforming growth factor beta 2 at 1.95 A resolution. J Mol Biol 231: 445-458, 1993.
Shackell GH, Hudson NL, Heath DA, Lun S, Shaw L, Condell L, Blay LR, McNatty KP Plasma gonadotrophin concentrations and ovarian characteristics in Inverdale ewes that are heterozygous for a major gene (FecX1) on the X chromosome that influences ovulation rate. Biol Reprod 48: 1150-1156, 1993.
Smith P, O WS, Corrigan KA, Smith T, Lundy T, Davis GH. McNatty KP: Ovarian morphology and endocrine characteristics of female sheep fetuses that are heterozygous or homozygous for the Inverdale prolificacy gene (fecXl). Biol Reprod 57: 1183-1192, 1997.
TC He, S Zhou, LT da Costa, J. Yu, KW Kinzler, B. Vogelstein (1998) A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci USA 95, 2509-2514.
Tisdall et al. (1999) Stem cell factor and c-kit gene expression and protein localisation in the sheep ovary during fetal development. J Reprod Fert 116: 277-291.
Vitt UA, Hayashi M, Klein C, Hsueh AJW: Growth differentiation factor-9 stimulates proliferation but suppresses the follicle-stimulating hormone-induced differentiation of culture granulosa cells from small antral and preovulatory rat follicles. Biol Reprod, 62, 370-377, 2000.
Vuojolainen K, Bondestam J, Hayashi M, Raivio T, Evans L, Groome NP, Hsneh AJW, Ritvos O: GDF-9 regulates inhibin B production in cultured human granulosa-luteal cells. Manuscript in preparation.





























Изобретение относится к области биотехнологии. Предложены молекула нуклеиновой кислоты GDF-9B дикого и мутированного типов, кодируемые ими полипептиды, вектор, конструкция, лиганд и способы использования таких нуклеиновых кислот и полипептидов. Предложенная группа изобретений позволяет модулировать фолликулярный рост яичников через активность гомодимеров GDF-9B и гетеродимеров GDF-9B/GDF-9 in vivo и in vitro. Изобретение может быть использовано в животноводстве для активной и пассивной иммунизации против этих полипептидов для изменения фолликулярного роста. 16 н. и 19 з.п. ф-лы, 9 ил., 4 табл.
a)SEQ ID NO:1;
b) последовательности, способной гибридизоваться в жестких условиях с молекулой по (а);
c) последовательности, которая является функциональным вариантом или фрагментом молекулы по (а);
d) последовательности, комплементарной молекуле, определенной в (а), (b) или (с); и
e) антисмысловой последовательности, соответствующей любой из молекул по (a)-(d).
a) SEQ ID NO:3 или SEQ ID NO:5;
b) последовательности, способной гибридизоваться в жестких условиях с молекулой по (а);
c) последовательности, которая является функциональным вариантом или фрагментом молекулы по (а);
d) последовательности, комплементарной молекуле, определенной в (а), (b) или (с); и
e) антисмысловой последовательности, соответствующей любой из молекул по (а)-(d).
a) SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6; и
b) функционального варианта или фрагмента последовательности по (а).
a) зрелого полипептида GDF-9B, содержащего аминокислотную последовательность, происходящую из SEQ ID NO:2, или функционального фрагмента, или варианта указанной последовательности; и
b) зрелого полипептида GDF-9 или его функционального варианта или фрагмента.
a) полипептида, полученного из полноразмерного препрополипептида по п.5;
b) гомодимерного полипептида по п.6; и
c) гетеродимерного полипептида по п.13, используемый для производства лекарственного средства для изменения роста фолликулов в яичниках млекопитающего in vivo или in vitro или для изменения роста/созревания выделенных клеток яичника млекопитающего in vitro, отличающийся тем, что он является антителом или фрагментом антитела, содержащим антигенсвязывающий домен, получаемым путем введения животному одного или более антигенов, выбранных из а), b) или с), и отбором связывающихся с ними антител.
a) создания экспрессирующей конструкции, содержащей молекулу нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1, или функционального фрагмента, или варианта указанной последовательности этой группы;
b) трансфицирования подходящих клеток указанной конструкцией;
c) отбора стабильных клонов и
d) выделения и очистки экспрессированного полипептида.
а) создания экспрессирующей конструкции, содержащей молекулу нуклеиновой кислоты, содержащую
i) последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1, или функционального фрагмента, или варианта указанной последовательности; и
ii) молекулу нуклеиновой кислоты, кодирующую GDF-9, или ее функциональный фрагмент, или вариант;
b) трансфицирования подходящих клеток указанной конструкцией;
c) отбора стабильных клонов и
d) выделения и очистки экспрессированного полипептида.
a) гомодимерного полипептида, имеющего субъединицы, содержащие полипептид GDF-9B, или его функциональный фрагмент, или вариант с гомодимерным полипептидом, имеющим субъединицы, содержащие полипептид GDF-9, или его функциональный фрагмент, или вариант, или без него;
b) гетеродимерного полипептида, имеющего субъединицы, содержащие полипептиды GDF-9B и GDF-9, или функциональные фрагменты, или варианты указанных полипептидов GDF-9B или GDF-9;
вместе с фармацевтически или ветеринарно приемлемым носителем (в том числе адъювантами) или разбавителем; и необязательно дополнительно включающая гонадотропины.
а) добавления эффективного количества гомодимерного полипептида GDF-9B и/или гетеродимерного полипептида GDF-9B/ GDF-9 к культуре клеток или органа яичника с другими факторами роста яичника (в том числе агонистами/антагонистами TGFβ) или без них; и
b) проведения биоанализа на указанной культуре клеток или органа для оценки биологической активности указанных гомодимерного или гетеродимерного полипептидов.
ii) изменения роста фолликулов в яичниках млекопитающего или другого позвоночного in vivo или in vitro или
iii) изменения роста/созревания выделенных клеток яичника in vitro.
| US 6030617, 29.02.2000 | |||
| WO 9950406, 07.10.1999 | |||
| WO 9917797, 15.01.1999 | |||
| US 5821056, 13.10.1998. |
Авторы
Даты
2006-02-27—Публикация
2001-06-15—Подача