Изобретение относится к химии и медицине, а именно к новым ингибиторам протеолитических ферментов, в частности ВИЧ-протеиназы, пепсина и химотрипсина, а также способу их получения.
Известно применение в медицине ингибиторов протеолитических ферментов, например, для лечения острых панкреатитов, а также ВИЧ-инфекции. В последнем случае лечебный эффект достигается путем использования ингибиторов протеиназы ВИЧ псевдопептидной природы (ифавиренц, криксиван). Кроме того, известно применение ингибиторов протеолитических ферментов в фармацевтике в составе лекарственных форм препаратов пептидно-белковой природы для предотвращения их деградации в желудочно-кишечном тракте.
Так как известные синтетические неприродные ингибиторы протеолитических ферментов обладают рядом отрицательных побочных эффектов при их терапевтическом применении, то задачей настоящего изобретения явилось создание новых ингибиторов ферментов, представляющих собой конъюгаты природных соединений.
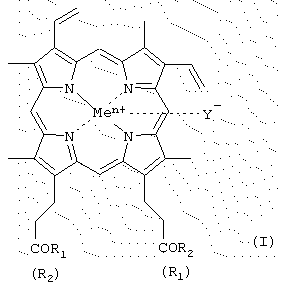
Было найдено, что поставленная задача решается хотя бы одним из производных гемина общей формулы (I)
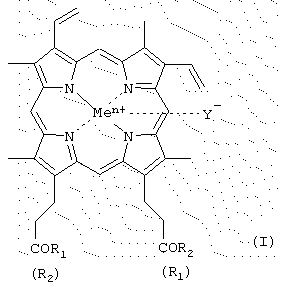
где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно, что R1=R2 или R1≠R2=OH, или R1=R2=OH, в частности
R1=-ValPheOMe, R2=-OH (V); R1=-ValPheOMe,
R2=-ValPheOMe (VI); R1=-LeuValPheOMe, R2=-OH (VII);
R1=-LeuLeuValPheOMe, R2=-OH (VIII); R1=-LeuLeuValPheOMe,
R2=-LeuLeuValPheOMe (IX); R1=-GlyProArgOMe, R2=-OH (X); R1=-ArgOMe,
R2=-OH (XI); R1=-ArgOMe, R2=-ArgOMe (XII); R1=-LeuValPheOH, R2=-OH (XIII); R1=-ValSerGlnAsnLeuOH, R2=-OH (XIV);
R1=-ArgArgTrpHisArgLeuLysGlu(OMe)OH, R2=-OH (XV); R1-лизиновый кор,
R2=-OH (XVI); R1=-GluAspLeuOH, R2=-OH (XVII);
карбоксильная группа порфирина может быть модифицирована метиловым или другим С2-С8-эфиром или физиологически приемлемой солью; Y- представляет собой Сl-, СН3СОО-; Me представляет собой Fe, или их фармацевтически приемлемых солей, обладающих способностью ингибировать протеолитические ферменты (протеиназы ВИЧ, пепсина, трипсина, химотрипсина), а также интерферониндуцирующей и противовирусной активностью.
Еще одним объектом данного изобретения является способ получения новых и известных псевдопептидов общей формулы (I).
Известные производные гемина, соответствующие формулам (V-IX), содержащие пептиды с этерифицированными карбоксильными группами, ранее получали различными методами классического пептидного синтеза в растворе. [Радюхин В.А., Филиппович Е.И., Евстигнеева Р.П. //Журн. общ. химии. 1980. Т. 50. С. 673-678; Радюхин В.А., Казакова Н.А., Филиппович Е.И., Евстигнеева Р.П. //Журн. общ. химии. 1982. Т. 52. №2 С. 432-440.]. В данной заявке пептиды в производных гемина (V, VI, VIII) получают методом смешанных ангидридов [Гершкович А.В., Кибирев В.К. Химический синтез пептидов. //АН Украины. Ин-т биоорган, химии и нефтехимии. - Киев: Наукова думка. 1992. 359 С.], что позволяет упростить процедуру их синтеза, увеличить выход и улучшить качество продукта. Промежуточные трет-бутилоксикарбонильные защиты α -аминогруппы аминокислот при синтезе пептидов удаляют воздействием трифторуксусной кислоты с последующей нейтрализацией триэтиламином. Остаток гемина вводят в молекулу путем взаимодействия предварительно деблокированного пептида с соответствующим 6(7)-моно- или 6,7-бис-N-оксисукцинимидным эфиром протогемина IX.
Получение пептидных производных гемина, особенно содержащих длинные пептиды и/или с карбоксильными и другими функциональными группами сопровождается рядом сложностей при их синтезе в растворе. Это определяется неполным протеканием реакции образования амидных связей между гемином и пептидом, плохой растворимостью незащищенных и длинных пептидов в органических растворителях, отсутствием селективности при получении моно- и бис-производных гемина, что приводит к трудностям при выделении целевого продукта - геминпептида.
Твердофазный метод синтеза пептидных производных гемина имеет ряд преимуществ перед классическим в растворе, а именно позволяет повысить выход и облегчает выделение целевого продукта (имеются в виду известные преимущества твердофазного синтеза вообще перед синтезом в растворе). Кроме того, синтез на твердой фазе позволяет селективно получать 6(7)-монопроизводные гемина. Данный подход в общем заключается в синтезе пептида на полимере с последующим ацилированием аминогруппы пептида на полимере активированным производным гемина с последующим отщеплением продукта от полимера.
Известно применение полимеров Меррифилда (хлорметилированный сополимер стирола и дивинилбензола) и Trilar (полиамидный носитель с щелочелабильной якорной группой) для синтеза геминпептидов [Евстигнеева Р.П., Лубсандоржиева Л.К., Желтухина Г.А.// Биоорган, химия. 1993. Т. 19. №6. С. 664-669; Евстигнеева Р.П., Желтухина Г.А., Халиль В., Ефимова Е.И.// Биоорган, химия. 1999. Т. 25. №8. С. 572-580]. Однако синтез на полимере Меррифилда не обеспечивал удовлетворительного выхода продукта при отщеплении его омылением или переэтерификацией. При таком способе синтеза стадия отщепления продукта является лимитирующей и проходит с низким выходом, хотя и позволяет получать производные гемина, содержащие остатки аспарагиновой и глутаминовой аминокислот, незащищенные как по С-концу, так и по боковым карбоксильным группировкам. Проведение отщепления производного гемина от полимера Меррифилда в жестких кислых условиях нецелесообразно вследствие деструкции целевого соединения, главным образом металлопорфиринового остатка.
Синтез на полимере Trilar имеет ограничения при выборе стратегии и предусматривает применение только кислотолабильных Nα -защитных групп, преимущественно Вос-защит. При этом защита боковых радикалов аминокислот осуществляется, главным образом, с помощью групп, удаляемых гидрогенолизом, что нежелательно вследствие возможности затрагивания винильных групп порфирина.
Новые производные гемина, в частности соединение (XVII), получают твердофазным методом с применением полимера Меррифилда и трет-бутилоксикарбонильной промежуточной защиты α -аминогруппы аминокислот. При этом для защиты боковых радикалов аспарагиновой и глутаминовой аминокислот используют бензильную защиту. Для образования пептидных связей на полимере используют пентафторфениловые эфиры аминокислот. Удаление Вос-группы проводят действием раствора 50% трифторуксусной кислоты в дихлорметане с последующей нейтрализацией раствором триэтиламина в DMFA. Присоединение остатка гемина проводят с использованием моно-N-оксисукцинимидного эфира протогемина IX [Радюхин В.А., Филиппович Е.И., Евстигнеева Р.П.// Журн. общ. химии. 1980. Т. 50. С. 673-678]. Отщепление производного гемина (XVII) с одновременным снятием сложноэфирных защитных группировок проводят действием 0.5 н. раствора NaOH в диоксане (1:1).
Задачей, стоявшей перед авторами при создании настоящего изобретения, являлась разработка более эффективного метода получения новых производных гемина, в частности соединений (XIII-XVI). Данная задача была решена путем применения новой модификации твердофазного метода синтеза порфиринопептидов с использованием полимера с 2-хлортритилхлоридной якорной группой [Barlos К., Chatzi О., Gamos D., Stavropouls G.// Int. J. Peptide Protein. Res. 1991. V. 37. P. 513-520], причем целевой продукт в конце синтеза отщепляется одновременно с деблокированием боковых защитных групп пептида в мягких кислых условиях, которые являются более предпочтительными по сравнению со щелочными и позволяют получать производные гемина, не защищенные по боковым функциональным группам и по С-концу. Для этого в качестве промежуточной защиты α -аминогруппы используют 9-флуоренилметилоксикарбонильную (Fmoc) группу [Гершкович А.В., Кибирев В.К. Химический синтез пептидов.// АН Украины. Ин-т биоорган. химии и нефтехимии. - Киев: Наукова думка. 1992. 359 с.]. Для защиты боковых радикалов серина, гистидина, лизина используют трифенилметильную группу [Barlos К., Mamos P., Papaioannou D., Patrianakou S., Sanida С., Schafer W.// Liebigs Ann. Chem. 1987. S. 1025-1030]. Для реакции образования пептидной связи на полимере используют эквивалентные количества N,N’-дициклогексилкарбодиимида (DCC) и 1-гидроксибензотриазола. Удаление Fmoc-защиты проводят в мягких условиях - 20%-ным раствором пиперидина в DMFA. Присоединение остатка гемина осуществляют действием моно-N-оксисукцинимидного эфира протогемина IX, полученного без выделения.
Отщепление производных гемина от полимера и деблокирование боковых защитных групп проводят смесью уксусной кислоты, трифторэтанола и дихлорметана в соотношении 1:1:8.
Предложенный способ твердофазного синтеза производных порфиринов может быть использован не только для синтеза геминпептидов, но и для синтеза производных любых карбоксилсодержащих порфиринов и металлопорфиринов, в том числе с использованием альтернативных способов активации карбоксильной группы порфирина (металлопорфирина).
Синтез производных гемина отражен в примерах 1-16.
Предлагаемые производные гемина получены с высокими выходами и высокой степенью чистоты и охарактеризованы УФ-, ИК-спектроскопией, масс-спектрометрией, ТСХ.
Индивидуальность полученных соединений проверяют методом ТСХ на пластинах Silufol UV-254 (Чехия) в системе растворителей хлороформ-метанол 9:1 (1), на пластинах Alufol (нейтр., "Merck", Германия) в системе хлороформ-метанол 9:1 (2), на пластинах Kieselgel ("Merck", Германия) в системах: хлороформ-метанол 9:1 (3), пиридин-вода-хлороформ-гексан 10:10:10:1 (4), н-бутанол-вода-уксусная кислота 4:5:1 (5), хлороформ-метанол-уксусная кислота 9:1:0.1 (6), хлороформ-метанол-уксусная кислота 7:3:1 (7), на бумаге в системе н-бутанол-вода-уксусная кислота 4:5:1 (8).
Хроматограммы проявляют нингидрином, хлор-толидиновым реактивом и по свечению в УФ-свете.
Выходы продуктов твердофазного синтеза рассчитывают по отношению к содержанию исходной аминокислоты в полимере. Пептидилполимеры для количественного аминокислотного анализа гидролизуют смесью 12 н. соляная кислота-пропионовая кислота (1:1) в течение двух часов при 140° С.
Количественный аминокислотный анализ гидролизатов проводят на автоматическом аминокислотном анализаторе Biotronic IC5001 (Германия).
Масс-спектры высокого разрешения получают на времяпролетном масс-спектрометре с лазерной десорбционной ионизацией (TOF MALDI) Vision 2000 (Thermo Bioanalysis, Англия) и магнитно-секторном приборе с прямой конфигурацией и электроспрей-ионизацией Finnigan MAT 900S (США).
Электронные спектры снимают на приборе Jasco model UV/VS 7800 Spectrophotometer (Япония).
ПМР-спектры регистрируют на приборе Bruker MSL 200 (200 МГц) (Германия) в CDCl3, CD3OD D2O.
ИК-спектры снимают на приборах Perkin ELMER FT-IR Spectrometer 1725X (Щвейцария) и Hitachi 250-70 IR Spectrometer (Япония).
Температуру плавления определяют на термоплавильном столике фирмы Boetius (Германия).
В качестве полимерных носителей в синтезе производных гемина используют сополимер стирола с 1% дивинилбензола с 2-хлортритилхлоридной якорной группой с содержанием Сl- 1.58 ммоль/г (фирма "Bachem", Германия), а также хлорметилированный сополимер стирола и 1% дивинилбензола, содержащий 1.05 ммоль/г Сl- (фирма "Sigma", Германия). Твердофазный синтез осуществляют в соответствии с Fmoc- и Воc-стратегиями соответственно. Нагрузку стартовой аминокислоты на носителе определяют спектрофотометрическим методом [Dryland A., Sheppard R.C.// J. Chem. Soc. Perkin Trans. I. 1986. №1. P. 125-137] и с применением пикриновой кислоты [Gisin B.E.// Anal. Chem. Acta. 1972. V. 58. Р. 248-249], а также по данным количественного аминокислотного анализа. Блокирование остаточных аминогрупп в полимере проводят действием 5-кратных избытков п-нитрофенилацетата [Желтухина Г.А., Сидорова М.В., Филиппович Е.И., Евстигнеева Р.П.// Журн. орг. химии. 1978. Т. 48. №5. C. 1171-1172]. Деблокирование Fmoc-пептидилполимеров проводят по следующей схеме: 1) промывка DMF 3 мин× 2; 2) обработка 20% раствором пиперидина в DMF 3 мин × 1, 11 мин × 1; промывка DMF 1 мин × 5. Деблокирование Вос-пептидилполимеров осуществляют по схеме: 1) промывка хлористым метиленом 2 мин × 2; 2) обработка 50% раствором TFA в хлористом метилене 15 мин × 2; 3) промывка хлористым метиленом 2 мин × 2; 4) промывка DMF 2 мин × 2; 5) нейтрализация 10% раствором Et3N в DMF 10 мин × 2; 6) промывка DMF 2 мин × 2. Полноту протекания реакций конденсации на полимере проверяют с помощью полуколичественного нингидринового теста [Kaiser E., Colescott R.L., Rossinger G.D., Cook P.J.// Anal. Biochem. 1970. V. 34. №2. P. 595-598].
Пример 1. Nα -Boc-Val-Phe-OMe (II) [Гершкович А.В., Кибирев В.К. Химический синтез пептидов.// АН Украины. Ин-т биоорган. химии и нефтехимии. - Киев: Наукова думка. 1992. 359 с.]
К раствору 0.79 мл (5.46 ммоль) Et3N и 4.0 мл DMFA прибавляют 1.19 г (5.46 ммоль) HCl· H-Phe-OMe, оставляют на 15 мин при 0° С. Осадок отделяют. К охлажденному до -15° С раствору 1.34 г (6.17 ммоль) Boc-Val-OH в 4.0 мл DMFA при перемешивании прибавляют 0.59 мл (5.83 ммоль) N-метилморфолина и 0.47 мл (5.83 ммоль) этилхлорформиата, перемешивают в течение 15 мин при -15° С. Контроль за образованием смешанного ангидрида проводят методом ТСХ. К реакционной смеси добавляют раствор H-Phe-OMe и перемешивают при -15° С 2 ч. Насыщенным раствором поташа доводят рН реакционной смеси до 8.5, перемешивают при 0° С 20 мин, разбавляют 40 мл насыщенного раствора хлористого натрия, доводят рН до 8.5 и экстрагируют этилацетатом (5× 15 мл). Этилацетатный экстракт промывают 5% раствором бикарбоната натрия (3× 10 мл), водой (2× 10 мл), 3% раствором НСl (2× 15 мл), водой (2× 15 мл), насыщенным раствором NaCl (2× 15 мл), водой (2× 15 мл). Сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме. Остаток сушат над Р2O5. Выход 1.80 г (87.0%), Rf 0.82 (1). Т. пл. 106-108° С. Лит. т. пл. 101-102° С [Евстигнеева Р.П., Лубсандоржиева Л.К., Желтухина Г.А.// ДАН. 1992. Т. 326. С. 452-455]. Масс-спектр, m/z: [М]+ 378.9.
Пример 2. Nα -Boc-Leu-Val-Phe-OMe (III).
Раствор 1.10 г (2.91 ммоль) Boc-Val-Phe-OMe в TFA оставляют на 25 мин при 20° С, после чего растворитель удаляют в вакууме. Остаток растирают с эфиром, растворитель удаляют в вакууме, сушат над безводным NaOH. К раствору CF3COOH· H-Val-Phe-OMe в 4.0 мл DMFA при перемешивании добавляют 0.42 мл (2.91 ммоль) Еt3N. Оставляют на 15 мин при 0° С. Реакцию конденсации с Boc-Leu-ОН проводят в условиях, аналогичных описанным для соединения (II). Выход 1.05 г (73.4%), Rf 0.74 (1). Т. пл. 134-136° С. Найдено %: С 63.29, Н 8.2, N 8.75. С26Н41N3О6. Вычислено %: С 63.50, Н 8.34, N 8.55. Масс-спектр, m/z: [M+2H2O]+ 527.0.
Пример 3. Nα -Boc-Leu-Leu-Val-Phe-OMe (IV).
Синтез, выделение и очистку пептида (IV) осуществляют в соответствии с методикой, описанной для пептида (III), исходя из 0.25 г (0.51 ммоль) Вос-Leu-Val-Phe-OMe. Выход 0.19 г (61.6%), Rf 0.60 (1). ИК-спектр, ν , см-1, вазелиновое масло: 3260 (NH-), 1745 (СО сл. эф.), 1632 (амид I), 1515 (амид II). Спектр 1Н-ЯМР (CDCl3), δ , м. д.: 1.4 (с, 9Н, трет. Вu), 1.6 (с, 6Н, изо-Pr.), 2.05 (к, 1Н, -СН-СОО), 3.1 (д, 2Н, -CH2-), 3.7 (с, 3Н, -O-СН3), 4.0 (т, 4Н, N-CH-CON), 4.9 (д, 4Н, 4NH), 6.6 (д, 6Н, (СН3)2-СН-), 7.1-7.3 (м, 5Н, Ph). Масс-спектр, m/z: [M]+ 605.6.
Пример 4. Nα -[6(7)-(Протогемин IX)-ил]-Val-Phe-OMe (V).
Раствор 0.10 г (0.26 ммоль) Boc-Val-Phe-OMe в TFA оставляют на 25 мин при 20° С, растворитель удаляют в вакууме. Остаток растирают с эфиром, растворитель удаляют в вакууме, сушат над безводным NaOH. К раствору СF3СООН· Н-Val-Рhе-ОМе в 0.5 мл DMFA при перемешивании прибавляют 0.04 мл (0.26 ммоль) Et3N и оставляют на 15 мин при 0° С. Добавляют 6(7)-моно-N-оксисукцинимидный эфир протогемина IX, полученный из 0.21 г (0.33 ммоль) гемина, в 3 мл DMFA по типичной методике [Радюхин В.А., Филиппович Е.И., Евстигнеева Р.П.// Журн. общ. химии. 1980. Т. 50. С. 673-678]. Оставляют на 48 ч при 20° С. Растворитель из реакционной смеси удаляют в вакууме, остаток растирают с эфиром, растворитель удаляют в вакууме. Сырой продукт очищают препаративной хроматографией на пластинах PSC-Fertigplatten Kieselgel 60 F254 (200× 200× 1 мм) (Merck) в системе растворителей хлороформ-метанол (9:1). Целевое вещество элюируют с сорбента смесью хлороформ-метанол (1:1). Для введения противоиона раствор геминпептида (V) в 10 мл хлороформа обрабатывают 0.5 н. раствором соляной (уксусной) кислоты, промывают водой до нейтральной реакции. Органический слой сушат над безводным Na2SO4, растворитель удаляют в вакууме, остаток сушат над безводным СаСl2 в вакууме. Выход 0.14 г (59.0%), Rf 0.41 (3), Rf 0.05 (2). Электронный спектр, λ max, нм, СНСl3, (ε · 10-3): 389.2 (78.5), 511.0 (8.8), 540.2 (6.9), 642.4 (5.0); ИК-спектр, ν , см-1, СНСl3: 3316 (NH-), 1745 (СО сл. эф.), 1619 (СОО-), 1667 (амид I), 1506 (амид II). Масс-спектр, m/z: [M+H]+ 877.1. Количественный аминокислотный анализ: Val 0.99(1), Phe 1.01(1).
Пример 5. Nα -[6,7-(Протогемин IX)-ил]-Val-Рhе-ОМе (VI).
Соединение (VI) получают по методике, описанной для соединения (V) из 0.10 г (0.26 ммоль) Boc-Val-Phe-OMe и 6,7-бис-N-оксисукцинимидного эфира протогемина IX в 2 мл DMF, синтезированного из 0.09 г (0.14 ммоль) гемина, 0.03 г (0.28 ммоль) N-гидроксисукцинимида и 0.06 г (0.28 ммоль) DCC. Продукт очищают на колонке (170× 20 мм) с силикагелем UA 02750 32-63 Active (США), элюируя целевое вещество смесью хлороформ-метанол (9:1). Для введения противоиона геминпептид (VI) обрабатывают по методике, описанной для соединения (V). Выход 0.11 г (74.2%), Rf 0.6 (3), Rf 0.9 (2). Электронный спектр, λ max, нм, СНСl3, (ε · 10-3): 389.0 (75.7), 509.6 (8.3), 543.6 (6.4), 641.6 (4.8); ИК-спектр, ν , см-1, СНСl3: 3316 (NH-), 1743 (СО сл. эф.), 1653 (амид I), 1516 (амид II). Масс-спектр, m/z: [М]+ 1137.41. Количественный аминокислотный анализ: Val 0.94(1), Phe 1.07(1).
Пример 6. Nα -[6(7)-(Протогемин IX)-ил]-Leu-Val-Phe-OMe (VII).
Соединение (VII) получают аналогично соединению (V) из 0.10 г (0.20 ммоль) Boc-Leu-Val-Phe-OMe и 6(7)-моно-N-оксисукцинимидного эфира протогемина IX в 2 мл DMF, синтезированного из 0.18 г (0.29 ммоль) гемина. Сырой продукт очищают препаративной хроматографией аналогично соединению (V). Для введения противоиона геминпептид (VII) обрабатывают в соответствии с методикой, описанной для соединения (V). Выход 0.02 г (12.4%), Rf 0.41 (3). Масс-спектр, m/z: [М+3Н]+ 992.26.
Пример 7. Nα -[6(7)-(Протогемин IX)-ил]-Leu-Leu-Val-Phe-OMe (VIII).
Соединение (VIII) получают аналогично соединению (V) из 0.12 г (0.20 ммоль) Boc-Leu-Leu-Val-Phe-OMe и 6(7)-моно-N-оксисукцинимидного эфира протогемина IX в 2.5 мл DMF, синтезированного из 0.18 г (0.29 ммоль) гемина. Сырой продукт очищают препаративной хроматографией аналогично соединению (V). Для введения противоиона геминпептид (VIII) обрабатывают в соответствии с методикой, описанной для соединения (V). Выход 0.09 г (41.0%), Rf 0.5 (3), Rf 0.05 (2). Электронный спектр, λ max, нм, СНСl3, (ε · 10-3): 387.0 (46.0), 512.0 (6.9), 543.0 (6.0); ИК-спектр, ν , см-1, СНСl3: 3250 (NH-), 1730 (СО сл. эф.), 1617 (COO-), 1640 (амид I), 1540 (амид II). Масс-спектр, m/z: [М]+ 1104.7. Количественный аминокислотный анализ: Leu 1.80 (2), Val 1.09 (1), Phe 1.01 (1).
Пример 8. Nα -[6,7-(Протогемин IX)-ил]-Leu-Leu-Val-Phe-OMe (IX).
Соединение (IX) получают аналогично соединению (VI) из 0.10 г (0.20 ммоль) Boc-Leu-Leu-Val-Phe-OMe и 6,7-бис-N-оксисукцинимидного эфира протогемина IX в 2 мл DMF, синтезированного из 0.07 г (0.11 ммоль) гемина. Сырой продукт очищают препаративной хроматографией аналогично соединению (V). Для введения противоиона геминпептид (IX) обрабатывают в соответствии с методикой, описанной для соединения (V). Выход 0.09 г (32.0%), Rf 0.7 (3), Rf 0.9 (2). Электронный спектр, λ max, нм, СНСl3, (ε · 10-3): 390.6 (53.9), 509.0 (5.9), 540.0 (5.5), 640.8 (2.5); ИК-спектр, ν , см-1, СНСl3: 3316 (NH-), 1745 (СО сл. эф.), 1650 (амид I), 1514 (амид II). Масс-спектр, m/z: [М]+ 1104.7. Количественный аминокислотный анализ: Leu 2.00 (2), Val 0.96 (1), Phe 1.07 (1).
Пример 9. Nα -[6(7)-(Протогемин IX)-ил]-Gly-Pro-Arg-OMe (X).
Деблокирование аминокомпонента и синтез геминпептида (X) осуществляют в соответствии с условиями, описанными для соединения (V), исходя из 0.04 г (0.09 ммоль) Boc-Gly-Pro-Arg-OMe и 6(7)-моно-N-оксисукцинимидного эфира протогемина IX в 2 мл DMF, синтезированного из 0.09 г (0.13 ммоль) гемина. Целевое вещество выделяют на колонке (300× 30 мм) с силикагелем L40/100 (Чехия), элюируя смесью растворителей хлороформ-метанол-уксусная кислота 9:1:0.1. Фракции, содержащие вещество с Rf 0.42 (6) собирают. Растворители удаляют в вакууме. Остаток очищают препаративной хроматографией на пластинах PSC-Fertigplatten Kieselgel 60 F254 (200× 200× 1 мм) (Merck) в системе растворителей (6). Для введения противоиона раствор геминпептида (X) в 5 мл н-бутанола обрабатывают 0.5н раствором соляной (уксусной) кислоты, промывают водой до нейтральной реакции. Органический слой сушат над безводным Na2SO4, растворитель удаляют в вакууме, остаток сушат над безводным CaCl2. Выход 0.03 г (28%), Rf 0.45 (6). Электронный спектр, λ max, нм, МеОН, (ε · 10-3): 399.4 (72.6), 481.6 (5.6), 597.0 (3.9). ИК-спектр, ν , см-1, вазелиновое масло: 1637 (амид I), 1562 (амид II). Масс-спектр, m/z: [M+] 940.53.
Пример 10. Nα -[6(7)-(Протогемин IX)-ил]-Arg-OMe (XI).
К раствору 0.12 мл (0.80 ммоль) Еt3N и 1 мл DMF прибавляют 0.10 г (0.40 ммоль) HCl· H-Arg-OMe, оставляют на 15 мин при 20° С. К раствору полученного аминокомпонента добавляют раствор 6(7)-моно-N-оксисукцинимидного эфира протогемина IX в 5 мл DMF, синтезированного из 0.38 г (0.58 ммоль) гемина. Реакционную смесь перемешивают в течение 5 ч, оставляют на 72 ч при 20° С. Растворитель из реакционной смеси удаляют в вакууме. Вещество очищают на колонке (300× 15 мм) с Kieselgel 60, целевой продукт элюируют смесью метанол-вода-уксусная кислота (3:1:1). Фракции, содержащие вещество с Rf 0.26 (6), собирают. Растворители удаляют в вакууме. Остаток очищают препаративной хроматографией на пластинах PSC-Fertigplatten Kieselgel 60 F254 (Merck) в системе растворителей хлороформ-метанол-уксусная кислота (7:3:0.5). Растворители удаляют в вакууме. Для введения противоиона геминпептид (XI) обрабатывают в соответствии с методикой, описанной для соединения (X). Выход 0.056 г (17%). Rf 0.26 (6). Электронный спектр, λ max, нм, МеОН, (ε · 10-3): 398.4 (53.9), 482.2 (5.9), 597.8 (3.0); ИК-спектр, ν , см-1, вазелиновое масло: 1745 (СО сл. эф.), 1635 (амид I), 1560 (амид II). Масс-спектр, m/z: [M]+ 786.41.
Пример 11. Nα -[6,7-(Протогемин IX)-ил]-Arg-OMe (XII).
Соединение (XII) получают аналогично соединению (XI) из 0.10 г (0.40 ммоль) HCl· H-Arg-OMe и 6,7-бис-N-оксисукцинимидного эфира протогемина IX в 2 мл DMF, синтезированного из 0.14 г (0.22 ммоль) гемина. Реакционную смесь перемешивают в течение 6 ч, оставляют на 72 ч при 20° С. Растворитель из реакционной смеси удаляют в вакууме. Вещество очищают на колонке (300× 15 мм) с Kieselgel 60, целевой продукт элюируют смесью хлороформ-метанол-уксусная кислота (7:3:1). Растворители удаляют в вакууме. Для введения противоиона геминпептид (XII) обрабатывают в соответствии с методикой, описанной для соединения (X). Выход 0.030 г (12%). Rf 0.4 (7). Электронный спектр, λ max, нм, МеОН, (ε · 10-3): 398.8 (50.9), 481.8 (5.4), 596.8 (4.8); ИК-спектр, ν , см-1, вазелиновое масло: 1745 (СО сл. эф.), 1632 (амид I), 1558 (амид II). Масс-спектр, m/z: [М]+ 956.52.
Пример 12. Nα -[6(7)-(Протогемин IX)-ил]-Leu-Val-Phe-OH (XIII).
Присоединение стартовой аминокислоты к полимерной матрице осуществляют в соответствии с методикой [Barlos К., Chatzi О., Gamos D., Stavropouls G.// Int. J. Peptide Protein. Res. 1991. V. 37. P. 513-520]. К 0.3 г (0.47 ммоль Сl-) полимера, предварительно набухшего в 3 мл DCE, прибавляют свежеприготовленный раствор 0.12 г (0.30 ммоль) Fmoc-Phe-OH и 0.11 мл (0.75 ммоль) Et3N в 4.5 мл DCE. Смесь перемешивают 25 мин при 20° С. Реакцию останавливают прибавлением 6 мл смеси МеОН-Еt3N (9:1), перемешивают 1 мин. Пептидилполимер отфильтровывают и промывают DCE (2 мин × 3), DMF (2 мин × 2), изопропанол (2 мин × 2), DMF (2 мин × 2), изопропанол (2 мин × 2), метанол (2 мин × 1), эфир (2 мин × 2). Объем одной промывки 3 мл. Сушат в вакууме над Р2О5. Содержание стартовой аминокислоты в полимере, определенное спектрофотометрическим методом по содержанию Fmoc-группы в полимере [Dryland A., Sheppard R.C.// J. Chem. Soc. Perkin Trans. I. 1986. №1. Р. 125-137], 0.43 ммоль/г. К раствору 0.13 г (0.39 ммоль) Fmoc-Val-OH в 3 мл DMF при охлаждении и перемешивании добавляют 0.06 г (0.39 ммоль) 1-НОВТ и 0.08 г (0.39 ммоль) DCC. Смесь перемешивают в течение 20 мин, прибавляют к деблокированному пептидилполимеру и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Дипептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. Реакцию пептидообразования повторяют с использованием 0.14 г (0.39 ммоль) Fmoc-Leu-ОН, трипептидилполимер отфильтровывают, промывают аналогично предыдущему. Нингидриновый тест положительный. Реакцию повторяют с 1 эквивалентом карбоксильного компонента. Оставляют на 2 ч. Нингидриновый тест отрицательный. Раствор 6(7)-моно-N-оксисукцинимидного эфира протогемина IX, полученного по типичной методике из 0.36 г (0.56 ммоль) гемина, в 10.5 мл DMF прибавляют к 0.3 г деблокированного трипептидилполимера и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Геминпептидилполимер отделяют, промывают DMF (1 мин × 7). Нингидриновый тест отрицательный. К 0.3 г геминпептидилполимера прибавляют 3 мл смеси AcOH-TFE-DCM (1:1:8), перемешивают в течение 1 ч. Полимер отделяют, промывают смесью AcOH-TFE-DCM (1:1:8) (1 мин × 4). Растворители из фильтрата удаляют в вакууме, остаток сушат в вакууме над NaOH. Для введения противоиона раствор геминпептида в 10 мл н-бутанола обрабатывают 0.5 н раствором соляной (уксусной) кислоты, промывают водой до нейтральной реакции. Органический слой сушат над безводным Na2SO4, растворитель удаляют в вакууме, остаток сушат над безводным СаСl2 вакууме. Продукт очищают на колонке с сефадексом LH-20 25/100μ (Швеция), элюируя целевое вещество смесью хлороформ-метанол (1:1). Выход 0.08 г (72.0%), Rf 0.63 (4). Электронный спектр, λ max, нм, СНСl3-МеОН (1:1), (ε · 10-3): 395.2 (60.3), 500.2 (6.4), 536.0 (5.7), 624.6 (4.8); ИК-спектр, ν , см-1, в пленке: 3291 (NH-), 1716 (-СООН), 1643 (амид I), 1546 (амид II). Масс-спектр, m/z: [M]+ 975.5. Количественный аминокислотный анализ: Leu 0.97 (1), Val 1.00 (1), Phe 1.04 (1).
Пример 13. Nα -[6(7)-(Протогемин IX)-ил]-Val-Ser-Gln-Asn-Leu-OH (XIV).
Присоединение стартовой аминокислоты Leu к 0.33 г (0.52 ммоль Сl-) полимера с 2-хлортритилхлоридной якорной группой осуществляют по методике, описанной для соединения (XIII), с использованием 0.12 г (0.33 ммоль) Fmoc-Leu-OH и 0.12 мл (0.83 ммоль) Et3N. Содержание стартовой аминокислоты в полимере 0.28 ммоль/г. К раствору 0.10 г (0.27 ммоль) Fmoc-Asn-OH в 3 мл DMF при охлаждении и перемешивании добавляют 0.04 г (0.27 ммоль) 1-НОВТ и 0.06 г (0.27 ммоль) DCC. Смесь перемешивают в течение 20 мин, прибавляют к деблокированному пептидилполимеру и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Дипептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест положительный. Аминоацилполимер промывают DMF (1 мин × 2), добавляют раствор 0.08 г (0.45 ммоль) п-нитрофенилацетата в 3 мл DMF, оставляют на 2 ч, дипептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. К деблокированному дипептидилполимеру прибавляют раствор 0.14 г (0.27 ммоль) Fmoc-Gln-OPfp в 3 мл DMF, перемешивают 30 мин, оставляют на 24 ч при 20° С. Трипептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. К раствору 0.15 г (0.27 ммоль) Fmoc-Ser(Trt)-OH в 3 мл DMF при охлаждении и перемешивании добавляют 0.04 г (0.27 ммоль) 1-НОВТ и 0.06 г (0.27 ммоль) DCC. Смесь перемешивают в течение 20 мин, прибавляют к деблокированному трипептидилполимеру и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Тетрапептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. Реакцию пептидообразования повторяют с использованием 0.09 г (0.27 ммоль) Fmoc-Val-OH. Пентапептидилполимер отфильтровывают, промывают DMF (1 мин× 5). Нингидриновый тест отрицательный. Раствор 6(7)-моно-N-оксисукцинимидного эфира протогемина IX, полученного по типичной методике из 0.36 г (0.56 ммоль) гемина, в 10.5 мл DMF прибавляют к 0.3 г деблокированного пентапептидилполимера и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Геминпептидилполимер отделяют, промывают DMF (1 мин × 7). Нингидриновый тест отрицательный. К 0.3 г геминпептидилполимера прибавляют 3 мл смеси AcOH-TFE-DCM (1:1:8), перемешивают в течение 1.5 ч. Полимер отделяют, промывают смесью AcOH-TFE-DCM (1:1:8) (1 мин × 4). Растворители из фильтрата удаляют в вакууме, остаток сушат в вакууме над NaOH. Сырой продукт растворяют в DMF и переосаждают эфиром. Осадок отделяют и промывают МеОН. Для введения противоиона геминпептид (XIV) обрабатывают в соответствии с методикой, описанной для соединения (XIII). Выход 0.10 г (92.0%), Rf 0.35 (5). Электронный спектр, λ max, нм, DMSO, (ε · 10-3): 404.0 (60.3), 499.4 (6.4), 537.6 (5.7), 622.2 (4.8); ИК-спектр, ν , см-1, DMSO: 3308 (NH-), 1725 (-COOH), 1671 (амид I), 1538 (амид II). Масс-спектр, m/z: [M]+ 1158.4. Количественный аминокислотный анализ: Leu 1.00 (1), Asp 1.10 (1), Glu 1.20 (1), Ser 0.80 (1), Val 0.90 (1).
Пример 14. Nα -[6(7)-(Протогемин IX)-ил]-Arg-Arg-Trp-His-Arg-Leu-Lys-Glu(OMe)-OH (XV).
Присоединение стартовой аминокислоты Glu к 0.6 г (0.95 ммоль Сl-) полимера с 2-хлортритилхлоридной якорной группой осуществляют по методике, описанной для соединения (XIII), с использованием 0.36 г (0.95 ммоль) Fmoc-Glu(OMe)-OH и 0.33 мл (2.38 ммоль) Et3N. Содержание глутаминовой кислоты в полимере 0.22 ммоль/г. Твердофазный синтез октапептидилполимера осуществляют аналогично описанному выше синтезу трипептидилполимера при получении геминпептида (XIII). Реакции образования пептидной связи на полимере проводят с использованием трехкратных избытков (по отношению к содержанию стартовой глутаминовой кислоты в полимере) Fmoc-производных аминокислот, в том числе Fmoc-Lys(methoxy-Trt)-OH и Fmoc-His(Trt)-OH, в присутствии эквивалентных количеств DCC 1-HOBT (по 0.40 ммоль) в среде DMF в течение 24 ч. Присоединение остатка гемина осуществляют в соответствии с методикой, описанной в примере синтеза соединения (XIII). Отщепление целевого геминпептида с одновременным деблокированием боковых функциональных групп проводят действием на пептидилполимер смеси AcOH-TFE-DCM (2:1:7) в течение 3 ч при перемешивании. Далее полимер промывают смесью AcOH-TFE-DCM (2:1:7) (4× 1 мин). Фильтрат собирают, растворители удаляют в вакууме, остаток растирают с эфиром, выпавший осадок отделяют, сушат в вакууме над Р2O5. Продукт очищают на колонке с сефадексом LH-20 25/100μ (Швеция), элюируя целевое вещество смесью метанол-уксусная кислота (5:1). Введение противоиона проводят аналогично тому, как описано в примере синтеза соединения (XIII). Выход г (%), Rf 0.35 (4). Количественный аминокислотный анализ октапептидилполимера: Glu 1.20 (1), Leu (1), Lys (1), Arg (3), Trp (1), His (1).
Пример 15. Конъюгат лизинового кора с протогемином IX (XVI).
Присоединение стартовой аминокислоты Lys к 0.30 г (0.47 ммоль Сl-) полимера с 2-хлортритилхлоридной якорной группой осуществляют по методике, описанной для соединения (XIII), с использованием 0.18 г (0.30 ммоль) Fmoc-Lys(Fmoc)-OH и 0.11 мл (0.75 ммоль) Et3N. Содержание стартовой аминокислоты в полимере 0.11 ммоль/г. К раствору 0.12 г (0.20 ммоль) Fmoc-Lys(Fmoc)-OH в 2 мл DMF при охлаждении и перемешивании добавляют 0.03 г (0.20 ммоль) 1-HOBT и 0.04 г (0.20 ммоль) DCC. Смесь перемешивают в течение 20 мин, прибавляют к деблокированному пептидилполимеру и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Пептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. Реакцию пептидообразования повторяют с использованием 0.24 г (0.40 ммоль) Fmoc-Lys(Fmoc)-OH. Пептидилполимер отфильтровывают, промывают DMF (1 мин × 5). Нингидриновый тест отрицательный. Присоединение остатка гемина проводят в соответствии с методикой, описанной для соединения (XIII), добавляя к 0.2 г деблокированного пептидилполимера раствор 6(7)-моно-N-оксисукцинимидного эфира протогемина IX в 15 мл DMF, полученного по типичной методике из 0.50 г (0.77 ммоль) гемина. Отщепление геминпептида и введение противоиона проводят аналогично тому, как описано в примере синтеза соединения (XIII). Целевое вещество (XVI) переосаждают эфиром из DMFA. Выход 0.03 г (35.0%). Rf 0.56 (5). Электронный спектр, λ max, нм, МеОН, (ε · 10-3): 397.0 (86.1), 492.8 (6.0), 597.0 (4.7).
Пример 16. Nα -[6(7)-(Протогемин IX)-ил]-Glu-Asp-Leu-OH (XVII).
К 1.0 г хлорметилированного сополимера стирола 1% DVB (1.05 ммоль/г Сl-) прибавляют 0.38 г (1.05 ммоль) Boc-Leu-OCs в 7 мл DMF, перемешивают при 40° C 18 ч и выдерживают без перемешивания при 20° С 48 ч. Аминоацилполимер отделяют, промывают DMF (2 мин × 3), DMF/Н2О (2 мин × 2), DMF (2 мин × 2), хлороформ (2 мин × 2), метанол (2 мин × 1), хлороформ (2 мин × 1), эфир (2 мин × 1). Объем одной промывки 5 мл. Сушат в вакууме над Р2O5. Нагрузку стартовой аминокислоты на носитель определяют с применением пикриновой кислоты [Gisin B.E.// Anal. Chem. Acta. 1972. V. 58. Р. 248-249]. Содержание аминогрупп Leu в аминоацилполимере 0.38 ммоль/г. К деблокированному пептидилполимеру добавляют свежеприготовленный раствор 0.56 г (1.14 ммоль) Boc-Asp(OBzl)-OPfp и 0.15 г (1.14 ммоль) 1-НОВТ в 3 мл DMF и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Дипептидилполимер отделяют, промывают DMF (2 мин × 3), хлороформ (2 мин × 2), метанол (2 мин × 1), хлороформ (2 мин × 1). Нингидриновый тест отрицательный. Последующую реакцию пептидообразования проводят аналогично предыдущей с 0.52 г (1.14 ммоль) Boc-Glu(OBzl)-OPfp и 0.15 г (1.14 ммоль) 1-НОВТ в 3 мл DMF. Нингидриновый тест отрицательный. Раствор 6(7)-моно-N-оксисукцинимидного эфира протогемина IX, полученного по типичной методике из 1.66 г (1.63 ммоль) гемина, в 28.0 мл DMF прибавляют к 1.0 г деблокированного трипептидилполимера и перемешивают в течение 30 мин. Оставляют на 24 ч при 20° С. Геминпептидилполимер отделяют, промывают DMF (1 мин × 5), хлороформ (2 мин × 2), метанол (2 мин × 1), хлороформ (2 мин × 1). Полноту прохождения реакции оценивают с применением пикриновой кислоты. Содержание непрореагировавших аминогрупп в полимере 0.07 ммоль/г. К 0.8 г геминпептидилполимера, предварительно набухшего в диоксане, прибавляют 7 мл смеси 0.5 н. водного раствора NaOH и диоксана (1:1). Суспензию перемешивают в течение 0.5 ч. Полимер отделяют, промывают смесью МеОН-СНСl3 (1:1) (1 мин × 4), DMF (1 мин × 2). Операцию повторяют с выдерживанием в течение 1 ч. Фильтраты по отдельности при охлаждении немедленно подкисляют уксусной кислотой до рН 6. Растворители из объединенных фильтратов удаляют в вакууме, остаток растирают с водой. Осадок отделяют, сушат в вакууме над Р2O5. Продукт очищают на колонке (450× 20 мм) с сефадексом LH-20 25/100μ (Швеция), элюируя целевое вещество смесью хлороформ-метанол (1:1). Для введения противоиона геминпептид (XVII) обрабатывают в соответствии с методикой, описанной для соединения (XIII). Выход 0.061 г (16.0%), Rf 0.41 (5), Rf 0.76 (6). Электронный спектр, λ max, нм, СНСl3-МеОН (1:1), (ε · 10-3): 399.8 (67.5), 497.0 (8,1), 536.7 (6.0), 618.0 (4.5); ИК-спектр, ν , см-1, в пленке: 3299 (NH-), 1721 (-СООН), 1648 (амид I), 1546 (амид II). Масс-спектр, m/z: [M]+ 973.3. Количественный аминокислотный анализ: Glu 1.09 (1), Asp 1.00 (1), Leu 0.91 (1).
Пример 17. Натриевая соль Nα -[6(7)-(Протогемин IX)-ил]-Val-Рhе-ОМе (XVIII).
В 0.2 мл раствора 0.01М NaOH добавляют 2 мг (0.002 ммоль) соединения (V). Суспензию перемешивают до полного растворения вещества. Получают водорастворимую натриевую соль Nα -[6(7)-(Протогемин IX)-ил]-Val-Рhе-ОМе (XVIII).
Далее, настоящее изобретение относится к применению известных соединений формулы (I)

где R1=R2 или R1≠R2=OH, или R1=R2=OH;
Y- представляет собой Cl-;
Me представляет собой Fe3+;
а также
R1=-LeuLeuValPheOMe, R2=-OH; R1=-ValPheOMe, R2=-OH; R1=-LeuHisOMe,
R2=-OH; R1=-LeuHisAlaOMe, R2=-OH; R1=-LeuHisNHC10H20COOMe, R2=-OH;
R1=-LeuHisNHC10H20COOH, R2=-OH; R1=-LeuHisNHC10H20COOMe,
R2=-LeuHisNHC10H20COOMe; R1=-Lys(Tfa)AlaAlaOMe, R2=-OH;
R1=-ValPheOMe, R2=-LeuHisOMe; R1=-LeuLeuValPheOMe, R2=-LeuHisOMe;
R1=-LeuLys(Tfa)LeuOMe, R2=-OH; R1=-LeuLys(Tfa)LeuOMe, R2=-LeuHisOMe;
R1=-Lys(Tfa)AlaAlaOMe, R2=-AlaHisLys(Cbz)LeuOMe; R1=-GlyOBzl,
R2=-GlyOBzl; R1=-HisOMe, R2=-HisOMe; R1=-LeuHisOMe, R2=-LeuHisOMe;
R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-LeuHisLeuGlyCys(Bzl)OBzl;
R1=-LeuHisOMe, R2=-OEt; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OEt; R1=-OBzl,
R2=-OBzl; R1=-OBzl, R2=-OH; R1=-AlaOMe, R2=-OBzl; R1=-HisOMe, R2=-OBzl;
R1=-LeuHisOMe, R2=-OBzl; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OBzl;
R1=-LeuHisAlaLys(Cbz)GlyCys(Bzl)OBzl, R2=-OBzl; R1=-LeuHisLys(Cbz)OMe,
R2=-OH; R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OH; R1=-LeuHisOMe, R2=-OMe;
R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)OMe,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisAlaLys(Cbz)Cys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisOMe, R2=-OMe;
R1=-GlyProArgGlyGlyOMe, R2=-OH;
R1=-ArgProProGlyPheSer(Bzl)PheArgGlyGlyOMe, R2=-OH,
или их фармацевтически приемлемых солей в качестве ингибиторов протеолитических ферментов: протеиназы ВИЧ, пепсина, трипсина, химотрипсина, а также в качестве индукторов интерферона и противовирусных средств.
Ингибирующая активность заявляемых соединений оценивалась в тестах по их влиянию на скорость гидролиза соответствующих субстратов протеиназой ВИЧ-1 пепсином, химотрипсином и трипсином.
Пример 19. Исследование влияния гемина и его производных гемина на функционирование протеиназы ВИЧ-1.
Гомогенный препарат ВИЧ-1 протеиназы получают экспрессией в клетках E.coli [Дергоусова Н.И., Румш Л.Д., Андреева Н.С.// Молекул. Биология. 1998. Т. 32. С. 692-698]. Расчет величин kcat, Km и Кi проводят в соответствии с методикой [Березин И.В., Клесов А.А. Практический курс химической и ферментативной кинетики.// 1976. С. 77-110]. Влияние исследуемых гемина и его производных на ВИЧ-1 протеиназу определяют по изменению скорости гидролиза субстрата по методике [Richards A.D., Phylip L.H., Farmeric W.G. et al.// J. Biol. Chem. 1990. V. 265. №14. P. 7733-7736.] в присутствии соответствующего соединения. За 100% принимают скорость ферментативной реакции в отсутствие гемина или его производного. В качестве субстрата используют синтетические пептиды H-Lys-Ala-Arg-Val-Tyr-Phe(p-NO2)-Glu-Ala-Nle-OH, H-Lys-Ala-Arg-Val-Nle-Phe(p-NO2)-Glu-Ala-Nle-OH, H-Lys-Ala-Arg-Val-Nle-Phe(p-NO2)-Glu-Ala-Met-OH, H-Ala-Thr-His-Arg-Val-Tyr-Phe(p-NO2)-Val-Arg-Lys-Ala-OH, H-Ala-Thr-His-Arg-Val-Tyr-Phe(p-NO2)-Val-Arg-OH, содержащие в качестве хромофорной метки п-нитрофенилаланин. При гидролизе субстрата в условиях рН 6.2, 37° С разрывается связь Tyr---Phe(p-NO2) (Nle-Phe(p-NO2)). Гидролиз пептида-субстрата регистрируют спектрофотометрически на приборе Gilford 2400-2 при λ 300 нм по уменьшению величины оптического поглощения при накоплении H-Phe(p-NO2)-Glu-Ala-Nle (H-Phe(p-NO2)-Glu-Ala-Met-OH, H-Phe(p-NO2)-Val-Arg-Lys-Ala-OH, H-Phe(p-NO2)-Val-Arg-OH). В экспериментах используют субстрат в концентрации: [S]0 0.2-0.5 мМ в 50 мМ MES буфере с рН 6.2, содержащем 4 мМ EDTA, 5 мМ дитиотреитола и 1 М NaCl, 37° при концентрации ингибитора и фермента соответственно [I]0 1-4 мкМ и [Е]0 5· 10-8 М.
Пример 20. Исследование влияния гемина и его производных на функционирование пепсина.
Влияние гемина и его производных на пепсин (фирмы "Merck") определяют по изменению скорости гидролиза субстрата по методике [Тиходеева А.Г., Зинченко А.А., Румш Л.Д., Антонов В.К.// ДАН СССР. 1973. Т. 214. С. 355-357]. При гидролизе субстрата Z-Ala-Ala-Phe(p-NO2)-Phe-APM в условиях рН 4.0, 37° С спектрофотометрически регистрируется возрастание величины оптического поглощения при λ 320 нм.
В экспериментах используют субстрат в концентрации: [S]0 0.15-6.00 мМ в 0.1 М ацетатном буфере при концентрации ингибитора и фермента соответственно [I]0 0.33-8.00 мкМ и [Е]0 8.44· 10-7 М. Объем реакционной смеси 1.5 мл.
Пример 21. Исследование влияния гемина и его производных на функционирование химотрипсина.
Активность химотрипсина определяют, регистрируя уменьшение величины оптической плотности при λ 237 нм, происходящее при гидролизе субстрата этилового эфира N-ацетил-L-тирозина (АТЕЕ). Предварительно инкубируют в течение 10 мин при 25° С 5 мкл запасного раствора химотрипсина в концентрации 4 мкМ в 0.001 М НСl с 0-20 мкл запасного раствора исследуемого соединения (2-5 мМ в DMSO) и 20-0 мкл DMSO, соответственно, в 0.5 мл 0.01 М трис-HCl, содержащего 0.05 М CaCl2. Затем добавляют 20-40 мкл запасного раствора АТЕЕ в концентрации 10-2 М и остальной буфер до общего объема 1.5 мл.
В экспериментах используют субстрат в концентрации: [S]0 0.133-0.267 мМ при концентрации фермента [Е]0 1.33· 10-8 М.
Пример 22. Исследование влияния гемина и его производных на функционирование трипсина.
Активность трипсина определяют с помощью субстрата p-нитроанилида N-бензоил-DL-аргинина (BAPNA). Спектрофотометрически регистрируют возрастание величины оптической плотности при гидролизе субстрата с образованием p-нитроанилина при λ 237 нм в условиях 25° С, рН 8. Смешивают 0.75-1.425 мл раствора BAPNA в концентрации 0.5 мг/мл в 0.1 М трис-НСl буфере, содержащем 0.05 М СаСl3 10% DMSO, с 0-50 мкл раствора исследуемого соединения и 100-50 мкл DMSO соответственно, добавляли тот же буфер до 1.525 мл и вносили 5 мкл запасного раствора трипсина в концентрации 2.6× 10-8 M в 0.1 М трис-НСl буфере рН 8, содержащем 0.05М CaCl2.
В экспериментах используют субстрат в концентрации: [S]0 0.568-1.08 мМ при концентрации фермента [Е]0 8.5· 10-8М.
В результате проведенной работы в ряду исследованных соединений обнаружены вещества, обладающие ингибирующей способностью в отношении протеиназы ВИЧ-1 в выбранных условиях (табл. 1), причем значения констант ингибирования составляют 10-6-10-8 М. Показано, что протопорфирин IX и пептид (II) в данных условиях не проявляют ингибирующего действия.

Показано также, что заявляемые соединения являются ингибиторами эндогенных протеиназ. Гемин является слабым ингибитором химотрипсина (Кi 0.101М), ингибирующая активность производных гемина на 1-2 выше. Для гемина величина константы ингибирования трипсина Кi составляет 6.43× 10-5M.
Таким образом, заявляемые соединения, соответствующие общей формуле, ингибируют протеиназы, например, пепсин, химотрипсин, трипсин и протеиназу ВИЧ-1 и, следовательно, предлагаемые соединения перспективны в качестве потенциальных лекарственных, в том числе противовирусных средств, что подтверждают результаты дальнейших биологических и биохимических исследований.
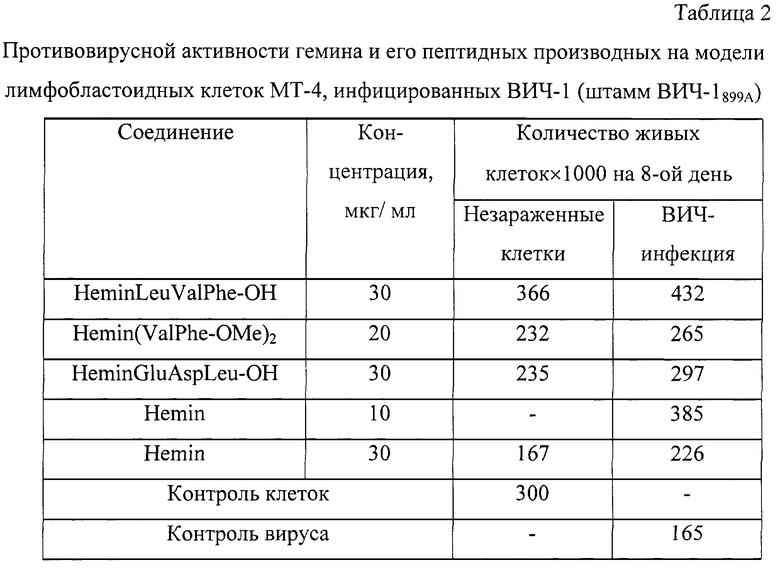
Пример 23. Влияние гемина и его производных на репродукцию вируса иммунодефицита человека при острой инфекции лимфобластоидных клеток. (фиг. 1).
Исследование проводили на культуре лимфобластоидных клеток человека МТ-4. В эксперименте использовали вирус иммунодефицита человека, тип 1, штаммы ВИЧ-1899А и ИВ76 из коллекции Института вирусологии им. Д.И.Ивановского РАМН. Изучали действие предлагаемых соединений на репродукцию вируса иммунодефицита человека в концентрациях: 0.03-30.0 мкМ. Препарат сравнения - азидотимидин (АЗТ) (фирма "Wellcome" Великобритания), в дозах 0.03-30.0 мкМ. Соединения вносили в культуру клеток МТ-4 за 1 час до внесения вируса в дозе 1000 ТЦИД50. Оценку жизнеспособности клеток МТ-4 проводили на 3, 5, 7, 8 дни эксперимента.
Основным параметром эффективности действия исследуемых соединений являлась жизнеспособность клеток.
Степень защиты клеток от цитодеструктивного действия ВИЧ определяли по формуле [Montefiori D.C., Robinson W.E., Mitchell W.M.// AIDS Research and Human Retroviruses. 1989. V. 5. №2. P. 193-203]:

где А - число жизнеспособных клеток в опытной культуре; В - число жизнеспособных клеток в инфицированной культуре (контроль вируса); К - число жизнеспособных клеток в контрольной неинфицированной культуре.
В предварительных экспериментах было показано, что исследуемые соединения являются малотоксичными и обладают выраженными свойствами подавлять репликацию ВИЧ-1.
В результате проведенных экспериментов на примере гемина и некоторых его производных показано, что предлагаемые соединения обладают способностью ингибировать репликацию ВИЧ-1 в культуре клеток МТ-4 при острой инфекции, причем АЗТ в концентрации 1.0 мкМ обеспечивал 75% защиту клеток от ВИЧ-1 штамм 899А, гемин был неэффективен, а защитный эффект пептидных производных гемина достигал 52-86% (табл. 2).
При исследовании действия гемина и его производных, в концентрациях 0.5 и 1.0 мкМ при одновременном с заражением внесении их в культуры лимфобластоидных клеток HPBALL ВИЧ-1 (изолят ИВ26) на репликацию ВИЧ в зависимости от времени их применения показано, что предлагаемые соединения одинаково эффективны как на ранних (до 6 часов), так и на поздних стадиях репликации вируса ВИЧ-1. При этом можно отметить, что максимальный антивирусный эффект порфиринопептидов отмечался после введения в культуру клеток через 4 часа, а гемина - через 20 часов. При этом уже через 2 часа после внесения вируса в культуру клеток в цитоплазме чувствительных клеток обнаруживается линейная форма ДНК провируса ВИЧ, а к 6 часам в ядре уже обнаруживаются как линейные, так и циркулярные формы вирусной ДНК.
Пример 24. Изучение дозово-зависимого эффекта гемина и его производных на репликацию ВИЧ-1.
В серии экспериментов для установления минимально эффективной концентрации были исследованы концентрации 10.0, 1.0, 0.5, 0.1 мкМ. Препаратом сравнения служил гемин, взятый в тех же концентрациях. Наряду с противовирусной активностью исследована токсичность предлагаемых соединений в использованных концентрациях, определяемая по 50% ингибирующей концентрации (ИК 50).
Токсичность гемина проявляется уже в концентрации 1 мкМ (деструкция 25% клеток): ИК 50 - 50-20 мкМ. Производные гемина оказались значительно менее токсичными для клеток МТ-4. Так, при концентрации до 10 мкМ токсичность для них практически отсутствует: ИК 50 - 50-30 мкМ.
Пример 25. Определение противовирусного эффекта по подавлению синцитиеобразования и по степени защиты от цитодеструктивного действия ВИЧ-1 (штамм BRU).
Гемин в концентрации 0.1-1.0 мкМ подавлял образование синцития на 50%, при 10 мкМ - на 75%. В то же время производные гемина в концентрации 0.5 мкМ подавляли синцитиеобразование уже на 75%, а при концентрации 1.0 мкМ фокусов синцитиев в инфицированных клетках не обнаруживалось.
Максимальная защита, достигнутая при использовании гемина составила 63.4% при концентрации 10.0 мкМ, а для его производных - 94.3% при той же концентрации. Индекс эффективности (ИЭ 50) для гемина составил 1.0 мкМ (0.95), а для производных гемина - 0.4 мкМ. Химиотерапевтический индекс (ХТИ), или индекс селективности, демонстрирует более высокую активность производных гемина: ХТИ гемина составляет 21, ХТИ порфиринопептидов - 75.
Аналогичные исследования были проведены со свежевыделенным изолятом ВИЧ-1 ИВ64, обладающим большей агрессивностью. В случае применения гемина подавление образования синцития наблюдалось лишь при 10 мкМ (75%), в то же время производные гемина подавляли синцитиеобразование уже при концентрации 0.5 мкМ (75%), а при 1.0 мкМ синцитий не обнаруживался. В этом случае индекс эффективности производных гемина составил 0.66 мкМ.
Таким образом, полученные результаты, показывают, что заявляемые соединения обладали защитным эффектом, выраженным в разной степени, от цитодеструктивного действия ВИЧ-1 в концентрациях 1-30 мкМ. Причем влияние соединений на сохранение жизнеспособности клеток было сопоставимо с действием препарата сравнения - азидотимидина.
Пример 26. Исследование острой токсичности гемина и его производных на модели экспериментальной инфекции, вызванной вирусом энцефаломиокардита мышей (ЕМС).
Мышам весом 10 г внутрибрюшинно однократно вводили растворы исследуемых веществ в дозе 1.0, 10.0, 20.0 и 50.0 мг/кг. При дозе 20.0 мг/кг и выше у мышей через 24 часа отмечались признаки токсического действия: вялость, озноб, взъерошенная шерсть. Однако в последующие дни симптомы исчезли, и животные выжили. Доза вещества 10 мг/кг гибели мышей не вызывала.
Известно, что металлопорфирины обладают интерферониндуцирующим действием [Novogrodsky A., Suthanthiran M., Stenzel K.H. Immune stimulatory properties of metalloporphyrins.// J. Immunol. 1989. V. 143. №12. P. 3981-3987]. Авторы заявки показали, что производные гемина также индуцируют синтез интеферона, что представляет собой дополнительный механизм противовирусной активности заявляемых соединений, наряду с ингибированием протеиназы ВИЧ.
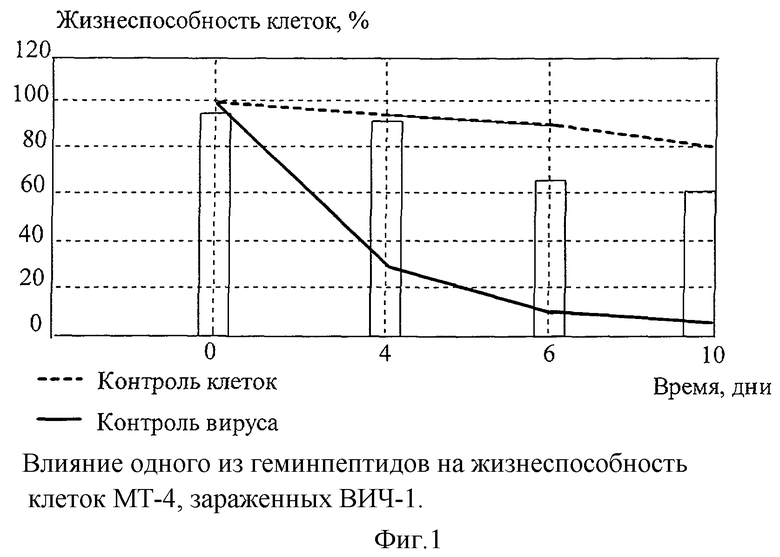
Пример 27. Изучение интерферониндуцирующей активности производных гемина.
Исследована возможность индукции интерферона гемином и его производными у мышей. Уровень интерферона определяли в сыворотке крови мышей через 5 и 24 часа после введения испытуемых веществ в дозах 0.1-5.0 мг/кг (фиг. 2).
Для определения интерферона сыворотки мышей в двукратном разведении наносили на монослой клеток L-929-перевиваемой линии фибробластов мышей. Через 24 часа инкубации при 37° С в СО2-термостате клетки инфицировали вирусом ЕМС (100 ТЦИД50). За титр интерферона принимали величину, обратную разведению пробы, при которой наблюдается защита 50% клеток от цитопатического действия вируса.
Установлено, что предлагаемые соединения, введенные внутрибрюшинно, обладают способностью индуцировать синтез "раннего" интерферона у мышей. Через 5 часов после введения уровень интерферона в крови колебался от 80 до 160 ед/мл-1.
Полученные данные позволяют предположить, что исследуемые вещества обладают иммуномодулирующими свойствами и в развитии противовирусного эффекта может играть роль стимуляция интерферонообразования.
При спектральных исследованиях (спектрофотометр Specord M-40) проникающей способности производных гемина в концентрации 6 мкмоль/мл по отношению к тимоцитам белых лабораторных мышей в физиологическом растворе по методике [Практикум по физико-химическим методам в биологии.// Под. ред. Литвина Ф.Ф. - М. - МГУ. - 1981. - С. 5-38.] показано, что производные гемина менее чем за 30 мин практически полностью проникают в тимоциты. Данные микроскопии подтвердили эти результаты. С использованием иммерсионного объектива [Первые шаги в микроскопии. // Цейсс. 1999.] и увеличения в 900 раз обнаружено, что бесцветная цитоплазма тимоцитов окрашивается в серо-коричневый цвет.
С целью выявления возможного негативного воздействия производных гемина, на клетки крови нами проведено спектрофотометрическое изучение влияния предлагаемых порфиринопептидов на эритроциты (по гиперхромному эффекту гемоглобина в полосе Соре при гемолизе эритроцитов) и основные типы лейкоцитов (лимфоциты и нейтрофилы) по методикам [Строев Е.А., Макарова В.Г. Практикум по биологической химии.// Москва. Высшая школа. 1986. С. 176-182.; Vekshin N.L. Photonics of Biopolymers.// Moscow. MGU. 1999. P. 35-36]. Выявлено, что гемин в концентрации 1 мкмоль/мл обладает гемолитическим действием по отношению к эритроцитам человека. Гемолиз оценивают по возрастанию оптической плотности при 410 нм за время инкубации в течение 2 ч при 25° С. Показано, что в отличие от гемина геминпептиды в концентрации, близкой к 1 мкмоль/мл, не вызывают гемолиза эритроцитов и даже оказывают гемопротекторное действие. Это подтверждается тем, что количество вышедшего из эритроцитов гемоглобина при незначительном осмотическом шоке (0.5-0.45% NaCl), когда заметен гемотоксический вклад DMSO, уменьшилось вдвое по сравнению с контролем. Это указывает также на способность производных гемина предотвращать гемолиз, вызванный органическими растворителями. При дальнейшем уменьшении концентрации NaCl порфиринопептиды утрачивают способность предотвращать гемолиз. В экспериментах, где клетки не подвергались действию осмотического давления, геминпептид также снижал гемолиз, вызванный органическими растворителями, поскольку оптическая плотность раствора в присутствии производных гемина была на 20% ниже, чем в экспериментах с гемином и в контроле с DMSO. Кроме того, выявлено, что около 57% добавленного порфиринопептида связываются с клетками крови, предположительно эритроцитами.
При исследовании связывания гемина и его производных в присутствии поверхностно-активного вещества - проксанола (сополимер полиэтоксиэтилена с полиоксипропиленом с молекулярной массой 8000 г/ммоль) с основными типами лейкоцитов показано, что гемин за время инкубирования в течение 30 мин вызывал разрушение клеток. При этом наблюдался выход ДНК, в результате чего раствор приобретал вязкую консистенцию, вследствие чего оценить связывание гемина с клетками не представлялось возможным. В отличие от гемина его производные в проксаноле не разрушали клетки, и независимо от разведения (1:50 и 1:100), количество связавшегося порфиринопептида (в пересчете на одну клетку) было одинаковым.
Спектральными методами оценивалось влияние гемина и его производных в проксаноле и самого проксанола на целостность клеточной мембраны. Показано, что ни проксанол в концентрации 1%, ни гемин или геминпептид в более низких концентрациях (8 мкмоль) не приводят к заметным нарушениям в проницаемости клеточной мембраны.
Известно, что некоторые порфирины способны интеркалировать в ДНК [Ward В., Skorobogaty A., Dabrowiak J.C.// Biochem. 1986. V. 25. Р. 7828-7833; Aft R.L., Mueller G.C.// J. Biol. 1983. V. 258. P. 19069-19079], что может вызывать мутагенез, а впоследствии и канцерогенез.
Методами флуоресцентной спектроскопии (стационарной и поляризационной, SLM-4800 (США)) исследована способность производных гемина конкурировать за места связывания в модельной нуклеотидной системе ДНК тимуса теленка и в синтетическом олигонуклеотиде (шпильке НР1) с типичным интеркалятором ДНК - этидием бромидом (EtBr) [Векшин Н.Л.// Журн. прикладной спектроскопии. 1998. Т. 65. С. 794-798.] и 7-амино-актиномицином D (7-AAMD), который, как предполагается, образует комплекс с ДНК за счет встраивания пептидолактонной части молекулы препарата в бороздку ДНК [Гурский Г.В.// Молекулярная биология. 1969. Т. 3 С. 749-756]. Нами показано отсутствие каких-либо взаимодействий предлагаемых производных гемина с нуклеотидными системами при соотношении компонентов 1:1 и отсутствие конкуренции между производными гемина и известными интеркаляторами за места связывания в ДНК при соотношении компонентов 1:10:6, что свидетельствует о том, что предлагаемые соединения не оказывают нежелательного воздействия на генетический материал клеток.
С целью моделирования поведения производных гемина в водной среде кровеносного русла методом флуоресцентной спектроскопии [Vekshin N.L. Photonics of Biopolymers.// Moscow. MGU. 1999. P. 145-147] исследована способность заявляемых соединений образовывать комплекс с бычьим сывороточным альбумином. Изменение параметров триптофановой флуоресценции альбумина (тушение флуоресценции и сдвиг максимума испускания в коротковолновую область) при введении в систему исследуемых производных гемина при соотношении компонентов 1:1 указывает на образование их комплекса с белком. Таким образом, эти данные могут свидетельствовать о том, что пептидные производные гемина имеют хорошие фармакокинетические характеристики, в том числе высокую биодоступность.
Настоящее изобретение относится также к фармацевтической композиции, содержащей в качестве активного ингредиента как новые, так и известные соединения общей формулы (I)

где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно, что R1=R2 или R1≠R2, или R1=R2=OH карбоксильная группа порфирина может быть модифицирована метиловым или другим C2-C8-эфиром или физиологически приемлемой солью;
Y- представляет собой Сl-, СН3СОО-;
или их фармацевтически приемлемые соли, обладающей способностью ингибировать протеолитические ферменты, конкретнее протеиназу ВИЧ и пепсин, противовирусным действием, в частности против ВИЧ-инфекции, интерферониндуцирующей активностью.
Фармацевтические композиции настоящего изобретения могут быть использованы в виде фармацевтических препаратов (например, в твердой, полутвердой или жидкой формах), содержащих предлагаемые в настоящем изобретении соединения в качестве активных ингредиентов в смеси с органическим или неорганическим носителем или наполнителем, приемлемым для внутримышечного, внутривенного, интраназального, перорального, сублингвального, ингаляционного и интраректального введения. Активный ингредиент может быть включен в фармацевтическую композицию вместе с обычно используемыми нетоксичными, фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, суппозиториев, эмульсий, суспензий, мазей и любых других лекарственных форм. В качестве носителей могут быть использованы вода, глюкоза, лактоза, аравийская камедь, желатин, крахмал, триксилит магния, тальк, кукурузный крахмал, мочевина и другие носители, пригодные для изготовления твердых, мягких или жидких препаратов. При этом в качестве добавок могут быть использованы стабилизаторы, загустители, красители и отдушки.
Активное целевое соединение вводят в фармацевтическую композицию в количестве, достаточном для получения нужного эффекта в зависимости от нозологии, течения и тяжести заболевания.
При изготовлении разовой лекарственной формы, количество активного ингредиента, используемого в комбинации с носителем, может варьировать в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании соединений настоящего изобретения в виде растворов для инъекций содержание действующего начала в них составляет 0,1-0,3%, предпочтительно в виде липосомальной формы или в составе смеси с фармацевтически разрешенным кровезаменителем или в виде комплекса с белками плазмы. Бислойные везикулярные мембраны со встроенным производным гемина готовят по типичной методике [Ушакова И.П., Василенко И.А., Радюхин В.А., Молокоедов А.С., Серебренникова Г.А., Флиппович Е.И., Евстигнеева Р.П.// Биоорган. химия. 1979. Т. 5. №10. С. 1550-1557]. В качестве разбавителя вещества могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы. При использовании соединения общей формулы (I) в виде таблеток и суппозиториев количество составляет 3,0-30,0 мг на единичную дозированную форму. Для таблеток и суппозиториев в качестве фармацевтического наполнителя используют любую фармацевтически пригодную основу. Предпочтительнее применение предлагаемых соединений внутрь в таких формах, как таблетки или капсулы.
Применение предлагаемых производных гемина в виде таблеток является перспективным еще и потому, что они проявляют ингибирующие свойства по отношению к пепсину. В этом случае гемин и его производные способны не только снизить скорость своей деградации при использовании их в качестве, например, противовирусного средства, но и в комбинации с пептидными и белковыми препаратами также увеличить биодоступность последних. Так, в литературе описано использование ингибитора пепсина, а именно упрощенного аналога пепстатина, в качестве компонента, снижающего скорость распада инсулина [Bernkop-Schnurch A., Kirchmayer R., Kratzel M.// Journal of Drug Targeting 1999. V. 7. №1. P. 55-63]. Таким образом, целесообразно использование предлагаемых соединений в качестве компонентов, снижающих скорость деградации препаратов пептидной природы.
Пример 28. Примеры лекарственных форм.
А. Желатиновые капсулы.
Состав вводимого в капсулу порошка, мг:
Соединение, соответствующее общей формуле (I), 1-35
Оксид магния 50
Крахмал 100-200
Указанные выше ингредиенты смешивают и смесь вводят в твердые желатиновые капсулы в количестве 151-285 мг.
Б. Таблетированная форма.
Таблетированную форму получают, используя приведенные ниже ингредиенты, мг:
Соединение, соответствующее общей формуле (I) 1-35
Крахмал картофельный 100
Поливинилпирролидон 10
Магния стеарат 2
Лактоза 48-82
Аэросил 5
Компоненты смешивают и прессуют для образования таблеток весом 200 мг каждая.
В. Аэрозольная форма.
Состав аэрозольной смеси, рассчитанной на 10 приемов, мг:
Соединение, соответствующее общей формуле (I) 10-40
Магния сульфата 150
Лактоза 110-140
Соединение смешивают с наполнителями и помещают в специальное устройство для распыления.
Г. Суппозитории.
В качестве суппозиторной основы могут быть использованы:
основы, не растворимые в воде - масло какао;
основы, растворимые в воде или смешиваемые с водой - желатино-глицериновые или полиэтиленоксидные;
комбинированные основы - мыльно-глицериновые.
Пример состава суппозитория:
Соединение, соответствующее общей формуле (I) 1-35
Масло какао - количество, необходимое для получения суппозитория.
При необходимости возможно изготовление ректальных, вагинальных и уретральных суппозиториев с соответствующими наполнителями.
Д. Мази.
В качестве мазевой основы могут быть использованы:
углеводородные мазевые основы - вазелин белый и желтый (Vaselinum album, Vaselinum flavum), вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции твердый парафин и воск;
абсорбтивные мазевые основы - гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens);
мазевые основы, смываемые водой - гидрофильная мазь (Unguentum hydrophylum);
водорастворимые мазевые основы - полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие.
Пример состава мази, г:
Соединение, соответствующее общей формуле (I) 0,1-0,5
Вазелин 10
Мази изготавливают по соответствующей технологии.
Е. Раствор для инъекций.
В качестве растворителя при приготовлении раствора для инъекций могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина. Производные гемина могут быть использованы в липосомальной форме (с применением, например, летицина) или солюбилизированными в разрешенных кровезаменителях, например проксаноле. Форма выпуска - ампулы, флаконы, шприц-тюбики, “insert”.
Состав раствора для инъекций:
Соединение, соответствующее общей формуле (I), 1-5
Вода дистиллированная 1-2
Возможно изготовление различных лекарственных форм для инъекций - стерильных растворов, стерильных порошков и таблеток.
Производные гемина в свободной форме или в виде фармацевтически приемлемой соли в эффективном количестве в фармацевтически приемлемом носителе, в том числе в липосомальной форме или в виде комплекса с белком плазмы, обладают полезными фармакологическими свойствами, поэтому они могут использоваться в качестве основы фармацевтических препаратов, например, в качестве противовирусных и иммуномодулирующих средств и/или добавки к лекарственным формам пептидных препаратов.
Предложен удобный способ получения всех предлагаемых препаратов.
Список сокращений
Tfa – трифторацетил
Cbz – бензилоксикарбонил
OBut - трет-бутиловый эфир
Вос - трет-бутилоксикарбонил
ТЦИД - тканевая цитопатическая доза
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕМИНПЕПТИД, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОВИРУСНОГО И ВИРУЛЕЦИДНОГО АГЕНТА | 2004 |
|
RU2296131C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ГЕМИНПЕПТИДОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ НУКЛЕОЛИТИЧЕСКИХ АГЕНТОВ | 2003 |
|
RU2250906C2 |
| ГЕМИНПЕПТИДЫ, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ | 2004 |
|
RU2280649C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2404191C2 |
| ПРОИЗВОДНЫЕ ГЕМИНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2009 |
|
RU2415868C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ГЕМИНА С АНТИБАКТЕРИАЛЬНОЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2475498C1 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2095368C1 |
| RGD-СОДЕРЖАЩИЕ ПЕПТИДЫ | 2001 |
|
RU2214416C2 |
| АНАЛОГИ ЦИКЛИЧЕСКОГО СОМАТОСТАТИНА | 1999 |
|
RU2242481C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2141483C1 |
Изобретение относится к производным гемина или их фармацевтически приемлемым солям - ингибиторам протеолитических ферментов и представляющим собой соединения общей формулы (I)
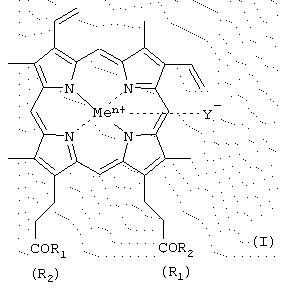
где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно, что R1=R2 или R1≠R2=OH; карбоксильная группа порфирина может быть модифицирована метиловым или другим C2-C8-эфиром или физиологически приемлемой солью; Y- представляет собой Cl-, СН3СОО-; Me представляет собой Fe, за исключением соединений, где
Ме=Fe3+, Y-=Cl-,
R1=-LeuLeuValPheOMe, R2=-OH; R1=-ValPheOMe, R2=-OH; R1=-LeuHisOMe,
R2=-OH; R1=-LeuHisAlaOMe, R2=-OH; R1=-LeuHisNHC10H20COOMe, R2=-ОН;
R1=-LeuHisNHC10H20COOH, R2=-OH; R1=-LeuHisNHC10H20COOMe,
R2=-LeuHisNHC10H20COOMe; R1=-Lys(Tfa)AlaAlaOMe, R2=-OH;
R1=-ValPheOMe, R2=-LeuHisOMe; R1=-LeuLeuValPheOMe, R2=-LeuHisOMe;
R1=-LeuLys(Tfa)LeuOMe, R2=-OH; R1=-LeuLys(Tfa)LeuOMe, R2=-LeuHisOMe;
R1=-Lys(Tfa)AlaAlaOMe, R2=-AlaHisLys(Cbz)LeuOMe; R1=-GlyOBzl,
R2=-GlyOBzl; R1=-HisOMe, R2=-HisOMe; R1=-LeuHisOMe, R2=-LeuHisOMe;
R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-LeuHisLeuGlyCys(Bzl)OBzl;
R1=-LeuHisOMe, R2=-OEt; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OEt; R1=-OBzl,
R2=-OBzl; R1=-OBzl, R2=-OH; R1=-AlaOMe, R2=-OBzl; R1=-HisOMe, R2=-OBzl;
R1=-LeuHisOMe, R2=-OBzl; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OBzl;
R1=-LeuHisAlaLys(Cbz)GlyCys(Bzl)OBzl, R2=-OBzl; R1=-LeuHisLys(Cbz)OMe,
R2=-OH; R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OH; R1=-LeuHisOMe, R2=-OMe;
R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)OMe,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisAlaLys(Cbz)Cys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisOMe, R2=-OMe;
R1=-GlyProArgGlyGlyOMe, R2=-OH;
R1=-ArgProProGlyPheSer(Bzl)PheArgGlyGlyOMe, R2=-OH,
двум способам получения производных гемина общей формулы I, фармацевтической композиции, обладающей способностью ингибировать протеолитические ферменты и применению производных гемина формулы I, ранее известных, обозначенных выше, в качестве ингибиторов протеолитических ферментов: протеиназы ВИЧ, пепсина, трипсина, химотрипсина. 5 н. и 9 з.п. ф-лы, 2 табл., 2 ил.
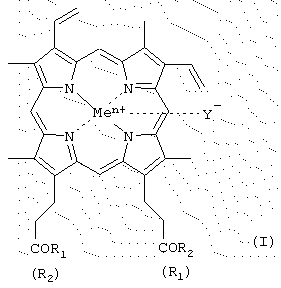
где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно, что R1=R2 или R1≠R2=OH; карбоксильная группа порфирина может быть модифицирована метиловым или другим C2-C8 эфиром или физиологически приемлемой солью;
Y- представляет собой Сl-, СН3СОО-;
Me представляет собой Fe;
за исключением соединений, где
Me=Fe3+, Y-=Сl-,
R1=-LeuLeuValPheOMe, R2=-OH; R1=-ValPheOMe, R2=-OH; R1=-LeuHisOMe;
R2=-OH; R1=-LeuHisAlaOMe, R2=OH; R1=-LeuHisNHC10H20COOMe, R2=-OH;
R1=-LeuHisNHC10H20COOH, R2=-OH; R1=-LeuHisNHC10H20COOMe;
R2=-LeuHisNHC10H20COOMe; R1=-Lys(Tfa)AlaAlaOMe, R2=-OH;
R1=-ValPheOMe, R2=-LeuHisOMe; R1=-LeuLeuValPheOMe, R2=-LeuHisOMe;
R1=-LeuLys(Tfa)LeuOMe, R2=-OH; R1=-LeuLys(Tfa)LeuOMe, R2=-LeuHisOMe;
R1=-Lys(Tfa)AlaAlaOMe, R2=-AlaHisLys(Cbz)LeuOMe; R1=-GlyOBzl;
R2=-GlyOBzl; R1=-HisOMe, R2=-HisOMe; R1=-LeuHisOMe, R2=-LeuHisOMe;
R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-LeuHisLeuGlyCys(Bzl)OBzl;
R1=-LeuHisOMe, R2=-OEt; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OEt; R1=-Obzl;
R2=-OBzl; R1=-OBzl, R2=-OH; R1=-AlaOMe, R2=-OBzl; R1=-HisOMe, R2=-Obzl;
R1=-LeuHisOMe, R2=-OBzl; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OBzl;
R1=-LeuHisAlaLys(Cbz)GlyCys(Bzl)OBzl, R2=-OBzl; R1=-LeuHisLys(Cbz)Ome;
R2=-OH; R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OH; R1=-LeuHisOMe, R2=-Ome;
R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)Ome;
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)Obzl;
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisAlaLys(Cbz)Cys(Bzl)Obzl;
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-GlyProArgGlyGlyOMe, R2=-OH;
R1=-ArgProProGlyPheSer(Bzl)PheArgGlyGlyOMe, R2=-OH.
где R1=-ValPheOMe, R2=-ValPheOMe (VI);
R1=-LeuValPheOMe, R2=-OH (VII);
R1=-LeuLeuValPheOMe, R2=-LeuLeuValPheOMe (IX);
R1=-GlyProArgOMe, R2=-OH (X);
R1=-ArgOMe, R2=-OH (XI);
R1=-ArgOMe, R2=-ArgОМе (XII);
R1=-LeuValPheOH, R2=-OH (XIII);
R1=-ValSerGlnAsnLeuOH, R2=-OH (XIV);
R1=-ArgArgTrpHisArgLeuLysGlu(OMe)OH, R2=-OH (XV);
R1=-лизиновый кор, R2=-OH (XVI);
R1=-GluAspLeuOH, R2=-OH (XVII);
Y-=Cl-; Me=Fe3+.
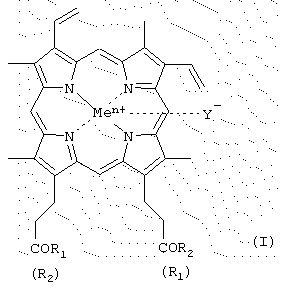
где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно что R1=R2 или R1≠R2, R1≠R2=OH; карбоксильная группа порфирина может быть модифицирована метиловым или другим C2-C8 эфиром или физиологически приемлемой солью;
Y- представляет собой Сl-, СН3СОО-;
Me представляет собой Fe,
твердофазным методом, заключающимся в том, что N-защищенную стартовую аминокислоту присоединяют к полимеру с хлортритилхлоридной якорной группой для твердофазного синтеза пептидов, деблокирование и присоединение по N-концу аминокислот, защищенных по боковым функциональным группам защитами тритильного типа, повторяют до достижения пептидилполимером необходимой длины, затем полученный продукт деблокируют и вводят во взаимодействие с активированным производным протогемина IX в ДМФА, геминпептид одновременно деблокируют и отщепляют от полимера в мягких кислых условиях и вводят противоион Сl- или СН3СОО-.
где R1=-LeuValPheOH, R2=-OH (XIII);
R1=-ValSerGlnAsnLeuOH, R2=-OH (XIV);
R1=-ArgArgTrpHisArgLeuLysGlu(OMe)OH, R2=-OH (XV);
R1=-лизиновый кор, R2=-OH (XVI);
Y-=Cl-;
Me=Fe3+,
а активированное производное протогемина IX представляет собой N-оксисукцинимидный эфир.
где R1=R2 или R1≠R2, R1≠R2=OH,
в том числе
R1=-ValPheOMe, R2=-OH (V);
R1=-ValPheOMe, R2=-ValPheOMe (VI);
R1=-LeuValPheOMe, R2=-OH (VII);
R1=-LeuLeuValPheOMe, R2=-OH (VIII);
R1=-LeuLeuValPheOMe, R2=-LeuLeuValPheOMe (IX);
Y-=Сl-, СН3СОО-; Me=Fe3+,
отличающийся тем, что конденсацию производного гемина проводят с пептидом требуемой длины, получаемым методом смешанных ангидридов с использованием алкилхлорформиата в присутствии N-метилморфолина.
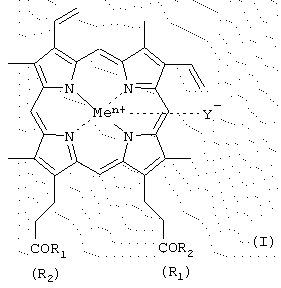
где R1 и R2 - заместители, которые могут представлять собой аминокислоты, производные аминокислот, пептиды, состоящие из 1-15 аминокислотных остатков, производные пептидов, состоящих из 1-15 аминокислотных остатков, а α -карбоксильная группа аминокислот или пептидов и боковые группы аминокислот или пептидов могут быть модифицированы, причем возможно, что R1=R2, или R1≠R2=OH, или R1=R2=OH; карбоксильная группа порфирина может быть модифицирована метиловым или другим C2-C8 эфиром или физиологически приемлемой солью;
Y- представляет собой Сl-, СН3СОО-;
Me представляет собой Fe,
в эффективном количестве и в фармацевтически приемлемом носителе, в том числе в липосомальной форме, а также в виде фармацевтически приемлемой соли.
где R1=R2, или R1≠R2=OH, или R1=R2=OH;
Y- представляет собой Сl-;
Me представляет собой Fe3+;
а также R1=-LeuLeuValPheOMe, R2=-OH; R1=-ValPheOMe, R2=-OH; R1=-LeuHisOMe,
R2=-OH; R1=-LeuHisAlaOMe, R2=-OH; R1=-LeuHisNHC10H20COOMe, R2=-OH;
R1=-LeuHisNHC10H20COOH, R2=-OH; R1=-LeuHisNHC10H20COOMe,
R2=-LeuHisNHC10H20COOMe; R1=-Lys(Tfa)AlaAlaOMe, R2=-OH;
R1=-ValPheOMe, R2=-LeuHisOMe; R1=-LeuLeuValPheOMe, R2=-LeuHisOMe,
R1=-LeuLys(Tfa)LeuOMe, R2=-OH; R1=-LeuLys(Tfa)LeuOMe, R2=-LeuHisOMe,
R1=-Lys(Tfa)AlaAlaOMe, R2=-AlaHisLys(Cbz)LeuOMe; R1=-GlyOBzl,
R2=-GlyOBzl; R1=-HisOMe, R2=-HisOMe; R1=-LeuHisOMe, R2=-LeuHisOMe;
R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-LeuHisLeuGlyCys(Bzl)OBzl;
R1=-LeuHisOMe, R2=-OEt; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OEt; R1=-OBzl,
R2=-OBzl; R1=-OBzl, R2=-OH; R1=-AlaOMe, R2=-OBzl; R1=-HisOMe, R2=-OBzl,
R1=-LeuHisOMe, R2=-OBzl; R1=-LeuHisLeuGlyCys(Bzl)OBzl, R2=-OBzl;
R1=-LeuHisAlaLys(Cbz)GlyCys(Bzl)OBzl, R2=-OBzl; R1=-LeuHisLys(Cbz)OMe,
R2=-OH; R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OH; R1=-LeuHisOMe, R2=-OMe,
R1=-LeuHis(Bzl)Lys(Cbz)OMe, R2=-OMe; R1=-AlaLeuAlaPheAlaCys(Bzl)OMe,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1 =-AlaLeuAlaPheAlaCys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-LeuHisAlaLys(Cbz)Cys(Bzl)OBzl,
R2=-LeuHis(Bzl)Lys(Cbz)OMe; R1=-GlyProArgGlyGlyOMe, R2=-OH;
R1=-ArgProProGlyPheSer(Bzl)PheArgGlyGlyOMe, R2=-OH,
или их фармацевтически приемлемых солей в качестве ингибиторов протеолитических ферментов: протеиназы ВИЧ, пепсина, трипсина химотрипсина.
| АСКАРОВ К.А., БЕРЕЗИН Б.Д | |||
| и др | |||
| Порфирины: структура, свойства, синтез | |||
| - М.: Наука, 1985, с | |||
| Телефонная трансляция с катодными лампами | 1922 |
|
SU333A1 |
| УШАКОВА И.П., ВАСИЛЕНКО И.А | |||
| и др | |||
| Биоорганическая химия, 1979, т | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для выдачи складных бумажных стаканов и т.п. предметов | 1924 |
|
SU1550A1 |
| ЖЕЛТУХИНА Г.А., СИДОРОВА М.В | |||
| и др | |||
| Журнал органической химии, 1978, №5, с | |||
| Вращающийся искровой разрядник с неодинаковым числом подвижных и неподвижных зубцов | 1924 |
|
SU1171A1 |
| РАДЮХИН В.А, ЕВСТИГНЕЕВА Р.П | |||
| и др | |||
| Журнал общей химии, 1980, т | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Фибровый челнок | 1924 |
|
SU673A1 |
Авторы
Даты
2004-10-27—Публикация
2002-04-25—Подача