ТЕХНИЧЕСКАЯ ЧАСТЬ
В изобретении рассматривается производство рекомбинантных пептидов и белков в эукариотических клетках и организмах, отличных от высших растений, в качестве хозяйских систем. Более подробно, пептиды и белки слиты с белковыми последовательностями, опосредующими индукцию формирования отложений рекомбинантного белка, которые подобны белковым тельцам (ОРБПБТ), стабильно экспрессируются и накапливаются в этих хозяйских системах после трансформации соответствующим вектором.
УРОВЕНЬ ТЕХНИКИ
Производство рекомбинантных белков для применения в терапевтических целях, в качестве пищевых добавок или для промышленного применения ознаменовалось ошеломительным успехом за последнее десятилетие. Было показано, что различные эукариотические клетки и организмы могут продуцировать эффективные лекарственные средства на основе белков. К сожалению, высокие цены, часто выводимые из низких уровней продукции рекомбинантного белка и/или из процедур выделения и очистки белка, могут сводить на нет их промышленное применение. Проведено активное исследование, чтобы улучшить и уровень продукции, и процедуры очистки посредством различных подходов.
Чтобы увеличить стабильность и накопление рекомбинантных белков в высших растениях, была разработана новая технология, основанная на слиянии домена запасного белка семян растений с представляющим интерес белком (WO 2000/003207). Эти запасные белки специфичны для семян растений, где они стабильно накапливаются в белковых тельцах (Galili et al., 1993, Trends Cell Biol 3:437-442).
Запасные белки встроены в люмен эндоплазматического ретикулума (ЭР) посредством сигнального пептида и собираются либо в эндоплазматическом ретикулуме, образуя специфические органеллы, называемые ЕР-производными белковыми тельцами (ЕР-БТ), либо в белковых запасающих вакуолях (БЗВ) (Okita and Rogers 1996 Annu. Rev. Plant Physiol Mol. Biol. 47:327-50; Herman and Larkins 1999 Plant Cell 11:601-613; Sanderfoot and Raikel 1999 Plant Cell 11:629-642). Также было описано, что рекомбинантные запасные белки собираются в БТ-подобных органеллах в нерастительных хозяйских системах, таких как ооциты Xenopus и дрожжи.
Экспрессия злаковых проламинов (наиболее распространенных злаковых запасных белков) была описана в ооцитах Xenopus после инъекции соответствующих мРНК. Эту систему использовали в качестве модели для изучения особенностей таргетинга этих запасных белков (Simon et al., 1990, Plant Cell 2:941-950; Altschuler et al., 1993, Plant Cell 5:443-450; Torrent et al., 1994, Planta 192:512-518) и для проверки возможности модификации 19 кДа α-зеина, проламина кукурузы, посредством введения необходимых аминокислот (лизина и триптофана) в его последовательность, без изменения его стабильности (Wallace et al., 1988, Science 240:662-664).
Зеины, коплексная группа проламинов кукурузы, также были продуцированы в дрожжах с различными целями. Coraggio и др., 1988, Eur J Cell Biol 47:165-172, экспрессировали нативный и модифицированный α-зеины в дрожжах, чтобы изучить детерминанты таргетинга этого белка. Kim и др., 2002, Plant Cell 14:655-672, изучали возможные взаимодействия α-, β-, γ- и δ-зеина, которые приводят к формированию белковых телец. Для этого они трансформировали дрожжевые клетки кДНК, кодирующей эти белки. Кроме того, упомянутые авторы сконструировали слитые белки зеин-GFP для определения субклеточной локализации зеиновых белков в дрожжевых клетках. Затем дрожжевые клетки были использованы в качестве модельной экспрессионной системы для изучения свойств зеина. Следует отметить, что Kim и др., 2002, Plant Cell 14:655-672, пришли к заключению, что дрожжи - неподходящая модель для изучения взаимодействия зеина, так как зеины как таковые плохо накапливались в трансформированных дрожжах. Дрожжевые клетки были использованы также в качестве модели для изучения механизмов, которые контролируют транспорт и отложение белковых телец запасных белков пшеницы, называемых глиадинами (Rosenberg et al., 1993, Plant Physiol 102:61-69).
Здесь авторы изобретения показали, что слиянием белковой последовательности, опосредующей индукцию отложений рекомбинантного белка, которые подобны белковым тельцам (ОРБПБТ), например, проламинам или проламиновым доменам, с пептидом или представляющим интерес белком (мишень), опосредовано накопление тех ОРБПБТ в клетках организмов, таких как грибы (включая дрожжи), водоросли и животные. Интересно, что эти слитые белки стабильно накапливаются в животных клетках внутри органелл, подобных белковым тельцам.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с системой и способом продуцирования слитого белка, содержащего последовательность, индуцирующую белковые тельца (ПИБТ), и представляющий интерес пептид или белок (часто называемый здесь полипептидом), в эукариотических клетках, отличных от клеток высших растений, таких как клетки животных, грибов и водорослей, а также в культивируемых клетках животных, грибов и водорослей, в которых слитые белки, содержащие пептид или представляющий интерес белок, стабильно накапливаются в качестве подобных белковым тельцам отложений рекомбинантного белка (ОРБПБТ). ПИБТ способны опосредовать индукцию образования ОРБПБТ и вход и/или накопление белка в этих органеллах, как, например, последовательностей природных и модифицированных запасных белков с пептидом или представляющим интерес белком (мишени).
Настоящее изобретение, помимо прочего, связано со способом продуцирования представляющего интерес продукта в виде слитого белка в эукариотических клетках, отличных от клеток высших растений, в качестве хозяйских систем, которые трансформировали последовательностью нуклеиновой кислоты, содержащей часть нуклеиновой кислоты, кодирующей ПИБТ, и часть нуклеиновой кислоты, кодирующей представляющий интерес полипептидный продукт.
В определенном воплощении последовательность нуклеиновой кислоты, используемой для трансформации, содержит последовательность нуклеиновой кислоты, кодирующую ПИБТ (i), и последовательность нуклеиновой кислоты (ii), содержащую нуклеотидную последовательность, кодирующую представляющий интерес продукт. В одном воплощении 3'-конец последовательности нуклеиновой кислоты (i) связан с 5'-концом вышеупомянутой последовательности нуклеиновой кислоты (ii). В другом воплощении 5'-конец последовательности нуклеиновой кислоты (i) связан с 3'-концом последовательности нуклеиновой кислоты (ii). Таким образом, последовательность ПИБТ может быть на N-конце или C-конце слитого белка.
В другом конкретном воплощении последовательность нуклеиновой кислоты, использованной для трансформации, содержит, в дополнение к ранее упомянутым последовательностям нуклеиновой кислоты (i) и (ii), последовательность нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность спейсера. Аминокислотная последовательность спейсера может быть аминокислотной последовательностью, расщепляемой или нерасщепляемой ферментативным или химическим способом. В определенном воплощении последовательность нуклеиновой кислоты (iii) расположена между последовательностями нуклеиновой кислоты (i) и (ii), например, 3'-конец последовательности нуклеиновой кислоты (iii) связан с 5'-концом вышеупомянутой последовательности нуклеиновой кислоты (ii). В другом воплощении 5'-конец вышеупомянутой последовательности нуклеиновой кислоты (iii) связан с 3'-концом последовательности нуклеиновой кислоты (ii).
В другом конкретном воплощении последовательность нуклеиновой кислоты, используемая с целью трансформации, кодирует специфически расщепляемую последовательность и соответствует таковой, описанной в международной патентной заявке WO 2004003207, которая переуступлена совместно с настоящей заявкой. Кроме того, в другом воплощении, нуклеиновая кислота соответствует таковой, описанной в международной патентной заявке WO 2004003207, где отсутствует последовательность нуклеиновой кислоты, кодирующей аминокислотную последовательность, которая специфически расщепляется ферментативным или химическим способом. В последующем воплощении слитые белки могут быть результатом прямого слияния ПИБТ с представляющим интерес пептидом или белком.
В последующем воплощении способ согласно изобретению дополнительно включает в себя выделение и очистку слитого белка.
В еще одном воплощении представляющий интерес белок слит с природным или модифицированным запасным белком, таким, например, как природные или модифицированные проламины или проламиновые домены. Примеры представляющих интерес белков включают в себя любой белок, имеющий терапевтическое применение, применение в качестве пищевых добавок, для осуществления биологического контроля или для промышленного применения.
Иллюстративные белки и пептиды включают в себя, например, гормон, такой как кальцитонин, гормон роста и пр.; антитела, такие как моноклональные антитела и их фрагменты, антигены, пригодные для [получения] вакцин против вируса иммунодефицита человека (ВИЧ); поверхностные или ядерные белки вируса гепатита В, [вызывающего] гастроэнтерит коронавируса и им подобные, ингибиторы протеаз, антибиотики, коллаген, человеческий лактоферрин, цитокины, промышленные ферменты, такие как гидролазы, гликозидазы, оксидоредуктазы и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Чертежи как часть настоящего описания, включают в себя
Фиг.1 - фотография SDS/PAGE-анализа, показывающая накопление слитых белков, включая кальцитонин (Ct), человеческий гормон роста (hGH) и эпидермальный фактор роста (EGF) как отдельных представляющих интерес белков, связанных с последовательностью RX3, производной гамма-зеина, индуцирующей белковые тельца, в трансфицированных клетках млекопитающих. Показаны слитые белки RX3-Ct, RX3-hGH и RX3-EGF, накопленные в трансфицированных культивируемых клетках млекопитающих 293T, CHO и Cos1. Эквивалентные количества трансфицированных клеток млекопитающих извлекали через 44 часа после трансфекции, и соответствующий суммарный растворимый белок исследовали посредством электрофореза и вестерн-блота, с применением анти-гамма-зеиновых антител. Схематические изображения конструкций, кодирующих слитые белки RX3-Ct, RX3-hGH и RX3-EGF, также включены: "с" = клетки; "RX3" = N-концевая, богатая пролином последовательность гамма-зеина без сигнального пептида; "m" = среда. Маркеры молекулярного веса (в кДа) отображены слева.
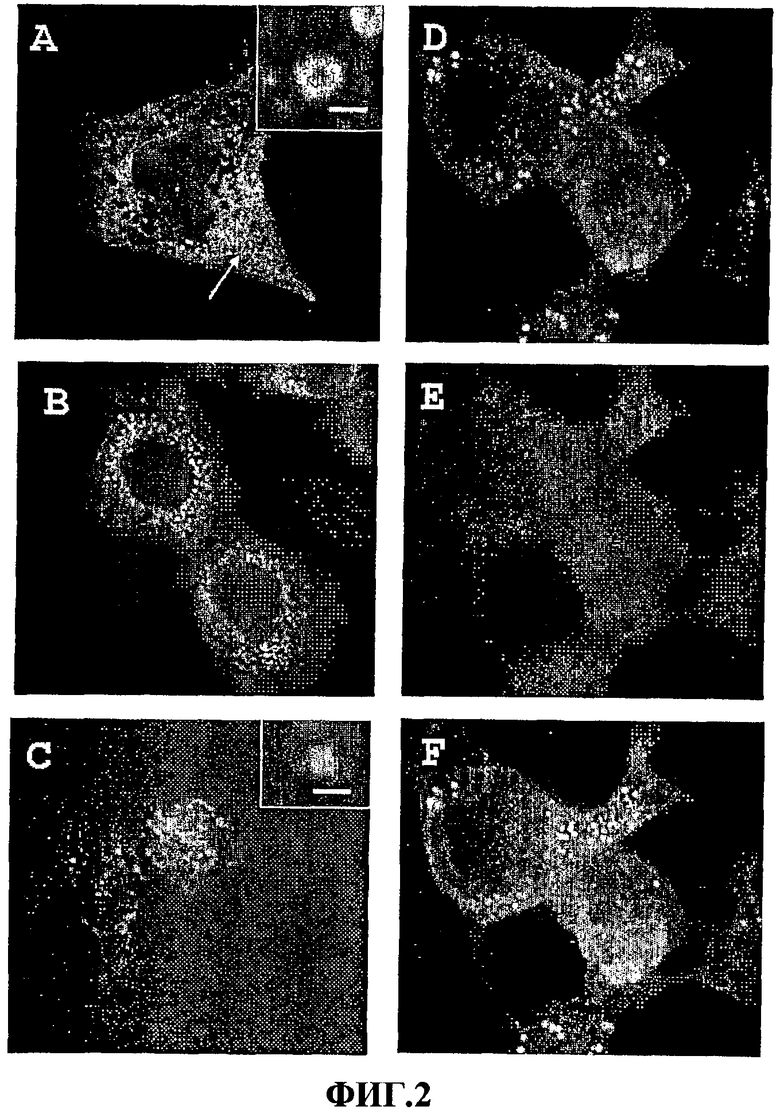
Фиг.2 - фотография в 6 фотоснимках (A-F), показывающая локализацию слитых белков в ОРБПБТ в трансфицированных клетках. Конфокальную микроскопию применяли, чтобы показать клетки Cos1, экспрессирующие RX3-CT (Фиг.2А), клетки СНО, экспрессирующие RX3-Ct (Фиг.2В) и RX3-EGF (Фиг.2С), и клетки 293Т, совместно экспрессирующие RX3-Ct и маркерный белок DsRed2-ER (Фиг.2D, Фиг.2E и Фиг.2F). RX3-производные слитые белки были иммунолокализованы, с применением анти-гамма-зеиновой сыворотки, в структурах, подобных белковым тельцам (Фиг.2A-2D), и в эндоплазматическом ретикулуме (см. стрелку на Фиг.2А). На Фиг.2Е показан ЭР, окрашенный красным флуоресцирующим белком-маркером DsRed2-ER. На Фиг.2F показано наложение Фиг.2D и Фиг.2E, демонстрирующее совместную локализацию RX3-Ct с DsRed2 в ЭР и в ПИБТ. Вкладки на Фиг.2А и 2С соответствуют большему увеличению изображений ПИБТ. Полосы: 1 микрон.
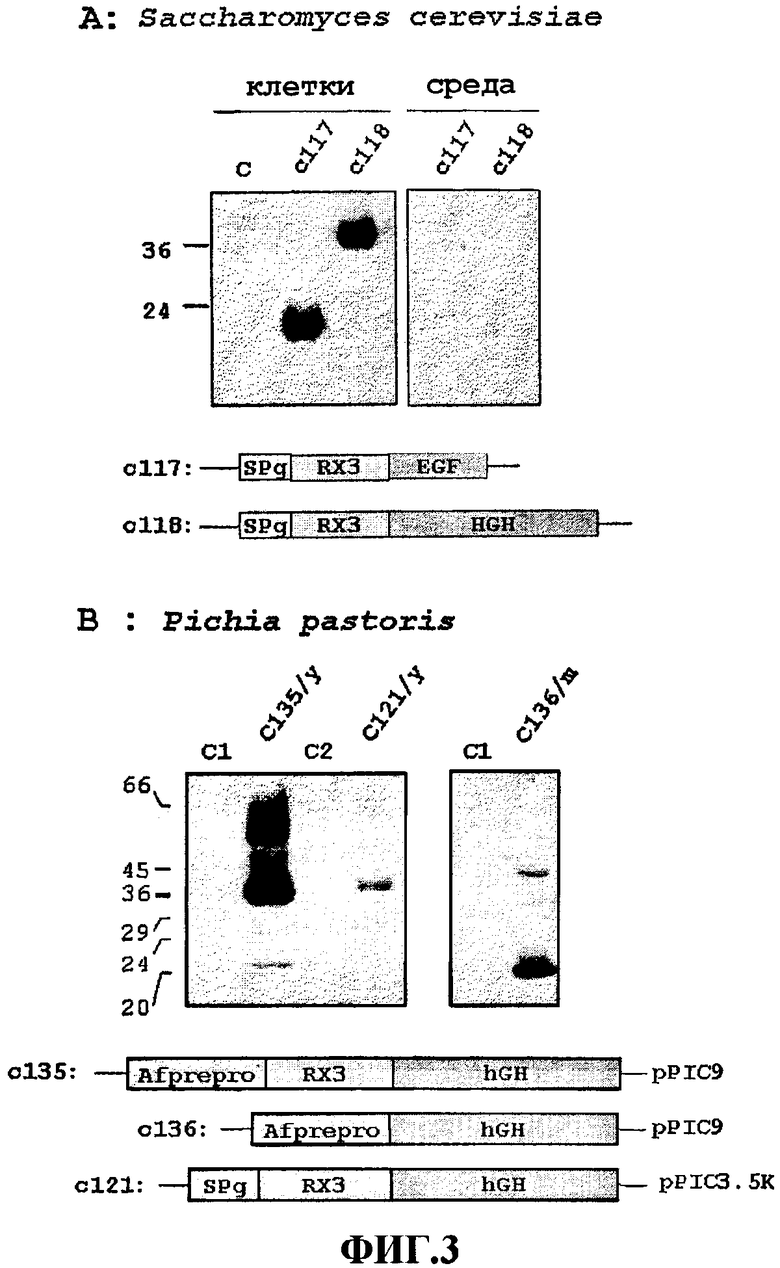
На Фиг.3 на двух фотоснимках (А и В) показано накопление слитых белков в трансформированных дрожжевых клетках. На Фиг.3А показано накопление слитых белков RX3-EGF (дорожка с117) и RX3-hGH (дорожка с118) в трансформированных Saccharomyces. Эквивалентные количества суммарных белковых экстрактов из клеток и среды исследовали посредством иммуноблотинга с применением специфических антител. Клетки, трансформированные плазмидой pYX243 без вставки, использовали в качестве контроля (С). Нижняя часть каждого фотоснимка содержит схематическую картину конструкций, кодирующих слитые белки RX3-hGH и RX3-EGF.
На Фиг.3В показано накопление hGH и RX3-hGH, содержащих слитые белки, в Pichia pastoris, с применением двух различных сигнальных пептидов. Эквивалентные количества суммарных белковых экстрактов из трансформированных клеток и среды исследовали посредством иммуноблотинга с применением специфических антител. С1 и С2 соответствуют клеткам, трансформированным соответственно плазмидами pPIC9 и pPIC3.5К, использованными в качестве контролей. Схематические изображения конструкций с135 и с121, кодирующих слитый белок RX3-hGH, и конструкции с136, кодирующей hGH, показаны внизу фотоснимков. Маркеры молекулярного веса (в кДа) показаны слева от изображений. "y" = дрожжевые клетки; "m" = среда; "SPg" = сигнальный пептид гамма-зеина; "RX3" = N-концевая богатая пролином последовательность гамма-зеина без сигнального пептида; "EGF" = эпидермальный фактор роста; "hGH" = человеческий гормон роста; "Afprepro" = препропептид альфа-фактора.
Настоящее изобретение имеет несколько преимуществ и достоинств.
Одно из преимуществ заключается в том, что его использование дает возможность относительно простой и быстрой экспрессии желательного рекомбинантного белка в предпочтительных эукариотических клетках, которые не являются клетками высших растений.
Достоинство изобретения состоит в том, что оно предоставляет источник легкодоступного и быстро очищаемого рекомбинантного белка вследствие экспрессии в ОРБПБТ.
Кроме того, дополнительные преимущества и достоинства станут очевидны квалифицированному сотруднику из последующего обсуждения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Рассматриваемые рекомбинантные белки - это слитые белки, которые образуют отложения рекомбинантного белка, подобные белковым тельцам (ОРБПБТ) в хозяйских клетках, в которых они экспрессируются. Формирование ОРБПБТ индуцируется доменами запасных белков, которые образуют высокоплотные включения внутри клеток. Эти плотные включения могут накапливаться в цитозоле, в эндомембранных системных органеллах, митохондриях, пластидах или могут быть секретируемыми. Отложения рекомбинантного белка, которые подобны белковым тельцам, имеют предопределенную плотность, которая может различаться у различных слитых белков, но известна для каждого из получаемых слитых белков. Указанная предопределенная плотность ОРБПБТ обычно больше, чем плотность в основном всех эндогенных белков хозяйской клетки, присутствующих в гомогенате, и обычно составляет от 1,1 до 1,35 г/мл. Высокая плотность новых ОРБПБТ имеет место вследствие общей способности рекомбинантных слитых белков собираться в виде мультимеров и накапливаться. Рассматриваемые ОРБПБТ экспрессируются в эукариотах, не высших растениях, и обычно характеризуются их плотностью, как описано выше. ОРБПБТ обычно сферические по форме, имеют диаметр около 1 микрона (мк) и имеют окружающую мембрану, в тех случаях, когда экспрессируются в животных клетках.
Эти слитые белки содержат две полипептидные последовательности, связанные друг с другом напрямую или опосредованно через пептидную связь, из которых одна - последовательность, индуцирующая белковые тельца (ПИБТ), связанная с полипептидным продуктом (например, пептидом или белком), представляющим интерес (мишень). ПИБТ - белковые или пептидные аминокислотные последовательности, которые опосредуют индукцию структур ОРБПБТ и вход и/или накопление белка в органеллах. Предпочтительно, чтобы ПИБТ и хозяйская клетка относились к разным биологическим типам. Поэтому ПИБТ обычно из высших растений, сперматофитов, тогда как хозяйская клетка - эукариотическая, то есть отлична от сперматофита и может быть животной клеткой, как, например, клетки млекопитающих или насекомых, грибов/дрожжей, или клеткой водорослей, все из которых относятся к иным типам, чем сперматофиты. Неограниченные иллюстративные примеры ПИБТ включают запасные белки или модифицированные запасные белки, как, например, проламины или модифицированные проламины, проламиновые домены или домены модифицированных проламинов. Проламины рассмотрены Shewry и др., 2002 J. Exp. Bot. 53(370):947-958. Предпочтительные ПИБТ - из проламиновых компаундов, такие как гамма-зеин, альфа-зеин или проламин риса, и описаны ниже.
Гамма-зеин, запасной белок кукурузы, чьи последовательности ДНК и амнокислотных остатков показаны ниже, является одним из четырех проламинов кукурузы и составляет 10-15 процентов суммарного белка в эндосперме кукурузы. Как и другие злаковые проламины, альфа- и гамма-зеины биосинтезируются в полисомах, связанных с мембранами, с цитоплазматической стороны шероховатого ЭР, связываются в люмене и затем изолируются в ЭР-производные белковые тельца (Herman et al., 1999 Plant Cell 11:601-613; Ludevid et al., 1984 Plant Mol. Biol. 3:277-234; Torrent et al., 1986 Plant Mol. Biol. 7:93-403).
Гамма-зеин состоит из четырех характерных доменов i) сигнальный пептид из 19 аминокислот, ii) повторяющийся домен, содержащий восемь блоков гексапептида PPPVHL (SEQ ID NO:1) (53 аминокислоты), iii) ProX домен, где остатки пролина чередуются с другими аминокислотами (29 аминокислот), и iv) гидрофобный С-концевой домен, богатый цистеином (111 аминокислот).
Способность гамма-зеина собираться в ЭР-производных ОРБПБТ не ограничена семенами. На самом деле, когда ген гамма-зеина конститутивно экспрессировался в трансгенных растениях Arabidopsis, запасной белок накапливался в ЭР-производных ПИБТ в клетках мезофилла листа (Geli et al., 1994 Plant Cell 6:1911-1922). В поисках сигнала, отвечающего за отложение гамма-зеина в ЭР-производных белковых тельцах (проламины не имеют KDEL-сигнала), было показано, что богатый пролином N-концевой домен, включающий в себя тандемный повторяющийся домен, был необходим для удержания в ЭР, и что С-концевой домен вовлекался в формирование белковых телец. Однако механизмы, с помощью которых эти домены способствуют образованию белковых телец, все еще неизвестны.
Поскольку белковые тельца соответственно названы только в семенах, подобные структуры, продуцируемые в других органах растений и продуцируемые не высшими растениями, относятся обычно к отложениям рекомбинантного белка, которые подобны белковым тельцам (ОРБПБТ).
Другие пригодные иллюстративные последовательности проламинового типа показаны в Таблице вместе с их GenBank-идентификаторами ниже.
Дополнительные пригодные последовательности получены путем проведения поиска через BLAST во всей неизбыточной базе данных GenBank: CDS translations+PDB+SwissProt+PIR+PRF (исключая образцы окружающей среды), как описано у Altschul и др., 1997 Nucleic Acids Res. 25:3389-3402, применяя запрос, как, например, показано ниже:
RX3 query SEQ ID NO: 2; Alpha-zein SEQ ID NO: 3 and Rice prolamin query SEQ ID NO: 4.
Иллюстративный модифицированный проламин включает (а) последовательность сигнального пептида, (b) последовательность одной или более копий повторяющегося доменного гексапептида PPPVHL белка гамма-зеина (SEQ ID NO: 1), целого домена, содержащего восемь блоков гексапептида; и (с) последовательность целого ProX-домена гамма-зеина или его части. Иллюстративные специфически модифицированные проламины включают в себя полипептиды, идентифицируемые ниже как R3, RX3 и P4, чьи последовательности ДНК и последовательности аминокислотных остатков также показаны ниже.
Особо предпочтительные проламины включают в себя гамма-зеин и его составляющие части, например, раскрытые в опубликованной заявке WO2004003207, белок риса rP13 и 22 кДа альфа-зеин кукурузы и его N-концевой фрагмент. Последовательности ДНК и аминокислотных остатков гамма-зеина (27 кДа), белков риса и альфа-зеиновых белков показаны в SEQ ID NO: 5 (последовательность ДНК) и SEQ ID NO: 6 (белковая последовательность); SEQ ID NO: 7 (последовательность ДНК RX3) и SEQ ID NO: 8 (белковая последовательность); SEQ ID NO: 9 (последовательность ДНК R3) и SEQ ID NO: 10 (белковая последовательность); SEQ ID NO: 11 (последовательность ДНК P4) и SEQ ID NO 12 (белковая последовательность); SEQ ID NO: 13 (последовательность ДНК X10) и SEQ ID NO: 14 (белковая последовательность);
rP13: (белковая последовательность SEQ ID NO: 15 и последовательность ДНК SEQ ID NO: 16) - проламин риса размером 13 кДа, гомологичный клону - AB016504 Sha et al., 1996 Biosci. Biotechnol. Biochem. 60(2):335-337; Wen et al., 1993 Plant Physiol. 101(3):1115-1116; Kawagoe et al., 2005 Plant Cell 17(4):1141-1153; Mullins et al., 2004 J. Agric. Food Chem. 52(8):2242-2246; Mitsukawa et al., 1999 Biosci. Biotechnol. Biochem. 63(11):1851-1858;
22aZt (белковая последовательность полной длины SEQ ID NO: 17 и последовательность ДНК полной длины SEQ ID NO: 18) N-концевой фрагмент альфа-зеина кукурузы размером 22 кДа - V01475 Kim et al., 2002 Plant Cell 14 (3):655-672; Woo et al., 2001 Plant Cell 13(10):2297-2317; Matsushima et al., 1997 Biochim. Biophys. Acta 1339 (1):14-22; Thompson et al., 1992 Plant Mol. Biol. 18(4):827-833.
Примеры представляющих интерес белков включают в себя любые белки, имеющие терапевтическое применение, применение в качестве пищевых добавок, для осуществления биологического контроля или промышленное применение, как, например, моноклональные антитела (такие как IgG, IgM, IgA и т.д.) и их фрагменты, антигены для вакцин (вирус иммунодефицита человека, ВИЧ; предповерхностные (pre-surface), поверхностные и ядерные антигены вируса гепатита В, [вызывающий] гастроэнтерит коронавирус и т.д.), гормоны (кальцитонин, гормон роста и т.д.), ингибиторы протеаз, антибиотики, коллаген, человеческий лактоферрин, цитокины, промышленные ферменты (гидролазы, гликозидазы, оксидоредуктазы и пр.). Предоставлены иллюстративные последовательности ДНК и аминокислотных остатков для представляющих интерес иллюстративных белков: кальцитонин лосося BAC57417 (белковая последовательность SEQ ID NO: 19 и последовательность ДНК SEQ ID NO: 20);
hEGF - конструкция, основанная на AAF85790 без сигнального пептида (белковая последовательность SEQ ID NO: 21 и последовательность ДНК SEQ ID NO: 22);
hGH - конструкция, основанная на P01241 без сигнального пептида (белковая последовательность SEQ ID NO: 23 и последовательность ДНК SEQ ID NO: 24).
В другом воплощении рекомбинантный слитый белок сверх того содержит, вдобавок к последовательностям ПИБТ и представляющего интерес белка, аминокислотную последовательность спейсера. Аминокислотная последовательность спейсера может быть аминокислотной последовательностью, расщепляемой или не расщепляемой ферментативным или химическим способом. В определенном воплощении аминокислотная последовательность спейсера помещена между ПИБТ и представляющим интерес белком. Иллюстративная аминокислотная последовательность расщепляется протеазой, такой как энтерокиназа, Arg--C-эндопротеаза, Glu--C-эндопротеаза, Lys--C-эндопротеаза, Factor Xa и пр. Альтернативно, аминокислотная последовательность кодируется таким образом, чтобы она специфически расщеплялась химическим реагентом, таким, например, как, цианбромид, который производит расщепление по метиониновым остаткам.
В последующем воплощении последовательность нуклеиновой кислоты, используемая для целей трансформации, такая, как раскрыто в патентной заявке WO 2004003207.
Более того, в другом воплощении последовательность нуклеиновой кислоты такова, как определено согласно патентной заявке WO 2004003207, но последовательность нуклеиновой кислоты, кодирующая расщепляемую аминокислотную последовательность, отсутствует.
В предпочтительном воплощении слитые белки получают согласно способу, который включает в себя систему для трансформации эукариотических хозяйских клеток, не являющихся клетками высших растений, такую как система для клеток животных, культур клеток животных, грибов/дрожжей, насекомых или водорослей, последовательностью нуклеиновой кислоты (i) (ДНК или РНК), содержащей первую нуклеиновую кислоту, кодирующую ПИБТ, которая оперативно связана в рамке считывания со второй последовательностью нуклеиновой кислоты (ii), содержащей нуклеотидную последовательность, кодирующую представляющий интерес полипептидный продукт; то есть последовательность нуклеиновой кислоты, которая кодирует ПИБТ, химически связана (пептидная связь) с последовательностью, которая кодирует представляющий интерес полипептид так, что оба полипептида экспрессируются с их собственных рамок считывания. Хозяйскую клетку поддерживают в течение времени и в условиях выращивания, подходящих для экспрессии слитого белка и накопления экспрессированного слитого белка в отложениях рекомбинантного белка, которые подобны белковым тельцам (ОРБПБТ). Образующийся при экспрессии слитый белок накапливается в трансформированной хозяйской системе в виде высокоплотных отложений рекомбинантного белка, которые подобны белковым тельцам. Затем слитый белок может быть выделен из хозяйских клеток либо хозяйские клетки, содержащие слитый белок, могут использоваться, как требуется, например для корма для животных, содержащего дополнительное питательное вещество или добавку. Слитый белок может быть выделен как часть ОРБПБТ или независимо от ОРБПБТ.
Условия выращивания, подходящие для экспрессии слитого белка, обычно отличаются для каждого типа хозяйской клетки. Впрочем, такие условия известны и легко определяются квалифицированными специалистами. Длительность поддержания также может различаться в зависимости от типа хозяйских клеток и от количества слитого белка, который предполагается получить. Опять же такие условия хорошо известны и могут быть легко определены в особых случаях. Кроме того, специфические условия культивирования могут быть получены из приведенных ссылок.
В одном воплощении 3'-конец первой последовательности нуклеиновой кислоты (i) связан (соединен) с 5'-концом второй последовательности нуклеиновой кислоты (ii). В другом воплощении 5'-конец первой последовательности нуклеиновой кислоты (i) связан (соединен) с 3'-концом второй последовательности нуклеиновой кислоты (ii). В другом воплощении ПИБТ содержит запасной белок или модифицированный запасной белок, его фрагмент или модифицированный фрагмент.
В другом конкретном воплощении слитый белок получают согласно способу, в котором используется система для трансформации хозяйских клеток, такая как система для клеток животных, культур клеток животных, грибов/дрожжей, насекомых или водорослей, последовательностью нуклеиновой кислоты, содержащей, в дополнение к ранее упомянутым последовательностям нуклеиновой кислоты (i) и (ii), последовательность нуклеиновой кислоты в рамке (iii), которая кодирует аминокислотную последовательность спейсера. Аминокислотная последовательность спейсера может быть аминокислотной последовательностью, расщепляемой или не расщепляемой ферментативным или химическим способом, как отмечено ранее. В одном конкретном воплощении последовательность нуклеиновой кислоты (iii) расположена между вышеупомянутыми последовательностями нуклеиновой кислоты (i) и (ii), например 3'-конец третьей последовательности нуклеиновой кислоты (iii) связан с 5'-концом второй последовательности нуклеиновой кислоты (ii). В другом воплощении 5'-конец третьей последовательности нуклеиновой кислоты (iii) связан с 3'-концом второй последовательности нуклеиновой кислоты (ii).
Последовательность нуклеиновой кислоты (часть), которая кодирует молекулу ранее описанного слитого белка, или коплемент этой кодирующей последовательности, также рассмотрена здесь. Такая часть нуклеиновой кислоты присутствует в изолированной и очищенной форме в некоторых предпочтительных воплощениях.
В живых организмах последовательность аминокислотных остатков белка или полипептида непосредственно связана через генетический код с последовательностью дезоксирибонуклеиновой кислоты (ДНК) гена, который кодирует белок. Поэтому, вследствие известной вырожденности генетического кода, могут быть получены, если требуется, дополнительные ДНК и соответствующие им последовательности РНК (нуклеиновые кислоты), которые кодируют те же самые последовательности аминокислотных остатков слитого белка, но значительно отличаются от ранее рассмотренной последовательности гена в такой степени, что две этих последовательности не гибридизуются в условиях жесткости, но гибридизуются в условиях умеренной жесткости.
Условия высокой жесткости могут быть определены как составная гибридизация при температуре около 50°-55°С в 6ХSSC и заключительной отмывке при температуре 68°С в 1-3XSSC. Условия умеренной жесткости включают в себя гибридизацию при температуре от 50°С до 65°С в 0,2-0,3 М NaCl, с последующей отмывкой при температуре от 50°С до 55°С в 0,2X SSC, 0,1% SDS (додецилсульфат натрия).
Нуклеотидная последовательность (последовательность ДНК или последовательность РНК), которая (1) сама кодирует (или комплементарная ей последовательность кодирует) слитый белок, содержащий последовательность, индуцирующую белковые тельца (ПИБТ), и представляющий интерес полипептид также рассмотрена здесь. Как известно, последовательность нуклеиновой кислоты, такая как рассмотренная последовательность нуклеиновой кислоты, экспрессируется, когда она оперативно связана с соответствующим промотором в соответствующей экспрессионной системе, как обсуждалось здесь.
Для различных хозяев часто предпочтителен определенный кодон для кодирования определенного аминокислотного остатка. Такие предпочтения в отношении кодонов общеизвестны, и ДНК-последовательность, кодирующая последовательность желаемого слитого белка, может быть изменена с использованием in vitro мутагенеза, например, таким образом, что для каждой хозяйской системы, в которой должен экспрессироваться слитый белок, будут использованы предпочтительные для этой хозяйской системы кодоны.
Также в этом изобретении рассматривается рекомбинантная молекула нуклеиновой кислоты, например молекула ДНК, составляющая вектор, содержащий одну или более регуляторных последовательностей (контрольные элементы), например промотор, подходящий для управления экспрессией гена в совместимой хозяйской клетке эукариотического организма, оперативно связанный с экзогенным участком нуклеиновой кислоты (например, с участком ДНК или последовательностью ДНК), который, как обсуждалось выше, определяет ген, кодирующий рассмотренный слитый белок. Более конкретно, рассмотрена рекомбинантная молекула ДНК, содержащая вектор, содержащий промотор для управления экспрессией слитого белка в клетках хозяйского организма, оперативно связанный с сегментом ДНК, который определяет ген, кодирующий последовательность, индуцирующую белковые тельца (ПИБТ), связанную с представляющим интерес пептидом. Эта рекомбинантная молекула ДНК, при соответствующей трансфекции и экспрессии в хозяйской эукариотической клетке, обеспечивает образование рассматриваемого слитого белка, такого как ОРБПБТ.
Как известно в данной области, при условии, если присутствует требуемая нуклеиновая кислота, например последовательность ДНК (включая старт- и стоп-сигналы), дополнительные пары оснований обычно могут присутствовать с любого конца сегмента ДНК и этот сегмент может по-прежнему быть использован для экспрессии белка. Это, конечно, предполагает отсутствие в этом сегменте оперативно связанной последовательности ДНК, которая тормозит экспрессию, [с которой] экспрессируется последующий продукт, который расходует слитый белок, желательный для экспрессии, экспрессируется продукт, который расходует желаемый продукт реакции, продуцируемый тем желаемым слитым белком, или, иначе, мешает экспрессии гена данного сегмента ДНК.
Таким образом, поскольку сегмент ДНК свободен от таких "мешающих" последовательностей ДНК, ДНК-сегмент согласно изобретению может составлять от 500 до 15000 пар оснований в длину. Максимальный размер рекомбинантной молекулы ДНК, особенно экспрессионного вектора, определяется главным образом удобством и размером вектора, который может включить хозяйская клетка, тогда как все минимальные последовательности ДНК, требующиеся для репликации и экспрессии, когда необходимо, присутствуют. Минимальные размеры вектора общеизвестны. Такие длинные сегменты ДНК не предпочтительны, но они могут быть использованы.
Участок ДНК, который кодирует ранее описанный слитый белок, может быть синтезирован химическими способами, например, фосфотриэфирным методом, описанным Matteucci и др. (1981) J. Am. Chem. Soc., 103:3185. Несомненно, посредством химического синтеза можно произвести любые желаемые модификации кодирующей последовательности просто путем замены соответствующих оснований на те основания, которые кодируют нативную последовательность аминокислотных остатков. Однако сегменты ДНК, включающие в себя рассмотренные в настоящей заявке последовательности, являются предпочтительными.
Участки ДНК, содержащие ген, кодирующий слитый белок, предпочтительно получены из молекул рекомбинантной ДНК (плазмидных векторов), содержащих этот ген. Вектор, который управляет экспрессией гена слитого белка в хозяйской клетке, описан здесь как "экспрессионный вектор".
Экспрессионный вектор содержит элементы контроля экспрессии, включая промотор. Ген, кодирующий слитый белок, оперативно связан с экспрессионным вектором, чтобы позволить последовательности промотора управлять связыванием РНК-полимеразы и экспрессей гена, кодирующего слитый белок. Для экспрессии гена, кодирующего полипептид, пригодны промоторы, которые являются индуцибельными, вирусными, синтетическими, конститутивными, как описано Poszkowski и др. (1989) EMBO J., 3:2719 and Odell et al. (1985) Nature, 313:810, так же как и регулируемыми во времени, регулируемыми в пространстве и регулируемыми в пространстве и времени, как описано у Chua и др. (1989) Science, 244:174-181.
Здесь расматриваются экспрессионные векторы, совместимые с эукариотическими клетками, такие как векторы, совместимые с дрожжевыми клетками, или векторы, совместимые с клетками млекопитающих, водорослей или насекомых и пр. Такие экспрессионные векторы могут использоваться также для создания молекул рекомбинантной ДНК, описанных в настоящем изобретении. Как известно, векторы для применения в дрожжах, как, например в S. cerivisiae или Pichia pastoris, могут быть эписомными или интегративными. Экспрессионные векторы эукариотических клеток общеизвестны в данной области и доступны из нескольких коммерческих источников. Обычно такие векторы содержат один или несколько удобных рестрикционных сайтов для введения желаемого участка ДНК и промоторные последовательности. Иногда такие векторы содержат селективный маркер, специфический для применения в эукариотических клетках. Типичные промоторы для применения в S. cerevisiae включают в себя промотор фосфоглицераткиназы (ФГК) S. cerevisiae и отличающиеся промоторы GAL10 и GAL1, тогда как ген алкогольоксидазы (AOX1) - пригодный промотор для Pichia pastoris. Иллюстративная экспрессия слитого белка в S. cerevisiae и Pichia pastoris показана ниже.
Ниже проиллюстрирована продукция слитого белка посредством экспрессии рекомбинантной ДНК в клетках млекопитающих с использованием вектора рекомбинантной ДНК, который экспрессирует ген слитого белка в хозяйских клетках яичника китайского хомячка (CHO), в хозяйских клетках обезьяны Cos1 и человеческих хозяйских клетках 293Т. Для достижения этого используются процедуры, которые общеизвестны в данной области и описаны более подробно у Sambrook и др., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratories (1989).
Система с клетками насекомых также может быть использована для экспрессии рассмотренного слитого белка. Например, в одной такой системе ядерный полиэдральный вирус Autographa californica (AcNPV) или бакуловирус применяют в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или личинки Trichoplusia. Последовательности, кодирующие слитый белок, могут быть клонированы в незначимый район вируса, такой как ген полиэдрина, и помещены под контроль полиэдринового промотора. Успешное введение последовательности слитого белка выключает ген полиэдрина и позволяет создать рекомбинантный вирус без белковой оболочки. Затем рекомбинантные вирусы можно использовать например, для инфицирования клетки S. Frugiperda или личинки Trichoplusia, в которых может быть экспрессирован слитый белок. E. Engelhard et al. (1994) Proc. Natl. Acad. Sci., USA, 91:3224-3227; и V. Luckow, Insect Cell Expression Technology, pp. 183-218, в Protein Engineering: Principles and Practice, J.L. Cleland et al. eds., Wiley-Liss, Inc, 1996). Гетерологичные гены, помещенные под контроль полиэдринового промотора ядерного полиэдрального вируса Autographa californica (AcNPV), часто экспрессируются на высоких уровнях во время последних стадий инфекции.
Рекомбинантные бакуловирусы, содержащие ген слитого белка, сконструированы с применением системы шаттл-векторов бакуловируса (Luckow et al. (1993) J. Virol., 67:4566-4579) коммерчески доступны в качестве экспрессионных систем бакуловируса Bac-To-Bac® (Life Technologies). Получают стоки рекомбинантных вирусов, и экспрессию рекомбинантного белка контролируют по стандартным протоколам (O'Reilly et al., Baculovirus Expression Vectors: A Laboratory Manual, W.H. Freeman and Company, New York, 1992; и King et al., The Baculovirus Expression System: A Laboratory Guide, Chapman & Hall, London, 1992).
Выбор экспрессионного вектора и, в конечном счете, того, с каким промотором оперативно связан ген, кодирующий слитый белок, зависит напрямую от желыемых функциональных особенностей, таких, например, как размещение и время экспрессии белка, а также от хозяйских клеток, которые подлежат трансформации. Эти общеизвестные ограничения являются неотъемлемой частью технологии конструирования рекомбинантных молекул ДНК. Однако вектор, пригодный для применения на практике настоящего изобретения, может управлять репликацией и, предпочтительно, также экспрессией (для экспрессионного вектора) гена слитого белка, заключенного в участок ДНК, с которым он оперативно связан.
Экспрессированные ОРБПБТ и их слитые белки могут быть получены из экспрессирующих хозяйских клеток обычными способами, используемыми при биохимическом и биологическом выделении белка. Так как ОРБПБТ плотнее других белков, присутствующих в хозяйских клетках, ОРБПБТ особенно удобны для отделения посредством центрифугирования клеточного гомогената. Слитые белки могут быть получены из осажденных ОРБПБТ посредством растворениия окружающей мембраны в буфере, содержащем восстановитель, такой как 2-меркаптоэтанол.
Без дальнейших уточнений предполагается, что специалист в данной области может на основании предшествующего описания и подробных примеров, приведенных ниже, использовать настоящее изобретение в его полном объеме. Следовательно, последующие предпочтительные специфические воплощения должны быть истолкованы только как иллюстративные и никоим образом не должны расцениваться как ограничивающие объем настоящего изобретения.
Пример 1: Накопление слитых белков в трансфицированных клетках млекопитающих
Синтетические гены, соответствующие последовательностям зрелого кальцитонина (Ct) и EGF, также как и кДНК, кодирующая hGH-последовательность, были слиты с последовательностью RX3, кодирующей N-концевой гамма-зеин (WO2004003207) и введены в вектор pcDNA3.1 (Invitrogen) для получения конструкции p3.1RX3Ct, p3.1RX3EGF и p3.1RX3hGH. Эти конструкции, кодирующие слитые белки RX3-Ct, RX3-EGF и RX3-hGH, вводили в культивируемые клетки млекопитающих 293T, Cos1 и CHO методом трансфекции, основанным на липофектамине (Invitrogen). Клетки 293T и Cos1, трансфицированные плазмидой pECFP-N1 (Clontech), содержащей генную последовательность усиленного голубого флуоресцирующего модифицированного GFP, использовали в качестве контролей.
Накопление слитых белков в транзитно трансфицированных клетках исследовали посредством Вестерн-блота, с использованием антител, полученных против гамма-зеина. После 44 часов трансфекции тотальные растворимые белки экстрагировали буфером А (100 мM Tris-HCl pH 8,0, 150 мM NaCl, 5 мM EDTA, 0,5% SDS, 0,5% Triton X-100, 2% 2-меркаптоэтанол и ингибиторы протеаз). Аликвоты среды инкубации клеток осаждали и хранили при -20°C. Белки, экстрагированные из эквивалентных количеств трансфицированных клеток, разделялись посредством электрофореза в SDS-полиакриламидном геле и переносили на нитроцеллюлозную мембрану.
Как может быть видно из результатов, отображенных на Фиг.1, три исследованных слитых белка RX3-Ct, RX3-EGF и RX3-hGH накапливались очень эффективно, независимо от типа культивируемых клеток, отобранных для экспрессии: сравните образец RX3-hGH, накапливавшийся в обеих линиях культивируемых клеток, 293Т и СНО, и образец RX3-EGF - в клетках СНО и Cos1. Слитые белки обнаруживались в белковых экстрактах, соответствующих трансфицированным клеткам (дорожки с), и не обнаруживалось иммунореактивной полосы в культуральной среде клеток (дорожки m). Это наблюдение говорит о том, что RX3-домен способен собирать и удерживать слитые белки в эндомембранном компартменте.
Эти результаты показывают, каким образом слитые белки, производные RX3, собираются и накапливаются в эндомембранной системе в трех типах исследованных клеток млекопитающих (человеческие клетки 293Т, клетки обезьяны Cos1 и клетки хомячка СНО), свидетельствуя о том, что эффективное накопление желаемого белка может быть достигнуто в любой клетке млекопитающих или в клетках выбранного организма через слияние с RX3-доменом.
Пример 2: Субклеточная локализация слитых белков в трансфицированных клетках млекопитающих
Как определено, поскольку N-концевая последовательность гамма-зеина RX3 могла индуцировать подобные белковым тельцам отложения рекомбинантного белка в клетках млекопитающих, локализация слитых белков RX3-Ct и RX3-EGF исследовалась иммуногистохимически с применением конфокальной микроскопии. Трансфицированные клетки фиксировали на 10 минут в 3,7% параформальдегиде и после отмывки в солевом фосфатном буфере инкубировали с гамма-зеиновой антисывороткой (разведение 1/700) в течение 1 часа. Неиммунная сыворотка использовалась в качестве контроля. Первичные антитела были детектированы с антикроличьими антителами, конъюгированными с красителями Alexa Fluor 488 или Alexa Fluor 555 (Molecular probes).
Микрофаги из трансфицированных клеток выделяли с использованием конфокального лазерного сканирующего микроскопа (Leica TCS SP, Heidelberg, Germany), снабженного спектрофотометрами для выбора диапазона длин волн. Изображения зеленой флюоресценции были получены при возбуждении аргоновым ионным лазером при длине волны 488 нм с использованием диапазона длин волн эмиссии 495-535 нм. Изображения красной флуоресценции были получены после возбуждения при 543 нм гелий-неоновым лазером и эмиссионном окне 550-600 нм. Оптические сечения были 0,5 мкм толщиной. Цифровые изображения и проекции записывали с применением компьютерных программ для конфокальной микроскопии.
На Фиг.2 показаны конфокальные проекции клеток, трансфицированных p3.1Ct и p3.1RX3EGF. Как показано на фиг.2, соответствующие слитые белки, RX3-Ct и RX3EGF, были выявлены в эндоплазматическом ретикулуме (ЭР, стрелка в Фиг.2A), указывая на то, что сигнальный пептид гамма-зеина функционирует в клетках млекопитающих, где он опосредует перемещение слитого белка в ЭР. Образцы, инкубированные с неиммунной сывороткой, использованные в качестве контроля, не показали какой-нибудь значительной флуоресценции (не показано).
Важно отметить, что неожиданно слитые белки накапливались в больших бляшках, очевидно окруженных мембраной (см. вкладку в Фиг.2А). Эти структуры, которые отсутствуют в нетрансфицированных клетках, сопоставимы по размеру с белковыми тельцами растений, имеющими диаметр около 1 микрона (вкладки А и С). Этот результат удивителен не только из-за того факта, что животные клетки могут воспроизводить БТ-органеллу хранения, описанную в растениях, но и из-за большего количества ОРБПБТ, наблюдаемых во всех трансфицированных клетках, демонстрируя, таким образом, эффективную накопительную емкость этих клеток. Более того, различные типы трансфицированных клеток продемонстрировали сходный характер локализации и накопления слитых белков (см. Фиг.2А, 2В и 2D), который проявляется независимо от того, какая мишень слита с ПИБТ (Фиг.2В и 2С).
Клетки были совместно трансфицированы плазмидой pDsRed2-ER (Clontech), содержащей последовательность флуоресцирующего белка, используемого в качестве ЭР-маркера для исследования субклеточного происхождения этих индуцированных ПИБТ. Интересно то, что как может быть видно на Фиг.2D, 2E, и 2F, оба белка, RX3-Ct и ЭР-маркер, совместно локализуются в ЭР и в БТ-подобных отложениях, указывая на ЭР-происхождение индуцированных ОРБПБТ в клетках млекопитающих, как происходит в клетках растений.
Пример 3: Накопление слитых белков в трансформированных дрожжевых клетках
Последовательности, кодирующие EGF и hGH, были слиты с последовательностью RX3, кодирующей N-концевой гамма-зеин (WO2004003207), и введены в вектор pYX243 (R&D системы), чтобы получить конструкции c117 и c118. Эти конструкции, которые кодируют слитые белки RX3-EGF и RX-hGH, вводили в Saccharomyces cerevisiae.
Экспрессионный анализ производили, выращивая трансформанты на среде, содержащей галактозу, и эквивалентные количества и клеток, и среды, исследовали посредством SDS-PAGE и иммуноблотинга с применением специфических антител против рекомбинантных экспрессированных белков. Как может быть видно из Фиг.3А, оба слитых белка, RX3-EGF (дорожки c117) и RX3-hGH (дорожки c118), накапливались в клетках дрожжей, следов белка в среде обнаружено не было.
Изучали также накопление hGH и слитых белков, производных hGH, в дрожжах Pichia pastoris, которые трансформировали конструкциями c135 и c121 (кодирующими слитый белок RX3-hGH) и c136 (кодирующей белок hGH, см. схематическое изображение на Фиг.3B). Были отобраны трансформанты, накапливающие наивысшие уровни рекомбинантных белков.
Использовали два разных сигнальных пептида для экспрессии слитого белка: сигнальный пептид гамма-зеина (Фиг.3В, SPg) и дрожжевой препропептид альфа-фактора (Фиг.3B, Afprepro). Кроме того, исследовали также контроль секреции с использованием дрожжевого препропептида альфа-фактора, оперативно слитого с hGH. Суммарные белки из клеток и среды исследовали посредством Вестерн-блота с применением специфических антител кролика против hGH.
Как ожидалось, hGH секретировался в среду (Фиг.3B, дорожка c136/m), когда использовали препропептид альфа-фактора. В противоположность этому слитый белок RX3-hGH накапливался внутри дрожжевых клеток независимо от использованного сигнального пептида. Как можно видеть из Фиг.3B, слитый белок был внутри клеток в обоих случаях: и когда использовали дрожжевой препропептид альфа-фактора (дорожка c135/y), и когда использовался сигнальный пептид гамма-зеина (дорожка c121/y); следов белка в среде обнаружено не было (не показано). Таким образом, N-концевого богатого пролином домена гамма-зеина было достаточно для того, чтобы опосредовать удержание белка в эндомембранном компартменте дрожжевых клеток, а именно в плотной фракции, соответствующей структурам, подобным БТ, которые могут быть отделены путем центрифугирования.
Результаты, полученные с Saccharomyces cerevisiae и Pichia pastoris, - это примеры других эукариотических организмов, отличающихся от царств растений и животных, где слитые белки, содержащие запасной белок семян, эффективно собираются и накапливаются в структурах, подобных БТ.
Экспериментальные примеры
Плазмидные конструкции для трансфекции клеток млекопитающих
Синтетический ген, соответствующий последовательности зрелого кальцитонина (Ct), был получен, как описано в патентной заявке WO2004003207.
Синтетический ген, кодирующий 53 аминокислоты активного hEGF, был выделен с помощью ПЦР с перекрытием праймеров, с применением 4 олигонуклеотидов размером около 60 оснований, с 20 перекрывающимися основниями. кДНК синтетического hEGF включала в себя 5'-линкерную последовательность, соответствующую специфическому сайту расщепления Factor Xa. Олигонуклеотиды (EGF1 SEQ ID NO: 25; EGF2 SEQ ID NO: 26; EGF3 SEQ ID NO: 27; EGF4 SEQ ID NO: 28) очищали посредством полиакриламидного денатурирующего геля.
Последовательность кДНК, кодирующая 191 аминокислоту человеческого гомона роста (hGH), была получена из кДНК гипофиза человека (Clontech, BDBiosciences) посредством ПЦР с использованием олигонуклеотидов GH5 (SEQ ID NO: 29) и GH3 (SEQ ID NO: 30), которые включали в себя последовательность, соответствующую сайту расщепления энтерокиназы.
Синтетические гены, соответствующие последовательностям зрелого кальцитонина (Ct, WO2004003207) и hEGF, так же как и кДНК, кодирующая hGH, были слиты с последовательностью RX3, кодирующей N-концевой гамма-зеин (патентная заявка WO2004003207) и введены в pUC18. Рестрикционные фрагменты SalI-BamHI плазмид pUC18RX3Ct, pUC18RX3EGF и pUC18RX3hGH, производных pUC18, содержащие соответствующие последовательности слитого белка RX3-Ct, RX3-EGF и RX3-hGH, были введены в вектор pcDNA3.1- (Invitrogen), рестрицированный XhoI-BamHI. В итоговых конструкциях, названных p3.1RX3CT, p3.1RX3EGF и p3.1RX3hGH, последовательности слитого белка находились под CMV-промотором и терминатором pA BGH.
Плазмидные конструкции для трансформации в дрожжи
Хозяйские штаммы и векторы:
Штамм Saccharomyces cerevisiae (генотип Mata his3 leu2 met15 ura3 bar1::URA3) трансформировали с применением конструкций, производных вектора pYX243 (GAL промотор, LEU2, AmpR, из R&D Systems). Штамм Pichia pastoris GS115 (his4) и вектор pPIC9 и pPIC3.5K (AOX1 промотор, HIS4, AmpR) были из Invitrogen life tech.
Плазмидные конструкции:
Рестрикционные фрагменты SalI (тупой конец)-BamHI из плазмид pUC18RX3EGF и pUC18RX3hGH, производных pUC18, описанных выше, содержащие соответствующие последовательности слитого белка RX3-EGF и RX3-hGH, были введены в вектор pYX243 (R&D Systems), рестрицированный EcoRI (тупой конец)-BamHI. В итоговых конструкциях, названных, соответственно, c117 и c118, последовательности слитого белка находились под индуцибельным GAL-промотором.
Рестрикционные фрагменты SalI (тупой конец)-BamHI (тупой конец) плазмид pUC18RX3EGF и pUC18RX3hGH, производных pUC18, были ввдены в вектор pPIC3.5K (Invitrogen), рестрицированный NotI (тупой конец)-EcoRI (тупой конец), для получения плазмид c120 и c121, чтобы трансформировать Pichia Pastoris.
Плазмиду pPIC9 (Invitrogen) применяли для исследования экспрессии слитого белка с использованием сигнального пептида дрожжей, препропептида альфа-фактора Saccharomyces. Последовательности, фланкированные XhoI-NotI, кодирующие белки RX3-hGH и hGH, были получены посредством ПЦР с использованием pUC18RX3hGH в качестве матрицы и олигонуклеотидов af06 (SEQ ID NO: 31), afRX (SEQ ID NO: 32) и 06Not (SEQ ID NO: 33).
Эти последовательности содержали последовательность, кодирующую сайт KEX2, необходимый для эффективного разрезания препропептида альфа-фактора (Invitrogen, Pichia expression Kit). ПЦР-продукты клонировали в pPIC9, рестрицированную XhoI-NotI, дающую плазмиды c135 и c136, содержащие соответственно белковые последовательности RX3-hGH и hGH, слитые с препропептидом альфа-фактора.
Трансформация дрожжей
Штамм Saccharomyces cerevisiae (leu2) трансформировали плазмидными конструкциями c117 и c118 посредством метода LiAc Method (Ito et al. 1983, J. Bacteriol. 153:163-168), трансформанты отбирали на Leu- чашках. Экспрессионный анализ проводили посредством выращивания трансформантов в среде, содержащей галактозу (необходимый состав).
Штамм Pichia pastoris GS115 (his4) трансформировали, используя набор Pichia EasyComp Kit (Invitrogen life tech.) с линеаризованными (с помощью SacI) плазмидами c120 и c121, и высевали на среде RDB His-. Mut-фенотипы определяли посредством пересева колоний на чашки с MD и ММ агаром. Испытания экспрессии проводили посредством выращивания трансформантов в среде YPD в течение двух дней. После этого клетки осаждали и суспендировали в ММ среде в течение следующих 48 часов, метанол добавляли каждые 24 часа до конечной концентрации 0,5%. Были отобраны трансформанты, накапливавшие самые высокие уровни рекомбинантного белка. Среды готовили, как описано Invitrogen (Pichia expression Kit).
Выделение белков дрожжей и Вестерн-блот
S. cerevisiae и P. рastoris, экспрессирующие рекомбинантные слитые белки, осаждали. Аликвоты соответствующей среды инкубации осаждали и хранили для исследования при -20°C. Осадки клеток также замораживали, и после оттаивания клетки разрушали посредством стандартных методов с использованием стеклянных бусин и среды H (50 мМ HCl-Tris pH 8,0, 150 мM NaCl, 5 мM EDTA, 200 мM DTT и ингибиторы протеаз). Эквивалентные количества и клеток, и среды исследовали посредством SDS-PAGE и иммуноблотинга с использованием специфических антител против рекомбинантных экспрессированных белков.
Каждый из цитируемых здесь патентов и статей считается включенным в настоящее описание в виде ссылки. В настоящем описании предполагается, что использование единственного и множественного числа является взимозаменяемым.
Предшествующее описание и примеры приводятся как иллюстративные и не могут быть расценены как ограничивающие объем настоящего изобретения. Кроме того, в рамках сущности и объема этого изобретения возможны вариации, которые могут быть предложены специалистами в данной области.














Изобретение относится к области биотехнологии и может быть использовано для рекомбинантной продукции белков внутри подобных белковым тельцам (ОРБПБТ) отложений рекомбинантного белка в эукариотических хозяйских клетках. Конструируют слитый белок, содержащий индуцирующую белковые тельца последовательность, гетерологичную хозяйской клетке и полученную из гамма-зеина, слитую через С-конец с N-концом последовательности представляющего интерес белка. Полученный слитый белок экспрессируют в хозяйской эукариотической клетке млекопитающих или насекомых. Изобретение позволяет получить представляющие интерес рекомбинантные белки, которые стабильно экспрессируются и накапливаются в хозяйских клетках внутри ОРБПБТ. 2 н. и 5 з.п. ф-лы, 3 ил., 1 табл.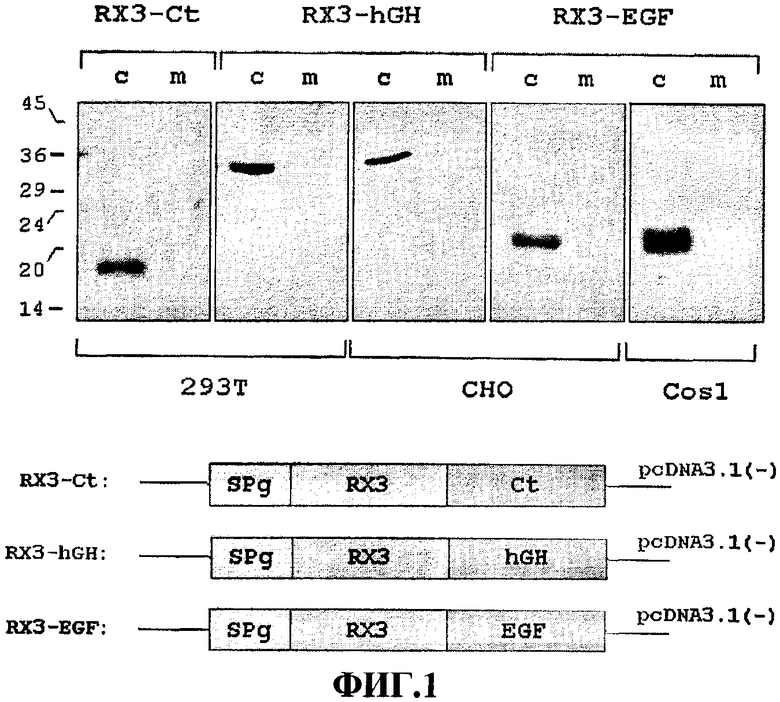
1. Хозяйская эукариотическая клетка, которая содержит рекомбинантный слитый белок внутри подобных белковым тельцам (ОРБПБТ) отложений рекомбинантного белка, где указанный слитый белок содержит две последовательности, связанные вместе, из которых одна последовательность - это индуцирующая белковые тельца последовательность, гетерологичная хозяйской клетке, и другая - последовательность представляющего интерес белка, где хозяйская эукариотическая клетка представляет собой клетку млекопитающих или насекомых, где индуцирующая белковые тельца последовательность, гетерологичная хозяйской клетке, получена из γ-зеина, и где С-конец индуцирующей белковые тельца последовательности связан с N-концом представляющего интерес белка.
2. Хозяйская клетка по п.1, где указанная плотность ОРБПБТ составляет приблизительно от 1,1 до 1,35 г/мл.
3. Хозяйская клетка по п.1, где указанный слитый белок дополнительно содержит линкерную последовательность между последовательностью, индуцирующей белковые тельца, и последовательностью представляющего интерес белка.
4. Способ получения слитого белка, который включает следующие стадии:
(а) трансформацию эукариотических хозяйских клеток последовательностью нуклеиновой кислоты, содержащей первую нуклеиновую кислоту (i), кодирующую последовательность, индуцирующую белковые тельца (ПИБТ), которая оперативно связана в рамке со второй последовательностью нуклеиновой кислоты (ii), содержащей нуклеотидную последовательность, кодирующую представляющий интерес полипептидный продукт;
(b) поддержание трансформированных хозяйских клеток в течение временного периода и в условиях культивирования, подходящих для экспрессии слитого белка и отложения экспрессируемого слитого белка в подобных белковым тельцам (ОРБПБТ) отложениях рекомбинантного белка, и
(c) извлечение экспрессированного слитого белка, где хозяйская эукариотическая клетка представляет собой клетку млекопитающих или насекомых, где индуцирующая белковые тельца последовательность получена из γ-зеина (γ-зеина (50 кДа)), и где 3′-конец последовательности первой нуклеиновой кислоты связан с 5′-концом второй последовательности нуклеиновой кислоты.
5. Способ по п.4, где указанная нуклеиновая кислота кодирует линкерную последовательность между ПИБТ и представляющим интерес полипептидным продуктом.
6. Способ по п.4, где последовательность нуклеиновой кислоты, использованной для трансформации хозяйских клеток, присутствует в экспрессионном векторе, содержащем одну или более регуляторных последовательностей.
7. Способ по п.6, где указанные одна или более регуляторных последовательностей включают в себя промотор.
| KIM C.S | |||
| et al., Zein protein interactions, rather than the asymmetric distribution of zein mRNAs on endoplasmic reticulum membranes, influence protein body formation in maize endosperm, Plant Cell, 2002, V.14, N.3, P.655-672 | |||
| RICHARD G | |||
| et al., Transport and Deposition of Cereal Prolamins, Plant Physiol., 1996, Biochem., V.34 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБЫ ТРАНСФОРМАЦИИ РАСТЕНИЙ ДЛЯ ЭКСПРЕССИИ ДЕЛЬТА-ЭНДОТОКСИНОВ BACILLUS THURINGIENSIS | 1999 |
|
RU2234531C2 |
| WO 2004003207, 08.01.2004. | |||
Авторы
Даты
2011-09-20—Публикация
2005-11-29—Подача