Настоящее изобретение относится к добавке к кормам для животных на основе ферментационного бульона, которая содержит D-пантотеновую кислоту и/или одну из ее солей, и к способам получения такой добавки.
Предпосылки создания изобретения
Пантотеновую кислоту производят во всем мире в количестве, составляющем несколько тысяч тонн в год. Большая часть производимой пантотеновой кислоты используется в животноводстве и птицеводстве при откорме животных, таких как домашняя птица и свиньи. Потребность в этом продукте постоянно растет.
Пантотеновая кислота может быть получена путем химического синтеза или биотехнологическим путем с помощью ферментации с использованием пригодных микроорганизмов в соответствующих питательных растворах. При химическом синтезе важным предшественником является DL-пантолактон. Его получают многостадийным способом из формальдегида, изобутилальдегида и цианида, на следующих стадиях способа рацемическую смесь разделяют, осуществляют конденсацию D-пантолактона с β -аланином и в результате получают D-пантотеновую кислоту.
Наиболее часто D-пантотеновая кислота поступает в продажу в форме кальциевой соли. Также находит применение кальциевая соль рацемической смеси D,L-пантотеновой кислоты.
Преимущество ферментативного получения с использованием микроорганизмов заключается в непосредственном получении требуемой стереоизомерной формы, а именно D-формы, не содержащей L-пантотеновую кислоту.
Как описано в ЕР-А 0493060, ЕР-А 0590857 и WO 97/10340, различные виды бактерий, такие как, например, Escherichia coli, Arthrobacter ureafaciens, Corynebacterium erythrogenes, Brevibacterium ammoniagenes, а также дрожжи, такие как, например, Debaromyces castellii, могут продуцировать D-пантотеновую кислоту в соответствующих условиях ферментации. Наиболее пригодными микроорганизмами являются описанные в этих публикациях производные штамма Escherichia coli IF03547, такие как, например, штаммы FV5069/pFV31 или FV5069/pFV202.
Как описано в ЕР-А 0493060, ЕР-А 0590857 и WO 97/10340, при ферментативном получении D-пантотеновой кислоты микроорганизм, обладающий способностью продуцировать D-пантотеновую кислоту, культивируют в соответствующей питательной среде, а затем образовавшуюся D-пантотеновую кислоту очищают и выделяют в виде кальциевой соли по технологии, которая является трудоемкой и дорогостоящей.
Пригодные для использования питательные среды содержат источник углерода, такой как, например, глюкоза или гидролизат картофельного крахмала, или сахароза либо меласса, соединения-предшественники, такие как, например, β -аланин, D,L-пантоиновая кислота или D,L-пантолактон, источник азота, такой как, например, сульфат аммония, источник фосфора, такой как, например, фосфат калия, и другие соли, микроэлементы и витамины, а также при необходимости комплексные добавки к среде, такие как, например, дрожжевой экстракт. Затем микроорганизмы инкубируют в этой среде, имеющей соответствующее значение рН, при соответствующей аэрации и перемешивании, при этом они вырабатывают D-пантотеновую кислоту.
Согласно известным из WO 96/33283 и ЕР-А 0590857 решениям кальциевую соль D-пантотеновой кислоты получают путем дорогостоящего выделения и очистки из ферментационного бульона, содержащего пантотеновую кислоту. После первоначального отделения биомассы с помощью фильтрации или центрифугирования осуществляют дальнейшую перебработку фильтрата путем очистки с помощью активированного угля или хроматографии на колонках. После осуществления реакции обмена полученного таким образом раствора с гидроксидом кальция можно получить путем кристаллизации требуемую кальциевую соль.
Как описано в WO 96/33283, в первой колонке фильтрат обесцвечивают с помощью активированного угля. С помощью концентрированной соляной кислоты значение рН доводят до 3,0 и затем жидкость очищают непрерывным способом, пропуская через две другие колонки, заполненные активированным углем. Элюирование D-пантотеновой кислоты осуществляют с помощью метилового спирта. После последующей нейтрализации с помощью порошкообразного Са(ОН)2 получают раствор, из которого путем кристаллизации при 5° С выделяют D-пантотенат кальция.
Согласно способу, описанному в ЕР-А 0590857, фильтрат сначала очищают с помощью катионо- и анионообменных колонок. Элюирование осуществляют с помощью соляной кислоты. Затем элюированную фракцию нейтрализуют Са(ОН)2, обрабатывают смешиванием с активированным углем и отфильтровывают. Полученный фильтрат экстрагируют низкомолекулярным спиртом (метанол, этанол, изопропанол) и путем кристаллизации получают D-пантотенат кальция.
Полученный описанным способом D-пантотенат кальция применяют в качестве добавки к кормам для животных.
Задача изобретения
Согласно уровню техники соли D-пантотеновой кислоты и D,L-пантотеновой кислоты получают взаимодействием кислот, полученных химическим синтезом или путем ферментации, с растворами соответствующих солей.
Задачей изобретения является разработка новых пригодных для использования в качестве добавок к кормам композиций, содержащих D-пантотеновую кислоту и ее соли.
Кроме того, задачей изобретения является разработка такого способа получения добавок к кормам, который был бы более экономичным и обеспечивал бы более высокую производительность, чем известные в настоящее время способы.
Описание изобретения
Объектом изобретения является добавка к кормам для животных на основе ферментационного бульона, отличающаяся тем, что она содержит
а) D-пантотеновую кислоту и/или ее соли, прежде всего соли щелочных или щелочно-земельных металлов,
б) полученную в процессе ферментации биомассу в количестве от 0 до 100% от ее образовавшегося количества и
в) по крайней мере преобладающую часть других растворимых ингредиентов ферментационного бульона и
г) представлена в твердой форме, прежде всего в тонкоизмельченной или гранулированной и сыпучей форме.
Добавки в зависимости от конкретных требований представлены либо в форме полученного распылительной сушкой или лиофилизацией тонкоизмельченного сыпучего порошка, либо в гранулированной форме, которая может содержать различные количества биомассы. Кажущаяся плотность в основном составляет приблизительно 500 кг/м3. Добавки являются стабильными при хранении.
Если отделяют биомассу, то, как очевидно, удаляют и другие вещества, например неорганические твердые вещества. Наряду с этим добавка по изобретению содержит по крайней мере преобладающую часть других растворенных в ферментационном бульоне образовавшихся или добавленных веществ, если только они не были отделены соответствующим способом.
К таким веществам могут относиться органические побочные продукты, которые наряду с D-пантотеновой кислотой продуцируются и выделяются применяемыми для ферментации микроорганизмами. К ним относятся L-аминокислоты, выбранные из группы, включающей L-метионин, L-лизин L-валин, L-треонин, L-аланин и L-триптофан, прежде всего L-валин. Кроме того, к ним относятся органические кислоты, несущие от одной до трех карбоксильных групп, такие как, например, уксусная кислота, молочная кислота, лимонная кислота, яблочная кислота или фумаровая кислота. И, наконец, к ним также относятся трудно метаболизируемые сахара, такие как, например, трегалоза. При необходимости такие соединения являются желательными, если они улучшают пищевую ценность добавки. Далее к таким веществам относятся остатки добавленного метаболизируемого сахара, такого как, например, глюкоза или сахароза.
Другим объектом изобретения является способ получения добавок к кормам, содержащих D-пантотеновую кислоту и/или ее соли, отличающийся тем, что
а) путем ферментации получают бульон, содержащий в основном натриевые, калиевые, аммонийные, магниевые или кальциевые соли получаемой D-пантотеновой кислоты,
б) из этого бульона при необходимости полностью или частично выделяют биомассу,
в) полученный таким образом раствор, соответственно бульон смешивают предпочтительно со стехиометрическим в пересчете на D-пантотеновую кислоту количеством гидроксида или оксида щелочного или щелочно-земельного металла и
г) полученную таким образом смесь сушат, сушат распылением, гранулируют напылением или гранулируют.
Еще одним объектом изобретения является способ получения добавок к кормам для животных с содержанием D-пантотеновой кислоты и/или ее натриевых, калиевых, аммонийных, магниевых или кальциевых солей в интервале от приблизительно 20 до 80 маc. % (в пересчете на сухую массу) из ферментационного бульона, отличающийся тем, что он включает следующие стадии:
а) предпочтительно удаление воды из ферментационного бульона (концентрирование),
б) при необходимости удаление от 0 до 100% образовавшейся в результате ферментации биомассы,
в) добавление одного или нескольких названных соединений к полученному на стадиях а) или б) ферментационному бульону, причем количество добавляемых соединений выбирают таким образом, чтобы их общая концентрация в добавке к кормам для животных составляла от приблизительно 20 до 80 мас.%, прежде всего от 50 до 80 мас.%, и
г) сушку полученного на стадии в) ферментационного бульона с получением добавки к кормам для животных в требуемой порошкообразной или гранулированной форме.
Для способа по изобретению пригодны ферментационные бульоны, которые получают с применением микроорганизмов, продуцирующих D-пантотеновую кислоту и которые содержат D-пантотеновую кислоту и/или ее соли.
В качестве микроорганизмов могут применяться грибы или дрожжи, такие как, например, Debaromyces castellii или грамположительные бактерии, относящиеся, например, к роду Corynebacterium, или грамотрицательные бактерии, относящиеся, например, к семейству Enterobacteriaceae. В семействе Enterobacteriaceae следует особо отметить род Escherichia и вид Escherichia coli. Внутри вида Escherichia coli следует отметить так называемые штаммы группы К-12, например, такие как штаммы MG1655 или W3110 (Neidhard и др., Escherichia coli and Salmonella. Cellular and Molecular Biology (ASM Press, Washington D.C.)) или штамм Escherichia coli дикого типа IFО3547 (Институт ферментации, Осака, Япония) и полученные из них мутанты. Среди штаммов, полученных из IFО3547, следует в свою очередь отметить штаммы FV5069/pFV31 (EP-A 0590857) и FV5069/pFV202 (WO 97/10340). В роде Corynebacterium следует, в частности, отметить вид Corynebacterium glutamicum.
Для продуцирования пантотеновой кислоты описанные выше микроорганизмы можно культивировать непрерывно или периодически с использованием периодического процесса (культивирование партий) или периодического процесса с подпиткой либо периодического процесса с повторяющейся подпиткой. Обзор известных способов культивирования приведен в учебнике Chmiel (Bioprozesstechnik 1.  in die Bioverfahrenstechnik (изд-во Gustav Fischer, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (изд-во Vieweg, Braunschweig/Wiesbaden, 1994)).
in die Bioverfahrenstechnik (изд-во Gustav Fischer, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (изд-во Vieweg, Braunschweig/Wiesbaden, 1994)).
Используемая культуральная среда должна быть соответствующим образом адаптирована к требованиям конкретного микроорганизма. Описания культуральных сред для различных микроорганизмов содержатся в справочнике "Manual of Methods for General Bacteriology" Американского общества бактериологии (Washington D.C., США, 1981). В качестве источника углерода могут быть использованы сахара и углеводы, например, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, крахмал и целлюлоза, масла и жиры, например, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, например, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, например, такие как глицерин и этанол, и органические кислоты, например, такие как уксусная кислота. Эти вещества могут применяться по отдельности или в виде смеси. В качестве источника азота могут применяться органические азотсодержащие соединения, такие как пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкость, образующаяся после замачивания зерен кукурузы до разбухания, соевая мука и мочевина, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота могут применяться по отдельности или в виде смеси. В качестве источника фосфора могут применяться кислый фосфат калия или дикалийгидрофосфат либо соответствующие натриевые соли. Кроме того, культуральная среда должна содержать соли металлов, например, такие как сульфат магния или сульфат железа, которые необходимы для роста. И, наконец, в дополнение к вышеназванным соединениям могут использоваться такие важные для роста вещества, как аминокислоты и витамины. Кроме того, для дополнительного увеличения производства пантотеновой кислоты в культуральную среду могут быть добавлены предшественники пантотеновой кислоты, такие как аспартат, β -аланин, кетоизовалерат, кетопантоиновая кислота или пантоиновая кислота, а при необходимости и их соли. Вышеуказанные добавки могут быть введены в культуральную среду в виде одноразовой добавки или добавляться соответствующим образом в процессе культивирования.
Для контроля значения рН культуральной среды предпочтительно применяют аммиак или аммиачную воду. Также пригодны другие основания, такие как гидроксид натрия или гидроксид калия. Если требуются кислые соединения, то соответствующим образом применяют фосфорную кислоту или серную кислоту. Для контроля пенообразования добавляют антивспениватели, например, такие как полигликолевые эфиры жирных кислот. Для поддержания стабильности плазмид могут быть добавлены соответствующие конкретной среде вещества, обладающие избирательным действием, например антибиотики. Для поддержания аэробных условий в культуру вводят кислород или кислородсодержащие газовые смеси, например, такие как воздух. Температура культивирования в норме составляет от 20° С до 45° С, предпочтительно от 25° С до 40° С. Культивирование продолжают до тех пор, пока не образуется максимальное количество пантотеновой кислоты. Как правило, на это требуется от 10 ч до 160 ч.
Получаемые таким путем ферментационные бульоны в норме имеют сухую массу в диапазоне от 7,5 до 25 мас.% и содержат D-пантотеновую кислоту в концентрации от более 0 до 20 мас.%. Особенно предпочтительны такие способы ферментации, при которых по окончании ферментации количество D-пантотеновой кислоты составляет от 2 до 20 мас.% в пересчете на сухую массу. Кроме того, предпочтительно, чтобы ферментация по крайней мере в конце процесса, предпочтительно, однако, на протяжении по крайней мере 30% времени ферментации, осуществлялась в условиях ограниченного количества сахаров. Это означает, что в течение указанного промежутка времени концентрацию метаболизируемого сахара в ферментационной среде поддерживают в диапазоне от ≥ 0 до 3 г/л, соответственно снижают до этого уровня.
В варианте получения добавок по изобретению с использованием ионов аммония от ферментационного бульона, содержащего пантотеновую кислоту, при необходимости прежде всего с использованием известных методов разделения, таких как, например, центрифугирование, фильтрация, декантирование или сочетание таких методов, полностью или частично отделяют биомассу. Согласно изобретению биомассу также можно полностью оставлять в ферментационном бульоне. Затем этот бульон смешивают в общей сложности с 0,8-1,2, предпочтительно 0,95-1,1 эквивалента оксида либо гидроксида щелочного или щелочно-земельного металла, прежде всего NaOH, КОН, Са(ОН)2 или MgO, в пересчете на количество D-пантотеновой кислоты. При низких концентрациях D-пантотеновой кислоты может оказаться целесообразным применять гораздо большие количества оксида или гидроксида, например от 1,2 до 4 эквивалентов. Полученную таким образом суспензию перед сушкой концентрируют до достижения содержания сухой массы, составляющего максимум 60 мас.%. Также можно сначала осуществлять концентрирование ферментационного бульона, а затем добавлять оксид или гидроксид. После этого из образовавшегося концентрата с использованием обычной сушилки либо, например, с использованием испарителя с падающей пленкой или пленочного испарителя, либо распылительной сушилки, либо распылительного гранулятора, либо установки для сублимационной сушки получают сыпучий, легко текучий, тонкоизмельченный порошок или гранулят. Грануляцию можно также осуществлять сразу же после сушки, например путем грануляции наслаиванием.
Кроме того, авторами изобретения был разработан новый способ получения более быстрым и экономичным путем порошкообразного продукта, содержащего аммонийные, калиевые, натриевые, магниевые или кальциевые соли D-пантотеновой кислоты, или содержащих такой продукт композиций. Для этого из содержащего D-пантотеновую кислоту ферментационного бульона, полученного с использованием соответствующих гидроксисоединений, при необходимости сначала полностью или частично удаляют биомассу с помощью известных методов разделения, таких как, например, центрифугирование, фильтрация, декантирование или сочетание таких методов. Согласно изобретению, однако, биомассу также можно целиком оставлять в ферментационном бульоне. После этого при необходимости предварительно обработанный бульон концентрируют или сушат известными методами, например с помощью роторного испарителя или пленочного испарителя либо испарителя с падающей пленкой. Затем при необходимости сконцентрированный бульон перерабатывают такими способами, как сушка распылением, грануляция распылением или сублимационная сушка, либо по другим технологиям в сыпучий, легко текучий, тонкоизмельченный порошок или гранулят.
Новые добавки к кормам для животных по изобретению в целом содержат 20-80 мас.%, предпочтительно 30-75 мас.% D-пантотеновой кислоты и/или ее солей в пересчете на общее количество. Кроме того, они содержат в общей сложности 2,5-25 мас.% неорганических компонентов и необязательно органические побочные продукты в количестве от более 0 до 30 мас.%. Доля сухой биомассы составляет от 0 до 35 мас.%. Содержание воды предпочтительно составляет ≤ 5 мас.%. Требуемого содержания D-пантотеновой кислоты и/или одной или нескольких из указанных ее солей при необходимости достигают добавлением соответствующих соединений к полученному путем ферментации продукту. Требуемые соединения предпочтительно добавляют к смеси перед сушкой или распылительной сушкой, главным образом после концентрирования, в форме растворов или сухого вещества и смешивают с ней. Полученный таким образом продукт применяют в качестве добавки к кормам.
Концентрацию D-пантотеновой кислоты определяют известными методами (Velisek; Chromatographic Science 60, 515-560 (1992)).
Примеры
Ниже изобретение проиллюстрировано на примерах его осуществления. Для этой цели проводили опыты с использованием продуцирующего D-пантотеновую кислоту штамма Escherichia coli 5069/pFV31, который в соответствии с Будапештским договором был депонирован под регистрационным номером FERM-BP 4395 в Институте исследований в области ферментации Агентства промышленных исследований и технологии (Fermentation Research Institute, Agency of Industrial Science and Technology, 1-1-3, Хигаши, Тсукубаши, Ибараки (Япония)).
Пример 1
Получение ферментационного бульона, содержащего D-пантотеновую кислоту
1. Получение инокулята
Образец штамма Escherichia coli 5069/pFV31 высевали мазками на LBG-агар, дополненный 50 мкг/мл ампициллина. Эту высеянную на агаровые пластины культуру инкубировали в течение 17 ч при 37° С и затем хранили в холодильнике при +4° С. После этого отобранные отдельные колонии размножали в LBG-бульоне. LBG-бульон имел следующий состав: 10 г/л пептона, 5 г/л дрожжевого экстракта, 5 г/л NaCI и 1 г/л глюкозы. Кроме того, LBG-агар дополнительно содержал 12 г/л агара. Предварительно приготовленные композиции были приобретены у фирмы Gibco/BRL (Пейсли, Шотландия, Великобритания) в виде основы LB-бульона (бульона Луриа) или LB-aгapa. После добавления 1 г/л глюкозы получали требуемые среды. Культуры объемом по 10 мл, помещенные в колбы Эрленмейера объемом 100 мл, инкубировали в течение 16 ч при 37° С и 180 об/мин в инкубаторе типа ESR фирмы  AG (Бирсфельден, Швейцария). После этого клеточную суспензию центрифугировали в течение 15 мин при 4000 об/мин на центрифуге типа J-6B фирмы Beckman (Ганновер, Германия). Клеточный дебрис ресуспендировали в 10 мл LBG-среды, дополненной 20% глицерина, и в виде 10 аликвот объемом по 1 мл каждая, приготовленных в стерильных условиях, замораживали при -70° С. Эти культуры использовали в качестве основного банка клеток.
AG (Бирсфельден, Швейцария). После этого клеточную суспензию центрифугировали в течение 15 мин при 4000 об/мин на центрифуге типа J-6B фирмы Beckman (Ганновер, Германия). Клеточный дебрис ресуспендировали в 10 мл LBG-среды, дополненной 20% глицерина, и в виде 10 аликвот объемом по 1 мл каждая, приготовленных в стерильных условиях, замораживали при -70° С. Эти культуры использовали в качестве основного банка клеток.
Для получения рабочего банка клеток LBG-среду, дополненную 50 мкг/мл ампициллина, распределяли порциями объемом по 10 мл в колбы Эрленмейера объемом 100 мл и затем в них вносили по 100 мкл описанной выше культуры из основного банка клеток. Инкубацию проводили в течение 16 ч при 37° С и 180 об/мин в инкубаторе типа ESR фирмы  AG (Бирсфельден, Швейцария). После инкубации определяли оптическую плотность (ОП) суспензии культуры с помощью фотометра типа LP2W фирмы Dr. Lange (Берлин, Германия) при длине волны 660 нм. Она составляла 3,5. Затем клеточной суспензией в стерильных условиях заполняли стерильные полиэтиленовые пробирки объемом 30 мл фирмы Greiner (Фриккенхаузен, Германия) и центрифугировали в течение 15 мин при 2500 об/мин в центрифуге типа J-6B фирмы Beckmann (Ганновер, Германия). Отделенную биомассу ресуспендировали в 10 мл LBG-среды, дополненной 20% глицерина. Затем порции клеточной суспензии по 500 мкл каждая вносили в стерильных условиях в стерильные пробирки объемом 1 мл фирмы Nalgene (Нью Йорк, США) и замораживали при -70° С. Полученный таким образом законсервированный продукт использовали в качестве рабочего банка клеток.
AG (Бирсфельден, Швейцария). После инкубации определяли оптическую плотность (ОП) суспензии культуры с помощью фотометра типа LP2W фирмы Dr. Lange (Берлин, Германия) при длине волны 660 нм. Она составляла 3,5. Затем клеточной суспензией в стерильных условиях заполняли стерильные полиэтиленовые пробирки объемом 30 мл фирмы Greiner (Фриккенхаузен, Германия) и центрифугировали в течение 15 мин при 2500 об/мин в центрифуге типа J-6B фирмы Beckmann (Ганновер, Германия). Отделенную биомассу ресуспендировали в 10 мл LBG-среды, дополненной 20% глицерина. Затем порции клеточной суспензии по 500 мкл каждая вносили в стерильных условиях в стерильные пробирки объемом 1 мл фирмы Nalgene (Нью Йорк, США) и замораживали при -70° С. Полученный таким образом законсервированный продукт использовали в качестве рабочего банка клеток.
2. Получение ферментационного бульона, содержащего D-пантотеновую кислоту
Для получения ферментационного бульона, содержащего D-пантотеновую кислоту, сначала рабочий банк клеток размножали в виде культуры, выращиваемой во встряхиваемых колбах, а затем ее использовали для посева в ферментер для предварительной культуры. Культуру, выращенную в ферментере для предварительной культуры, использовали для посева в ферментер для получения продукта.
Для культуры, выращиваемой во встряхиваемых колбах, применяли SKA-среду. SKA-среду приготавливали следующим образом. В химический стакан объемом 1 л вносили 7,0 г (NH4)2SO4, 0,5 г KH2PO4, 1,0 г К2НРО4, 0,5 г MgSO4·7H2O, 0,01 г MnSO4·H2O, 0,01 г ZnSO4·7H2O, 0,005 г Fe2(SO4)3 и 20 г образующейся после замачивания зерен кукурузы до разбухания жидкости, значение рН которой предварительно доводили до 6,8 с помощью 25%-ного раствора аммиака, и затем добавляли 875 мл дистиллированной воды. Этот солевой раствор, содержащий жидкость, образующуюся после замачивания зерен кукурузы до разбухания, стерилизовали в автоклаве в течение 20 мин при 121° С. После этого стерилизовали фильтрацией раствор, содержащий 125 г дистиллированной воды, 28,7 г глюкозы и 0,002 г гидрохлорида тиамина (тиамин· НСl). В колбу объемом 100 мл вносили 10 г СаСО3 и стерилизовали в автоклаве в течение 20 мин при 123° С. SKA-среду получали путем смешивания обоих указанных выше компонентов с солевым раствором, содержащим жидкость, образующуюся после замачивания зерен кукурузы до разбухания.
Порции этой SKA-среды объемом по 12,5 мл вносили в колбы Эрленмейера объемом 100 мл и затем в них высевали по 0,5 мл суспензии клеток. В качестве суспензии клеток использовали законсервированную рабочую культуру, разбавленную стерильным физиологическим раствором в соотношении 1:100. Проводили инкубацию в течение 20 ч при 32° С и 150 об/мин в инкубаторе типа RC-1-TK фирмы Infors AG (Боттминген, Швейцария). После этого определяли оптическую плотность при длине волны 660 нм (ОП 660), которая составляла 12,5.
0,5 мл этой выращенной во встряхиваемых колбах культуры разбавляли с использованием 4,5 мл физиологического раствора и 0,7 мл полученного разведения использовали для посева в 1300 мл среды для выращивания, которую помещали в лабораторный ферментер типа Biostat®MD фирмы Braun Diessel Biotech GmbH (Мельзунген, Германия) объемом 2 л.
Среду для выращивания приготавливали следующим образом. Значение рН ратвора, содержащего 9,81 г (NH4)2SO4, 0,7 г KH2PO4, 1,402 г К2НРО4 0,70 г MgSO4·7H2O, 0,014 г MnSO4·H2O, 0,014 г Fe2(SO4)3 и 28,04 г жидкости, образующейся после замачивания зерен кукурузы до разбухания, в 1300 мл водопроводной воды, доводили до 6,5 с помощью 25%-ного раствора аммиака и стерилизовали в автоклаве в течение 20 мин при 121° С. К этому солевому раствору, содержащему жидкость, образующуюся после замачивания зерен кукурузы до разбухания, добавляли в стерильных условиях отдельно простерилизованный фильтрацией раствор, содержащий 40,62 г глюкозы и 0,0042 г тиамин· НСl в 100 г дистиллированной воды.
Ферментацию проводили в течение 16 ч при 37° С при аэрации с расходом 1 объемная единица газа/объем жидкости/минуту (об./об./мин). Концентрацию растворенного кислорода поддерживали на уровне 20%, а значение рН на уровне 6,5. Для коррекции значения рН использовали 25%-ный раствор аммиака. Оптическая плотность составляла 13,1. 90 мл этой культуры использовали для посева в 1144 мл среды для выращивания, предназначенной для основной ферментации, в лабораторном ферментере типа Biostat®MD объемом 2 л.
Среду для выращивания приготавливали следующим образом. Значение рН раствора, содержащего 4,14 г (NH4)2SO4, 0,744 г КH2РО4, 1,0 г К2НРО4, 0,83 г MgSO4·7H2O, 0,0124 г MnSO4·H2O, 18,87 г β -аланина, 0,74 г структола J647 и 49,72 г жидкости, образующейся после замачивания зерен кукурузы до разбухания, в 1144 мл водопроводной воды, доводили до 6,5 с помощью 25%-ного раствора аммиака и стерилизовали в автоклаве в течение 20 мин при 121° С. К этому солевому раствору, содержащему жидкость, образующуюся после замачивания зерен кукурузы до разбухания, добавляли в стерильных условиях отдельно простерилизованный фильтрацией раствор, содержащий 35,92 г глюкозы и 0,002 г тиамин· НСl в 100 мл дистиллированной воды.
Ферментацию проводили в течение 40 ч при 37° С. В фазе роста значение рН составляло 6,5, а аэрацию проводили с расходом 1 об./об./мин. В фазе производства значение рН составляло 6,0, а аэрацию проводили с расходом 1,5 об./об./мин. Концентрацию растворенного кислорода в обеих фазах поддерживали на уровне 2%. Для коррекции значения рН использовали 25%-ный раствор аммиака. В процессе ферментации осуществляли периодическую подпитку средой 1 для получения продукта и средой 2 для получения продукта. В процессе культивирования однократно добавляли жидкость, образующуюся после замачивания зерен кукурузы до разбухания. Среда 1 для получения продукта содержала 465,29 г глюкозы и 0,0261 г тиамин· НСl в 584 мл водопроводной воды, и ее стерилизовали фильтрацией. Среда 2 для получения продукта содержала 37,5 г β -аланина в 140 мл водопроводной воды, и ее стерилизовали в автоклаве в течение 20 мин при 121° С. После ферментации в течение 7,5 ч и до окончания культивирования производили периодическую подпитку средой 1 для получения продукта. После культивирования в течение 10,5 ч добавляли в стерильных условиях еще 49,5 г жидкости, образующейся после замачивания зерен кукурузы до разбухания, которую растворяли в 100 мл водопроводной воды и стерилизовали в автоклаве в течение 20 мин при 121° С. После ферментации в течение 12,5 ч и до окончания культивирования производили подпитку средой 2 для получения продукта со скоростью добавления 3,5 г/ч. После культивирования в течение 41 ч концентрация пантотеновой кислоты в ферментационном бульоне составляла 6,1 мас.%.
Содержание D-пантотеновой кислоты определяли с помощью устройства для ЖХВР (жидкостная хроматография высокого разрешения) типа М321 фирмы Knauer (Берлин, Германия) путем определения показателя преломления (ПП) с использованием аминофазы Hypersil APS2 с размером зерен 5 мкм.
Пример 2
Путем ферментации, которую осуществляли в тех же условиях, которые описаны в примере 1, после культивирования в течение 43 ч получали концентрацию пантотеновой кислоты в ферментационном бульоне, равную 5,4 мас.%. Концентрация L-валина составляла 8 г/л.
Пример 3
Получение D-пантотената кальция
Сначала удаляли биомассу из содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2, и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты. Для этого 1 л указанного выше ферментационного бульона центрифугировали в течение 20 мин при 4000 об/мин на лабораторной центрифуге типа Biofuge-Stratos фирмы Heraeus (Дюссельдорф, Германия) и затем полученную центрифугированием надосадочную жидкость подвергали дальнейшей очистке путем ультрафильтрации в поперечном потоке через полимерную мембрану типа MRC, пропускающую частицы массой до 30 кДа, с помощью устройства для ультрафильтрации фирмы ICT GmbH (Бад Хомбург, Германия).
Затем порциями при перемешивании добавляли 10,1 г твердого Са(ОН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 10,3. Обработанный таким образом бульон затем концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон сушили распылением для выделения кальциевой соли D-пантотеновой кислоты. Для этого применяли лабораторную распылительную сушилку типа
GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон сушили распылением для выделения кальциевой соли D-пантотеновой кислоты. Для этого применяли лабораторную распылительную сушилку типа  фирмы
фирмы  GmbH (Констанц, Германия) при температуре на входе 107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
GmbH (Констанц, Германия) при температуре на входе 107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
В полученном таким путем содержащем D-пантотенат кальция продукте содержание D-пантотеновой кислоты составляло 68,5 мас.%, этот продукт был сыпучим, а его кажущаяся плотность составляла 460 мг/мл. После хранения в течение пяти месяцев содержание D-пантотеновой кислоты составило 67,6 мас.%.
Пример 4
Получение D-пантотената натрия
Сначала удаляли биомассу из содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2 и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты. Для этого 1 л указанного выше ферментационного бульона подвергали центрифугированию и ультрафильтрации, как описано в примере 3.
Затем порциями при перемешивании добавляли 10,6 г NaOH (99%, фирма Merck). После этого значение рН составляло приблизительно 10. Обработанный таким образом бульон затем концентрировали в вакууме при 50-60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения натриевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold (Кельн, Германия).
GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения натриевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold (Кельн, Германия).
В полученном таким путем содержащем D-пантотенат натрия продукте содержание D-пантотеновой кислоты составляло 63,8 мас.%, и этот продукт был сыпучим. После хранения в течение пяти месяцев содержание D-пантотеновой кислоты составило 63,0 мас.%.
Пример 5
Получение D-пантотената магния
Сначала удаляли биомассу из содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2, и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты. Для этого 1 л указанного выше ферментационного бульона подвергали центрифугированию и ультрафильтрации, как описано в примере 3.
Затем порциями при перемешивании добавляли 5,4 г твердого MgO (97%, фирма Merck). После этого значение рН составляло приблизительно 9-10.
Обработанный таким образом бульон затем концентрировали в вакууме при 50-60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения магниевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения магниевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
В полученном таким путем содержащем D-пантотенат магния продукте содержание D-пантотеновой кислоты составляло 64,7 мас.%, и этот продукт был сыпучим. После хранения в течение пяти месяцев содержание D-пантотеновой кислоты составило 64,4 мас.%.
Пример 6
Получение D-пантотената калия
Сначала удаляли биомассу из содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2 и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты. Для этого 1 л указанного выше ферментационного бульона подвергали центрифугированию и ультрафильтрации, как описано в примере 3.
Затем порциями при перемешивании добавляли 17,4 г КОН (85%, фирма Merck). После этого значение рН составляло приблизительно 10-11. Обработанный таким образом бульон затем концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH до тех пор, пока содержание сухого вещества в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения калиевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
GmbH до тех пор, пока содержание сухого вещества в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения калиевой соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
В полученном таким путем содержащем D-пантотенат калия продукте содержание D-пантотеновой кислоты составляло 63,5 мас.%, и этот продукт был сыпучим. После хранения в течение пяти месяцев содержание D-пантотеновой кислоты составило 62,9 мас.%.
Пример 7
Получение D-пантотената аммония
Сначала удаляли биомассу из содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2, и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты. Для этого 1 л указанного выше ферментационного бульона подвергали центрифугированию и ультрафильтрации, как описано в примере 3.
Обработанный таким образом бульон затем концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения аммонийной соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
GmbH до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 50%. После этого сконцентрированный таким образом бульон лиофилизировали для выделения аммонийной соли D-пантотеновой кислоты в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold.
В полученном таким путем содержащем D-пантотенат аммония продукте содержание D-пантотеновой кислоты составляло 66,8 мас.%, и этот продукт был сыпучим.
Пример 8
Получение D-пантотената кальция из ферментационного бульона, содержащего биомассу
Сначала 1 л содержащего пантотеновую кислоту ферментационного бульона, который получали согласно примерам 1 и 2 и который содержал приблизительно 6,1 мас.% D-пантотеновой кислоты, концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH (Konstanz, Германия) до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 30%. После этого порциями при перемешивании добавляли 10,1 г твердого Са(ОН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 10. Затем обработанный таким образом и сконцентрированный бульон, содержащий биомассу, сушили распылением для выделения кальциевой соли D-пантотеновой кислоты. Для этого применяли лабораторную распылительную сушилку типа
GmbH (Konstanz, Германия) до тех пор, пока содержание сухой массы в жидкости не становилось равным приблизительно 30%. После этого порциями при перемешивании добавляли 10,1 г твердого Са(ОН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 10. Затем обработанный таким образом и сконцентрированный бульон, содержащий биомассу, сушили распылением для выделения кальциевой соли D-пантотеновой кислоты. Для этого применяли лабораторную распылительную сушилку типа  фирмы
фирмы  GmbH (Констанц, Германия) при температуре на входе 107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
GmbH (Констанц, Германия) при температуре на входе 107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
В полученном таким путем содержащем D-пантотенат кальция продукте содержание D-пантотеновой кислоты составляло 49,8 мас.%, этот продукт был сыпучим, а его кажущаяся плотность составляла 480 мг/мл. Содержание биомассы составляло приблизительно 30 мас.%.
Пример 9
Получение продукта, содержащего D-пантотенат кальция и биомассу, состоящую из Corynebacterium glutamicum
1. Получение штамма Corynebacterium glutamicum, продуцирующего пантотеновую кислоту
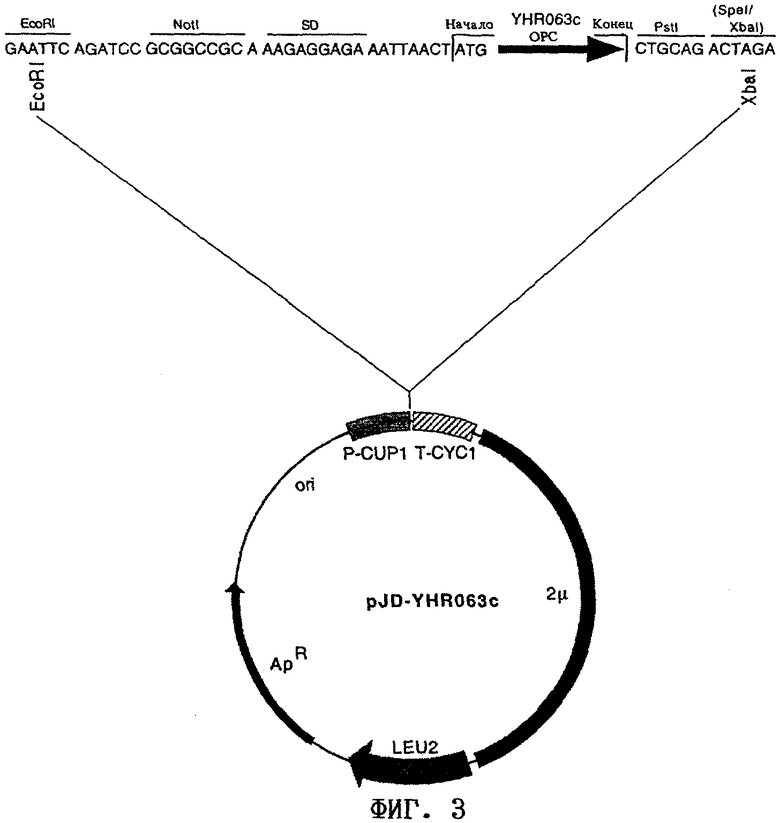
В патенте US 5188948 описан штамм Brevibacterium lactofermentum FERM ВР-1763, продуцирующий L-валин. В DE 19855313.7 описана плазмида pND-DBC2 (фиг.1), несущая гены раnВ, раnС и panD Corynebacterium glutamicum. Плазмида в форме штамма ATCC13032/pND-DBC2 депонирована в Немецкой коллекции микроорганизмов и клеточных культур (Брауншвейг, Германия) под регистрационным номером DSM 12437. Путем трансформации штамма FERM ВР-1763 плазмидой pND-DBC2 получали продуцирующий пантотеновую кислоту штамм FERM BP-1763/pND-DBC2.
2. Получение ферментационного бульона, содержащего пантотеновую кислоту
Образец штамма Brevibacterium lactofermentum FERM BP-1763/pND-DBC2 высевали мазками на ННК-агар.
ННК-агар состоит из агара со средой, используемой для инфузии в мозг и сердце, который получали от фирмы Merck KGaA (Дармштадт, Германия), и его дополняли канамицином. Состав ННК-агара представлен в таблице 1а.
Эту высеянную на агаровые пластины культуру инкубировали в течение 17 ч при 37° С и затем хранили в холодильнике при +4° С. После этого отобранные отдельные колонии размножали на такой же среде. Петлей для посева из ННК-агара отбирали клеточный материал одного клона и переносили в 100 мл ННК-бульона, помещенного во встряхиваемую колбу общим объемом 1000 мл.
ННК-бульон состоял из используемой для инфузии в мозг и сердце среды, которую получали от фирмы Merck KGaA (Дармштадт, Германия) и которую дополняли глюкозой и канамицином. Состав ННК-бульона представлен в таблице 1б.
Смесь инкубировали в течение 22 ч при 30° С и 150 об/мин. По окончании культивирования фотометром измеряли оптическую плотность при длине волны 660 нм (ОП 660), которая оказалась равной 6,1. Эту культуру штамма FERM BP-1763/pND-DBC2 использовали для внесения в ферментер для получения продукта.
Ферментацию осуществляли в среде SK-71, представленной в таблице 1в. Все компоненты среды SK-71 в количествах, соответствующих рабочим концентрациям, загружали непосредственно в ферментер и стерилизовали in situ.
В качестве ферментера использовали реактор с мешалкой фирмы B.Braun (BBI, Германия, Мельзунген, модель Biostat E/ED) объемом 10 л.
Для инокуляции 1950 г ферментационной среды SK-71 применяли 100 мл описанной выше предварительной культуры, выращенной во встряхиваемых колбах в ННК-бульоне.
Смесь культивировали в течение всего периода ферментации при температуре 30° С, аэрации с удельным объемным расходом 0,75 об./об./мин, скорости перемешивания 800-1700 об/мин в зависимости от расхода кислорода, значении рН 7,0 и парциальном давлении кислорода 20% от насыщения воздухом. Культуру выращивали в вышеуказанных условиях в общей сложности в течение 49 ч до достижения ОП при 660 нм, равной 26,2. В качестве корректирующего средства для регулирования значения рН применяли водный раствор аммиака (25%-ный (мас./об.)).
После этого измеряли оптическую плотность (ОП) при длине волны 660 нм с помощью цифрового фотометра типа LP1W фирмы Dr. Bruno Lange GmbH (Берлин, Германия) и определяли концентрацию образовавшейся D-пантотеновой кислоты с помощью ЖХВР (Hypersil APS 2 с размером зерен 5 мкм, 250× 5 мм, определение ПП).
В образце ферментационного бульона через 49 ч концентрация D-пантотеновой кислоты составляла приблизительно 0,2 г/л.
3. Получение продуктов, содержащих пантотеновую кислоту
Содержащий D-пантотеновую кислоту ферментационный бульон с концентрацией D-пантотеновой кислоты приблизительно 0,02 мас.% получали согласно примеру 9.2. Сначала 1,4 л этого ферментационного бульона концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы  GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в бульоне не становилось равным приблизительно 15%. Затем порциями при перемешивании добавляли 27,1 г твердого Са(ОН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 10,0. Далее в обработанный таким образом и сконцентрированный бульон, содержащий биомассу, добавляли 37,7 г D-пантотената кальция (>98%, фирма Euro OTC Pharma GmbH, Камен, Германия). Для последующей распылительной сушки применяли лабораторную распылительную сушилку типа
GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в бульоне не становилось равным приблизительно 15%. Затем порциями при перемешивании добавляли 27,1 г твердого Са(ОН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 10,0. Далее в обработанный таким образом и сконцентрированный бульон, содержащий биомассу, добавляли 37,7 г D-пантотената кальция (>98%, фирма Euro OTC Pharma GmbH, Камен, Германия). Для последующей распылительной сушки применяли лабораторную распылительную сушилку типа  фирмы
фирмы  GmbH (Констанц, Германия) при температуре на входе107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
GmbH (Констанц, Германия) при температуре на входе107° С, температуре на выходе 85° С, перепаде давления -40 мбар и расходе воздуха при нормальных условиях 600 л/ч.
В полученном таким путем содержащем D-пантотенат кальция продукте содержание D-пантотеновой кислоты составляло приблизительно 35%, этот продукт был сыпучим, а его кажущаяся плотность составляла 600 мг/мл. Содержание биомассы, состоящей из С. glutamicum, составляло приблизительно 3,5 мас.%.
Пример 10
Получение продуктов, содержащих D-пантотенат кальция и биомассу, состоящую из Saccharomyces cerevisiae
1. Получение штамма Saccharomvces cerevisiae, продуцирующего пантотеновую кислоту
Амплификация рамки считывания YHR063c:
На основе нуклеотидной последовательности рамки считывания YHR063c Saccharomyces cerevisiae (регистрационный номер U00061 Национального центра биотехнологии, Бетесда, шт. Мэриленд, США) синтезировали следующие праймеры для полимеразной цепной реакции (ПЦР) (фирма MWG-Biotech, Эберсберг, Германия). Начало, соответственно конец рамки считывания обозначены точкой (.):
- оJD539 (начало 5' EcoRI-NotI):
5'-GCG CGA ATT CAG ATC CGC GGC CGC AAA GAG GAG AAA TTA ACT.ATG ACT GCA CCA CAC AGA AG-3';
- oJD540 (конец 3' SpeI-PstI):
5'-CGC GAC TAG TCT GCA G.TC AGT CCT TTC TCC AGT CAC-3'.
В качестве матрицы использовали геномную ДНК штамма S. cerevisiae JD242, которую выделяли согласно методу С.Guthrie и G.R.Fink (Guide to yeast 20 genetics and molecular biology, Methods in Enzymology, т.194, изд-во Academic Press, San Diego, шт. Калифорния, 1991). Этот штамм представляет собой гаплоидный сегрегант диплоидного штамма SC288C (Winston и др., Yeast 11, стр.53 и далее (1995)), геном которого секвенирован (Goffeau и др., Science 274, стр.546 (1996)). Тетрадный анализ проводили согласно методу С.Guthrie и G.R.Fink (Guide to yeast genetics and molecular biology, Methods in Enzymology, т. 194, Academic Press, San Diego, шт. Калифорния, 1991). Штамм JD242 является ауксотрофом в отношении лейцина (аллель leu2Δ 1) и урацила (аллель ura3-52). С использованием набора "High Fidelity Expand Polymerase" фирмы Roche (Маннгейм) после 28 циклов ПЦР, проведенной в условиях, рекомендованных производителем, оказалось возможным амплифицировать фрагмент ДНК длиной 1,2 т.п.н. Размер фрагмента определяли путем электрофоретического разделения в 0,8%-ном агарозном геле.
Конструирование pJD-YHR063c
Для экспрессии рамки считывания YHR063c в S. cerevisiae продукт, полученный в результате ПЦР-амплификации, встраивали в бифункциональный (челночный) вектор pJDCEX2, позволяющий осуществлять репликацию и в Е. coli, и в S. cerevisiae (см. фиг.2, а также у Dohmen и др., Journal of Biological Chemistry 270, 18099-18109 (1995)).
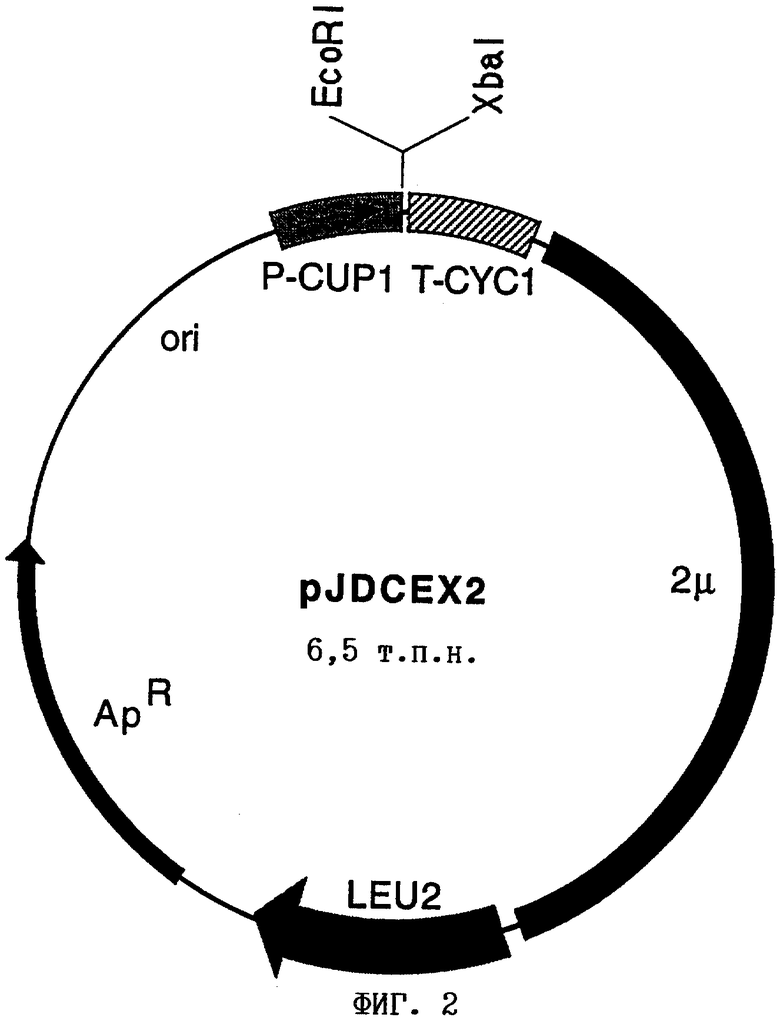
ПЦР-продукт сначала расщепляли с помощью EcoRI и Spel (фирма AGS, Гейдельберг, Германия). Затем его смешивали с ДНК pJDCEX2, обработанной EcoRI и Xbal (фирма AGS, Гейдельберг, Германия) и лигировали с помощью ДНК лигазы фага Т4 (фирма Roche, Маннгейм, Германия). Продуктом, полученным в результате лигирования, трансформировали штамм Е. coli XL1-Blue (Bullock и др., Biotechniques 5, 376). Трансформанты выделяли путем отбора на LB-агаре, содержащем 150 мкг/мл ампициллина (фирма Sigma, Дайзенгофен, Германия). Плазмидную ДНК из устойчивых к ампициллину клонов обрабатывали путем щелочного лизиса (Sambrook и др., Molecular Cloning, A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, 1989). После этого выделенную плазмидную ДНК анализировали путем расщепления с помощью NotI и PstI и последующего разделения на 0,8%-ном агарозном геле. Плазмида требуемого строения получила название pJD-YHR063c (фиг.3).
Получение штамма JD242/pJD-YHR063c:
Штамм S. cerevisiae JD242 трансформировали плазмидой pJD-YHR063c согласно методу Dohmen и др. (Dohmen и др., Yeast 7, 691 (1991)). Отбор трансформантов проводили на минимальной среде SD, не содержащей лейцина, с 1,8%-ным агаром (см. таблицы 2а и 2б).
2. Получение содержащего пантотеновую кислоту ферментационного бульона
Для получения содержащего D-пантотенат ферментационного бульона сначала высевали мазками отдельную колонию штамма S. cerevisiae JD242/pJD-YHR063c на агаровую пластину с минимальной средой SD и инкубировали в течение 3 дней при 30° С. Затем для получения этой первой предварительной культуры клетки суспендировали во встряхиваемых колбах в 5 мл минимальной среды SD. После этого по 2,5 мл этой суспензии клеток вносили во встряхиваемые колбы (общий объем 500 мл), содержащие 50 мл минимальной среды SD (таблицы 2а и 2б), и культивировали в течение 6 ч в инкубаторе типа RC-1-ТК фирмы Infors AG (Боттмингем, Швейцария) при 30° С и 130 об/мин до достижения оптической плотности, измеряемой при длине волны 660 нм (ОП 660), равной 1,9. Вторую предварительную культуру выращивали в колбе с дефлекторами объемом 1000 мл, содержащей 150 мл минимальной среды SD (таблицы 9а и 96), в которую вносили 50 мл описанной выше предварительной культуры 1. Инкубацию проводили в течение 20 ч при 30° С и 80 об/мин до достижения оптической плотности, измеряемой при длине волны 660 нм (ОП 660), равной приблизительно 3,8. Основную ферментацию для получения пантотеновой кислоты проводили в круглой колбе общим объемом 6000 мл, содержащей 1500 мл минимальной среды SD (таблицы 2а и 2б). Для этого в круглую колбу каждый раз вносили по 90 мл предварительной культуры 2 и затем инкубировали в течение 30 ч при 30° С и 60 об/мин.
Оптическую плотность (ОП) измеряли при длине волны 660 нм с помощью цифрового фотометра типа LP1W фирмы Dr. Bruno Lange GmbH (Берлин, Германия). Концентрацию образовавшейся D-пантотеновой кислоты определяли с использованием штамма Lactobacillus plantarum ATCC® 8014 согласно инструкциям, изложенным в справочнике "DIFCO MANUAL" фирмы DIFCO (Мичиган, США, 10-е изд., 1100-1102 (1984)).
Оптическая плотность (ОП 660) составляла приблизительно 4, а содержание D-пантотеновой кислоты составляло приблизительно 1 мг/л.
Получение продукта, содержащего пантотеновую кислоту
Содержащий пантотеновую кислоту ферментационный бульон с концентрацией D-пантотеновой кислоты приблизительно 1 мг/л получали согласно примеру 10.2. Сначала 6,0 л этого ферментационного бульона концентрировали в вакууме при 60° С на роторном испарителе типа Rotavapor RE-120 фирмы 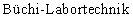 GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в бульоне не становилось равным приблизительно 16%. Затем порциями при перемешивании добавляли 15,9 г твердого Са(OН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 9,2. Далее в обработанный таким образом и сконцентрированный бульон, содержащий биомассу, добавляли 28,4 г D-пантотената кальция (>98%, фирма Euro OTC Pharma GmbH, Камен, Германия). Затем бульон лиофилизировали в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold (Кельн, Германия).
GmbH (Констанц, Германия) до тех пор, пока содержание сухой массы в бульоне не становилось равным приблизительно 16%. Затем порциями при перемешивании добавляли 15,9 г твердого Са(OН)2 (96%, фирма Merck, Дармштадт, Германия). После этого значение рН составляло приблизительно 9,2. Далее в обработанный таким образом и сконцентрированный бульон, содержащий биомассу, добавляли 28,4 г D-пантотената кальция (>98%, фирма Euro OTC Pharma GmbH, Камен, Германия). Затем бульон лиофилизировали в установке для сублимационной сушки типа LYOVAC GT 2 фирмы Leybold (Кельн, Германия).
В полученном таким путем содержащем D-пантотенат кальция продукте содержание D-пантотеновой кислоты составляло 26,5 мас.%, этот продукт был сыпучим, а его кажущаяся плотность составляла 450 мг/мл. Содержание биомассы, состоящей из S. cerevisiae, составляло приблизительно 6,8 мас.%.
Описание чертежей
На прилагаемых к описанию чертежах показано:
на фиг.1 - карта плазмиды pND-DBC2,
на фиг.2 - карта плазмиды pJDCEX2 и
на фиг.3 - карта плазмиды pJD-YHR063c.
Используемые на чертежах сокращения имеют следующие значения:
на фиг.1:
rrnВТ1Т2: терминатор транскрипции гена rrnВ,
Ptac: промотор tac,
pan В: кодирующая область гена pan В,
раn С: кодирующая область гена pan С,
pan D: кодирующая область гена pan D,
rep-C.g.: область ДНК, обеспечивающая репликацию в С. glutamicum,
oriV-E.c.: начало области вегетативного переноса в Е. coli,
kan: ген, обусловливающий устойчивость к канамицину,
BglII: сайт рестрикции рестриктазы BglII,
ClaI: сайт рестрикции рестриктазы ClaI,
NcoI: сайт рестрикции рестриктазы NcoI,
Nrul: сайт рестрикции рестриктазы NruI,
PvuI: сайт рестрикции рестриктазы PvuI,
SacI: сайт рестрикции рестриктазы SacI,
SalI: сайт рестрикции рестриктазы SalI,
ScaI: сайт рестрикции рестриктазы ScaI,
SphI: сайт рестрикции рестриктазы SphI,
XhoI: сайт рестрикции рестриктазы XhoI;
на фиг.2 и 3:
Leu2: ген β -изопропилмалатдегидрогеназа Saccharomyces cerevisiae,
2μ : последовательности эндогенной 2μ -плазмиды Saccharomyces cerevisiae,
ApR: ген β -лактамаза,
P-CUP1: промотор гена CUP1 Saccharomyces cerevisiae (металлотионеин),
T-CYC1: терминатор гена CYC1 (цитохром С) Saccharomyces cerevisiae,
SD: последовательность Шайна-Дальгарно,
EcoRI: сайт рестрикции рестриктазы EcoRI,
NotI: сайт рестрикции рестриктазы NotI,
SpeI: сайт рестрикции рестриктазы SpeI,
XbaI: сайт рестрикции рестриктазы XbaI.
Изобретение относится к кормопроизводству. Создана добавка к кормам для животных на основе ферментационного бульона, которую получают путем ферментации с использованием продуцирующих D-пантотеновую кислоту микроорганизмов и которая содержит одну или несколько солей D-пантотеновой кислоты, выбранных из группы, включающей натриевую, калиевую, аммонийную, магниевую и кальциевую соли, при необходимости с добавлением одного или нескольких из этих соединений, и способ ее получения (варианты). Изобретение позволяет разработать новую пригодную для использования в качестве добавки к корму композицию, содержащую D-пантотеновую кислоту и/или ее соли, а также разработать такой способ получения добавки, который был бы более экономичным и обеспечивал бы более высокую производительность чем известные способы. 4 с. и 10 з.п. ф-лы, 3 ил., 5 табл.
а) D-пантотеновую кислоту и/или ее соли,
б) биомассу, полученную в процессе ферментации с использованием продуцирующих D-пантотеновую кислоту микроорганизмов, в количестве 0-100% от ее образовавшегося количества и
в) по крайней мере преобладающую часть других ингредиентов ферментационного бульона и представлена в твердой форме, прежде всего в тонкоизмельченной или гранулированной сыпучей форме.
| ЕР 0533039 A1, 24.03.1993 | |||
| Декодирующее устройство | 1976 |
|
SU590857A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| ЕР 0615693 А2, 21.09.1994 | |||
| СПОСОБ ПОЛУЧЕНИЯ ДОБАВКИ К КОРМАМ ДЛЯ ЖИВОТНЫХ НА ОСНОВЕ ФЕРМЕНТАЦИОННОГО БУЛЬОНА | 1997 |
|
RU2180175C2 |
| ЕР 0809940 А2, 03.12.1997. | |||
Авторы
Даты
2005-02-10—Публикация
2000-05-04—Подача