Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины и, в частности, композиции, способной увеличивать количество стволовых клеток и клеток-предшественников в циркуляции периферической крови у млекопитающих. Предложенная композиция отличается тем, что она содержит дефибротид в комбинации, по меньшей мере, с одним гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники, предпочтительно G-CSF.
Уровень техники
Возможность получения повышенного количества стволовых клеток и клеток-предшественников в циркуляции периферической крови у млекопитающих и, в частности, у человека в течение многих лет была предметом интенсивных исследований. Доступность стволовых клеток и/или клеток-предшественников является очень важной в таких областях, как аутогенная трансплантация циркулирующих клеток-предшественников, аллотрансплантация циркулирующих клеток-предшественников и генная терапия циркулирующих гематопоэтических клеток.
Хотя после рождения стволовые клетки и клетки-предшественники находятся почти исключительно в костном мозге, тем не менее, они обладают миграционными свойствами; то есть, иными словами, в физиологических условиях они мигрируют через полости костного мозга и вовлекаются в циркуляцию. Этот процесс, обычно известный как “активация”, может быть усилен у млекопитающих за счет различных обработок, таких как, например, введение цитокинов, и в особенности фактора роста колоний гранулоцитов (G-CSF). Обратный процесс, известный как “хоминг”, происходит, например, у облученных реципиентов после трансплантации гематопоэтических клеток. Однако механизм, лежащий в основе активации и хоминга, остается еще неясным (C.F.Craddock et al. "Antibodies to VLA4 Integrin Mobilize Long-Term Repopulating Cells and Augment Cytokine-Induced Mobilization in Primates and Mice", Blood, Vol. 90, №12, 1997, pp. 4779-4788; F. Prosper et al. Mobilization and Homing of Peripheral Blood Progenitors in Related to Reversible Downregulation of α4β1 Integrin Expression and Function", J. Clin. Invest., Vol. 101, №11, 1998, pp. 2456-2467; M. Vermeulen et al., "Role of Adhesion Molecules in the Homing and Mobilization of Murine Hematopoietic Stem and Progenitor Cells", Blood, Vol. 92, №3, 1998, pp. 894-900).
Фактор G-CSF (регистрационный номер CAS 143011-2-7/Merck Index, 1996, стр.4558) представляет собой гематопоэтический фактор роста, который незаменим при пролиферации и дифференциации клеток-предшественников гранулоцитов. Он является гликопротеином с молекулярной массой 18-22 кД и обычно образуется в ответ на специфическую стимуляцию под действием множества клеток, включающих моноциты, фибробласты и эндотелиальные клетки.
Термин дефибротид (DEF) (регистрационный номер CAS 83712-60-1) означает полидезоксирибонуклеотид, полученный экстракцией (US 3770720 и US 3899481) животных и/или растительных тканей. Обычно этот полидезоксирибонуклеотид применяется в виде соли щелочного металла, обычно натрия. Дефибротид обычно используют в связи с его антитромботической активностью (US 3829567), хотя его можно применять и в других областях, например, при лечении острой почечной недостаточности (US 4694134) и острой ишемической болезни миокарда (US 4693995).
Наконец, в US 4985552 и US 5223609 описан способ получения дефибротида, который обеспечивает получение продукта с постоянными и хорошо определенными физико-химическими свойствами, не обладающего каким-либо побочным эффектом.
В контексте настоящего изобретения термин дефибротид означает любой олигонуклеотид и/или полинуклеотид, полученный экстракцией животных и/или растительных тканей, в частности органов млекопитающих. Предпочтительно, дефибротид получают в соответствии со способами, описанными в указанных выше патентах, которые, таким образом, необходимо рассматривать как составную часть настоящего изобретения. Еще более предпочтительно, дефибротид получают согласно способам, описанным в патентах США №№4985552 и 5223609.
Сущность изобретения
В настоящем изобретении неожиданно было обнаружено, что активацию стволовых клеток и клеток-предшественников можно увеличить путем введения дефибротида в комбинации и/или в непосредственной временной близости с гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники.
Как можно будет оценить из примеров, введение дефибротида в комбинации и/или в непосредственной временной близости с гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники, позволяет достичь гораздо более высокой степени активации, чем в случае введения одного гематопоэтического фактора.
Следовательно, предмет настоящего изобретения включает композицию, содержащую в качестве активных ингредиентов дефибротид в комбинации, по меньшей мере, с одним гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники, предпочтительно G-CSF. В предпочтительном варианте осуществления предложенная композиция представляет собой водный раствор для инъекции; альтернативно композиция может представлять собой два различных раствора, один из которых содержит дефибротид, а другой гематопоэтический фактор, обладающий способностью активировать гематопоэтические клетки-предшественники. Поэтому композиция, согласно настоящему изобретению, имеет форму объединенного препарата для одновременного, раздельного или последовательного применения указанных выше активных ингредиентов для увеличения количества стволовых клеток и/или гематопоэтических клеток-предшественников в циркуляции в периферической крови млекопитающих.
Второй аспект настоящего изобретения включает применение дефибротида в комбинации, по меньшей мере, с одним гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники, для получения композиций, способных увеличить количество стволовых клеток и/или гематопоэтических клеток-предшественников в циркуляции в периферической крови млекопитающих, в частности, человека.
Наконец, еще один предмет настоящего изобретения включает способ увеличения количества стволовых клеток и/или гематопоэтических клеток-предшественников в циркуляции в периферической крови млекопитающих, заключающийся в введении дефибротида в комбинации и/или в непосредственной временной близости, по меньшей мере, с одним гематопоэтическим фактором, обладающим способностью активировать гематопоэтические клетки-предшественники. В качестве гематопоэтического фактора, используемого при к разработке настоящего изобретения, был использован другими G-CSF. Однако не исключено, что аналогичные результаты могут быть получены с гематопоэтическими факторами, отличающимися от G-CSF, которые тем не менее обладают способностью активировать гематопоэтические кллетки-предшественники, например, такими как фактор роста колоний гранулоцитов и макрофагов (GM-CSF), “Flt3 лиганд 3 (FL)”, “фактор стволовых клеток” (SCF), тромбопоэтин (ТРО), интерлейкин 8 (IL-8), и другие, что без сомнения ясно для специалистов в этой области техники.
В качестве дефибротида, применяемого в комбинации с G-CSF на первой экспериментальной стадии, был использован дефибротид, выпускаемый фирмой Crinos Spa под товарным знаком Proclicide™, полученный согласно способу, описанному в US 4985552 и US 5223609.
Что касается способов введения этих двух активных компонентов, они не ограничиваются для задач настоящего изобретения. Иными словами, дефибротид и гематопоэтический фактор, обладающий способностью активировать гематопоэтические клетки-предшественники, можно вводить млекопитающим (и, в частности, человеку) в соответствии со способами и нозологией, которые известны в этой области техники. Обычно их вводят перорально, внутримышечно, внутрибрюшинно, подкожно или внутривенно, причем последний способ является предпочтительным.
Кроме того, эти два активных ингредиента могут быть введены одновременно или последовательно. Иными словами, в первом случае их вводят в виде простой композиции, которая содержит оба активных ингредиента и в которую необязательно, но можно добавить обычные лекарственные эксцепиенты и/или адъюванты, известные в этой области. Альтернативно, оба активных компонента можно вводить последовательно, а именно в виде двух различных композиций, одна из которых содержит гематопоэтический фактор, обладающий способностью активировать гематопоэтические клетки-предшественники, предпочтительно G-CSF, а другая содержит дефибротид.
Обычно G-CSF вводят подкожно в количестве от 5 до 24 мкг/кг, в то время как дефибротид (DEF) вводят путем непрерывного вливания в количестве от 5 до 15 мг/кг в час в течение 2-7 суток.
Как можно будет оценить из приведенных примеров, которые следует рассматривать только как иллюстрации, не ограничивающие это изобретение, введение G-CSF в комбинации с дефибротидом мышам, которые являются наиболее распространенной экспериментальной моделью млекопитающих, и обезьянам позволяет достичь гораздо более высокой степени активации, чем в случае введения одного G-CSF, с четкими преимуществами для всех тех областей терапии, где желательным является высокий уровень активации.
Перечень чертежей
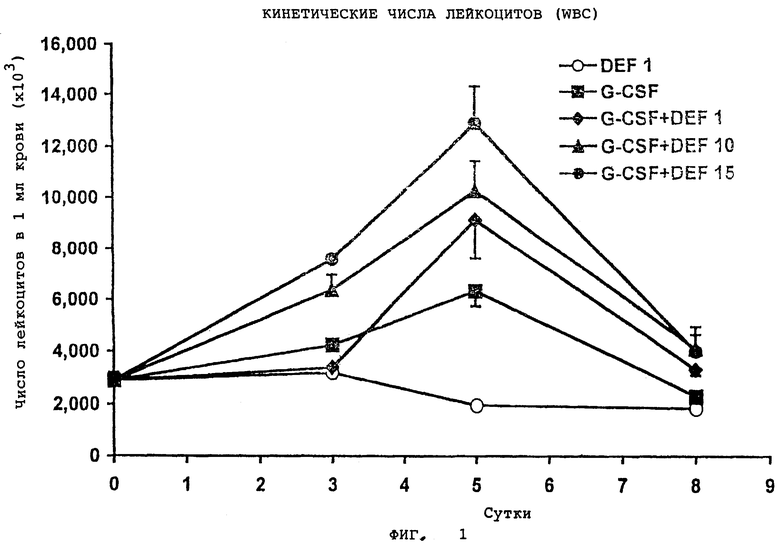
На Фигуре 1 показана кинетика числа лейкоцитов (WBC).
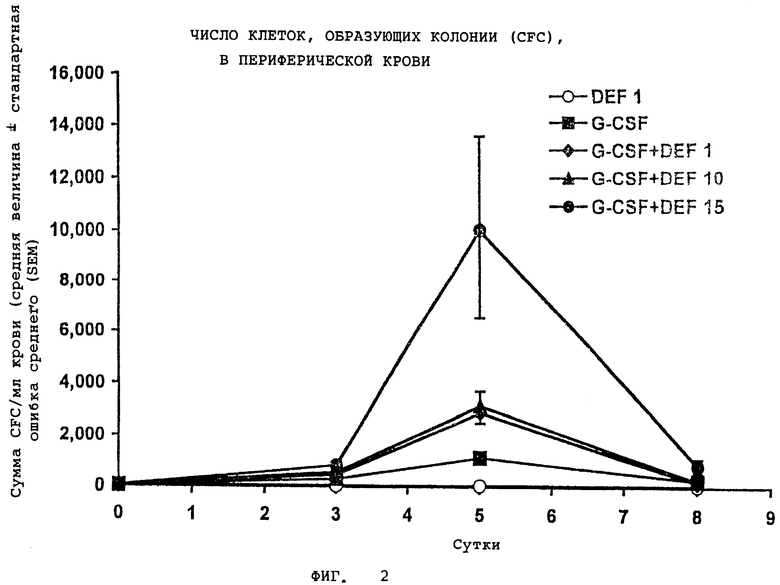
На Фигуре 2 показано число клеток, образующих колонии (CFC), в периферической крови.
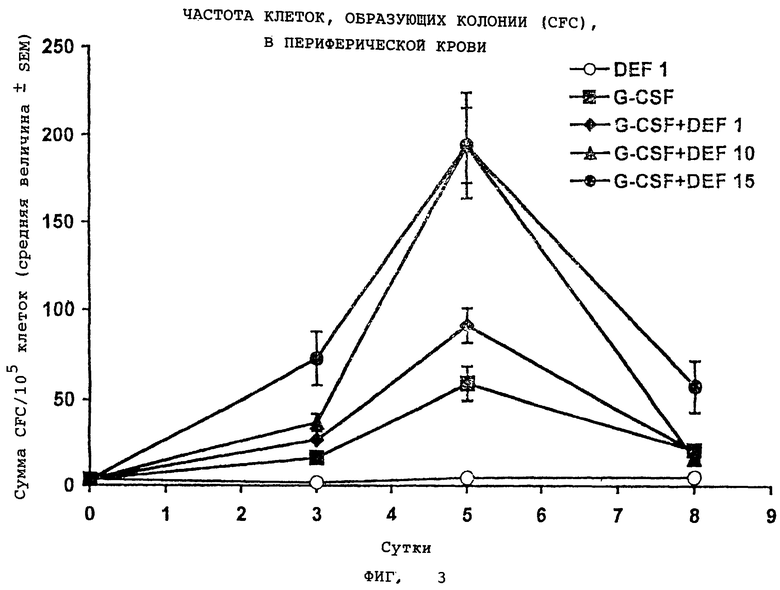
На Фигуре 3 показана частота клеток, образующих колонии (CFC), в периферической крови.
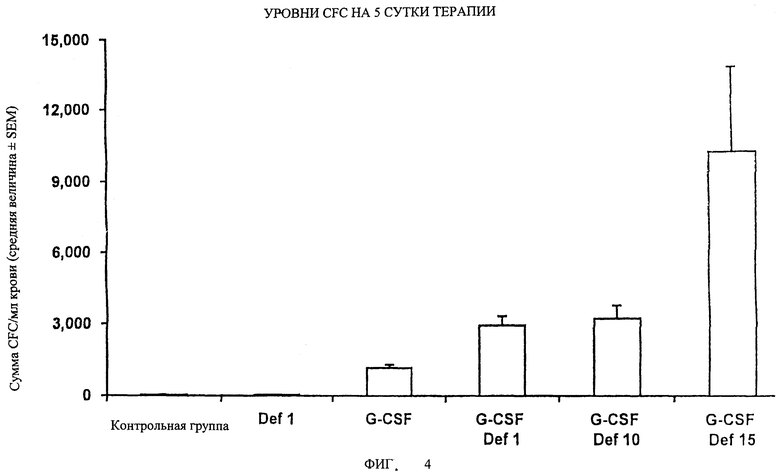
На Фигуре 4 показаны уровни CFC на 5 сутки терапии.
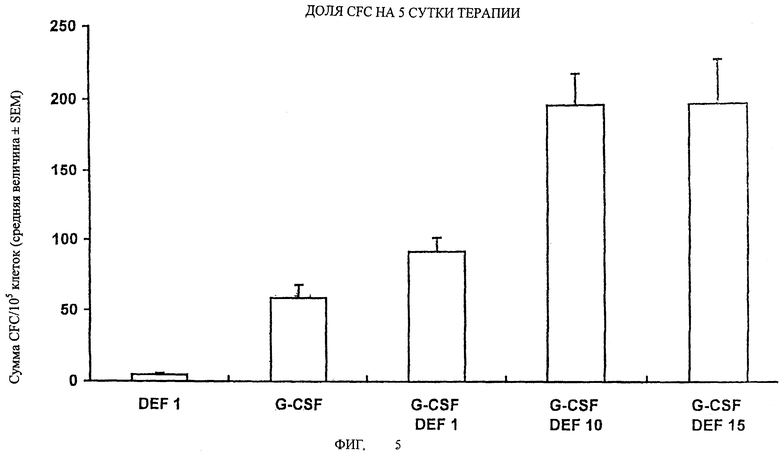
На Фигуре 5 показана доля CFC на 5 сутки терапии.
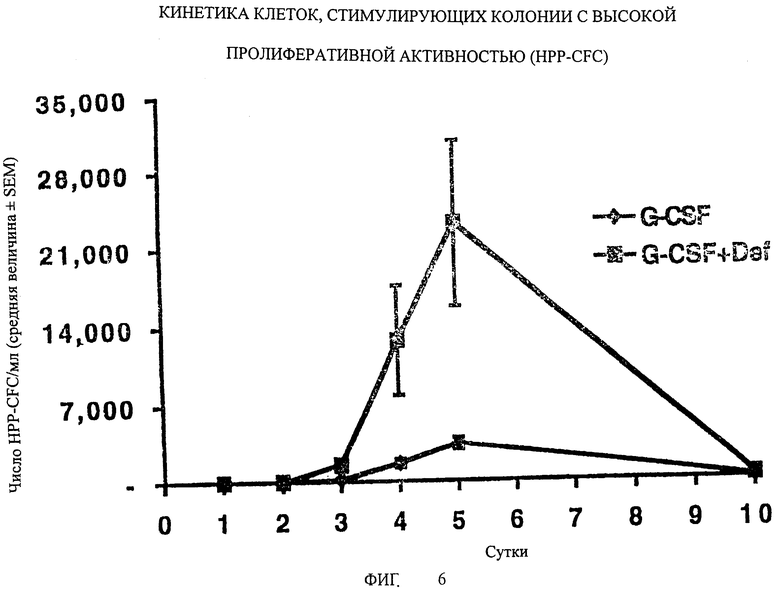
На Фигуре 6 показана кинетика клеток, стимулирующих колонии с высокой пролиферативной активностью (HPP-CFC).
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
Этот эксперимент проводят для того, чтобы оценить влияние от введения G-CSF и/или дефибротида на число лейкоцитов (WBC), присутствующих в крови мышей. Мышам BALB/c в возрасте от 6 до 8 недель с массой тела от 20 до 25 г внутрибрюшинно (IP) инъекцировали G-CSF (5 мкг/мышь в сутки), дефибротид (1 мг/мышь в сутки) или G-CSF (5 мкг/мышь в сутки) в комбинации с возрастающими дозами дефибротида (1, 10, 15 мг/мышь в сутки). Контрольной группе мышей, не получавшей G-CSF или дефибротид, внутрибрюшинно инъецировали PBS, содержащий до 1% мышиного сывороточного альбумина (PBS/MSA). Мышей обрабатывают в течение 5 суток и умерщвляют через 3 или 5 суток обработки, или через 3 суток после прекращения терапии. Результаты этого эксперимента приведены на фиг.1. Для представления каждой группы мышей использованы следующие символы: G-CSF ( ) (n=24), дефибротид 1 (
) (n=24), дефибротид 1 ( ) (n=3), G-CSF+ дефибротид 1 (
) (n=3), G-CSF+ дефибротид 1 ( ) (n=13), G-CSF+дефибротид 10 (
) (n=13), G-CSF+дефибротид 10 ( ) (n=6), G-CSF+ дефибротид 15 (
) (n=6), G-CSF+ дефибротид 15 ( ) (n=23). Среднее число лейкоцитов для контрольной группы мышей (PBS/MSA) составляло 2,87±0,2*106 мл крови; данные выражены как средняя величина±стандартная ошибка среднего (SEM).
) (n=23). Среднее число лейкоцитов для контрольной группы мышей (PBS/MSA) составляло 2,87±0,2*106 мл крови; данные выражены как средняя величина±стандартная ошибка среднего (SEM).
Пример 2
Кинетика активации клеток, образующих общие колонии (CFC), в 1 мл крови мышей из примера 1. Среднее число клеток CFC в PBS/MSA для контрольной группы мышей составляло 39±12 на 1 мл крови; данные приведены на фиг.2 и выражены как средняя величина±стандартная ошибка среднего (SEM), которые получены из дублированных культур на образцах для каждого животного в данный момент времени.
Пример 3
Изменения частоты суммарного количества клеток, образующих общие колонии (CFU-GM + BFU-E + CFU-Mix + HPP-CFC) на 105 клеток, покрытых слоем кровяного сгустка периферической крови, у мышей, упомянутых в примере 1. Среднее число клеток CFC в PBS/MSA для контрольной группы мышей составляло 3,5±1; данные приведены на фиг.3 и выражены как средняя величина ± стандартная ошибка среднего (SEM), которые получены из дублированных культур на образцах из каждого животного в данный момент времени.
Пример 4
Суммарное число клеток, образующих общие колонии (CFU-GM + BFU-E + CFU-Mix + HPP-CFC), на 1 мл крови через 5 суток обработки мышей из примера 1; данные приведены на фиг.4 и выражены как средняя величина±стандартная ошибка среднего (SEM), которые получены из дублированных культур на образцах из каждого животного.
Пример 5
Частота суммарного количества клеток, образующих общие колонии (CFU-GM + BFU-E + CFU-Mix + HPP-CFC) для 105 клеток, покрытых слоем кровяного сгустка периферической крови, у мышей, упомянутых в примере 1; данные приведены на фиг.5 и выражены как средняя величина±стандартная ошибка среднего (SEM), которые получены из дублированных культур на образцах из каждого животного.
Пример 6
Этот эксперимент проводят для того, чтобы оценить влияние от введения G-CSF и/или дефибротида на количество гематопоэтических клеток-предшественников/стволовых клеток (клетки, стимулирующие колонии с высокой пролиферативной активностью или HPP-CFC) в циркуляции в периферической крови обезьян. Исследование проводили на макак-резусах (Масаса mulatta) в возрасте 4-6 лет, имеющих хорошее здоровье и нормальные показатели гематологии и клинической химии. Фактор G-CSF вводили подкожно, 100 мкг/кг, в течение 5 суток, в двух циклах. Дефибротид вводили со скоростью 15 мкг/кг в час с помощью системы непрерывной инфузии в течение 5 суток, на втором цикле. Животных подвергали анестезии для забора крови, введения G-CSF и смены пакета лекарств. Результаты этого эксперимента приведены на фигуре 6, из которой можно оценить, что введение G-CSF в комбинациис дефибротидом обеспечивает уровень активации HPP-CFC у обезьян, который приблизительно в 8 раз выше, по сравнению с уровнем, достигаемым при введении одного G-CSF.
ВЫВОДЫ
Из данных, приведенных на фиг.1, следует, что введение G-CSF в комбинации с дефибротидом приводит к существенному увеличению количества лейкоцитов в циркулирующей крови мышей. В частности, следует отметить, что введение одного дефибротида не влияет на количество лейкоцитов в циркуляции крови. Следовательно, комбинация G-CSF и дефибротида обладает неожиданным эффектом (зависящим от дозы) - приводит к увеличению числа лейкоцитов, причем этот эффект не является простой суммой двух откликов, не зависящих друг от друга.
Фигуры 2-5 ясно демонстрируют, что введение G-CSF в комбинации с дефибротидом обеспечивает уровень активации у мышей, который гораздо выше (от 10 до 100 раз), чем уровень активации, полученный при введении одного G-CSF. Наконец, фиг.6 подтверждает, что введение G-CSF в комбинации с дефибротидом обеспечивает уровень активации стволовых клеток (HPP-CFC) у обезьян, который приблизительно в 8 раз выше, по сравнению с уровнем, достигаемым при введении одного G-CSF.
Эффект совместного введения двух активных ингредиентов зависит от дозы, поскольку уровень активации возрастает пропорционально количеству введенного дефибротида; во всех случаях пик наивысшей активации достигается приблизительно на пятые сутки после введения.
Изобретение относится к фармакологии и касается способа увеличения количества стволовых клеток и/или гематопоэтических клеток-предшественников в периферической крови млекопитающих; включающий введение дефибротида в комбинации или в непосредственной временной близости, по меньшей мере, с одним гематопоэтическим фактором (предпочтительно G-CSF), обладающим способностью активировать гематопоэтические клетки-предшественники. Изобретение обеспечивает повышение уровня стволовых клеток. 4 с. и 9 з.п. ф-лы, 6 ил.
| US 5223609 А, 29.06.1993 | |||
| US 5199942 А, 06.04.1993 | |||
| ПРОИЗВОДНЫЕ 2-МЕРКАПТОБЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОИШЕМИЧЕСКОЙ, АНТИАРИТМИЧЕСКОЙ И ПРОТИВОФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2136667C1 |
Авторы
Даты
2005-03-20—Публикация
2001-04-10—Подача