ОПИСАНИЕ
Настоящее изобретение относится к фосфолипидным комплексам проантоцианидина А2 или экстрактам, обогащенным проантоцианидином А2, и к их применению для изготовления лекарственных средств для профилактики и лечения атеросклероза и инфаркта миокарда и головного мозга.
Проантоцианидин А2 или 8,14-метан-2Н,14Н-1-бензопиран-[7,8-d][1,3]бензодиоксоцин-3, 5, 11, 13, 15-пентол-2,8-бис-(3,4-дигидроксифенил) 3, 4-дигидро [2R-2α, 3α, 8β, 14β, 15R)] формулы (I)
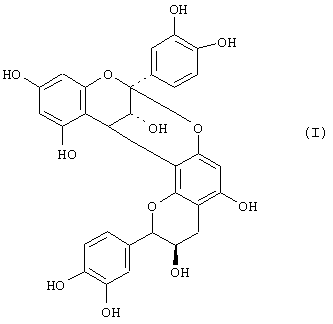
был выделен из семян Aesculus hippocastanum (Tetrahedron Lett., 429, 1966). Терапевтическое применение проантоцианидина А2 в качестве рубцующего, цитозащитного, противоязвенного, венотонического, вазозащитного и антипероксидативного агента описано а ЕР-А-210785 (4 февраля 1987 г.).
В настоящее время неожиданно было установлено, что фосфолипидные комплексы проантоцианидина А2 обладают выраженной антиатеросклеротической активностью как у животных, так и у человека при системном введении, предпочтительно, пероральным путем.
Комплексы по настоящему изобретению могут состоять из натуральных синтетических фосфолипидов, таких как лецитины, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин. Соотношение проантоцианидина А2 и фосфолипидов изменяется от 2:1 до 1:2, и, предпочтительно, составляет около 1:1,5 масс/масс. Особенно предпочтительным комплексом является комплекс с фосфатидилхолином сои.
Комплексы по настоящему изобретению получают взаимодействием раствора фосфолипида и раствора проантоцианидина А2 в подходящих растворителях, таких как ацетон, этилацетат, этанол, с последующей концентрацией реакционной смеси при пониженном давлении, с получением густого остатка, который можно размалывать.
Комплексы по настоящему изобретению в зависимости от доз предотвращают или уменьшают образование атеросклеротических бляшек. Указанная активность наблюдалась на кроликах, которые получали гиперхолестеринемический рацион для того, чтобы вызвать образование атеросклеротических повреждений, подобных таким повреждениям у человека, на сосудистом уровне, особенно, в дуге аорты, брюшной аорте, сонных артериях и сосудах головного мозга. На указанной модели вышеупомянутые фосфолипидные комплексы изменяют состояние сосудов на макро- и микуровнях, уменьшая, по сравнению с нелеченными животными как количество, так и тяжесть атероматозных бляшек, с удивительно благоприятным действием на сосуды и ткани. На другой модели атеросклероза, с целью защиты головного мозга, когда просвет внутренней сонной артерии кролика уменьшали хирургическим путем, а животные получали гиперхолестеринемический рацион, богатый насыщенными жирами, наблюдалось уменьшение обструкции сонных артерий, уменьшение толщины сосудистых стенок и повышение выживаемости животных. У пациентов, страдающих атеросклерозом, после шести месяцев лечения наблюдалось уменьшение обструкции сонных артерий, вызванной атероматозными бляшками, и улучшение кровотока через сонные артерии, что оценивали с помощью допплеровского ультразвукового исследования.
Фосфолипидные комплексы проантоцианидина А2 можно применять в виде лекарственных форм, подходящих для перорального введения, таких как таблетки, мягкие и твердые желатиновые капсулы, в дозах, в интервале от 50 до 500 мг, два - три раза в день, в зависимости от тяжести заболевания. Изготовление препаративных фармацевтических форм можно осуществлять с использованием обычных технологий и наполнителей.
Следующие ниже примеры иллюстрируют настоящее изобретение более подробно.
Пример 1
Получение комплекса проантоцианидина А2 с фосфатидилхолином
К раствору 1577 г фосфатидилхолина в 5 литрах этилацетата с температурой 70° добавляли раствор 1 кг проантоцианидината с температурой 70° добавляли раствор 1 кг проантоцианидина А2 в 5 литрах ацетона.
Смесь кипятили с обратным холодильником при перемешивании и выпаривали до сухости в вакууме. Остаток высушивали в вакууме при температуре 50°С в течение 24 ч, затем размалывали до получения частиц желаемого размера.
Пример 2
32 новозеландских кролика разделяли на 4 группы по 8 животных в каждой и обрабатывали следующим образом:
Группа 1): контроль, нормальный рацион
Группа 2): гиперхолестеринемический рацион (0,2 мас.% холестерина)
Группа 3): гиперхолестеринемический рацион + фосфолипидный комплекс проантоцианидина А2, экстракт (0,2 мас.% холестерина +2 мас.% комплекса примера 1).
Группа 4): гиперхолестеринемический рацион + экстракт проантоцианидина А2 (0,2 мас.% холестерина + проантоцианидин А2 в количестве, эквивалентном тому, которое имеется в 2 мас.% комплекса примера 1).
Спустя 8 недель лечения, в ходе которого измеряли уровни холестерина, ЛПНП/ЛПОНП, ЛПВП и триглицеридов, животных умерщвляли.
Оценивали количество, размер и распределение атеросклеротических повреждений в грудной и брюшной аорте.
Полоски аорты фиксировали и окрашивали Суданом IV для визуализации повреждений и оценки сосудистого холестерина и содержания окисленного холестерина с помощью газовой хроматографии.
Результаты, представленные в следующей таблице, доказывают, что лечение фосфолипидными комплексами проантоцианидина А2 заболеваний статистически достоверным образом уменьшает атеросклеротические повреждения, индуцированные гиперхолестеринемическим рационом.
*р<0,01 по сравнению с группой 2.
Пример 3
Капсулы, содержащие 500 мг фосфолипидного комплекса проантоцианидина А2.
Состав:
Комплекс проантоцианидина А2 с фосфатидилхолином сои 150 мг
Лактоза 57 мг
Модифицированный крахмал 40 мг
Стеарат магния 3,0 мг
Пример 4
Энтеросолюбильные таблетки
Комплекс проантоцианидина А2 с фосфатидилхолином сои 200 мг
Микрокристаллическая целлюлоза 118 мг
Осажденный диоксид кремния 3 мг
Стеарат магния 4 мг
Анионный полимер метакриловой кислоты
и его сложные эфиры 12 мг
Тальк 8 мг
Карбонат магния 8 мг
Кукурузный крахмал 5 мг
Аравийская камедь 159 мг
Пример 5
Мягкие желатиновые капсулы
Комплекс проантоцианидина А2 с фосфатидилхолином сои 216 мг
Арахисовое масло 209 мг
Частично гидрогенизированные растительные масла 100 мг
Лецитин сои 5 мг
Пример 6
Данные физико-химических исследований комплекса проантоцианидина А2 с фосфатидилхолином при массовом соотношении 1:1,5 (масс/масс)
Обозначения
Проантоцианидин А2 представляет собой димер эпикатецина типа А, а именно эпикатецин-(2β→7, 2β→7)-эпикатецин, в котором две единицы эпикатецина связаны через С-4 - С-8 и С-2 - О-7 связи.
Фосфатидилхолин (торговое наименование (Phospholipon® 90G) представляет собой очищенный фосфатидилхолин, полученный из лецитина сои.
Ниже представленные данные растворимости, термогравиметрического/дифференциального термического анализа (профиль ТГ/ДТА), ИК-спектроскопии, 1Н-ЯМР и 13С ЯМР спектроскопии для комплекса проантоцианидина А2 с фосфатидилхолином при массовом соотношении 1:1,5 (масс/масс) индивидуальных соединений проантоцианидина А2 и фосфатидилхолина, а также для физической смеси фосфатидилхолином в том же весовом соотношении.
1. Профиль растворимости
Растворимость комплекса проантоцианидина А2 с фосфатидилхолином в сравнении со смесью проантоцианидин А2/фосфатидилхолин испытывали в соответствии с методикой, описанной в Eur.Ph., III Ed.
2.Термический анализ
Методика и оборудование
Установка для термогравиметрического/дифференциального термического анализа (ТГ/ДТА) Seiko 6200 с программой EXTAR 6000 ver. 5.7, с использованием открытого алюминиевого тигля (⊘ 6 мм). Поток тепла регистрировали от 25°С до 300°С с линейной скоростью нагрева 5°С/мин под током азота 200 мл/мин. ТГ/ДТА нормализовали на основе массы.
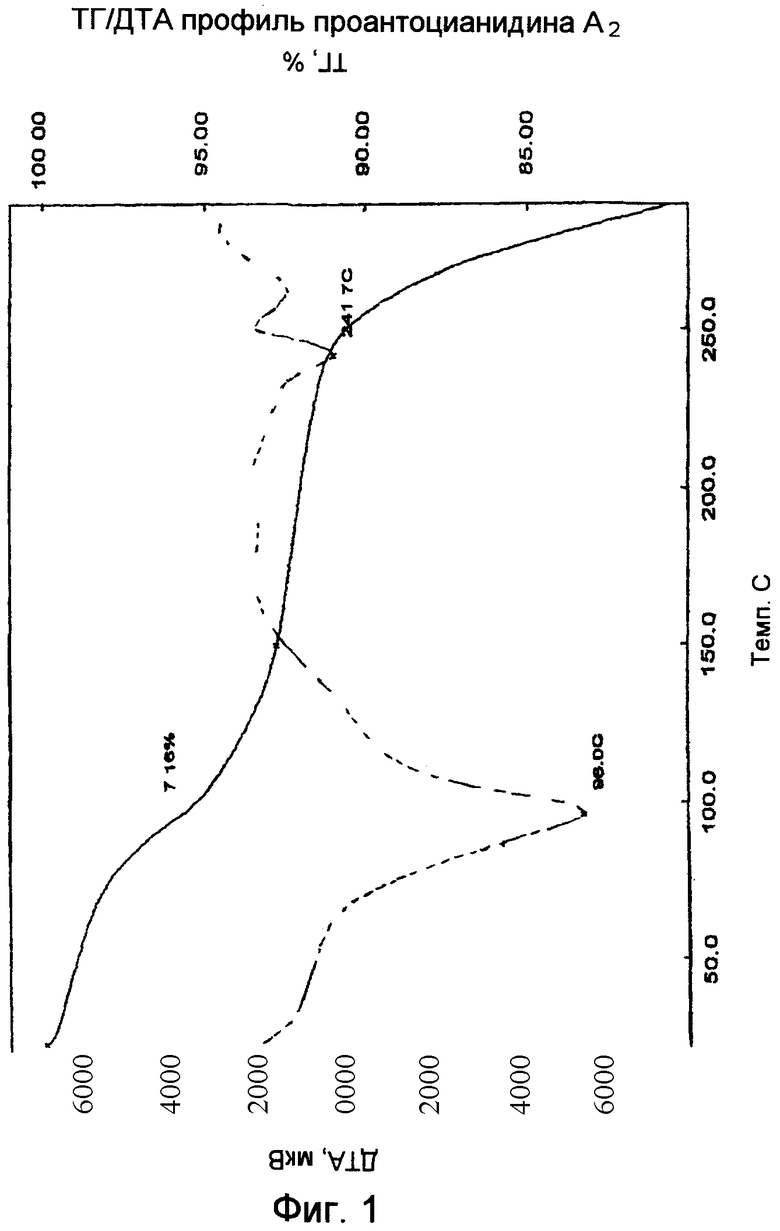
Проантоцианидин А2
ТГ/ДТА профиль (термогравиметрический/дифференциальный термический анализ) показывает высвобождение растворителя кристаллизации при 96°С с соответствующей потерей массы 7,2%, что согласуется с бигидратом. Процесс разложения наблюдают после 240°С с пиком ДТА при 241,7° (Фиг.1).
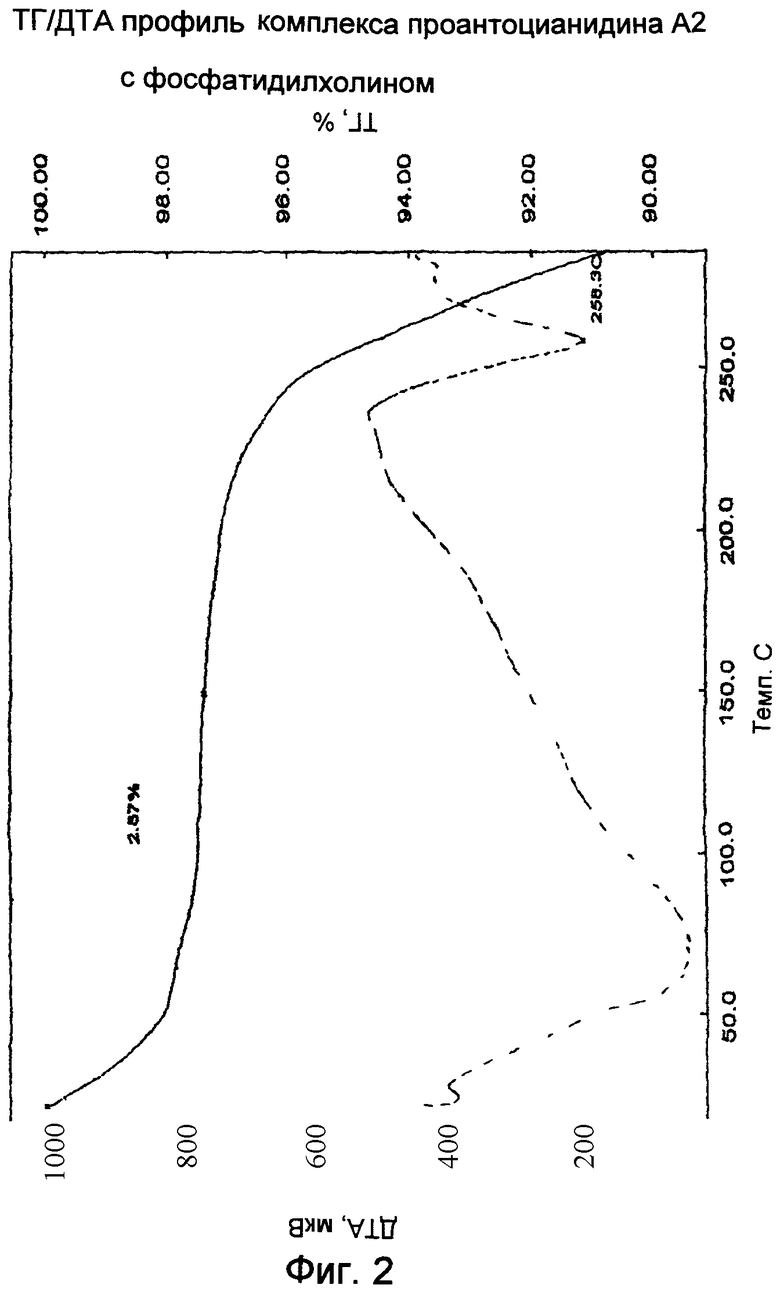
Комплекс проантоцианидина А2 с фосфатидилхолином
Профиль не показывает эндотермического пика из-за потери растворителя кристаллизации. Потеря при сушке, составляющая 2,57%, может быть отнесена за счет потери несвязанного растворителя. Процесс разложения начинается при примерно 200°С с переходом при 258,3°С. Твердое состояние проантоцианидина А2 в фитосоме отличается от чистого вещества (Фиг.2).
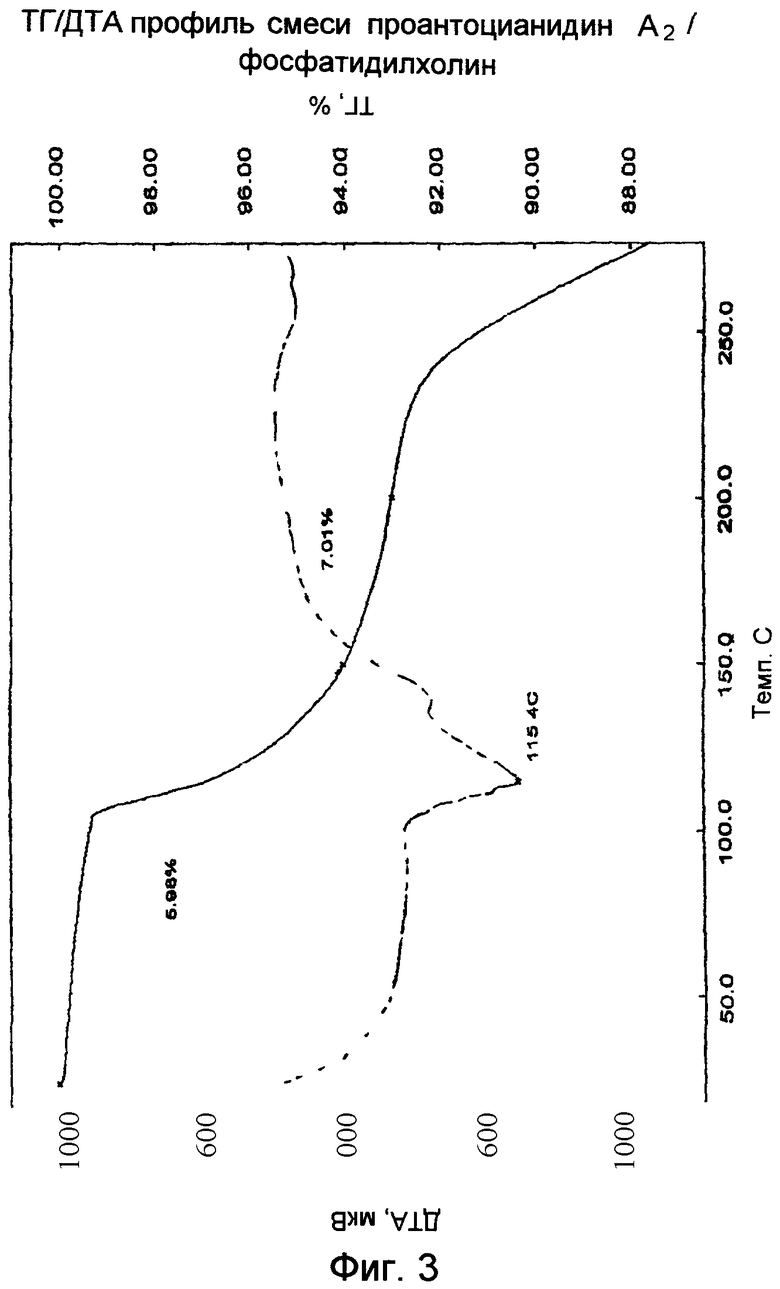
Смесь проантоцианидин А2/фосфатидилхолин
Хотя термический профиль показывает поведение, подобное наблюдаемому для проантоцианидина А2, наблюдали потерю растворителя кристаллизации (8,15%) с переходом при 108,7°С с последующей дополнительной потерей растворителя (например, воды в липидах). Общая потеря массы составила 9,66%. Твердое состояние отличается, и никакого перехода не происходит при температуре выше 240°С (Фиг.3).
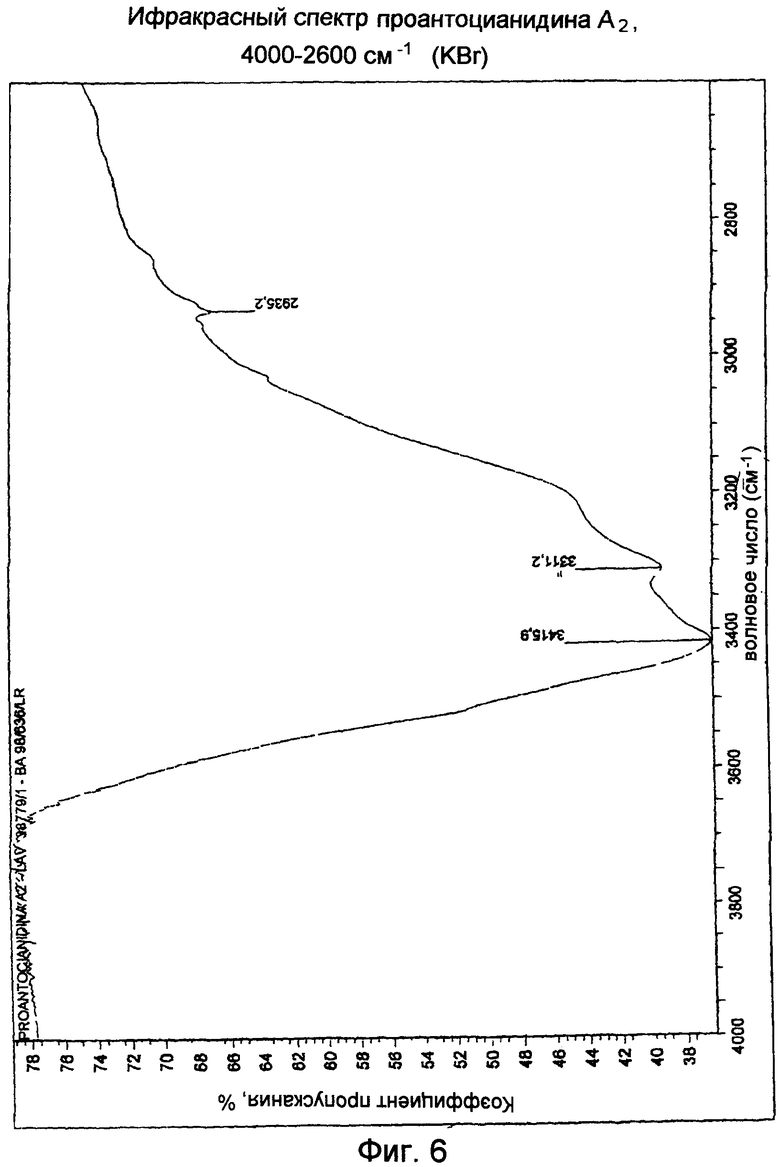
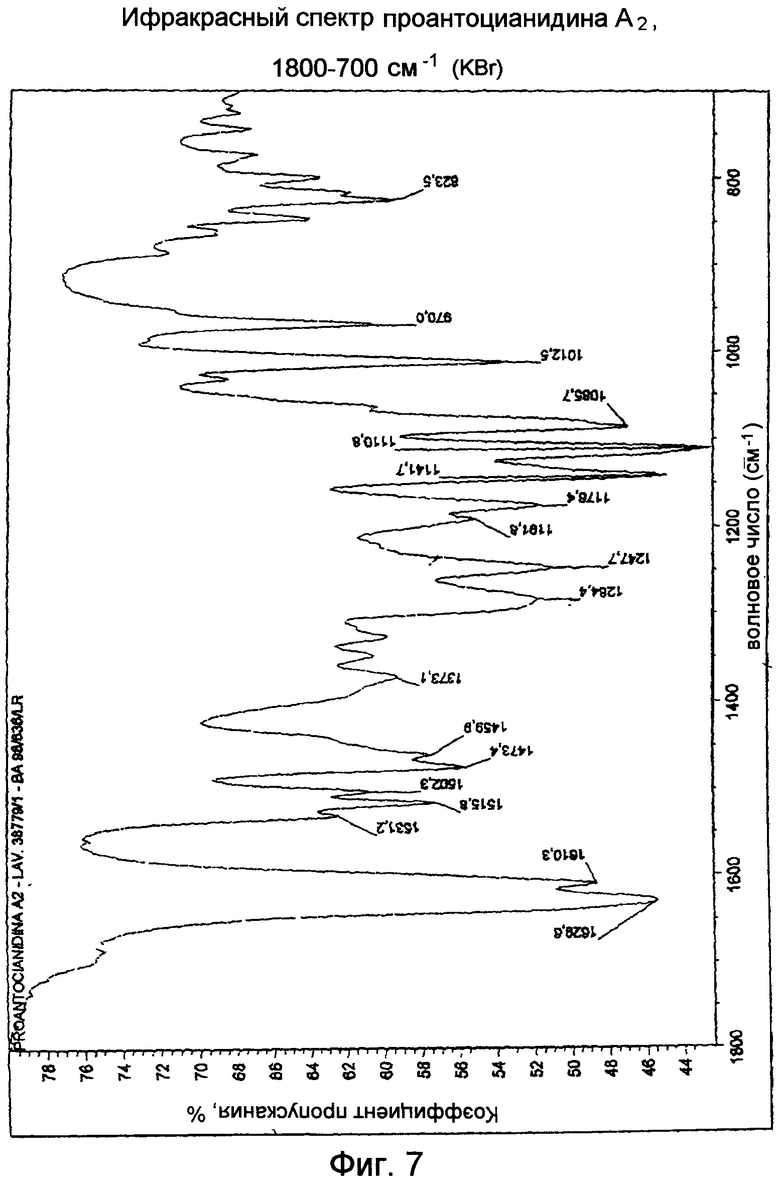
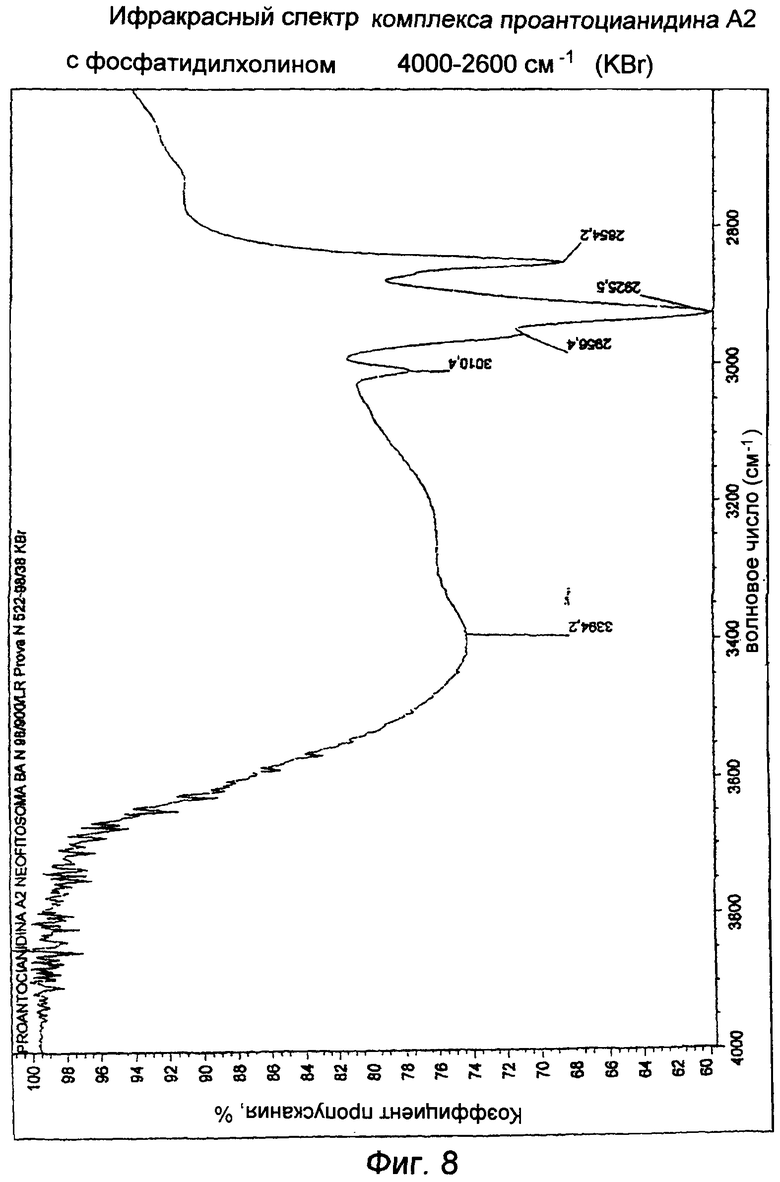
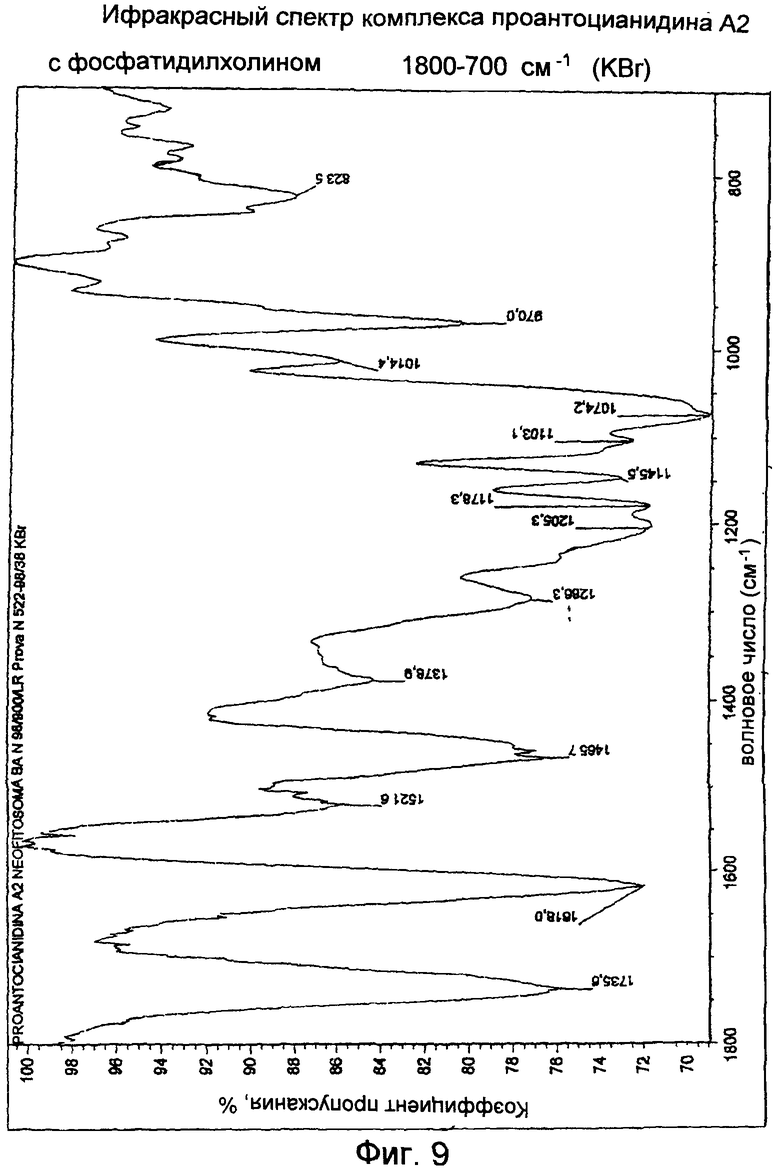
3. Инфракрасный спектр
Методика и оборудование
ИК-спектры записывали на спектрометре Маgnа 550 Series II с Фурье преобразованием. Спектры проантоцианидина А2 и комплекса проантоцианидина А2 с фосфатидилхолином получали с использованием пластины КВг (степень чистоты для спектроскопии), спектры фосфатидилхолина и смеси проантоцианидин А2/ фосфатидилхолин - в ячейке NaCl. Оборудование было снабжено оптической скамьей, стандартным детектором DTGS, расщепителем КВr и программой OMNIC ver. 5.1. Спектр получали как результат сбора и преобразования совокупности 32 сканов в области спектра 4000-400 см-1, при разрешении 4 см-1.
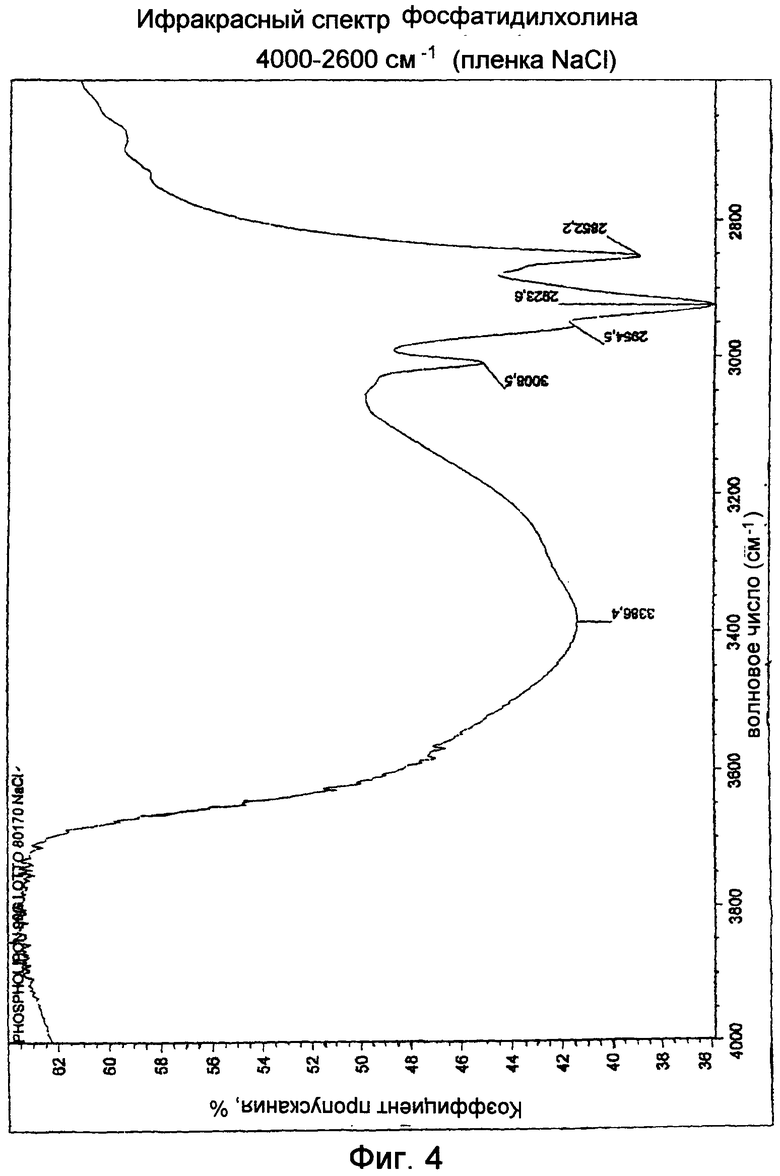
Фосфатидилхолин
Инфракрасный спектр (Фиг.4, 5) показывает симметричные и асимметричные вытянутые полосы для групп СН2 при 2852 и 2924 см-1, глубокую полосу поглощения группы СН2 при 1466 см-1, и вытянутую полосу для С=О при 1736 см-1, симметричные и асимметричные вытянутые полосы поглощения фосфатной группы при 1088 и 1236 см-1. При 968 см-1 присутствует также полоса, показывающая внеплоскостной изгиб ("извивы") С-Н на трансдвойной связи. Это согласуется с составом ацильных остатков (олеиновой кислоты 10±3%, линолевой кислоты 66±5%, линоленовой кислоты 5±3%), известным для данного продукта.
Проантоцианидин А2
Основные полосы поглощения представляют сильное искривление для Н-О-Н при 1630-1610 см-1 (это согласуется с бигидратом), глубокую полосу поглощения СН2 при около 1470 см-1, вытянутые полосы поглощения фенольной и спиртовой группы С-ОН при 1247 и 1112 см-1, соответственно (Фиг.6, 7).
Комплекс проантоцианидина А2 с фосфатидилхолином
Инфракрасный спектр показывает вытянутую полосу поглощения группы С=О при 1735 см-1, изгиб Н-О-Н при 1618 см-1. Две сильные полосы поглощения наблюдали при 1076 и 1203-1179 см-1. Эти полосы приписывают сдвигу к более низким волновым числам симметрической и антисимметрической вытянутых полос поглощения фосфатной группы. Также присутствует полоса поглощения ненасыщенного ацильного остатка при 969 см-1 (Фиг.8, 9).
Смесь проантоцианидин А2/ фосфатидилхолин
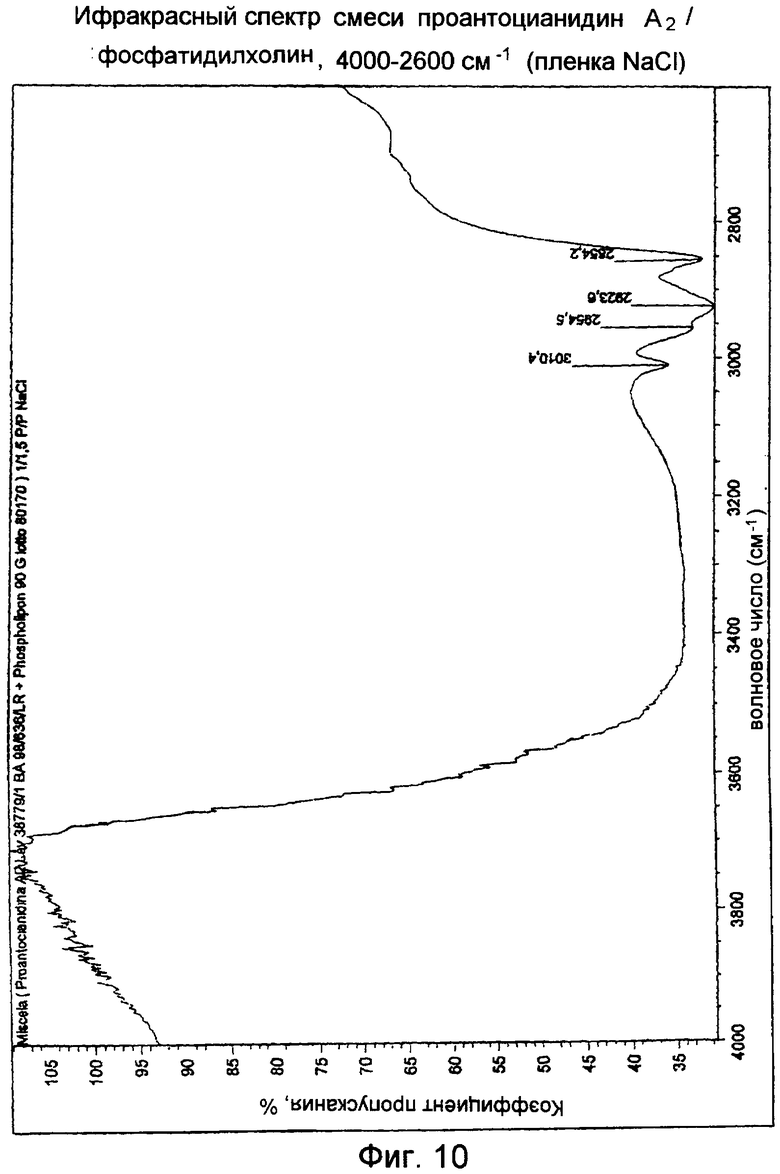
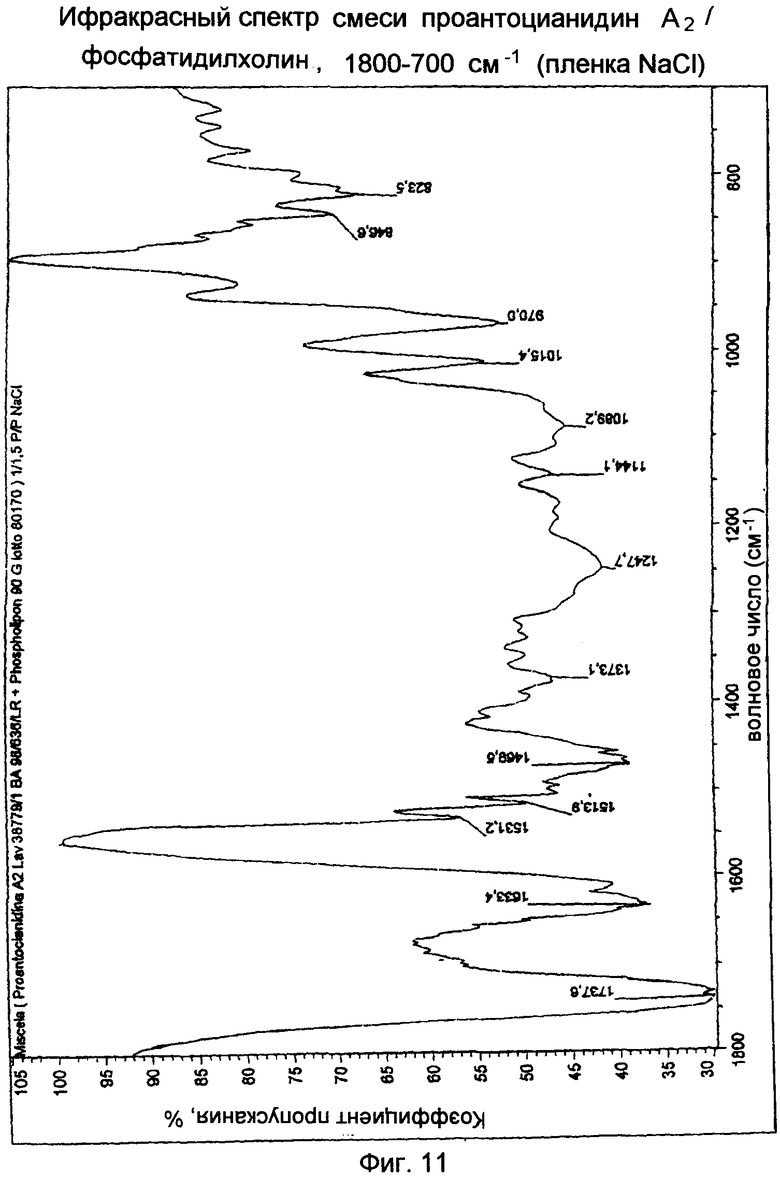
Инфракрасный спектр показывает широкие полосы поглощения в области 1300-900 см-1, без присутствия двух полос при 1076 и 1203-1179 см-1. Кроме того, полосы поглощения при 1088 и 968 перекрываются полосами поглощения фосфатидилхолина (Фиг.10, 11).
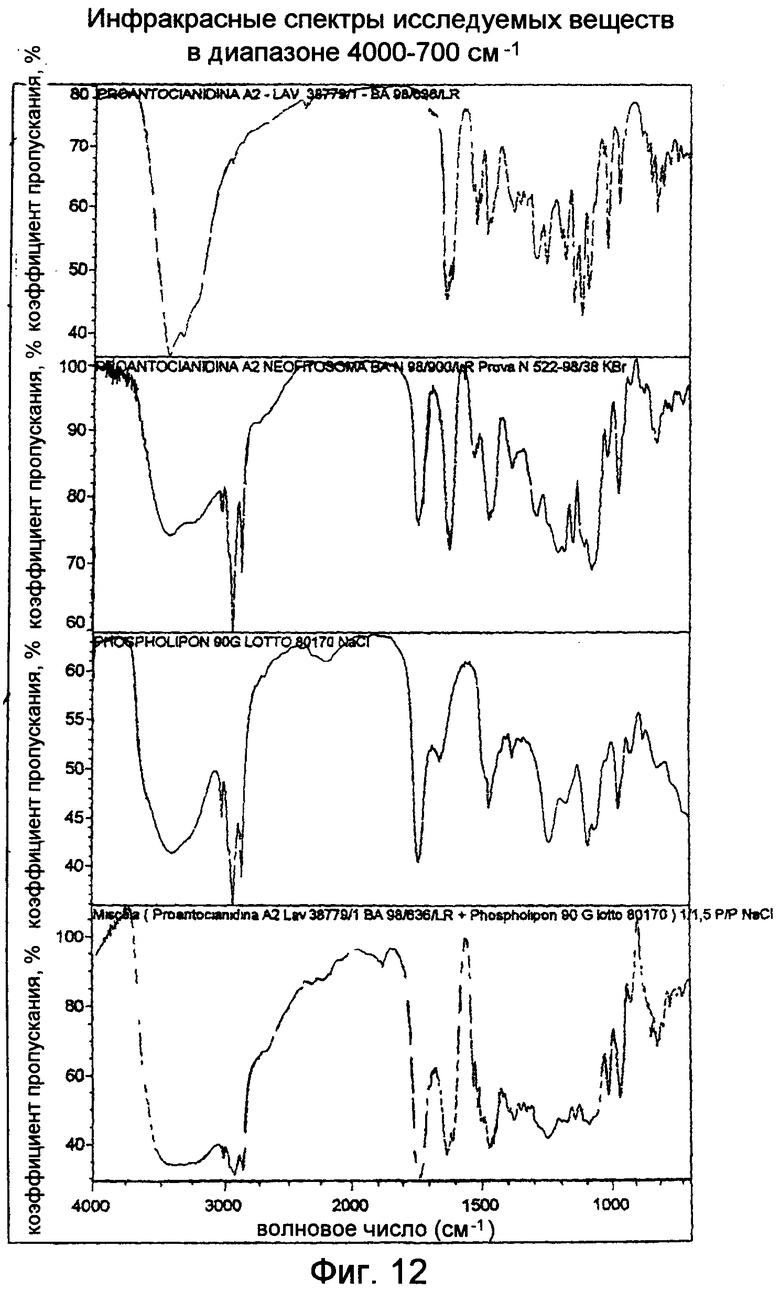
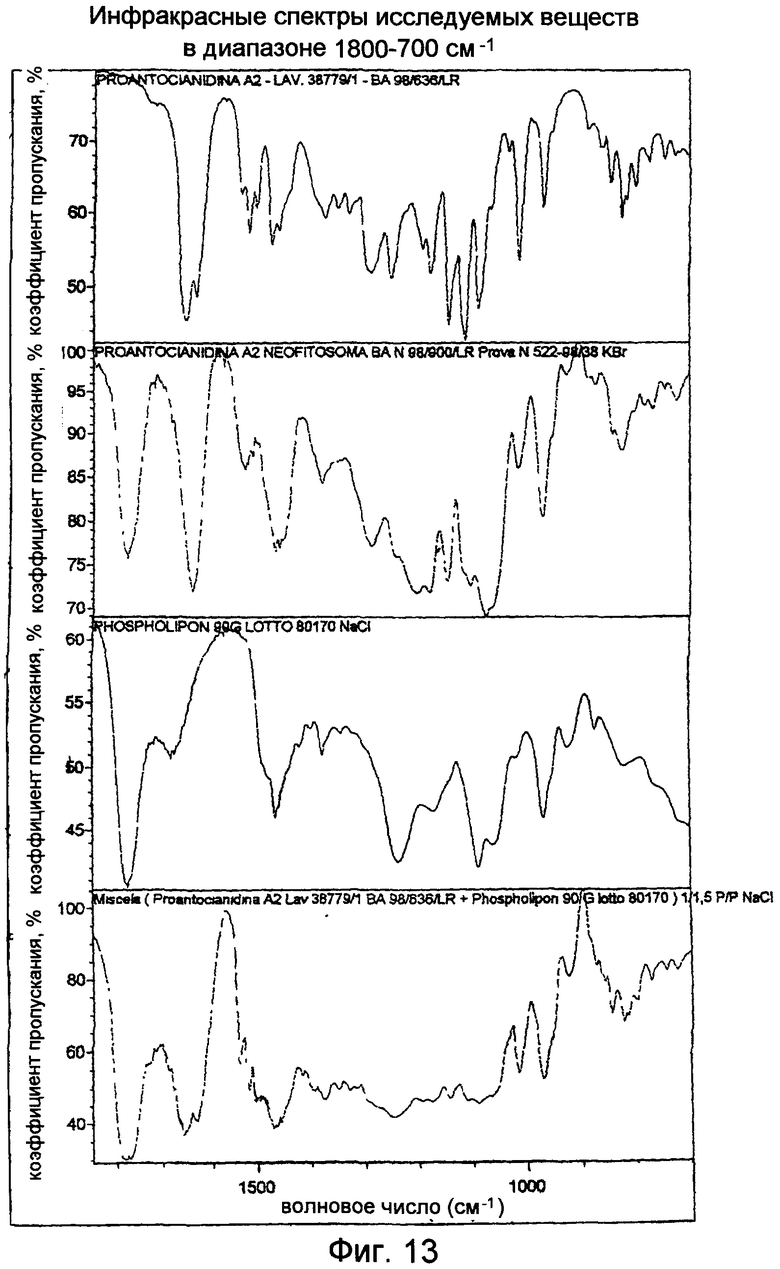
ИК-спектры четырех рассматриваемых продуктов представлены на Фиг.12, 13.
4. Спектры 1Н-ЯМР
Методика и оборудование
Спектры ЯМР получали в CDCl3 или ДМСО-d6 (чистота для анализа ЯМР) при 300 МГц (1Н) на установке VARIAN INOVA 300 МГц с программой VNMRTM ver. 6.1.b, снабженной 5 мм переключаемым широкополосным датчиком. Использовали трубку Wilmad 528-PP (7"×5 мм). Температура 30°С.
Мультиплетность атомов углерода устанавливали с использованием эксперимента DEPT (неискажаемое усиление при переносе поляризации).
Химические сдвиги соотносили с тетраметилсиланом (чистота для анализа ЯМР) при 0 м.д. в качестве внешнего стандарта.
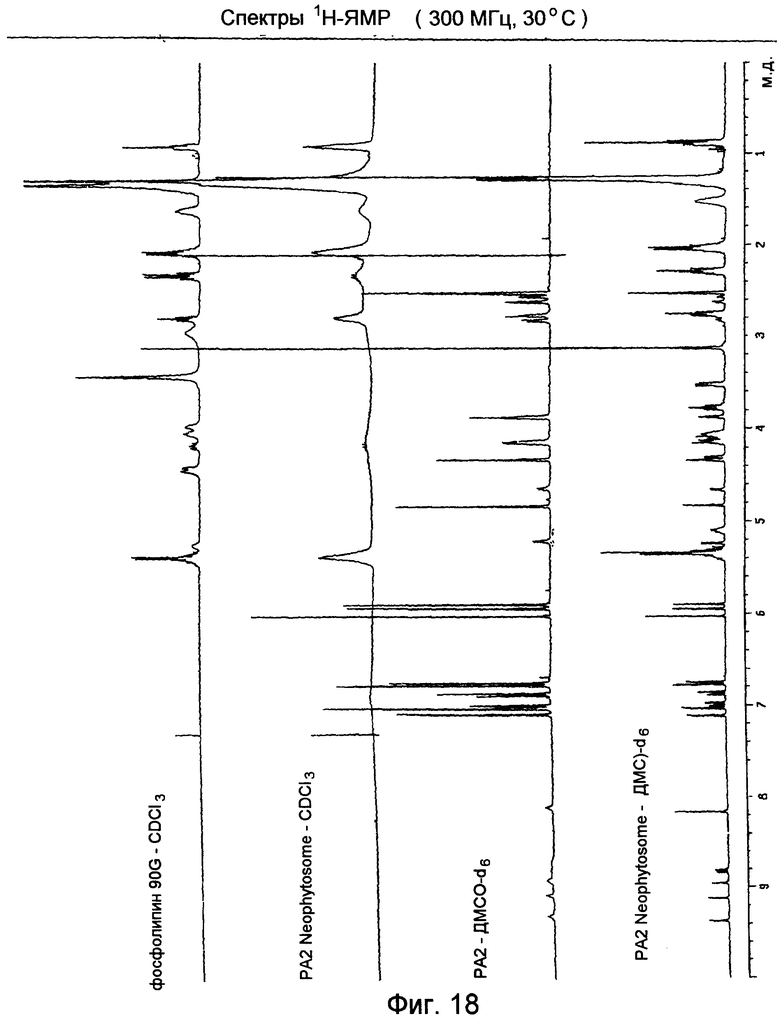
Спектры фосфатидилхолина и комплекса проантоцианидина А2 с фосфатидилхолином можно получать в CDCl3, тогда как спектр проантоцианидина A2 получают в ДМСO-d6, в соответствии с профилем растворимости.
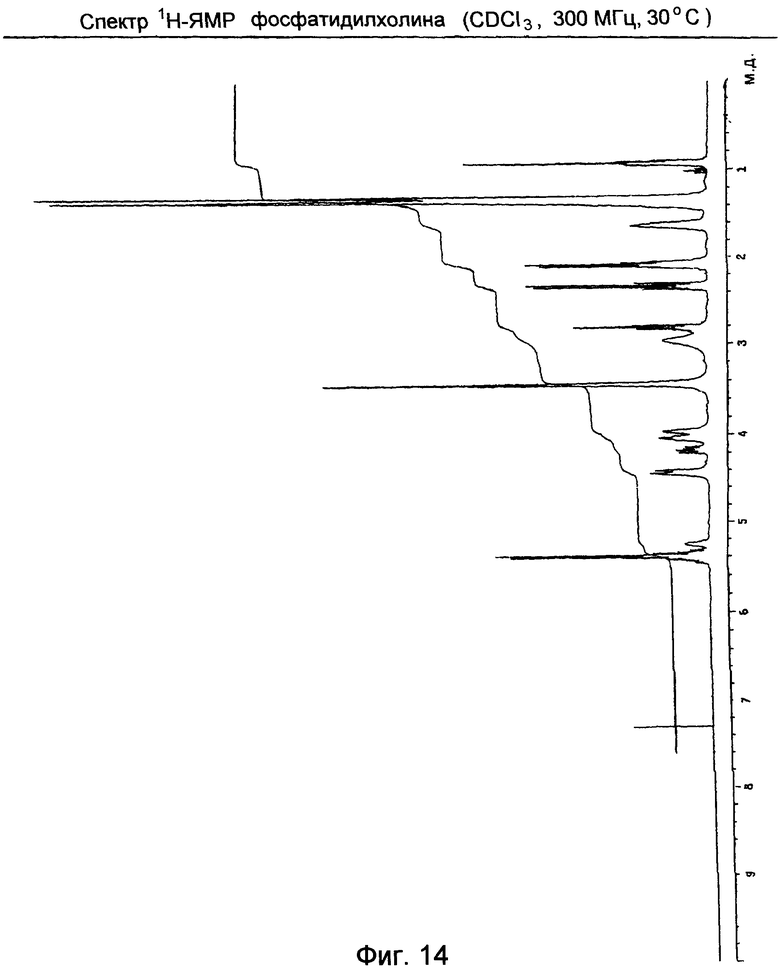
Фосфатидилхолин (Спектр 1H-ЯМР на Фиг.14)
- концевая метильная группа при 0,93 м.д.
- СН2 на основной длинной цепи при 1,32, 1,64, 2,09, 2,34 и 2,81 м.д.
- NMe
- протоны на двойных связях и сложноэфирной группе при около 5,3-5,4 м.д.
- мультиплеты при 4,16-4,42 м.д.: СН и СН2 на глицериновой части.
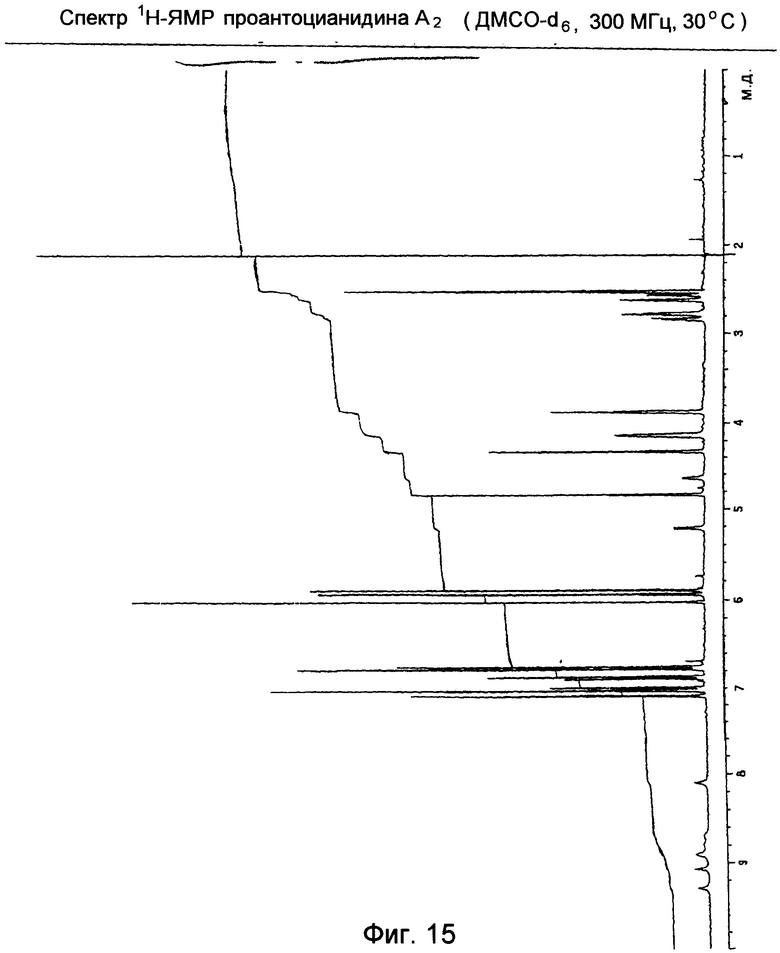
Проантоцианидин А2 (Спектр 1H-ЯМР на Фиг.15)
Протонный спектр, полученный в ДМСО-d6, показывает следующие сигналы:
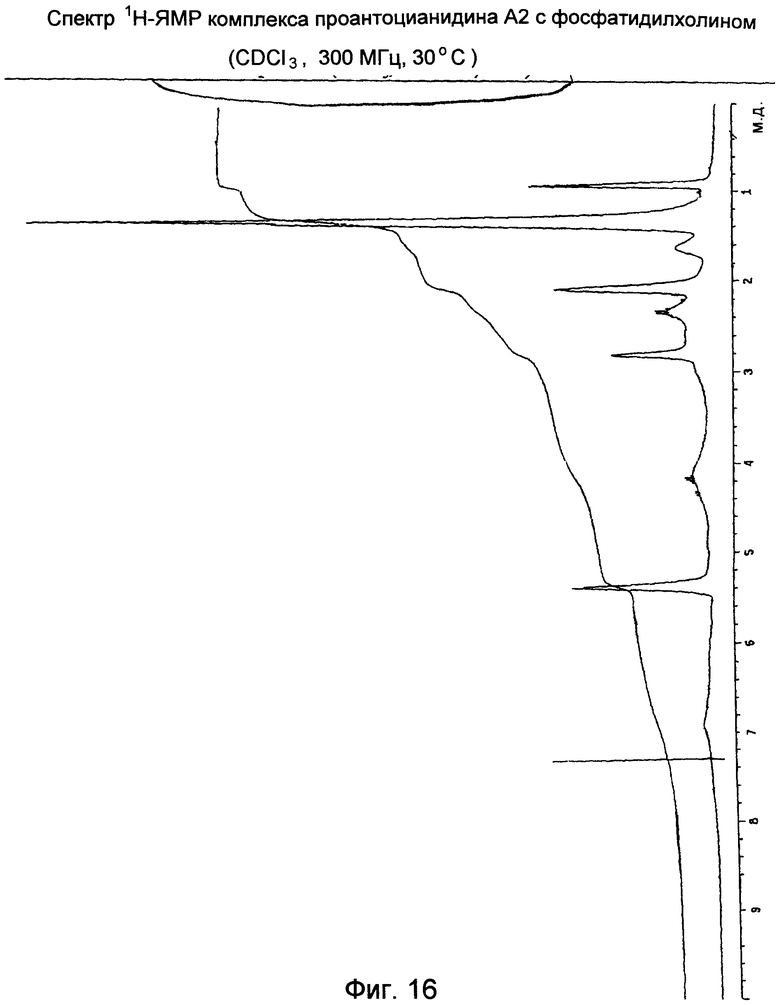
Комплекс проантоцианидина А2 с фосфатидилхолином (Спектр 1H-ЯМР на Фиг.16)
Спектр показывает очень широкие сигналы с отсутствием разрешения, что согласуется с сильным изменением времени релаксации протонов. Сигнал, соответсвующий полярной головной группе NMе
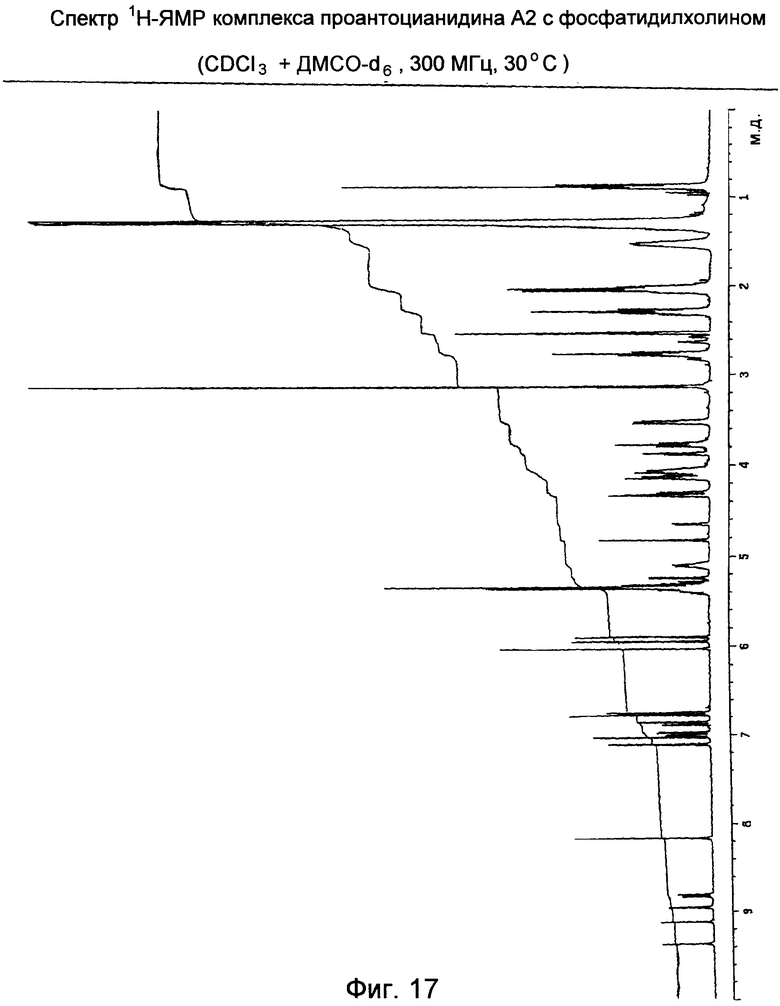
Спектр комплекса, полученный после добавления ДМСО-d6 (Фиг.17), показывает резонанс и фосфатидилхолина и проантоцианидина A2. Добавление полярного растворителя влияет на взаимодействие между двумя молекулами с получением спектра с узкими пиками, соответствующими смеси двух веществ без взаимодействия.
Спектрограммы представлены на Фиг.18.
5. Спектры 13С ЯМР
Методика и оборудование
Спектры ЯМР получали в СDСl3 или ДМСО-d6 (чистота для анализа ЯМР) при 75 МГц (13С) на установке VARIAN INOVA 300 МГц с программой VNMRTM ver. 6.1.b, снабженной 5 мм переключаемым широкополостным датчиком. Использовали трубку Wilmad 528-PP (7"×5 мм). Температура 30°С.
Мультиплетность атомов углерода устанавливали с использованием эксперимента DEPT (неискажаемое усиление при переносе поляризации).
Химические сдвиги соотносили с тетраметилсиланом (чистота для анализа ЯМР) при 0 м.д. в качестве внешнего стандарта.
Спектры фосфатидилхолина и комплекса проантоцианидина А2 с фосфатидилхолином можно получать в СDСl3, тогда как спектр проантоцианидина А2 получают в ДМСО-d6, в соответствии с профилем растворимости.
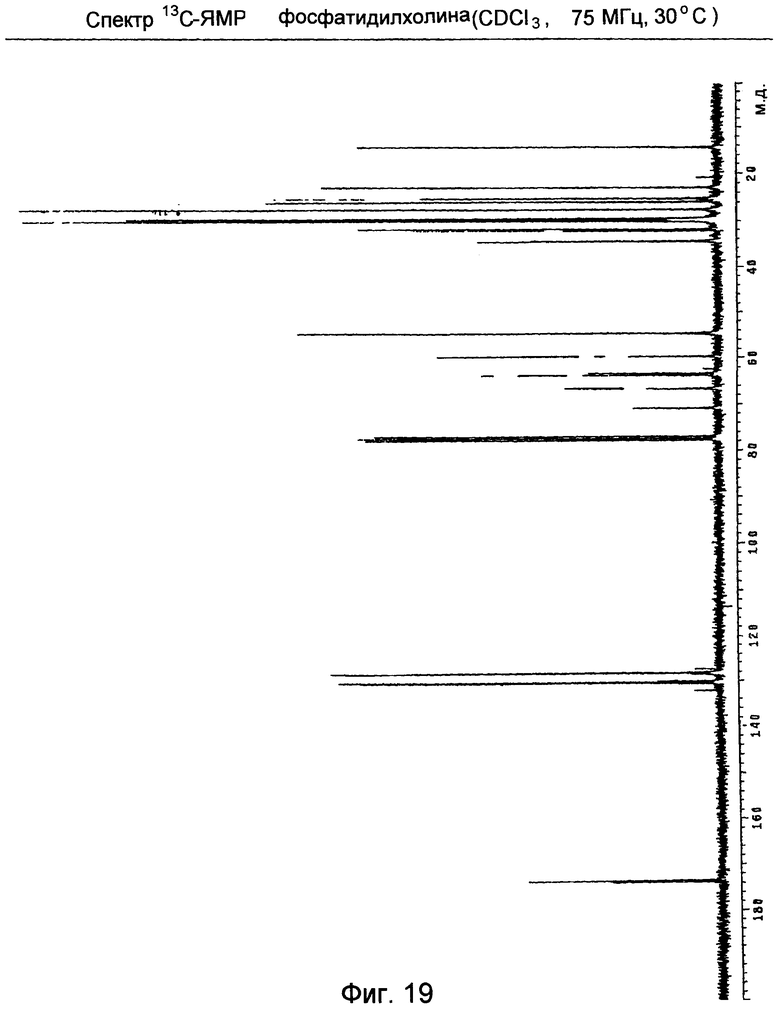
Фосфатидилхолин (Спектр 13С-ЯМР на Фиг.19)
- карбоксильные группы при 173,8, 173,7 и 173,4 м.д.
- олефиновые углерода (основной длинной цепи) при 128,1, 128,3, 129,9, 130,2 и 130,4 м.д.
- метиновая группа глицерина, дублет (связывание с фосфором) при 70,8 и 70,7 м.д. (Jc-p=7,4 Гц)
- метиленовая группа глицерина, дублеты (связывание с фосфором) при 66,6 и 66,5 м.д. (Jc-p=7,5 Гц) и при 63,7 и 63,6 м.д. (Jc-p=5,5 Гц)
- метилен на карбоксильной группе (RO-CH2-CHOR-CH2-OP) при 63,2 м.д., без связывания С-Р
- метилен, содержащий группу азота при 59,6 м.д. (как С-Р связанный дублет, Jc-p=4,8 Гц)
- группа тетраметиламмония при 54,6 м.д.
- метиленовые группы на основной длинной цепи в области 34,5-22,8 м.д.
- концевые метильные группы на длинноцепочечной основной цепи при 14,3 м.д.
Проантоцианидин А2 (Спектр 13С-ЯМР на Фиг.20)
Спектр, полученный в ДМСO-d6, показывает следующие сигналы
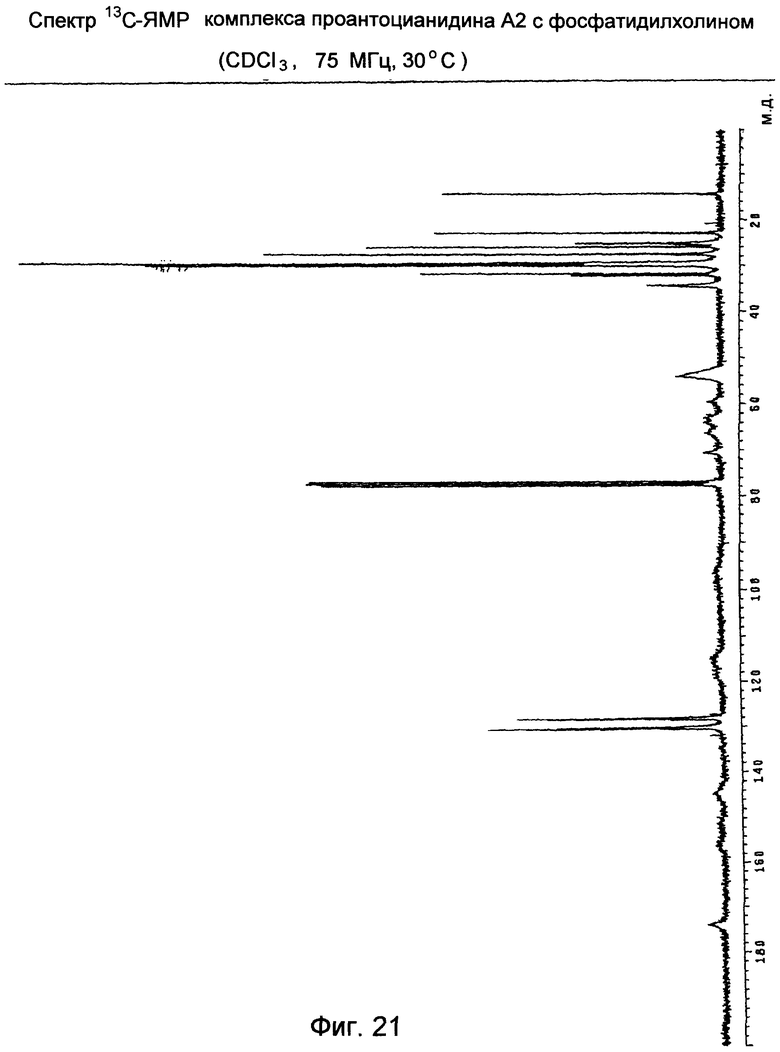
Комплекс проантоцианидина А2 с фосфатидилхолином (Спектр 13С-ЯМР на Фиг.21)
Спектр показывает широкие сигналы с отсутствием разрешения, что согласуется с сильным изменением времени релаксации атомов углерода. Резкий сигнал, соответствующий полярной головной группе NHMe
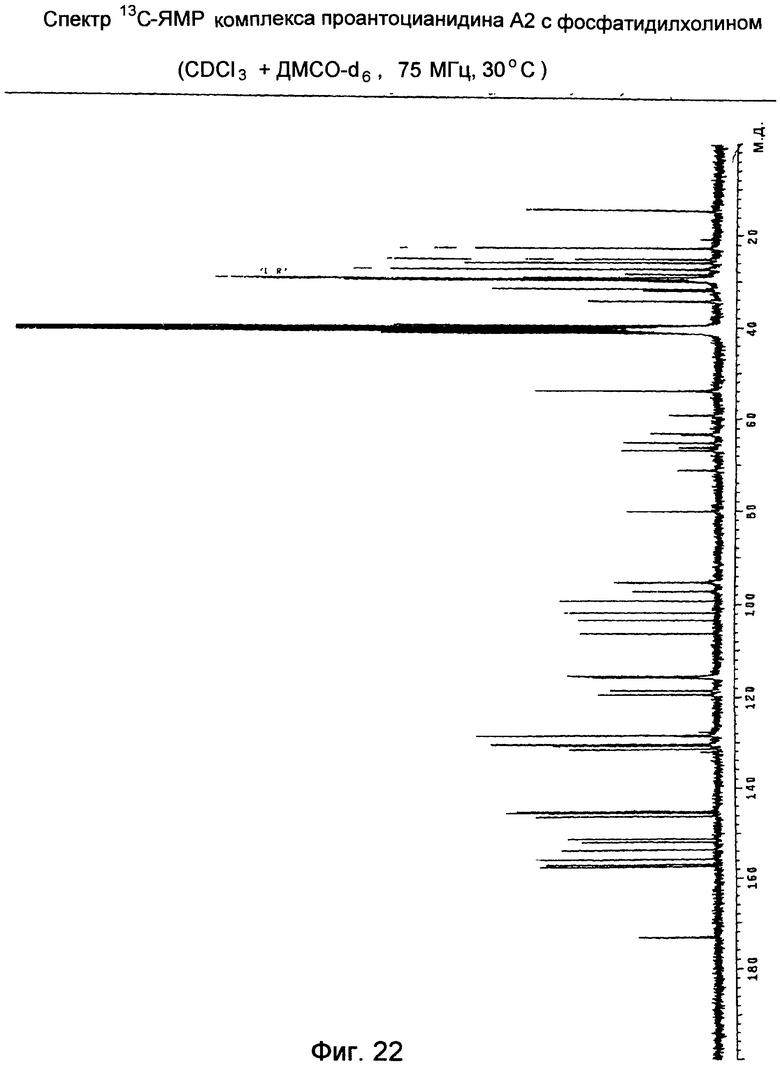
Как уже описывалось в §4, добавление ДМСО-d6 (Фиг.22) обеспечивает распад комплекса, образованного двумя молекулами, с получением спектра, в котором эти два вещества легкораспознаваемы.
ВЫВОДЫ
Представленные данные свидетельствуют о том, что комплекс проантоцианидина А2 с фосфатидилхолином представляет собой продукт, в котором полярная головная группа липидной фракции вступает в сильное взаимодействие с молекулой проантоцианидина А2. Ацильные группы длинной цепи фосфатидилхолина не вовлечены в комплексообразование. Характерной особенностью комплекса проантоцианидина А2 с фосфатидилхолином является повышенная липофильность, как продемонстрировано профилем растворимости, что обеспечивает быстрое растворение проантоцианидина А2 в неполярных растворителях, таких как хлороформ и толуол. Комплекс может быть разрушен добавлением полярного растворителя, который изменяет процесс взаимодействия между двумя веществами. Экспериментальные данные с очевидностью показывают различие между комплексом и смесью проантоцианидина А2/ фосфатидилхолин.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОСФОЛИПИДНЫЕ КОМПЛЕКСЫ КУРКУМИНА, ОБЛАДАЮЩИЕ УЛУЧШЕННОЙ БИОДОСТУПНОСТЬЮ | 2007 |
|
RU2450818C2 |
| ФОСФОЛИПИДНЫЕ КОМПЛЕКСЫ ИЗ ЭКСТРАКТОВ ЛИСТЬЕВ ИЛИ ПЛОДОВ МАСЛИНЫ, ОБЛАДАЮЩИЕ УЛУЧШЕННОЙ БИОДОСТУПНОСТЬЮ | 2007 |
|
RU2432169C2 |
| Новые флуоресцентные производные α-гидрокси-бисфосфонатов в качестве ингибиторов солеотложений и способы их получения | 2018 |
|
RU2699104C1 |
| Способ получения замещенных 2-илиден-1,3-дитиоланов | 2018 |
|
RU2686338C1 |
| ПРИМЕНЕНИЕ ФОСФОЛИПИДНЫХ КОМПЛЕКСОВ ЭКСТРАКТОВ ИЗ vitis vinifera В КАЧЕСТВЕ ПРОТИВОАТЕРОСКЛЕРОТИЧЕСКИХ АГЕНТОВ | 1998 |
|
RU2207866C2 |
| АДДУКТЫ ТРИАЛЛИЛБОРАНОВ С АММИАКОМ И АМИНАМИ В КАЧЕСТВЕ АЛЛИЛИРУЮЩИХ РЕАГЕНТОВ | 2018 |
|
RU2678208C1 |
| АЗОСОЕДИНЕНИЯ НА ОСНОВЕ 4-АМИНО-2,3',4'-ТРИЦИАНОДИФЕНИЛА | 2011 |
|
RU2479573C1 |
| НОВЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2395493C2 |
| Производные 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4Н)-ил)-2,2-дифторэтанонов, способ их получения и их применение в качестве фотогенераторов кислоты | 2020 |
|
RU2750297C1 |
| Комплексы цинка и кадмия N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидов, обладающие люминесцентной активностью | 2017 |
|
RU2650529C1 |


Предложено: фосфолипидные комплексы проантоцианидина А2 и фармацевтические композиции на их основе в качестве антиатеросклеротических агентов, агентов для профилактики и лечения инфаркта миокарда и головного мозга. Фосфолипиды комплекса предпочтительно выбирают из лецитинов, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина. Изобретение обеспечивает средство для лечения перечисленных заболеваний путем уменьшения количества и тяжести атероматозных бляшек, уменьшения обструкции сонных артерий и уменьшения толщины сосудистых стенок. 2 с. и 7 з.п. ф-лы, 4 табл., 22 ил.
| US 5648377 А, 15.07.1997 | |||
| US 4963527 A, 16.10.1990 | |||
| ФАРМКОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С НАРУШЕНИЕМ ОБМЕНА ВЕЩЕСТВ | 1991 |
|
RU2093154C1 |
| АВТОНОМНЫЙ ГЛУБИННЫЙ ТЕРМОМЕТР | 0 |
|
SU210785A1 |
| Устройство для штамповки | 1978 |
|
SU713706A1 |
Авторы
Даты
2005-03-27—Публикация
1999-12-13—Подача