Изобретение относится к новым соединениям в ряду металлохелатов цинка и кадмия бидентатных азометиновых лигандов на основе 2-N-тозиламинобензальдегида, а именно к не описанным раннее комплексам бис-[N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидов]цинка(II) и кадмия(II) общей формулы I и цвиттерионных комплексов цинка(II) и кадмия(II) N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидов, общей формулы II
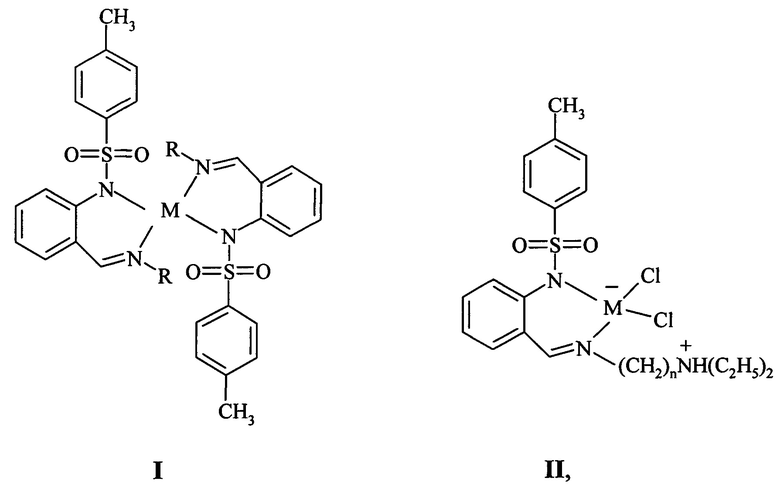
где R= СН2СН=СН2, CH2CH2N(C2H5)2, CH2CH2CH2N(C2H5)2, СН2СН2Р(С6Н5)2; M=Zn, Cd; n=2, 3, например, при условии:
Ia R= СН2СН=СН2, M=Zn; Ib R= CH2CH=CH2, M=Cd; Ic R= CH2CH2N(C2H5)2, M=Zn; Id R= CH2CH2N(C2H5)2, M=Cd; Ie R= CH2CH2CH2N(C2H5)2, M=Zn; If R= CH2CH2CH2N(C2H5)2, M=Cd; Ig R= CH2CH2P(С6Н5)2, M=Zn; IIa M=Zn, n=2; IIb M=Zn, n=3; IIc M=Cd, n=2; IId M=Cd, n=3
Металлокомплексные соединения I, II обладают фотолюминесцентными (ФЛ) свойствами, излучают в сине-фиолетовой области спектра и могут быть использованы в качестве фотолюминесцентных материалов, в частности при создании светоизлучающих органических диодов (OLED) белого и видимого света в качестве электролюминесцентных слоев.
Для комплексов металлов, используемых в качестве эмиссионных слоев при изготовлении OLED устройств, важнейшими характеристиками являются: достаточно высокие квантовые выходы фотолюминесценции, термическая стабильность, легкость сублимации в вакууме и формирование однородных пленок, а также хорошая растворимость в органических растворителях. Однако высоких ФЛ свойств и перечисленных выше характеристик не всегда достаточно для получения эффективных OLED устройств. Необходим индивидуальный подбор комплексов металлов в качестве эмиссионных слоев. Поэтому синтез новых, термически устойчивых комплексов с высокими ФЛ характеристиками, расширение их ассортимента является важной научно-технологической задачей. Особенно востребованными в настоящее время являются соединения, люминесцирующие в синей и сине-фиолетовой областях спектра.
Известен [N,N'-ди(салицилиден)триэтилентетрааминат]цинка формулы III с координационным узлом ZnN2O2:
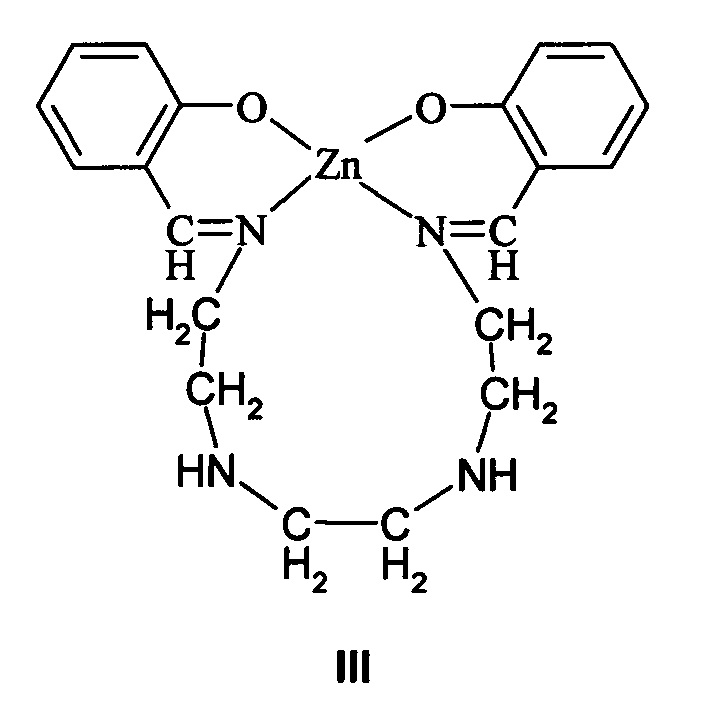
где R=C1-C6-алкил.
Соединения III проявляют фотолюминесцентные свойства в синей области спектра: полоса поглощения λ=381 нм, полоса фотолюминесценции λ=457 нм (хлороформ), квантовый выход ϕ=0.158, полоса электролюминесценции λ=457 нм. Этот комплекс использовался при создании OLED с яркостью 5.26 кд/м2, что соответствует квантовой эффективности 0.104 кд/А при напряжении 6 В [Yu G., Liu Y., Wu X., Zhu D. Synthetic Metals. 2001. V. 117. P. 211-214]. Соединения III термостабильны до температуры 345°C.
Известен N,N'-бис[(2-N-тозиламинобензилиден)-1,3-диамино-2-пропанолат]цинка формулы IV на основе тетрадентатного азометинового лиганда с координационным узлом ZnN4:
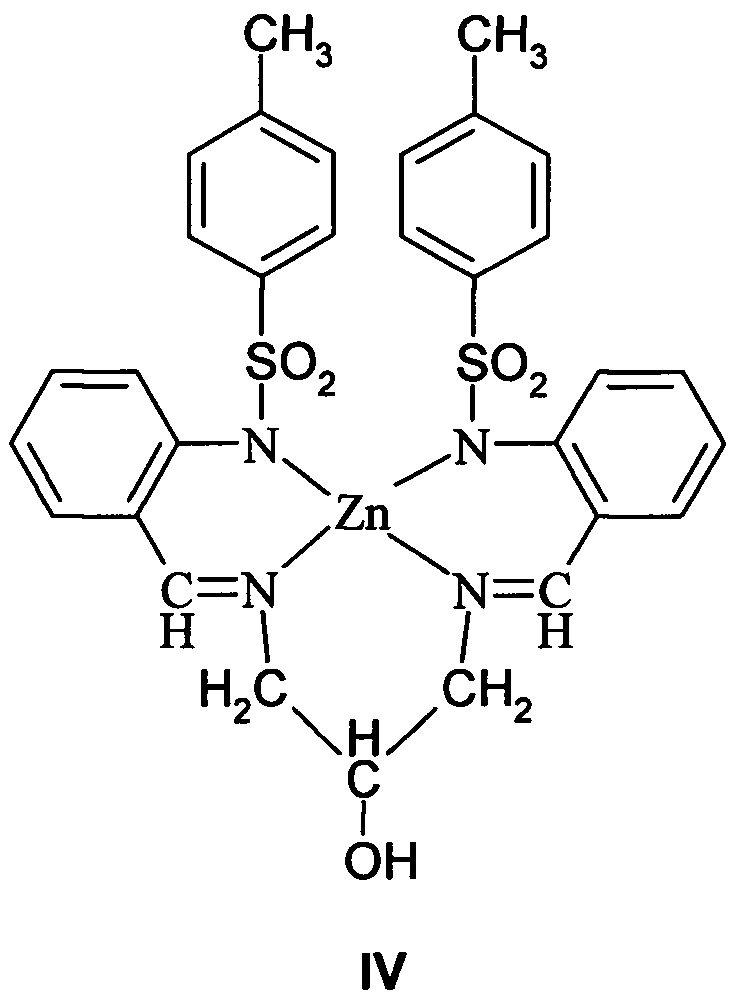
Соединение IV проявляет люминесцентные свойства (полоса флюоресценции λ=430 нм (ацетонитрил), квантовый выход ϕ=0.14). Сведения о его термостабильности не приводятся [M.R. Bermejo, М. Vazquez, J. Sanmartin et al. New J. Chem. 2002. V. 26. Р. 1365-1370].
Известны металлохелаты бидентатных азометиновых лигандов 2-N-тозиламинобензальдегида и 2-гидроксибензальдегида с 3,5-диметоксифенилэтиламином, а именно бис-[2-(N-тозиламинобензилиден)-3',4'-диметоксифенилэтилиминат]цинка(II) и бис-[2-(гидроксибензилиден)-3',4'-диметоксифенилэтилиминат]цинка(II) формулы V [патент РФ №2602263, C07F 3/06, C07C 211/65, C09K 11/06, 2016 г.].
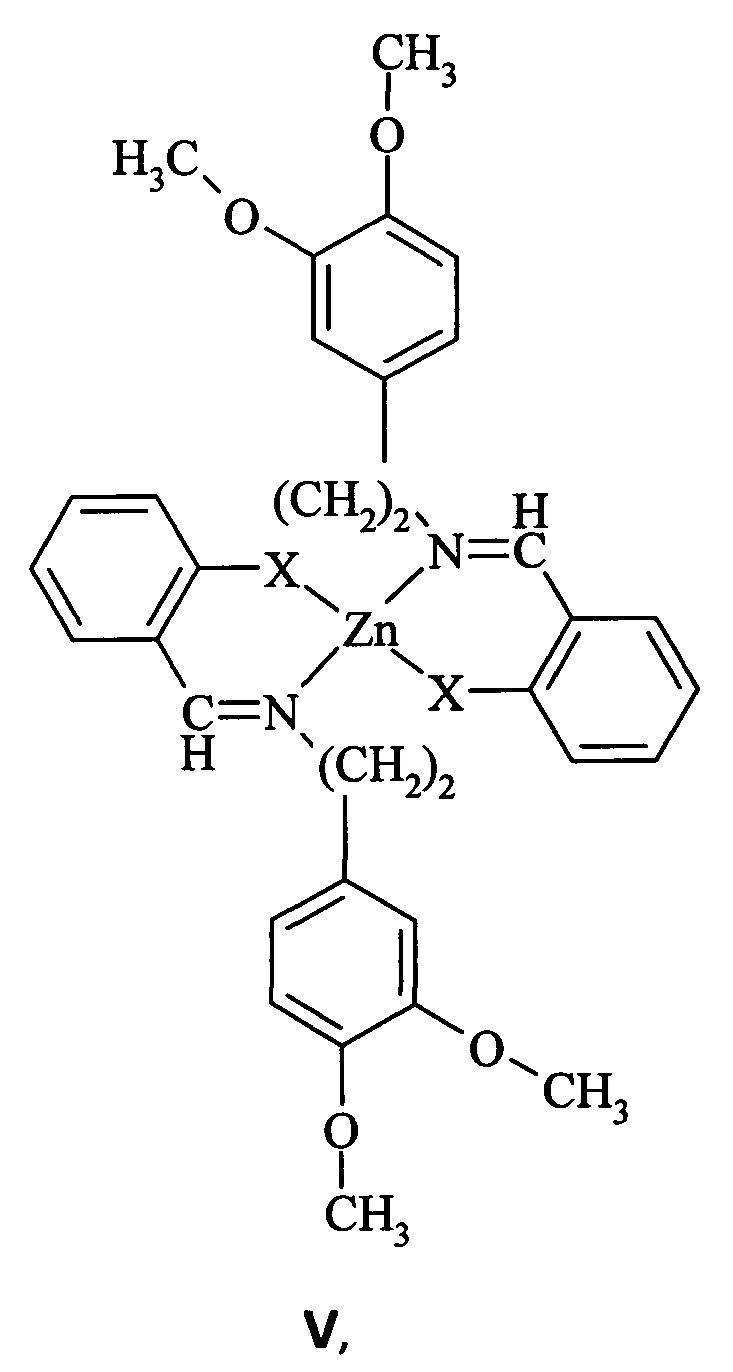
где Х=NTs (а), Х=О (б); Ts=-SO2-C6H4-CH3-п.
Металлокомплексные соединения V проявляют фотолюминесцентные свойства в фиолетовой и синей областях спектра λФЛ=427 нм (Va) и λФЛ=442 нм (Vб) с квантовыми выходами флуоресценции 0.33 и 0.36, обладающие термической стабильностью до 248 и 195°С соответственно.
Известны металлокомплексные соединения N,N'-бис(2-тозиламинобензилиден)диаминодипропилиминаты цинка и кадмия VI(a,б) [патент РФ №2562456, C07F 3/06, C09K 11/06, 2015 г.], которые люминесцируют в синей области спектра λФЛ=428 нм (VIa) и λФЛ=425 нм (VIб) с высокими квантовыми выходами флуоресценции 0.75 и 0.2 соответственно.
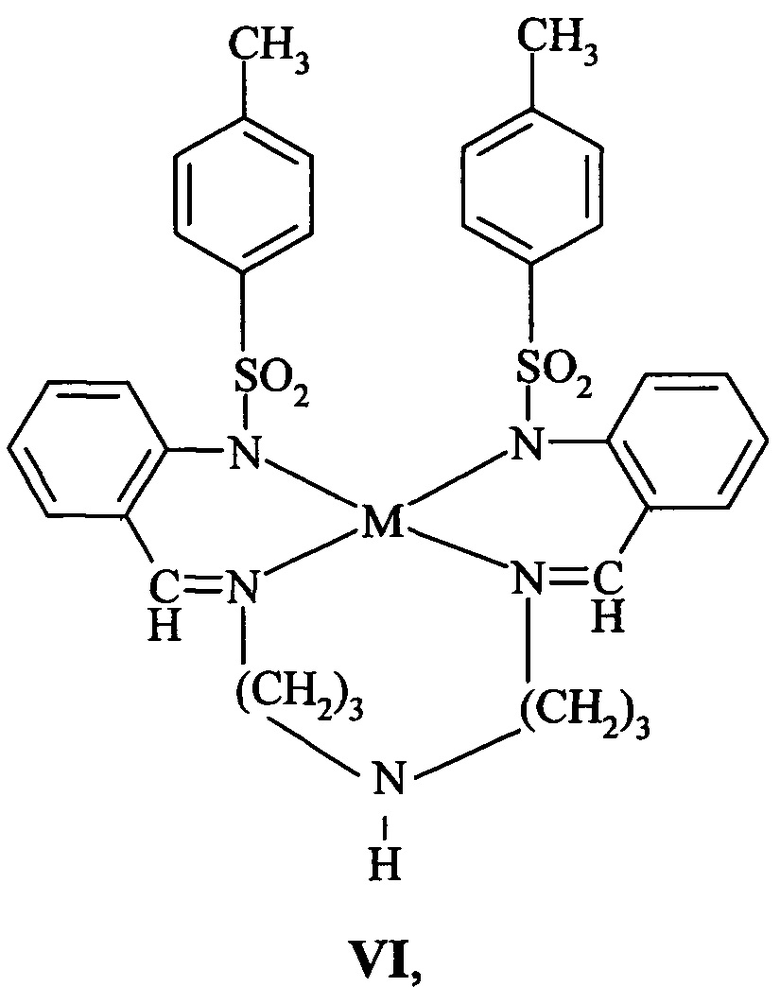
где M=Zn (a), Cd (б)
Соединения VI(a,б) термостабильны до температур 285°С, легколетучи в условиях вакуумного напыления и дают хорошие однородные пленки.
Наиболее близкими по выполнению и достигаемому результату являются бис[(2-тозиламино)бензилиден-N-алкилиминаты]цинка бидентатных азометиновых лигандов общей формулы VII, в которых реализуется координационный узел ZnN4.
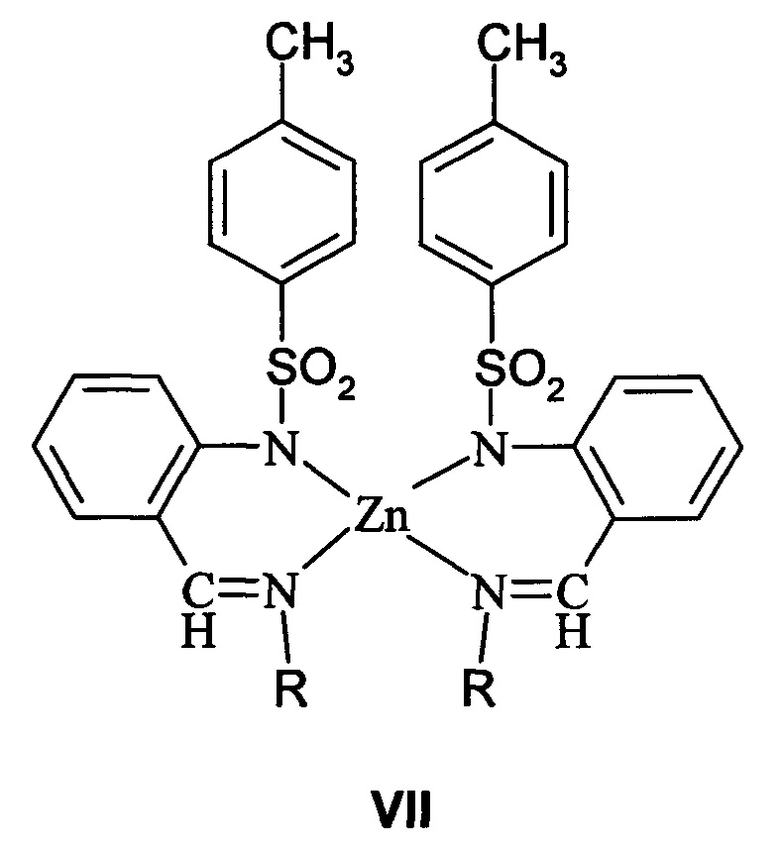
Соединения VIIa (R=C1-C6-алкил, C1-C6 -алкилзамещенный фенил, C1-C6-алкоксизамещенный фенил) проявляют фотолюминесцентные свойства в синей области спектра, их квантовые выходы составляют порядка ϕ=0.20-0.25, и термостабильны до температур порядка 220°С - 280°С [патент РФ №2295527, C07F 3/06, 2007 г.].
Однако несмотря на высокие квантовые выходы ФЛ и термостабильность попытка создания OLED устройства с использованием в качестве эмиссионных слоев комплексов цинка VIIa оказалась неудачной из-за разложения их в условиях вакуумного напыления.
Комплекс VIIб (R = пиридил) люминесцирует в зеленой области спектра λФЛ=498 нм. С использованием этого комплекса в качестве эмиссионного слоя создано электролюминесцентное устройство, излучающее в желто-зеленой области спектра [патент РФ №2551675, C09K 11/06, C07F 3/06, 2015 г.].
Комплексы цинка VIIв (R= метил- или этилпиридин) обладают ФЛ свойствами, их растворы в ДМФА люминесцируют в синей (λФЛ=435-451 нм) области спектра с квантовыми выходами флуоресценции 0.22 - 0.28 и термостабильны до температур порядка 270°С - 280°С [Патент РФ №2616979, C07F 3/06, C09K 11/06, 2017 г.].
Комплексы цинка VIIг (R=C7-C18-алкил) обладают ФЛ свойствами, люминесцируют в синей (λФЛ=428 нм) области спектра с квантовыми выходами флуоресценции 0.23-0.37 и термостабильны до температур порядка 230°С - 265°С [патент РФ №2395512, C07F 3/06, C09K 11/06, 2010 г.]
Задачей изобретения является расширение серии люминесцирующих комплексов цинка и кадмия бидентатных азометиновых лигандов, излучающих в сине-фиолетовой области спектра, обладающих достаточно высокими квантовыми выходами фотолюминесценции и термостабильностью.
Техническим результатом изобретения являются новые соединения в ряду комплексов цинка и кадмия бидентатных азометиновых лигандов на основе 2-N-тозиламинобензальдегида, проявляющие люминесцентную активность в сине-фиолетовой области спектра.
Технический результат достигается соединениями общей формулы I, II.
Изобретение удовлетворяет критерию изобретательского уровня, так как в ряду комплексов цинка и кадмия бидентатных азометиновых лигандов - продуктов конденсации 2-N-тозиламинобензальдегида и аллиламина, N,N-диэтилэтилендиамина, N,N-диэтилпропилендиамина, (2-аминоэтил)дифенилфосфина, неизвестна взаимосвязь между строением этих комплексных соединений и люминесцентными свойствами, в том числе неизвестно влияние введения аллильных, диалкиламиноалкильных, дифенилфосфиноалкильных групп в лигандные системы на изменение величины люминесцентных характеристик комплексов цинка и кадмия.
Азометиновые соединения (лиганды HL1, HL2, HL3, HL4), использованные для получения комплексов I и II, получают конденсацией 2-(N-тозиламино)бензальдегида с аллиламином, N,N-диэтилэтилендиамином, N,N-диэтилпропилендиамином и (2-аминоэтил)дифенилфосфином.
Способ получения комплексов цинка I, II заключается во взаимодействии азометиновых лигандов с дигидратами ацетатов цинка и кадмия или хлоридами цинка и кадмия (химический способ ХС). В зависимости от этого получаются комплексы различного состава и строения I или II.
Комплексы цинка и кадмия I могут быть получены также электрохимическим (ЭС) способом.
Ниже приведены примеры получения лигандных систем, а также комплексов цинка и кадмия I ХС и ЭС способами.
Пример 1. N-[2-(Аллилиминометил)фенил]-4-метилбензолсульфамид (HL1 лиганд для комплексов Ia,b).
К раствору 5 ммолей 2-(N-тозиламино)бензальдегида в 20 мл бензола прибавляли раствор 5,5 ммолей аллиламина в 20 мл бензола. Смесь кипятили с насадкой Дина-Старка до полного отделения воды в течение 2 часов. Отгоняли бензол на ротационном испарителе до объема реакционной смеси 15 мл. Охлаждали, осадок отфильтровывали. Выход 89%. Перекристаллизовывали из гексана. Желтый порошок с Tпл 84-85°С. Найдено, %: С 65.07, Н 5.89, N 9.10. Для C17H18N2O2S вычислено, %: С 64.94, Н 5.77, N 8.91.
ИК спектр (в твердой фазе): 1642 (СН=СН2), 1634 (CH=N), 1331 (νasSO2), 1159 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 2.27 (3Н, с, СН3), 4.23-4.25 (2Н, м, CH2=СН), 5.18-5.25 (2Н, м, СН2-CH), 6.01-6.07 (1Н, м, СН2-СН), 7.06 (1H, т, J=7.3 Гц, СНаром), 7.28 (2Н, д, J=8.3 Гц, СНаром), 7.34 (1H, т, J=7.8 Гц, СНаром), 7.45-7.47 (2Н, м, СНаром), 7.62 (2Н, д, J=8.3 Гц, СНаром), 8.44 (1Н, с, CH=N), 12.97 (1Н, уш.с, NH).
Пример 2. N-[2-(2-Диэтиламиноэтилиминометил)фенил]-4-метилбензолсульфамид (HL2 лиганд для комплексов Ic,d и IIa,с).
Соединение получено аналогично примеру 1 из 2-(N-тозиламино)бензальдегида и N,N-диэтилэтилендиамина. Выход 85%. Светло-желтый порошок с Тпл 44-45°С. Найдено, %: С 64.28, Н 7.32, N 11.20. Для C20H27N3O2S вычислено, %: С 64.31, Н 7.29, N 11.25.
ИК спектр (в твердой фазе): 1600 (CH=N), 1340 (νasSO2), 1164 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 0.94 (6Н, т, J=7.2 Гц, 2 СН2СН3), 2.29 (3Н, с, С-СН3), 2.53 (4Н, к, J=7.2 Гц, 2 CH2CH3), 2.71 (2Н, т, J=6.3 Гц, CH2CH2N(C2H5)2), 3.68 (2Н, т, J=6.3 Гц, CH2CH2N(C2H5)2), 7.04 (1H, т, J=7.5 Гц, СНаром), 7.30 (2Н, д, J=8.1 Гц, СНаром), 7.34 (1Н, д, J=7.5 Гц, СНаром), 7.45 (2Н, т, J=6.3 Гц, СНаром), 7.67 (2Н, д, J=8.1 Гц, СНаром), 8.45 (1H, с, CH=N).
Пример 3. N-[2-[(3-(Диэтиламино)пропилиминометил]фенил]-4-метилбензолсульфамид (HL3 лиганд для комплексов Ie,f и IIb,d)
Соединение получено аналогично примеру 1 из 2-(N-тозиламино)бензальдегида и N,N-диэтилпропилендиамина. Выход 85%. Желтый порошок с Tпл 114-115°С. Найдено, %: С 65.28, Н 7.46, N 10.89. Для C21H29N3O2S вычислено, %: С 65.08, Н 7.54, N 10.84.
ИК спектр (в твердой фазе): 1635 (CH=N), 1338 (νasSO2), 1154 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 0.92 (6Н, т, J=7.2 Гц, 2 СН2СН3), 1.72-1.77 (2Н, м, СН2), 2.28 (3Н, с, С-СН3), 2.44-2.50 (6Н, м, 3СН2), 3.62 (2Н, т, J=6.4 Гц, СН2), 7.03 (1Н, т, J=7.6 Гц, СНаром), 7.29 (2Н, д, J=8.3 Гц, СНаром), 7.32 (1Н, т, J=7.8 Гц, СНаром), 7.46 (2Н, т, J=7.6 Гц, СНаром), 7.64 (2Н, д, J=8.3 Гц, СНаром), 8.46 (1Н, с, CH=N).
Пример 4. N-[2-(2-Дифенилфосфинилэтилиминометил)фенил]-4-метилбензолсульфамид (HL4 лиганд для комплекса IIg).
Соединение получено аналогично примеру 1 из 2-(N-тозиламино)бензальдегида и (2-аминоэтил)дифенилфосфина. Выход 62%. Светло-желтые кристаллы с Тпл 134-135°С (из ацетонитрила). Найдено, %: С 69.25, Н 6.10, N 5.86. Для C28H27N2O2PS вычислено, %: С 69.12, Н 5.59, N 5.76.
ИК спектр (в твердой фазе): 1634 (CH=N), 1339 (νasSO2), 1159 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 2.27 (3Н, с, С-СН3), 2.46-2.49 (2Н, м, СН2), 3.65-3.67 (2Н, м, СН2), 7.06-7.09 (1Н, м, СНаром), 7.20-7.27 (3Н, м, СНаром), 7.33-7.41 (6Н, м, СНаром), 7.44-7.48 (6Н, м, СНаром), 7.69 (2Н, д, J=8.3 Гц, СНаром), 8.39 (1H, с, CH=N), 12.93 (1Н, уш.с, NH).
Пример 5
Химический способ (ХС) получения комплексов Ia-g и IIa-d.
К раствору 2 ммоль соответствующего лиганда (примеры 1-4) в 30 мл этанола прибавляли раствор 1 ммоль дигидрата ацетата цинка или 2 ммоль безводного хлорида цинка или дигидрата хлорида кадмия. Смесь кипятили при перемешивании в течение 2 ч. Выпавшие по охлаждении осадки комплексов отфильтровали, промывали 5 мл метанола и перекристаллизовывали из смеси метанол: хлороформ (2:1)
Пример 6
Электрохимический способ получения соединений Ia-g.
В электрохимическую ячейку с платиновым катодом и цинковым или кадмиевым анодом помещают раствор 1 ммоль соответствующего лиганда (примеры 1-4) в 20 мл ацетонитрила, добавляют 0.01 г [Et4N]ClO4 в качестве токопроводящей добавки. Электросинтез осуществляют при силе тока 40 mA и напряжении 20 B в течение 1 ч при комнатной температуре. Выпавшие осадки комплексов отфильтровывают и перекристаллизовывают из смеси этанол: хлороформ (2:1)
Катод (Pt): 2LH+2e→2L-1+H2
Анод: (М0) М-2е→М2+ (М=Zn, Cd)
Раствор: 2L-1+М2+→М L2
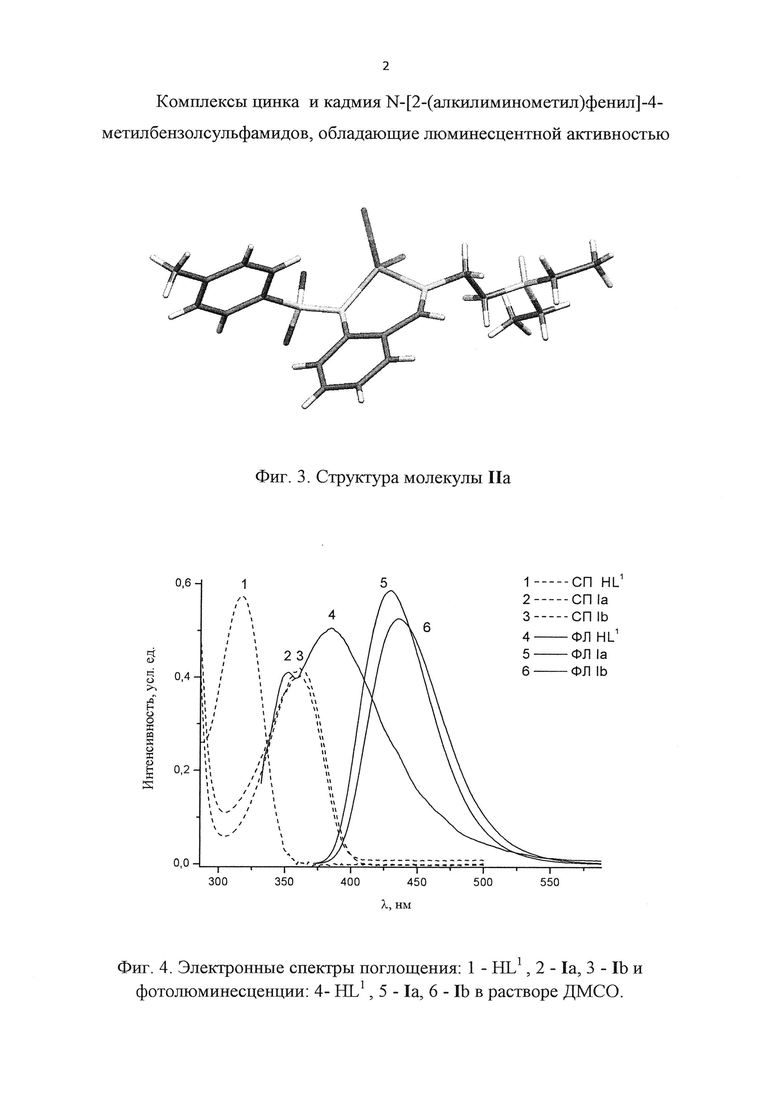
Строение комплексов Ia-g, IIa-d подтверждено данными элементного анализа ИК- и 1Н ЯМР спектроскопии. Строение комплексов Ia (ZnL1), Ic (ZnL2), IIa (ZnCl2HL2) установлены методом РСА (фиг. 1-3).
Полученные по примерам 5, 6 комплексные соединения цинка и кадмия Ia-g, IIa-d имеют следующие характеристики:
Бис[N-[2-(аллилиминометил)фенил]-4-метилбензолсульфамидо]цинк(II) (Ia).
Выход 80%. Белые кристаллы с Тпл. > 260°С.
Найдено, % ХС: С 59.10, Н 4.85, N 8.19, Zn 9.52.
ЭС: С 58.86, Н 4.90, N 8,22, Zn 9,60.
Для C34H34N4O4S2Zn вычислено, %: С 59.00, Н 4.95, N 8.09, Zn 9.45.
ИК спектр (в твердой фазе): 1639 (СН=СН2), 1627 (CH=N), 1297 (νasSO2), 1136 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 2.22 (6Н, с, 2СН3), 4.15 (2Н, уш.с, СН2), 4.53 (2Н, уш.с, СН2), 4.84 (2Н, д, J=9.9 Гц, СН2), 4.95 (2Н, д, J=9.8 Гц, СН2), 5.70-5.77 (2Н, м, СН), 6.84 (2Н, т, J=7.4 Гц, СНаром), 7.12 (4Н, д, J=8.0 Гц, СНаром), 7.20 (2Н, т, J=7.8 Гц, СНаром), 7.25 (2Н, д, J=8.5 Гц, СНаром), 7.45 (2Н, д, J=7.8 Гц, СНаром), 7.89 (4Н, д, J=8.2 Гц, СНаром), 8.51 (2Н, с, CH=N).
Бис [N-[2-(аллилиминометил)фенил]-4-метилбензолсульфамидо]кадмий(II)
(Ib). Выход 67%. Белые кристаллы с Тпл. > 260°С.
Найдено, % ХС: С 55.20, Н 4.72, N 7.69, Zn 15.12.
ЭС: С 55.12, Н 4.70, N 7,62, Zn 15,30.
Для C34H34N4O4S2Cd вычислено, %: С 55.24, Н 4.64, N 7.58, Zn 15.21.
ИК спектр (в твердой фазе): 1644 (СН=СН2), 1623 (CH=N), 1293 (νasSO2), 1124 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 2.26 (6Н, с, 2СН3), 4.27 (4Н, д, J=5.3 Гц, 2СН2), 4.98 (2Н, уш.с, СН2), 5.13 (2Н, д, J=7.7 Гц, СН2), 5.91 (2Н, уш.с, СН), 6.85 (2Н, с, СНаром), 7.17-7.21 (6Н, м, СНаром), 7.32 (2Н, с, СНаром), 7.34-7.41 (2Н, м, СНаром), 7.78 (4Н, уш.с, СНаром), 8.47 (2Н, с, CH=N).
Бис [N-[2-(2-диэтиламиноэтилиминометил)фенил]-4-метилбензолсульфамидо]цинк(II) (Ic).
Выход 84%. Желтые кристаллы с Тпл. > 260°С.
Найдено, % ХС: С 59.34, Н 6.52, N 10.38, Zn 8.17.
ЭС: С 59.20, Н 6.56, N 10.42, Zn 8.22.
Для C40H52N6O4S2Zn вычислено, %: С 59.28, Н 6.47, N 10.37, Zn 8.07.
ИК спектр (в твердой фазе): 1628 (CH=N), 1295 (νasSO2), 1132 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 0.70 (12Н, т, J=7.2 Гц, 4 СН2СН3), 2.16-2.34 (18Н, м, 6СН2, 2С-CH3), 3.53 (2Н, уш.с, СН2), 4.10 (2Н, уш.с, СН2), 6.86 (2Н, т, J=8.2 Гц, СНаром), 7.15 (4Н, д, J=8.2 Гц, СНаром), 7.21 (2Н, т, J=7.2 Гц, СНаром), 7.31 (2Н, д, J=8.4 Гц, СНаром), 7.49 (2Н, д, J=6.9 Гц, СНаром), 7.96 (4Н, д, J=8.2 Гц, СНаром), 8.59 (2Н, с, CH=N).
Бис [N-[2-(2-диэтиламиноэтилиминометил)фенил]-4-метилбензол сульфамидо]кадмий(II) (Id).
Выход 79%. Белые кристаллы с Тпл. 230-231°С.
Найдено, % ХС: С 56.14, Н 6.22, N 9.89, Cd 13.17.
ЭС: С 56.00, Н 6.16, N 9.86, Cd 13.21.
Для C40H52N6O4S2Cd вычислено, %: С 56.03, Н 6.11, N 9.80, Cd 13.11.
ИК спектр (в твердой фазе): 1621 (CH=N), 1284 (νasSO2), 1124 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 0.76 (12Н, т, J=6.8 Гц, 4 СН2СН3), 2.26 (6Н, с, 2С-СН3), 2.34-2.43 (8Н, м, 4CH2CH3), 2.63 (4Н, т, J=6.9 Гц, CH2CH2N(C2H5)2), 3.73 (4Н, уш.с, CH2CH2N(C2H5)2), 6.81 (2Н, т, J=8.1 Гц, СНаром), 7.18-7.22 (6Н, м, СНаром), 7.32 (2Н, д, J=8.1 Гц, СНаром), 7.43 (2Н, д, J=6.9 Гц, СНаром), 7.85 (4Н, д, J=7.5 Гц, СНаром), 8.54 (2Н, с, CH=N).
Бис [N-[2-[(3-(диэтиламино)пропилиминометил]фенил]-4-метилбензолсульфамидо]цинк(II) (Ie).
Выход 81%. Белые кристаллы с Тпл.=250-251°С.
Найдено, % ХС: С 60.11, Н 6.83, N 10.12, Zn 7.87.
ЭС: С 60.08, Н 6.88, N 10.06, Zn 7.90.
Для C42H56N6O4S2Zn вычислено, %: С 60.17, Н 6.73, N 10.02, Zn 7.80.
ИК спектр (в твердой фазе): 1632 (CH=N), 1296 (νasSO2), 1133 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 0.76 (12Н, т, J=7.1 Гц, 4 СН2СН3), 1.57-1.67 (4Н, м, 2СН2), 2.18-2.22 (12Н, м, 6СН2), 2.24 (6Н, с, 2С-СН3), 3.50 (2Н, уш.с, СН2), 4.06 (2Н, уш.с, СН2), 6.85 (2Н, т, J=7.2 Гц, СНаром), 7.13 (4Н, д, J=8.3 Гц, СНаром), 7.20 (2Н, т, J=7.2 Гц, СНаром), 7.34 (2Н, д, J=8.5 Гц, СНаром), 7.47 (2Н, д.д, J=7.9 Гц, J=1.5 Гц, СНаром), 7.93 (4Н, д, J=8.3 Гц, СНаром), 8.56 (2Н, с, CH=N).
Бис [N-[2-[(3-(диэтиламино)пропилиминометил]фенил]-4-метилбензолсульфамидо]кадмий(II) (If).
Выход 78%. Белые кристаллы с Тпл.=250-251°С.
Найдено, % ХС: С 56.91, Н 6.43, N 9.58, Cd 12.77.
ЭС: С 56.88, Н 6.45, N 9.46, Cd 12.80.
Для C42H56N6O4S2Cd вычислено, %: С 56.97, Н 6.37, N 9.49, Cd 12.69.
ИК спектр (в твердой фазе): 1631 (CH=N), 1283 (νasSO2), 1125 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 0.74 (12Н, т, J=6.6 Гц, 4 СН2СН3), 1-70 (4Н, т, J=6.6 Гц, 2СН2), 2.17-2.22 (12Н, м, 6СН2), 2.27 (6Н, с, 2С-СН3), 3.70 (4Н, уш.с, СН2), 6.84 (2Н, т, J=7.2 Гц, СНаром), 7.18-7.24 (6Н, м, СНаром), 7.32 (2Н, д, J=8.4 Гц, СНаром), 7.42 (2Н, д, J=7.8 Гц, СНаром), 7.87 (4Н, д, J=7.8 Гц, СНаром), 8.54 (2Н, с, CH=N).
Бис [N-[2-(2-дифенилфосфинилэтилиминометил)фенил]-4-метилбензолсульфамидо]цинк(II) (Ig).
Выход 48%. Белые кристаллы с Тпл. > 260°С.
Найдено, % ХС: С 64.80, Н 5.13, N 5.52, Zn 6.36.
ЭС: С 64.78, Н 5.00, N 5.56, Zn 6.40.
Для C56H52N4O4P2S2Zn вычислено, %: С 64.89, Н 5.06, N 5.41, Zn 6.31.
ИК спектр (в твердой фазе): 1632 (CH=N), 1293 (νasSO2), 1131 (νsSO2) см-1.
lH ЯМР спектр (DMSO-d6, 600 МГц), δ, м.д.: 2.24 (6Н, с, 2С-СН3), 2.31-2.43 (4Н, м, 2СН2), 3.42 (2Н, уш.с, СН2), 3.95 (2Н, уш.с, СН2), 6.88-6.90 (2Н, м, СНаром), 7.09 (4Н, д, J=8.2 Гц, СНаром), 7.13 (4Н, уш.с, СНаром), 7.17-7.29 (18Н, м, СНаром), 7.46-7.48 (4Н, м, СНаром), 7.85 (4Н, д, J=8.2 Гц, СНаром), 8.51 (2Н, с, CH=N).
Цвиттерионный комплекс хлорида цинка с N-[2-(2-диэтиламиноэтилиминометил)фенил]-4-метилбензолсульфамидом (IIa). Выход 68%. Светло-желтые кристаллы с Тпл. > 260°С.
Найдено, %: С 47.15, Н 5.35, N 8.34, Zn 12.96.
Для C20H27Cl2N3O2SZn вычислено, %: С 47.12, Н 5.34, N 8.24, Zn 12.82.
ИК спектр (в твердой фазе): 1622 (CH=N), 1301 (νasSO2), 1136 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 1.13 (6Н, уш.с, 2 СН2СН3), 2.31 (3Н, с, С-СН3), 2.97 (6Н, уш.с, 3СН2), 3.83 (2Н, уш.с, СН2), 6.84 (1Н, т, J=7.2 Гц, СНаром), 7.11-7.41 (4Н, м, СНаром), 7.53 (1Н, д, J=7.5 Гц, СНаром), 7.67 (1Н, д, J=8.4 Гц, СНаром), 7.93 (1Н, д, J=7.8 Гц, СНаром), 8.40 (1Н, уш.с, NH), 8.51 (1Н, с, CH=N).
Цвиттерионный комплекс хлорида цинка с N-[2-[(3-(диэтиламино)пропилиминометил]фенил]-4-метилбензолсульфамидом (IIb).
Выход 67%. Бледно-желтые кристаллы с Тпл. 255-256°С.
Найдено, %: С 48.09, Н 5.65, N 8.10, Zn 12.56.
Для C21H29Cl2N3O2SZn вычислено, %: С 48.15, Н 5.58, N 8.02, Zn 12.48.
ИК спектр (в твердой фазе): 1635 (CH=N), 1297 (νasSO2), 1138 (νsSO2) см-1.
1H ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 1.15 (6Н, т, J=6.6 Гц, 2 СН2СН3), 1.97 (2Н, уш.с, СН2), 2.32 (3Н, с, С-СН3), 3.00 (6Н, уш.с, 3СН2), 3.68 (1Н, т, J=6.3 Гц, СН2), 3.76 (1Н, уш.с, СН2), 6.83 (1H, т, J=6.9 Гц, СНаром), 7.07-7.41 (4Н, м, СНаром), 7.51 (1H, д, J=7.8 Гц, СНаром), 7.66 (1H, д, J=8.1 Гц, СНаром), 7.97 (1Н, д, J=8.1 Гц, СНаром), 8.39 (1Н, уш.с, NH), 8.51 (1Н, с, CH=N).
Цвиттерионный комплекс хлорида кадмия с N-[2-(2-диэтиламиноэтилиминометил)фенил]-4-метилбензолсульфамидом (IIc).
Выход 70%. Бледно-желтые кристаллы с Тпл. 230-231°С.
Найдено, %: С 43.21, Н 4.95, N 7.64, Cd 20.26.
Для C20H27CdCl2N3O2S вычислено, %: С 43.14, Н 4.89, N 7.55, Cd 20.19.
ИК спектр (в твердой фазе): 1621 (CH=N), 1284 (νasSO2), 1124 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 1.01 (6Н, уш.с, 2 СН2СН3), 2.30 (3Н, с, С-СН3), 2.63-2.77 (6Н, м, 3СН2), 3.67 (2Н, уш.с, СН2), 6.81 (1Н, уш.с, СНаром), 7.14 (2Н, м, СНаром), 7.26 (2Н, д, J=7.8 Гц, СНаром), 7.34 (1H, уш.с, СНаром), 7.83 (2Н, уш.с, СНаром), 8.39 (1Н, уш.с, CH=N).
Цвиттерионный комплекс хлорида кадмия с N-[2-[(3-(диэтиламино)пропилиминометил]фенил]-4-метилбензолсульфамидом (IId).
Выход 65%. Бледно-желтые кристаллы с Тпл. > 250°С.
Найдено, %: С 44.09, Н 5.18, N 7.30, Cd 19.59.
Для C21H29CdCl2N3O2S вычислено, %: С 44.18, Н 5.12, N 7.36, Cd 19.69.
ИК спектр (в твердой фазе): 1628 (CH=N), 1297 (νasSO2), 1127 (νsSO2) см-1.
1Н ЯМР спектр (DMSO-d6, 300 МГц), δ, м.д.: 1.01 (6Н, уш.с, 2 СН2СН3), 1.83 (2Н, уш.с, СН2), 2.31 (3Н, с, С-СН3), 2.67 (6Н, уш.с, 3СН2), 3.65 (2Н, т, J=6.3 Гц, СН2), 7.08 (1H, уш.с, СНаром), 7.30-7.46 (5Н, м, СНаром), 7.65 (1H, уш.с, СНаром), 7.96 (1H, уш.с, СНаром), 8.47 (1Н, с, CH=N).
Электронные спектры поглощения (ЭСП) получены на спектрофотометре «Cary 100 Scan». Флуоресцентные измерения проведены на спектрофлуориметре «Varian Cary Eclipse». Для приготовления растворов использовали ДМСО (Aldrich) и толуол (Aldrich) спектральной степени чистоты. Растворимость комплексов изучалась также в ДМФА, хлористом метилене, хлороформе, ацетонитриле, в которых соединения также растворимы.
Значения квантовых выходов флуоресценции определены методом Паркера - Риса [С. Паркер, Фотолюминесценция растворов, Мир, Москва, 1972, с. 247] с использованием антрацена в ацетонитриле (ϕ=0.1) в качестве стандартного люминофора [Б.М. Красовицкий, Б.М. Болотин, Органические люминофоры, Химия, Москва, 1984, с. 292].
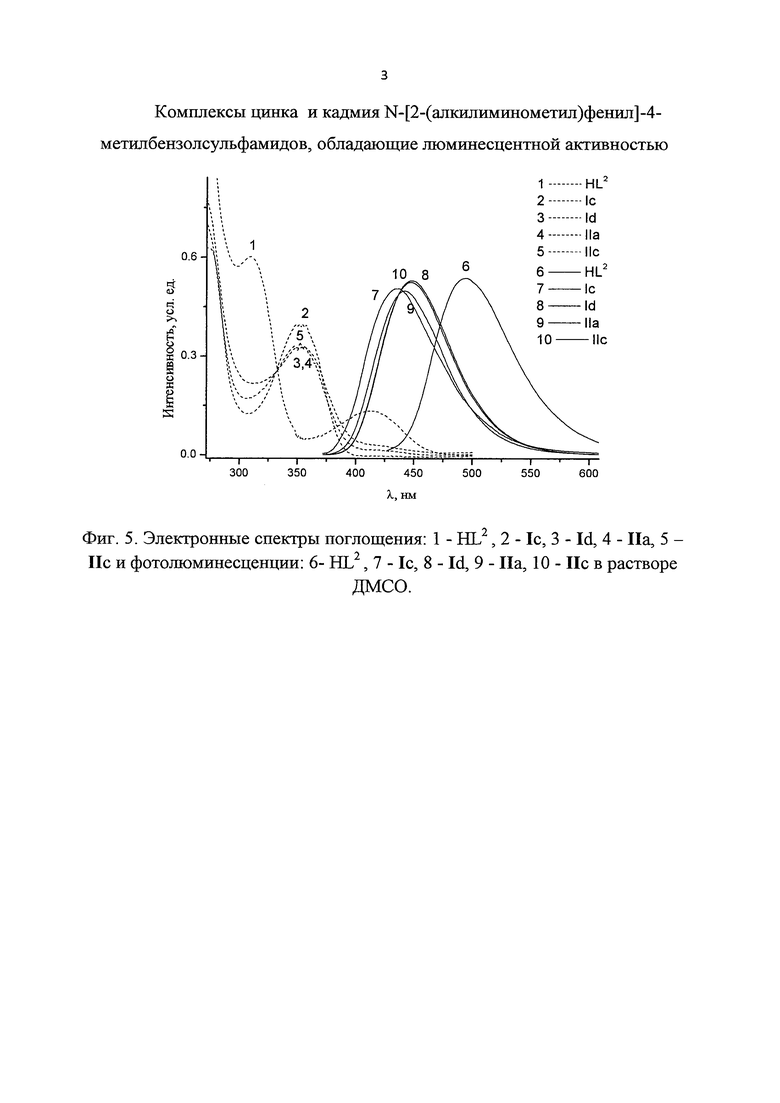
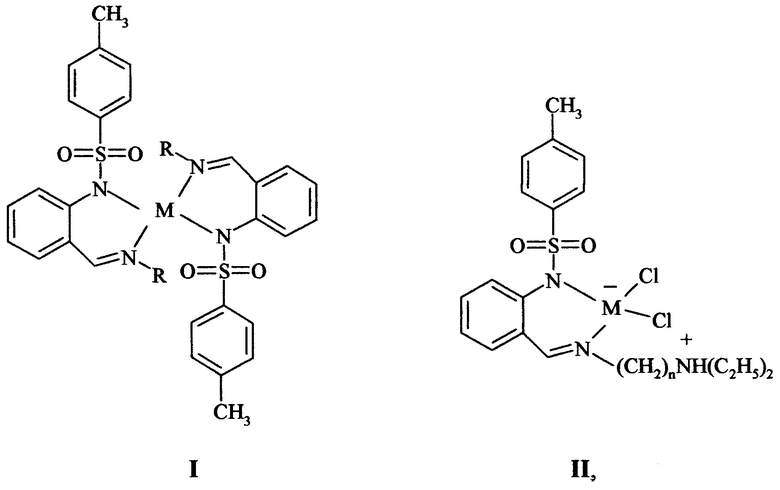
Спектрально-абсорбционные и фотолюминесцентные свойства комплексов цинка(II) и кадмия(II) Ic-g, IIa-с исследованы в растворе ДМСО, комплексы Ia,b,e,g исследованы в растворе толуола. Полученные данные систематизированы в таблице. В качестве иллюстрации на фиг. 4 и 5 приведены спектры поглощения, флуоресценции и возбуждения флуоресценции исследуемых соединений.
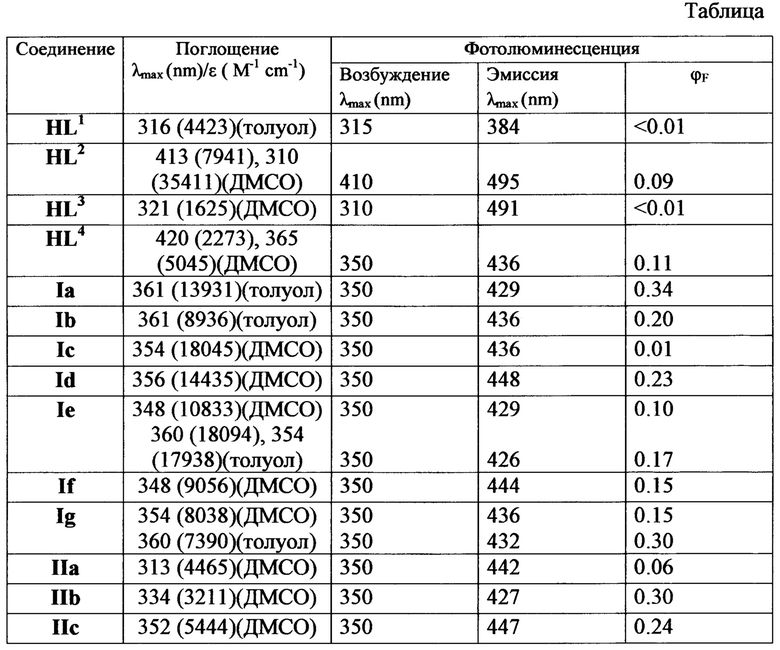
ЭСП растворов бисхелатных комплексов Zn(II) и Cd(II) Ia-g (таблица, рис. 4 и 5) в ДМСО и толуоле характеризуются сходными по форме и положению, но отличающимися по интенсивности, длинноволновыми полосами поглощения с максимумами при 348 (Ie, If), 354 (Ic, Ig), и 356 (Id) нм и молярными коэффициентами экстинкции в максимумах этих полос, принимающими значения 10833, 9056, 18045, 8038 и 14435 моль⋅л-1⋅см-1 соответственно (ДМСО) и с максимумами при 360 (Ie, Ig) и 361 (Ia, Ib) нм и молярными коэффициентами экстинкции в максимумах этих полос, принимающими значения 18094, 7390, 13931 и 8936 моль⋅л-1⋅см-1 соответственно (толуол). ЭСП цвиттерионных комплексов IIa-с в ДМСО характеризуются длинноволновыми полосами поглощения с максимумами при 313 (IIa), 334 (IIb), и 352 (IIc) нм и молярными коэффициентами экстинкции в максимумах этих полос, принимающими значения 4465, 3211 и 5444 моль⋅л-1⋅см-1 соответственно. Молярные коэффициенты экстинкции цвиттерионных комплексов IIa ZnCl2HL2, IIb ZnCl2HL3 и IIc CdCl2HL2 в сравнении с соответствующими бисхелатными соединениями Ic Zn(L2)2, Ie Zn(L3)2 и Id Cd(L2)2 в 2.7-4.0 раза меньше, что соответствует установленному строению этих комплексов.
Флуоресценция комплексов I и II наблюдается в сине-фиолетовой области спектра с максимумами полос ФЛ при 426-448 нм. Эффективность флуоресценции комплексов I и II достаточно высока - их квантовые выходы достигают значений 0.20-0.34 (таблица).
Комплексы I,II термостабильны до температур 250°С и выше, растворимы в органических растворителях (ДМФА, ДМСО, толуол, хлористый метилен, хлороформ, ацетонитрил).
По своим фотолюминесцентным свойствам полученные комплексы цинка и кадмия сравнимы с аналогичными комплексами VII. Ранее, несмотря на низкий квантовый выход ФЛ ϕ=0.06 комплекса VIIб, на его основе было создано электролюминесцентное OLED устройство, излучающее в желто-зеленой области спектра, яркость излучения которого составляет 220 кд/м2 при рабочем напряжении 10 В, координаты CIE (x=0.409, y=0.506). Максимальная яркость устройства превышает 1000 кд/м2 при напряжении 16 В и плотности тока 600 мА/см2. Световая эффективность устройства составляет около 1 Лм/Вт, пороговое напряжение - 5 В. Полученные комплексы I,II также могут найти применение в качестве ФЛ материалов при конструировании OLED устройств.
Таким образом, предлагаемые комплексы, в отличие от наиболее близких аналогов, излучают в сине-фиолетовой области спектра, обладают достаточно высокими квантовыми выходами ФЛ, растворимостью в органических растворителях и термостабильностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ БИС(1-ФЕНИЛ-3-МЕТИЛ-4-ФОРМИЛ-5-ПИРАЗОЛОНАТА)ЦИНКА И КАДМИЯ С АМИНОПРОИЗВОДНЫМИ АЗОТИСТЫХ ГЕТЕРОЦИКЛОВ, ОБЛАДАЮЩИЕ ЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2485128C1 |
| ФОТОХРОМНЫЕ ПОЛИМЕРЫ ДЛЯ ТРЕХМЕРНОЙ ОПЕРАТИВНОЙ ОПТИЧЕСКОЙ ПАМЯТИ | 2004 |
|
RU2345997C2 |
| ЦИНКОВЫЕ КОМПЛЕКСЫ 5-[2-ГИДРОКСИ(ТОЗИЛАМИНО)БЕНЗИЛИДЕНАМИНО]-2-(2-ТОЗИЛАМИНОФЕНИЛ)-1АЛКИЛБЕНЗИМИДАЗОЛОВ, ОБЛАДАЮЩИЕ ФОТОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2532904C1 |
| ФОТОУПРАВЛЯЕМЫЕ ФОТОХРОМНЫЕ ЭЛЕКТРОЛЮМИНЕСЦИРУЮЩИЕ И ЭЛЕКТРОПРОВОДЯЩИЕ ПОЛИМЕРЫ ДЛЯ ФОТОНИКИ | 2004 |
|
RU2345998C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,8,9,10-ТЕТРАГИДРОПИРИМИДО[4,5-d]АЗОЦИНОВ, ИМЕЮЩИХ В 4-М ПОЛОЖЕНИИ ТРИФЛАТНУЮ, ВТОРИЧНУЮ И ТРЕТИЧНУЮ АМИНОГРУППЫ | 2011 |
|
RU2478637C2 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ | 2012 |
|
RU2519218C2 |
| СЕЛЕКТИВНЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ АГЕНТ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ 3-ГИДРАЗОНО-6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)- 1,2,4,5-ТЕТРАЗИН И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2479311C2 |
| Комплексы цинка 2-(N-тозиламинобензилиден)-2'-иминоалкилпиридинов, обладающие люминесцентной активностью | 2016 |
|
RU2616979C1 |
| Новые производные гелиомицина и фармацевтические композиции на их основе, ингибирующие опухолевый рост | 2018 |
|
RU2670763C1 |
| ЦИНКОВЫЕ И КАДМИЕВЫЕ КОМПЛЕКСЫ ТЕТРАДЕНТАТНЫХ АЗОМЕТИНОВ 2-ТОЗИЛАМИНОБЕНЗАЛЬДЕГИДА, ОБЛАДАЮЩИЕ ЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2532642C1 |
Изобретение относится к новым соединениям в ряду металлохелатов цинка и кадмия, а именно к комплексам бис-[N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамида]цинка(II) или кадмия(II) общей формулы I или цвиттерионным комплексам цинка(II) или кадмия(II) с N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидом общей формулы II
где R=СН2СН=СН2, CH2CH2N(C2H5)2, CH2CH2CH2N(C2H5)2, СН2СН2Р(С6Н5)2; M=Zn, Cd; n=2, 3. Металлокомплексные соединения I, II обладают фотолюминесцентными свойствами, излучают в сине-фиолетовой области спектра и могут быть использованы при создании светоизлучающих органических диодов (OLED) белого и видимого света в качестве электролюминесцентных слоев. 2 з.п. ф-лы, 5 ил., 1 табл., 6 пр.
1. Комплексы бис-[N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидов]цинка(II) или кадмия(II) общей формулы I или цвиттерионные комплексы цинка(II) или кадмия(II) N-[2-(алкилиминометил)фенил]-4-метилбензолсульфамидов общей формулы II
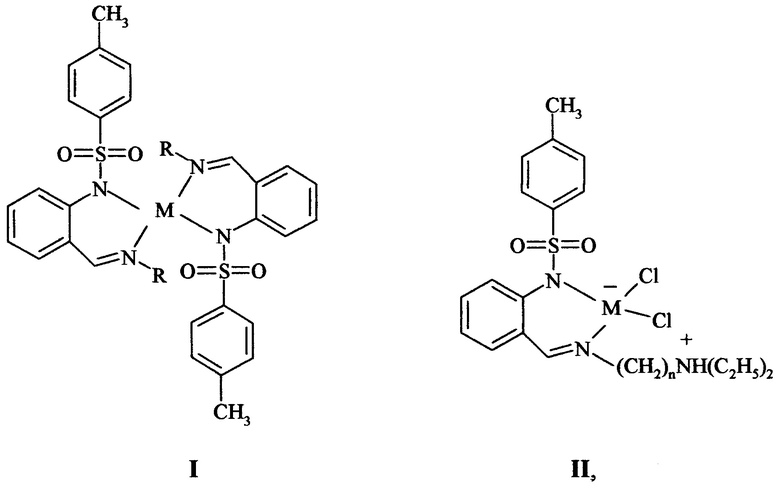
где R=СН2СН=СН2, CH2CH2N(C2H5)2, CH2CH2CH2N(C2H5)2, СН2СН2Р(С6Н5)2; M=Zn, Cd; n=2, 3.
2. Комплексы по п. 1, где Ia R=СН2СН=СН2, M=Zn; Ib R=СН2СН=СН2, M=Cd; Ic R=СН2СH2N(C2H5) M=Zn; Id R=CH2CH2N(C2H5)2, M=Cd; Ie R=CH2CH2CH2N(C2H5)2, M=Zn; If R=CH2CH2CH2N(C2H5)2, M=Cd; Ig R=CH2CH2P(C6H5)2, M=Zn; IIa M=Zn, n=2; IIb M=Zn, n=3; IIc M=Cd, n=2; IId M=Cd, n=3.
3. Комплексы по п. 1, обладающие люминесцентной активностью.
| БИС[2-(ТОЗИЛАМИНО)БЕНЗИЛИДЕН-N-АЛКИЛ(АРИЛ, ГЕТАРИЛ)АМИНАТЫ]ЦИНКА, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЮМИНОФОРОВ | 2006 |
|
RU2295527C1 |
| БИС[2-(ТОЗИЛАМИНО)БЕНЗИЛИДЕН-N-АЛКИЛИМИНАТЫ]ЦИНКА, ОБЛАДАЮЩИЕ ЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2395512C1 |
| Комплексы цинка 2-(N-тозиламинобензилиден)-2'-иминоалкилпиридинов, обладающие люминесцентной активностью | 2016 |
|
RU2616979C1 |
| [N,N'-БИС(2-ТОЗИЛАМИНОБЕНЗИЛИДЕН)ДИАМИНОДИПРОПИЛИМИНАТ]МЕТАЛЛА, ОБЛАДАЮЩИЙ ЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2562456C1 |
| BERMEJO М.R | |||
| et al, Zinc and cadmium complexes with an achiral symmetric helicand | |||
| Crystal structure of an enantiomerically pure Zn(II) monohelicate, NEW J | |||
| CHEM., 2002, v | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Приспособление для подачи коробок к машинам для сборки коробок и наклеивания ярлыков | 1924 |
|
SU1365A1 |
Авторы
Даты
2018-04-16—Публикация
2017-08-14—Подача