Изобретение относится к способу получения новых производных имидазо С.1, 2-31 пурина, которые обладают бро хорасширяклцими, антиаплергическими и периферическими сосудорасширяющим свойствами и которые могут найти пр менение в медицине. Известна реакция восстановления в формид1ирующих условиях 4-амино-5-нитрозопиримидинов и последующей циклизации образующихся моноформил.диаминопиримидинов в производные пу рина СИ. Цель изобретения - получение новых производных имидазо (.1,2-а)пурин обладающих ценными фармакологичесними свойствами. Поставленная цель достигается те что согласно способу получения прои водных имидазо Cl г 2-а пурина общей формулы vylCy IN--:у--Д Л Чгде к водород, C -Ci -алкил, заме щенный галогеном аралкил с 8-12 атомами -углерода ил арилоксиалкил с 8-12 атома углерода; Е - водород, галоген или-СдCi -алкил;R - водород, С -Сц-алкил 4-, 3-или 2 пиридилметил, арал кил с 8-12 -атомами углерода, замещенный одним или двумя галогенами, одним ил двумя ((-алкоксигруппами или арнлоксиалкил с 8-, 12 атомами углерода, Р R водород или метил, или их кислотноаддитивных солей соединение - обш.ей формулы О ТГз A jT-Sx Ъ где В -R имеют указанные значения, восстанавливают в формилирующих условияк, полученный моноформилдиаг шнопиримидин общей формулы НСОЙН 11 аш. где FT-В имеют указанные значения, подвергают циклизации с последующим выделением целевого продукта в виде основания или кислотноадцитивной cohM, или галогенируют для получения со€;динения формулы Q , где F - галоген, или алкилиругт или- аралкилируют для получения соединения формулы С1), где R -указанный алкил или аралкил, с последующим в.ыделением целевого продукта в виде основания или кислотноаддитивной соли,, Для восстановительного формилирования соединения- (.0) в качестве реакционной среды используют 114уравьиную кислоту. Восстановление осуществля.ют либо каталитическим гидрированием в присутствии палладия на угле, либо с использованием в качестве восстановителя дитионита натрия. Обычно используют 97%-ную муравьиную кислоту в количестве 10-30 мл на 1 г соединения Oj). Каталитическое гидрирование ведут при комнатной температуре (процесс является экзотермическим) при давлении от атмосферного до 7 ата до поглощениярассчитанного количества водорода. При использовании дитионита натрия в качестве восстановителя его добавляют к раствору соединения С.П) в 87-97%-ной муравьиной кислоте. Используют восстановитель в количестве немного превышающем стехиометрическое. Следует отметить, что для восстановления- до аминосоединения дитионитом в кислой среде необходимо 2 моль на 1 моль ароматического нитрозосоединёния. Циклизацию соединения формилдиаминопиримидина (};}) в целевые соединения формулы (Jl осуществляют нагреванием, можно в.присутствии дегидратирующего средства, такого как полифосфорная кислота.или ангидрид карбоновой кислоты.. Для термической циклизации используют температуры до 260°С и процесс проводят в присутствии разбавителя, такого как диметилформамид, который отгоняют во время .процесса цикли3 ации, Для получения соединения Ф , где - галоген, соединение (Л , где Е - водород, в растворе уксусной кислоты обрабатывают бромом, или галогенируют И-бромсукцинимидом, tj-хлорсукцинамидом, или N-хлорацетамидом. в качестве- галогенирующих агентов могут быть использованы трихлорид или трибро1иид фосфора. 2-Хлорпроизводное можно действием 47%-ной водной иодистоводородной кислоты превратить в соответствующее иодпроизводное либо через триэтиламмониевую соль и реакцию сКНР при 50 в отсутствии разбавителя превратить в 2-фторпроизводное. Алкилирование или аралкилирование соединения (.1) , где R - водород, осуществляют, предварительно превратив его в соль с щ.елочным металлом. Соединения, полученные по предла гаемому способу, могут быть исполь.зованы.в качестве бронхорасширяющих средств, антиаллергических средств, подавляющих непосредственно гиперчувствительную реакцию, средств,расширяющих периферические кровеносные сосуды и подавляющих фосфодиэстераэу В следующих примерах температуры плавления скорректи эованы согласно способу по фармакопее США (скоррД Спектральные хар актеристики ядерного магнитного; резонанса. fHMI) относят ся к химическим сдвигам («П, выраженным в частях на миллион (M.J по отношению к тетраметилсилану в качестве стандарта. Относительная площадь, указан ная для различных смещений, соответствует числу водородных атомов в заместителе, указана мультиплетность смещ.ения терминами: широкий, синглет C.bs), синглет CS, мультиплет (т, дублет Cd , трР1Плет (t) или квадруплет ({{. с соответствующей константой взаимодействия. Описанные спектры поглощения вклю чают только дрины волн поглощения (см.) с. идентифицированным значением функциональной группы, В некоторых. случаях указаны структурные характеристики. Если не оговорено особо, KBf используют в качестве наполнителя для измеренийИК-спектра. Пример 1. 7-.:мино-2,3-дигидро-8- :(:4-хлорфенил) метил1-6-нитро зоимидазоС ,2-а1пиримидин-5 (8К) -сн. К раствору 62,30 г (0,44 моль) 4-хлор бензиламина в 500 кл абсолютного этанола, высушенного над мол кулярным ситом, добавляют 107,40 г 0,44 моль) 2-(метилтио)-2-имидазоли иодгидрата.- Смесь нагревакт до кипения на паровой бане в открытой колбе и медленно выпаривают примерно ISC мл этанола в течение 2ч. Этот раствор добавляют в горячем состоянии к 1,76 моль этилата натрия в 1650 мл абсолютного этанола. К полученному перемешиваемому раствору 2- ; -хлор фенилСметил1-амино-2-имидазолина частями добавляют 61,85 г (0,44 молЦ кристаллического (129-131)С скси1 ноцианоацетата. Светло-желтый раствор кипятят с обратным холодильником в течение 3ч, а затем охлаждают до комнатной температуры. Желтый осадок собирают, прокивают изопропанолом и частично высушивают на воздухе. Влажную натриевую соль растворяют в 2000 МП воды и подкисляют ледяной уксусной кислотой. Светлорозовый осадок отфильтровывают и высушивают в течение ночи на воздухе, а затем высушивают под вакуумом при ЮО.С, получая 108,05 г (,77%) ро зового продукта с т.пл. 238-241° С (разл.) Перекристаллизация этого про дукта из смеси диметилформамида - этанол дает красные кристаллы, т.пл. 240° С (разл.) . Найдено,%: С 50,68, Н 3,93, N 22,59. HK.CNuJol), см 1600-1700 , 3550 (NH) , ЯУРОМ80-аб);3,90 С4, 1п,ССН2)Д5,15С2, S, СН.е); 7,32 (4, S, Аг) . Пример 2. 7-амино-8- ti; 4-xлopфенил метил -6- (формиламино) -2 , 3- 1Игидроимидазо 1, 2-alпиримидин-5 С8Н) -он, Навеску 40,50 г СО,133 моль) неперекристалливованного нитрозосоединения примера 1 растворяют в 950 мл 97%-ной муравьиной кислоты и добавляют 25,0 г 5% Pd/C в атмосфере Эту смесь восстанавливают в гидрогенизационном аппарате Парра при исходном давлении 50 фунтов (кв. дюйм). Поглощение примерно 90% рассчитанного количества водорода происходит меньше, чем за 15 мин при повышении температуры на . Реакция продолжается в течение 3 ч и температура возвращается к комнатной. Катализатор отфильтровывают и полученный бесцветный раствор концентрируют под вакуумом в вязкий сироп. Сироп растворяют в 500 мл воды и нейтрализуют концентрированным аммиаком при охлаждении. Белое твердое вещество отфильтровывают и высушивагт на воздухе, получая 41,90 г (96%), т.пл. 272-275°С (разл.) Перекристаллизация из метанол-изопропанала дает белые кристаллы, т.пл. 275,0°С (разл.) Найдено :С 52,74; Н 4,46; К 22,01. ИК-спектр (Nujol), 3420, СЛН); 3340, 3200 ( , 1680, 1620, 1580, фopмa д, лактамХС N) . ЯМР (DMaJ-di) 8,38-7,72 : 2, мультиплетные сигналы для конформаций NHCHOI 4,00 14, m,CCF,2)jl; 5,90 (2, Б, ), 7,25 (4, S, Аг) . Пример -3.4- ГС4-Хлорфенил) метилЗ-6,7-дигидро-ЗН7Имилаэо р. ,2-aJ пурик-9 (4Ь)-он. Суспензию 45,88 г ;1оД4 моль) формиламинопроизводного, полученного в примере 2, в смеси 130 мл уксусного ангидрида (1,4 моль) и 65 мл триэтилортоформиата (0,39 моль кипятят с обратным холодильником в течение 5 ч (раствор образуется через- 30 мину. Концентрирование под вакуумом примерно до 1/4 первоначального объема дает масло, которое растворяют в 300мл воды. Смесь обрабатывают активированным углем и отфильтровывают, прозрачный фильтрат нейтрализуют концентрированным водным аммиаком. Белый осадок отфильтровывают и высушивают в вакуум-сушильном шкафу, получая 28,06 г (66%) белого твердого вещества, т.пл. 285-290°С. Перекристаллизация из диметилформамид-изопропанола дает белые кристаллы, т.пл, 289-293 С (скорр.т.пл. 284,0285,О°С). Если этот продукт согласно данным спектра ЯМР содержит сольватированный ДМФ, то его можно удалить ., перемешиванием суспендированного твердого вещества в эфире с последующей сушкой,
Найдено,%: С 55,96, Н 4,40v
N 23,16,
ИК (Kujol), 1620 (С N) 1680 СС о1.,
ЯКР (DMSO-dt), m.g. :, 3,84 U, m, ( 5,10(2, S, ) ,7,, S, Ar), 7/91 tl, S, CH).
Хлористоводородную соль этого продукта получают растворением 21,7 Т вьшеполученного продукта в 75 мл 3 и. соляной кислоты до полного растворения осадка, начинает выпадать новое белое вещество. Добавляют воду tlOO смесь нагревают до растворения осадка. Раствор обрабатывают активированным углрм и. фильтруют, к теплому фильтрату добавляют изопропанол С150 мл) и при охлаждении вы,падает осадок. Его собирают, высушивают в вакуум-сушильном шкафу при
80с в течение ночи, получают 17,ОБ г т.пл. 249-250 0 (разл. скорр.) ,
Найдено, %: С 49,75; Н 3,83, К 20,92.
Пример 4. Пиролитический способ получения продукта примера 3.
.Суспензию 7,20 г С0,022 моль рродукта, полученного в примере 2, в небольшом объеме ДМФ повышают в масляную баню при 260 С.Быстро упаривают ДМФ и остаточную лепешку нагревают в течение 12 мин при постоянном перемешивании. Полученное светло-коричневое твердое вещество (6,36 г, 93%J имеет т.пл. 280-285 С. Перекристаллизация из ДМФ дает продукт, идентичный продукту, полученному в приме -ре 3.
Различные амины используют вместо 4-хлорбензиламина в условиях примера 3 и полученные нитрозоимидазопиримидиноны превращают по способу примера 2 в соответствующие формиламиноимидазопиримидиноны, которые затем превращают либо по способу примера 3 либо по способу примера 4 в один из продуктов формулы J.} .
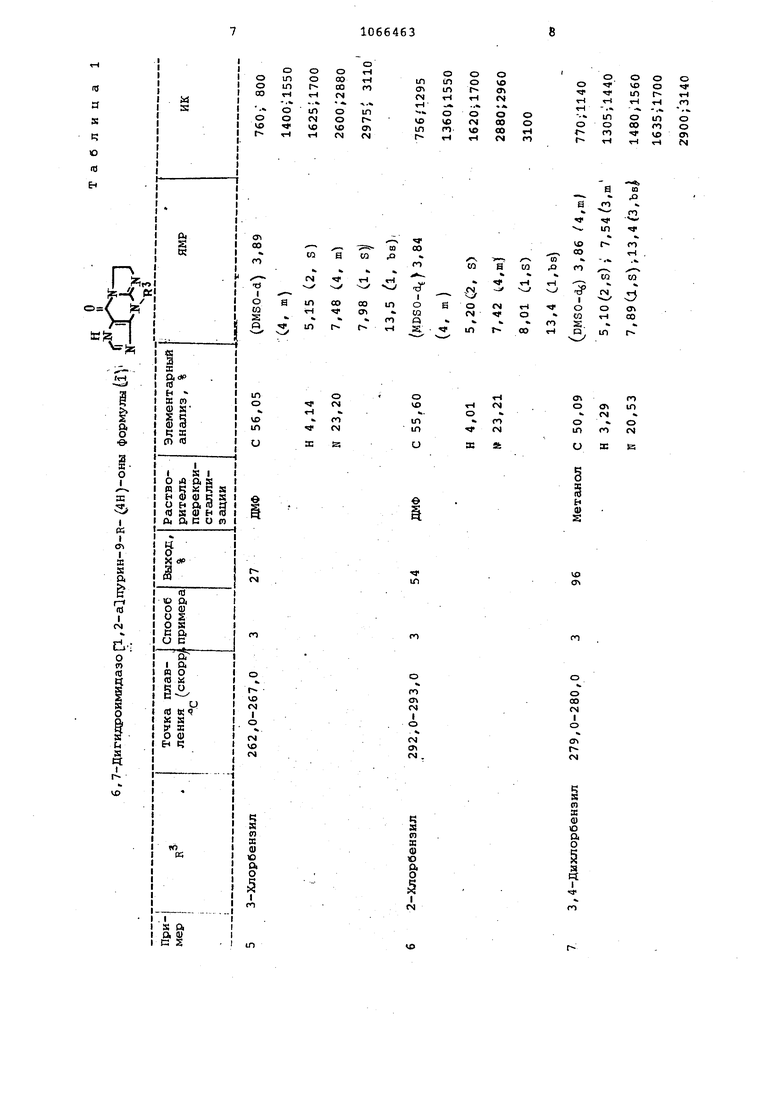
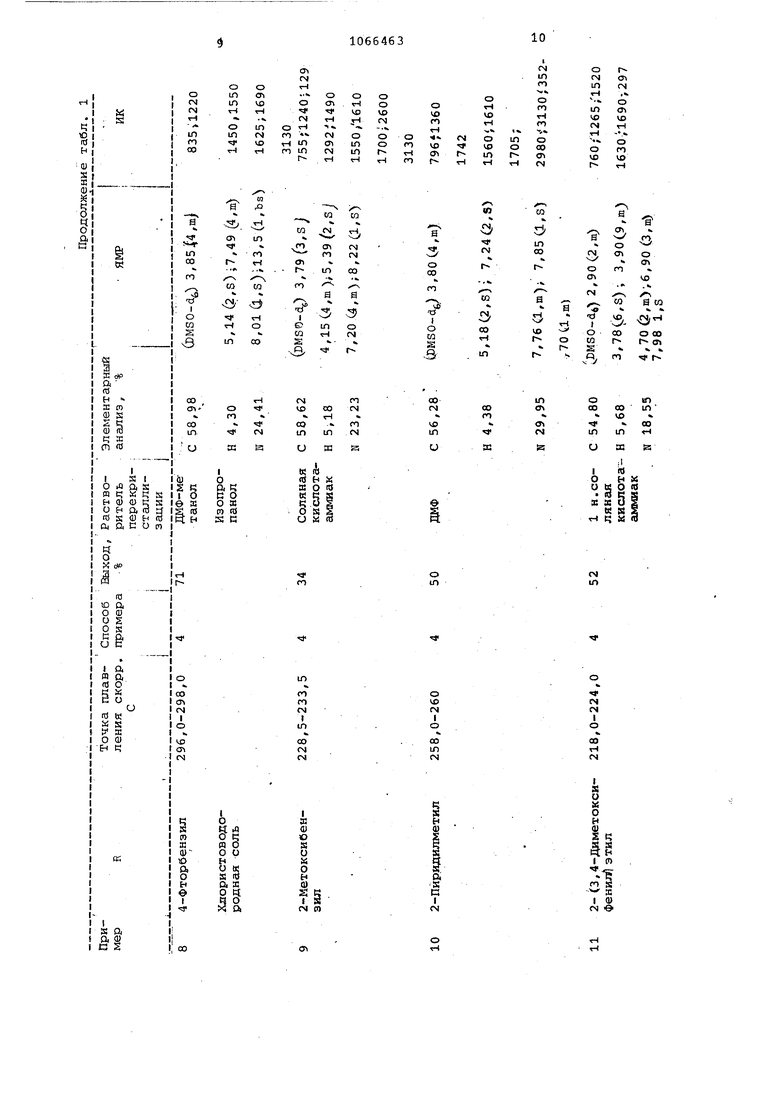
В табл. 1 приведены условия и результаты проведения примеров 5-13. Приме р-14. 4- t(4-Xлopфeнил кетил -2 этил-6,7-дигидроимидазо 1,2-а1пурин-9(4Н)-он. Смесь из 25,00 г (0,078 моль про дукта примера 2,50 мл безвод ого пиридина и 50 мл (0,388 моль) пропионового ангидрида кипятят с обратным холодильником в течение 3 ч. При охлаждении выпадает белое вещество. До бавляют ацетонитрил, отфильтровывают белое твердое вещество и высушивают на воздухе/ получают кристаллы, т.пл 278,0-279,0° С скорр.) . Полученный материал можно перекристаллизовать из ДКФ-изопропанола. ЯМР (DMSO-d) : 1,22 (З, t 7,5 Гц) 2,67 2,9-, 7,5 3,98 (4, кj , 5,08 (.2, S , 7,43 (4., т};11,зС1, широкий синглет) ИК: 756, 805, 1295, 1510,.1630, 1695, 30Sb, 3100, 3160. Найдено,%: С 58,28; Н 4,76; И21., Пример 15. 4- :(4-ХлорфенилУ метил- -6,7-дигидра-2-к-етилимидазо р.,2-сЛпурин-9 , В условиях примера 14, заменив пр .пионовый ангидрид уксусным ангидридом, получают целевой продукт в виде твердого вещества кремового цвета, т.пл. 311,5-313,5° С Сск6рр, J перекристаллизованный из ДМФ-изопропанола Найдено,%: С 56,72; Н 4,,З (DMSO-db): 2,36 .(З, В 3,91 С4, .ml, 5,20 С2, S) 7,90 (,4, т , ИК: 755, 04, 1020, 1294, 1510, 1630,. 1690, 3050, 3160. Пример 16. 4- (2-Хлорфенил метил --2- (1-метилэтил) -6 , 7 дигидрокмидазо Г1 2-а пурин-9 (4К) -он . Вместо 4-хлорбензиЛоГ -ина в условиях примера 1 используг-т 2-хлорбензиламин и полученный нитрозоил-идазопи римидинон превращают в соответствующее формиламиносоединение согласно примеру 2, а полученный продукт зат подвергают реакции с изомасляным ангидридом в смеси изомасляного ангидрида и пиридина согласно примеру 14, Получают продукт в виде легкого кристаллического белого вещества, т.пл; 249,5-255, (после перекристаллизации из смеси хлороформа и ацетонитрила). Найдено,%J С 59,34, Ы 5,54;н 20, ЯКР (DMSO-di): 2,10 Сб , d,- 6,5 Гц| 2.94 (12, септет, 6,5 Гц), 3,84 (4, ml; 5,12 (2, s},- 7,30 (J, га). ИК; 760, 1300, ISOS; 1626, 2980, 3180. П р и м е р 17. .2-Бромо 4-Г ( фенилСметил1.-6,7-дигидро-ЗН-имидазо С1,2-а1пурин-9 ) -он бромгидрат , Бром (1,6О г; 0,010, моль j добавпяют к раствору 2,00 г:0,0066 продукта примера 3 в 10 мл уксусной кислоты и полученный .раствор нагревают на паровой бане в в течение 10 мин. Выпадают желтые хлопья, их отфильтровывают и высушивают (i;a воздухе, получают 3, 29 г твердого вещества, т.пл. 212 С разл.) Нагревание суспензии продукта в ацетонитриле дает белый порошок, т.пл. (разл.) . Перикристалли зация из ДМФ-ацетонитрила дает тонкие белые иглн, т.пл. 228,5-229,5 С (разл. скоррД Найдено,%: С 36,48; Н 2,92,К 15,01. Пример 18. 7-Амино-8-б §нзил-2,3-дигидро-б-нитрозоимидазо-1,2-а пиримидин-5 С8Н)-он получен в условиях примера 1 при замене 4-хлорбензиламина бензиламином. Т.пл. продукта 242°С (разлО выход 68%, перекристаллизован из №Ф. Пример 19. 7-ДМИНО-2,3-дигидро-б-формиламиноимидазоС /2-а}пирнмндин-5 (8Н)-он получают в условиях примера 2 из продукта .примера 18, т.пл. 26 8 С (разл.) , выход 40%. Продукт не перекоисталлизовывают. Пример 20. 6,7-Дигидро-2-С1-метилэтил|-4- (2-метилпропионил) -ЗН-имидазо|:1, 2-е1пурин-9 (4Н) -он получают по методике примера 14 из продукта примера 19, заменяя пропионовый ангидрид изомасляным ангидридом Продукт получают с выходом 35%, т.пл. 271,0-273, (скоррект. , после перекристаллизации из изспропанола. Найдено,%; С 58,50-, Н 6,25; и 24,39. ЯМР (ЕМЗО-йб) : l,2G{6, d);.1.34 (6, d); 3,00 а, m); 4,10 (5, ю) ; з, 2 (1, DS) . ИК:; 780, 1250, .1275, 1365, 1410, 1540, 1580, 1700, 2980, 3200.Пример 21. 7- мино-8- L(4-фторфенил)метил1-6-(формил-.амино) -. -2, 3-дигидроши.идазс 1,2-а1пиримидин-5(6НУ-он. 7-ЙМИНС-2,З-дигидро-8-С(4-фторфенил «этил1-6-нитрозоимидазоС1/ 2-а пиримидин-5 (8Н)-он получают по способу примера 1, заменяя 4-хлорб ндиламин-4-фтор6ензиламином.К полученноь продукту (9 ,79 г О ,034 моль), т.пл,223,5225,5 С (сраз,л„, скоррект. , в 100 мл 97%-ной муравьиной kиcлoты при комнатной температуре добавляют 15,00 г (0,086 моль) дитионита натрия частямк в течение - 5 мин. Раствор превращается из темно-пурпурного в светложелтый, .во время этой экзотермической реакции и образуется желтый осадок. Смесь перемешивают в.течение 10 мин, затем упаривают в вакууме до объема мл. Остаток растворяют в 150 мл воды, фильтруют и нвйтрализу1ст концентрированным аммиаком. Белый осадок собирают, суспендируют в горячем метаноле и отфильтровывают. Сушка в вакуум-сушильном шкафу дает 9,25 г 90%) белого i-вердого вещества,т.пл.
248-250 С. Перекристаллизация из метанола дает белые кристаллы, т.пл. 262С (с разл.).
Найдено,%s С, 55,20, Н 4,62 N 22,87.
Полученное формиламиносоединение в условиях примера 4 превращают в продукт, идентичный с продуктом, полученным в примере 8.
Пример 22. 7-АМИНО-8-(фенимeтилV2, 3-дигидро-б- (формиламино) имидазо С1,2-а1пиримидин-5-{. получают способом примера 21 из продукта примера 18 с выходом 86%, т.пл. 248-250°С (после перекристаллизации из ДМФ-изопропанола) .,
Найдено,%:Р 58,84, Н 5,38iN 24,3
ЯМР (DMSd-Tjtj): 3,79 С4, т i 5,30 C2,S); 6,66 (2, Ьв); 7,50 С5, mV; 8,36 С1 sy, 8,82 1, S .
ИК: 700, 740, 1305, 1500, 1580, 1612, 1655, 3200, 3320, 3400.
Пример 23. 4-СФенилметил)-6,7-дигидро-ЗН-имидазо С1 2-а -цуРИН-9С4Н1-ОН получают способом примера 22 КЗ формиламиносоединения примера 3. Получают продукт с выходом 64% в виде светло-желтого кристаллического твердого вещества, т.пл. 262-264 С (скоррект. , после перекристаллизации из ДМФ-изопропанола..
Найдено,%: С 62,57/ Н 5,15; N 26,13.
HMP(DMSO-dl;,): 3,88 С4, т); 5,16 (2, 7,45 (5, m) 8,00 (.1,5.
ИК: 715, 764, 1300, 1435, 1550, 1620, 1700, 3150.
Пример 24. 1-Бутил-4С -хлор енил метил1-6,7-дигидроимидазо 1, 2-а1пурин-9 (4Н)-он хлоргидрат .
К перемешиваемой суспензии 1,77 г Со,0059 моль) продукта примера 3 в 20 МП безводного ДМФ добавляют 0,27 г Ср,0065. моль) гидрида натрия (57% дисперсия в минеральном масле). После завершения растворения добавляют 0,69 г 0,0065 моль) бромистого
Ц-бутила и смесь нагревают при в течение 3 ч. Добавляют воду С200 мл, и водную часть сливают от выпавшего смолистого вещества. Его растворяют в 100 МП 1 Н. соляной кислоты и филь5 труют. Полученный желтый раствор подщелачивают аммиаком, и полученное смолистое вещество экстрагируют изопропанолом. Изопропаноловый раствор подкисляют раствором хлористого во0 дорода в этаноле и упаривают. Твердый осадок перекристаллизовывают из ацетонитрил-этилацетата, получают 0,65 г С28%) бледно-желтых кристаллов, т.пл. 223-225°С Сскоррект.) .
5 т.пл.205,5-206,5 С Сразл.).
ИК: 770, 1310, 1480, 1500, 1608, .1660, 1720, 2710 и 31.10.
HKPCcDCIj : 0,83 СЗ, t-, 6,2 Гц); 1,27 С2, т-); 1,73 (2, т), 4,28 С6, тЬ 5,88 C2,SV, 7,39 С2, 8,04 Cl, S .
Примеры 25-32. Используя методику примера 24 к продукту примера 13, заменяя бромистый н-бутил следующими реагентами, получают аналогичные продукты, которые перечислены в табл. 2.
Таблица 2









Способ получения производных имидаэо{ 1,2-а)пурина общей формулы ,. С1) где R - водород, Сд-Сг -алкил, замещенный галогеном аралкил с 8-12 атомами углерс5да или арилоксиалкилс 8-12 атомами углерода, R - водород, галоген или С -О апкил, R - водород, С -С -алкил, 4-,3-или 2-пиридилметил, аралкил с.8-12 атомами углерода, замещенный одним или двумя галогенами , одним или двумя С(-Q -алкоксигруппами, или арилоксиалкил „с 8-1,2 атомами углерода, в и В - водород или метил или их кислотноаддитивных солей, отличающийся тем, что соединение общей формулы Ат 4. и -И л NT} вгк iijN к5 где В -R имеют указанные значения, восстанавливают в формилирующих условиях, полученный моноформилдиаминопиримидин общей формулы О II , со ЁЗ аи) г где В -В имеют указанные значения, подвергают циклизации с последующим выделением целевого продукта в виде основания или кислотноа дитивной 4 соли, или галогенируют для получения соединения формулы Cl), где R - галоген , или алкилируют или аралкилируют для получения соединения форо: мулы 1, где R - указанный алкил :о или аралкил, с последующим выделением целевого продукта в виде основания или кислотноаддитивной соли.
Хлористый 4-фторбензил
Хлористый 3,4-дихлорбензил
Хлористый 2-метоксибензил
Бромистый 2- (4-хлорфенил этил
3-Хлорметилпиридин
4-Хлорметиопиридин
З-бром-2-метилпропенил
Бромистый 2-нафтилметил
4-фторбензил
3,4-Дихлорбензил
2-Метоксибензил
2- (4-Хлорфенил этил
3-Пиридилметил
4-Пиридилметил
2-Метилпропенил
2-Нафтилметил
l-R-6,7-диги о-4- (2-метилпропил)-. -имидазо 1,2-а1 пурин-9 (.4Н|-он
Выход 53%, перекристаллизован из ацетонитрила, т.пл, 228-230°с.
ЯМР CCDCl3 i: 1,10 t6, d; 6,2 Гц), 2,40 (.l,m)t 4,41 (8,m); , 4,83 (2,t , 6,0 Гц); 7,21 8,06 (1,3), 13,07 (l,bs).
ИК: 700, 760, 1250, 1460, 1600, 1645, 1715, 2600, 2980.
Найдено,.%: С 58,75, Н 6,18, N 17,88.
Пример 33. 1,4-Ди 13 Ф1орФрнил метил -б ,7-дигидро-кмидазо 1,2-а1пурий-9 С4Н)-он получают по
методике примерна 54 из соединения примера 3, используя 4-фтор6ензилхлорид вместо бромистого и.-бутила. Продукт получают с выходом 53%, перекрисгаллизовывают из смеси изрпропиловый спирт-гексан, т.пл. 186,0188, (скорр .J
ЯМР (ССС1з 4,03 Сп1,4) 5,25 (3,2); 5,45 CS,2V, 7,34 Cm,8) и 7,574S,1).
- ИК: 760, 775, 834, 1230, 1520, 1648 и 1690.
Найдено,%: С 63,76, Н 4,54, N 17,50.
В табл. 3 приведены фармакологические свойства соединений, получаемых по предлагаемому способу.
о in
Of
in м
in
CN
01
гН
rj
о
о fdp VO OJ
п
10
гН Г)
чо
со
ОО
ш (П
чП
о
п
ш
о in
in
г
in
чVD
г
тН
-fe
-У Р
О
(N т-1 гН
&
D
1Л Ltl
о о
CN (N
О СО
(N
1Л ГМ
из
(М
N
О
.:i .3
ТК
о
.-3
Ч
0-1
Ч
Oi
on
CM Бронхорасширяюи;ее действие in vitro оценивали на изолированной тр хеальной спирали морской свинки, оп деляя концентрацию вещества, требую щуюся для релаксации самопроизвольн го тонуса Сспон) ткани, а также кон центрации, вызванной такими спаэмогенами, как ацетилхоли нхлоридом (АЦХ), гистамином (.гист1, хлористым барием. Активность выражают в концентрации, необходимой для.50% ингибирования контр актуры ), котору|о находят построением кривой, выражаю щей зависимость ингибирования от концентрации исследуемого вещества Стабл, 3), Бронхорасширяющее действие in vivo оценивают на крысах, определяя дозу исследуемого вещества, вызывающую ингибирование бронхоспазма, индуцированного- метахолином Стабл.З Процентные величины представляют собой процент ингибирования при дозе испьатуемого соединения, указанной в скобках, и наоборот, данные значения представляют собоЦ дозу в мг/кг веса тела, требуемую: для 50% ингибирования бронхоспазма СЕДд,у В этом опыте измеряемым параметром является давление в легочной ajjTeрии СДЛ.) при дыхании у анестез ированных животных. Испытуемые соединения вводят интрадуодеально через 5,15 и 30-минутные промежутки после внутривенного введения дозы метахолина, вызывающей 50% снижение ДЛА и определенной предварительно. Процент ингибирования представляет собой степень, с которой испытуемые соединения ингибируют снижение ДЛА, вызванное действием метахолина. Антиаллергическое действие, выражающееся в способности ингибировать немедленную реакцию гиперчувствительности, оценивают с помощью пассивной кожной анафилактический реакции (РСА) на крысах (табл. 3). Животных пассивно сенсибилизировали внутрикожным введением крысиной антисыворотки в различные места кожи на освобожденной от волосяного покрова спинке и через 48 ч вводили испытуемый препарат. После этого через заранее определенные промежутки времени, обычно через 15 мин, вводили яичный альбумин .и голубой Эванса. Оценивали кожную реакцию в сенсибилизированных участках и измеряли дис1метр папулы, появившейся в сенсибилизированном участке, В табл. 3 даны значения либо ЕД испнтуекых соединений в миллиграмм на килограмм веса тела, введенных орально, либо в проценте ингибирования для дозы, указанной в скобах С1 означает неактивное пои данной дозе). Антиаллергические испытания (табл. .З) проводили также на крысах, активно сенсибилизированных яичным альбумином и вакциной В. pertuBsis, использованной в качестве антисыворотки в РСА опыте. Через 15 дней после сенсибилизации животных подготовили для измерения ДЛА: как и в опыте по индуцированному метахолином бронхоспазму измерили изменения ДЛА после заражения яичным альбумином и обработки исследуемым препаратом. В табл. 3 даны значения ЕДда в миллиграмм на килограмм веса тела для исследованных соединений, введенных орально.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Гетероциклические соединения Под | |||
| ред | |||
| Р | |||
| Эльдеофильда | |||
| Т | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Деревянное стыковое устройство | 1920 |
|
SU163A1 |
Авторы
Даты
1984-01-07—Публикация
1978-03-23—Подача