Изобретение относится к химии гетероциклических соединений, а именно к замещенным 1-(пиридинил-3)-2-(пиразолил-1)этанолам-1 общей формулы I,
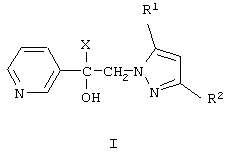
где R1 и R2 независимо друг от друга означают атом водорода или алкил с числом атомов углерода от одного до четырех, Х означает циклоалкил с числом атомов углерода от трех до восьми, группу 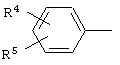 или группу
или группу 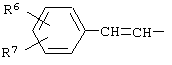
где R4, R5, R6 и R7 независимо друг от друга означают атом водорода, галогена или трифторметильную группу, которые обладают фунгицидной активностью и могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
Известны 1-пиридинил-2-имидазолилэтанолы общей формулы II, где R1 означает атом водорода, алкильную группу или атом галогена, R2 означает замещенный или незамещенный тиенил или замещенный или незамещенный фенил, R3 означает атом водорода или метальную группу [Заявка ФРГ №3345813 А1, кл. C 07 D 401/06, 1983], которые обладают антидепрессантной активностью и могут быть использованы в медицине.
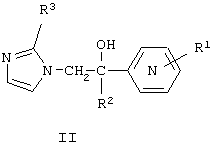
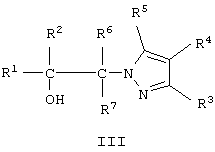
Известны соединения формулы III, где R1, R2, R6 и R7 означают Н, алкил, галоалкил, арил, алкиларил, алкокси, арилокси, алкоксиарил, гидроксиалкил, циано, амино, нитро, карбоксамидо, карбалкокси или гетероцикл, R3, R4, и R5 означают Н, галоген, алкил, арил, аралкил, алкокси, алкокси, арилокси, алкоксиалкил, амино, гидрокси, гидроксиалкил, циано, карбалкокси, которые обладают гипогликемическими, противовирусными и жаропонижающими свойствами и могут быть использованы в качестве фармацевтических препаратов [Пат. США №3303200, кл.260-310,1967].
В зависимости от физико-химических свойств препарата, его назначения и способа использования, пестициды применяют в виде различных препаративных форм (композиций), например в виде порошков, гранулированных препаратов, микрокапсулированных препаратов, растворов в воде и органических растворителях, смачивающихся порошков, концентратов эмульсий, мазей и мастик. Препаративные формы помимо основного действующего вещества содержат различные наполнители и добавки, характер которых определяется конкретными условиями применения такой формы. Так, растворы пестицидов в воде или органических растворителях, применяющиеся для опрыскивания растений, внесения в почву различными методами, пропитки материалов содержат действующее вещество и растворитель, но могут также содержать регуляторы кислотности, поверхностно-активные вещества, красители, умягчители воды, синергические добавки. Известен препарат ДНОК, который применяют в виде водного раствора для опрыскивания садов и виноградников в концентрации 0,1-0,2% [Пестициды и регуляторы роста растений / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.9-26, 242].
Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами.
Для решения этой задачи синтезируют замещенные 1-(пиридинил-3)-2-(пиразолил-1)этанолы-1 общей формулы I, обладающие фунгицидной активностью.
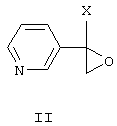
Согласно изобретению, замещенные 1-(пиридинил-3)-2-(пиразолил-1)этанолы-1 формулы I получают взаимодействием замещенных 2-(пиридинил-3)оксиранов формулы IV с незамещенным или замещенным пиразолом в присутствии твердого гидроксида щелочного металла в среде высококипящего полярного апротонного растворителя, например, N-метилпирролидона, диметил-формамида или диметилсульфоксида, при 100-150°С в присутствии воды или без нее:
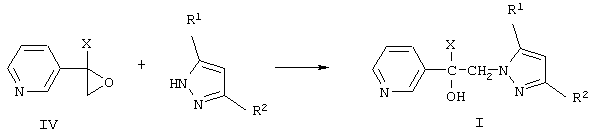
где R1, R2 и Х имеют те же значения, что и в формуле I.
Аналогичные процессы присоединения пиразола к другим замещенным оксиранам описаны в литературе [Пат. США №3303200, кл. 260-310, 1967].
Замещенные 1-(пиридинил-2)оксираны формулы IV получают взаимодействием пиридинилкетонов общей формулы V с солями триметилсульфония в диметилсульфоксиде или диметилсульфиде в присутствии сильного основания, например трет-бутилата калия, трет-амилата натрия или гидрида натрия, или в межфазных условиях при температуре от -10 до +5°С:
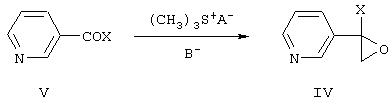
где X означает то же, что и в формуле I, А- означает анион кислоты, В- означает основание.
Для других субстратов такая реакция известна [E.J.Corey, M.Chaykovsky. Dimethyloxosulfonium methylide ((CH3)2SOCH2) and dimethylsulfonium methylide ((CH3)2SCH2). Formation and application to organic syntheses // Journal of the American Chemical Society. 1965. Vol.87. №6. P.1353-1364].
Пиридинилкетоны формулы V могут быть получены взаимодействием 3-цианопиридина с металлорганическими соединениями или металлированного пиридина с производными карбоновых кислот [P.S.Teague, A.R.Ballentine. Some pyridylhydantoins / J. Am. Chem. Soc.1953. Vol.75. P.3429]:
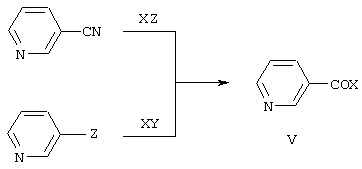
где Х означает то же, что и в формуле I, Y означает группу CN, CONAlk2, COOAlk, COHal, Z означает Li, MgHal, CdHal.
Кетоны формулы VI могут быть получены взаимодействием 3-ацетилпиридина с бензальдегидами:
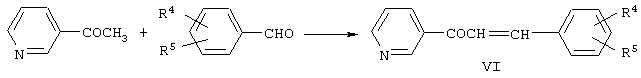
Кетоны формулы VI известны [Цукерман С.В., Никитченко В.М., Бугай А.И., Лаврушин В.Ф. Синтез и УФ-спектры поглощения пиридиновых аналогов халконов // В сб. Химическое строение и реактивность органических соединений. - Киев: Наукова думка, 1969. - С.53-59].
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. (Пиридинил-3)циклогексилкетон. К охлажденному до -70°С раствору 15,8 г (0,1 моль) 3-бромпиридина в 60 мл эфира при перемешивании приливают 65 мл 15%-ного раствора бутиллития в эфире (0,1 моль), реакционную массу перемешивают 10 мин и при перемешивании прибавляют по каплям раствор 18,1 г (0,1 моль) диметиламида циклогексанкарбоновой кислоты в 100 мл абсолютного тетрагидрофурана. Охлаждение снимают и оставляют смесь на ночь. Затем реакционную массу упаривают в вакууме, добавляют 50 мл насыщенного раствора NH4Cl и экстрагируют эфиром (3×100 мл). Экстракт промывают рассолом, сушат над MgSO4, отгоняют растворитель и продукт перегоняют в вакууме, собирая фракцию с т.кип. 140-155°С / 1 мм рт.ст. Получают 13,7 г (72%) (пиридинил-3)циклогексилкетона.
Пример 2. 2-(Пиридинил-3)-2-циклогексилоксиран. К смеси 2,1 г (0,01 моль) (пиридинил-3)циклогексилкетона, 2,86 г (0,014 моль) иодида триметилсульфония и 6 мл диметилсульфоксида при охлаждении до 0°С добавляют по каплям в течение 30 мин раствор 0,93 г (0,0126 моль) трет-бутоксида калия в 6 мл диметилсульфоксида. Смесь перемешивают 15 мин, охлаждают в смеси льда и соли и в течение 30 мин добавляют по каплям 30 мл воды. Реакционную массу экстрагируют СНСl3 (3х10 мл), экстракт промывают водой (3×10 мл) и 10 мл рассола, сушат над MgSO4 и растворитель отгоняют в вакууме. Получают 1,7 г (85%) 2-(пиридинил-3)-2-циклогексилоксирана.
Пример 3. 1-(Пиридинил-3)-2-(пиразолил-1)-1-циклогексилэтанол (1). К раствору 1,65 г (8,3 ммоль) 2-(пиридинил-3)-2-циклогексилоксирана и 0,57 г (8,3 ммоль) пиразола в 5,63 мл диметилформамида прибавляют 0,033 мл воды, 0,11 г гидроксида натрия и перемешивают в течение 4 ч при 120°С. Реакционную массу охлаждают, выливают в 40 мл воды, выпавшее масло экстрагируют 10 мл эфира, экстракт сушат над MgSO4, растворитель отгоняют, а продукт очищают на колонке с силикагелем. Получают 1,32 г (59%) 1-(пиридинил-3)-2-(пиразолил-1)-1-циклогексилэтанола.
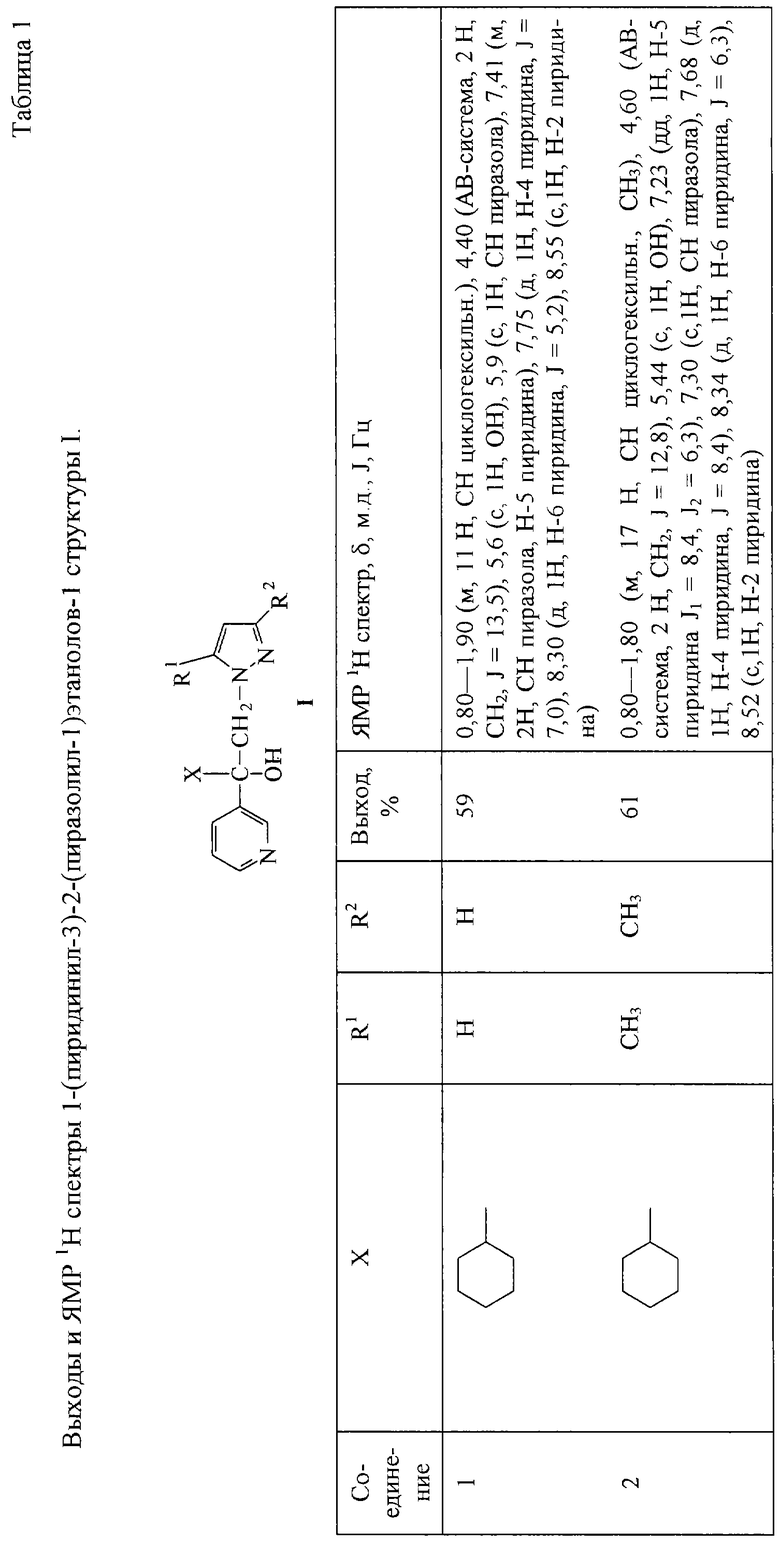
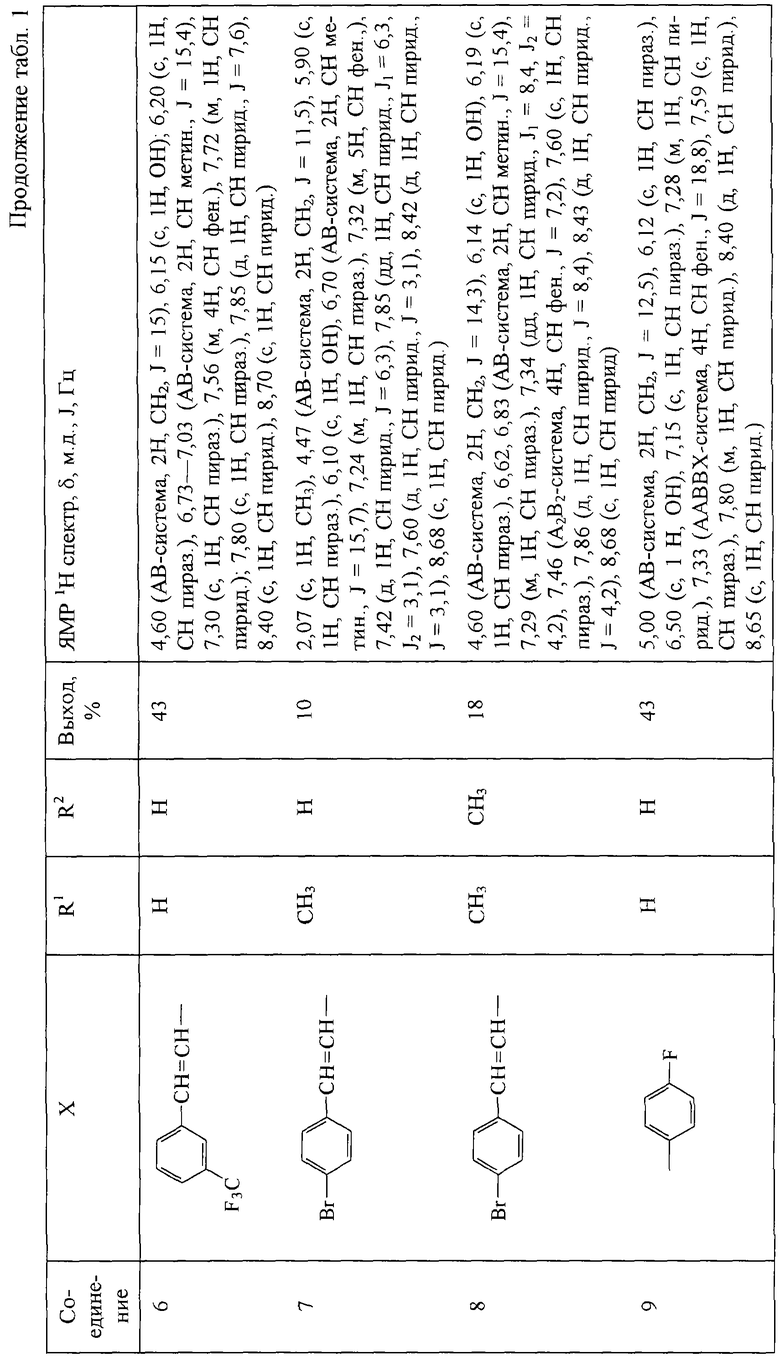
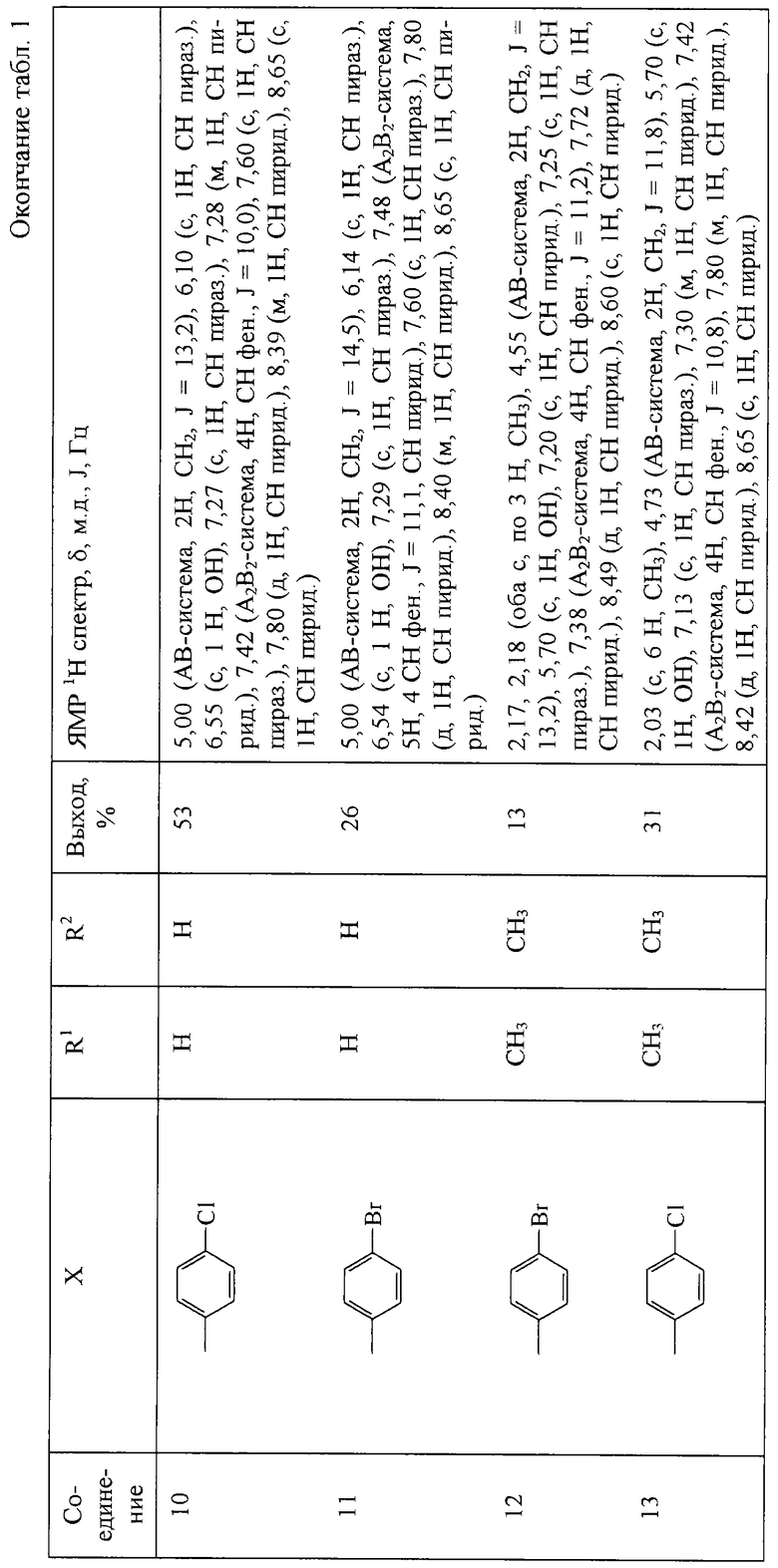
Другие 1-(пиридинил-3)-2-(пиразолил-1)этанолы-1 получают аналогично. Их выходы и ЯМР 1Н спектры приведены в табл.1.

Пример 4. Испытания на биологическую активность соединений проводили в экспериментах in vitro. В расплавленный сахарозно-картофельный агар добавляли испытуемое вещество в виде композиции, содержащей 3 мг/мл действующего вещества, остальное - ацетон, по 1 мл на 100 мл агара. При этом получали агаровую среду, содержащую 30 мг/л испытуемого соединения. В среду для контроля добавляли чистый ацетон в том же количестве. Приготовленные таким способом среды разливали в чашки Петри, охлаждали и на поверхность затвердевшего агара высевали кусочки мицелия грибов, после чего чашки инкубировали в течение 3 суток при 25±0,5°С. Подавление роста мицелия вычисляли в процентах к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в табл.2.
Результаты испытаний замещенных 1-(пиридинил-3)-2-(пиразолил-1)этанолов-1 на фунгицидную активность в концентрации 30 мг/л.
Обозначения: V.i. - Venluria inaequalis, R.s. - Rhizoctonia solani, F.o. - Fusarium oxysporum, F.m. - Fusarium moniliforme, H.s. - Helminthosporium sativum, S.s. - Sclerotinia sclerotiorum
Описываются замещенные 1-(пиридинил-3)-2-(пиразолил-1)этанолы-1 формулы I, где R1 и R2 означают атом водорода или С1-С4 алкил, Х означает циклоалкил с числом атомов углерода от трех до восьми, фенил, стирил, их способ получения и фунгицидная композиция на их основе. Представленные соединения обладают фунгицидной активностью и используются для более эффективной борьбы с вредоносными грибами. 3 н.п. ф-лы, 2 табл.
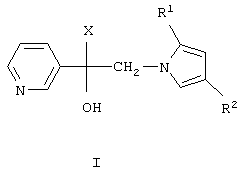
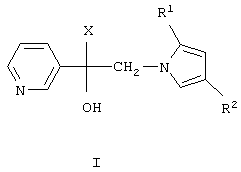
где R1 и R2 независимо друг от друга означают атом водорода или алкил с числом атомов углерода от одного до четырех,
Х циклоалкил с числом атомов углерода от трех до восьми,
группу 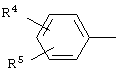 или группу
или группу 
где R4, R5, R6 и R7 независимо друг от друга означают атом водорода, галогена или трифторметильную группу.
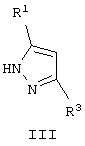
где R1 и R2 независимо друг от друга означают атом водорода или алкил с числом атомов углерода от одного до четырех,
Х циклоалкил с числом атомов углерода от трех до восьми,
группу 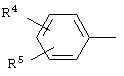 или группу
или группу 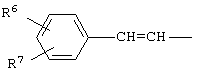
где R4, R5, R6 и R7 независимо друг от друга означают атом водорода, галогена или трифторметильную группу,
в присутствии твердого гидроксида щелочного металла в среде полярного апротонного растворителя при 100—150°С в присутствии воды или без нее.
| СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ ПОСЛЕРОДОВЫХ ЭНДОМЕТРИТОВ У КОРОВ | 1997 |
|
RU2129000C1 |
| US 4623654, 18.11.1986 | |||
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛА, ОПТИЧЕСКИ ИНЕРТНЫЕ ИЛИ ИМЕЮЩИЕ R- ИЛИ S-КОНФИГУРАЦИЮ C-2 И C-3 АСИММЕТРИЧНЫХ ЦЕНТРОВ, ИЛИ ИХ СОЛИ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1990 |
|
RU2039050C1 |
Авторы
Даты
2005-05-10—Публикация
2004-02-03—Подача