Изобретение относится к химии гетероциклических соединений, а именно к замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5] деканам общей формулы I:
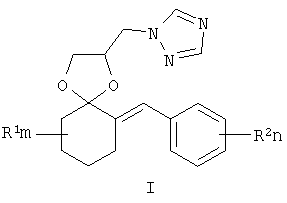
где R1 - одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 - одинаковые или разные, означают атом водорода или галогена; m и n означают целые числа от 0 до 5; к их солям с кислотами, или комплексам с солями металлов, обладающими фунгицидной активностью. Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов.
Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибными болезнями растительных организмов, животных или человека.
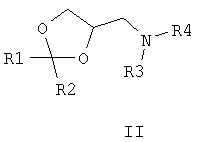
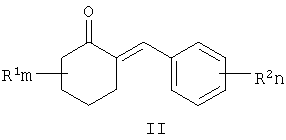
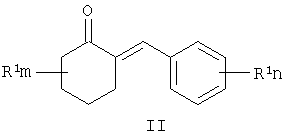
Известны многие продукты с азольными и диоксолановыми циклами, в частности замещенные 4-аминометил-1,3-диоксоланы, общей формулы II, где R1, R2, R3, R4 означают алкильный, циклоалкильный, алкенильный, арильный, гетероциклический заместители [патент США №4503059, МКИ C07D 317/16, заявл. 20.05.1983, опубл. 05.03.85], проявляющие фунгицидные свойства.
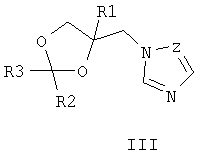
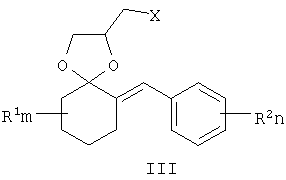
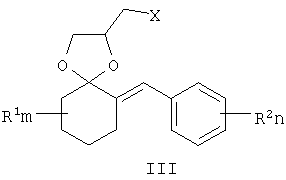
Известны 4-азолилметилзамещенные 1,3-диоксоланы с фунгицидной активностью общей формулы III, где R1 означает атом водорода, алкильный, циклоалкильный или ароматический заместители, R2 и R3 означают атом водорода, алкильный, арильный, а также R2 и R3 совместно могут представлять полиметиленовую группу, Z означает атом углерода или атом азота [патент Великобретании №2095236, МКИ A01N 43/50, заявл. 22.02.1982, опубл. 29.09.1982].
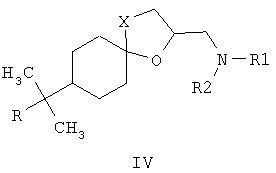
Наиболее близкими к заявленным замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканам по структуре и по способу получения являются соединения общей формулы IV, где R представляет собой атом водорода, алкильный заместитель с разветвленной или неразветвленной цепью и с числом атомов углерода от 1 до 6, а также циклогексильный и фенильный фрагменты, замещенные атомами водорода или имеющими от 1 до 3 разных или одинаковых алкильных заместителей с числом атомов углерода или галогенов от 1 до 4; R1 и R2 могут представлять собой атом водорода, алкил, с числом углеродных атомов от 1 до 12, алкенил или алкинил, с числом атомов углерода от 3 до 8, гидроксиалкил, с числом атомов углерода от 3 до 6, алкоксикарбонил, с числом атомов углерода от 1 до 6, циклоалкил, циклоалкилалкил, с числом атомов углерода от 3 до 7, диоксоланилалкил, диоксанилалкил, оксоланилалкил, с числом атомов углерода от 1 до 4, арилалкил, арилалкенил, арилалкинил, с числом атомов углерода от 6 до 10; R1 вместе с R2 и совместно с атомом азота могут представлять собой гетероциклические радикалы: пирролидинил-, морфолинил-, пиперидинил-, тиоморфолинил-, азепанил-, замещенные алкильными или гидроксиалкильными заместителями с числом атомов углерода от 1 до 4 [патент ФРГ №3735555, МКИ C07D 317/72, заявл. 21.10.1987, опубл. 15.09.1988], обладающие фунгицидной активностью. Соединения общей формулы IV получают взаимодействием 2-хлорметил-1,4-диоксаспиро[4.5]деканов с аминами в среде амина или диметилформамида при нагревании. Наиболее эффективным из упомянутых в патенте соединений является спироксамин (8-трет-бутил-1,4-диокса[4.5]декан-2-илметил(этил)(пропил)амин), находящий применение для борьбы с грибными болезнями растений в период вегетации. Нормы расхода этого препарата при защите, например, зерновых культур сравнительно высоки и составляют 500-750 г/га, в то время как такой широко используемый фунгицид как триадимефон на зерновых культурах применяют с нормами расхода 125-500 г/га [The world compendium. The e-Pesticides Manual 2000-2001. 12th Version 2.0. Ed. C.D.S. Tomlin-British Crop Protection Council].
Алкилированию азолов, в частности 1,2,4-триазола, посвящено множество статей. Первоначально получают 1,2,4-триазолат щелочного металла, например, взаимодействием с гидридом натрия в ДМФА или с этилатом натрия в спирте, к которому затем прибавляют алкилгалогенид и получают 1-алкил-1,2,4-триазолы [Bergtrap M., Larsen P. Alkylation, acylation and silylation of azoles.// Acta Chem. Scand. - 1990. - Vol.44, №10. - Р.1050-1057].
Известны способы получения замещенных 4-галогенметил-1,3-диоксаланов или 2-галогенметил-1,4-диоксаспиро[4.5]деканов циклизацией замещенных кетонов или алкилциклогексанонов с 3-галоген-1,2-пропандиолами при катализе кислотами, которую проводят с азеотропной отгонокой воды [Wolinski J., Czerwinska A. Poszukiwanie zwiazkow antycholinergicznych. // Acta Pol. Pharm. - 1976. - Vol.33, №6. - P.695-699].
Замещенные 2-бензилиденциклогексаноны получают взаимодействием циклогексанонов с ароматическими альдегидами в присутствии оснований, например водного раствора гидроксида калия при нагревании [Jonson W. Introduction of the Angular Methyl Group. The Preparation of cis- and trans-9-Methyldecalone-1. // J. Am. Chem. Soc. - 1943. - Vol.65, №7. - Р.1317-1324].
Техническая задача данного изобретения состоит в увеличении эффективности фунгицидных препаратов и расширении их ассортимента.
Поставленная задача заключается в получении соединений общей формулы I, обладающих фунгицидной активностью, а также в увеличении эффективности фунгицидных препаратов за счет применения замещенных 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканов I и расширении ассортимента фунгицидных препаратов.
Согласно настоящему изобретению, замещенные 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканы VII получают взаимодействием 2-бензилиденциклогексанонов V, где R1 - одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 - одинаковые или разные, означают атом водорода или галогена; тип означают целые числа от 0 до 5, с 3-галоген-1,2-пропандиолами VI, где Х означает хлор, бром и йод, например, с 3-хлор-1,2-пропандиолом, при катализе кислотами, например n-толуолсульфокислотой, серной кислотой и др., при кипячении в органическом растворителе, например бензоле или толуоле с азеотропной отгонкой воды.
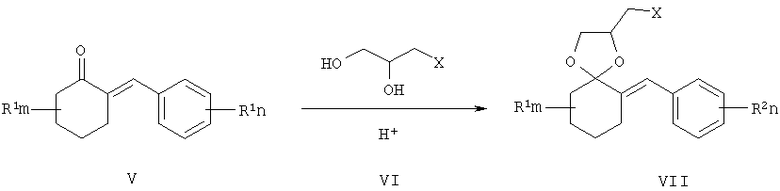
Согласно настоящему изобретению, замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы формулы I получают взаимодействием замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов VII, где R1 - одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 - одинаковые или разные, означают атом водорода или галогена; m и n означают целые числа от 0 до 5, Х означает хлор, бром и йод, с 1,2,4-триазолатом щелочного металла, где М+ означает щелочной метал, например натрий, калий и т.п., в среде полярного апротонного растворителя например, диметилформамида, при температуре от 60 до 180°С.

Техническим результатом изобретения являются новые вещества - замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы общей формулы I и способ их получения. В указанном патенте [патент ФРГ №3735555, 1988 г.] предлагается получать замещенные 2-аминометил-1,4-диоксаспиро[4.5]деканы технической чистоты в виде смеси основного продукта с продуктами побочных реакций. Авторы предлагают получать новые соединения 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы очищенными от примесей, выделяя их в индивидуальном виде, с помощью флеш-хроматографии. Помимо этого, авторы предлагают получать указанные соединения в стабильной при хранении кристаллической форме, например в виде их солей с щавелевой кислотой.
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, смягчители воды, синергические добавки и др. Известен препарат гетерофос, который применяют в виде 7.5%-ных гранул для защиты картофеля от нематоды и сахарной свеклы от корневой тли. [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.24, с.347].
Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещенных 2-азол-1-илметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека. По результатам фунгицидных испытаний in vitro замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы, например оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (5), превосходят используемый в качестве эталонного известный фунгицид - триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) по отношению к большинству из испытанных видов грибов-патогенов. Упомянутый в патенте-прототипе наиболее эффективный фунгицид спироксамин предлагают применять, например, для борьбы с грибными болезнями зерновых культур с более высокими нормами расхода, чем триазольный широко применяемый фунгицид триадимефон, который уступает по фунгицидной активности соединению 5.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. 2-(4-Хлорбензилиден)-6-метилциклогексанон (1). К раствору 22,4 г (0,2 моль) 2-метилциклогексанона и 25,4 (0,24 моль) 4-хлорбензальдегида в 50 мл метанола добавляли по каплям 33 мл 15% водного раствора гидроксида калия, перемешивали при комнатной температуре 1 час, затем кипятили на водяной бане при перемешивании 2 часа. После охлаждения экстрагировали реакционную массу хлороформом (2×70 мл), промывали органический слой разбавленной соляной кислотой, водой, сушили над сульфатом магния, хлороформ удаляли в вакууме, остаток перекристаллизовывали из изопропанола и получали 29,2 г (62%) 2-(4-хлорбензилиден)-6-метилциклогексанона (1) с т.пл. 67-68°С.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1.13 (д, 3 Н, СН3), 1.56-1.78 (м, 2Н, 2СН цикл.), 1.87-1.95 (м, 1Н, СН цикл.), 2.08-2.14 (м, 1Н, СН цикл.), 2.40-2.50 (м, 1Н, СН цикл.), 2.64-2.75 (м, 1Н, СН цикл.), 2.96-3.04 (м, 1Н, СН цикл.) 7.26 (т, 1Н, СН=С, J=6.2), 7.48 (с 4Н аром.); ИК-спектр, ν/см-1: 1670 (С=O), 1580 (СН=С), 730 (С-Cl).
Пример 2. 2-(4-хлорбензилиден)-4-метилциклогексанон (2).
К раствору 14,05 (0,1 моль) 4-хлорбензальдегида в 112 г (1 моль) 4-метилциклогексанона добавляют 1,17 л воды. При эффективном перемешивании добавляют 10,14 мл (0,875 М) раствора гидроксида натрия порциями, в течение 10 минут, перемешивают 10 часов, отделяют органический слой, водный слой экстрагируют хлороформом (3×60 мл), органические фазы объединяют, промывают 100 мл воды, 100 мл хлористого аммония, затем 50 мл воды, сушат над сульфатом магния, переносят в литровую круглодонную колбу. Под вакуумом отгоняют хлороформ и избыток 4-метилциклогексанона. К остатку массой 26,2 г, представляющему собой в основном 2-[(4-хлорфенил)(гидрокси)метил]-4-метилциклогексанон в виде светло-жетлого масла, добавляют 450 мл бензола, добавляют к нему 0,534 г (0,003 моль) n-толуолсульфокислоты и кипятят в течение 9 ч. По охлаждении реакционную массу промывают 5% раствором соды (2×10 мл), водой (2×30 мл), рассолом, сушат на сульфатом магния, отгоняют растворитель при пониженном давлении, остаток вакуумируют при комнатной температуре 2 часа при 0,5 мм рт.ст, затем добавляют к нему 35 мл изопропанола. Выпавшие желтые кристаллы отфильтровывают. Получают 10,1 г (43%) 2-(4-хлорбензилиден)-4-метилциклогексанона (2) в виде желтоватых кристаллов, т.пл.=71-72°С.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1.08 (д, 3 Н, СН3, J3=6.3), 1.49-1.75 (м, 1Н, СН цикл.), 1.80-2.10 (м, 2Н, 2СН цикл.), 2.21-2.60 (м, 2Н, 2СН цикл.), 2.60-2.66 (м, 0.7Н, СН цикл.), 2.66-2.75 (м, 0.3Н, СН цикл.), 2.94-2.98 (м, 0.7Н, СН цикл.), 3.02-3.08 (м, 0.3Н, СН цикл.) 7.26 (т, 1Н, СН=C, J3=6.2), 7.36 (с 4Н аром.), 7.42 (у.с 1Н СН=C);
ИК-спектр, ν/см-1: 1670 (С=О), 1590 (СН=С), 725 (С-Cl).
Пример 3. 2-Хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декан (3).
Смесь 20 г (0,085 моль) 2-(4-хлорбензилиден)-6-метилциклогексанона (1), 18,83 г (0,170 моль) 3-хлор-1,2-пропандиола, 0,731 г (0,00425 моль) n-толуолсульфокислоты в 120 мл бензола кипятят в течение 8 ч с насадкой Дина-Старка до отделения 1,7 мл воды. После охлаждения реакционную массу промывают 5% раствором гидроксида натрия (2×50 мл), водой, сушат над сульфатом магния, отгоняют бензол в вакууме. Получают 25,4 г (91%) 2-хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (3) в виде желтого масла, nD 20=1,5604.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1.00 (д, 3 Н, СН3), 1.25-1.48 (м, 2Н, СН2 цикл.), 1.52-1.60 (м, 1Н, СН цикл.), 1.60-1.75 (м, 2Н, СН2 цикл.), 1.75-1.87 (м, 1Н, СН цикл.), 1.87-2.00 (м, 1Н, СН цикл.), 3.45-3.60 (дд, 1 Н, СН2Cl, J3=10.2), 3.61-3.73 (дд, 1Н, СН2Cl, J3=10.2), 3.75-4.12 (дд, 2 Н, CH2O, J3=7,4), 4.35-4.50 (м, 1Н, СНО), 6.62 (c, 1H, С=СН), 7.15 (д, 2Н С3,5Н аром. J3=7.4), 7.32 (д, 2Н С2,6H аром. J3=7.4).
ИК-спектр, ν/см-1: 1590 (СН=С), 1090, 1175 (СОСОС), 720 (С-Cl).
Последующее соединение, упомянутое в примере 4, получают аналогично способу, приведенному в примере 3.
Пример 4. 2-Хлорметил-6-(4-хлорбензилиден)-8-метил-1,4-диоксаспиро[4.5]декан (4), выход 92%, nD 20=1.5561.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1.07 (д, 3 Н, СН3), 1.39-1.69 (м, 2Н, СН2 цикл.), 1.69-2.06 (м, 3Н, СН-СН3, СН2 цикл.), 2.21-2.77 (м, 2Н, СН2 цикл.), 3.42-3.81 (м, 2 Н, СН2Cl), 3.84-4.00 (дд, 2 Н, СН2O, J3=7,3), 4.21-4.45 (м, 1Н, СНО), 6.58 (с, 1Н, С=СН), 7.13 (д, 2Н С3,5Н аром. J3=7.4), 7.31 (д, 2Н С2,6Н аром. J3=7.4).
ИК-спектр, ν/см-1: 1590 (СН=С), 1090, 1180 (СОСОС), 715 (С-Cl).
Пример 5. Оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (5).
Смесь 10,8 г (0,033 моль) 2-хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (3), 3,03 г (0,033 моль) триазолата натрия и 40 мл сухого ДМФА кипятят при перемешивании в течение 20 ч. Реакционную массу охлаждают, отфильтровывают, фильтрат упаривают при пониженном давлении. Остаток растворяют в хлороформе и промывают водой (2×40 мл), сушат над сульфатом магния и упаривают при пониженном давлении. Продукт очищают с помощью градиентной флеш-хроматографии: силикагель "Acros Organics" 35/70), система: смесь гексана с ацетоном (от 10 до 40 об.% ацетона). Получают 10,33 г (87%) 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана в виде желоватого масла. При перемешивании к маслу прибавляют раствор 2,58 г (0,287 моль) щавелевой кислоты в 30 мл ацетона. Выпавшие белые кристаллы отфильтровывают, промывают гексаном и сушат на воздухе, получают 12,71 г оксалата 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диокса-спиро[4.5]декана (5) с т.пл. 108-109°C.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.96 (д, 3Н, СН3, J3=5.34), 1.22-1.46 (м, 1Н, СН цикл.), 1.48-1.74 (м, 2Н, СН цикл.), 1.74-2.00 (м, 2Н, СН цикл.), 2.12-2.46 (м, 1Н, СН цикл.), 2.51-2.73 (м, 1Н, СН цикл.), 3.74-3.95 (м, 1.12Н, СН2O), 4.02 (дд, 0.44Н, СН2O, J3=8,1), 4.17 (дд, 0.44Н, СН2O, J3=8,1), 4.29-4.54 (м, 2.56Н, CH2N, СН2O), 4.63 (кв, 0.44Н, СНО), 6.52 (д, 1 Н, С=СН, J4=3.8), 7.13 (д, 2Н С3,5Н аром., J3=8.6), 7.31 (д, 2Н С2,6H аром., J3=8.6), 7.95 (с, 1Н, С3Hтриаз.), 8.23 (с, 1Н С5Hтриаз.) ИК-спектр, ν/см-1: 1560 (С=С), 1270 (СНтриаз.), 1080, 1170 (СОСОС), 720 (С-Cl).
Последующее соединение, упомянутое в примере 6, получают аналогично способу, приведенному в примере 5.
Пример 6. Оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-8-метил-1,4-диоксаспиро[4.5]декана (6), выход 47%, т.пл. 140-141°С.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.86 (д, 3 Н, СН3, J3=5.34), 1.21-1.57 (м, 2Н, СН2 цикл.), 1.58-1.94 (м, 5Н, СН цикл.), 3.77-3.96 (м, 2Н, СН2О), 4.04-4.16 (м, 0.4Н, СНО), 4.27-4.46 (м, 2Н, CH2N), 4.04-4.16 (м, 0.4Н, СНО), 4.50-4.66 (м, 0.6Н, СНО), 6.51 (д, 1 Н, С=СН, J4=3.8), 7.22 (д, 2Н С3,5Н аром., J3=8.6), 7.40 (д, 2Н С2,6Н аром., J3=8.6), 8.00 (с, 1Н, С3Hтриаз.), 8.53 (с, 1Н С5Нтриаз.)
ИК-спектр, ν/см-1: 1565 (СН=С), 1270 (СНтриаз.), 1085, 1170 (СОСОС), 720 (С-Cl).
Пример 7. Композиция концентрата эмульсии
Действующее вещество: (замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы) - 70 г (7%).
Алкилбензолсульфокислоты кальциевая соль (АБСК) - 15 г (1,5%)
Оксиэтилированный октилфенол (ОП-7) - 70 г (7%)
Циклогексанон - 280 г (28%)
Смесь ксилололов - 110 г (11%)
1-Метилнафталин - 45 г (4,5%)
Керосин 410 г (41%).
Пример 8. Испытания на фунгицидную активность соединений проводили в экспериментах in vitro. [Методические рекомендации по испытанию химических веществ на фунгицидную активность. Черкассы: НПО «Защита растений», ВНИИХСЗР, 1990. - 68с.]
Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле-сахарозный агар при 50°C до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и в растворах с действующими веществами составили 1%. В чашки Петри, содержащей 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°C и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 3.
Применение соединений общей формулы I как в индивидуальном виде, так и в композициях с другими активными и вспомогательными соединениями позволяет более эффективно бороться с грибковыми заболеваниями сельскохозяйственных культур в сравнении с применяющимся сельскохозяйственным фунгицидом - триадимефоном.
| название | год | авторы | номер документа |
|---|---|---|---|
| Замещенные 4-(азол-1-илметил)-1-фенил-5,5-диалкилспиро-[2.5]октан-4-олы, способ их получения (варианты), фунгицидная и рострегуляторная композиции на их основе | 2016 |
|
RU2648240C1 |
| Замещенные 4-(азол-1-илметил)-1,6-бисфенилдиспиро[2.1.2.3]декан-4-олы, способ их получения и фунгицидная композиция на их основе | 2019 |
|
RU2730490C1 |
| Замещенные 1-(1Н-1,2,4-триазол-1-илметил)-циклогексанолы, обладающие фунгицидной активностью, замещенные оксираны в качестве промежуточных продуктов для синтеза замещенных 1-(1Н-1,2,4-триазол-1-илметил)-циклогексанолов, обладающих фунгицидной активностью | 1991 |
|
SU1838304A3 |
| СПОСОБ БОРЬБЫ С ГРИБНЫМИ БОЛЕЗНЯМИ РАСТЕНИЙ | 1991 |
|
RU2028052C1 |
| ПРОИЗВОДНЫЕ БЕНЗИЛИДЕНАЗОЛИЛМЕТИЛЦИКЛОАЛКАНА ИЛИ АЛКЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1989 |
|
RU2096406C1 |
| 2-Алкилтио-5-(1Н-1,2,4,-триазол-1-илметил)-1,3,4-тиадиазолы, способ их получения и фунгицидные композиции на их основе | 2020 |
|
RU2757808C1 |
| 2-Алкилтио-5-(1,2,4-триазол-1-илметил)-1,3,4-оксадиазолы, способ их получения и фунгицидные композиции на их основе | 2022 |
|
RU2794339C1 |
| N-Замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе | 2017 |
|
RU2668212C1 |
| 5-Алкилтио-4-арилиденамино-3-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения и фунгицидные композиции на их основе | 2023 |
|
RU2810785C1 |
| ПРОИЗВОДНЫЕ ОКСОПИПЕРИДИНА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В ТЕРАПИИ | 2005 |
|
RU2376298C2 |
Изобретение относится к новым замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканам формулы I:
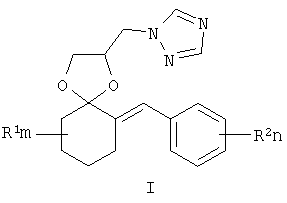
где R1, R=H, Hal и др., m, n=0-5, и способу их получения, который заключается в конденсации замещенных 2-бензилиденциклогексанонов II с 3-галоген-1,3-пропандиолами при катализе кислотами с азеотропной отгонкой воды в органических растворителях с получением замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов формулы III и алкилированием их 1,2,4-триазолатами щелочных металлов в среде полярных апротонных растворителей при температуре от 60 до 180°С.
Изобретение также относится к фунгицидной композиции, содержащей замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы формулы I, например оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана, который показывает фунгитоксичность выше, чем у эталона триадимефона. 3 н.п. ф-лы, 1 табл.
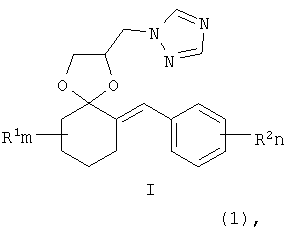
где R1, одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6, где R2 - одинаковые или разные, означают атом водорода, галогена, тип означает целое число от 0 до 5, к их солям с кислотами, или комплексам с солями металлов.

где R1, одинаковые или разные, означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 6, где R2 - одинаковые или разные, означают атом водорода, галогена, тип означает целое число от 0 до 5,
заключающийся в том, что замещенные 2-бензилиденциклогексаноны II, где R1, R2, m и n имеют те же значения, что и в формуле I, конденсируют с 3-галоген-1,3-пропандиолами при катализе кислотами с азеотропной отгонкой воды в органических растворителях с получением замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов общей формулы III, где R, m, n имеют те же значения, что и в формуле I, X означает галоген,
которые подвергают взаимодействию с 1,2,4-триазолатами щелочных металлов в среде полярного апротонного растворителя при температуре от 60 до 180°С
| Приспособление для вспарывания и очистки вязиги | 1951 |
|
SU94167A1 |
| DE 3735555 A1, 15.09.1988 | |||
| ФУНГИЦИДНЫЕ ПРОИЗВОДНЫЕ ОКСЕТАНА И ИХ СОЛИ | 1992 |
|
RU2044736C1 |
| 2-[1', 2', 4'-ТРИАЗОЛ-3'-ИЛОКСИМЕТИЛЕН]АНИЛИДЫ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И СРЕДСТВО БОРЬБЫ С ВРЕДОНОСНЫМИ ГРИБАМИ | 1995 |
|
RU2165927C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛИЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО | 1995 |
|
RU2158734C2 |
| RU 2005101615 A, 20.07.2005. | |||
Авторы
Даты
2008-06-20—Публикация
2006-11-17—Подача