ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение в основном относится к ферментационным способам, в частности к биопревращению фитостерольных композиций в андростендион и/или андростадиендион.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Микробиологическое превращение фитостеролов (получаемых чаще всего из соевого масла) под действием различных штаммов бактерий является хорошо известным способом, который использовался для коммерческого получения андростендиона (AD) и андростадиендиона (ADD) с середины 1970-х годов. Вообще, известный ферментационный способ включает размножение мутантного Mycobacterium в соответствующей питательной среде, перенос культуры в биореактор, содержащий фитостеролы и затем процесса биотрансформации в AD и/или ADD в течение периода времени, равного приблизительно 120 часам. Ферментационный бульон собирают, экстрагируют органическим растворителем, затем кристаллизуют из органического растворителя, получая, как правило, продукты AD и/или ADD в виде белых кристаллических порошков. Наиболее близкими ссылками, в которых обсуждается известный способ и суммируются проведенные ранее исследования, являются следующие:
S. Kraychy, and R.D. Muir, патент США №3684657 (1972).
W.J. Marsheck, S. Kraychy, and R.D. Muir, Appl. Microbiol.,
23, 72 (1972).
A.H. Conner, M. Nagaoka, J.W. Rowe and D. Perlman, Appl.
and Environ. Microbiol., 32, 310 (1976).
К. Klieslich, J. Basic Microbiol., 25, 461 (1985).
Одной из проблем, связанных с известным способом биопревращения фитостеролов (эта проблема существует для всей стероидной промышленности), является плохая растворимость субстрата, в данном случае фитостерольной композиции, в водной питательной среде. Недостаточная растворимость требует присутствия в питательной среде только относительно низких концентраций субстрата, что приводит к слабому контакту с микроорганизмом и, в общем, к низким выходам конечных продуктов. Для достижения любой удовлетворительной степени биопревращения обычно требуется также длительное время ферментации.
Другая проблема, связанная с известным способом биопревращения фитостеролов, состоит в том, что конечный продукт биопревращения фитостеролов (или композиций фитостеролов) обычно содержит значительные количества как AD, так и ADD. Из-за похожей химической структуры AD и ADD последовательное разделение этих двух стероидных продуктов является трудным и дорогим.
Дополнительной проблемой, связанной с известным способом биопревращения фитостеролов, является то, что микроорганизм, используемый для проведения биопревращения (обычно мутантный Mycobacterium), выращивают и размножают в питательной среде, которая обычно является дорогой для производства.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Решение проблемы растворимости включает использование выбранных подходящих солюбилизирующих агентов, которые способствуют растворению фитостерольной композиции с образованием прозрачного раствора, обеспечивая таким образом превосходный контакт с микроорганизмом, используемым для биопревращения. Обнаружено, что ранее известные солюбилизирующие агенты, такие как подсолнечное масло, являются предельно эффективными. Один аспект настоящего изобретения включает обнаружение и использование высокоэффективных солюбилизирующих агентов для биопревращения ряда фитостерольных композиций в AD и/или ADD. Сами фитостерольные композиции могут быть получены из побочного продукта процесса образования пульпы из древесной массы (известного как “мыло таллового масла”), из любого обычного растительного масла (включая, например, соевое, рапсовое, кукурузное, хлопковое, подсолнечное, оливковое, льняное и рисовое), или из смеси вышеупомянутых источников.
Эти выбранные подходящие солюбилизирующие агенты, включающие члены семейства гликолей и члены семейства силиконов, позволяют получать высокие концентрации фитостеролов, раствореных в питательной среде. Это обеспечивает превосходный контакт с микроорганизмом, уменьшение времени ферментации и получение относительно высоких выходов конечных продуктов.
В соответствии с другим аспектом данного изобретения, для проведения биопревращения фитостерольной композиции в AD и/или ADD используют Mycobacterium MB 3683. Обнаружено, что процессы биопревращений с использованием Mycobacterium MB 3683 для ферментативного превращения фитостерольных композиций в AD дают конечный продукт, в значительной степени свободный от ADD; с другой стороны, процессы биопревращений с использованием Mycobacterium MB 3683 для ферментативного превращения фитостерольных композиций в ADD дают конечный продукт, в значительной степени свободный от AD.
В соответствии со следующим аспектом данного изобретения, микроорганизмы, использующиеся для проведения биопревращения, выращивают и размножают в питательной среде, включающей рафинированную мелассу и неорганические соли.
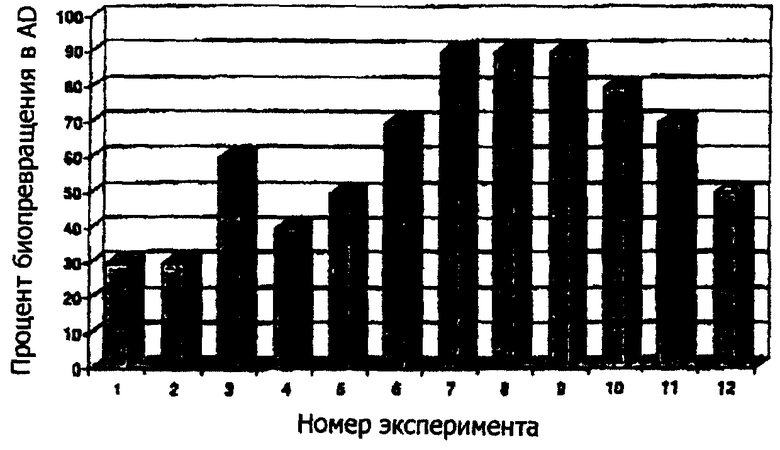
Настоящее изобретение иллюстрируется чертежом, который представляет собой столбчатую диаграмму, демонстрирующую процент биопревращения фитостеролов в AD в 12 экспериментах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним предпочтительным способом конкретные солюбилизирующие агенты относятся к семейству гликолей. Солюбилизирующие агенты семейства гликолей, такие как полипропиленгликоль (PPG), обеспечивают растворимость высоких концентраций фитостеролов и, в свою очередь, их эффективное биопревращение в AD и/или ADD. Например, как показано на чертеже, были завершены успешные биопревращения фитостерольных композиций в AD в различных условиях. В типичных испытаниях концентрация фитостерольной композиции изменяется от 5 до 30 граммов на литр питательной среды. Для улучшения взаимодействия между фитостерольной композицией и микроорганизмом фитостерольную композицию растворяют в выбранном количестве PPG (например, 100 граммов или один килограмм на литр PPG) и превращение приводит к образованию AD, определенному, как показано на чертеже.
Особое значение в этом способе имеет значительно увеличенная концентрация фитостерольной композиции (30 граммов или более на литр питательной среды), которая может быть превращена в AD. Обычная концентрация, используемая в промышленных ферментаторах в соответствии с известным способом биопревращения фитостерола, составляет 10 граммов на литр питательной среды.
Примеры 1 и 3 иллюстрируют, что при использовании PPG в качестве солюбилизирующего агента способ данного изобретения позволяет проводить превращение различных композиций фитостерола, полученных из различных источников. Пример 1 описывает успешное превращение в AD с использованием фитостерольной композиции, полученной из побочного продукта "Tall Oil soap" целлюлозной и бумажной промышленности, тогда как пример 3 демонстрирует превращение фитостерольной композиции, полученной из рапсового масла.
Вышеуказанные примеры также демонстрируют, что мутант Mycobacterium, обозначенный как MB 3683, способен превращать эти различные фитостерольные композиции, которые различаются по относительным соотношениям их основных компонентов (включая, например, бета-ситостерол, кампестерол, стигмастанол, стигмастерол, брассикастерол), в AD. Из этих примеров становится ясно, что для биопревращения в AD могут использоваться различные фитостерольные композиции, полученные из побочных продуктов целлюлозной и бумажной промышленности и/или из любого из различных распространенных растительных масел, каждое из которых содержит эти обычные фитостеролы в различных соотношениях.
В другом предпочтительном способе, как иллюстрируется в примере 2, конкретные солюбилизирующие агенты относятся к силиконовому семейству. Как и в случае солюбилизирующих агентов, относящихся к гликолевому семейству, солюбилизирующие агенты силиконового семейства обеспечивают растворимость высоких концентраций фитостеролов и, в свою очередь, их эффективное биопревращение в AD и/или ADD.
Во всех приведенных здесь примерах инокулят (посевной материал) микроорганизма вначале выращивают в питательной среде, включающей рафинированную мелассу и неорганические соли, затем переносят в биореактор, в котором проводят биопревращение.
Успешные биопревращения достигают при нагревании фитостерольной композиции в присутствии выбранного подходящего солюбилизирующего агента с образованием пастообразной консистенции и затем добавляют последнюю в биореактор, содержащий микроорганизм и соответствующую неорганическую солевую среду.
В течение ферментационного процесса важно поддерживать температуру в интервале, составляющем приблизительно 30-35°С. Контроль рН в течение ферментации показывает, что рН может изменяться в интервале приблизительно от 7,0 в начальный период времени до 4,7 во время сбора продукта.
Как показано в таблице 1, период ферментации может изменяться приблизительно от 6 до 25 дней, в зависимости, в частности, от количества фитостерольной композиции (в граммах на литр среды в биореакторе), подлежащей биопревращению в конечные продукты.
Выходы продуцируемого AD могут изменяться в зависимости от условий ферментации, но, как показано на фиг.1 (эксперименты №№7-10), можно легко достигнуть выходов, составляющих 80-90%. Эксперимент №10 является особенно выразительным, с выходом AD, равным 80%, при уровне фитостерольной композиции, составляющем 30 грамм на литр среды. Как отмечено выше, в известном способе биопревращения фитостерола обычно используется уровень фитостерольной композиции, составляющий 10 грамм на литр среды.
Использование растительного масла (например, подсолнечного масла) в качестве солюбилизирующего агента (эксперименты №№1, 2, 5) обычно приводит к намного более низкому выходу AD. Было обнаружено, что использование растительного масла в качестве солюбилизирующего агента фактически оказывает вредное воздействие на выход AD, даже если его смешивают с PPG (эксперимент №11), используемым в качестве солюбилизирующего агента.
Примеры 1-5, приведенные ниже, подробно представляют успешные лабораторные испытания. Однако каждое из них может быть экстраполировано к применению в промышленном масштабе с использованием известных промышленных методик для осуществления изобретения, как описано здесь.
ПРИМЕР 1
Инокулят Mycobacterium MB 3683 готовят в четырех 2-литровых колбах Эрленмейера, каждая из которых содержит 500 мл следующей среды (г/литр): рафинированная меласса (54 мл), NаNО3 (5,4 г), NH4H2PO4 (0,6 г), глюкоза (6,0 г). рН среды равен 7,0. Смесь оставляют для роста в течение 2-3 дней.
Фитостерольную композицию, полученную из "Tall Oil soap" (100 г), нагревают в пропиленгликоле (0,8-1 литр) при 100-130°С до тех пор, пока не будет получен пастоподобный раствор в виде крема. Этот раствор добавляют в 50-литровый биореактор, содержащий 15 литров солевой среды, которая содержит (г/литр): NH4NO3 (2 г), КН2РO4 (1 г), Na2HPO4 (2 г), КСl (0,2 г), MgSO4 (0,2 г), CaCl2 (0,3 г), и следующие микроэлементы, добавленные в количестве 1 мл/литр солевой среды и взятые из следующего типичного базового раствора (г/л): ZnSO4 (11 г), MnSO4 (6 г), FeSO4 (1 г), CoCl2 (0,3 г), CuSO4 (0,04 г), Н3ВО3 (0,03 г), Kl (0,001 г).
Все содержимое биореактора стерилизуют при 120°С и охлаждают до комнатной температуры. Потом в этот биореактор добавляют вышеупомянутый инокулят и дают ферментации протекать в течение 120-144 ч при 35°С. В течение этого периода начальное значение рН, составляющее 7,0, изменяется до 4,7-5,5 во время сбора продукта. GLC (см., например, эксперименты 6 и 7, фиг.1). Экстракция ферментационной смеси хлороформом дает экстракт, содержащий полипропиленгликоль и смесь AD/ADD с различными соотношениями от 9:1 до 7:3 соответственно.
ПРИМЕР 2
Инокулят готовят как в Примере 1, но с более коротким периодом роста (2 дня), в единственной 2-литровой колбе, содержащей 500 мл вышеуказанной среды. Этот инокулят затем переносят в 10-литровый биореактор, содержащий 5 литров следующей "посевной" среды (г/литр): меласса (54 г), КNО3 (5,4 г), NH4H2PO4 (0,6 г), подсолнечное масло (20 мл). После роста в биореакторе в течение 12-16 часов порцию (1,5 литра) этого инокулята добавляют в другой 50-литровый биореактор, содержащий уже стерилизованную фитостерольную композицию, как указано ниже.
Фитостерольную композицию, полученную из рапсового масла (100 г), смешивают с силиконом (1,6 литра) и нагревают при 100-130°С до получения пасты. Эту пасту затем переносят в 50-литровый биореактор, содержащий 15 литров солевой среды такого же состава, как в примере 1. Все содержимое стерилизуют при 120°С и охлаждают до комнатной температуры. Порцию (1,5 литра) инокулята, как указано выше, теперь переносят в этот биореактор и дают протекать ферментации при 35°С в течение 48 ч. Контроль GLC показывает, что к этому времени осуществляется 90% биопревращения фитостерольной композиции. Начальное значение рН, равное 7,2, слегка изменяется до значения 7,4.
Отделенный силиконовый слой, содержащий AD, экстрагируют ацетонитрилом (3×0,7 литра) и растворитель выпаривают, получая неочищенный продукт. Кристаллизация неочищенного AD с использованием углеводородных растворителей (н-пентан и н-гексан), содержащих н-бутанол (2-5%) или изопропанол (2-5%), дает превосходный выход (>90%) чистого AD (чистота >96%).
Оставшийся инокулят (3,5 литров), полученный как указано выше, используют в примере 3.
ПРИМЕР 3
В этом более крупномасштабном эксперименте используют инокулят, оставшийся (3,5 литров) от примера 2.
Фитостерольную композицию, полученную из рапсового масла (900 г, концентрация 30 г/литр), помещают в 50-литровый биореактор, растворяют в пропиленгликоле (8 литров), нагревая до 100-130°С, и содержимое охлаждают до комнатной температуры. Добавляют инокулят (3,5 литров) и ферментацию оставляют протекать в течение 18-25 дней (см. эксперимент 10, таблица 1). Как и в примере 1, в этом более крупномасштабном эксперименте обнаруживается подобное изменение рН от начального значения, равного 7,0 до 5,5 во время сбора продукта. Контроль GLC показывает, что биопревращение осуществлено на 80%. В результате экстракции ферментационной смеси хлороформом получают экстракт, содержащий пропиленгликоль и AD.
ПРИМЕР 4
Инокулят Mycobacterium MB 3683 готовят в шести 2-литровых колбах Эрленмейера, каждая из которых содержит 500 мл следующей среды (г/литр): глюкоза (10 г), пептон (10 г), дрожжевой экстракт (3 г) и солодовый экстракт (20 г), и оставляют расти в течение 2 дней, в течение которых рН поддерживают при 7,0.
Инокулят (2 литра) из колб Эрленмейера затем переносят в 30-литровый биореактор, содержащий 20 литров неорганической солевой среды с рафинированной мелассой примера 1 и выращивают в течение 16 часов. Последний инокулят (20 литров) затем переносят в 400-литровый биореактор, содержащий 200 литров неорганической солевой среды примера 1.
Фитостерольную композицию, полученную из рапса (один килограмм, концентрация 5 г на литр питательной среды), растворяют в PPG (десять литров, концентрация 100 г на литр) нагреванием при 115°С до образования пасты. Эту пасту затем переносят в 400-литровый биореактор и ферментацию оставляют протекать в общем на 115 часов в следующих условиях: аэрация: один литр в минуту, перемешивание 200 об/мин, температура 35°С. рН слегка изменяется от 6,45 до 6,6 во время сбора продукта.
Для того чтобы оценить степень биопревращения, берут аликвоты ферментационной смеси и анализируют их. Наблюдают следующие уровни биопревращения в AD: 20 часов (10%), 44 часа (20%), 68 часов (50%), 91 час (80%), 115 часов (90%). Экстракция хлороформом, как в примере 1, дает экстракт, содержащий PPG и AD.
ПРИМЕР 5
Этот эксперимент является повторением примера 4 за исключением того, что солюбилизирующим агентом вместо PPG является силикон.
Фитостерольную композицию (один килограмм) растворяют в силиконе (20 литров) нагреванием при 130°С до образования пасты. Эту пасту переносят в 400-литровый биореактор, содержащий 200 литров питательной среды, как в примере 4. В процессе ферментации, которую проводят в условиях, суммированных в примере 4 и в течение 120 часов, завершается биопревращение в AD. Экстракция силиконового слоя, как в примере 2, ацетонитрилом с последующей кристаллизацией, дает AD с выходом 90%.
Хотя были продемонстрированы и описаны отдельные варианты, воплощения и применения настоящего изобретения, должно быть понятно, конечно, что данное изобретение не ограничивается этим, так как специалистом в применяемых технологиях могут быть сделаны модификации, особенно в свете предыдущего описания. Прилагающаяся формула включает в свой объем такие модификации и варианты данного изобретения, описанного здесь, как это должно быть очевидно для специалистов в применяемых технологиях.
bолипропиленгликоль
Выход AD в процессе ферментации стерола с использованием растительного масла в качестве солюбилизирующего агента при повышенной температуре
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ MYCOBACTERIUM NEOAURUM И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2231553C2 |
| ДИСПЕРСИИ ФИТОСТЕРОЛОВ | 2010 |
|
RU2501328C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОХЛОРОФИЛЛА А | 2014 |
|
RU2671158C2 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗООБРАЗНОГО СУБСТРАТА, СОДЕРЖАЩЕГО МОНООКСИД УГЛЕРОДА И ВОДОРОД | 2011 |
|
RU2566565C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ СТЕРОИДНЫХ ГЛИКОЗИДОВ RUSCUS ACULEATUS | 2000 |
|
RU2249043C2 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗА, СОДЕРЖАЩЕГО МОНООКСИД УГЛЕРОДА | 2011 |
|
RU2573918C2 |
| СОДЕРЖАЩИЕ ФИТОСТЕРОЛ ГЛУБОКО ОБЖАРЕННЫЕ ПИЩЕВЫЕ ПРОДУКТЫ И СПОСОБЫ С ПОДДЕРЖИВАЮЩИМИ ЗДОРОВЬЕ ХАРАКТЕРИСТИКАМИ (ВАРИАНТЫ) | 2006 |
|
RU2396759C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ ИЛИ ИХ ПРОИЗВОДНЫХ | 1998 |
|
RU2205224C2 |
| БИОПРЕПАРАТ ДЛЯ ОЧИСТКИ ПОЧВЫ И ШЛАМОВ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ | 2014 |
|
RU2568063C1 |
| АНТИБИОТИЧЕСКИЕ СОЕДИНЕНИЯ | 2010 |
|
RU2536587C2 |
Способ ферментативного превращения фитостерольных композиций в андростендион (андрост-4-ен-3,17-дион, AD) и андростадиендион (андроста-1,4-диен-3,17-дион, ADD) заключается в том, что фитостерольную композицию нагревают в присутствии одного или более солюбилизирующих агентов до температуры 100-130°С с образованием пастообразного раствора. Солюбилизирующие агенты выбирают из полипропиленгликоля, силикона или растительного масла. Полученную пастообразную массу помещают в биореактор, содержащий микроорганизмы Mycobacterium MB 3683 и неорганическую солевую среду и подвергают ферментации. Способ позволяет значительно увеличить концентрацию фитостерольной композиции (30 грамм и более на литр питательной среды) с выходом продуцируемого вещества до 80-90%. 5 з.п. ф-лы, 1 ил., 2 табл.
| DE 3521111 A, 11.12.1986 | |||
| Способ получения 4-андростен-3,17-диона или 1,4-андростадиен-3,17-диона | 1987 |
|
SU1679977A3 |
| ХОЛОДИЛЬНАЯ КОМПОЗИЦИЯ, СПОСОБ ОХЛАЖДЕНИЯ, ХОЛОДИЛЬНЫЙ АППАРАТ | 2003 |
|
RU2335522C2 |
| СПОСОБ СУШКИ И ТЯЖКИ КОЖ | 0 |
|
SU248144A1 |
| DD 230641 A3, 04.12.1985 | |||
| КОЛЬЦЕВОЙ СЧЕТЧИК НА ДВУХТАКТНЫХ ФЕРРИТ-ДИОДНЫХ ЭЛЕМЕНТАХ С ЦИФРОВОЙ ИНДИКАЦИЕЙ | 0 |
|
SU291341A1 |
| FLYGARE S., LARSSON P.O., Steroid transformation in agueous two - phase systems: side-chain degradation of cholesterol by Mycobacterium sp | |||
| Enzyme-Microb | |||
| Technol | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| STEINERT H.J | |||
| et al | |||
| Steroid side chain cleavage with immobilize living cells in organic solvents | |||
| Stud | |||
| Org | |||
| Chem | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Biocatal | |||
| Org | |||
| Media | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
Авторы
Даты
2005-05-20—Публикация
1999-03-26—Подача