Изобретение относится к области биотехнологии, а именно к способу получения андрост-4-ен-3,17-диона из стеринов растительного и животного происхождения и их производных, и может быть использовано в фармацевтической, микробиологической и химической промышленности.
Андрост-4-ен-3,17-дион (далее АД) - ценное стероидное соединение, которое может быть использовано как ключевой полупродукт в синтезе стероидных лекарственных препаратов из стеринов растительного и животного происхождения (ситостерина или холестерина), которые являются наиболее дешевым и доступным источником стероидного сырья.
Стероидные лекарственные препараты широко применяются в медицине, животноводстве и ветеринарии в качестве гормональных противовоспалительных, антиаллергических, диуретических, контрацептивных, анаболических и других лекарственных средств [1].
Микробиологические трансформации холестерина и ситостерина в 3,17-дикетостероиды (в частности, в АД) широко изучены и документированы. Известна способность различных штаммов бактерий родов Arthrobacter, Brevibacterium, Corynebacterium, Pseudonocardia и Mycobacterium трансформировать стерины с образованием АД. Однако большинство известных способов получения АД из стеринов основано на использовании бактерий рода Mycobacterium.
Известен способ получения АД путем микробиологической трансформации стеринов штаммом Mycobacterium fortuitum [2]. При осуществлении этого способа трансформацию стерина проводят при нагрузке 30 г/л в течение 14 суток. Согласно этому способу в культуральной жидкости за время трансформации накапливается, помимо целевого АД, продукт его более глубокого окисления - андроста-1,4-диен-3,17-дион (далее сокращенно АДД). Количество АДД весьма значительно: соотношение АД/АДД равно 8:1. Разделение указанной смеси является трудновыполнимой задачей. Кроме того, недостатком данного способа получения АД является большая продолжительность процесса (14 суток), при которой возрастает риск появления посторонней микрофлоры.
Известен способ получения АД с использованием штамма Mycobacterium vaccae [3]. Этот штамм устойчив к стрептомицину и рифампицину; что позволяет использовать антибиотик при необходимости подавления роста посторонних микроорганизмов, способных в противном случае модифицировать целевой продукт трансформации. Однако недостатком способа, основанного на использовании данного штамма, является проведение трансформации при низких нагрузках исходного стероидного субстрата (1 г/л).
Наиболее близким к предлагаемому по технической сущности и достигаемому эффекту является способ получения АД из холестерина при нагрузке 0,3 г/л с помощью штамма Mycobacterium smegmatis SG-99 [4]. Низкая специфичность этого метода в отношении АД и низкая нагрузка исходного субстрата являются его существенным недостатком: АД образуется в смеси с АДД в соотношении 1:4. От АДД избавляются на второй стадии ферментации, которую проводят в анаэробных условиях в течение 2 суток. За этот период АДД полностью восстанавливается в АД. Таким образом, во-первых, имеет место усложнение технологии получения АД, во-вторых, в анаэробных условиях, помимо восстановления АДД, в АД может также протекать нежелательное восстановление 17-кетогруппы продуктов ферментации с образованием побочных соединений.
Указанный способ предусматривает выделение целевого продукта трансформации АД экстракцией из культуральной жидкости большими объемами несмешивающихся с водой органических растворителей. При этом экстракт, кроме целевого АД и побочных продуктов, содержит нетрансформированный исходный стерин. Наличие примеси исходного субстрата в техническом продукте, а также присутствие побочных соединений затрудняют выделение АД в чистом виде. Применяется дополнительная операция очистки. После упаривания растворителя целевой продукт отделяют от других стероидов кристаллизацией. Выход АД не указан.
Задача, на решение которой направлено настоящее изобретение, заключается в интенсификации процесса получения АД путем микробиологической трансформации стеринов.
Технический результат, который может быть получен при осуществлении изобретения, заключается в следующем:
- увеличение нагрузки исходного субстрата и степени его превращения;
- повышение выхода и качества целевого продукта;
- сокращение числа технологических операций и трудоемкости процесса;
- сокращение количества органического растворителя, используемого для выделения целевого продукта;
- повышение экологической безопасности процесса.
Сущность изобретения заключается в том, что согласно способу получения АД путем микробиологической трансформации из стеринов растительного и животного происхождения или их производных в качестве микроорганизма-трансформатора используют штамм Mycobacterium smegmatis ВКПМ-Ас-1552, а в качестве стеринов и их производных используют соединения общей формулы: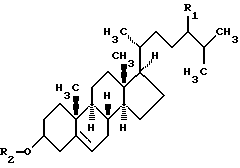
где R1 - H или С2Н5; R2 - H или СО(СН2)2СООХ (X - Na, К или NH4-группа).
Извлечение продукта трансформации из реакционной среды осуществляют с помощью неионогенного сорбента.
Микробиологическая трансформация осуществляется с помощью нового мутантного штамма Mycobacterium smegmatis ВКПМ Ac-1552, несущего хромосомный маркер устойчивости к стрептомицину и полученного в результате лабораторной селекции. Указанный штамм способен селективно расщеплять боковую цепь стеринов при нагрузке 10-30 г/л с образованием АД без примеси АДД и проводить трансформацию в присутствии антибиотика без существенного уменьшения выхода АД и удлинения срока ферментации. Приведенные ниже примеры показывают, что стероидтрансформирующая активность культуры Mycobacterium smegmatis ВКПМ Ac-1552 не уменьшается при переходе от ферментации в колбах к трансформациям в ферментерах.
Преимуществом использования указанных выше модифицированных стеринов является существенное повышение удельной активности биомассы (Таблица).
Кроме того, модификация молекулы стерина приводит к значительному изменению гидрофильных свойств исходного субстрата, что позволяет использовать его в трансформации без предварительной микронизации. Субстрат вносят в виде коллоидного раствора без применения детергентов, солюбилизирующих добавок и каких-либо других комплексообразующих соединений, способствующих изменению растворимости гидрофобного стерина или повышению стабильности его суспензии. Это позволяет исключить сложную энерго- и трудоемкую операцию измельчения субстрата. Трансформация осуществляется в водных растворах какого-либо источника углерода, например углевода (предпочтительно глюкозы, фруктозы или галактозы), или других сахаров, а также спиртов (предпочтительно глицерина) в отсутствии других компонентов среды.
Также отличительной особенностью данного способа является извлечение целевого продукта из реакционной среды методом сорбции с помощью неионогенного полярного или малополярного макропористого сорбента в эффективном количестве. В качестве сорбентов могут быть использованы модифицированные сополимеры этилстирола и дивинилбензола, характеризующиеся большой удельной поверхностью (500-1000 м2/г), объемом пор более 1 см1/г, высокой механической прочностью и стабильностью, например пороласы, вофатиты, леватиты. Указанные выше сорбенты могут быть использованы в циклах сорбция-десорбция многократно.
Введение сорбента в ферментационную среду может быть осуществлено в разный период трансформации: одновременно с исходным субстратом, в течение процесса, или после его завершения. Благодаря избирательной адсорбционной способности сорбента проведение трансформации в присутствии сорбента позволяет выводить целевой продукт из реакционной среды по мере его образования и тем самым предотвращать возможное ингибирование продуктом роста клеточной массы. Кроме того, благодаря избирательной адсорбционной способности сорбента способ позволяет исключить трудоемкую операцию отделения целевого продукта от остаточного исходного стерина и тем самым упростить стадию выделения.
Сведения об использовании в качестве штамма трансформатора Mycobacterium smegmatis ВКПМ Ac-1552, химически модифицированных производных стеринов общей формулы 1 в качестве исходных субстратов в процессах получения 3,17-кетоандростанов (в частности, АД) путем микробиологической трансформации, а также информация о возможности проведения трансформации стеринов до АД в присутствии сорбента в литературе отсутствуют.
Для контроля накопления АД в культуральной жидкости, а также для оценки содержания основного вещества в продукте трансформации использовали метод ВЭЖХ. Контроль процессов сорбции и десорбции осуществляли с помощью ТСХ-анализа.
Способ иллюстрируется примерами.
Пример 1
Mycobacterium smegmatis ВКПМ Ac-1552 выращивают в течение 7-10 суток на твердой среде следующего состава (г/л): глюкоза - 10, соевая мука - 3,0, лимонная кислота - 2,2, мочевина - 0,5, аммоний хлористый - 1,0, калий фосфорнокислый однозамещенный -0,5, магний сернокислый - 0,5, кальций углекислый - 1,5, железо сернокислое - 0,05, агар-агар - 2,5, рН 7,0 - 7,5. Биомассу переносят в жидкую среду того же состава (без агара), в которой культуру выращивают в течение 48-70 часов в аэробных условиях на качалке при температуре 30oС (питательную среду разливают по 100 мл в конические колбы объемом 750 мл). Полученный посевной материал в количестве 10 об. % переносят в среду для трансформации следующего состава (г/л): глюкоза - 10, соевая мука - 10, лимонная кислота - 2,2, мочевина - 0,5, аммоний фосфорнокислый двухзамещенный - 1,5, магний сернокислый - 0,5, кальций углекислый - 1,5, железо сернокислое - 0,05, холестерин с размером частиц 3-10 мк - 10, сорбиталь - 3,2, рН 7,2 -7,4. Среду для трансформации разливают по 50 мл в колбы Эрленмейера объемом 500 мл. Трансформацию проводят в аэробных условиях на качалке при температуре 30oС в течение 90-100 ч.
Культуральную жидкость, содержащую АД и непрореагировавший стерин, подкисляют до рН 2-3 и перемешивают с пороласом в количестве 1/7 части от веса исходного субстрата. Суспензию выдерживают при температуре 20-25oС до завершения сорбции. Сорбент отделяют, адсорбированный АД элюируют ацетоном. Раствор осветляют активированным углем. Растворитель упаривают, остаток растирают с водой, осадок отфильтровывают, промывают водой. Получают порошок белого цвета с содержанием АД 97%, т. пл. 169-171oС, выход 66,2% (от теор.).
Культуральную жидкость после отделения пороласа центрифугируют. Биомассу обрабатывают ацетоном. Полученный раствор осветляют активированным углем, растворитель упаривают. Остаток растирают с водой, осадок отфильтровывают. Получают порошок белого цвета, содержащий по данным ГЖХ 94% холестерина, пригодного для повторного использования. Выход АД в пересчете на вступивший в реакцию стерин составляет 71%.
Пример 2
Посевной материал, полученный аналогично примеру 1 (1-й инокулят), вносят в 500 мл свежей питательной среды того же состава, как для 1-ого инокулята, инкубируют на качалке в условиях примера 1 в течение 24 ч. Получают 2-й инокулят, который переносят в ферментер объемом 10 л, заполненный 5 л трансформационной среды состава, приведенного в примере 1, но с добавлением пеногасителя. Трансформацию проводят в течение 96-100 ч при 30oС, перемешивании 700 об/мин и подаче воздуха с интенсивностью до 0,6 л/л среды/мин. Продукт выделяют аналогично примеру 1. Получают технический продукт с выходом АД 60,7% (от теор.) с содержанием основного вещества 95%, т.пл. 167-170oС.
Пример 3
Проводят трансформацию аналогично примеру 1, но с заменой холестерина на β-ситостерин. Выделение осуществляют аналогично примеру 1. Получают продукт с выходом 54,4% (от теор. ) с содержанием основного вещества 96%, т.пл. 169-171oС. Дополнительно выделяют непрореагировавший ситостерин. Выход АД в пересчете на вступивший в реакцию стерин составляет 85%.
Пример 4
Трансформацию β-ситостерина при нагрузке 10 г/л проводят в ферментере аналогично примеру 2. Продукт выделяют аналогично примеру 1. Получают технический продукт с выходом 51,4% (от теор.) с содержанием основного вещества 94%, т. пл. 167-170oС. Выход АД в пересчете на вступивший в реакцию ситостерин составляет 82%.
Пример 5
Посевной материал, полученный согласно примеру 1, вносят в количестве 10 об. % в трансформационную среду следующего состава (г/л): глицерин - 20, крахмал - 5,0, дрожжевой экстракт - 0,5, мочевина - 0,4, калий фосфорнокислый однозамещенный - 0,7, аммоний хлористый - 0,7, магний сернокислый - 0,5, железо хлорное - 0,05, холестерин - 20 (в виде частиц 3-10 мк), сорбиталь - 6,5, рН 7,0-7,2. Среду разливают по 50 мл в конические колбы объемом 750 мл. Ферментацию проводят в условиях примера 1 в течение 230 ч. За этот период в культуральной жидкости согласно данным ВЭЖХ анализа накапливается 10 г/л АД. По данным ВЭЖХ в продуктах трансформации отсутствует примесь АДД, а имеющаяся примесь в количестве 4% состоит из Δ1,4- и Δ4-22-спиртов.
Продукт выделяют аналогично примеру 1. В качестве сорбента используют Wofatit ЕР 60. Получают порошок белого цвета с содержанием АД 96%, т. пл. 169-171oС, выход 58,5% (от теор.). С учетом возвращенного стерина выход АД составляет 66,2%.
Пример 6
Трансформацию холестерина при нагрузке 30 г/л проводят в условиях примера 1 в течение 330 ч. Выделяют продукт с выходом 52,6% (от теор.) и содержанием основного вещества 97%.
Пример 7
Трансформацию холестерина при нагрузке 30 г/л проводят в условиях примера 1 в течение 6 суток, после чего в культуральную жидкость добавляют стрептомицин и продолжают ферментацию в течение 8 суток. Выделение продукта проводят аналогично примеру 1. Получают продукт с выходом 49,5% (от теор.) с содержанием основного вещества 96%.
Пример 8
Посевной материал и трансформационную среду готовят аналогично примеру 1 (10 г/л холестерина), ферментацию проводят в течение 24 часов также в условиях примера 1, затем к культуральной жидкости добавляют простерилизованный отдельно поролас в количестве 20% от объема среды. Ферментацию продолжают в тех же условиях еще 3 суток. Сорбент отделяют от культуральной жидкости и обрабатывают аналогично примеру 1. Получают АД с выходом 58,4% (от теор.).
Пример 9
Непревращенный холестерин, возвращенный после трансформаций, описанных в примерах 1, 2, 5-8, трансформируют при нагрузке 10 г/л в условиях примера 1 в течение 96 ч. Получают АД с выходом 53,1%, который выделяют согласно примеру 1 с использованием Lewatit ОС 1062.
Пример 10
Гель аммонийной соли гемисукцината холестерина (концентрация по холестерину 20 г/л) смешивают с водным раствором глицерина в соотношении 1:1 (содержание источника углерода составляет 1%), рН полученного раствора 7,5-7,8.
Раствор распределяют по 50 мл в конические колбы объемом 500 мл и стерилизуют 20 мин при 110oС. Посевной материал, приготовленный согласно примеру 1, вносят в стерильные растворы в количестве 20 об.% и проводят трансформацию на качалке в условиях примера 1. Образование АД начинается через сутки ферментации, в течение которой рН поддерживают выше 7,0. Выделение АД проводят аналогично примеру 1.
Пример 11
Посевной материал и трансформационную среду готовят аналогично примеру 1 (10 г/л ситостерина). В колбу вместимостью 0,75 л вносят 20 мл посевного материала 50 мл трансформационной среды (количество компонентов из расчета объема среды 100 мл), 10 мл 10% суспензии ситостерина и 20 мл пороласа. Трансформацию проводят в течение 96 ч. Выделение АД проводят аналогично примеру 1 с использованием в качестве сорбента Wofatit EP 62. Получают АД с содержанием основного вещества 90% и с выходом 66,7% (от теор.). С учетом содержания основного вещества в исходном субстрате (90%) выход АД составляет 74%.
Источники информации
1. Машковский М.Д. "Лекарственные средства", М., "Медицина", 1993, т. 1, с.690-710.
2. Пат. США 4 345 033, Кл. 435-55.
3. Докл. Болг. АН, т. 46, с.123-126, 1993 г.
4. Пат. ГДР 137 661, С 07 J 1/00.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ MYCOBACTERIUM SMEGMATIS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ОКИСЛЕНИЯ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ ДО АНДРОСТ-4-ЕН-3,17-ДИОНА | 1997 |
|
RU2126837C1 |
| ШТАММ БАКТЕРИЙ MYCOBACTERIUM NEOAURUM И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2231553C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-1,4-ДИЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2005 |
|
RU2297455C2 |
| ШТАММ Rhodococcus erythropolis ВКПМ Ac-1740 ДЛЯ ПОЛУЧЕНИЯ 9 АЛЬФА-ГИДРОКСИСТЕРОИДОВ | 2007 |
|
RU2351645C1 |
| ШТАММ PIMELOBACTER SIMPLEX, ПРОЯВЛЯЮЩИЙ СТЕРОИД-1,2-ДЕГИДРОГЕНАЗНУЮ АКТИВНОСТЬ | 2001 |
|
RU2215038C2 |
| СПОСОБ ПОЛУЧЕНИЯ γ-ЛАКТОНА 3(7α-АЦЕТИЛТИО-17β-ГИДРОКСИ-3-ОКСОАНДРОСТ-4-ЕН-17α-ИЛ)ПРОПИОНОВОЙ КИСЛОТЫ | 1999 |
|
RU2163606C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТЕРОИДНЫХ ЭФИРОВ | 1996 |
|
RU2091388C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕГНАНОВ | 1999 |
|
RU2156255C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАНДРОСТЕНОЛОНА | 2002 |
|
RU2236464C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-1,4-ДИЕН-3,17-ДИОНА | 1993 |
|
RU2039824C1 |
Изобретение относится к биотехнологии, получению стероидов. Предложен способ получения андрост-4-ен-3,17-диона (АД) общей формулы 1: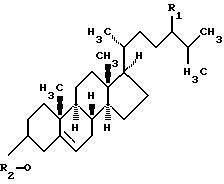
где R1 = Н или С2Н5; R2 = Н или СО(CH2)2СООХ (Х = группа NH4, Na или К) из стеринов растительного и животного происхождения или их производных с помощью штамма Mycobacterium smegmatis ВКПM Ас-1552, устойчивого к стрептомицину. Способ позволяет трансформировать указанные стерины при нагрузке 10-30 г/л с образованием АД с выходом до 66,2% от теор. без учета возвращенного исходного субстрата. Выделение продукта трансформации стеринов осуществляют сорбционным методом. В качестве сорбентов используют модифицированные сополимеры этилстирола и дивинилбензола, а также сверхсшитые полистиролы. Указанные сорбенты могут быть многократно использованы в циклах сорбция-десорбция. Сорбент добавляют в среду для трансформации в процессе ферментации или после ее завершения. Способ обеспечивает повышение выхода и качества целевого продукта, снижение трудоемкости процесса. 2 з.п.ф-лы, 1 табл.
где R1 - Н или С2Н5;
R2 - Н или СО(СH2)2СООХ (Х - группа NH4, Na или К).
| Раствор для травления аустенитных сталей, легированным титаном | 1956 |
|
SU137361A1 |
| US 4345033, 17.08.1982. | |||
Авторы
Даты
2003-05-27—Публикация
1998-11-25—Подача