Изобретение относится к области клинической диагностики на основе лабораторных методов исследования биологических препаратов, а именно гистохимических исследований, и может быть использовано для выявления вегетативных нервных структур в удаленных тканях организма.
Известны методы выявления холинэстеразы по Гомори и Лилли с использованием в качестве субстрата миристоилхолина и фиксацией ткани или срезов замороженной ткани в ацетоне или кальций-формоле.
Метод выявления холинэстеразы по Гомори заключается в том, что ткань фиксируют в ацетоне при 0°С в течение 12-24 часов, проводят по спиртам и заливают в парафин. Затем срезы депарафинируют, отмывают от фиксатора и проводят гистохимическую реакцию с инкубацией в растворе специфического субстрата (смесь растворителя и миристоилхолина). Инкубация продолжается в течение 10-16 часов [1].
Метод выявления холинэстеразы по Лилли отличается использованием срезов замороженной ткани, полученных в криостате и помещенных на предметные стекла с последующей фиксацией в ацетоне или кальций-формоле (15 мин при 3°С). Затем срезы отмывают от фиксатора и проводят гистохимическую реакцию в той же инкубационной среде с сокращением срока инкубации до 2-4 часов [2].
После инкубации срезов в растворе специфического субстрата в обоих случаях срезы промывают в проточной воде, погружают на 15 минут в 0,5% желтый сульфид аммония или 0,5% сульфид натрия. Вновь промывают в проточной воде, обезвоживают, просветляют в ксилоле и заливают в канадский бальзам.
В результате проведенных мероприятий места локализации активной холинэстеразы окрашиваются в темно-коричневый цвет, что позволяет идентифицировать нервные структуры (холинергические), содержащие ацетилхолин.
Недостатками вышеуказанных методов являются:
- необходимость фиксировать ткань в ацетоне при 0°С в течение 12-24 часов или кальций-формоле (15 мин при 3°С) для сохранения содержания и локализации ацетилхолинэстеразы (далее АХЭ) в нервных структурах;
- заливка в парафин и депарафинирование срезов при использовании метода Гомори;
- невозможность исследования адренергических нервных структур на фиксированном в ацетоне или кальций-формоле материале;
- необходимость разделять полученный материал на две части и исследовать холинергические нервные структуры в одной из них, а адренергические нервные структуры в другой.
Известен также метод выявления холинэстеразы по Келле и Фриденвальду с использованием в качестве субстрата ацетилтиохолина и тиохолината меди на замороженных срезах свежей нефиксированной ткани [2].
Метод выявления холинэстеразы по Келле и Фриденвальду заключается в том, что готовят замороженные срезы свежей нефиксированной ткани, помещают в раствор специфического субстрата (смесь растворителя и ацетилтиохолина) и инкубируют при 37°С в течение 60 мин. Ополаскивают в дистиллированной воде, насыщенной тиохолинатом меди. Переносят в 0,5% раствор сульфида аммония для предотвращения осадка тиохолина меди. Промывают, обезвоживают, просветляют в ксилоле и заливают в бальзам.
В результате исследования места локализации холинэстеразы выявляют по темно-коричневым отложениям сульфида меди, что позволяет идентифицировать холинергические нервные структуры.
Основным недостатком вышеуказанных методов является то, что для сохранения содержания и локализации АХЭ в нервных структурах ткани ткань фиксируют в ацетоне. Из-за этого не возможно использовать этот самый материал для проведения гистохимической реакции для выявления адренергических нервных структур.
Следует также отметить, что исходный полученный для исследования материал, которого может быть ограниченное количество, необходимо разделить на две части, для того чтобы провести две разные реакции.
Наиболее близким к заявляемому способу является метод выявления ацетилхолинэстеразы по Карновскому-Рутс с использованием в качестве субстрата ацетилтиохолина [3].
Метод Карновского-Рутс включает специфическую гистохимическую реакцию с использованием в качестве субстрата ацетилтиохолинйодида. Процедура выявления холинергических нервных волокон состоит в следующем: фиксация ткани в 10% растворе формалина в течение 24 часов, изготовление криостатных срезов толщиной 20-25 мкм, которые погружают в приготовленную непосредственно перед реакцией инкубационную смесь и помещают на 1 час 30 мин в термостат (t=37°С). Затем после быстрой промывки в дистиллированной воде срезы проводят по спиртам возрастающей концентрации (от 50% до 90%), просветляют в ксилоле и заключают в бальзам.
В результате этого холинергические нервные структуры, локализованные в ткани, приобретают темно-коричневый цвет.
Недостатками метода являются:
- необходимость фиксировать ткань в 10% растворе формалина в течение 24 часов для сохранения содержания и локализации АХЭ в нервных структурах;
- невозможность исследования адренергических нервных структур на фиксированном в 10% растворе формалина материале;
- необходимость разделять полученный материал на две части и исследовать холинергические нервные структуры в одной из них, а адренергические нервные структуры в другой, что не позволяет сравнивать локализацию и плотность распределения вегетативных нервных волокон разной нейромедиаторной принадлежности на одном и том же участке удаленной ткани.
Технический результат настоящего изобретения состоит в сокращении сроков обработки полученного материала и его объема, а также в обеспечении возможности морфологического сопоставления локализации и плотности распределения адренергических и холинергических нервных структур в одном и том же участке ткани на гистологическом срезе, тотальном или пленочном препарате.
Этот результат достигается тем, что в способе выявления в ткани нервных волокон адренергической и холинергической природы, включающем фиксацию материала и проведение гистохимической реакции для выявления холинергических нервных структур, при которой исследуемый зафиксированный материал инкубируют в течение 60-90 минут в термостате при температуре 37°С в смеси, содержащей в качестве субстрата ацетилтиохолинйодид, ополаскивают, проводят по спиртам возрастающей концентрации, просветляют и заключают в бальзам, согласно изобретению, фиксацию материала осуществляют 2% раствором глиоксиловой кислоты, приготовленной на 0,1 М фосфатном буфере с рН 7,0, и одновременно с фиксацией материала проводят гистохимическую реакцию для выявления в нем адренергических нервных структур, содержащих нейромедиаторы, образующие люминесцирующие продукты реакции с глиоксиловой кислотой, в которой материал инкубируют в течение 15-20 минут при температуре 20-25°С, затем высушивают и прогревают в термостате 5-10 минут при температуре 80°С, изучают с помощью люминесцентного микроскопа, проводят их морфометрию и фотографируют, после чего на этом же материале проводят гистохимическую реакцию для выявления холинергических нервных структур.
Наличие отличительных признаков, а именно фиксация материала в 2% растворе глиоксиловой кислоты, приготовленном на 0,1 М фосфатном буфере с рН 7,0, проведение в момент фиксации материала гистохимической реакции для выявления в нем адренергических нервных структур, содержащих нейромедиаторы, образующие люминесцирующие продукты реакции с глиоксиловой кислотой, путем инкубации материала в течение 15-20 минут при температуре 20-25°С, высушивания и прогрева в термостате 5-10 минут при температуре 80°С, изучения с помощью люминесцентного микроскопа, проведения морфометрии и фотографии, а также проведения после этого на этом же материале гистохимической реакции для выявления холинергических нервных структур, свидетельствует о соответствии заявляемого технического решения критерию патентоспособности “новизна”.
Способ разработан в Санкт-Петербургском научно-исследовательском институте уха, гола, носа и речи и прошел испытания на срезах опухолеподобных образований голосовых складок у 20 пациентов и миокарда у 20 мышей (из них 5 использовали в качестве контроля).
Способ осуществляют следующим образом.
Вместо фиксации полученного материала в формалине (СН2О·Н2О), как это проводят в прототипе, согласно предложенному решению, выполняют известную гистохимическую реакцию для выявления адренергических нервных структур с помощью глиоксиловой кислоты (С2Н2О3·Н2О) на предварительно замороженных срезах. Это позволяет выявить нейромедиаторы (адреналин и норадреналин) в местах их локализации и одновременно зафиксировать ацетилхолинэстеразу в холинергических нервных волокнах. Проведение гистохимической реакции для выявления адренергических структур осуществляли по методу Бъорклунда в модификации Швалева В.Н. и Жучковой Н.И. [4].
Криостатные срезы согласно прописи, составленной авторами, инкубировали в 2% растворе глиоксиловой кислоты (glyoxylic acid monohydrate 98%, производства фирмы Fluke AG, Швейцария), приготовленной на 0,1 М фосфатном буфере (рН 7,0). После инкубации в течении 15 минут при комнатной температуре срезы промокали фильтровальной бумагой и сушили в струе теплого воздуха под феном 15 минут. Высушенные препараты помещали на 5 мин в сушильный шкаф при t=80°С. После этого, в отличие от прописи, препараты не заключали в полистирол или вазелиновое масло, а изучали с помощью люминесцентного микроскопа ЛЮМАМ Р-8, проводили морфометрию и фотографировали, не используя покровных стекол, что исключает дополнительное светопреломление в покрывающих средах, улучшает качество визуального наблюдения и фотодокументации, а также позволяет использовать препарат для последующих манипуляций. После выявления адренергических нервных волокон на тех же срезах, тотальных или пленочных препаратах проводили гистохимическую реакцию для выявления холинергических нервных структур в соответствии с прототипом.
Инкубация препаратов в растворе глиоксиловой кислоты является специфическим методом выявления в ткани нейромедиаторов адренергической природы, так как в результате гистохимической реакции глиоксиловой кислоты с моноаминами образуются интенсивно люминесцирующие соединения, локализованные в нервных структурах. Вместе с тем раствор глиоксиловой кислоты позволяет фиксировать ацетилхолинэстеразу в холинергических нервных волокнах и окончаниях, что необходимо для получения качественных препаратов при постановке гистохимической реакции на ацетилхолинэстеразу. В результате места локализации фермента окрашиваются в темно-коричневый цвет. Полученные препараты по интенсивности окраски и плотности распределения холинергических нервных структур в ткани не отличаются от контрольных срезов, обработанных по прописи, указанной в прототипе.
Таким образом, способ позволяет получить качественные препараты для изучения адренергических и холинергических нервных структур без предварительной фиксации ткани в формалине, поочередно проследить адренергические и холинергические нервные структуры на одном и том же срезе, тотальном или пленочном препарате, а также проводить исследования на удаленных тканях, имеющих маленький объем, не позволяющий сделать несколько гистологических срезов, тотальных или пленочных препаратов.
Из вышесказанного следует, что технический результат достигается новой совокупностью существенных признаков, следовательно, заявляемый способ соответствует критерию патентоспособности “изобретательский уровень”.
При испытании предложенного способа в клинике объектом исследования служили опухолеподобные образования (полипы и узелки) голосовых складок, удаленные во время операции у больных.
В эксперименте объектом исследования служил миокард белой беспородной мыши. Животные содержались в виварии на обычном рационе в условиях ветеринарного надзора. Материал для исследования получали с использованием эфирного наркоза. Контролем служили срезы миокарда, обработанные в соответствии с прототипом с предварительной фиксацией ткани в формалине, без проведения гистохимической реакции выявления адренергических нервных структур.
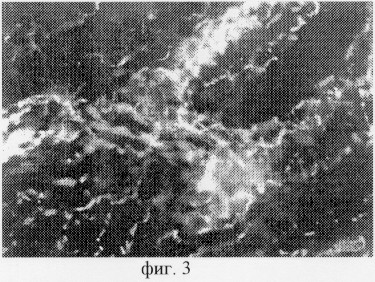
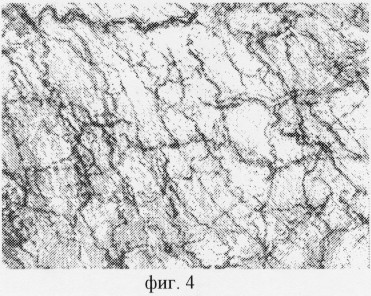
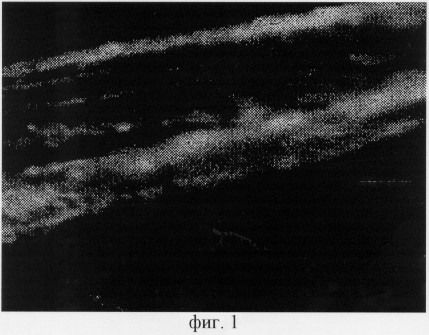
Способ иллюстрируется чертежами, где на фиг.1 изображены адренергические вегетативные нервные структуры в полипе, которые располагаются на сосуде в виде продольных проводников со специфической люминесценцией и небольшим количеством мелких варикозных расширений, от нервных волокон, локализованных на сосудах, ответвляются тонкие безварикозные терминали; на фиг.2 показаны холинергические вегетативные нервные структуры в этом же полипе, расположенные в подэпителиальном слое параллельно покровному эпителию и отдающие свои терминали к его базальной мембране, а также к глубжележащей соединительной ткани; на фиг.3 представлены адренергические нервные структуры, выявленные в миокарде мыши с помощью глиоксиловой кислоты, различного диаметра с хорошо выраженными варикозными расширениями, они образовывают внутритканевые широкопетлистые нервные сплетения; на фиг.4 изображены холинергические нервные структуры, выявляемые на тех же срезах, они представляют собой густые нервные сплетения, состоящие из нервных волокон, которые выглядят более толстыми и содержат меньшее число варикозных расширений, чем адренергические волокна.
Способ поясняется следующими примерами.
Пример 1.
Больная К., 39 лет (ИБ № 1030) обратилась в фониатрическое отделение НИИ ЛОР с жалобами на охриплость голоса, которая продолжалась около 3-х месяцев. Причиной заболевания пациентка считала повышенные голосовые нагрузки на занятиях с вокальным педагогом.
На основании анамнеза заболевания и данных объективного обследования был поставлен клинический диагноз “полип левой голосовой складки”. Оперативное вмешательство представляло собой удаление полипа под контролем видеостробоскопа в условиях местной анестезии с предварительной премедикацией. Операционный материал использовали для проведения патолого-гистологического и гистохимического анализа.
Патолого-гистологическое исследование проведено в отделении морфологии Санкт-Петербургского НИИ ЛОР по стандартной методике: 1/2 часть удаленного материала фиксировали в 10% нейтральном формалине, заключали в парафин, нарезали с помощью микротома и окрашивали срезы гематоксилином и эозином. При этом исследовании был поставлен диагноз “полип голосовой складки”.
Для постановки гистохимических реакций из оставшейся части полипа изготавливали серийные срезы толщиной 10-15 мкм на криостате-микротоме. Криостатные срезы инкубировали в 2% растворе глиоксиловой кислоты (glyoxylic acid monohydrate 98%, производства фирмы Fluke AG, Швейцария), приготовленной на 0,1 М фосфатном буфере (рН 7,0). После инкубации в течение 15 минут при комнатной температуре срезы промокали фильтровальной бумагой и сушили в струе теплого воздуха под феном 15 минут. Высушенные препараты помещали на 5 мин в сушильный шкаф при t=80°С.
После проведения гистохимической реакции с глиоксиловой кислотой препараты изучали с помощью люминесцентного микроскопа (объектив 60, окуляр Гомаль 3). При этом в полипе были обнаружены адренергические нервные структуры, которые, в основном, располагались на сосудах в виде продольных проводников со специфической люминесценцией и небольшим количеством мелких варикозных расширений. От нервных волокон, локализованных на сосудах, ответвлялись тонкие безварикозные терминали (фиг.1).
После выявления адренергических нервных волокон на тех же срезах проводили гистохимическую реакцию для выявления холинергических нервных структур. Для этого материал инкубировали в течение 60-90 минут в термостате при 37°С в смеси, содержащей в качестве субстрата ацетилтиохолинйодид, ополаскивали, проводили по спиртам возрастающей концентрации (от 50% до 90%), просветляли в ксилоле и заключали в бальзам.
Затем препараты изучали в световом микроскопе (объектив 40 и окуляр 10). При этом холинергические нервные структуры представляли собой волокна, расположенные в подэпителиальном слое параллельно покровному эпителию и отдающие свои терминали к его базальной мембране, а также к глубжележащей соединительной ткани (фиг.2).
Пример 2.
Миокард мыши резали на микротоме-криостате (толщина среза - 15 мкм). Затем проводили гистохимические реакции согласно предлагаемому способу.
Криостатные срезы инкубировали в 2% растворе глиоксиловой кислоты (glyoxylic acid monohydrate 98%, производства фирмы Fluke AG, Швейцария), приготовленной на 0,1 М фосфатном буфере (рН 7,0). После инкубации в течение 15 минут при комнатной температуре срезы промокали фильтровальной бумагой и сушили в струе теплого воздуха под феном 15 минут. Высушенные препараты помещали на 5 мин в сушильный шкаф при t=80°С. После проведения гистохимической реакции с глиоксиловой кислотой препараты изучали с помощью люминесцентного микроскопа (объектив 60, окуляр Гомаль 3).
Адренергические нервные структуры, выявляемые в миокарде мыши с помощью глиоксиловой кислоты, находились непосредственно среди мышечных волокон (люминесцентный микроскоп, объектив 40 и окуляр Гомаль 3). Нервные волокна различного диаметра с хорошо выраженными варикозными расширениями образовывали внутритканевые широкопетлистые нервные сплетения (фиг.3).
После выявления адренергических нервных волокон на тех же срезах проводили гистохимическую реакцию для выявления холинергических нервных структур. Для этого материал инкубировали в течение 60-90 минут в термостате при 37°С в смеси, содержащей в качестве субстрата ацетилтиохолинйодид, ополаскивали, проводили по спиртам возрастающей концентрации (от 50% до 90%), просветляли в ксилоле и заключали в бальзам. Затем препараты изучали в световом микроскопе (объектив 40 и окуляр 10).
Холинергические нервные структуры, выявляемые на тех же срезах, были локализованы в миокарде мыши так же, как и адренергические (световой микроскоп, объектив 40, окуляр 10). Они представляли собой густые нервные сплетения, состоящие из нервных волокон, которые выглядели более толстыми и содержали меньшее число варикозных расширений, чем адренергические волокна (фиг.4).
Полученные препараты по интенсивности окраски и плотности распределения холинергических нервных структур в ткани не отличались от контрольных срезов, обработанных по прописи, указанной в прототипе.
Из вышесказанного следует, что предлагаемый способ обеспечивает технический результат, не вызывает затруднений, предполагает использование освоенных материалов и стандартного оборудования, что свидетельствует о соответствии заявляемого технического решения критерию патентоспособности “промышленная применимость”.
Источники информации
1. Кононский А.И. Гистохимия. - Киев: Изд.объед. “Вища школа”, 1976. - С.191-192.
2. Лилли Р. Патогистологическая техника и практическая гистохимия. - М.: Мир, 1969. – 645 с.
3. Karnovsky M.C., Rootz Z.A. Direct-Coloring thiocholine method forcholinesterase // J. Histochem Cytochem. – 1964. - N12. - P.219-221.
4. Швалев В.Н., Жучкова Н.И. Простой способ выявления адренергических структур в тканях человека и животных с применением глиоксиловой кислоты // Архив анат. – 1979. - N6. - C.114-116.
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммуногистохимический способ выявления симпатических и парасимпатических структур на гистологических препаратах | 2016 |
|
RU2657787C1 |
| Способ подготовки препарата лимфатических сосудов к исследованию | 1989 |
|
SU1730553A1 |
| Способ выявления тучных клеток на гистологических препаратах сердца человека | 2022 |
|
RU2798117C1 |
| Способ комбинированного выявления клеток Купфера и коллагеновых волокон соединительной ткани на гистологических препаратах печени человека | 2024 |
|
RU2841222C1 |
| СПОСОБ ПАТОМОРФОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БИФУРКАЦИОННОЙ НЕДОСТАТОЧНОСТИ СОСУДОВ АРТЕРИАЛЬНОГО КРУГА БОЛЬШОГО МОЗГА | 2014 |
|
RU2575588C1 |
| СПОСОБ ГИСТОХИМИЧЕСКОГО ВЫЯВЛЕНИЯ МЕТАЦИДА В ПЕЧЕНИ ПРИ ОТРАВЛЕНИИ СУРРОГАТНЫМ АЛКОГОЛЕМ НА ПОЛИМЕРНОЙ ОСНОВЕ | 2010 |
|
RU2433409C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ОЦЕНКИ СОСТОЯНИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ | 2013 |
|
RU2555750C1 |
| Способ демаскирования антигенов при проведении иммуноцитохимических реакций | 2019 |
|
RU2719163C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАНИЙ ДЛЯ ВЫБОРА МЕТОДА ЛЕЧЕНИЯ АКСИАЛЬНЫХ ГРЫЖ ПИЩЕВОДНОГО ОТВЕРСТИЯ ДИАФРАГМЫ И СОЧЕТАННЫХ С НИМИ ЗАБОЛЕВАНИЙ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ | 1997 |
|
RU2124316C1 |
| Способ выявления тромбоцитов на гистологических препаратах | 2020 |
|
RU2770557C1 |

Изобретение относится к области клинической диагностики и может быть использовано для морфологического исследования вегетативных нервных структур в тканях организма, удаленных во время оперативного вмешательства. Способ влючает фиксацию материала и проведение гистохимической реакции для выявления холинергических нервных структур, при которой исследуемый зафиксированный материал инкубируют в течение 60-90 минут в термостате при температуре 37°С в смеси, содержащей в качестве субстрата ацетилтиохолинйодид, ополаскивают, проводят по спиртам возрастающей концентрации, просветляют и заключают в бальзам. При этом фиксацию материала осуществляют 2% раствором глиоксиловой кислоты, приготовленной на 0,1 М фосфатном буфере с рН 7,0. Одновременно с фиксацией материала проводят гистохимическую реакцию для выявления в нем адренергических нервных структур, содержащих нейромедиаторы, образующие люминесцирующие продукты реакции с глиоксиловой кислотой, в которой материал инкубируют в течение 15-20 минут при температуре 20-25°С, затем высушивают и прогревают в термостате 5-10 минут при температуре 80°С, изучают с помощью люминесцентного микроскопа, проводят их морфометрию и фотографируют. После этого на этом же материале проводят гистохимическую реакцию для выявления холинергических нервных структур. Изобретение позволяет проводить морфологическое сопоставление локализации и плотности распределения адренергических и холинергических нервных структур в одном и том же участке ткани. 4 ил.
Способ выявления в ткани нервных волокон адренергической и холинергической природы, включающий фиксацию материала и проведение гистохимической реакции для выявления холинергических нервных структур, при которой исследуемый зафиксированный материал инкубируют в течение 60-90 мин в термостате при температуре 37°С в смеси, содержащей в качестве субстрата ацетилтиохолинйодид, ополаскивают, проводят по спиртам возрастающей концентрации, просветляют и заключают в бальзам, отличающийся тем, что фиксацию материала осуществляют 2%-ным раствором глиоксиловой кислоты, приготовленной на 0,1 М фосфатном буфере с рН 7,0, и одновременно с фиксацией материала проводят гистохимическую реакцию для выявления в нем адренергических нервных структур, содержащих нейромедиаторы, образующие люминесцирующие продукты реакции с глиоксиловой кислотой, в которой материал инкубируют в течение 15-20 мин при температуре 20-25°С, затем высушивают и прогревают в термостате 5-10 мин при температуре 80°С, изучают с помощью люминесцентного микроскопа, проводят их морфометрию и фотографируют, после чего на этом же материале проводят гистохимическую реакцию для выявления холинергических нервных структур.
| KARNOVSKY M.C | |||
| et al | |||
| Direct-Coloring thiocholine method forcholinesterase | |||
| J | |||
| Histochem Cytochem | |||
| Прибор для заливки свинцом стыковых рельсовых зазоров | 1925 |
|
SU1964A1 |
| Прибор для записи звуковых волн | 1920 |
|
SU219A1 |
| ШУСТОВА Т.И | |||
| и др | |||
| Вегетативная иннервация мышц гортани | |||
| Новости оториноларингологии и логопатологии | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Способ выявления миелинизированных нервных волокон на гистологическом препарате | 1988 |
|
SU1573386A1 |
| ШВАЛЕВ В.Н | |||
| и др | |||
| Простой способ выявления адренергических нервных структур | |||
Авторы
Даты
2005-07-10—Публикация
2004-05-07—Подача