ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому гетероциклическому соединению и его фармацевтически приемлемой соли, которые обладают гипогликемическим действием, гиполипидемическим действием в кровотоке, действием, повышающим инсулинорезистентность, или активирующим PPAR (рецептор, активированный средством пролиферации пероксисомой) действием. Настоящее изобретение относится также к фармацевтической композиции, включающей вышеуказанное новое гетероциклическое соединение или его фармацевтически приемлемую соль. Кроме того, настоящее изобретение относится к гипогликемическому средству, гиполипидемическому средству, средству, повышающему инсулинорезистентность, терапевтическому средству для лечения диабета, средству против осложнения при диабете (т.е. терапевтическому средству против диабетического осложнения), средству, повышающему толерантность к глюкозе, средству против атеросклероза, средству против ожирения, противовоспалительному средству, средству для профилактики или лечения PPAR-опосредованного заболевания и средству для профилактики или лечения синдрома X, причем все из них включают вышеуказанное новое гетероциклическое соединение или его фармацевтически приемлемую соль.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В качестве терапевтического средства для лечения диабета использовали соединения бигуанида, обладающие в качестве основного действия ингибирующим действием на абсорбцию глюкозы через кишечник и на высвобождение глюкозы из печени, соединения сульфонилмочевины, обладающие ускоряющим действием на секрецию инсулина в качестве основного действия, инсулин и тому подобное. Однако соединения бигуанида вызывают молочный ацидоз, а соединения сульфонилмочевины иногда вызывают серьезную гипогликемию вследствие их сильного гипогликемического действия. Следовательно, должна быть предпринята должная осторожность при использовании указанных соединений. В последние годы были проведены активные исследования и разработки терапевтического средства для лечения диабета, которое не имеет указанные недостатки, в результате чего были найдены различные соединения, обладающие действием, повышающим инсулинорезистентность.
Инсулинорезистентность важна в качестве причины инсулиннезависимого сахарного диабета (NIDDM) вместе с понижением секреции инсулина. Следовательно, было необходимо разработать фармацевтическое средство, которое повышает инсулинорезистентность. В качестве средства, способного повысить инсулинорезистентность, известны различные соединения тиазолидина. В качестве таких соединений, например, 5-[4-[(6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)метокси]бензил]-2,4-тиазолидиндион (обычное название: троглитазон) описан в патенте Японии JP-B-2-31079, 5-[[4-[2-(5-этилпиридин-2-ил)этокси]фенил]метил]-2,4-тиазолидиндион (обычное название: пиоглитазон) описан в патенте Японии JP-B-5-66956 и 5-[[4-[2-[N-метил-N-(пиридин-2-иламино]этокси]фенил]метил]-2,4-тиазолидиндион (обычное название: розиглитазон) описан в патенте Японии JP-A-1-131169.
Таким образом, объектом настоящего изобретения является соединение, обладающее гипогликемическим действием, гиполипидемическим действием в кровотоке, повышающим инсулинорезистентность действием и РPAR-активирующим действием, которое имеют структуру, полностью отличающуюся от структуры общепринятых соединений, чтобы тем самым повысить разнообразие и расширить диапазон отбора гипогликемических средств, гиполипидемических средств, средств, повышающих инсулинорезистентность, терапевтических средств для лечения диабета, терапевтических средств для лечения диабетических осложнений, средств, повышающих толерантность к глюкозе, средств против атеросклероза, средств против ожирения, противовоспалительных средств, средств для профилактики или лечения PPAR-опосредованного заболевания и средств для профилактики или лечения синдрома X.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения провели интенсивные исследования для разрешения вышеуказанных проблем и обнаружили, что гетероциклическое соединение, имеющее новую структуру формулы [I]

где
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил, или моноциклический гетероциклилалкил, где указанный гетероцикл включает 5- или 6-членное кольцо, содержащее атом азота, и необязательно имеет заместитель, выбранный из низшего алкила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из атома кислорода и атома азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила, или его фармацевтически приемлемая соль обладает гипогликемическим действием, гиполипидемическим действием в кровотоке, действием, повышающим инсулинорезистентность, и PPAR-активирующим действием, что привело к завершению изобретения.
В соответствии с этим настоящее изобретение относится к следующему:
[1] производные тетрагидроизохинолинов формулы [I]

где
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил, или моноциклический гетероциклилалкил, где указанный гетероцикл включает 5- или 6-членное кольцо, содержащее атом азота, и необязательно имеет заместитель, выбранный из низшего алкила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из атома кислорода и атома азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила (в дальнейшем называемое гетероциклическим соединением [I]), и его фармацевтически приемлемая соль;
[2] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила, или его фармацевтически приемлемая соль;
[3] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, циклоалкилалкил, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил или гетероцикл-алкил,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль;
[4] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, циклоалкилалкил и арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила,
R3 представляет собой атом водорода,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль;
[5] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
Y-A - представляет собой



где RA представляет собой изопропил или трет-бутил,
RB представляет собой изопропил или трет-бутил,
RC представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил, 3-бутенил, циклопропил, 1-бутенил или 2,2-диметилпропил,
и его фармацевтически приемлемая соль;
[6] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
Y-A- представляет собой



где RА представляет собой изопропил или трет-бутил,
Rв представляет собой изопропил или трет-бутил,
Rс представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил или 3-бутенил,
и его фармацевтически приемлемая соль;
[7] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
Y-A- представляет собой


и его фармацевтически приемлемая соль;
[8] производное тетрагидроизохинолина по вышеуказанному [1], где в формуле [I]
Y-A- представляет собой

и его фармацевтически приемлемая соль;
[9] производное тетрагидроизохинолина по вышеуказанному [1], где гетероциклическое соединение формулы [1] является любым из следующих соединений от (1) до (67):
(1) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(2) 2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(3) 2-ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(4) 2-метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(5) 2-гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(6) 2-гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(7) 2-изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(8) 2-циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(9) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(10) 2-бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(11) 2-бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(12) 2-бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(13) 2-бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(14) этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(15) метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(16) 2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(17) этил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(18) 2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(19) этил-2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(20) 2-бензил-7-[2-(6-карбоксииндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(21) 2-(4-фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(22) 2-(2,2-диметилпропионил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(23) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(24) 2-бензил-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(25) 2-бензил-7-[2-(5-метил-2-(тиофен-2-ил)оксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(26) 2-бензил-7-[2-(5-метил-2-изопропилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(27) 2-бутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(28) 2-бензил-7-{2-[5-метил-2-(2-метилпропенил)оксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(29) 2-бензил-7-{2-[2-(3-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(30) 2-аллил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(31) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(2-пропинил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(32) 2-(2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(33) 2-бензил-7-[(индолин-3-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(34) 2-(3-бутенил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(35) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-пентаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(36) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(4-пентеноил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(37) 2-(3-метил-2-бутеноил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(38) 2-(3,3-диметилбутирил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(39) 2-бензил-7-метокси-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(40) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-2-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(41) 2-бензил-7-(3-метил-3-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(42) 2-бензил-7-(3,3-диметил-4-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(43) 2-бензил-7-(2-изопропилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(44) 2-бензил-7-(2-трет-бутилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(45) 2-бензил-7-(2-трет-бутилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(46) 7-(2-трет-бутилбензоксазол-6-ил)метокси-2-(2,2-диметилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(47) 2-бензил-7-(2-изопропилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(48) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-4-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(49) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-[(пиридин-2-ил)карбонил]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(50) метил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(51) 2-бензил-7-[2-(2-циклопропил-5-метилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(52) 2-(3-метил-2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(53) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(54) 2-бензил-7-{2-[(1-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(55) 2-бензил-7-{2-[(2,2-диметилпропил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(56)этил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(57) 7-(бензофуран-2-илметокси)-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(58) 2-изобутирил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(59) 7-[2-(бензофуран-2-ил)этокси]-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(60) 7-[2-(5-этилпиридин-2-ил)этокси]-2-гексаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(61) 2-карбоксиметил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(62) 2-[3-(метоксикарбонил)пропионил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(63) 2-[3-(этоксикарбонил)пропил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(64) 2-бензил-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(65) 2-(3-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(66) 2-(2-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и
(67) 2-бензил-7-[(5-метил-2-фенилоксазол-4-ил)метокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и их фармацевтически приемлемых солей;
[10] производное тетрагидроизохинолина по вышеуказанному [9], где производным тетрагидроизохинолина формулы [I] является любое из вышеуказанных соединений (1)-(47) или его фармацевтически приемлемая соль;
[11] производное тетрагидроизохинолина по вышеуказанному [9], где производным тетрагидроизохинолина формулы [I] является любое из вышеуказанных соединений (1)-(21) и его фармацевтически приемлемая соль;
[12] фармацевтическая композиция, обладающая гипогликемическим и гиполипидемическим действием, включающая производное тетрагидроизохинолина по любому из вышеуказанных [1]-[11] или его фармацевтически приемлемую соль;
[13] фармацевтическое средство, включающее производное тетрагидроизохинолина по любому из вышеуказанных [1]-[11] или его фармацевтически приемлемую соль, которое выбрано из группы, включающей гипогликемическое средство, гиполипидемическое средство, средство, повышающее инсулинорезистентность, терапевтическоое средство для лечения диабета, терапевтическое средство против диабетического осложнения, средство, повышающее толерантность к глюкозе, средство против атеросклероза, средство против ожирения, противовоспалительное средство, средство для профилактики или лечения PPAR-опосредованного заболевания и средство для профилактики или лечения синдрома X;
Новое производное тетрагидроизохинолина формулы [I]

где
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил, или моноциклический гетероциклилалкил, где указанный гетероцикл включает 5- или 6-членное кольцо, содержащее атом азота, и необязательно имеет заместитель, выбранный из низшего алкила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из атома кислорода и атома азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
и его фармацевтически приемлемая соль обладают гипогликемическим действием, гиполипидемическим действием в кровотоке, действием, повышающим инсулинорезистентность, и PPAR-активирующим действием.
Алкоксикарбонил в настоящем изобретении, предпочтительно, имеет от 2 до 5 атомов углерода. Примеры включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил и тому подобное.
Низший алкил в R1, R3 и R5 представляет собой, предпочтительно, алкил с неразветвленной или разветвленной цепью, имеющий от 1 до 6 атомов углерода, примерами которого являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил и тому подобное, предпочтительно, метил, этил, пропил и изопропил.
Низший алкокси в R3 представляет собой, предпочтительно, алкокси с неразветвленной или разветвленной цепью, имеющий от 1 до 6 атомов углерода, примерами которого являются метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, гексилокси и тому подобное, предпочтительно, метокси, этокси, пропокси и изопропокси.
“Алкенил” в алкениле, необязательно имеющем заместитель, в R2 и R4 представляет собой, предпочтительно, алкенил с неразветвленной или разветвленной цепью, имеющий от 2 до 6 атомов углерода, примерами которого являются винил, 1-пропенил, 2-пропенил, изопропенил, аллил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил и тому подобное, предпочтительно, аллил, 2-бутенил, 3-бутенил, 4-пентенил, 2-пропенил и 2-метил-1-пропенил. Примерами заместителя являются низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино и тому подобное. Когда алкенил в R2 или R4 является замещенным, число заместителей, предпочтительно, равно 1 или 2.
“Алкинил” в алкиниле, необязательно имеющем заместитель, в R2 представляет собой, предпочтительно, алкинил с неразветвленной или разветвленной цепью, имеющий от 2 до 4 атомов углерода, примерами которого являются этинил, 1-пропинил, 2-пропинил, 1-метил-2-пропинил и тому подобное, предпочтительно, этинил и 2-пропинил. Примерами заместителя являются низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино и тому подобное. Когда алкинил в R2 является замещенным, число заместителей, предпочтительно, равно 1 или 2.
“Алкил” в алкиле, необязательно имеющем заместитель, в R2 и R4 представляет собой, предпочтительно, алкил с неразветвленной или разветвленной цепью, имеющий от 1 до 8 атомов углерода, примерами которого являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил и тому подобное, предпочтительно, метил, этил, изобутил, пропил, гексил, пентил и изопропил. Примерами заместителя являются низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино и тому подобное. Когда алкил в R2 является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Циклоалкил в R2 представляет собой, предпочтительно, циклоалкил, имеющий от 3 до 8 атомов углерода, примером которого является циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и тому подобное, предпочтительно, циклопропил, циклопентил и циклогексил.
Циклоалкилалкил в R2 является циклоалкилалкилом, у которого циклоалкильная часть представляет собой, предпочтительно, циклоалкил, имеющий от 3 до 8 атомов углерода, и алкильная часть представляет собой, предпочтительно, алкил с неразветвленной или разветвленной цепью, имеющий от 1 до 3 атомов углерода. Примерами его являются циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, 2-циклопропилэтил, 2-циклобутилэтил, 2-циклопентилэтил, 2-циклогексилэтил, 2-циклогептилэтил, 2-циклооктилэтил, 3-циклопропилпропил, 3-циклобутилпропил, 3-циклопентилпропил, 3-циклогексилпропил, 3-циклогептилпропил, 3-циклооктилпропил, 1-циклогексилэтил, 1-циклогексилпропил, 2-циклогексилпропил и тому подобное, предпочтительно, циклогексилметил, 2-циклогексилэтил, циклопентилметил и 2-циклопентилэтил.
Примером арила в ариле, необязательно имеющем заместитель, в R2, R4 и Y является фенил, нафтил и тому подобное. Примерами заместителя являются низший алкил (как определено для низшего алкила в R1, R3 и R5), низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино, ацил (например, формил, ацетил, пропаноил и т.д.) и тому подобное. Когда арил в Y является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Примером арилалкила, необязательно имеющего заместитель, в R2 и R4 является арилалкил, в котором арильная часть представляет собой, предпочтительно, фенил, нафтил и тому подобное, и алкильная часть представляет собой, предпочтительно, алкил с неразветвленной или разветвленной цепью, имеющий от 1 до 3 атомов углерода. Примерами арилалкила являются бензил, 1-нафтилметил, 2-нафтилметил, 2-фенилэтил, 2-(1-нафтил) этил, 2-(2-нафтил) этил, 3-фенилпропил, 3-(1-нафтил) пропил, 3-(2-нафтил)пропил, 1-фенилэтил, 2-фенилпропил, 1-(1-нафтил)этил, 1-(2-нафтил)этил, 1-(1-нафтил)пропил, 1-(2-нафтил)пропил, 2-(1-нафтил)пропил, 2-(2-нафтил)пропил и тому подобное, предпочтительно, бензил, 3-фенилпропил, 1-нафтилметил и 2-нафтилметил. Примерами заместителей являются низший алкил (как определено для низшего алкила в R1, R3 и R5), низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино, ацил (например, формил, ацетил, пропаноил и т.д.) и тому подобное, предпочтительно, низший алкил, низший алкокси, атом галогена и ацил. Когда арилалкил в Y является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Ароматический гетероцикл в ароматическом гетероциклическом остатке, необязательно имеющем заместитель в Y, представляет собой, предпочтительно, моноциклический гетероцикл или конденсированный гетероцикл, содержащий, по меньшей мере, один гетероатом, выбранный из группы, состоящей из атома кислорода, атома азота и атома серы. Конденсированный гетероцикл в настоящем изобретении имеет два кольца и включает конденсированный гетероцикл, имеющий гетероатом(ы) в обоих кольцах. Моноциклический гетероцикл, предпочтительно, включает 5- или 6-членное кольцо. Гетероцикл, составляющий конденсированный гетероцикл, предпочтительно, представляет собой 5- или 6-членное кольцо. Кольцо без гетероатома, которое образует конденсированный гетероцикл, предпочтительно, является 5- или 6-членным кольцом. Примерами ароматического гетероциклического остатка являются моноциклический гетероциклический остаток, такой как фурил, тиенил, пиридил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, триазолил, тиадиазолил, оксадиазолил, пиридазинил, пиримидинил или пиразинил и тому подобное; конденсированный гетероциклический остаток, такой как индолил, изоиндолил, индолинил, изоиндолинил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, бензоксазолил, бензотиазолил, хинолил, изохинолил, бензоксазинил, бензотиазинил, фуро[2,3-b]пиридил, тиено[2,3-b]пиридил, нафтиридинил, имидазопиридил, оксазолопиридил, тиазолопиридил и тому подобное, с предпочтением, отданным пиридилу, оксазолилу, индолинилу, бензоксазолилу, тиазолилу, бензотиазолилу, индолилу, хинолилу и бензофуранилу. Примерами заместителя являются низший алкил (как определено для низшего алкила в R1, R3 и R5), низший алкокси (как определено для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино, арил (например, фенил, нафтил и тому подобное), гетероциклический остаток (например, тиенил, пиридил, фурил и тому подобное), алкенил (как определено для алкенила в R2 и R4), циклоалкил (например, циклопропил и т.д.) и тому подобное, предпочтительно, арил, низший алкил, карбокси, гетероциклический остаток, алкенил и циклоалкил. Когда ароматический гетероциклический остаток в Y является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Низший алкилен в В представляет собой, предпочтительно, алкилен с неразветвленной или разветвленной цепью, имеющий от 1 до 6 атомов углерода, примерами его являются метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, метилметилен, 2,2-диметилтриметилен, 2-этилтриметилен, 1-метилтетраметилен, 2-метилтетраметилен, 3-метилтетраметилен, 3,3-диметилтриметилен, 3,3-диметилтетраметилен и тому подобное, предпочтительно, этилен, триметилен и тетраметилен.
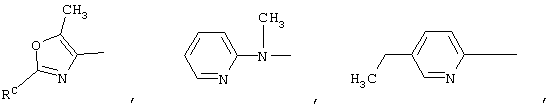
Гетероциклическая часть в гетероциклическом алкиле, необязательно имеющем заместитель в R2, имеет значение, указанное для “ароматического гетероциклического остатка” в “ароматическом гетероциклическом остатке, необязательно имеющем заместитель, в Y. Примером алкильной части является алкил с неразветвленной или разветвленной цепью, имеющий от 1 до 3 атомов углерода. Определенными примерами гетероциклического алкила являются 1-пиридилметил, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 1- (1-пиридил)этил, 1-(2-пиридил)этил, 1-(3-пиридил)этил, 1-(4-пиридил)этил, 2-(1-пиридил)этил, 2-(2-пиридил)этил, 2-(3-пиридил)этил, 2-(4-пиридил)этил; 1-(1-пиридил)пропил, 1-(2-пиридил)пропил, 1-(3-пиридил)пропил, 1-(4-пиридил)пропил, 2-(1-пиридил)пропил, 2-(2-пиридил)пропил, 2-(3-пиридил)пропил, 2-(4-пиридил)пропил, 3-(1-пиридил)пропил, 3-(2-пиридил)пропил, 3-(3-пиридил)пропил, 3-(4-пиридил)пропил; 2-тиенилметил, 3-тиенилметил; 1-(2-тиенил)этил, 1-(3-тиенил)этил, 2-(2-тиенил)этил, 2-(3-тиенил)этил; 1-(2-тиенил)пропил, 1-(3-тиенил)пропил, 2-(2-тиенил)пропил, 2-(3-тиенил)пропил, 3-(2-тиенил)пропил, 3-(3-тиенил)пропил и тому подобное. Гетероциклический алкил может быть замещен в гетероциклической части. Примерами заместителей являются низший алкил (как указано для низшего алкила в R1, R3 и R5), низший алкокси (как указано для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино и тому подобное. Когда гетероциклический остаток является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Что касается гетероциклического остатка, необязательно имеющего заместитель, в R4, гетероциклический остаток является таким же, как “ароматический гетероциклический остаток” в “ароматическом гетероциклическом остатке, необязательно имеющем заместитель”, в Y, который, предпочтительно, представляет собой пиридил. Гетероциклический остаток может быть замещен. Примерами заместителей являются низший алкил (как указано для низшего алкила в R1, R3 и R5), низший алкокси (как указано для низшего алкокси в R3), гидрокси, карбокси, алкоксикарбонил, атом галогена (атом хлора, атом брома, атом иода и атом фтора), нитро, амино и тому подобное. Когда гетероциклический остаток является замещенным, число заместителей, предпочтительно, равно 1 или 2.
Примерами гетероциклического соединения [I] и его фармацевтически приемлемой соли, предпочтительно, являются следующие соединения.
Гетероциклическое соединение вышеуказанной формулы [I],
где
(1) R1 представляет собой атом водорода или низший алкил, R2 представляет собой атом водорода, алкил, необязательно имеющий заместитель, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, арилалкил, необязательно имеющий заместитель, или -COR4, где R4 представляет собой атом водорода, алкил, необязательно имеющий заместитель, арил, необязательно имеющий заместитель, или арилалкил, необязательно имеющий заместитель,
R3 представляет собой атом водорода, низший алкил или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой атом водорода или низший алкил,
В представляет собой низший алкилен и
Y представляет собой арил, необязательно имеющий заместитель, или ароматический гетероциклический остаток, необязательно имеющий заместитель,
(2) R1 представляет собой атом водорода или низший алкил,
R2 представляет собой атом водорода, алкил, циклоалкилалкил, арилалкил, необязательно имеющий заместитель, алкенил, алкинил, гетероциклический алкил или -COR4, где R4 представляет собой алкил, алкенил или арил,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой простую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен и
Y представляет собой арил или ароматический гетероциклический остаток, необязательно имеющий заместитель, или
(3) R1 представляет собой атом водорода или низший алкил,
R2 представляет собой атом водорода, алкил, циклоалкилалкил, арилалкил, необязательно имеющий заместитель, или -COR4, где R4 представляет собой алкил или арил,
R3 представляет собой атом водорода,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен и
Y представляет собой ароматический гетероциклический остаток, необязательно имеющий заместитель, и его фармацевтически приемлемая соль.
В формуле [I] Y-A- представляет собой, предпочтительно,





где RA представляет собой изопропил или трет-бутил,
RB представляет собой изопропил или трет-бутил и
RC представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил или 3-бутенил или
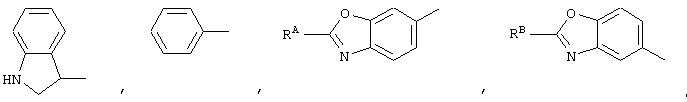
где RA представляет собой изопропил или трет-бутил,
RB представляет собой изопропил или трет-бутил и
RC представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил, 3-бутенил, циклопропил, 1-бутенил или 2,2-диметилпропил, с особым предпочтением, отданным
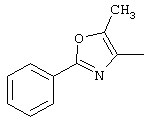
Предпочтительными примерами гетероциклического соединения [I] и его фармацевтически приемлемой соли являются (1) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(2) 2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(3) 2-ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(4) 2-метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(5) 2-гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(6) 2-гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(7) 2-изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(8) 2-циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(9) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(10) 2-бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(11) 2-бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(12) 2-бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(13) 2-бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(14) этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(15) метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(16) 2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(17) этил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(18) 2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(19) этил-2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(20) 2-бензил-7-[2-(6-карбоксииндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(21) 2-(4-фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и их фармацевтически приемлемые соли. Кроме вышеуказанных предпочтительными являются
(22) 2-(2,2-диметилпропионил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]- 1,2,3,4-тетрагидроизохинолин-(3S)карбоновая кислота,
(23) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(24) 2-бензил-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(25) 2-бензил-7-[2-(5-метил-2-(тиофен-2-ил)оксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(26) 2-бензил-7-[2-(5-метил-2-изопропилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(27) 2-бутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(28) 2-бензил-7-{2-[5-метил-2-(2-метилпропенил)оксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(29) 2-бензил-7-{2-[2-(3-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(30) 2-аллил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(31) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(2пропинил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(32) 2-(2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(33) 2-бензил-7-[(индолин-3-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(34) 2-(3-бутенил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(35) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-пентаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(36) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2- (4-пентеноил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(37) 2-(3-метил-2-бутеноил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(38) 2-(3,3-диметилбутирил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(39) 2-бензил-7-метокси-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(40) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-2-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(41) 2-бензил-7-(3-метил-3-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(42) 2-бензил-7-(3,3-диметил-4-фенилбутокси)-1,2,3,4-тетрагидроизохинолин- (3S)-карбоновая кислота,
(43) 2-бензил-7-(2-изопропилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(44) 2-бензил-7-(2-трет-бутилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(45) 2-бензил-7-(2-трет-бутилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(46) 7-(2-трет-бутилбензоксазол-6-ил)метокси-2-(2,2-диметилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая
кислота и
(47) 2-бензил-7-(2-изопропилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и их фармацевтически приемлемые соли.
Кроме вышеуказанных предпочтительными являются следующие гетероциклические соединения [I] и их фармацевтически приемлемые соли.
(48) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-4-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(49) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-[(пиридин-2-ил)карбонил]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(50) метил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(51) 2-бензил-7-[2-(2-циклопропил-5-метилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(52) 2-(3-метил-2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(53) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(54) 2-бензил-7-{2-[(1-бутенил)-5-метилоксазол-4-ил]этокси}1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(55) 2-бензил-7-{2-[(2,2-диметилпропил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(56) этил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)карбоксилат,
(57) 7-(бензофуран-2-илметокси)-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(58) 2-изобутирил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(59) 7-[2-(бензофуран-2-ил)этокси]-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(60) 7-[2-(5-этилпиридин-2-ил)этокси]-2-гексаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(61) 2-карбоксиметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(62) 2-[3-(метоксикарбонил)пропионил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)карбоновая кислота,
(63) 2-[3-(этоксикарбонил)пропил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)карбоновая кислота,
(64) 2-бензил-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(65) 2-(3-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(66) 2-(2-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и
(67) 2-бензил-7-[(5-метил-2-фенилоксазол-4-ил)метокси]1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота.
Поскольку гетероциклическое соединение [I] имеет асимметричный углерод в 3-положении кольца 1,2,3,4-тетрагидроизохинолина, оно включает различные стереоизомеры.
Наиболее предпочтительной конфигурацией является

где R1, R2, R3, Y, А и В имеют значения, указанные выше.
Если необходимо, гетероциклическое соединение [I] можно преобразовать в фармацевтически приемлемую соль.
Когда гетероциклическое соединение [I] содержит основную группу, можно получить кислотно-аддитивную соль. Кислота, используемая для образования кислотно-аддитивной соли, не подвергается какому-либо конкретному ограничению, если она образует соль с основной частью и является фармацевтически приемлемой кислотой. Примеры кислоты включают неорганические кислоты, такие как хлористоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и тому подобное, и органические кислоты, такие как щавелевая кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное, и тому подобное.
Когда гетероциклическое соединение [I] имеет кислотную группу (например, карбоксильную группу и тому подобное), можно получить соль, такую как соль щелочного металла (например, соль натрия, соль калия и тому подобное), соль щелочноземельного металла (например, соль кальция, соль магния и тому подобное) или соль органического основания (например, соль триэтиламина, соль дициклогексиламина, соль пиридина и тому подобное) и тому подобное.
Гетероциклическое соединение [I] и его фармацевтически приемлемую соль можно получить по любому из следующих способов получения.
Способ получения 1

где R1, R3, А, В и Y имеют значения, указанные выше, R6 представляет собой атом водорода, алкил, необязательно имеющий заместитель, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, арилалкил, необязательно имеющий заместитель, алкенил, необязательно имеющий заместитель, алкинил, необязательно имеющий заместитель, гетероциклический алкил, необязательно имеющий заместитель, -COR4 (R4 имеет указанные выше значения) или аминозащитную группу и Х представляет собой гидрокси, атом галогена (атом фтора, атом хлора, атом брома или атом иода) или удаляемую группу, такую как алкансульфонилокси (например, метансульфонилокси, этансульфонилокси, пропансульфонилокси, трифторметансульфонилокси и тому подобное), арилсульфонилокси (например, фенилсульфонилокси, толилсульфонилокси и тому подобное) и тому подобное.
В способе получения 1 соединение формулы [Iа] (называемое также соединением [Iа]) синтезируют взаимодействием соединения формулы [II] (называемого также соединением [II]) с соединением формулы [III] (называемым также соединением [III]).
“Алкил, необязательно имеющий заместитель”, “циклоалкил”, “циклоалкилалкил”, “арил, необязательно имеющий заместитель”, “арилалкил, необязательно имеющий заместитель”, “алкенил, необязательно имеющий заместитель”, “алкинил, необязательно имеющий заместитель” и “гетероциклический алкил, необязательно имеющий заместитель”, в R6 имеют значения, указанные для R2.
Примерами аминозащитной группы в R6 являются формил, монохлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксикарбонил, этоксикарбонил, бензилоксикарбонил, п-нитробензилоксикарбонил, дифенилметилоксикарбонил, метоксиметилкарбонил, метоксиметилоксикарбонил, триметилсилил, 2,2,2-трихлорэтоксикарбонил, 2-метилсульфонилэтилоксикарбонил, трет-бутоксикарбонил (обозначаемый далее Воc), тритил и тому подобное.
Способ получения 1-а: Когда Х представляет собой гидрокси, способ получения 1 включает реакцию дегидратации, такую как реакция Мицунобу (Reagents for Organic Synthesis, Fisher and Fisher, Vol. 6, 645) и тому подобное. Реакцию обычно проводят в растворителе с азосоединением и фосфином. Примерами азосоединения являются ди(С1-С4-алкил)азодикарбоксилат (например, диэтилазодикарбоксилат и тому подобное), азодикарбоксамид (например, 1,1' -(азодикарбонил)дипиперидин и тому подобное) и тому подобное. Примерами фосфина являются триарилфосфин (например, трифенилфосфин и тому подобное), три(С1-С4-алкил)фосфин (например, трибутилфосфин и тому подобное) и тому подобное.
Примерами растворителя, используемого в способе получения 1-а, являются диоксан, ацетонитрил, тетрагидрофуран, хлороформ, метиленхлорид, этиленхлорид, бензол, толуол, ксилол, этилацетат, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и тому подобное и их смеси и тому подобное, но растворитель не ограничивают, пока он не оказывает неблагоприятное влияние на реакцию.
Количество соединения [II], используемого в способе получения I-а, не подвергается какому-либо конкретному ограничению. Его используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [III]. Азосоединение и фосфин соответственно используют в количестве обычно 1-3 моль, предпочтительно 1-1,5 моль, на 1 моль соединения [III].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, в способе получения 1-а варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 50°С в течение от 30 мин до приблизительно 12 часов.
Способ получения 1-b: Когда Х представляет собой атом галогена или удаляемую группу, такую как алкансульфонилокси (например, метансульфонилокси, этансульфонилокси, пропансульфонилокси, трифторметансульфонилокси и тому подобное), арилсульфонилокси (например, фенилсульфонилокси, толилсульфонилокси и тому подобное) и тому подобное, получение по способу 1-b проводят в растворителе, подобном растворителю, используемому в способе получения 1-а, и в присутствии основания.
Примерами основания, используемого в способе получения 1-b, но основания не ограничиваются указанными примерами, являются неорганическое основание, такое как карбонат щелочного металла (например, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и тому подобное), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия и тому подобное), гидридное соединение металла (например, гидрид натрия, гидрид калия, гидрид кальция и тому подобное) и тому подобное; органическое основание, такое как алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное), амины (например, триэтиламин, диизопропилэтиламин и тому подобное) и тому подобное.
Количество соединения [II], используемого в способе получения 1-b, не подвергается какому-либо конкретному ограничению. Его используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [III]. Основание используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [III].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, в способе получения 1-b варьируют в зависимости от реагента, растворителя и тому подобное, используемых в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 30 мин до приблизительно 12 часов.
В способе получения 1 R1 соединения [III], предпочтительно, представляет собой низший алкил. В указанном случае получают соединение [Iа], где R1 представляет собой низший алкил, данное соединение можно преобразовать в соединение [Iа], где R1 представляет собой атом водорода, гидролизом по способу, известному per se.
В способе получения 1, когда R6 соединения [III] представляет собой аминозащитную группу, получают соединение [Iа], где R6 представляет собой аминозащитную группу. Данное соединение можно преобразовать в соединение [Iа], где R1 представляет собой атом водорода, удалением защиты по способу, известному per se.
Способ получения 2

где R1, R3, А, В и Y имеют указанные выше значения, R7 представляет собой аминозащитную группу, R8 представляет собой алкил, необязательно имеющий заместитель, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, арилалкил, необязательно имеющий заместитель, алкенил, необязательно имеющий заместитель, алкинил, необязательно имеющий заместитель, или гетероциклический алкил, необязательно имеющий заместитель, и U представляет собой атом галогена (атом фтора, атом хлора, атом брома, атом иода) или удаляемую группу, такую как алкансульфонилокси (например, метансульфонилокси, этансульфонилокси, пропансульфонилокси, трифторметансульфонилокси и тому подобное), арилсульфонилокси (например, фенилсульфонилокси, толилсульфонилокси и тому подобное) и тому подобное.
В способе получения 2 аминозащитную группу R7 соединения формулы [Ib] (называемого также соединением [Ib]) элиминируют способом, известным per se, с получением соединения формулы [Iс] (называемого также соединением [Iс]), которое затем подвергают взаимодействию с соединением формулы [V] (называемым также соединением [V]), посредством чего получают соединение формулы [Id] (называемое также соединением [Id]).
“Алкил, необязательно имеющий заместитель”, “циклоалкил”, “циклоалкилалкил”, “арил, необязательно имеющий заместитель”, “арилалкил, необязательно имеющий заместитель”, “алкенил, необязательно имеющий заместитель”, “алкинил, необязательно имеющий заместитель” и “гетероциклический алкил, необязательно имеющий заместитель”, в R8 имеют значения, указанные для R2.
Аминозащитная группа в R7 имеет значения, указанные для R6.
В способе получения 2 соединение [Iс] подвергают взаимодействию с соединением [V] в растворителе, который не ингибирует взаимодействие, таком как диоксан, ацетонитрил, тетрагидрофуран, хлороформ, метиленхлорид, этиленхлорид, бензол, толуол, ксилол, этилацетат, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и тому подобное и их смеси и тому подобное, в присутствии основания, с получением соединения [Id].
В способе получения 2 примером основания, используемого для взаимодействия соединения [Iс] с соединением [V], но основания не ограничиваются указанными примерами, является неорганическое основание, такое как карбонат щелочного металла (например, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и тому подобное), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия и тому подобное), гидридное соединение металла (например, гидрид натрия, гидрид калия и гидрид кальция и тому подобное) и тому подобное; органическое основание, такое как алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное), амины (например, триэтиламин, диизопропилэтиламин и тому подобное) и тому подобное.
Количество соединения [V], используемого в способе получения 2, обычно составляет 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic]. Основание используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, для взаимодействия соединения [Ic] с соединением [V] в способе получения 2 варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 30 мин до приблизительно 24 часов.
В способе получения 2 R1 соединения [Ib], предпочтительно, представляет собой низший алкил. В данном случае получают соединение [Id], где R1 представляет собой низший алкил, и указанное соединение можно преобразовать в соединение [Id], где R1 представляет собой атом водорода, гидролизом по способу, известному per se.
Способ получения 3

где R1, R3, R4, А, В и Y имеют указанные выше значения.
В способе получения 3 соединение формулы [Iе] (называемое также соединением [Iе]) синтезируют взаимодействием соединения [Iс] с соединением формулы [VI] (называемым также соединением [VI]).
В способе получения 3 соединение [VI] можно использовать не только в форме свободной кислоты, но также в форме соли (например, соли натрия, соли калия, соли кальция, соли триэтиламина, соли пиридина и тому подобное) или в виде реакционноспособного производного (например, галогенангидрида кислоты, такого как хлорангидрид кислоты, бромангидрид кислоты и тому подобное; ангидрида кислоты; смешанного ангидрида кислоты с замещенной фосфорной кислотой, такой как диалкилфосфат и тому подобное, и алкилкарбонатом, таким как моноэтилкарбонат и тому подобное; реакционноспособного амида, который является амидом с имидазолом и тому подобное; сложного эфира, такого как цианометиловый эфир и 4-нитрофениловый эфир и тому подобное) и тому подобное.
В способе получения 3, когда соединение [VI] используют в форме свободной кислоты или соли, данную реакцию, предпочтительно, проводят в присутствии конденсирующего агента. В качестве конденсирующего агента можно использовать дегидратирующий агент, такой как соединение карбодиимида (например, N,N'-дициклогексилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид, N-циклогексил-N'-морфолиноэтилкарбодиимид, N-циклогексил-N'-(4-диэтиламиноциклогексил)карбодиимид и тому подобное), соединение азолида (например, N,N'-карбонилдиимидазол, N,N'-тионилдиимидазол и тому подобное) и тому подобное. Конденсирующий агент используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic]. Принимается во внимание, что, когда используют конденсирующий агент, соединение [VI] становится реакционноспособным производным и вступает в реакцию.
Способ получения 3 обычно проводят в растворителе, инертном для реакции. Примерами растворителя являются ацетон, диоксан, ацетонитрил, хлороформ, бензол, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин, вода и их смешанные растворители. В способе получения 3 можно использовать основание, такое как триэтиламин, пиридин, 4-диметиламинопиридин, карбонат калия и тому подобное. Когда используют основание, его используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic].
В способе получения 3 соединение [VI] используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, для взаимодействия соединения [VI] с соединением [Ic] в способе получения 3 варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 10 мин до приблизительно 12 часов.
В способе получения 3 соединение [Ie'] получают взаимодействием соединения [VI] с соединением [Iс], выделением и восстановлением образовавшегося соединения [Ie]. Данную реакцию восстановления проводят в растворителе, который не оказывает неблагоприятное влияние на реакцию (например, воде, метаноле, этаноле, диоксане, ацетонитриле, тетрагидрофуране, хлороформе, метиленхлориде, этиленхлориде, бензоле, толуоле, ксилоле, этилацетате, N,N-диметилформамиде, N,N-диметилацетамиде, диметилсульфоксиде, их смеси и тому подобное) в присутствии восстановителя.
Примером восстановителя, используемого в данной реакции, является гидридный комплекс металла (например, алюмогидрид лития, цианоборогидрид натрия (NaBH3CN), борогидрид натрия и тому подобное), боран и тому подобное. Агент не подвергается любому конкретному ограничению, поскольку его обычно используют для восстановления карбонильной группы в метиленовую группу. Восстановитель используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ie].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, в реакции восстановления варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 30 мин до приблизительно нескольких часов.
Способ получения 4

где R1, R2, R3, R5, В, X, Y и U имеют указанные выше значения и R10 представляет собой аминозащитную группу.
Аминозащитная группа в R10 имеет значения, указанные для R6.
Способ получения 4 предназначается для гетероциклического соединения [I], где А представляет собой >N-R5. В данном способе соединение формулы [VII] (называемое также соединением [VII]) подвергают взаимодействию с соединением формулы [VIII] (называемым также соединением [VIII]) таким же способом, как в способе получения 1, получая при этом соединение формулы [IX] (называемое также соединением [IX]), и аминозащитную группу в R10 соединения [IX] элиминируют способом, известным per se, получая при этом соединение формулы [X] (называемое также соединением [X]), которое затем подвергают взаимодействию с соединением формулы [XI] (называемым также соединением [XI], посредством чего получают соединение формулы [If] (называемое также соединением [If].
Взаимодействие соединения [X] с соединением [XI] в способе получения 4 проводят в растворителе, который не оказывает неблагоприятное влияние на реакцию в присутствии основания. Примерами растворителя являются диоксан, ацетонитрил, тетрагидрофуран, хлороформ, метиленхлорид, этиленхлорид, бензол, толуол, ксилол, этилацетат, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и тому подобное и их смеси. Когда соединение [XI] можно использовать в качестве растворителя, его используют в качестве растворителя.
Примерами основания, используемого в реакции соединения [X] с соединением [XI] в способе получения 4, но основания не ограничиваются указанными примерами, являются неорганическое основание, такое как карбонат щелочного металла (например, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и тому подобное), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия и тому подобное), гидридное соединение металла (например, гидрид натрия, гидрид калия, гидрид кальция и тому подобное) и тому подобное; органическое основание, такое как алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и тому подобное) и амины (например, триэтиламин, диизопропилэтиламин и тому подобное) и тому подобное. Основание используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [X].
В способе получения 4 соединение [XI] используют в пропорции обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [X].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, в реакции соединения [X] с соединением [XI] в способе получения 4 варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 30 мин до приблизительно нескольких часов.
Способ получения 5
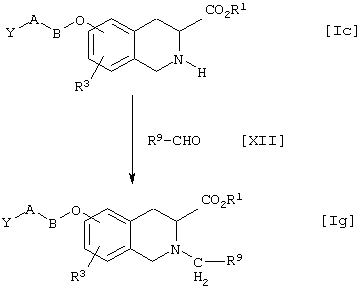
где R1, R3, А, В и Y имеют указанные выше значения, R9 представляет собой такую группу, которая делает группу формулы -CH2-R9 алкилом, необязательно имеющим заместитель, циклоалкилалкилом, арилалкилом, необязательно имеющим заместитель, алкенилом, необязательно имеющим заместитель, алкинилом, необязательно имеющим заместитель, или гетероциклическим алкилом, необязательно имеющим заместитель.
В способе получения 5 соединение [Iс] подвергают взаимодействию с соединением формулы [XII] (называемым также соединением [XII]), посредством чего получают соединение формулы [Ig] (называемое также соединением [Ig]).
В группе формулы -CH2-R9 “алкил, необязательно имеющий заместитель”, “циклоалкилалкил”, “арилалкил, необязательно имеющий заместитель”, “алкенил, необязательно имеющий заместитель”, “алкинил, необязательно имеющий заместитель”, и “гетероциклический алкил, необязательно имеющий заместитель”, имеют значения, указанные для R2.
В способе получения 5 соединение [Iс] и соединение [XII] конденсируют в растворителе, который не ингибирует реакцию (например, воде, метаноле, этаноле, диоксане, ацетонитриле, тетрагидрофуране, хлороформе, метиленхлориде, этиленхлориде, бензоле, толуоле, ксилоле, этилацетате, N,N-диметилформамиде, N,N-диметилацетамиде, диметилсульфоксиде, их смеси и тому подобное) в присутствии восстановителя.
Восстановитель, используемый в способе получения 5, не подвергают любому конкретному ограничению, и примером его является гидридный комплекс металла (например, алюмогидрид лития, цианоборогидрид натрия (NaBH3CN), борогидрид натрия и тому подобное), боран и тому подобное.
В способе получения 5 соединение [XII] используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Iс]. Восстановитель используют в количестве обычно 1-5 моль, предпочтительно 1-3 моль, на 1 моль соединения [Ic].
Хотя условия реакции, такие как температура реакции и время реакции и тому подобное, в способе получения 5 варьируют в зависимости от реагента, растворителя и тому подобное, которые используют в данной реакции, реакция обычно протекает при температуре от -30°С до 150°С в течение от 30 мин до приблизительно нескольких часов.
Гетероциклическое соединение [I], полученное по вышеуказанным способам 1-5, можно выделить общепринятым способом и, когда необходимо, очистить общепринятым способом, таким как перекристаллизация, препаративная тонкослойная хроматография, колоночная хроматография и тому подобное. Если необходимо, соединение можно также очистить превращением в соль.
Гетероциклическое соединение [I] можно преобразовать в его фармацевтически приемлемую соль способом, известным per se.
Фармацевтическая композиция, включающая гетероциклическое соединение [I] или его фармацевтически приемлемую соль настоящего изобретения, может содержать добавку и тому подобное. Примерами добавки являются эксципиент (например, крахмал, лактоза, сахар, карбонат кальция, фосфат кальция и тому подобное), связующее (например, крахмал, гуммиарабик, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, кристаллическая целлюлоза и тому подобное), смазывающее вещество (например, стеарат магния, тальк и тому подобное), разрыхлитель (например, кальцийкарбоксиметилцеллюлоза, тальк и тому подобное) и тому подобное.
Вышеуказанные компоненты смешивают с получением препарата для перорального введения, такого как капсула, таблетка, порошок, гранула, сухой сироп и тому подобное, или препарата для парентерального введения, такого как инъекция, суппозиторий и тому подобное, по способу, известному per se.
Хотя доза гетероциклического соединения [I] или его фармацевтически приемлемой соли варьирует в соответствии с индивидуумом, которому вводят дозу, симптомом и другими факторами, когда ее вводят перорально взрослому пациенту, страдающему, например, диабетом, диабетическими осложнениями или гиперлипидемией, разовая доза составляет приблизительно 1-500 мг/кг массы тела при введении 1-3 раза в день.
Гетероциклическое соединение [I] и его фармацевтически приемлемая соль настоящего изобретения проявляют превосходящее гипогликемическое действие, гиполипидимическое действие в кровотоке, действие, повышающее инсулинорезистентность, и PPAR-активирующее действие у млекопитающих (человека, крупного рогатого скота, лошади, собаки, кошки, крысы, мыши, хомяка и тому подобное), и их можно использовать в качестве гипогликемического средства, гиполипидемического средства, средства, повышающего инсулинорезистентность, терапевтического средства для лечения диабета, терапевтического средства против осложнения при диабете, средства, повышающего толерантность к глюкозе, средства против атеросклероза, средства против ожирения, противовоспалительного средства, средства для профилактики или лечения PPAR-опосредованного заболевания и средства для профилактики или лечения синдрома X. Гетероциклическое соединение [I] и фармацевтически приемлемая соль настоящего изобретения в особенности полезны для профилактики или лечения диабета, диабетических осложнений, гиперлипидемии, атеросклероза, гипергликемии, заболеваний, вызванных инсулинорезистентной, ослабленной толерантностью к глюкозе, заболеваний, вызванных инсулинорезистентностью, ожирения, воспаления, PPAR-опосредованного заболевания и синдрома X.
ПРИМЕРЫ
Настоящее изобретение объясняют в деталях ссылкой на следующие примеры. Настоящее изобретение никоим образом не ограничивается приведенными примерами.
Пример 1
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
(1) Этил-2-трет-бутоксикарбонил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,50 г) и 2-(5-метил-2-фенилоксазол-4-ил)этилметансульфонат (2,50 г) растворяют в N,N-диметилформамиде (20 мл). К раствору добавляют карбонат калия (2,0 г) и смесь перемешивают при 80°С в течение 5 час. К реакционной смеси добавляют этилацетат (100 мл) и смесь промывают водой (100 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-трет-бутоксикарбонил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,62 г). Этил-2-трет-бутоксикарбонил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 2978, 2930, 1738, 1699, 1614, 1587.
1H-ЯМР (СDСl3) δ (м.д.);
1,29 (3Н, т, J=7,0 Гц), 1,46, 1,50 (9Н, с, с), 2,36 (3Н, с), 2,95 (2Н, т, J=6,8 Гц), 2,90-3,30 (2Н, м), 4,00-4,40 (4Н, м), 4,51, 4,61 (2Н, с, с), 4,70-4,90, 5,00-5,20 (1Н, м, м), 6,60-6,90 (2Н, м), 7,12 (1Н, д, J=8,4 Гц), 7,30-7,55 (3Н, м), 7,90-8,15 (2Н, м).
(2) Соединение (5,2 г), полученное на указанной выше стадии (1), растворяют в муравьиной кислоте (20 мл). К раствору добавляют 8,78 н. раствор хлористого водорода (6,0 мл) в 2-пропаноле при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют этилацетат (100 мл) и смесь нейтрализуют насыщенным водным раствором гидрокарбоната натрия и разделяют на два слоя. Полученный слой этилацетата промывают насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении, получая при этом этил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (3,6 г). Этил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тет-рагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 3476, 1742, 1639, 1611, 1553.
1H-ЯМР (СDСl3) δ (м.д.);
1,29 (3Н, т, J=7,0 Гц), 2,02 (1Н, с), 2,36 (3Н, с), 2,80-3,10 (4Н, м), 3,50-3,80 (1H, м), 4,00-4,40 (6Н, м), 6,50-6,80 (2Н, м), 7,00 (1H, д, J=8,4 Гц), 7,30-7,50 (3Н, м), 7,90-8,10 (2Н, м).
(3) Соединение (1,11 г), полученное на указанной выше стадии (2), растворяют в метаноле (20 мл). К раствору добавляют 1 н. водный раствор гидроксида натрия (3,0 мл) и смесь перемешивают при комнатной температуре в течение 2 час. Растворитель выпаривают при пониженном давлении. К полученному кристаллическому остатку добавляют воду (5 мл) и кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,92 г).
ИК ν (нуйол) см-1; 3427, 1589, 1504.
1H-ЯMP (DMSO-d6) δ (м.д.);
2,35 (3Н, с), 2,60-3,10 (6Н, м), 3,86 (2Н, ушир.с), 4,14 (2Н, т, J=6,6 Гц), 6,50-6,80 (2Н, м), 6,94 (1Н, д, J=8,1 Гц), 7,40-7,60 (3Н, м), 7,75-8,05 (2Н, м).
Пример 2
2-Бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,40 г), полученное в примере 1(2), растворяют в N,N-диметилформамиде (20 мл). К раствору добавляют гидрид натрия (160 мг, 60% дисперсия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 мин. К полученной смеси по каплям добавляют бензилбромид (0,40 мл) и смесь далее перемешивают при такой же температуре в течение 1 час. К реакционной смеси добавляют этилацетат (50 мл) и смесь промывают водой (50 мл) и насыщенным раствором соли (30 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,38 г).
Этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1728, 1639, 1614, 1551.
1H-ЯМР (СDСl3) δ (м.д.);
1,21 (3Н, т, J=7,0 Гц), 2,34 (3Н, с), 2,92 (2Н, т, J=7,0 Гц), 3,05-3,20 (2Н, м), 3,60-4,00 (5Н, м), 4,12 (2Н, кв., J=7,0 Гц), 4,16 (2Н, т, J=7,0 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,4 Гц), 6,99 (1Н, д, J=8,4 Гц), 7,30-7,50 (8Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (8,20 г), полученное на вышеуказанной стадии (1), растворяют в 80 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (42 мл) и смесь перемешивают при 50°С в течение 2 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием. Полученные сырые кристаллы (9,0 г) перекристаллизовывают из метанола, получая при этом указанное в заголовке соединение (6,33 г).
ИК ν (нуйол) см-1; 1638, 1501.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,33 (3Н, с), 2,65-3,30 (4Н, м), 3,50-4,00 (5Н, м), 4,00-6,20 (1Н, ушир.), 4,13 (2Н, т, J=7,0 Гц), 6,59 (1Н, ушир.с), 6,68 (1Н, ушир.д, J=8,4 Гц), 7,01 (1Н, д, J=8,4 Гц), 7,32 (5Н, с), 7,35-7,70 (3Н, м), 7,85-8,10 (2Н, м).
Пример 3
2-Ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (800 мг), полученное в примере 1(2), растворяют в метиленхлориде (8,0 мл). К раствору добавляют уксусный ангидрид (0,23 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 10 мин. К реакционной смеси добавляют этилацетат (30 мл) и смесь нейтрализуют насыщенным водным раствором гидрокарбоната натрия и затем два слоя разделяют. Полученный органический слой промывают насыщенным раствором соли (10 мл) и сушат над Na2SO4. Растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (873 мг).
Этил-2-ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1732, 1651, 1555.
1H-ЯМР (CDCl3) δ (м.д.);
1,12 (3Н, т, J=7,0 Гц), 2,13, 2,21 (3Н, с, с), 2,36 (3Н, с), 2,95 (2Н, т, J=6,6 Гц), 3,05-3,30 (2Н, м), 4,04 (2Н, кв., J=7,0 Гц), 4,22 (2Н, т, J=6,6 Гц), 4,62 (2Н, с), 5,45 (1Н, дд, J=4,0, 5,7 Гц), 6,55-6,85 (2Н, м), 7,04 (1Н, д, J=8,2 Гц), 7,30-7,50 (3Н, м), 7,85-8,10 (2Н, м).
(2) Соединение (800 мг), полученное на вышеуказанной стадии (1), растворяют в 5,0 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (3,0 мл) и смесь перемешивают при комнатной температуре в течение 30 мин. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (668 мг).
ИК ν (нуйол) см-1; 3400, 1732, 1641, 1612, 1555.
1H-ЯМР (СDСl3) δ (м.д.);
2,10, 2,17 (3Н, с, с), 2,32 (3Н, с), 2,70-3,30 (4Н, м), 3,90-4,20 (2Н, м), 4,30-4,90 (2Н, м), 5,35-5,60 (1Н, м), 6,50-6,80 (2Н, м), 7,03 (1Н, д, J=8,1 Гц), 7,30-7,60 (3Н, м), 7,80-8,10 (2Н, м).
Пример 4
2-Метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,0 г), полученное в примере 1 (2), растворяют в метаноле (10 мл). К раствору добавляют формалин (0,4 мл) и цианоборогидрид натрия (310 мг) и смесь перемешивают при комнатной температуре в течение 1 час. Метанол выпаривают при пониженном давлении. К полученному остатку добавляют этилацетат (20 мл) и смесь промывают водой (20 мл) и насыщенным раствором соли (10 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,08 г).
Этил-2-метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1;, 2926, 2874, 1732, 1641, 1614.
1H-ЯМР (СDСl3) δ (м.д.);
1,25 (3Н, т, J=7,0 Гц), 2,35 (3Н, с), 2,50 (3Н, с), 2,94 (2Н, т, J=6,8 Гц), 3,02 (2Н, д, J=6,0 Гц), 3,45 (1Н, т, J=6,0 Гц), 3,64 (1Н, д, J=15,6 Гц), 3,98 (1Н, д, J=15,6 Гц), 4,17 (2Н, кв., J=7,0 Гц), 4,20 (2Н, т, J=6,6 Гц), 6,56 (1Н, д, J=2,0 Гц), 6,70 (1H, дд, J=2,0, 8,4 Гц), 6,98 (1H, д, J=8,4 Гц), 7,30-7,50 (3Н, м), 7,85-8,10 (2Н, м).
(2) Соединение (1,08 г), полученное на вышеуказанной стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (7,5 мл) и раствор перемешивают при комнатной температуре в течение 1 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,74 г).
ИК ν (нуйол) см-1; 1616, 1555, 1541, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,36 (3Н, с), 2,55 (3Н, с), 2,70-3,10 (4Н, м), 3,40-3,60 (1H, м), 3,70-4,30 (4Н, м), 6,60-6,80 (2Н, м), 7,05 (1Н, д, J=8,6 Гц), 7,35-7,65 (3Н, м), 7,75-8,10 (2Н, м).
Пример 5
2-Гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,0 г), полученное в примере 1(2), растворяют в метиленхлориде (10 мл). К раствору добавляют гексаноилхлорид (0,41 мл) и триэтиламин (0,51 г) при охлаждении льдом и смесь перемешивают при такой же температуре в течение 10 мин. К реакционной смеси добавляют этилацетат (70 мл) и смесь промывают 10% водным раствором лимонной кислоты (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл) и затем насыщенным раствором соли (50 мл) и сушат над Na2SO4. Растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,02 г).
Этил-2-гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1736, 1653, 1587.
1H-ЯМР (CDCl3) δ (м.д.);
0,70-1,90 (12Н, м), 2,20-2,60 (2Н, м), 2,36 (3Н, s), 2,95 (2Н, т, J=6,8 Гц), 3,10-3,20 (2Н, м), 4,04 (2Н, кв., J=7,0 Гц), 4,22 (2Н, т, J=7,0 Гц), 4,63 (2Н, с), 5,45 (1Н, дд, J=4,0, 5,4 Гц), 6,60-6,90 (2Н, м), 7,04 (1Н, д, J=8,1 Гц), 7,30-7,50 (3Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (1,02 г), полученное на указанной выше стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (6,0 мл) и смесь перемешивают при комнатной температуре в течение 4 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,56 г).
ИК ν (нуйол) см-1; 1742, 1641, 1612, 1572.
1H-ЯМР (CDCl3) δ (м.д.);
0,88 (3Н, ушир.т, J=6,0 Гц), 1,10-1,90 (6Н, м), 2,32 (3Н, с), 2,30-2,50 (2Н, м), 2,70-3,30 (4Н, м), 4,07 (2Н, т, J=7,0 Гц), 4,60 (2Н, с), 5,40-5,60 (1Н, м), 6,60-6,80 (2Н, м), 7,05 (1Н, д, J=8,6 Гц), 7,35-7,65 (3Н, м), 7,75-8,10 (2Н, м).
Пример 6
2-Гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,20 г), полученное в примере 1(2), растворяют в N,N-диметилформамиде (12 мл). К раствору добавляют гексилиодид (0,65 мл) и карбонат калия (0,82 г) и смесь перемешивают при 50°С в течение 15 час. К реакционной смеси добавляют воду (100 мл) и смесь экстрагируют дважды этилацетатом (50 мл). Слой этилацетата промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,05 г). Этил-2-гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1724, 1643, 1611.
1H-ЯМР (CDCl3) δ (м.д.);
0,88 (3Н, ушир.т, J=5,0 Гц), 1,10-1,75 (11Н, м), 2,35 (3Н, с), 2,50-2,80 (2Н, м), 2,94 (2Н, т, J=7,0 Гц), 3,02 (2Н, д, J=5,5 Гц), 3,68 (1Н, т, J=5,5 Гц), 3,83 (1Н, с), 3,94 (1Н, с), 4,12 (2Н, кв., J=7,0 Гц), 4,20 (2Н, т, J=7,0 Гц), 6,50-6,80 (2Н, м), 6,97 (1Н, д, J=8,4 Гц), 7,30-7,60 (3Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (1,0 г), полученное на указанной выше стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (5,1 мл) и смесь перемешивают при комнатной температуре в течение 11 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,80 г).
ИК ν (нуйол) см-1; 1620, 1555, 1506.
1H-ЯМР (CDCl3) δ (м.д.);
0,89 (3Н, ушир.т, J=6,0 Гц), 1,00-1,45 (6Н, м), 1,50-1,90 (2Н, м), 2,36 (3Н, с), 2,70-3,30 (2Н, м), 2,93 (2Н, т, J=6,2 Гц), 3,15 (2Н, д, J=6,4 Гц), 3,75 (1Н, т, J=6,4 Гц), 4,00-4,40 (4Н, м), 6,23 (1Н, ушир.с), 6,60-6,85 (2Н, м), 7,06 (1Н, д, J=8,4 Гц), 7,30-7,60 (3Н, м), 7,80-8,10 (2Н, м).
Пример 7
2-Изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,40 г), полученное в примере 1(2), растворяют в N,N-диметилформамиде (14 мл). К раствору добавляют изобутилиодид (1,20 мл) и карбонат калия (0,95 г) и смесь перемешивают при 50°С в течение 3 дней. К реакционной смеси добавляют воду (100 мл) и смесь экстрагируют дважды этилацетатом (50 мл). Полученный слой этилацетата промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,15 г).
Этил-2-изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1719, 1645, 1614, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
0,89 (6Н, д, J=6,6 Гц), 1,19 (3Н, т, J=7,0 Гц), 1,70-1,90 (1Н, м), 2,35 (3Н, с), 2,10-2,50 (2Н, м), 2,94 (2Н, т, J=7,0 Гц), 3,02 (2Н, д, J=5,2 Гц), 3,66 (1Н, т, J=5,2 Гц), 3,83 (1H, с), 3,92 (1Н, с), 4,16 (2Н, кв., J=7,0 Гц), 4,20 (2Н, т, J=7,0 Гц), 6,45-6,75 (2Н, м), 6,97 (1H, д, J=8,2 Гц), 7,25-7,50 (3Н, м), 7,85-8,10 (2Н, м).
(2) Соединение (1,05 г), полученное на указанной выше стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (5,7 мл) и смесь перемешивают при комнатной температуре в течение 24 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,83 г).
ИК ν (нуйол) см-1; 3339, 1620, 1553, 1508.
1H-ЯМР (СDСl3) δ (м.д.);
0,95 (3Н, д, J=6,7 Гц), 1,01 (3Н, д, J=7,0 Гц), 1,95-2,15 (1H, м), 2,36 (3Н, с), 2,60-2,80 (2Н, м), 2,94 (2Н, т, J=6,7 Гц), 3,16 (2Н, д, J=6,6 Гц), 3,70 (1H, т, J=6,6 Гц), 4,11 (2Н, с), 4,18 (2Н, т, J=6,6 Гц), 4,84 (1H, ушир.с), 6,60-6,90 (2Н, м), 7,49 (1H, д, J=8,1 Гц), 7,25-7,50 (3Н, м), 7,85-8,10 (2Н, м).
Пример 8
2-Циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,40 г), полученное в примере 1(2), растворяют в N,N-диметилформамиде (14 мл). К раствору добавляют циклогексилметилбромид (1,44 мл) и карбонат калия (0,95 г) и смесь перемешивают при 50°С в течение 2 дней. К реакционной смеси добавляют воду (100 мл) и смесь экстрагируют дважды этилацетатом (50 мл). Слой этилацетата промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,1, 3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,0 г).
Этил-2-циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1728, 1638, 1614, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
0,80-2,00 (11H, м), 1,19 (3Н, т, J=7,0 Гц), 2,36 (3Н, с), 2,40-2,55 (2Н, м), 2,94 (2Н, т, J=7,1 Гц), 3,00 (2Н, д, J=5,3 Гц), 3,65 (1Н, т, J=5,3 Гц), 3,82 (1Н, с), 3,92 (1Н, с), 4,05 (2Н, т, J=7,0 Гц), 4,16 (2Н, кв., J=7,0 Гц), 6,50-6,80 (2Н, м), 6,97 (1Н, д, J=8,1 Гц), 7,30-7,50 (3Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (0,95 г), полученное на указанной выше стадии (1), растворяют в 28 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (7,13 мл) и смесь перемешивают при комнатной температуре в течение 3 дней. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,76 г).
ИК ν (нуйол) см-1; 3319, 1624, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
0,70-2,10 (11Н, м), 2,36 (3Н, с), 2,40-2,55 (2Н, м), 2,93 (2Н, т, J=6,4 Гц), 3,16 (2Н, д, J=7,2 Гц), 3,70 (1Н, т, J=7,2 Гц), 4,00-4,30 (4Н, м), 5,30 (1Н, ушир.с), 6,60-6,90 (2Н, м), 7,08 (1Н, д, J=8,4 Гц), 7,30-7,50 (3Н, м), 7,80-8,10 (2Н, м).
Пример 9
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,40 г), полученное в примере 1(2), растворяют в N,N-диметилформамиде (14 мл). К раствору добавляют 3-фенилпропилбромид (0,78 мл) и карбонат калия (0,95 г) и смесь перемешивают при 50°С в течение 22 час. К реакционной смеси добавляют воду (100 мл) и смесь экстрагируют дважды этилацетатом (50 мл). Слой этилацетата промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,05 г).
Этил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1720, 1647, 1612, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
1,17 (3Н, т, J=7,0 Гц), 1,60-2,05 (2Н, м), 2,35 (3Н, с), 2,50-2,80 (4Н, м), 2,94 (2Н, т, J=7,1 Гц), 3,04 (2Н, д, J=5,7 Гц), 3,67 (1Н, т, J=5,7 Гц), 3,84 (1Н, с), 3,94 (1Н, с), 4,04 (2Н, т, J=7,1 Гц), 4,16 (2Н, кв., J=7,0 Гц), 6,50-6,80 (2Н, м), 7,07 (1Н, д, J=9,0 Гц), 7,20 (5Н, с), 7,10-7,50 (3Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (1,0 г), полученное на указанной выше стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (4,77 мл) и смесь перемешивают при комнатной температуре в течение 10 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,66 г).
ИК ν (нуйол) см-1; 3346, 1616, 1556, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
1,70-2,20 (3Н, м), 2,35 (3Н, с), 2,40-2,70 (4Н, м), 2,70-3,30 (2Н, м), 2,92 (2Н, т, J=6,3 Гц), 3,10 (2Н, д, J=7,0 Гц), 3,65 (1Н, т, J=7,0 Гц), 3,90-4,30 (4Н, м), 5,12 (1Н, ушир.с), 6,55-6,80 (2Н, м), 6,90-7,25 (6Н, м), 7,25-7,55 (3Н, м), 7,80-8,10 (2Н, м).
Пример 10
2-Бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,4 г), полученное в примере 1(2), растворяют в метиленхлориде (14 мл). К раствору добавляют бензоилхлорид (0,48 мл) и триэтиламин (0,72 мл) при охлаждении льдом и смесь перемешивают при такой же температуре в течение 15 мин. К реакционной смеси добавляют этилацетат (100 мл) и смесь промывают последовательно 10% водным раствором лимонной кислоты (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл) и затем насыщенным раствором соли (50 мл) и сушат над Na2SO4. Растворитель выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,16 г).
Этил-2-бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1734, 1638, 1612, 1591.
1H-ЯМР (СDСl3) δ (м.д.);
0,75-1,15 (3Н, м), 2,35 (3Н, с), 2,93 (2Н, т, J=6,6 Гц), 3,05-3,25 (2Н, м), 3,85-4,40 (4Н, м), 4,20-4,80 (2Н, м), 5,00-5,60 (1Н, м), 6,47 (1Н, ушир.с), 6,72 (1Н, ушир.д, J=8,4 Гц), 7,05 (1Н, ушир.д, J=8,4 Гц), 7,30-7,60 (8Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (1,0 г), полученное на указанной выше стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (6,0 мл) и смесь перемешивают при комнатной температуре в течение 1,5 час. Растворитель выпаривают при пониженном давлении. К остатку добавляют воду (20 мл) и смесь промывают этилацетатом (10 мл). Полученный водный слой подкисляют 6 н. хлористоводородной кислотой и смесь экстрагируют дважды диэтиловым простым эфиром (20 мл). Слой диэтилового эфира промывают насыщенным раствором соли (30 мл) и сушат над Na2SO4. Диэтиловый эфир выпаривают при пониженном давлении. Полученный остаток перекристаллизовывают из метанола, получая при этом указанное в заголовке соединение (0,75 г).
ИК ν (нуйол) см-1; 1730, 1636, 1551.
1H-ЯМР (СDСl3) δ (м.д.);
2,32 (3Н, с), 2,87 (2Н, т, J=6,4 Гц), 3,00-3,35 (2Н, м), 4,02 (2Н, т, J=6,4 Гц), 4,40-4,90 (2Н, м), 4,90-5,30 (1Н, ушир.), 5,00-5,65 (1Н, м), 6,40 (1Н, ушир.с), 6,50-6,80 (1Н, м), 7,03 (1Н, д, J=8,4 Гц), 7,20-7,60 (8Н, м), 7,75-8,05 (2Н, м).
Пример 11
2-Бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
(1) Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,38 г) растворяют в N,N-диметилформамиде (10 мл). К раствору добавляют гидрид натрия (210 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. К смеси добавляют 2-(N-трет-бутоксикарбонил-N-метиламино)этилметансульфонат (1,30 г) и смесь дополнительно перемешивают при такой же температуре в течение 1 час. К реакционной смеси добавляют этилацетат (50 мл) и смесь промывают водой (50 мл) и насыщенным раствором соли (30 мл) и сушат над Nа2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(N-трет-бутоксикарбонил-N-метиламино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,44 г).
Этил-2-бензил-7-[2-(N-трет-бутоксикарбонил-N-метиламино)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 2978, 2932, 1732, 1695, 1614.
1H-ЯМР (СDСl3) δ (м.д.);
1,23 (3Н, т, J=7,0 Гц), 1,44 (9Н, с), 2,95 (3Н, с), 3,08 (2Н, д, J=4,9 Гц), 3,54 (2Н, т, J=5,5 Гц), 3,60-4,30 (7Н, м), 6,50 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,1 Гц), 7,01 (1Н, д, J=8,1 Гц), 7,20-7,50 (5Н, м).
(2) Соединение (1,44 г), полученное на указанной выше стадии (1), растворяют в муравьиной кислоте (7,0 мл). К раствору добавляют 8,78 н. раствор хлористого водорода (2,0 мл) в 2-пропаноле и смесь перемешивают при комнатной температуре в течение 15 мин. К реакционной смеси добавляют этилацетат (100 мл) и смесь нейтрализуют насыщенным водным раствором гидрокарбоната натрия и затем два слоя разделяют. Полученный слой этилацетата промывают насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении, получая при этом этил-2-бензил-7-(2-метиламиноэтокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,08 г).
Этил-2-бензил-7-(2-метиламиноэтокси)-1,2,3,4-тетрагидроизохинолин- (3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 3332, 1732, 1612, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
1,22 (3Н, т, J=7,0 Гц), 2,41 (1Н, ушир.с), 2,49 (3Н, с), 2,95 (2Н, т, J=5,5 Гц), 3,08 (2Н, д, J=4,9 Гц), 3,60-4,25 (7Н, м), 6,52 (1Н, д, J=2,0 Гц), 6,70 (1Н, дд, J=2,0, 8,4 Гц), 7,00 (1Н, д, J=8,4 Гц), 7,20-7,50 (5Н, м).
(3) Соединение (1,05 г), полученное на указанной выше стадии (2), растворяют в 2-хлорпиридине (2,0 мл) и смесь перемешивают при 140°С в течение 16 час. Реакционную смесь очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,5 г). Этил-2-бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 2932, 2905, 1732, 1597, 1560, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
1,22 (3Н, т, J=7,0 Гц), 3,06 (2Н, д, J=6,2 Гц), 3,11 (3Н, с), 3,60-4,30 (11Н, м), 6,40-6,80 (4Н, м), 6,97 (1Н, д, J=8,4 Гц), 7,20-7,50 (6Н, м), 8,00-8,20 (1Н, м).
(4) Соединение (488 мг), полученное на указанной выше стадии (3), растворяют в 5,0 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида натрия (2,2 мл) и смесь перемешивают при комнатной температуре в течение 6 час. Растворитель выпаривают при пониженном давлении. Добавляют воду (10 мл) и затем солевой раствор до перенасыщения и смесь экстрагируют три раза этилацетатом (30 мл). Слой этилацетата промывают насыщенным раствором соли (10 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. К полученному остатку добавляют диэтиловый простой эфир. Твердое вещество собирают фильтрованием, получая при этом указанное в заголовке соединение (356 мг).
ИК ν (нуйол) см-1; 1597, 1497.
1H-ЯМР (MeOH-d4) δ (м.д.);
2,95-3,20 (2Н, м), 3,07 (3Н, с), 3,40-4,20 (9Н, м), 6,40-6,70 (4Н, м), 6,92 (1Н, д, J=8,4 Гц), 7,20-7,50 (3Н, м), 7,90-8,15 (1Н, м).
Пример 12
2-Бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
(1) Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,0 г) растворяют в N,N-диметилформамиде (10 мл). К раствору добавляют гидрид натрия (200 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин, получая при этом раствор (А). Отдельно 5-этил-2-пиридинэтанол (1,5 г) и триэтиламин (1,68 мл) растворяют в метиленхлориде (40 мл). К раствору добавляют трифторметансульфоновый ангидрид (2,0 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь промывают водой (30 мл) и сушат над Na2SO4. Метиленхлорид выпаривают при пониженном давлении. Полученный 5-этил-2-пиридинэтилтрифторметансульфонат (2,81 г) добавляют к вышеуказанному раствору (А) и смесь перемешивают при комнатной температуре в течение 30 мин. К реакционной смеси добавляют этилацетат (100 мл) и смесь промывают водой (50 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,58 г).
Этил-2-бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1732, 1612, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
1,22 (6Н, т, J=7,2 Гц), 2,61 (2Н, кв., J=7,2 Гц), 3,07 (2Н, д, J=5,5 Гц), 3,18 (2Н, т, J=6,6 Гц), 3,72 (1Н, т, J=5,5 Гц), 3,81 (1Н, с), 3,90 (4Н, с), 4,13 (2Н, кв., J=7,2 Гц), 4,27 (2Н, т, J=6,6 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,69 (1Н, дд, J=2,0, 8,4 Гц), 6,98 (1Н, д, J=8,4 Гц), 7,10-7,50 (7Н, м), 8,00-8,20 (1Н, м).
(2) Соединение (0,94 г), полученное в вышеуказанном пункте (1), растворяют в 40 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 2 н водный раствор гидроксида натрия (6,0 мл) и смесь перемешивают при 40°С в течение 2 час. Растворитель выпаривают при пониженном давлении. Добавляют воду (10 мл) и затем хлорид натрия до перенасыщения и смесь экстрагируют три раза этилацетатом (30 мл). Слой этилацетата промывают насыщенным раствором соли (10 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. К полученному остатку добавляют диизопропиловый простой эфир. Твердое вещество собирают фильтрованием, получая при этом указанное в заголовке соединение (0,58 г).
ИК ν (нуйол) см-1; 1576, 1504.
1H-ЯМР (MeOH-d4) δ (м.д.);
1,22 (6Н, т, J=7,5 Гц), 2,63 (2Н, кв., J=7,5 Гц), 2,90-3,20 (4Н, м), 3,72 (1Н, с), 3,85 (1Н, с), 3,95-4,35 (5Н, м), 4,27 (2Н, т, J=6,6 Гц), 6,40-6,75 (2Н, м), 6,91 (1Н, д, J=8,4 Гц), 7,20-7,65 (7Н, м), 8,20-8,35 (1Н, м).
Пример 13
2-Бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,0 г) растворяют в N,N-диметилформамиде (10 мл). К раствору добавляют гидрид натрия (154 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют 1-(2-бромэтил)индолин (1,09 г) и смесь далее перемешивают при комнатной температуре в течение 2 час. К реакционной смеси добавляют этилацетат (100 мл) и смесь промывают водой (100 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,18 г).
Этил-2-бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 2926, 2843, 1732, 1609, 1493.
1H-ЯМР (СDСl3) δ (м.д.);
1,22 (3Н, т, J=7,2 Гц), 2,95 (2Н, т, J=8,3 Гц), 3,08 (2Н, д, J=5,3 Гц), 3,20-3,60 (3Н, м), 3,60-4,30 (10Н, м), 6,40-6,80 (4Н, м), 6,80-7,20 (3Н, м), 7,20-7,50 (5Н, м).
(2) Соединение (1,17 г), полученное на вышеуказанной стадии (1), растворяют в 24 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (7,69 мл) и смесь перемешивают при 50°С в течение 1 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,93 г).
ИК ν (нуйол) см-1; 1634, 1609, 1491.
1H-ЯМР (СDСl3) δ (м.д.);
2,95 (2Н, ушир.т, J=8,2 Гц), 3,16 (2Н, ушир.д, J=6,1 Гц), 3,25-3,60 (3Н, м), 3,60-4,40 (8Н, м), 4,07 (2Н, с), 4,10 (2Н, т, J=5,5 Гц), 4,13 (2Н, кв., J=7,2 Гц), 5,60-6,30 (1Н, ушир.), 6,30-6,85 (4Н, м), 6,85-7,20 (3Н, м), 7,32 (5Н, с).
Пример 14
Этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (10,0 г) и 2-(5-метил-2-фенилоксазол-4-ил)этилметансульфонат (18,01 г) растворяют в N,N-диметилформамиде (200 мл). К раствору добавляют карбонат калия (13,3 г) и смесь перемешивают при 80°С в течение 10 час. К реакционной смеси добавляют воду (1 л) и смесь экстрагируют дважды этилацетатом (200 мл). Слой этилацетата промывают насыщенным раствором соли (500 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом указанное в заголовке соединение (7,06 г).
ИК- и ЯМР-спектры соответствуют спектрам, полученным в примере 2(1).
Пример 15
Метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
(1) Метил-2-трет-бутоксикарбонил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (15,16 г) и 2-(5-метил-2-фенилоксазол-4-ил)этилметансульфонат (20,0 г) растворяют в N,N-диметилформамиде (300 мл). К раствору добавляют карбонат калия (19,7 г) и смесь перемешивают при 80°С в течение 3,5 час. К реакционной смеси добавляют воду (1 л) и смесь экстрагируют дважды этилацетатом (300 мл). Слой этилацетата промывают насыщенным раствором соли (500 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом метил-2-трет-бутоксикарбонил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (14,0 г). Метил-2-трет-бутоксикарбонил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
1H-ЯМР (СDСl3) δ (м.д.);
1,46, 1,50 (9Н, с, с), 2,36 (3Н, с), 2,95 (2Н, т, J=6,8 Гц), 2,90-3,30 (2Н, м), 3,60 (3Н, с), 4,21 (2Н, т, J=6,8 Гц), 4,50, 4,60 (2Н, с, с), 4,70-4,90, 5,00-5,20 (1Н, м, м), 6,60-6,90 (2Н, м), 7,12 (1Н, д, J=8,4 Гц), 7,30-7,55 (3Н, м), 7,90-8,15 (2Н, м).
(2) Соединение (14,0 г), полученное на указанной выше стадии (1), растворяют в муравьиной кислоте (42 мл). К раствору добавляют 8,78 н. раствор хлористого водорода (10,7 мл) в 2-пропаноле при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 мин. К реакционной смеси добавляют этилацетат (300 мл) и воду (500 мл) и смесь нейтрализуют гидрокарбонатом натрия и два слоя разделяют.
Полученный слой этилацетата промывают насыщенным раствором соли (500 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом указанное в заголовке соединение (9,4 г).
ИК ν (нуйол) см-1; 3560, 1744, 1643, 1612, 1578, 1553, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
1,92 (1Н, с), 2,36 (3Н, с), 2,80-3,20 (4Н, м), 3,60-3,85 (1Н, м), 3,76 (3Н, с), 4,04 (2Н, с), 4,21 (2Н, т, J=6,6 Гц), 6,57 (1Н, д, J=2,0 Гц), 6,71 (1Н, дд, J=2,0, 8,6 Гц), 7,00 (1Н, д, J=8,6 Гц), 7,30-7,60 (3Н, м), 7,85-8,15 (2Н, м).
Пример 16
2-(4-Метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (800 мг) примера 15 растворяют в N,N-диметилформамиде (8 мл). К раствору добавляют гидрид натрия (96 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. К полученной смеси по каплям добавляют 4-метоксибензилхлорид (0,41 мл) и смесь далее перемешивают при 50°С в течение 3 час. К реакционной смеси добавляют этилацетат (50 мл) и смесь промывают водой (50 мл) и насыщенным раствором соли (30 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом метил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,82 г).
Метил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1736, 1638, 1614, 1553, 1514.
1H-ЯМР (СDСl3) δ (м.д.);
2,35 (3Н, с), 2,93 (2Н, т, J=6,6 Гц), 3,05 (2Н, д, J=5,5 Гц), 3,66 (3Н, с), 3,70-4,00 (8Н, м), 4,17 (2Н, т, J=6,6 Гц), 6,50 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,6 Гц), 6,85 (2Н, д, J=8,6 Гц), 6,98 (1Н, д, J=8,6 Гц), 7,28 (2Н, д, J=8,6 Гц), 7,30-7,50 (3Н, м), 7,80-8,10 (2Н, м).
(2) Соединение (450 мг), полученное на вышеуказанной стадии (1), растворяют в 10 мл смешанного растворителя тетрагидрофуран-метанол (3:1). К раствору добавляют 2 н. водный раствор гидроксида лития (2,5 мл) и смесь перемешивают при комнатной температуре в течение 3 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (350 мг).
ИК ν (нуйол) см-1; 3288, 1612, 1555, 1514.
1H-ЯМР (СDСl3) δ (м.д.);
2,35 (3Н, с), 2,93 (2Н, т, J=6,4 Гц), 3,18 (2Н, д, J=6,8 Гц), 3,70-4,10 (5Н, м), 3,77 (3Н, с), 4,17 (2Н, т, J=6,4 Гц), 4,50 (1Н, ушир.с), 6,60 (1Н, д, J=2,0 Гц), 6,65-6,95 (3Н, м), 7,08 (2Н, д, J=8,4 Гц), 7,20-7,60 (5Н, м), 7,80-8,10 (2Н, м).
Пример 17
Этил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Таким же способом, как в примере 16(1), получают указанное в заголовке соединение.
1H-ЯМР (СDСl3) δ (м.д.);
1,21 (3Н, т, J=7,0 Гц), 2,34 (3Н, с), 2,91 (2Н, т, J=7,0 Гц), 3,04 (2Н, д, J=5,5 Гц), 3,60-3,95 (8Н, м), 4,12 (2Н, кв., J=7,0 Гц), 4,15 (2Н, т, J=7,0 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,67 (1Н, дд, J=2,0, 8,8 Гц), 6,75-7,00 (3Н, м), 7,15-7,50 (5Н, м), 7,85-8,10 (2Н, м).
Пример 18
2-(4-Метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (800 мг) примера 15 растворяют в N,N-диметилформамиде (8,0 мл). К раствору добавляют гидрид натрия (96 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. К полученной смеси по каплям добавляют α-хлор-п-ксилол (0,40 мл) и смесь далее перемешивают при 50°С в течение 3 час и далее перемешивают при комнатной температуре в течение 15 час. К реакционной смеси добавляют этилацетат (50 мл) и смесь промывают водой (50 мл) и насыщенным раствором соли (30 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом метил-2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,90 г).
Метил-2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1736, 1639, 1614, 1595, 1551.
1H-ЯМР (СDСl3) δ (м.д.);
2,34 (6Н, с), 2,93 (2Н, т, J=6,7 Гц), 3,06 (2Н, д, J=5,0 Гц), 3,50-4,00 (5Н, м), 3,65 (3Н, с), 4,17 (2Н, т, J=6,7 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,6 Гц), 6,98 (2Н, д, J=8,6 Гц), 7,11 (2Н, д, J=8,4 Гц), 7,26 (2Н, д, J=8,4 Гц), 7,30-7,55 (3Н, м), 7,80-8,15 (2Н, м).
(2) Соединение (608 мг), полученное на вышеуказанной стадии (1), растворяют в 17 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (6,1 мл) и смесь перемешивают при комнатной температуре в течение 3 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (400 мг).
ИК ν (нуйол) см-1; 1620, 1555, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
2,32 (3Н, с), 2,35 (3Н, с), 2,93 (2Н, т, J=7,0 Гц), 3,17 (2Н, д, J=6,6 Гц), 3,65-4,05 (5Н, м), 4,17 (2Н, т, J=7,0 Гц), 4,73 (1Н, ушир.с), 6,60 (1Н, д, J=2,0 Гц), 6,77 (1Н, дд, J=2,0, 8,8 Гц), 6,95-7,60 (8Н, м), 7,85-8,10 (2Н, м).
Пример 19
Этил-2-(4-метилбензил)-1-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Таким же способом, как в примере 18(1), получают указанное в заголовке соединение.
1H-ЯМР (СDСl3) δ (м.д.);
1,21 (3Н, т, J=7,0 Гц), 2,34 (3Н, с), 2,92 (2Н, т, J=7,0 Гц), 3,05 (2Н, д, J=5,4 Гц), 3,71 (1Н, т, J=5,4 Гц), 3,80 (1Н, с), 3,92 (1Н, с), 4,12 (2Н, кв., J=7,0 Гц), 4,16 (2Н, т, J=7,0 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,4 Гц), 6,98 (1Н, д, J=8,4 Гц), 7,00-7,60 (7Н, м), 7,80-8,10 (2Н, м).
Пример 20
2-Бензил-7-[2-(6-карбоксииндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,0 г) растворяют в N,N-диметилформамиде (10 мл). К раствору добавляют гидрид натрия (154 мг, 60% суспензия в масле) при охлаждении льдом и смесь перемешивают при такой же температуре в течение 30 мин. К полученной смеси добавляют 1-(2-бромэтил)-6-метоксикарбонилиндолин (1,36 г) и смесь далее перемешивают при комнатной температуре в течение 4 час. К реакционной смеси добавляют этилацетат (100 мл) и смесь промывают водой (100 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом этил-2-бензил-7-[2-(6-метоксикарбонилиндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,18 г). Этил-2-бензил-7-[2-(6-метоксикарбонилиндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (неразбавленный) см-1; 2949, 2841, 1717, 1611, 1587, 1497.
1H-ЯМР (СDСl3) δ (м.д.);
1,23 (3Н, т, J=7,2 Гц), 2,99 (2Н, т, J=8,8 Гц), 3,00-3,25 (2Н, м), 3,35-4,35 (13Н, м), 3,87 (3Н, с), 6,52 (1Н, д, J=2,4 Гц), 6,70 (1Н, дд, J=2,4, 8,3 Гц), 6,90-7,20 (3Н, м), 7,20-7,55 (6Н, м).
(2) Соединение (1,31 г), полученное на вышеуказанной стадии (1), растворяют в 33 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (15,3 мл) и смесь перемешивают при 50°С в течение 2 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (1,0 г).
ИК ν (нуйол) см-1; 3400, 1693, 1612, 1497.
1H-ЯМР (MeOH-d4) δ (м.д.);
2,96 (2Н, ушир.т, J=8,0 Гц), 3,15-3,75 (3Н, м), 3,80-4,50 (10Н, м), 6,65-7,70 (11Н, м).
Пример 21
2-(4-Фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Соединение (1,00 г), полученное в примере 15, растворяют в N,N-диметилформамиде (20 мл). К раствору добавляют 4-фторбензилхлорид (0,46 мл), карбонат калия (0,53 г) и иодид калия (0,21 г) и смесь перемешивают при 50°С в течение 1,5 час. К реакционной смеси добавляют этилацетат (50 мл) и смесь промывают водой (100 мл) и насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом метил-2-(4-фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,92 г). Метил-2-(4-фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1738, 1639, 1616, 1551, 1510.
1H-ЯМР (СDСl3) δ (м.д.);
2,35 (3Н, с), 2,93 (2Н, т, J=6,8 Гц), 3,07 (2Н, д, J=5,0 Гц), 3,55-4,00 (5Н, м), 3,65 (3Н, с), 4,18 (2Н, т, J=6,8 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,70 (1Н, дд, J=2,0, 8,6 Гц), 6,80-7,15 (3Н, м), 7,15-7,50 (5Н, м), 7,80-8,15 (2Н, м).
(2) Соединение (900 мг) вышеуказанной стадии (1) растворяют в 18 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (8,9 мл) и смесь перемешивают при комнатной температуре в течение 3 час. Растворитель выпаривают при пониженном давлении и полученный остаток подкисляют лимонной кислотой. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,68 г).
ИК ν (нуйол) см-1; 3398, 1614, 1555, 1510.
1H-ЯМР (СDСl3) δ (м.д.);
2,36 (3Н, с), 2,94 (2Н, т, J=6,4 Гц), 3,15 (2Н, д, J=6,4 Гц), 3,45-4,00 (5Н, м), 4,19 (2Н, т, J=6,4 Гц), 6,60 (1Н, д, J=2,0 Гц), 6,75 (1Н, дд, J=2,0, 8,6 Гц), 6,90-7,55 (8Н, м), 7,90-8,10 (2Н, м).
Пример 22
2-(2,2-Диметилпропионил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
Метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (0,60 г) растворяют в метиленхлориде (6 мл). К раствору добавляют пивалоилхлорид (0,22 мл) и триэтиламин (0,32 мл) при охлаждении льдом и смесь перемешивают при такой же температуре в течение 15 мин. К реакционной смеси добавляют этилацетат (100 мл) и смесь последовательно промывают 10% водным раствором лимонной кислоты (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Растворитель выпаривают при пониженном давлении. Полученный остаток растворяют в 18 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (4,6 мл) и смесь перемешивают при 50°С в течение 30 мин. Растворитель выпаривают при пониженном давлении. К остатку добавляют воду (20 мл) и смесь подкисляют лимонной кислотой. Полученную смесь экстрагируют этилацетатом (50 мл). Слой этилацетата промывают насыщенным раствором соли (30 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении, получая при этом указанное в заголовке соединение (0,65 г).
ИК ν (нуйол) см-1; 1734, 1630, 1612, 1553.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,24 (9Н, с), 2,36 (3Н, с), 2,80-4,00 (1Н, ушир.), 2,92 (2Н, т, J=6,4 Гц), 2,95-3,15 (2Н, м), 4,18 (2Н, т, J=6,4 Гц), 4,41, 4,91 (2Н, АВкв., J=18,1 Гц), 4,90-5,15 (1Н, м), 6,77 (1Н, дд, J=2,0, 8,1 Гц), 6,89 (1Н, д, J=2,0 Гц), 7,09 (1H, д, J=8,1 Гц), 7,30-7,65 (3Н, м), 7,80-8,10 (2Н, м).
Пример 23
2-(2,2-Диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
Указанное в заголовке соединение (1,66 г) примера 22 растворяют в пиридине (16,6 мл). К раствору добавляют борогидрид натрия (1,36 г) и смесь перемешивают при 100°С в течение 4 час. Смесь подкисляют 10% водным раствором лимонной кислоты и экстрагируют этилацетатом (100 мл). Слой этилацетата промывают последовательно добавлением 10% водного раствора лимонной кислоты (100 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом указанное в заголовке соединение (0,84 г).
ИК ν (нуйол) см-1; 3391, 3279, 1668, 1645, 1616, 1597, 1497.
1H-ЯМР (СDСl3) δ (м.д.);
0,96 (9Н, с), 2,35 (3Н, с), 2,46, 2,73 (2Н, АВкв., J=13,9 Гц), 2,93 (2Н, т, J=6,7 Гц), 3,03-3,23 (2Н, м), 3,57-3,78 (1H, м), 3,91, 4,18 (1Н, АВкв., J=15,4 Гц), 4,17 (2Н, т, J=6,7 Гц), 5,60-6,05 (1Н, ушир.), 6,60 (1H, д, J=2,0 Гц), 6,73 (1H, дд, J=2,0, 8,4 Гц), 7,04 (1H, д, J=8,4 Гц), 7,30-7,55 (3Н, м), 7,80-8,10 (2Н, м).
Пример 24
2-(2,2-Диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
(1) Метил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Метил-2-(2,2-диметилпропил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,5 г) и 2-(5-метил-2-фенилоксазол-4-ил)этилметансульфонат (2,59 г) растворяют в толуоле (45 мл). К раствору добавляют карбонат калия (2,24 г) и фторид тетраэтиламмония (0,60 г) и смесь перемешивают при 80°С в течение 3 час. Реакционную смесь промывают последовательно водой (50 мл) и насыщенным раствором соли (50 мл) и сушат над Na2SO4. Толуол выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, получая при этом метил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (2,77 г).
1H-ЯМР (СDСl3) δ (м.д.);
0,88 (9Н, с), 2,35, 2,58 (2Н, АВкв., J=14,5 Гц), 2,36 (3Н, с), 2,46 (2Н, т, J=6,8 Гц), 2,95-3,20 (2Н, м), 3,60 (3Н, с), 3,60-3,80 (1Н, м), 3,85-4,20 (2Н, м), 4,19 (2Н, т, J=6,8 Гц), 6,54 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,4 Гц), 6,98 (1Н, д, J=8,4 Гц), 7,30-7,50 (3Н, м), 7,85-8,05 (2Н, м).
(2) Соединение (5,0 г) вышеуказанной стадии (1) растворяют в 130 мл смешанного растворителя тетрагидрофуран - метанол (3:1). К раствору добавляют 1 н. водный раствор гидроксида лития (54 мл) и смесь перемешивают при 50°С течение 3,5 час и подкисляют 6 н. хлористоводородной кислотой. Растворитель выпаривают при пониженном давлении. Полученный остаток экстрагируют этилацетатом (200 мл). Слой этилацетата промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток растворяют в этаноле (25 мл). К раствору добавляют воду (150 мл) и смесь перемешивают при комнатной температуре, тем самым вызывая кристаллизацию. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (4,52 г).
ИК- и 1H ЯМР-спектры соответствуют спектрам, полученным в примере 23.
Пример 25
Гидрохлорид 2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
Указанное в заголовке соединение (675 мг) примера 2 растворяют в 75% этаноле (10,1 мл) при нагревании. К раствору добавляют 6 н. хлористоводородную кислоту (2,23 мл) и смесь выдерживают при комнатной температуре в течение 2 час, чтобы вызвать кристаллизацию. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (625 мг).
ИК ν (нуйол) см-1; 3398, 1734, 1680, 1641, 1620, 1587, 1574, 1551.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,36 (3Н, с), 2,92 (2Н, т, J=6,0 Гц), 3,00-3,70 (2Н, м), 4,19 (2Н, т, J=6,0 Гц), 4,25-4,75 (5Н, м), 4,80-6,70 (2Н, ушир.), 6,70-7,05 (2Н, м), 7,20 (1Н, д, J=8,6 Гц), 7,30-7,77 (8Н, м), 7,80-8,10 (2Н, м).
Пример 26
2-Бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
Указанное в заголовке соединение (1,0 г) примера 2 суспендируют в метаноле (10 мл). К раствору добавляют 2,09 н. раствор гидроксида натрия (1,02 мл) в метаноле. После растворения метанол выпаривают при пониженном давлении. К полученному остатку добавляют диэтиловый простой эфир и осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (1,03 г).
ИК ν (нуйол) см-1; 1638, 1589, 1503.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,33 (3Н, с), 2,55-3,60 (6Н, м), 3,60-4,30 (5Н, м), 6,47 (1Н, с), 6,60 (1Н, д, J=8,6 Гц), 6,92 (1Н, д, J=8,6 Гц), 7,00-7,67 (8Н, м), 7,67-8,05 (2Н, м).
Пример 27
Гидрохлорид 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
Указанное в заголовке соединение (2,1 г) примера 23 растворяют в метаноле (10,5 мл). К смеси добавляют 8,78 н. раствор хлористого водорода (1,07 мл) в изопропаноле и затем этилацетат (50 мл) и смесь перемешивают при комнатной температуре для кристаллизации. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (1,03 г).
ИК ν (нуйол) см-1; 3362, 3206, 1740, 1672, 1612, 1576, 1553.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,12 (9Н, с), 2,37 (3Н, с), 2,65-3,50 (6Н, м), 4,21 (2Н, т, J=6,5 Гц), 4,40-4,80 (3Н, м), 4,85-6,50 (2Н, ушир.), 6,90 (1Н, д, J=8,1 Гц), 6,94 (1Н, с), 7,21 (1Н, д, J=8,1 Гц), 7,35-7,65 (3Н, м), 7,80-8,05 (2Н, м).
Пример 28
Сульфат 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
Указанное в заголовке соединение (0,5 г) примера 23 растворяют в метаноле (1,25 мл). К смеси добавляют серную кислоту (0,3 мл) и затем воду (16,8 мл) и смесь перемешивают при комнатной температуре для кристаллизации. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,25 г).
ИК ν (нуйол) см-1; 3400, 1715, 1650, 1615, 1550.
1H-ЯМР (DMSO-d6) δ (м.д.);
0,93 (9Н, с), 2,36 (3Н, с), 2,40-3,30 (6Н, м), 3,75-4,45 (5Н, м), 4,60-6,50 (2Н, ушир.), 6,70 (1Н, ушир.с), 6,74 (1Н, д, J=8,1 Гц), 7,06 (1H, д, J=8,1 Гц), 7,25-7,65 (3Н, м), 7,75-8,10 (2Н, м).
Пример 29
Тозилат 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
Указанное в заголовке соединение (0,5 г) примера 23 и п-толуолсульфоновую кислоту (0,28 г) растворяют в этаноле (10 мл) при нагревании. После кристаллизации при комнатной температуре при перемешивании осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,3 г).
ИК ν (нуйол) см-1; 3047, 1734, 1645, 1612, 1514.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,07 (9Н, с), 2,28 (3Н, с), 2,36 (3Н, с), 2,70-3,50 (6Н, м), 4,21 (2Н, т, J=6,5 Гц), 4,40-4,80 (3Н, м), 6,80-7,35 (5Н, м), 7,35-7,65 (5Н, м), 7,75-8,05 (2Н, м), 8,40-12,00 (2Н, ушир.).
Пример 30
Фумарат 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
Указанное в заголовке соединение (1,0 г) примера 23 и фумаровую кислоту (0,23 г) растворяют в метаноле (5 мл). К смеси добавляют воду (5 мл) и смесь перемешивают при комнатной температуре для кристаллизации. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,94 г).
ИК ν (нуйол) см-1; 3500, 3395, 1680, 1650, 1625, 1575, 1550.
1H-ЯМР (DMSO-d6) δ (м.д.);
0,85 (9Н, с), 2,00-6,30 (2Н, ушир.), 2,35 (3Н, с), 2,32, 2,59 (2Н, АВкв., J=14,9 Гц), 2,75-3,10 (2Н, м), 2,85 (2Н, т, J=6,6 Гц), 3,45-4,30 (3Н, м), 4,15 (2Н, т, J=6,6 Гц), 6,61 (1Н, д, J=2,2 Гц), 6,64 (1H, с), 6,66 (1Н, дд, J=2,2, 8,4 Гц), 7,00 (1Н, д, J=8,4 Гц), 7,35-7,65 (3Н, м), 7,75-8,10 (2Н, м).
Пример 31
2-(2,2-Диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат кальция
Указанное в заголовке соединение (0,9 г) примера 23 растворяют в этаноле (9 мл). К смеси добавляют 0,04 н. водный раствор гидроксида кальция (54 мл) и смесь перемешивают при комнатной температуре для кристаллизации. Осажденные кристаллы собирают фильтрованием, получая при этом указанное в заголовке соединение (0,79 г).
ИК ν (нуйол) см-1; 3396, 1638, 1611, 1556, 1504.
1H-ЯМР (MeOH-d4) δ (м.д.);
0,87 (9Н, с), 2,34 (3Н, с), 2,36, 2,58 (2Н, АВкв., J=14,0 Гц), 2,80-3,10 (2Н, м), 2,90 (2Н, т, J=6,5 Гц), 3,30-3,80 (3Н, м), 4,15 (2Н, т, J=6,5 Гц), 6,50 (1Н, д, J=2,4 Гц), 6,60 (1Н, дд, J=2,4, 8,2 Гц), 6,90 (1Н, д, J=8,2 Гц), 7,30-7,60 (3Н, м), 7,80-8,05 (2Н, м).
Следующие соединения были синтезированы таким же способом, как в примерах 1-24.
Пример 32
2-Бензил-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3458, 1682, 1618, 1587, 1510.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,32 (9Н, с), 2,23 (3Н, с), 2,83 (2Н, т, J=6,6 Гц), 3,18 (2Н, д, J=5,9 Гц), 3,65-4,40 (7Н, м), 5,60 (1Н, ушир.с), 6,56 (1Н, ушир.с), 6,73 (1Н, ушир.д), 7,06 (1Н, д, J=8,4 Гц), 7,20-7,55 (5Н, м).
Пример 33
2-Бензил-7-[2-(5-метил-2-(тиофен-2-ил)оксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3423, 1616, 1578, 1510.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,31 (3Н, с), 2,70-3,10 (4Н, м), 3,40-4,00 (4Н, м), 3,39 (2Н, с), 4,11 (2Н, д, J=6,2 Гц), 6,59 (1Н, ушир.с), 6,67 (1Н, д, J=8,4 Гц), 7,01 (1Н, д, J=8,4 Гц), 7,05-7,80 (3Н, м), 7,32 (5Н, с).
Пример 34
2-Бензил-7-[2-(5-метил-2-изопропилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3456, 1684, 1614, 1576, 1510.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,21 (6Н, м), 2,19 (3Н, с), 2,70-3,10 (5Н, м), 3,50-4,20 (5Н, м), 6,40-6,85 (2Н, м), 7,01 (1Н, д, J=8,1 Гц), 7,34 (5Н, ушир.с).
Пример 35
2-Бутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3382, 1722, 1614, 1554, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
0,88 (3Н, т, J=6,6 Гц), 1,10-1,95 (4Н, м), 2,36 (3Н, с), 2,75-3,40 (6Н, м), 3,71 (2Н, ушир.т), 3,95-4,25 (4Н, м), 6,57-7,57 (6Н, м), 7,80-8,10 (3Н, м).
Пример 36
2-Бензил-7-{2-[5-метил-2-(2-метилпропенил)оксазол-4-ил]-этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3443, 3300, 1695, 1655, 1622, 1543, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,89 (3Н, с), 2,11 (3Н, с), 2,27 (3Н, с), 2,79 (2Н, т, J=6,1 Гц), 2,90-3,20 (2Н, м), 3,50-4,00 (4Н, м), 3,93 (2Н, с), 4,07 (2Н, т, J=6,1 Гц), 5,99 (1Н, с), 6,58 (1H, с), 6,67 (1Н, д, J=8,2 Гц), 6,72 (1H, д, J=8,2 Гц), 7,33 (5Н, с).
Пример 37
2-Бензил-7-{2-[2-(3-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3442, 1688, 1614, 1578, 1508.
1H-ЯМР (СDСl3) δ (м.д.);
2,23 (3Н, с), 2,49 (2Н, т, J=6,2 Гц), 2,65-2,90 (4Н, м), 3,05-3,30 (2Н, м), 3,75-4,50 (8Н, м), 4,90-5,20 (2Н, м), 5,65-6,10 (1H, м), 6,58 (1H, д, J=1,7 Гц), 6,75 (1H, дд, J=1,7, 8,2 Гц), 7,07 (1H, д, J=8,2 Гц), 7,35 (5Н, с).
Пример 38
2-Аллил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3335, 1690, 1618, 1553, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,35 (3Н, с), 2,70-3,15 (4Н, м), 3,38 (2Н, д, J=6,2 Гц), 3,55-4,00 (3Н, м), 4,16 (2Н, т, J=6,6 Гц), 4,40-5,50 (1H, ушир.), 5,00-5,40 (2Н, м), 5,60-6,10 (1H, м), 6,65 (1H, с), 6,69 (1H, д, J=8,1 Гц), 7,01 (1H, д, J=8,1 Гц), 7,35-7,65 (3Н, м), 7,75-8,10 (2Н, м).
Пример 39
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-(2-пропинил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3383, 3306, 3221, 1692, 1622, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,00-6,40 (1Н, ушир.), 2,35 (3Н, с), 2,70-3,10 (4Н, м), 3,10-3,25 (1Н, м), 3,50-4,00 (5Н, м), 4,17 (2Н, т, J=6,4 Гц), 6,66 (1Н, с), 6,70 (1Н, д, J=8,6 Гц), 7,01 (1Н, д, J=8,6 Гц), 7,30-7,70 (3Н, м), 7,85-8,05 (2Н, м).
Пример 40
2-(2-Бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3447, 3342, 1684, 1620, 1556.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,67 (3Н, д, J=4,9 Гц), 2,35 (3Н, с), 2,70-3,10 (4Н, м), 3,20-3,50 (2Н, м), 3,50-4,00 (3Н, м), 4,16 (2Н, т, J=6,4 Гц), 4,35-5,20 (1Н, ушир.), 5,25-5,90 (2Н, м), 6,55-6,90 (2Н, м), 7,01 (2Н, д, J=8,1 Гц), 7,35-7,70 (3Н, м), 7,75-8,10 (2Н, м).
Пример 41
2-Бензил-7-[(индолин-3-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1611, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,60-2,30 (2Н, м), 2,80-4,20 (10Н, м), 3,91 (2Н, с), 4,20-6,00 (1Н, ушир.), 6,25-7,10 (7Н, м), 7,33 (5Н, с).
Пример 42
2-(3-Бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3425, 1682, 1612, 1555.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,10-2,40 (2Н, м), 2,35 (3Н, с), 2,60-3,15 (6Н, м), 3,50-4,00 (3Н, м), 4,17 (2Н, т, J=6,3 Гц), 4,40-5,40 (1Н, ушир.), 4,85-5,25 (2Н, м), 5,55-6,10 (1Н, м), 6,50-6,85 (2Н, м), 7,01 (1Н, д, J=8,1 Гц), 7,35-7,70 (3Н, м), 7,75-8,05 (2Н, м).
Пример 43
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-пентаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1742, 1639, 1611, 1572, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
0,88 (3Н, ушир.т), 1,05-1,75 (4Н, м), 2,15-2,70 (2Н, м), 2,35 (3Н, с), 2,70-3,30 (4Н, м), 4,18 (2Н, ушир.т), 4,30-4,90 (2Н, м), 4,90-5,25 (1Н, м), 6,60-6,95 (2Н, м), 7,08 (1Н, д, J=7,9 Гц), 7,35-7,70 (3Н, м), 7,75-8,10 (2Н, м), 11,00-13,00 (1Н, ушир.).
Пример 44
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-(4-пентеноил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1742, 1641, 1611, 1570.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,15-2,70 (2Н, м), 2,35 (3Н, с), 2,70-3,30 (4Н, м), 4,18 (2Н, ушир.т), 4,37-5,50 (5Н, м), 5,60-6,15 (1Н, м), 6,60-6,95 (2Н, м), 7,09 (1Н, д, J=7,7 Гц), 7,30-7,75 (3Н, м), 7,75-8,15 (2Н, м), 11,00-13,00 (1Н, ушир.).
Пример 45
2-(3-Метил-2-бутеноил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1738, 1641, 1611, 1555.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,87 (6Н, с), 2,35 (3Н, с), 2,70-3,30 (4Н, м), 4,18 (2Н, ушир.т), 4,49 (1Н, д, J=18,0 Гц), 4,76 (1Н, д, J=18,0 Гц), 4,95-5,22 (1Н, м), 5,75-6,10 (1Н, м), 6,50-6,90 (2Н, м), 7,08 (1Н, д, J=7,5 Гц), 7,20-7,60 (3Н, м), 7,60-8,05 (2Н, м), 11,00-13,00 (1Н, ушир.).
Пример 46
2-(3,3-Диметилбутирил)-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1738, 1639, 1611, 1583, 1555.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,02 (9Н, с), 2,36 (5Н, с), 2,73-3,20 (4Н, м), 4,17 (2Н, т, J=7,0 Гц), 4,50 (1Н, д, J=9,0 Гц), 4,83 (1Н, д, J=9,0 Гц), 5,12 (1Н, т, J=6,0 Гц), 6,60-6,95 (2Н, м), 7,10 (1Н, д, J=7,0 Гц), 7,35-7,65 (3Н, м), 7,80-8,05 (2Н, м), 11,00-13,00 (1Н, ушир.).
Пример 47
2-Бензил-7-метокси-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3SR)-карбоновая кислота
ИК ν (нуйол) см-1; 1722, 1628, 1553, 1520.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,36 (3Н, с), 3,00 (2Н, т, J=6,8 Гц), 3,10-3,35 (2Н, м), 3,80-4,10 (3Н, м), 3,75 (3Н, с), 4,23 (2Н, т, J=6,8 Гц), 5,80-6,20 (1Н, ушир.), 6,50, 6,72 (2Н, с, с), 7,20-7,60 (8Н, м), 7,80-8,10, (2Н, м).
Пример 48
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-2-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
ИК ν (нуйол) см-1; 1609, 1575, 1554, 1502.
1H-ЯМР (CDCl3) δ (м.д.);
2,32 (3Н, с), 2,60-3,20 (4Н, м), 3,20-3,90 (5Н, м), 4,08 (2Н, ушир.т, J=6,5 Гц), 6,15-6,40 (1Н, м), 6,40-6,70 (1Н, м), 7,75-8,20 (3Н, м), 7,20-7,65 (4Н, м), 7,75-8,10 (2Н, м), 8,25-8,60 (1Н, м).
Пример 49
2-Бензил-7-(3-метил-3-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1612, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,32 (6Н, с), 2,02 (2Н, т, J=7,5 Гц), 2,80-3,10 (2Н, м), 3,40-4,00 (5Н, м), 3,88 (2Н, с), 4,10-6,00 (1Н, ушир.), 6,36 (1Н, д, J=2,0 Гц), 6,53 (1Н, дд, J=2,0, 8,6 Гц), 6,96 (1Н, д, J=8,6 Гц), 7,10-7,55 (10Н, м).
Пример 50
2-Бензил-7-(3,3-диметил-4-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1611, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
0,87 (6Н, с), 1,61 (2Н, т, J=7,0 Гц), 2,54 (2Н, с), 2,85-3,15 (2Н, м), 3,50-4,20 (5Н, м), 3,91 (2Н, с), 4,20-6,00 (1Н, ушир.), 6,60 (1Н, ушир.с), 6,67 (1Н, д, J=8,6 Гц), 7,01 (1Н, д, J=8,6 Гц), 7,05-7,50 (10Н, м).
Пример 51
2-Бензил-7-(2-изопропилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1632, 1585, 1572, 1501.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,37 (6Н, д, J=7,0 Гц), 2,85-3,45 (4Н, м), 3,50-4,20 (6Н, м), 5,12 (2Н, с), 6,69 (1Н, с), 6,77 (1Н, д, J=8,6 Гц), 7,04 (1Н, д, J=8,6 Гц), 7,25-7,85 (8Н, м).
Пример 52
2-Бензил-7-(2-трет-бутилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1611, 1583, 1562, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,42 (9Н, с), 2,85-3,10 (2Н, ушир.), 3,50-4,20 (6Н, м), 5,13 (2Н, с), 6,70 (1Н, с), 6,77 (1Н, д, J=8,4 Гц), 7,04 (1Н, д, J=8,4 Гц), 7,20-7,50 (6Н, м), 7,55-7,65 (1Н, м), 7,70 (1Н, с).
Пример 53
2-Бензил-7-(2-трет-бутилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1717, 1645, 1612, 1553.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,43 (9Н, с), 2,85-3,15 (2Н, м), 3,50-4,15 (3Н, м), 3,90 (2Н, с), 5,11 (2Н, с), 6,69 (1Н, ушир.с), 6,75 (1H, д, J=8,1 Гц), 7,03 (1H, д, J=8,1 Гц), 7,10-7,50 (6Н, м), 7,65 (1H, д, J=9,0), 7,71 (1H, ушир.с).
Пример 54
7-(2-трет-Бутилбензоксазол-6-ил)метокси-2-(2,2-диметилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1740, 1612, 1560, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,10 (9Н, с), 1,43 (9Н, с), 2,79, 3,19 (2Н, АВкв., J=13,6 Гц), 3,20-3,45 (3Н, м), 4,25-4,55 (4Н, ушир.), 5,20 (2Н, с), 6,96 (1H, д, J=8,1 Гц), 7,00 (1H, с), 7,20 (1H, д, J=8,1 Гц), 7,40 (1H, д, J=8,1 Гц), 7,68 (1H, д, J=8,1 Гц), 7,73 (1H, с).
Пример 55
2-Бензил-7-(2-изопропилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1634, 1587, 1570, 1501.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,37 (6Н, д, J=6,8 Гц), 2,90-3,15 (2Н, м), 3,25 (1H, квинтет, J=6,8 Гц), 3,50-4,30 (7Н, м), 5,11 (2Н, с), 6,69 (1H, с), 6,76 (1H, д, J=8,1 Гц), 7,04 (1H, д, J=8,1 Гц), 7,20-7,50 (6Н, м), 7,55-7,65 (1H, м), 7,70 (1H, с).
Пример 56
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-4-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
ИК ν (нуйол) см-1; 3420, 3177, 1639, 1558, 1504.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,34 (3Н, с), 2,70-3,05 (4Н, м), 3,10-3,60 (3Н, м), 3,98 (2Н, ушир.т, J=5,7 Гц), 4,10-4,25 (2Н, м), 6,51 (1Н, ушир.с), 6,61 (1Н, ушир.д, J=8,7 Гц), 6,94 (1Н, ушир.д, J=8,7 Гц), 7,25-7,65 (5Н, м), 7,75-8,00 (2Н, м), 8,46 (2Н, д, J=5,2 Гц).
Пример 57
7-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]-2-[(пиридин-2-ил)карбонил]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат натрия
ИК ν (нуйол) см-1; 3385, 1624, 1566, 1504.
1H-ЯМР (MeOH-d4) δ (м.д.);
2,31, 2,36 (3Н, с, с), 2,75-3,05 (2Н, м), 3,05-3,30 (2Н, м), 4,00-4,30 (2Н, м), 4,50-5,30 (3Н, м), 6,60-6,80 (2Н, м) 7,03 (1Н, дд, J=2,0, 8,5 Гц), 7,30-7,75 (5Н, м), 7,75-8,10 (3Н, м), 8,50-8,70 (1Н, м).
Пример 58
Метил-2-бенэил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
ИК ν (нуйол) см-1; 1736, 1639, 1612, 1504.
1H-ЯМР (СDСl3) δ (м.д.);
2,34 (3Н, с), 2,92 (2Н, т, J=7,0 Гц), 3,07 (2Н, д, J=5,0 Гц), 3,64 (3Н, с), 3,64-4,00 (5Н, м), 4,17 (2Н, т, J=7,0 Гц), 6,51 (1Н, д, J=2,0 Гц), 6,68 (1Н, дд, J=2,0, 8,4 Гц), 6,98 (1Н, д, J=8,4 Гц), 7,20-7,60 (8Н, м), 7,80-8,10 (2Н, м).
Пример 59
2-Бензил-7-[2-(2-циклопропил-5-метилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3470, 1684, 1618, 1583, 1510.
1H-ЯМР (DMSO-d6) δ (м.д.);
0,70-1,10 (4Н, м), 1,80-2,20 (1Н, м), 2,16 (3Н, с), 2,60-2,85 (2Н, м), 2,90-3,15 (2Н, м), 3,50-4,20 (5Н, м), 6,50-6,80 (2Н, м), 7,03 (1Н, д, J=8,1 Гц), 7,34 (5Н, с).
Пример 60
2-(3-Метил-2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3447, 3335, 1670, 1668, 1622, 1556, 1506.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,61 (3Н, с), 1,72 (3Н, с), 2,35 (3Н, с), 2,70-3,20 (4Н, м), 3,39 (2Н, д, J=7,0 Гц), 3,50-4,01 (3Н, м), 4,16 (2Н, т, J=7,0 Гц), 4,35-5,60 (1Н, ушир.), 5,25 (1Н, ушир.т), 6,67 (1Н, с), 6,71 (1Н, д, J=8,4 Гц), 7,02 (1Н, д, J=8,4 Гц), 7,30-7,70 (8Н, м), 7,75-8,10 (2Н, м).
Пример 61
2-(2,2-Диметилпропил)-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1717, 1614, 1566, 1504.
1H-ЯМР (CDCl3) δ (м.д.);
0,97 (9Н, с), 1,33 (9Н, с), 2,24 (3Н, с), 2,44, 2,68 (2Н, АВкв., J=13,9 Гц), 2,84 (2Н, т, J=6,7 Гц), 3,00-3,22 (2Н, м), 3,65 (3Н, т, J=6,1 Гц), 3,83, 4,08 (2Н, АВкв., J=15,1 Гц), 4,07 (2Н, т, J=6,7 Гц), 6,58 (1Н, д, J=1,7 Гц), 6,72 (1Н, дд, J=1,7, 8,4 Гц), 7,05 (1Н, д, J=8,4 Гц), 7,50-8,20 (1H, ушир.).
Пример 62
2-Бензил-7-{2-[2-(1-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3470, 1682, 1614, 1585, 1512.
1H-ЯМР (СDСl3) δ (м.д.);
1,07 (3Н, т, J=7,5 Гц), 2,05-2,20 (1H, м), 2,26 (3Н, с), 2,50-3,00 (3Н, м), 3,65-4,45 (7Н, м), 5,92 (1H, ушир.с), 6,17 (1H, д, J=16,3 Гц), 6,45-6,85 (3Н, м), 7,05 (1H, д, J=8,4 Гц), 7,34 (5Н, с).
Пример 63
2-Бензил-7-{2-[2-(2,2-диметилпропил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1722, 1614, 1568, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
0,95 (9Н, с), 2,34 (3Н, с), 2,55 (2Н, с), 2,60-3,00 (2Н, м), 3,00-3,30 (2Н, м), 3,80-4,40 (7Н, м), 6,64 (1H, ушир.с), 6,70 (1H, д, J=8,8 Гц), 7,02 (1H, д, J=8,8 Гц), 7,32 (5Н, с), 7,80 (1Н, ушир.с).
Пример 64
Гидрохлорид этил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилата
ИК ν (нуйол) см-1; 340,0, 1744, 1676, 1614, 1589, 1574, 1553, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,12 (9Н, с), 1,23 (3Н, т, J=7,0 Гц), 2,36 (3Н, с), 2,60-3,60 (6Н, м), 4,00-4,40 (4Н, м), 4,40-6,00 (4Н, м), 6,88 (1Н, д, J=8,0 Гц), 6,92 (1Н, с), 7,18 (1Н, д, J=8,0 Гц), 7,35-7,70 (8Н, м), 7,75-8,10 (2Н, м).
Пример 65
7-(Бензофуран-2-илметокси)-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1632, 1587, 1501.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,00-6,50 (1Н, ушир.), 2,85-3,15 (2Н, м), 3,50-4,10 (3Н, м), 3,91 (2Н, с), 5,16 (2Н, с), 6,60-7,80 (8Н, м), 7,33 (5Н, с).
Пример 66
2-Изобутирил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1736, 1639, 1612, 1504.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,02 (6Н, ушир.д), 2,35 (3Н, с), 2,65-3,30 (5Н, м), 4,00-5,30 (6Н, м), 6,60-6,95 (2Н, м), 7,09 (1Н, д, J=8,0 Гц), 7,25-7,70 (8Н, м), 7,70-8,10 (2Н, м).
Пример 67
7-[2-(Бензофуран-2-ил)этокси]-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1634, 1585, 1501.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,80-3,10 (2Н, м), 3,19 (2Н, ушир.т), 3,45-4,10 (3Н, м), 3,90 (2Н,с), 4,25 (2Н, ушир.т), 6,50-7,80 (9Н, м), 7,33 (5Н, s).
Пример 68
Гидрохлорид 7-[2-(5-этилпиридин-2-ил)этокси]-2-гексаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты
1H-ЯМР (CDCl3) δ (м.д.);
0,87 (3Н, ушир.т), 1,05-1,85 (9Н, м), 2,15-2,55 (4Н, м), 2,55-3,75 (4Н, м), 4,00-4,90 (4Н, м), 5,25-5,50 (1Н, м), 6,40-7,10 (4Н, м), 7,75 (1Н, ушир.д), 8,15 (1Н, ушир.д), 8,52 (1Н, ушир.с).
Пример 69
2-Карбоксиметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1620, 1585, 1556, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,35 (3Н, с), 2,70-3,15 (4Н, м), 3,41, 3,65 (2Н, АВкв., J=17,5 Гц), 3,70-4,00 (3Н, м), 4,16 (2Н, т, J=7,0 Гц), 6,00-11,00 (1H, ушир.), 6,64 (1H, с), 6,69 (1Н, д, J=8,2 Гц), 7,01 (1H, д, J=8,2 Гц), 7,20-7,70 (8Н, м), 7,70-8,05 (2Н, м).
Пример 70
2-[3-(Метоксикарбонил)пропионил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1732, 1652, 1554, 1505.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,33 (3Н, с), 2,50-3,40 (7Н, м), 3,65 (3Н, с), 4,07 (2Н, ушир.т), 4,45-5,50 (3Н, м), 5,60-6,20 (1H, ушир.), 6,59 (1H, ушир.с), 6,67 (1H, д, J=8,0 Гц), 7,03 (1H, д, J=8,0 Гц), 7,20-7,60 (3Н, м), 7,80-8,10 (2Н, м).
Пример 71
2-[3-(Этоксикарбонил)пропил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3375, 1733, 1620, 1555, 1505.
1H-ЯМР (DMSO-d6) δ (м.д.);
1,18 (3Н, т, J=7,0 Гц), 1,76-2,15 (2Н, м), 2,15-2,50 (2Н, м), 2,35 (3Н, с), 2,70-3,35 (6Н, м), 3,60-4,40 (7Н, м), 5,27 (1H, ушир.с), 6,61 (1H, ушир.с), 6,73 (1H, д, J=8,4 Гц), 7,03 (1H, д, J=8,4 Гц), 7,25-7,55 (3Н, м), 7,80-8,10 (2Н, м).
Пример 72
2-Бензил-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота
ИК ν (нуйол) см-1; 1634, 1614, 1499.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,35 (3Н, с), 2,65-3,25 (4Н, м), 3,40-4,00 (3Н, м), 3,90 (2Н, с), 4,17 (2Н, ушир.т), 6,20-10,00 (1Н, ушир.), 6,50-7,00 (2Н, м), 6,71 (1Н, с), 7,30-7,70 (3Н, м), 7,32 (5Н, с), 7,75-8,15 (2Н, м).
Пример 73
2-(3-Ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1682, 1620, 1508,
1H-ЯМР (DMSO-d6) δ (м.д.);
2,33 (3Н, с), 2,56 (3Н, с), 2,70-3,20 (4Н, м), 3,50-4,30 (5Н, м), 3,97 (2Н, с), 6,50-6,90 (2Н, м), 7,02 (1Н, д, J=8,4 Гц), 7,30-8,00 (9Н, м).
Пример 74
2-(2-Ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 1668, 1643, 1614, 1504.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,33 (3Н, с), 2,36 (3Н, с), 2,70-3,20 (4Н, м), 3,30-4,30 (5Н, м), 6,57 (1Н, д, J=2,0 Гц), 6,66 (1Н, дд, J=2,0, 8,4 Гц), 7,00 (1Н, д, J=8,4 Гц), 7,20-7,75 (7Н, м), 7,75-8,10 (2Н, м).
Пример 75
2-Бензил-7-[(5-метил-2-фенилоксазол-4-ил)метокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота
ИК ν (нуйол) см-1; 3462, 1680, 1614, 1556, 1508.
1H-ЯМР (DMSO-d6) δ (м.д.);
2,41 (3Н, с), 2,83-3,20 (2Н, м), 3,44-4,20 (5Н, м), 4,91 (2Н, с), 6,73 (1Н, ушир.с), 6,77 (1Н, д, J=8,1 Гц), 7,34 (1Н, д, J=8,1 Гц), 7,34 (5Н, с), 7,40-7,68 (3Н, м), 7,75-8,10 (2Н, м).
Ссылочный пример 1
Этил-2-трет-бутоксикарбонил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
(1) Дигидрат 3,5-дииод-L-тирозина (25,0 г) суспендируют в концентрированной хлористоводородной кислоте (250 мл). К суспензии последовательно добавляют 1,2-диметоксиэтан (18 мл) и 37% формалин (20 мл) и смесь нагревают до 75°С на протяжении 30 мин. К реакционной смеси далее добавляют концентрированную хлористоводородную кислоту (120 мл), 1,2-диметоксиэтан (9 мл) и 37% формалин (10 мл) и смесь перемешивают при 75°С в течение 18 час. Осажденные кристаллы собирают фильтрованием и промывают 1,2-диметоксиэтаном (20 мл), получая при этом гидрохлорид 7-гидрокси-6,8-дииод-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты (12,8 г).
Гидрохлорид 7-гидрокси-6,8-дииод-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновой кислоты:
ИК ν (нуйол) см-1; 1751, 1599, 1578.
1H-ЯМР (СDСl3) δ (м.д.);
3,00-3,30 (2Н, м), 4,05 (2Н, с), 4,30 (1Н, дд, J=5,9, 9,5 Гц), 7,71 (1Н, с).
(2) Соединение (12,8 г), полученное на указанной выше стадии (1), суспендирую в этаноле (500 мл). К суспензии добавляют концентрированную хлористоводородную кислоту (10 мл) и смесь кипятят с обратным холодильником в течение 15 час. Этанол выпаривают при пониженном давлении. К полученному остатку добавляют этилацетат (300 мл) и соединение промывают насыщенным водным раствором гидрокарбоната натрия (100 мл) и насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении, получая при этом этил-7-гидрокси-6,8-дииод-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (11,11 г).
Этил-7-гидрокси-6,8-дииод-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
1H-ЯМР (СDСl3) δ (м.д.);
1,29 (3Н, т, J=7,0 Гц), 2,80-3,00 (2Н, м), 3,30-4,10 (5Н, м), 4,23 (2Н, кв., J=7,0 Гц), 7,46 (1Н, с).
(3) 10% Pd-C (350 мг) суспендирую в метаноле (60 мл). К суспензии добавляют триэтиламин (2,0 мл) и соединение (2,80 г), полученное на вышеуказанной стадии (2), и соединение каталитическим способом гидрируют при комнатной температуре, 29,4×104 Па (3,0 кгс/см2) в течение 3 час. Pd-C отфильтровывают и метанол выпаривают при пониженном давлении. К полученному остатку добавляют этилацетат (10 мл). Смесь промывают насыщенным раствором соли (100 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении, получая при этом этил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат (1,14 г).
Этил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат:
ИК ν (нуйол) см-1; 1732, 1607, 1516.
1H-ЯМР (СDСl3) δ (м.д.);
1,28 (3Н, т, J=7,0 Гц), 2,80-3,10 (3Н, м), 3,60-3,80 (1Н, м), 3,97 (2Н, с), 4,05-4,20 (4Н, м), 6,43 (1Н, с), 6,50-6,80 (1Н, м), 6,92 (1Н, д, J=8,4 Гц).
(4) Соединение (1,13 г), полученное на вышеуказанной стадии (3), растворяют в тетрагидрофуране (20 мл). К раствору добавляют ди-трет-бутилдикарбонат (1,50 г) и смесь перемешивают при комнатной температуре в течение 1 час. К реакционной смеси добавляют этилацетат (30 мл) и смесь промывают насыщенным раствором соли (20 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом указанное в заголовке соединение (1,51 г).
ИК ν (нуйол) см-1; 3260, 1756, 1671, 1615, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
1,29 (3Н, т, J=7,0 Гц), 1,47 (9Н, с), 3,08 (2Н, д, J=5,2 Гц), 4,21 (2Н, кв., J=7,0 Гц), 4,41 (1Н, д, J=15,5 Гц), 4,60-5,25 (1Н, м), 4,65 (1Н, д, J=15,5 Гц), 5,00-6,00 (1Н, ушир.), 6,50-6,80 (2Н, м), 6,98 (1Н, д, J=8,1 Гц).
Ссылочный пример 2
Метил-2-трет-бутоксикарбонил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Таким же способом, как в ссылочном примере 1, получают указанное в заголовке соединение.
ИК ν (нуйол) см-1; 3261, 1755, 1672, 1614, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
1,47 (9Н, с), 3,08 (2Н, д, J=5,2 Гц), 3,63 (3Н, с), 4,40 (1Н, д, J=16,5 Гц), 4,60-5,25 (1Н, м), 4,66 (1Н, д, J=16,5 Гц), 5,60-6,60 (1Н, ушир.), 6,50-6,80 (2Н, м), 6,99 (1Н, д, J=8,1 Гц).
Ссылочный пример 3
2-(5-Метил-2-фенилоксазол-4-ил)этилметансульфонат
К метиленхлориду (200 мл) добавляют 2-(5-метил-2-фенилоксазол-4-ил)этанол (20 г) и триэтиламин (19,2 мл). К смеси по каплям добавляют метансульфонилхлорид (9,52 мл) при 0°С и смесь перемешивают при такой же температуре в течение 15 мин. Смесь промывают 10% водным раствором лимонной кислоты (200 мл), насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл) и сушат над Na2SO4. Метиленхлорид выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом указанное в заголовке соединение (21,45 г).
1H-ЯМР (СDСl3) δ (м.д.);
2,53 (3Н, с), 2,94 (3Н, с), 2,94 (2Н, т, J=7,0 Гц), 4,52 (2Н, т, J=7,0 Гц), 7,30-7,50 (3Н, м), 7,80-8,10 (2Н, м).
Ссылочный пример 4
Этил-2-бензил-7-гидрокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат
Соединение (8,1 г), полученное в ссылочном примере 1(3), растворяют в N,N-диметилформамиде (80 мл). К раствору добавляют триэтиламин (2,0 мл) и бензилбромид (4,57 мл) и смесь перемешивают при комнатной температуре в течение 3 час. К реакционной смеси добавляют воду (500 мл) и смесь экстрагируют дважды этилацетатом (200 мл). Объединенный слой этилацетата промывают насыщенным раствором соли (500 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом указанное в заголовке соединение (10,46 г).
ИК ν (нуйол) см-1; 3410, 1717, 1624, 1506.
1H-ЯМР (СDСl3) δ (м.д.);
1,22 (3Н, т, J=7,0 Гц), 3,06 (2Н, д, J=5,0 Гц), 3,66 (1Н, т, J=5,0 Гц), 3,78 (2Н, с), 3,90 (2Н, с), 4,13 (2Н, кв., J=7,0 Гц), 6,37 (1Н, д, J=2,0 Гц), 6,56 (1Н, дд, J=2,0, 8,4 Гц), 6,92 (1Н, д, J=8,4 Гц), 7,20-7,50 (5Н, м).
Ссылочный пример 5
2-(N-трет-Бутоксикарбонил-N-метиламино)этилметансульфонат
(1) 2-(Метиламино)этанол (3,5 мл) растворяют в тетрагидрофуране (150 мл). К раствору добавляют ди-трет-бутилдикарбонат (12,5 г) и смесь перемешивают при комнатной температуре в течение 20 мин. Тетрагидрофуран выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом 2-(N-трет-бутоксикарбонил-N-метиламино)этанол (6,35 г).
2-(N-трет-Бутоксикарбонил-N-метиламино)этанол:
ИК ν (неразбавленный) см-1; 3423, 2976, 2934, 2882, 1674.
1H-ЯМР (СDСl3) δ (м.д.);
1,43 (9Н, с), 2,89 (3Н, с), 3,34 (2Н, т, J=5,8 Гц), 3,67 (2Н, т, J=5,8 Гц), 4,00-6,00 (1Н, ушир.).
(2) Соединение (505 мг), полученное на вышеуказанной стадии (1), растворяют в метиленхлориде (20 мл). К раствору добавляют триэтиламин (0,5 мл) и метансульфонилхлорид (0,25 мл) и смесь перемешивают при комнатной температуре в течение 1 час. К смеси добавляют метиленхлорид (30 мл) и смесь промывают насыщенным раствором соли (20 мл) и сушат над Na2SO4. Метиленхлорид выпаривают при пониженном давлении, получая при этом указанное в заголовке соединение (720 мг).
1H-ЯМР (СDСl3) δ (м.д.);
1,46 (9Н, с), 2,94 (3Н, с), 3,01 (3Н, с), 3,54 (2Н, т, J=5,5 Гц), 4,33 (2Н, т, J=5,5 Гц).
Ссылочный пример 6
1-(2-Бромэтил)индолин
К 1,2-дибромэтану (58,0 мл) добавляют индолин (5,0 г) и триэтиламин (28,7 мл) и смесь перемешивают при 90°С в течение 2 час. К реакционной смеси добавляют этилацетат (200 мл) и смесь промывают насыщенным раствором соли (400 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом указанное в заголовке соединение (4,09 г).
ИК ν (неразбавленный) см-1; 2924, 2845, 1607, 1489.
1H-ЯМР (СDСl3) δ (м.д.);
2,99 (1H, т, J=8,4 Гц), 3,45 (1H, т, J=8,4 Гц), 3,49 (4Н, с), 6,40-6,75 (2Н, м), 6,90-7,20 (2Н, м).
Ссылочный пример 7
1-(2-Бромэтил)-6-метоксикарбонилиндолин
К 1,2-дибромэтану (15,7 мл) добавляют 6-метоксикарбонилиндолин (2,41 г) и триэтиламин (7,8 мл) и смесь перемешивают при 90°С в течение 2 час. К реакционной смеси добавляют этилацетат (150 мл) и смесь промывают насыщенным раствором соли (300 мл) и сушат над Na2SO4. Этилацетат выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией, получая при этом указанное в заголовке соединение (1,71 г).
ИК ν (неразбавленный) см-1; 1713, 1611, 1499.
1H-ЯМР (СDСl3) δ (м.д.);
3,03 (1H, т, J=8,4 Гц), 3,53 (1Н, т, J=8,4 Гц), 3,53 (4Н, с), 3,88 (3Н, с), 6,00-6,20 (2Н, м), 7,39 (1H, дд, J=1,5, 7,8 Гц).
Экспериментальный пример 1 Гипогликемическое действие (способ А)
Кровь отбирали из хвостовой вены самцов мышей KK-AУ в неголодном состоянии, которые были моделями с самопроизвольным диабетом, имели обнаруживаемый диабет вследствие инсулинорезистентности и которые проявляли гипергликемию и гиперинсулинемию. Уровень глюкозы в плазме измеряли с использованием коммерчески доступного набора для анализа (glucose CII-test WAKO, Wako Pure Chemical Industries, Ltd.). Мышей распределяли по группам (5 мышей на группу), получив контрольную группу и группу введения (испытуемого соединения), так, чтобы среднее и стандартное отклонение уровня глюкозы в плазме каждой группы было почти то же самое. Каждое испытуемое соединение суспендировали или растворили в 5% растворе гуммиарабика и вводили перорально группе введения в течение 4 последовательных дней со следующего дня. 5% раствор гуммиарабика перорально вводили контрольной группе. Кровь отбирали из хвостовой вены мышей в неголодном состоянии приблизительно спустя 24 часа после последнего введения и измеряли уровень глюкозы в плазме. Снижение уровня глюкозы в плазме вычисляли по следующей формуле. Результаты приводятся в таблице 1.
Снижение (%) уровня глюкозы в плазме = [(средний уровень глюкозы в плазме контрольной группы - средний уровень глюкозы в плазме группы введения испытуемого соединения)/средний уровень глюкозы в плазме контрольной группы] × 100.
Гипогликемическое действие (способ А)
30
60,6
30
49,6
30
43,4
30
12,2
30
17,4
30
42,9
Экспериментальный пример 2 Гипогликемическое действие (способ В)
Кровь отбирали из хвостовой вены самцов мышей КК-АУ в неголодном состоянии, которые были моделями с самопроизвольным диабетом, имели обнаруживаемый диабет вследствие инсулинорезистентности и которые проявляли гипергликемию и гиперинсулинемию. Уровень глюкозы в плазме измеряли с использованием коммерчески доступного набора для анализа (glucose CII-test WAKO, Wako Pure Chemical Industries, Ltd.). Мышей распределяли по группам (5 мышей на группу), получив контрольную группу и группу введения (испытуемого соединения), так, чтобы среднее и стандартное отклонение уровня глюкозы в плазме каждой группы было почти то же самое. Каждое испытуемое соединение смешивали в пропорции 0,1 мас./мас.% с порошкообразным кормом (СЕ-2, Clea) и кормовую смесь вводили группе введения в течение 4 дней со следующего дня. Контрольной группе регулярно вводили порошкообразный корм. На день 5 кровь отбирали из хвостовой вены мышей в неголодном состоянии и измеряли уровень глюкозы в плазме. Снижение уровня глюкозы в плазме вычисляли по следующей формуле. Результаты приводятся в таблице 2.
Снижение (%) уровня глюкозы в плазме = [(средний уровень глюкозы в плазме контрольной группы - средний уровень глюкозы в плазме группы введения испытуемого соединения)/средний уровень глюкозы в плазме контрольной группы] × 100.
Гипогликемическое действие (способ В)
Экспериментальный пример 3 Гипотриглицеридемическое действие
Кровь отбирали из хвостовой вены самцов мышей KK-AУ в неголодном состоянии, которые были моделями с самопроизвольным диабетом, имели обнаруживаемый диабет вследствие инсулинорезистентности и которые проявляли гипергликемию и гиперинсулинемию. Уровень триглицерида в плазме измеряли с использованием коммерчески доступного набора для анализа (triglyceride G-test WAKO, Wako Pure Chemical Industries, Ltd.). Мышей распределили по группам (5 мышей на группу), получив контрольную группу и группу введения (испытуемого соединения), так, чтобы среднее и стандартное отклонение уровня триглицерида в плазме каждой группы было почти то же самое. Каждое испытуемое соединение суспендировали или растворили в 5% растворе гуммиарабика и вводили перорально группе введения в течение 4 последовательных дней со следующего дня. 5% раствор гуммиарабика перорально вводили контрольной группе. Кровь отбирали из хвостовой вены мышей в неголодном состоянии приблизительно спустя 24 часа после последнего введения и измеряли уровень триглицерида в плазме. Снижение уровня триглицерида в плазме вычисляли по следующей формуле.
Результаты приводятся в таблице 3.
Снижение (%) уровня триглицерида в плазме = [(средний уровень триглицерида в плазме контрольной группы - средний уровень триглицерида в плазме группы введения испытуемого соединения)/средний уровень триглицерида в плазме контрольной группы] ν 100.
Гипотриглицеридемическое действие
30
54,3
30
50,4
Экспериментальный пример 4 Гипогликемическое действие и гипоинсулинемическое действие у инсулинорезистентной диабетической мыши
Действие, повышающее инсулинорезистентность, исследовали на мышах КК-АУ, которые были моделями с самопроизвольным диабетом, имели обнаруживаемый диабет вследствие инсулинорезистентности и которые проявляли гипергликемию и гиперинсулинемию. Кровь отбирали из хвостовой вены 12-недельных самцов мышей KK-AУ в неголодном состоянии и уровень глюкозы в плазме измеряли с использованием коммерчески доступного набора для анализа (glucose CII-test WAKO, Wako Pure Chemical Industries, Ltd.). Мышей распределили по группам (5 мышей на группу), получив контрольную группу и группу введения (испытуемого соединения), так, чтобы средний уровень глюкозы в плазме и средняя масса тела каждой группы, а также стандартное отклонение уровня ее были почти одинаковыми. Испытуемое соединение (10 мг/кг) суспендировали в 5% водном растворе гуммиарабика и вводили перорально один раз в день группе введения в течение 4 дней со следующего дня. 5% раствор гуммиарабика перорально вводили контрольной группе. Кровь отбирали из хвостовой вены мышей в неголодном состоянии спустя 24 часа после последнего введения. Измеряли концентрации глюкозы плазмы и инсулина плазмы. Результаты приводятся в таблице 4.
В результате каждое испытуемое соединение (10 мг/кг) снижало уровень глюкозы в плазме, а также снижало концентрацию инсулина в плазме. Это означает, что испытуемое соединение снижало уровень глюкозы в плазме не посредством секреции инсулина, а посредством действия, потенцирующего чувствительность к инсулину (действие, повышающее инсулинорезистентность), тем самым улучшая состояние при гиперинсулинемии.
Гипогликемическое действие и гипоинсулинемическое действие
Экспериментальный пример 5 Действие, стимулирующее аккумуляцию триглицерида в клетках 3T3-L1
Культуральную среду 80% конфлюэнтных клеток 3T3-L1 удаляли и клетки диссоциировали раствором 0,25% трипсин-ЭДТУ. Добавляли 5% FBS(фетальная бычья сыворотка)-DMEM(модифицированная по способу Дульбекко среда Игла) (такое же количество, как и количество удаленной среды) и полученную клеточную суспензию центрифугировали при 25°С и 100×g в течение 1 мин для получения клеточного седимента и супернатант удаляли. Клетки снова суспендировали в подходящем количестве среды 5% FBS-DMEM и клетки подсчитывают. Добавляли среду 5% FBS-DMEM для установления концентрации 1×105 клеток/мл и смесь распределяли по 1 мл на 24-луночный планшет. Клетки культивировали с аэрацией 5% СO2 при 37°С в течение 2 дней. После подтверждения послеконфлюэнтного состояния супернатант культуры заменяли на среду, содержащую 0,5 мМ-IBMX, клетки культивировали в течение 2 дней. Затем среду заменяли на среду, содержащую 10 нг/мл инсулина и 10-7 М испытуемого соединения, и клетки далее культивировали в течение 4 дней. После удаления супернатанта культуры клетки лизировали в 0,1% растворе SDS (додецилсульфат натрия) и измеряли количество триглицерида. Аккумулирование триглицерида (%) вследствие потенцирования активности инсулина испытуемым соединением вычисляли из следующей формулы. Результаты приводятся в таблице 5 [(количество триглицерида с добавлением испытуемого соединения - количество триглицерида контроля)/количество триглицерида контроля] × 100.
Действие, стимулирующее аккумуляцию триглицерида
Действие патента
Гетероциклическое соединение [I] и фармацевтически приемлемая соль настоящего изобретения проявляют превосходящее гипогликемическое действие, гиполипидимическое действие в кровотоке, действие, повышающее инсулинорезистентность, и PPAR-активирующее действие, их можно использовать в качестве гипогликемических средств, гиполипидемических средств, средств, повышающих инсулинорезистентность, терапевтических средств для лечения диабета, терапевтических средств против осложнений при диабете, средств, повышающих толерантность к глюкозе, средств против атеросклероза, средств против ожирения, противовоспалительных средств, средств для профилактики или лечения PPAR-опосредованного заболевания и средств для профилактики или лечения синдрома X. Следовательно, гетероциклическое соединение [I] и фармацевтически приемлемая соль настоящего изобретения полезны для профилактики или лечения диабета, диабетических осложнений, гиперлипидемии, атеросклероза, гипергликемии, заболеваний, вызванных инсулинорезистентной, ослабленной толерантностью к глюкозе, и заболеваний, вызванных инсулинорезистентностью, ожирения, воспаления, PPAR-опосредованного заболевания и синдрома X. Гетероциклическое соединение [I] настоящего изобретения имеет структуру, полностью отличающуюся от структуры соединений, до сих пор используемых в качестве активного ингредиента общепринятых средств, повышающих инсулинорезистентность. Благодаря предоставлению данного соединения можно получить большое число гипогликемических средств, гиполипидемических средств, средств, повышающих инсулинорезистентность, терапевтических средств для лечения диабета, терапевтических средств против осложнений при диабете, средств, повышающих толерантность к глюкозе, средств против атеросклероза, средств против ожирения, противовоспалительных средств, средств для профилактики или лечения PPAR-опосредованного заболевания и средств для профилактики или лечения синдрома X, из которых можно свободно выбрать нужное средство.
Данная заявка основана на заявках на патенты №№345543/1999 и 295108/2000, зарегистрированных в Японии, содержание которых, таким образом, включается в качестве ссылки.
Исследование токсичности при однократном введении мышам и крысам
Метод
Самцов мышей ICR и крыс SD (возраста 6 недель) распределяли по группам: группа, которой вводили испытываемое соединение, и контрольная группа (по 5 животных на группу) таким образом, чтобы средняя масса тела и стандартное отклонение были практически одинаковыми у животных в группе. Единственную дозу суспензии (1000 мг/20 мл/кг соединения по примеру 2 в 0,5% водном растворе метилцеллюлозы) перорально вводили группе, отобранной для введения испытываемого соединения, а единственную дозу 0,5% водного раствора метилцеллюлозы перорально вводили контрольной группе и наблюдали общее состояние животных. Начиная со следующего дня в течение 14 дней регулярно измеряли массу тела и потребление пищи и наблюдали общее состояние животных, затем производили аутопсию животных для визуального обследования внешнего вида и состояния основных органов.
Результаты
Результаты представлены в таблицах 6 и 7.
Группа, которой вводили испытываемое соединение, не показала отклонений в поведении или состоянии животных в течение 6 часов после введения соединения. Эта группа также не показала отклонений в поведении или состоянии животных в процессе наблюдения в течение 14 дней после введения соединения. При аутопсии не было обнаружено никаких отклонений внешнего вида, в срезах и полостях сердца, печени, почек, селезенки, легких, надпочечников, поджелудочной железы, яичек, желудка, тонкого кишечника и толстой кишки у всех животных.
Токсичность, вызванная однократным введением мышам ICR
Токсичность, вызванная одной дозой у крыс SD
Примеры фармацевтических композиций.
Пример композиции 1: таблетка
Таблетку, содержащую следующие ингредиенты, получают обычным способом. Если это необходимо, на таблетку можно наносить сахарное или пленочное покрытие.
Пример композиции 2: капсула
Капсулу, содержащую следующие ингредиенты, получают обычным способом заполнения капсулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ МЕДИЦИНСКОЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2287529C2 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2299197C2 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ СИНАПТИЧЕСКОГО ЗАХВАТА ДОПАМИНА И СПОСОБ ЛЕЧЕНИЯ | 2000 |
|
RU2293728C2 |
| НОВЫЕ ИНДОЛИЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2693629C2 |
| ЗАМЕЩЕННЫЕ КАРБОНОВЫМИ КИСЛОТАМИ ОКСАЗОЛОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ PPAR-АЛЬФА И ГАММА-АКТИВАТОРОВ ПРИ ЛЕЧЕНИИ ДИАБЕТА | 2002 |
|
RU2278859C2 |
| НОВЫЕ ПИРРОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2607788C2 |
| ПРОИЗВОДНОЕ ПИПЕРИДИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2730508C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 2001 |
|
RU2265598C2 |
Изобретение относится к новым производным тетрагидроизохинолинов формулы [I]

где R1 представляет собой атом водорода или низший алкил, R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил, или моноциклический гетероциклилалкил, где указанный гетероцикл включает 5- или 6-членное кольцо, содержащее атом азота, и необязательно имеет заместитель, выбранный из низшего алкила,R3 представляет собой атом водорода или низший алкокси, А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил, В представляет собой низший алкилен, и Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из атома кислорода и атома азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила, или к его фармацевтически приемлемой соли. Изобретение также относится к фармацевтической композиции, обладающей гипогликемическим и гиполипидемическим действием, на основе этих производных. Технический результат – получение новых соединений и фармацевтических средств на их основе, а именно гипогликемическое средство, гиполипидемическое средство, средство, повышающее инсулинорезистентность, терапевтическое средство для лечения диабета, терапевтическое средство против осложнения при диабете, средство, повышающее толерантность к глюкозе, средство против атеросклероза, средство против ожирения, противовоспалительное средство, средство для профилактики или лечения PPAR-опосредованного заболевания и средство для профилактики или лечения синдрома X. 3 н. и 10 з.п. ф-лы, 7 табл.
где
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил, или моноциклический гетероциклилалкил где указанный гетероцикл включает 5- или 6-членное кольцо, содержащее атом азота, и необязательно имеет заместитель, выбранный из низшего алкила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из атома кислорода и атома азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль.
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, необязательно имеющий заместитель, выбранный из алкоксикарбонила и карбокси, циклоалкил, циклоалкилалкил, арил, необязательно имеющий заместитель, выбранный из низшего алкила, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль.
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, циклоалкилалкил, арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила, алкенил, алкинил или гетероциклалкил,
R3 представляет собой атом водорода или низший алкокси,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой арил или моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль.
R1 представляет собой атом водорода или низший алкил,
R2 представляет собой алкил, циклоалкилалкил и арилалкил, необязательно имеющий заместитель, выбранный из низшего алкила, низшего алкокси, атома галогена и ацила,
R3 представляет собой атом водорода,
А представляет собой прямую связь или >N-R5, где R5 представляет собой низший алкил,
В представляет собой низший алкилен, и
Y представляет собой моноциклический или конденсированный гетероциклил, содержащий, по меньшей мере, один гетероатом, выбранный из группы, включающей атом кислорода и атом азота, и необязательно имеющий заместитель, выбранный из низшего алкила, карбокси, арила, алкенила, циклоалкила и тиенила,
или его фармацевтически приемлемая соль.
Y-A представляет собой



где RA представляет собой изопропил или трет-бутил,
RB представляет собой изопропил или трет-бутил,
RC представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил, 3-бутенил, циклопропил, 1-бутенил или 2,2-диметилпропил,
или его фармацевтически приемлемая соль.
Y-A представляет собой



где RA представляет собой изопропил или трет-бутил,
RB представляет собой изопропил или трет-бутил,
RC представляет собой изопропил, трет-бутил, фенил, тиофен-2-ил, 2-метилпропенил или 3-бутенил,
или его фармацевтически приемлемая соль.
Y-A - представляет собой

или его фармацевтически приемлемая соль.
Y-A - представляет собой
или его фармацевтически приемлемая соль.
(2) 2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(3) 2-ацетил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(4) 2-метил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(5) 2-гексаноил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(6) 2-гексил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(7) 2-изобутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(8) 2-циклогексилметил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(9) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(3-фенилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(10) 2-бензоил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(11) 2-бензил-7-[2-(N-метил-N-(пиридин-2-ил)амино)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(12) 2-бензил-7-[2-(5-этилпиридин-2-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(13) 2-бензил-7-[2-(индолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(14) этил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(16) 2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(17) этил-2-(4-метоксибензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(18) 2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(19) этил-2-(4-метилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(20) 2-бензил-7-[2-(6-карбоксииндолин-1-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(21) 2-(4-фторбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(22) 2-(2,2-диметилпропионил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(23) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(24) 2-бензил-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(25) 2-бензил-7-[2-(5-метил-2-(тиофен-2-ил)оксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(26) 2-бензил-7-[2-(5-метил-2-изопропилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(27) 2-бутил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(28) 2-бензил-7-{2-[5-метил-2-(2-метилпропенил)оксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(29) 2-бензил-7-{2-[2-(3-бутенил)-5-метилоксазол-4-ил]-этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(30) 2-аллил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(31) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(2-пропинил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(32) 2-(2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(33) 2-бензил-7-[(индолин-3-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(34) 2-(3-бутенил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(35) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-пентаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(36) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(4-пентеноил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(37) 2-(3-метил-2-бутеноил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S) -карбоновая кислота,
(38) 2-(3,3-диметилбутирил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(39) 2-бензил-7-метокси-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(40) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-2-илметил)-1,2,3,4-тетрагидроизохинолин-(33)-карбоновая кислота,
(41) 2-бензил-7-(3-метил-3-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(42) 2-бензил-7-(3,3-диметил-4-фенилбутокси)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(43) 2-бензил-7-(2-изопропилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(44) 2-бензил-7-(2-трет-бутилбензоксазол-6-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(45) 2-бензил-7-(2-трет-бутилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(46) 7-(2-трет-бутилбензоксазол-6-ил)метокси-2-(2,2-диметилпропил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(47) 2-бензил-7-(2-изопропилбензоксазол-5-ил)метокси-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(48) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-(пиридин-4-илметил)-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(49) 7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-2-[(пиридин-2-ил)карбонил]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(50) метил-2-бензил-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(51) 2-бензил-7-[2-(2-циклопропил-5-метилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(52) 2-(3-метил-2-бутенил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(53) 2-(2,2-диметилпропил)-7-[2-(5-метил-2-трет-бутилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(54) 2-бензил-7-{2-[2-(1-бутенил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(55) 2-бензил-7-{2-[2-(2,2-диметилпропил)-5-метилоксазол-4-ил]этокси}-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(56) этил-2-(2,2-диметилпропил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоксилат,
(57) 7-(бензофуран-2-илметокси)-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(58) 2-изобутирил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(59) 7-[2-(бензофуран-2-ил)этокси]-2-бензил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(60) 7-[2-(5-этилпиридин-2-ил)этокси]-2-гексаноил-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(61) 2-карбоксиметил-7-[2-(5-метил-2-фенилоксазол-4-ил)-этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(62) 2-[3-(метоксикарбонил)пропионил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(63) 2-[3-(этоксикарбонил)пропил]-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(64) 2-бензил-6-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3RS)-карбоновая кислота,
(65) 2-(3-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
(66) 2-(2-ацетилбензил)-7-[2-(5-метил-2-фенилоксазол-4-ил)этокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота и
(67) 2-бензил-7-[(5-метил-2-фенилоксазол-4-ил)метокси]-1,2,3,4-тетрагидроизохинолин-(3S)-карбоновая кислота,
или его фармацевтически приемлемая соль.
Приоритет:
| WO 9800403 A1, 08.01.1998 | |||
| WO 9323378 A1, 25.11.1993 | |||
| ЗАМЕЩЕННЫЕ 1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИНЫ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И ФАРМКОМПОЗИЦИЯ | 1993 |
|
RU2135473C1 |
Авторы
Даты
2005-07-20—Публикация
2000-11-29—Подача