Изобретение относится к микробиологии и может быть использовано для получения вакцины оспенной инактивированной сухой.
Известен способ получения вакцины оспенной живой, включающий получение производственных штаммов, оспенных соскобов, вируссодержащей жидкости (регламент производства вакцины оспенной живой сухой №963-00 от 14.09.2000 г.). Также известен способ получения вакцины оспенной инактивированной (регламент производства вакцины инактивированной №249 от 1982 г.).
Однако применение вакцины оспенной живой ограничено рядом установленных противопоказаний, особенно в условиях, когда население длительное время не вакцинировалось или ранее не получало прививку против оспы.
Задачей предлагаемого способа является создание грундиммунитета у человека, впервые вакцинируемого против оспы, и снижение реактогенности вакцины оспенной живой.
Поставленная задача достигается путем получения производственного штамма, оспенных соскобов, вируссодержащей жидкости и ее инактивирования, причем вирус вакцины инактивируют гамма-излучением Со60, интегральная (суммарная) доза облучения составляет 1,75·106 Р при исходной специфической активности вируссодержащей жидкости 1·109-1,9·109 ООЕ/мл или 1,9·1006 Р - при исходной специфической активности вируссодержащей жидкости 2·109-5·109 ООЕ/мл, доводят содержание общего белка до концентрации 100 мкг/мл, вводят в состав стабилизаторы сушки, в качестве стабилизаторов сушки используют сахарозу в конечной концентрации 5% и желатозу в конечной концентрации 1%, в качестве производственного штамма используют штамм вируса вакцины Л-ИВП (Листер, Институт вирусных препаратов).
Процесс получения вакцины включает:
- получение производственных штаммов;
- получение оспенных соскобов;
- приготовление вируссодержащей жидкости;
- приготовление инактивированной вирусной жидкости;
- приготовление жидкого полуфабриката вакцины - сведение инактивированной вирусной жидкости, буферного раствора, растворов стабилизаторов;
- разлив жидкого полуфабриката в ампулы, лиофилизация вакцины и герметизация ампул с вакциной;
- упаковка вакцины в комплекте с растворителем, в качестве которого используют раствор натрия хлорида 0,9%.
Получение производственных штаммов представляет собой:
- получение производственного штамма путем пассажа исходного штамма вируса вакцины на кроликах, получения соскоба, его размола, обработки фреоном-113, получения вируссодержащей жидкости с добавлением глицерина в конечной концентрации 50% (ляпина);
- получение маточного штамма путем пассажа производственного штамма (ляпины) на телятах, получения соскоба, его размола, обработки фреоном-113, получения вируссодержащей жидкости с добавлением глицерина в конечной концентрации 50% (ляпино-вакцина I генерации);
- получение посевного вируса путем пассажа на телятах маточного штамма, получения соскоба, его размола, обработки фреоном-113, получения вируссодержащей жидкости с добавлением глицерина в конечной концентрации 50% (ляпино-вакцина II генерации).
Специфическая активность производственных штаммов контролируется в реакции на хорион-аллантоисных оболочках двенадцатидневных куриных эмбрионов и должна быть: ляпины - не менее 5,0·108 ООЕ/мл, ляпино-вакцины I и II генерации - не менее 1,0·109 ООЕ/мл.
Получение оспенных соскобов представляет собой получение оспенного детрита при пассаже посевного вируса на телятах.
Приготовление вируссодержащей жидкости:
- размол соскоба, обработка соскоба фреоном-113 гомогенизацией при 5-10 тыс. об/мин в течение 10 минут, получение вируссодержащей жидкости (ляпино-вакцина III генерации) в виде надосадочной жидкости после центрифугирования при 3000 об/мин в течение 20 минут.
Специфическая активность ляпино-вакцины III генерации контролируется в реакции на хорион-аллантоисных оболочках двенадцатидневных куриных эмбрионов и должна быть не менее 1,0·109 ООЕ/мл. Микробиологическая чистота контролируется в соответствии с ГФ XI вып.2: в 1 мл допускается не более 50 посторонних микроорганизмов, в том числе аэробных и факультативных анаэборных бактерий и грибов. Должны отсутствовать патогенные анаэробные бактерии, бактерии семейства Enterobacteriaceae и видов Pseudomonas aeruginosa и Staphylococcus aureus. Материал должен быть безвредным для морской свинки и двух белых мышей.
Приготовление инактивированной вирусной жидкости представляет собой процесс инактивации вируса гамма-излучением. Вируссодержащую жидкость облучают на изотопной установке с применением Со60.
Интегральная (суммарная) доза облучения вируссодержащей жидкости не зависит от ее объема и составляет 1,75·106 Р при исходной специфической активности вируссодержащей жидкости 1·109 ООЕ/мл - 1,9·109 ООЕ/мл или 1,9·106 Р при исходной специфической активности вируссодержащей жидкости 2·109 ООЕ/мл - 5·109 ООЕ/мл.
Инактивированная вирусная жидкость не должна содержать живой вирус, должна быть стерильна, нетоксична и содержать общий белок в количестве не менее 1 мг/мл.
Контроль полноты инактивации проводят на хорион-аллантоисных оболочках двенадцатидневных куриных эмбрионов, на которых не должно развиваться типичных специфических поражений от нанесения инактивированной вирусной жидкости.
Приготовление жидкого полуфабриката вакцины:
Серию жидкого полуфабриката вакцины получают при добавлении стабилизаторов в инактивированную вирусную жидкость с расчетной концентрацией общего белка 100 мкг/мл.
Стабилизаторы: желатозу в конечной концентрации 1% и сахарозу в конечной концентрации 5% вводят в виде растворов желатозы 10% и сахарозы 50%.
Концентрация общего белка в инактивированной вирусной жидкости до 100 мкг/мл доводится буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4.
Разлив жидкого полуфабриката в ампулы, лиофилизация вакцины и герметизация ампул с вакциной:
Препарат разливают в стерильные ампулы. Номинальный объем вакцины в ампуле при ее разливе - 0,5 мл. Процесс разлива проводят в потоке стерильного воздуха.
Затем кассеты с препаратом помещают в низкотемпературный прилавок для замораживания продукта до конечной температуры минус 50-55°С. Замороженный препарат лиофилизируют в течение 36 часов. Начальная температура полок минус 40°С, скорость подогрева полок 5°С, конечная температура продукта 25°С.
Высушенный препарат запаивают в потоке стерильного азота для защиты от кислорода воздуха. Концентрация остаточного кислорода в препарате после герметизации должна быть не более 3%.
Упаковка вакцины в комплекте с растворителем:
Вакцина выпускается в комплекте с растворителем - раствором натрия хлорида 0,9%. Первичная упаковка вакцины - по 1 дозе (0,5 мл) в ампулах ШП-1, ШП-2 из стекла марки НС-1 или НС-3 или аналогичного качества, или импортных, разрешенных к применению в РФ, упаковка растворителя - по 0,5 мл в таких же ампулах.
На ампулы с вакциной и растворителем наносят маркировку быстрозакрепляющейся краской методом печати или этикетированием.
Комплект состоит из одной ампулы вакцины и одной ампулы растворителя. По 5 или 10 комплектов вместе с инструкцией по применению и ножом ампульным или скарификатором упаковывают в пачку из картона коробочного или в контурную ячейковую упаковку. По одной или две контурные упаковки помещают в пачку из картона.
Основным качественным показателем вакцины, характеризующим иммунобиологические свойства, является специфическая активность. Специфическую активность препарата, обусловленную активным компонентом - инактивированным антигеном вируса вакцины, оценивают по способности вызывать у иммунизированных белых крыс образование вируснейтрализующих антител к вирусу вакцины. Концентрацию специфических вируснейтрализующих антител (титр) в сыворотке крови иммунизированных животных определяют в реакции биологической нейтрализации на куриных эмбрионах, используя в качестве тест-штамма вирус вакцины. Среднегеометрический титр вируснейтрализующих антител в сыворотках крови крыс, вакцинированных одной дозой вакцины внутривенно, должен быть не менее 1:80.
В качестве производственного штамма для получения инактивированной оспенной вакцины используют штамм вируса вакцины Л-ИВП.
Предлагаем примеры приготовления серии жидкого полуфабриката вакцины.
Пример 1. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 1,0·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,75·106 Р. При мощности дозы излучения (W) 22,45 Р/с продолжительность инактивации (Т), рассчитанная по формуле  , составляет
, составляет  c или 21 час 40 минут.
c или 21 час 40 минут.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрации общего белка установлена 3,0 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл. Для этого 417 мл инактивированной вирусной жидкости с концентрацией белка 3,0 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4 (расчетное количество добавляемого буферного раствора 12083 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Пример 2. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 1,5·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,75·106 Р. При мощности дозы излучения (W) 24 Р/с продолжительность инактивации (Т), рассчитанная по формуле  составляет
составляет  с или 20 часов 15 минут.
с или 20 часов 15 минут.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична, и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрация общего белка установлена 2,0 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл. Для этого 625 мл инактивированной вирусной жидкости с концентрацией белка 2,0 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4 (расчетное количество добавляемого буферного раствора 11875 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Пример 3. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 1,9·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,75·106 Р. При мощности дозы излучения (W) 26 Р/с продолжительность инактивации (Т), рассчитанная по формуле  , составляет
, составляет  или 18 часов 41 минуту.
или 18 часов 41 минуту.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрация общего белка установлена 3,25 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл. Для этого 385 мл инактивированной вирусной жидкости с концентрацией белка 3,25 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4 (расчетное количество добавляемого буферного раствора 12115 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Пример 4. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 2,0·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,9·106 Р. При мощности дозы излучения (W) 24 Р/с продолжительность инактивации (Т), рассчитанная по формуле  , составляет
, составляет  или 22 часа.
или 22 часа.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрации общего белка установлена 3,5 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл. Для этого 357 мл инактивированной вирусной жидкости с концентрацией белка 3,5 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4 (расчетное количество добавляемого буферного раствора 12143 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Пример 5. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 4,4·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,9·106 Р. При мощности дозы излучения (W) 22,45 Р/с продолжительность инактивации (Т), рассчитанная по формуле  , составляет
, составляет 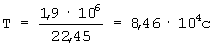 или 23 часа 28 минут.
или 23 часа 28 минут.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрации общего белка установлена 3,125 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл, для чего 400 мл инактивированной вирусной жидкости с концентрацией белка 3,125 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,А (расчетное количество добавляемого буферного раствора 12100 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Пример 6. Вируссодержащая жидкость, полученная после обработки соскоба (РП №963-00 от 14.09.00) имеет специфическую активность 5,0·109 ООЕ/мл. Вирус инактивируют на изотопной установке гамма-излучением Со60 при интегральной дозе облучения (Д) 1,9·106 Р. При мощности дозы излучения (W) 26 Р/с продолжительность инактивации (Т), рассчитанная по формуле  , составляет
, составляет 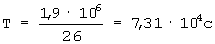 или 20 часов 17 минут.
или 20 часов 17 минут.
Инактивированная вирусная жидкость должна быть безопасна (контроль полноты инактивации), стерильна, нетоксична и содержание общего белка должно быть не менее 100 мкг/мл. В примере концентрация общего белка установлена 2,5 мг/мл. Для приготовления серии полуфабриката вакцины объемом 15,55 л необходимо приготовить 12,5 л инактивированной вирусной жидкости с расчетной концентрацией общего белка 100 мкг/мл. Для этого 500 мл инактивированной вирусной жидкости с концентрацией белка 2,5 мг/мл доводят до 12500 мл стерильным апирогенным нетоксичным буферным раствором Мак-Ильвейна 0,007 М рН 7,2-7,4 (расчетное количество добавляемого буферного раствора 12000 мл). Жидкость перемешивают, не допуская вспенивания, и берут выемку 20 мл для контроля концентрации общего белка. Затем в полученную жидкость добавляют стабилизаторы: желатозу до конечной концентрации 1% в виде стерильного апирогенного нетоксичного раствора желатозы 10% - 1560 мл и сахарозу до конечной концентрации 5% в виде стерильного апирогенного нетоксичного раствора сахарозы 50% - 1560 мл. Полученную жидкость перемешивают и берут пробу 50 мл на контроль стерильности. Серию жидкого полуфабриката вакцины объемом 15,55 л передают на разлив в ампулы.
Вакцина не содержит консерванта. Вакцину высушивают под вакуумом из замороженного состояния в ампулах и запаивают под азотом. Полученную предлагаемым способом вакцину «Оспавир» можно использовать в медицине для вакцинации против оспы.
Преимущества полученной вакцины состоят в том, что вакцина имеет упаковку по одной дозе в ампуле. Назначение: первичная вакцинация при двухэтапном методе вакцинации для активной профилактики оспы у детей с двухлетнего возраста, подростков и взрослых. Вакцина вводится лицам, подлежащим первичной вакцинации. Кроме того, вакцина «Оспавир» имеет преимущество перед аналогичной мультидозной вакциной в силу простоты и удобства применения, а также исключения ятрогенной ошибки.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения вакцины оспенной инактивированной эмбриональной сухой в таблетированной форме для орального применения | 2020 |
|
RU2744707C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИРАБИЧЕСКОЙ ВАКЦИНЫ | 1986 |
|
SU1367487A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2009 |
|
RU2420314C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ВЕНЕСУЭЛЬСКОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1991 |
|
RU2035191C1 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| Способ получения микрокапсулированной формы живой культуральной вакцины против сезонного и пандемического гриппа для интраназального применения | 2016 |
|
RU2617051C1 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2003 |
|
RU2330885C2 |
| СПОСОБ СТЕРИЛИЗУЮЩЕЙ ФИЛЬТРАЦИИ ВИРУССОДЕРЖАЩЕГО МАТЕРИАЛА ДЛЯ ПОЛУЧЕНИЯ КУЛЬТУРАЛЬНОЙ АНТИРАБИЧЕСКОЙ ВАКЦИНЫ | 1989 |
|
RU1755580C |
| Вакцина оспенная инактивированная эмбриональная сухая таблетированная для орального применения "ТЭОВин" и способ ее получения | 2016 |
|
RU2651040C2 |
Изобретение относится к области биотехнологии. Способ заключается в том, что получают производственный штамм, оспенные соскобы, вируссодержащую жидкость. Вируссодержащую жидкость инактивируют гамма-излучением Со60. Интегральная (суммарная) доза облучения составляет 1,75·106 P при исходной специфической активности вируссодержащей жидкости от 1·109 до 1,9·109 ООЕ/мл и 1,9·106 Р - при исходной специфической активности вируссодержащей жидкости от 2·109 до 5·109 ООЕ/мл. Доводят содержание общего белка до концентрации 100 мкг/мл и добавляют стабилизаторы сушки. Вакцина обладает высокой иммуногенностью, удобна в применении, нетоксична. 2 з.п. ф-лы.
| ЖИВАЯ РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ГЕПАТИТА В И НАТУРАЛЬНОЙ ОСПЫ ДЛЯ НАКОЖНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2073524C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ОСПЫ ОВЕЦ | 1998 |
|
RU2138291C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ, СПОСОБ ПОЛУЧЕНИЯ СВОБОДНОЙ ОТ КЛЕТОК ВАКЦИНЫ, СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК, ПИТАТЕЛЬНАЯ СРЕДА | 1993 |
|
RU2126269C1 |
Авторы
Даты
2005-08-27—Публикация
2004-01-28—Подача