Изобретение относится к кодирующим нуклеотидным последовательностям гена pgi из коринебактерий и к способу усиления интенсивности метаболизма в пентозо-фосфатном цикле путем ослабления гена pgi.
Предпосылки создания изобретения
Нуклеотиды, витамины и передпочтительно L-аминокислоты, наиболее предпочтительно лизин и триптофан, применяются в пищевой промышленности, в кормах для животных, медицине и в фармацевтической промышленности.
Известно, что эти вещества получают ферментативным путем с использованием штаммов коринебактерий, прежде всего с использованием Corynebacterium glutamicum. Поскольку эти продукты имеют большое значение, постоянно ведется работа по совершенствованию способа их получения. Усовершенствования способа могут касаться технических сторон процесса ферментации, таких как перемешивание и обеспечение кислородом, или состава питательных сред, например концентрации сахара в процессе ферментации, или переработки продукта, например, с помощью ионообменной хроматографии, или присущей самому микроорганизму продуктивности.
Для улучшения продуктивности этих микроорганизмов применяют методы мутагенеза, селекции и отбора мутантов. Таким путем получают штаммы, которые обладают устойчивостью к антиметаболитам или являются ауксотрофами в отношении обладающих регуляторной функцией важных промежуточных продуктов и продуцируют нуклеотиды, витамины или аминокислоты.
В течение ряда лет для улучшения продуцирующих нуклеотиды, витамины и L-аминокислоты штаммов Corynebacterium также применяют методы рекомбинантной ДНК.
Обычным исходным продуктом для получения этих соединений является глюкоза, которую, как правило, применяют в форме гидролизата крахмала. В качестве исходного продукта также используют сахарозу.
При клеточной абсорбции глюкоза подвергается фосфорилированию с поглощением фосфоенолпирувата (фосфотрансферазная система) (Malin и Bourd, Journal of Applied Bacteriology 71, 517-523 (1991)) и после этого поступает в клетку в виде глюкозо-6-фосфата. Сахароза превращается во фруктозу и глюкозо-6-фосфат с помощью фосфотрансферазной системы (Shio и др., Agricultural and Biological Chemistry 54, 1513-1519 (1990)) и путем взаимодействия с инвертазой (Yamamoto и др., Journal of Fermentation Technology 64, 285-291 (1986)).
В процессе катаболизма глюкозы ферменты глюкозо-6-фосфатдегидрогеназа (КФ 1.1.14.9) и глюкозо-6-фосфат-изомераза (КФ 5.3.1.9) конкурируют друг с другом в отношении субстрата глюкозо-6-фосфата. Фермент глюкозо-6-фосфат-изомераза катализирует первую стадию реакции пути Эмбдена-Мейерхофа-Парнаса (Embden-Meyerhof-Parnas) или гликолиза, а именно превращение во фруктозо-6-фосфат. Фермент глюкозо-6-фосфат-дегидрогеназа катализирует первую стадию реакции окислительной части пентозофосфатного цикла, а именно превращение в 6-фосфоглюконолактон.
На окислительной стадии пентозофосфатного цикла глюкозо-6-фосфат превращается в рибулозо-5-фосфат, в результате чего образуются восстановительные эквиваленты в форме восстановленного никотинамид-аденин-динуклеотида (NADPH). Если пентозофосфатный цикл продолжается, то пентозофосфаты, гексозофосфаты и триозофосфаты превращаются друг в друга. Пентозофосфаты, такие как 5-фосфорибозил-1-пирофосфат, активно участвуют, например, в биосинтезе нуклеотидов. Кроме того, 5-фосфорибозил-1-пирофосфат является предшественником ароматических аминокислот и такой аминокислоты, как L-гистидин. NADPH действует в качестве восстановительного эквивалента в многочисленных путях биосинтеза анаболиков. При этом для биосинтеза одной молекулы L-лизина из оксауксусной кислоты требуются четыре молекулы NADPH.
Известно, что пентозофосфатный цикл важен для биосинтеза и продуцирования аминокислот, прежде всего L-лизина, коринебактериями, и поэтому он представляет интерес для многих специалистов.
В частности, у Oishi и Aida (Agricultural and Biological Chemistry 29, 83-89 (1965)) описан "гексозомонофосфатный шунт" Brevibacterium ammoniagenes. Исследования метаболизма глюкозы в процессе ферментации глутаминовой кислоты и лизина, проведенные Ishino и др. (Journal of General and Applied Microbiology 37, 157-165 (1991)) с помощью методов, основанных на использовании изотопа 13С, выявили корреляцию между проидуцированием лизина и интенсивностью метаболизма в пентозофосфатном цикле.
Задача изобретения
Задачей изобретения является разработка способа увеличения интенсивности метаболизма в пентозофосфатном цикле.
Описание изобретения
Нуклеотиды, витамины и прежде всего L-аминокислоты, наиболее предпочтительно L-лизин и L-триптофан, применяются в пищевой промышленности, в кормах для животных, медицине и в фармацевтической промышленности. Поэтому общий интерес представляет разработка новых улучшенных способов получения этих продуктов.
Объектом изобретения является выделенный полинуклеотид, содержащий полинуклеотидную последовательность, выбранную из группы, включающей
а) полинуклеотид, идентичный по крайней мере на 70% полинуклеотиду, кодирующему полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO:2,
б) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 70% аминокислотной последовательности, представленной в SEQ ID NO:2,
в) полинуклеотид, комплементарный полинуклеотидам, указанным в подпункте а) или б), и
г) полинуклеотид, содержащий по крайней мере 15 последовательных пар оснований полинуклеотидной последовательности, указанной в подпункте а), б) или в).
Объектом изобретения также является полинуклеотид, предпочтительно содержащий способную к репликации ДНК, которая включает:
(I) нуклеотидную последовательность, представленную в SEQ ID NO:1, или
(II) по крайней мере одну последовательность, которая соответствует последовательности, указанной в подпункте (I), в пределах вырожденности генетического кода, или
(III) по крайней мере одну последовательность, которая гибридизуется с последовательностью, комплементарной последовательности, указанной в подпункте (I) или (II), и необязательно
(IV) функционально нейтральные смысловые мутации в последовательности, указанной в подпункте (I).
Объектами изобретения также являются:
полинуклеотид, включающий нуклеотидную последовательность, представленную в SEQ ID NO:1,
полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO:2,
вектор, содержащий указанный выше в подпункте г) полинуклеотид, прежде всего рМС1, депонированный в штамме Е.coli DSM 12969, и
коринебактерии, служащие в качестве клеток-хозяев и содержащие вышеуказанный вектор.
Понятие "выделенный" в контексте настоящего изобретения относится к какому-либо элементу, выделенному из его естественного окружения.
Понятие "полинуклеотид" в целом относится к полирибонуклеотидам и полидезоксирибонуклеотидам, которые могут представлять собой как немодифицированную РНК или ДНК, так и модифицированную РНК или ДНК.
Понятие "полипептиды" обозначает пептиды или протеины, содержащие две или более аминокислот, которые связаны пептидными связями.
Полипептиды по изобретению включают полипептид, последовательность которого представлена в SEQ ID NO:2, прежде всего обладающий биологической активностью глюкозе-6-фосфат-изомеразы, а также полипептиды, идентичные полипептиду, последовательность которого представлена в SEQ ID NO:2, по крайней мере на 70%, предпочтительно по крайней мере на 80% и наиболее предпочтительно идентичные по крайней мере на 90-95% полипептиду, последовательность которого представлена в SEQ ID NO:2, и обладающие указанной активностью.
Объектом изобретения также является способ ферментативного получения нуклеотидов, витаминов и прежде всего L-аминокислот, наиболее предпочтительно лизина и триптофана, с использованием коринебактерии, прежде всего таких, которые уже обладают способностью продуцировать указанные вещества и в которых ослабляют, прежде всего обеспечивают низкий уровень экспрессии кодирующих нуклеотидных последовательностей гена pgi.
Понятие "ослабление" в контексте настоящего описания означает понижение или подавление в микроорганизме внутриклеточной активности одного или нескольких ферментов (протеинов), кодируемых соответствующей ДНК, за счет, например, использования более слабого промотора либо гена или аллеля, кодирующего соответствующий фермент с низкой активностью или инактивирующего соответствующий фермент (протеин), и необязательно за счет сочетания этих мер.
Микроорганизмы, являющиеся объектом настоящего изобретения, могут продуцировать нуклеотиды, витамины и прежде всего L-аминокислоты, наиболее предпочтительно лизин и триптофан, из глюкозы, сахарозы, лактозы, фруктозы, мальтозы, мелассы, крахмала, целлюлозы или из глицерина и этанола. Эти микроорганизмы могут включать представителей коринебактерий, прежде всего из рода Corynebacterium. В роде Corynebacterium следует прежде всего отметить вид Corynebacterium glutamicum, который, как известно специалистам, обладает способностью продуцировать L-аминокислоты.
Пригодными штаммами бактерий р. Corynebacterium, прежде всего вида Corynebacterium glutamicum, являются, например, следующие известные штаммы дикого типа:
Corynebacterium glutamicum ATCC 13032,
Corynebacterium acetoglutamicum ATCC 15806,
Corynebacterium acetoacidophilum ATCC 13870,
Corynebacterium thermoaminogenes FERM BP-1539,
Brevibacterium flavum ATCC 14067,
Brevibacterium lactofermentum ATCC 13869 и
Brevibacterium divaricatum ATCC 14020, а также полученные из них мутанты, соответственно штаммы, продуцирующие нуклеотиды, витамины или L-аминокислоты, например следующие продуцирующие 5'-инозиновую кислоту штаммы:
Corynebacterium ammoniagenes ATCC 15190,
Corynebacterium ammoniagenes ATCC 15454 и
Corynebacterium glutamicum ATCC 14998, или например следующие продуцирующие 5'-гуаниловую кислоту штаммы:
Corynebacterium glutamicum ATCC 21171 и
Corynebacterium ammoniagenes ATCC 19216, или например следующие продуцирующие D-пантотеновую кислоту штаммы:
Corynebacterium glutamicum ATCC 13032/pECM3ilvBNCD,pEKEx2panBC и
Corynebacterium glutamicum ATCC 13032/pND-D2, или, например, следующие продуцирующие L-лизин штаммы:
Corynebacterium glutamicum FERM-P 1709,
Brevibacterium flavum FERM-P 1708,
Brevibacterium lactofermentum FERM-P 1712,
Corynebacterium glutamicum FERM-P 6463,
Corynebacterium glutamicum FERM-P 6464 и
Corynebacterium glutamicum DSM 5714, или, например, следующие продуцирующие L-триптофан штаммы:
Corynebacterium glutamicum ATCC 21850 и
Corynebacterium glutamicum KY9218(pKW9901).
При создании изобретения удалось выделить новый ген pgi из С.glutamicum, кодирующий фермент глюкозо-6-фосфат-изомеразу (КФ 5.3.1.9).
Для выделения гена pgi, а также других генов из С.glutamicum сначала создают библиотеку генов этого микроорганизма в Е.coli. Создание библиотеки генов описано в широко известных учебниках и справочниках. В качестве примеров можно назвать учебник Winnacker: Gene und Klone, Eine  in die Gentechnologie (изд-во Chemie, Weinheim, Германия (1990)) или справочник Sambrook и др.: Molecular Cloning, A Laboratory Manual (Cold Spring Harbor Laboratory Press (1989)). Одной из широко известных библиотек генов является библиотека генов штамма Е.coli K-12 W3110, созданная Kohara и др. (Cell 50, 495-508 (1987)) в λ-векторах. У Bathe и др. (Molecular and General Genetics, 252: 255-265 (1996)) описана библиотека генов штамма С.glutamicum ATCC 13032, полученная с помощью космидного вектора SuperCos I (Wahl и др., Proceedings of the National Academy of Sciences USA, 84:2160-2164 (1987)) в штамме Е.coli K-12 NM554 (Raleigh и др., Nucleic Acids Research 16, 1563-1575 (1988)). В свою очередь у
in die Gentechnologie (изд-во Chemie, Weinheim, Германия (1990)) или справочник Sambrook и др.: Molecular Cloning, A Laboratory Manual (Cold Spring Harbor Laboratory Press (1989)). Одной из широко известных библиотек генов является библиотека генов штамма Е.coli K-12 W3110, созданная Kohara и др. (Cell 50, 495-508 (1987)) в λ-векторах. У Bathe и др. (Molecular and General Genetics, 252: 255-265 (1996)) описана библиотека генов штамма С.glutamicum ATCC 13032, полученная с помощью космидного вектора SuperCos I (Wahl и др., Proceedings of the National Academy of Sciences USA, 84:2160-2164 (1987)) в штамме Е.coli K-12 NM554 (Raleigh и др., Nucleic Acids Research 16, 1563-1575 (1988)). В свою очередь у  и др. (Molecular Microbiology 6(3), 317-326) описана библиотека генов штамма С.glutamicum ATCC 13032, полученная с использованием космиды рНС79 (Hohn и Collins, Gene 11, 291-298 (1980)). У O'Donohue (The Cloning and Molecular Analysis of Four Common Aromatic Amino Acid Biosynthetic Genes from Corynebacterium glutamicum, докторская диссертация, Национальный универститет Ирландии, Голуэй, 1997) описано клонирование генов С.glutamicum с использованием экспрессионной системы λ Zap, описанной Short и др. (Nucleic Acids Research, 16:7583).
и др. (Molecular Microbiology 6(3), 317-326) описана библиотека генов штамма С.glutamicum ATCC 13032, полученная с использованием космиды рНС79 (Hohn и Collins, Gene 11, 291-298 (1980)). У O'Donohue (The Cloning and Molecular Analysis of Four Common Aromatic Amino Acid Biosynthetic Genes from Corynebacterium glutamicum, докторская диссертация, Национальный универститет Ирландии, Голуэй, 1997) описано клонирование генов С.glutamicum с использованием экспрессионной системы λ Zap, описанной Short и др. (Nucleic Acids Research, 16:7583).
Для создания библиотеки генов С.glutamicum в Е.coli могут быть использованы также такие плазмиды, как pBR322 (Bolivar, Life Sciences, 25, 807-818 (1979)) или pUC9 (Viera и др., Gene, 19:259-268 (1982)). В качестве хозяев прежде всего могут быть использованы такие штаммы Е.coli, которые имеют дефекты, полученные в результате рестрикции и рекомбинации, например штамм DH5α (Jeffrey H. Miller: "A Short Course in Bacterial Genetics, A Laboratory Manual and Handbook for Escherichia coli and Related Bacteria", Cold Spring Harbor Laboratory Press (1992)).
Затем библиотеку генов встраивают в индикаторный штамм путем трансформации (Hanahan, Journal of Molecular Biology 166, 557-580 (1983)) или путем электропорации (Tauch и др., FEMS Microbiological Letters, 123:343-347 (1994)). Индикаторный штамм отличается наличием мутации в рассматриваемом гене, которая обусловливает обнаруживаемый фенотип. Для целей настоящего изобретения представляет интерес мутант Е.coli DF1311, описанный Kupor и Fraenkel (Journal of Bacteriology 100: 1296-1301 (1969)). Этот штамм несет мутации в генах pgi и pgl, в результате чего его рост на глюкозе ингибируется в значительной степени. После трансформации с помощью вектора, содержащего ген pgi, рост на глюкозе восстанавливается. Примером такого вектора, содержащего ген pgi, является рАМС1 (фиг.1).
Затем клонированные с помощью космид или других λ-векторов длинные фрагменты ДНК могут быть в свою очередь субклонированы в обычных пригодных для секвенирования ДНК векторах.
Методы секвенирования ДНК описаны среди прочего у Sanger и др. (Proceedings of the National Academy of Sciences of the United States of America, 74:5463-5467 (1977)).
После этого полученные последовательности ДНК могут быть изучены с использованием известных алгоритмов или программ анализа последовательностей, например, таких как программа, созданная Staden (Nucleic Acids Research 14, 217-232 (1986)), программа GCG, созданная Butler (Methods of Biochemical Analysis 39, 74-97 (1998)), алгоритм FASTA, разработанный Pearson и Lipman (Proceedings of the National Academy of Sciences of the USA, 85, 2444-2448 (1988)), или алгоритм BLAST, разработанный Altschul и др. (Nature Genetics 6, 119-129 (1994)), и сравнены с данными о последовательностях, которые могут быть получены из доступных научной общественности баз данных. Доступными общественности базами данных нуклеотидных последовательностей являются, например, база данных Европейской лаборатории молекулярной биологии (European Molecular Biology Laboratory (EMBL), Гейдельберг, Германия) или база данных Национального центра биотехнологической информации (NCBI, Бетезда, шт.Мэриленд, США).
С помощью этих методов была получена новая кодирующая последовательность ДНК гена pgi из С.glutamicum, которая представлена в настоящем описании в виде SEQ ID NO:1. Кроме того, из данной последовательности ДНК с использованием описанных выше методов была выведена аминокислотная последовательность соответствующего протеина. В последовательности SEQ ID NO:2 представлена выведенная аминокислотная последовательность продукта гена pgi.
Кодирующие последовательности ДНК, которые получают из SEQ ID NO:1 на основе вырожденности генетического кода, также являются составной частью изобретения. Аналогично этому составной частью изобретения являются и последовательности ДНК, которые гибридизуются с SEQ ID NO:1 или с частями SEQ ID NO:1. И, наконец, последовательности ДНК, получаемые в результате полимеразной цепной реакции (ПЦР) с использованием праймеров, полученных из SEQ ID NO:1, также являются составной частью настоящего изобретения.
Соответствующие рекомендации по идентификации последовательностей ДНК с помощью гибридизации можно найти, в частности, в справочнике "The DIG System Users Guide for Filter Hybridization" фирмы Boehringer Mannheim GmbH (Маннгейм, Германия (1993)) и у Liebl и др. (International Journal of Systematic Bacteriology 41:255-260 (1991)). Рекомендации касательно амплификации последовательностей ДНК с помощью полимеразной цепной реакции (ПЦР) можно найти, среди прочего, в справочнике Gait: Oligonucleotide synthesis: a practical approach (IRL Press, Oxford, Великобритания, 1984) и у Newton и Graham: PCR (изд-во Spectrum Akademischer Verlag, Heidelberg, Германия,1994).
При создании изобретения было установлено, что в результате ослабления гена pgi в коринебактериях может быть усилена интенсивность пути метаболизма в пентозофосфатном цикле и повышена эффективность синтеза нуклеотидов, витаминов и прежде всего L-аминокислот, наиболее предпочтительно L-лизина и L-триптофана.
Ослабление может быть достигнуто за счет снижения или подавления либо экспрессии гена pgi, либо каталитических свойств протеина фермента. Оба метода необязательно могут применяться совместно.
Снизить экспрессию гена можно за счет соответствующего контроля культуры или путем генетической модификации (мутации) сигнальных структур, контролирующих экспрессию гена. Сигнальными структурами, контролирующими экспрессию гена, являются, например, гены-репрессоры, гены-активаторы, операторы, промоторы, аттенюаторы, сайты связывания рибосомы, инициирующий кодон и терминаторы. Соответствующую информацию можно найти, например, в WO 96/15246, у Boyd и Murphy (Journal of Bacteriology 170:5949 (1988)), у Voskuil и Chambliss (Nucleic Acids Research 26: 3548 (1998)), у Jensen и Hammer (Biotechnology and Bioengineering 58:191 (1998)), у Patek и др. (Microbiology 142:1297 (1996)) и в известных учебниках по генетике и молекулярной биологии, как, например, учебник Knippers ("Moleculare Genetik", 6-е изд., изд-во Georg Thieme Verlag, Stuttgart, Германия, 1995) или Winnacker ("Gene und Klone", изд-во VCH Verlagsgesellschaft, Weinheim, Германия, 1990).
Мутации, которые могут приводить к модификации или снижению каталитических свойств протеинов ферментов, известны из уровня техники; в качестве примеров следует назвать статьи Qiu и Goodman (Journal of Biological Chemistry 272:8611-8617 (1997)), Sugimoto и др. (Bioscience Biotechnology and Biochemistry 61:1760-1762 (1997)) и  ("Die Threonindehydratase aus Corynebacterium glutamicum: Aufhebung der allosterischen Regulation und Struktur des Enzyms", отчеты Исследовательского центра Юлих (Forschungszentrum
("Die Threonindehydratase aus Corynebacterium glutamicum: Aufhebung der allosterischen Regulation und Struktur des Enzyms", отчеты Исследовательского центра Юлих (Forschungszentrum  ), Jul-2906, ISSN 09442952, Юлих, Германия, 1994). Обзор публикаций можно найти в известных учебниках по генетике и молекулярной биологии, таких как, например, учебник Hagemann ("Allgemeine Genetik", изд-во Gustav Fischer Vertag, Stuttgart, 1986).
), Jul-2906, ISSN 09442952, Юлих, Германия, 1994). Обзор публикаций можно найти в известных учебниках по генетике и молекулярной биологии, таких как, например, учебник Hagemann ("Allgemeine Genetik", изд-во Gustav Fischer Vertag, Stuttgart, 1986).
Мутации, которые могут быть использованы для данной цели, представляют собой транзиции, инсерции, делеции и трансверсии. В зависимости от воздействия замены аминокислот на ферментативную активность мутации подразделяют на миссенс-мутации и нонсенс-мутации. Инсерции или делеции по крайней мере одной пары оснований в гене приводят к мутациям "сдвига рамки", в результате которой происходит встраивание неправильных аминокислот или преждевременное прекращение трансляции. Делеции двух или большего количества кодонов, как правило, приводят к полному нарушению ферментативной активности. Методы создания таких мутаций известны, а соответствующие рекомендации можно найти в известных учебниках по генетике и молекулярной биологии, таких как, например, учебник Knippers ("Moleculare Genetik", 6-е изд., изд-во Georg Thieme Verlag, Stuttgart, Германия, 1995), Winnacker ("Gene und Klone", изд-во VCH Verlagsgesellschaft, Weinheim, Германия, 1990) или Hagemann ("Allgemeine Genetik", изд-во Gustav Fischer Verlag, Stuttgart, 1986).
Примером осуществления мутагенеза путем инсерции является плазмида рМС1 (фиг.2), с помощью которой может быть подвергнут мутации ген pgi. Плазмида рМС1 представляет собой плазмиду pBGS8, описанную Spratt и др. (Gene 41:337 (1986)), в которую встроен внутренний фрагмент гена pgi, представленный в виде SEQ ID NO:3. После трансформации и гомологичной рекомбинации гена pgi (инсерция) эта плазмида приводит к полной потере функции фермента. Соответствующие данные и пояснения касательно мутагенеза путем инсерции можно найти у Schwarzer и  (Bio/Technology 9, 84-87 (1991)) или у Fitzpatrick и др. (Applied Microbiology and Biotechnology 42, 575-580 (1994)).
(Bio/Technology 9, 84-87 (1991)) или у Fitzpatrick и др. (Applied Microbiology and Biotechnology 42, 575-580 (1994)).
Для продуцирования нуклеотидов, витаминов и прежде всего L-аминокислот, наиболее предпочтительно L-лизина и L-триптофана, может оказаться целесообразным наряду с ослаблением гена pgi дополнительно усиливать, прежде всего сверхэкспрессировать, один или несколько ферментов, участвующих в конкретном пути биосинтеза.
Так, например, для продуцирования нуклеотидов можно
- одновременно сверхэкспрессировать ген purF, кодирующий глутамин-PRPP (фосфорибозилпирофосфат)амидотрансферазу и/или
- одновременно сверхэкспрессировать ген carAB, кодирующий карбамоилфосфатсинтетазу.
Для продуцирования L-лизина, например, можно
- одновременно сверхэкспрессировать ген dapA, кодирующий дигидродипи-колинат-синтазу (ЕР-В 0197335), и/или
- одновременно сверхэкспрессировать ген gdh, кодирующий глутаматдегидрогеназу (Bormann и др. Molecular Microbiology 6, 317-326 (1992)), и/или
- одновременно амплифицировать фрагмент ДНК, обусловливающий устойчивость к S-(2-аминоэтил)цистеину (EP-A 0088166).
Для продуцирования L-триптофана, например, можно
- одновременно сверхэкспрессировать ген tkt, кодирующий транскетолазу, и/или
- одновременно сверхэкспрессировать ген prs, кодирующий фосфорибозил-пирофосфатсинтазу.
Кроме того, для продуцирования нуклеотидов, витаминов и прежде всего L-аминокислот, наиболее предпочтительно L-лизина и L-триптофана, может оказаться целесообразным наряду с ослаблением гена pgi исключить нежелательные побочные реакции (Nakayama: "Breeding of Amino Acid Producing Microorganisms", Overproduction of Microbial Products, под ред. Krumphanzl, Sikyta, Vanek, изд-во Academic Press, London, UK, 1982).
Микроорганизмы, содержащие предлагаемый полинуклеотид, являются также объектом изобретения, и для продуцирования нуклеотидов, витаминов и прежде всего L-аминокислот, наиболее предпочтительно L-лизина и L-триптофана, их можно культивировать непрерывно или периодически с использованием периодического процесса (культивирование партий) или периодического процесса с подпиткой либо периодического процесса с повторяющейся подпиткой. Обзор известных методов культивирования представлен в учебнике Chmiel (Bioprozesstechnik 1. Einfuhrung in die Bioverfahrenstechnik (изд-во Gustav Fischer, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (изд-во Vieweg, Braunschweig/Wiesbaden, 1994)).
Используемая культуральная среда должна быть соответствующим образом адаптирована к требованиям конкретного штамма. Описания культуральных сред для различных микроорганизмов содержатся в справочнике "Manual of Methods for General Bacteriology" Американского общества бактериологии (Washington D.C., США, 1981). В качестве источника углерода могут быть использованы сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, крахмал и целлюлоза, масла и жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти вещества могут применяться по отдельности или в виде смеси. В качестве источника азота могут применяться органические азотсодержащие соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкость, образующаяся после замачивания зерен кукурузы до разбухания, соевая мука и мочевина, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота могут применяться по отдельности или в виде смеси. В качестве источника фосфора могут применяться фосфорная кислота, кислый фосфат калия или дикалийгидрофосфат, либо соответствующие натриевые соли. Кроме того, культуральная среда должна содержать соли металлов, такие как сульфат магния или сульфат железа, которые необходимы для роста. Помимо этого, в дополнение к вышеназванным соединениям могут использоваться такие важные для роста вещества, как аминокислоты и витамины. Кроме того, в культуральную среду могут быть добавлены соответствующие предшественники. Вышеуказанные добавки могут быть введены в культуральную среду в виде одноразовой добавки или добавляться соответствующим образом в процессе культивирования.
Для контроля значения рН культуральной среды используют соответственно либо основания, такие как гидроксид натрия, гидроксид калия, аммиак, соответственно аммиачная вода, либо кислоты, такие как фосфорная кислота или серная кислота. Для контроля пенообразования добавляют антивспениватели, такие как полигликолевые эфиры жирных кислот. Для поддержания стабильности плазмид могут быть добавлены соответствующие конкретной среде вещества, обладающие избирательным действием, например антибиотики. Для поддержания аэробных условий в культуру вводят кислород или содержащие кислород газовые смеси, например воздух. Температура культуральной среды в норме находится в диапазоне от 20°С до 45°С, предпочтительно от 25°С до 40°С. Культивирование продолжают до тех пор, пока не образуется максимальное количество лизина. Как правило, эта цель достигается за 10-160 ч.
Интенсивность метаболизма в пентозофосфатном цикле определяют, например, с использованием культуры, содержащей в качестве источника углерода глюкозу, меченную с помощью 13С в положении С-1. Этот аналитический метод основан на том известном факте, что когда глюкоза катаболизируется в пентозофосфатном цикле, атом углерода в положении С-1 превращается в двуокись углерода, тогда как, если она катаболизируется путем гликолиза, 13С из положения С-1 переносится в положение С-3 пирувата. Для исследования внеклеточных метаболитов, таких как лактат и прежде всего лизин, через определенный промежуток времени определяют с помощью ядерного магнитного резонанса или масс-спектроскопии содержание 13С в положении С-3 пирувата. В альтернативном варианте из биомассы путем кислотного гидролиза могут быть получены аминокислоты и затем может быть определено содержание 13С в отдельных положениях атомов углерода в конкретной аминокислоте. Соответствующие указания, касающиеся, в частности, оценки с помощью компьютера содержания 13С в различных положениях атомов углерода в исследуемых метаболитах, можно найти у Sonntag и др. (European Journal of Biochemistry 213, 1325-1331 (1993)), у Sonntag и др. (Applied Microbiology and Biotechnology 44, 489-495 (1995)), у Marx и др. (Biotechnology and Bioengineering 49, 111-129 (1996)) и у Marx и др. (Biotechnology and Bioengineering 56, 168-180 (1997)).
Методы определения нуклеотидов, витаминов и L-аминокислот известны. Так, например, анализ L-аминокислот можно проводить с помощью анионообменной хроматографии с последующей дериватизацией с обнаружением нингидрином по методу, описанному у Spackman и др. (Analytical Chemistry, 30, 1190 (1958)), или их можно анализировать с помощью ЖХВР с обращенной фазой, как это описано у Lindroth и др. (Analytical Chemistry 51: 1167-1174 (1979)).
В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung  Mikroorganismen und Zeilkulturen (DSMZ), Брауншвейг, Германия) был депонирован следующий микроорганизм:
Mikroorganismen und Zeilkulturen (DSMZ), Брауншвейг, Германия) был депонирован следующий микроорганизм:
- штамм Escherichia coli DH5α/pMC1 под регистрационным номером DSM 12969.
Примеры
Ниже настоящее изобретение проиллюстрировано на примерах его осуществления. Используемые методы молекулярной биологии, например выделение плазмидной ДНК, обработка рестриктазами, лигирование, стандартная трансформация Escherichia coli и т.д. (если не указано иное), описаны у Sambrook и др. (Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)).
Пример 1
Создание библиотеки гена штамма Corvnebacterium elutamicum AS019
Библиотеку ДНК штамма Corinebacterium glutamicum AS019 (Yoshihama и др., Journal of Bacteryology 162, 591-597 (1985)) конструировали с использованием экспрессионной системы λ Zap Express™ (Short и др., Nucleic Acids Research, 16: 7583-7600 (1988)) по методу, описанному у O'Donohue (O'Donohue M., The Cloning and Molecular Analysis of Four Common Aromatic Amino Acid Biosynthetic Genes from Corynebacterium glutamicum. докторская диссертация, Национальный универститет Ирландии, Голуэй, 1997). Набор λ Zap Express™ был приобретен у фирмы Stratagene (Stratagene, 11011 North Torrey Pines Rd., La Jolla, California 92037) и его применяли согласно инструкциям производителя. ДНК штамма AS019 расщепляли рестриктазой Sau3A и путем лигирования встраивали в расщепленные с помощью BamHI и дефосфорилированные "плечи" λ Zap Express™.
Пример 2
Клонирование и секвенирование гена pgi
1. Клонирование
Штамм Escherichia coli DF1311, несущий мутации в генах pgi и pgl, как описано у Kupor и Fraenkel (Journal of Bacteriology 100: 1296-1301 (1969)), трансформировали с использованием приблизительно 500 нг библиотеки AS019 в плазмиде λ Zap Express™, описанной в примере 1. Отбор трансформантов проводили на минимальной среде М9 (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, США (1989)), содержащей канамицин в концентрации 50 мг/л, и инкубацию проводили в течение 48 ч при 37°С. Из одного трансформанта выделяли плазмидную ДНК по методу, описанному у Birnboim и Doly (Nucleic Acids Research 7:1513-1523 (1979)), и эту плазмиду обозначили как рАМС1 (фиг.1).
2. Секвенирование
Для анализа последовательности клонированной вставки рАМС1 применяли метод, описанный у Sanger и др. (Proceedings of the National Academy of Sciences of the USA, 74:5463-5467 (1977)), с использованием праймеров, дифференциально меченных окрашенной флуоресцентной меткой. Анализ проводили с использованием генетического анализатора типа ABI prism 310 фирмы Perkin Elmer Applied Biosystems (Perkin Elmer Corporation, Норуолк, шт.Коннектикут, США) и набора для секвенирования типа АВ1 prism 310 Big Dye™ Terminator Cycle Sequencing Ready Reaction также фирмы Perkin Elmer.
Первичный анализ последовательности проводили с использованием универсального прямого праймера и обратного праймера М13, полученных от фирмы Pharmacia Biotech (St. Albans, Herts, AL1 3AW, Великобритания):
универсальный прямой праймер: СТА АТА CGA CTC ACT ATA GGG С;
обратный праймер М13: GGA AAC AGC TAT GAC CAT G.
Затем из полученной последовательности конструировали внутренние праймеры, которые позволяли получить полный ген pgi. Внутренние праймеры имели следующие последовательности:
внутренний праймер 1: GGA AAC AGG GGA GCC GTC;
внутренний праймер 2: TGC TGA GAT ACC AGC GGT.
Затем полученную последовательность анализировали с использованием программы Strider для ДНК (Marck, Nucleic Acids Research 16:1829-1836 (1988)), версия 1.0 для компьютера типа Apple Macintosh. Эта программа позволяет проводить такие анализы, как выявление наиболее часто встречающегося сайта рестрикции, анализ открытой рамки считывания и выявление наиболее часто встречающегося кодона. Сравнение полученной последовательности ДНК с последовательностями, находящимися в базах данных EMBL и Genbank, проводили с использованием программы BLAST (Altschul и др.. Nucleic Acids Research, 25:3389-3402 (1997)). Сравнительный анализ последовательностей ДНК и протеина осуществляли с использованием программ Clustal V и Clustal W (Higgins и Sharp, Gene 73:237-244 (1988)).
Полученная таким образом последовательность представлена в виде SEQ ID NO:1. Анализ полученной нуклеотидной последовательности позволил выявить открытую рамку считывания длиной 1650 пар оснований, которую обозначили как ген pgi. Этот ген кодирует протеин, состоящий из 550 аминокислот и представленный в виде SEQ ID NO:2.
Пример 3
Введение мутацие в ген pgi
1. Конструирование дезинтегрирующего вектора pgi
Внутренний сегмент гена pgi амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы геномной ДНК, выделенной из штамма Corynebacterium glutamicum AS019 (Неегу и Dunican, Applied and Environmental Microbiology 59:791-799 (1993)). Использовали следующие праймеры для pgi:
прямой праймер: ATG GAR WCC AAY GGH АА;
обратный праймер: YTC CAC GCC CCA YTG RTC,
где R=A+G, Y=С+Т, W=А+Т, Н=А+Т+С.
Параметры ПЦР были следующими:
35 циклов
при 94°С в течение 1 мин,
при 47°С в течение 1 мин,
при 72°С в течение 30 с,
1,5 мМ MgCl2,
приблизительно 150-200 нг ДНК-матрицы.
Полученный ПЦР-продукт клонировали в коммерчески доступном векторе pGEM-T, предоставленном фирмой Promega Corp.(Promega UK, Southampton), с использованием штамма Е.coli JM109 (Yanisch-Perron и др., Gene, 33:103-119 (1985)) в качестве хозяина. Последовательность ПЦР-продукта представлена в SEQ ID NO:3. Затем клонированную вставку вырезали в виде EcoRI-фрагмента и лигировали с плазмидой pBGS8 (Spratt и др., Gene 41:337-342 (1986)), предварительно обработанной EcoRI. Используемые рестриктазы получали от фирмы Boehringer Mannheim UK Ltd. (Bell Lane, Lewes, East Sussex BN7 1LG, Великобритания) и применяли согласно инструкциям производителя. Затем штамм Е.coli JM109 трансформировали этой полученной в результате лигирования смесью, и трансформанты, полученные с помощью электропорации, отбирали на агаре Луриа, дополненном ИПТГ (изопропил-β-D-тиогалактопиранозид), XGAL (5-бром-4-хлор-3-индолил-В-галактопиранозид) и канамицином в концентрациях 1 мМ, 0,02% и 50 мг/л соответственно. Агаровые пластины инкубировали в течение 12 ч при 37°С. Из одного трансформанта выделяли плазмидную ДНК, определяли ее характеристики с помощью рестрикционного анализа с использованием EcoRI, BamHI и Sall, и эту плазмиду обозначили как рМС1 (фиг.2).
2. Мутагенез путем инсерции гена pgi в штамм DSM 5715
После этого штамм DSM 5715 трансформировали плазмидой рМС1 с использованием метода электропорации, описанного у Liebl и др. (FEMS Microbiology Letters, 53:299-303 (1989)). Отбор трансформантов осуществляли на LBHIS-агаре, содержащем 18,5 г/л бульона, используемого для инфузии в мозг и сердце, 0,5М сорбит, 5 г/л бакто-триптона, 2,5 г/л экстракта бакто-дрожжей, 5 г/л NaCl и 18 г/л бакто-агара и дополненном 15 мг/л канамицина и 1% фруктозы. Инкубацию проводили в течение 2 дней при 33°С. Таким путем получали трансформанты 1, 2 и 3.
Полученные трансформанты тестировали с использованием полимеразной цепной реакции (ПЦР). Для этой цели из полученных трансформантов и из штамма DSM 5715 выделяли хромосомную ДНК согласно способу, описанному у Eikmanns и др. (Microbiology 140:1817-1828 (1994)). На основе последовательности гена pgi, представленной в SEQ ID NO:1, в качестве праймеров были выбраны следующие олигонуклеотиды:
pgi-1: 5'-АСС САС GCT GTC СТА ССТ ТА-3';
pgi-2: 5'-TGT CCC AAA TCA CGC CCT AG-3';
pgi-3: 5'-gat gat age ggc cag tgc at-3'.
Указанные праймеры были синтезированы компанией MWG Biotech (Эберсберг, Германия), а ПЦР проводили с использованием стандартного метода, описанного у Innis и др. (PCR-Protocols. A guide to methods and applications, Academic Press (1990)). В качестве матрицы использовали хромосомную ДНК трансформантов, а в качестве контроля использовали хромосомную ДНК штамма DSM 5715. Каждую матрицу использовали в двух реакциях ПЦР, одну с парой праймеров pgi-1/pgi-2, а другую с парой праймеров pgi-1/pgi-3.
ПЦР-продукты разделяли путем электрофореза на 0,8%-ном агарозном геле. С использованием пары праймеров pgi-1/pgi-2 в каждой из четырех реакций ПЦР получали фрагмент ДНК длиной 0,5 т.п.н. С использованием пары праймеров pgi-1/pgi-3 только в контроле с использованием ДНК штамма DSM 5715 был получен амплифицированный продукт длиной 0,7 т.п.н. В опытах с хромосомной ДНК из трансформантов не было обнаружено продукта ПЦР.
Трансформант №3, охарактеризованный таким образом, был обозначен как штамм DSM5715::pMC1.
Пример 4
Получение лизина
Штамм С.glutamicum DSM5715::pMC1, полученный в примере 3, культивировали в питательной среде, пригодной для продуцирования лизина, и определяли содержание лизина в надосадочной жидкости культуры.
Для этого сначала штамм инкубировали в течение 24 ч при 33°С на агаровой пластине, содержащей соответствующий антибиотик (агар со средой, используемой для инфузии в мозг и сердце и содержащей канамицин (25 мг/л)). Этой выращенной на агаровой пластине культурой инокулировали предварительную культуру (10 мл среды в колбе Эрленмейера объемом 100 мл).
В качестве среды для предварительной культуры использовали полную среду CgIII (Kase и Nakayama, Agricultural and Biological Chemistry 36 (9) 1611-1621 (1972)). В эту предварительную культуру добавляли канамицин (25 мг/л). Предварительную культуру инкубировали в течение 24 ч при 33°С на шейкере при 240 об/мин. Этой предварительной культурой инокулировали основную культуру таким образом, чтобы начальная оптическая плотность (ОП) (измеряемая при длине волны 660 нм) основной культуры была равна 0,1. Для основной культуры использовали среду CGC.
Состав среды CGC:
Значения рН для ЖЗК и раствора солей доводили до 7 с помощью аммиачной воды и автоклавировали. Затем добавляли стерильный субстрат и растворы витаминов.
Культивирование осуществляли, используя объемы среды по 10 мл, находящейся в колбе Эрленмейера объемом 100 мл с дефлекторами. Добавляли канамицин (25 мг/л). Культивирование проводили при 33°С и 80%-ной влажности воздуха.
Через 48 ч определяли оптическую плотность (ОП) при длине волны 660 нм с использованием прибора типа Biomek 1000 (фирма Beckmann Instruments GmbH, Мюнхен). Концентрацию образовавшегося лизина определяли с помощью анализатора аминокислот компании Eppendorf-BioTronik (Гамбург, Германия) с использованием ионообменной хроматографии и последующей дериватизации на колонках с обнаружением нингидрином.
Результаты эксперимента представлены в таблице 1.
Пример 5
Увеличение интенсивности метаболизма в пентозофосфатном пути (ПФП)
Клетки предварительно культивировали в 10 мл среды CGIII (Menkel и др., Applied and Environmental Microbiology 55:684-688 (1989)). Культивирование, для которого использовали встряхиваемые колбы объемом 100 мл, снабженные дефлекторами, проводили в течение 24 ч при начальном значении рН 7,0 при 33°С на шейкере с диаметром вращения 50 мм при 250 об/мин. Клетки промывали 9 г/л NaCl и их использовали для инокуляции основной культуры до оптической плотности при 660 нм, равной 0,1 (прибор типа Biochrom Novaspec 4049, фирма LKB Instrument GmbH, Грефельфинг, Германия, ширина кюветы 10 мм). Основную культуру выращивали в 10 мл среды CGC (Schrumpf и др., Journal of Bacteriology 173:4510-4516 (1991)), модифицированной путем добавления 5 г/л жидкости, образующейся при замачивании зерен кукурузы до разбухания. Кроме того, в среду добавляли 30 г/л [1-13С]декстрозы (эксперимент А) или 15 г/л немеченой декстрозы+15 г/л [6-13С] декстрозы (эксперимент Б). [1-13С]декстрозу (с содержанием 99%) и [6-13С]декстрозу (с содержанием 99%) получали от фирмы Cambridge Isotope Laboratories, Кеймбридж, шт.Массачусетс, США. Культивирование, для которого использовали встряхиваемые колбы объемом 100 мл, снабженные дефлекторами, проводили в течение 72 ч при начальном значении рН 7,0 при 33°С на шейкере с диаметром вращения 50 мм при 250 об/мин. После завершения ферментации определяли оптическую плотность при 660 нм и концентрацию лизина·HCl (аминокислотный анализатор, фирма Eppendorf-BioTronik, Гамбург, Германия). Затем биомассу удаляли центрифугированием при 15000 g и не содержащую клеток надосадочную жидкость сушили замораживанием.
Высушенный порошок повторно растворяли в 1 мл D2O (99,98%, фирма Deutero GmbH, Кастеллаун, Германия) и добавляли в качестве стандарта 3-триметилсилилпропионат-2,2,3,3,d4 (фирма MSD Isotopes, Монреаль, Канада). Спектроскопические исследования ядерным магнитным резонансом с использованием метода изучения спектра спинового эха и дифференциального спектрального анализа проводили с помощью спектрометра типа АМХ 400-WB (фирма Bruker Analytik GmbH, Карлсруэ, Германия) по методу, описанному у Marx и др. (Biotechnology and Bioengineering 49:111-129 (1996)), у Marx и др. (Metabolic Engineering 1:35-48 (1999)) и у Wendisch и др. (Analytical Biochemistry 245:196-202 (1997)). Определяли 13С-обогащение в различных положениях атомов углерода в лизине и, как описано ниже, для оценки уровня метаболизма в пентозофосфатном пути (ПФП) использовали положения, сформулированные у Marx и др. (Biotechnology and Bioengineering 49:111-129(1996)), у Marx и др. (Biotechnology and Bioengineering 56:168-180 (1997)), у Marx и др. (Metabolic Engineering 1:35-48 (1999)), у Sonntag и др. (European Journal of Biochemistry 213:1325-1331 (1993)) и у Sonntag и др. (Applied Microbiology and Biotechnology 44:489-495 (1995)).
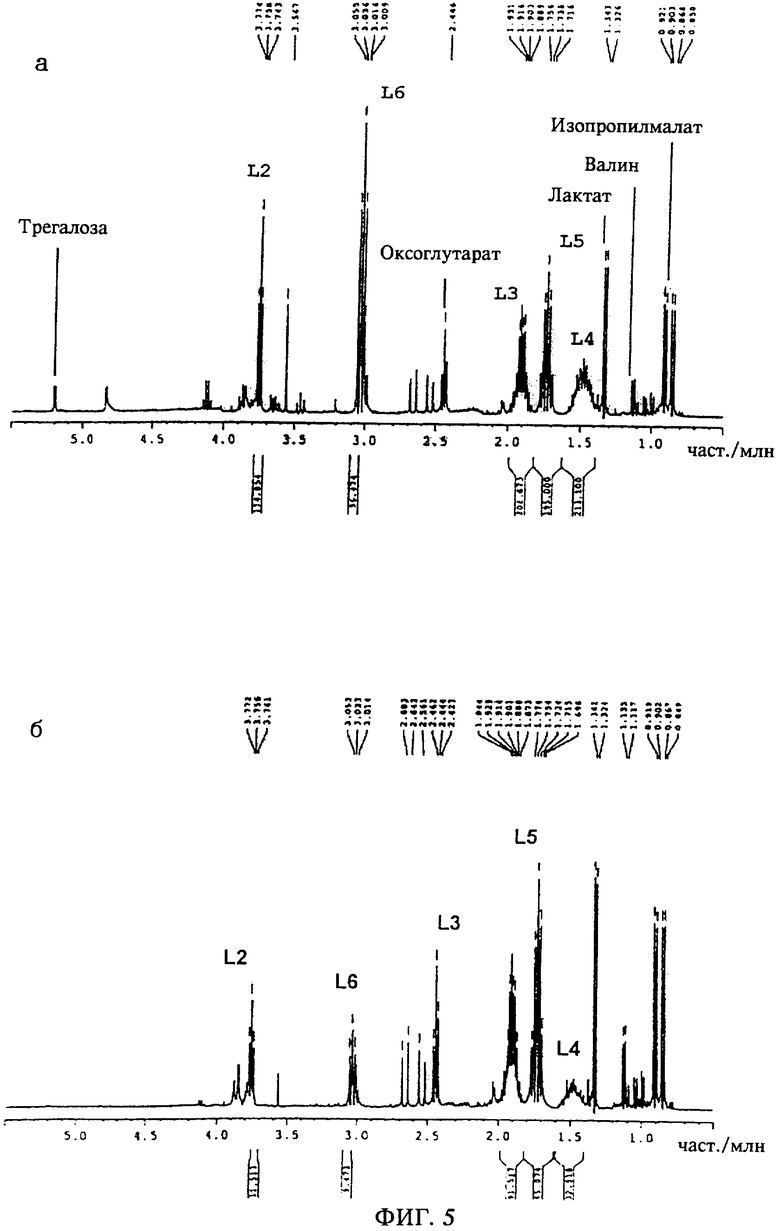
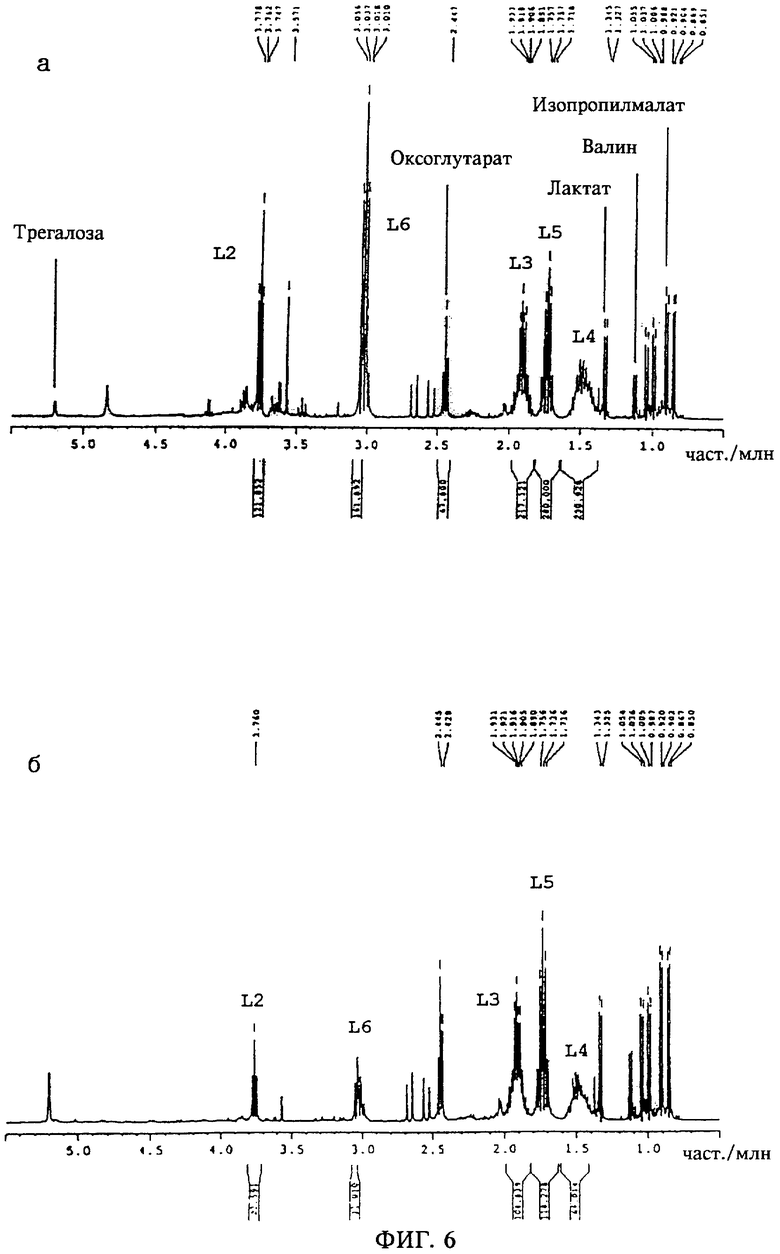
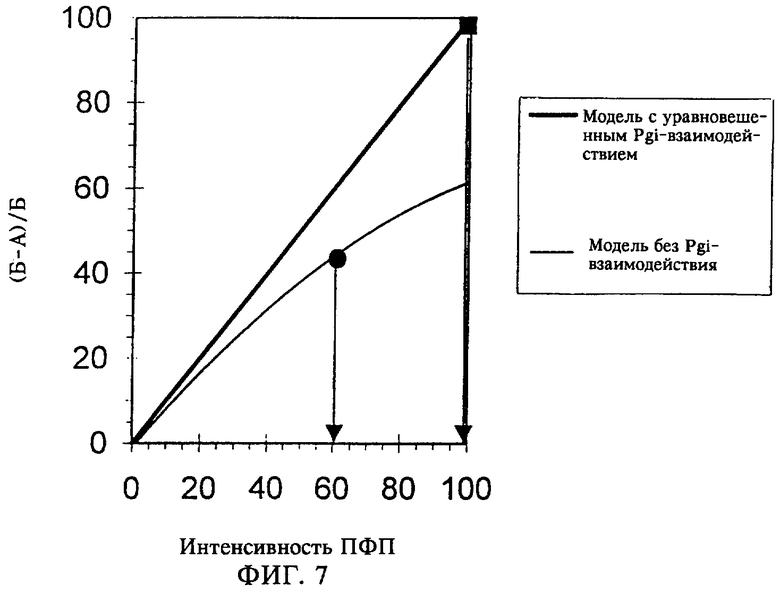
Результаты спектроскопических исследований методом ядерного магнитного резонанса приведены на фиг.3-6. На спектограммах а) представлены интегралы разделенных 13С-спектров. Были получены интегралы дифференциальных спектров, которые представлены на спектограммах б), при этом интегралы, характеризующие 13С-обогащение в конкретных положениях атомов углерода, получали путем деления значения интеграла, приведенного на спектограмме б), на значение интеграла, приведенного на спектограмме а). Для атома углерода в положении С-4 лизина (обозначенного на фиг.3а) и на фиг.3б) как L-4) значение интеграла дифференциального спектра, равное 38,286, делили на значение интеграла разделенного 13С-спектра, равное 198,867, и полученный результат делили на 1,95, что давало величину обогащения, равную 9,9% (таблица 2). Эффективность экспериментов по изучению спектра спинового эха была различной для различных положений атомов углерода в лизине, как это отмечено у Wendisch и др., (Analytical Biochemistry 245:196-202 (1997)), поэтому коэффициент разделения варьировался от 1,80 до 1,99. Результаты, представленные на фиг.3 и 5, получали для условий культивирования, когда в среду добавляли [6-13С] декстрозу (эксперимент Б). Результаты, представленные на фиг.4 и 6, получали для условий культивирования, когда в среду добавляли [1-13С] декстрозу (эксперимент А).
Таблица 2
13С-Обогащение в конкретных положениях атомов углерода в лизине для родительского штамма DSM 5715 и штамма DSM5715::pMC1, содержащего мутантный ген pgi. Положения атомов углерода в лизине обозначены как L-2...L-6 (ср. фиг.3-6). В последней колонке представлена интенсивность метаболизма в пентозо-фосфатном пути, стандартизованная с учетом скорости поглощения декстрозы. В восьмой колонке представлен коэффициент обогащения (Б-А)/Б.
1обогащенная декстроза,
2штамм 1, представляющий собой DSM 5715,
3штамм 2, представляющий собой DSM5715::pMC1,
4к.о. означает коэффициент обогащения (Б-А)/Б.
Для клеток, выращенных в эксперименте А и в эксперименте Б, были получены разные величины 13С-обогащения в соответствующих положениях атома углерода в лизине (таблица 2). В частности, низкий уровень обогащения в положениях С3 и С5 лизина в эксперименте А для штамма DSM5715::pMC1 свидетельствует о высокой интенсивности метаболизма в ПФП. Интенсивность метаболизма в ПФП определяли по соотношению (Б-А)/Б, где А обозначает полное 13С-обогащение в лизине, полученном в эксперименте А, а Б обозначает полное 13С-обогащение в лизине, полученном в эксперименте Б (приведенные ниже уравнение 1, уравнение 2 и уравнение 3; табл.2). Так, например, LYS_2_A означает 13С-обогащение в положении 2 атома углерода в лизине в эксперименте A, a GLC_6_B означает 13С-обогащение в положении 6 атома углерода в декстрозе как субстрате в эксперименте А. При использовании уравнения 3 обогащение стандартизовали путем деления на обогащение в положении С1 декстрозы, равное 99%, и на обогащение в положении С6 декстрозы, равное 49%, в эксперименте А и в эксперименте Б соответственно. Для штамма DSM 5715 данные о 13С-обогащении в трегалозе свидетельствуют о наличии полного равновесия между цитоплазматическими пулами глюкозе-6-фосфата и фруктозо-6-фосфата, что является важным для определения интенсивности метаболизма в ПФП, получаемой по соотношению (Б-А)/Б.
уравнение 1: LYS_A=LYS_2_A+LYS_3_A+LYS_5_A+LYS_6_A - 4,4,
уравнение 2: LYS_Б=LYS_2_Б+LYS_3_Б+LYS_5_Б+LYS_6_Б - 4,4,
уравнение 3: (Б-А)/Б=[LYS_Б.99/(GLC_6_Б - 1,1) -
LYS_A·99/(GLC_1_A - 1,1)]/[LYS_Б·99/(GLC__6_Б - 1,1)].
Путем компьютерного моделирования и с использованием моделей метаболизма, описанных у Marx и др. (Biotechnology and Bioengineering 49:111-129 (1996)), у Marx и др. (Biotechnology and Bioengineering 56:168-180 (1997)), у Marx и др. (Metabolic Engineering 1:35-48 (1999)), у Sonntag и др. (European Journal of Biochemistry 213:1325-1331 (1993)) и у Sonntag и др. (Applied Microbiology and Biotechnology 44:489-495 (1995)), было установлено, что существует гиперболическая или линейная зависимость интенсивности ПФП от коэффициента обогащения (Б-А)/Б для схемы метаболизма, когда присутствует фосфоглюкоизомераза, и является полностью уравновешенной или отсутствует соответственно (фиг.7). Сравнение экспериментальных данных для коэффициента (Б-А)/Б, представленных в таблице 2, с данными, полученными путем компьютерного моделирования, показало, что для родительского штамма DSM 5715 молярная интенсивность метаболизма в ПФП составляет приблизительно 60 молей на 100 молей декстрозы (фиг.5). Это хорошо согласуется с опубликованными в научной литературе данными об интенсивности метаболизма для штамма DSM 5715 (Marx и др., Biotechnology and Bioengineering 49:111-129 (1996); Marx и др., Biotechnology and Bioengineering 56:168-180 (1997); Marx и др., препринты материалов 7-й Международной конференции по применению компьютеров в биотехнологии (Preprints of the 7-th International Conference in Computer Applications in Biotechnology), Осака, Япония, 31 мая - 4 июня 1998 г., стр.387-392; Marx и др., Metabolic Engineering 1:35-48 (1999); Sonntag и др., Applied Microbiology and Biotechnology 44:489-495 (1995)). Для штамма DSM5715::pMC1 было установлено, что молярная интенсивность метаболизма в ПФП составляет 98 молей на 100 молей декстрозы.
Результаты ясно свидетельствуют о том, что в результате мутации, подавляющей ("выключающей") ген pgi, вся интенсивность метаболизма при поглощении декстрозы переключается на ПФП.
Пример 6
Уменьшение образования побочных продуктов
Штаммы DSM5715 и DSM5715::pMC1 культивировали и анализировали в соответствии с примером 5. Анализ спектров, полученных с помощью ЯМР-спектроскопии с использованием надосадочной жидкости культур (фиг.3-6), показал, что концентрации побочных продуктов (например трегалозы, изопропилмалата, лактата, оксоглутарата и валина) для штамма DSM5715::pMC1 были существенно меньше, чем для родительского штамма DSM 5715. Полученные данные обобщены в таблице 3.
Краткое описание чертежей
На фиг.1 представлена карта плазмиды pAMC1.
На фиг.2 представлена карта плазмиды рМС1.
Сокращения и обозначения, использованные на фиг.1 и 2, имеют следующие значения:
Neo r: фрагмент, обусловливающий устойчивость к неомицину/канамицину,
ColEl ori: начало репликации плазмиды ColEl,
CMV: промотор цитомегаловируса,
lacP: промотор лактозы,
pgi: ген фосфоглюкозоизомеразы,
lacZ: 5'-конец гена β-галактозидазы,
SV40 3' splice: 3'-сайт сплайсинга вируса обезьян SV40,
SV40 polyA: сайт полиаденилирования вируса обезьян SV40,
fl(-)ori: начало репликации филаментозного фага f1,
SV40 ori: начало репликации вируса обезьян SV40,
kan r: фрагмент, обусловливающий устойчивость к канамицину,
pgi insert: внутренний фрагмент гена pgi,
ori: начало репликации плазмиды pBGS8,
AccI: сайт рестрикции рестриктазы AccI,
ApaI: сайт рестрикции рестриктазы ApaI,
BamHI: сайт рестрикции рестриктазы BamHI,
ClaI: сайт рестрикции рестриктазы ClaI,
DraI: сайт рестрикции рестриктазы DraI,
EcoRI: сайт рестрикции рестриктазы EcoRI,
HindIII: сайт рестрикции рестриктазы HindIII,
Mlul: сайт рестрикции рестриктазы Mlul,
MstII: сайт рестрикции рестриктазы MstII,
NheI: сайт рестрикции рестриктазы NheI,
NsiI: сайт рестрикции рестриктазы NsiI,
PstI: сайт рестрикции рестриктазы PstI,
PvuII: сайт рестрикции рестриктазы PvuII,
Sacl: сайт рестрикции рестриктазы SacI,
SalI: сайт рестрикции рестриктазы SalI,
SmaI: сайт рестрикции рестриктазы SmaI,
SpeI: сайт рестрикции рестриктазы SpeI,
SspI: сайт рестрикции рестриктазы SspI.
На фиг.3 представлены спектры ядерного магнитного резонанса для штамма DSM5715::pMC1, выращенного на [6-13С] декстрозе. Сокращения: L-2...L-6 относятся к результатам, полученным методом ядерного магнитного резонанса для протонов, связанных с атомами углерода в положениях С-2...С-6 в лизине, при измерениях с 13С-разделением (а) и при обработке результатов измерений спектра спинового эха без 13С-разделения (б).
На фиг.4 представлены спектры ядерного магнитного резонанса для штамма DSM5715::pMC1, выращенного на [1-13С] декстрозе. Сокращения: L-2...L-6 относятся к результатам, полученным методом ядерного магнитного резонанса для протонов, связанных с атомами углерода в положениях С-2...С-6 в лизине, при измерениях с 13С-разделением (а) и при обработке результатов измерений спектра спинового эха без 13С-разделения (б).
На фиг.5 представлены спектры ядерного магнитного резонанса для штамма DSM5715, выращенного на [6-13С] декстрозе. Сокращения: L-2...L-6 относятся к результатам, полученным методом ядерного магнитного резонанса для протонов, связанных с атомами углерода в положениях С-2...С-6 в лизине, при измерениях с 13С-разделением (а) и при обработке результатов измерений спектра спинового эха без 13С-разделения (б).
На фиг.6 представлены спектры ядерного магнитного резонанса для штамма DSM5715, выращенного на [1-13С]декстрозе. Сокращения: L-2...L-6 относятся к результатам, полученным методом ядерного магнитного резонанса для протонов, связанных с атомами углерода в положениях С-2...С-6 в лизине, при измерениях с 13С-разделением (а) и при обработке результатов измерений спектра спинового эха без 13С-разделения (б).
На фиг.7 представлена корреляция между интенсивностью метаболизма в пентозофосфатном пути и коэффициентом обогащения (Б-А)/Б. Путем компьютерного моделирования и с использованием моделей метаболизма, описанных у Marx и др. (Biotechnology and Bioengineering 49:111-129 (1996)), у Marx и др. (Biotechnology and Bioengineehng 56:168-180 (1997)), у Магх и др. (Metabolic Engineering 1:35-48 (1999)), у Sonntag и др. (European Journal of Biochemistry 213:1325-1331) и у Sonntag и др. (Applied Microbiology and Biotechnology 44:489-495 (1995)) было установлено, что корреляция между интенсивностью ПФП и коэффициентом обогащения (Б-А)/Б описывается гиперболической или линейной зависимостью для схемы метаболизма, когда присутствует фосфоглюкоизомераза (Pgi), и является полностью уравновешенной  или отсутствует (-) соответственно. Интенсивность метаболизма в ПФП определяли по соотношению (Б-А)/Б, где А обозначает полное 13С-обогащение в лизине, полученном в эксперименте А, а Б обозначает полное 13С-обогащение в лизине, полученном в эксперименте Б (таблица 2). Полученные в эксперименте значения (Б-А)/Б и соответствующие интенсивности метаболизма в ПФП обозначены для штамма DSM 5715 с помощью символа
или отсутствует (-) соответственно. Интенсивность метаболизма в ПФП определяли по соотношению (Б-А)/Б, где А обозначает полное 13С-обогащение в лизине, полученном в эксперименте А, а Б обозначает полное 13С-обогащение в лизине, полученном в эксперименте Б (таблица 2). Полученные в эксперименте значения (Б-А)/Б и соответствующие интенсивности метаболизма в ПФП обозначены для штамма DSM 5715 с помощью символа  , а для штамма DSM5715::pMC1 символом
, а для штамма DSM5715::pMC1 символом  . Интенсивность метаболизма в ПФП выражена в молях на 100 молей поглощения декстрозы, а коэффициент обогащения (Б-А)/Б указан в процентах.
. Интенсивность метаболизма в ПФП выражена в молях на 100 молей поглощения декстрозы, а коэффициент обогащения (Б-А)/Б указан в процентах.



Изобретение относится к биотехнологии. Описан полинуклеотид, имеющий активность глюкозо-6-фосфатизомеразы и содержащий полинуклеотидную последовательность, выбранную из группы, включающей а) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 90% аминокислотной последовательности, представленной в SEQ ID NO:2, б) полинуклеотид, комплементарный полинуклеотидам, указанным в подпункте а), также описан способ увеличения интенсивности метаболизма в пентозо-фосфатном цикле путем ослабления гена pgi и способ получения L-аминокислот. Данное изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 3 н. и 13 з.п. ф-лы, 7 ил., 3 табл.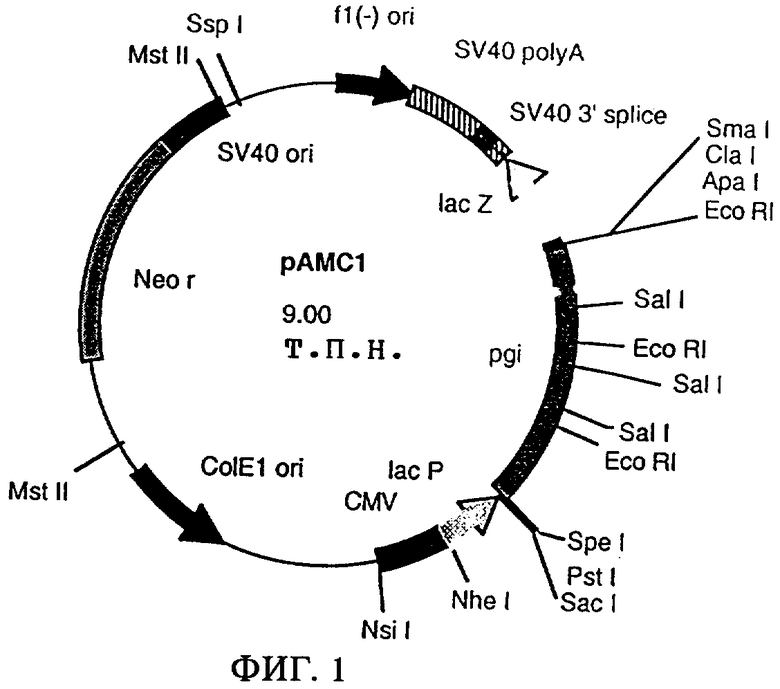
а) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 90% аминокислотной последовательности, представленной в SEQ ID NO:2,
б) полинуклеотид, комплементарный полинуклеотидам, указанным в подпункте а),
причем полипептид имеет активность глюкозо-6-фосфатизомеразы.
| СПОСОБ ОБЛИТЕРАЦИИ ВАРИКОЗНЫХ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ | 2021 |
|
RU2772788C1 |
| Катализатор для получения циклогексана | 1978 |
|
SU733712A1 |
| US 5605818, 25.02.1997 | |||
| ШТАММ БАКТЕРИЙ CORYNEBACTERIUM GLUTAMICUM В-7198-ПРОДУЦЕНТ L-ГЛЮТАМИНОВОЙ КИСЛОТЫ | 1996 |
|
RU2107723C1 |
Авторы
Даты
2005-10-10—Публикация
2000-09-15—Подача