ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области молекулярной биологии и биоинженерии, в частности, к полипептиду с аспартаткиназной активностью, рекомбинантному полипептиду, полинуклеотиду, кодирующему указанный полипептид или указанный рекомбинантный полипептид, конструкции нуклеиновой кислоты, рекомбинантному вектору экспрессии, рекомбинантной клетке-хозяину и способу получения аминокислоты.
УРОВЕНЬ ТЕХНИКИ
Лизин, химическое название которого – 2,6-диаминопимеловая кислота, является незаменимой аминокислотой для организма животных и человека. Его функции включают стимулирование роста, повышение иммунитета и улучшение функции тканей центральной нервной системы. Лизин включает три оптических изомера, а именно, L-форму (левовращающую), D-форму (правовращающую) и DL-форму (рацемическую), из которых только L-форма пригодна для использования с биологической точки зрения, и обычно под лизином подразумевают L-лизин. Лизин известен как первая лимитирующая аминокислота, потому что злаки – основной продукт питания человека – имеют низкое содержание лизина, а недостаток лизина может привести к дисфункции белкового обмена и неблагоприятному влиянию на рост; кроме того, лизин подвержен разрушению во время обработки. Лизин занимает очень важное место в фармацевтике, здравоохранении, пищевой, кормовой и косметической промышленности.
На сегодняшний день существует три метода промышленного производства лизина, а именно, метод протеолиза, метод химического синтеза и метод микробиологической ферментации. Среди них метод микробиологической ферментации имеет такие преимущества, как низкая стоимость, высокая интенсивность производства, высокая специфичность и низкий уровень загрязнения окружающей среды, и поэтому он становится наиболее широко применяемым методом промышленного производства лизина. В промышленном производстве лизина широко используются бактерии Corynebacterium и Escherichia. Например, обычно используемая Escherichia представляет собой Escherichia coli, обычно используемая Corynebacterium включает Corynebacterium glutamicum из рода Corynebacterium, Brevibacterium flavum из рода Brevibacterium, и некоторые виды Arthrobacterium и некоторые виды Microbacterium. Из-за своего физиологического превосходства Corynebacterium glutamicum стал наиболее важным штаммом для производства в промышленности.
Corynebacterium glutamicum имеет два пути биосинтеза лизина, т. е. дегидрогеназный путь и сукцинилазный путь. В синтезе лизина посредством Corynebacterium glutamicum по дегидрогеназному пути участвуют шесть ферментов, катализирующих реакции: аспартаткиназа (AK, кодируется геном lysC), аспартаполуальдегиддегидрогеназа (ASADH, кодируется геном asd), дигидродипиколинатсинтаза (DHDPS, кодируется геном dapA), дигидродипиколинатредуктаза (DHDPR, кодируется геном dapB), диаминопимелатдегидрогеназа (DAPDH, кодируется геном ddh) и диаминопимелатдекарбоксилаза (DAPDC, кодируется геном lysA). В синтезе лизина посредством Corynebacterium glutamicum по сукцинилазному пути участвуют еще четыре фермента для синтеза мезодиаминопимелиновой кислоты: тетрагидродипиколинатсукцинилаза(кодируется геном dapD), N-сукцинилдиаминопимелатаминотрансфераза(кодируется геном dapC), сукцинилдиаминопимелатдеацилаза (кодируется геном dapE) и диаминопимелатэпимераза (кодируется геном dapF). Первойстадией пути биосинтеза L-аспарагиновой кислоты посредством Corynebacterium glutamicum является получение аспартатфосфатазы из L-аспартата, катализируемое аспартаткиназой, что также является лимитирующей стадией получения лизина. Активность аспартаткиназы ингибируется лизином по принципу обратной связи [1]. Поэтому устранение ингибирования аспартаткиназы лизином по принципу обратной связи в пути биосинтеза лизина имеет большое значение для селекции высокопродуктивных штаммов-продуцентов лизина.
В ссылочном документе 1 раскрыты мутанты аспартаткиназы, нечувствительные к ингибированию лизином. Путем случайного мутагенеза гена, кодирующего аспартаткиназу III (аспартаткиназа III, AKIII), выделенного из Escherichia coli, отбирают и получают два мутанта AK III, устраняющих ингибирование по принципу обратной связи, соответственно путем замены треонина изолейцином в положении 352 (T352I) и замены метионина изолейцином в положении 318 (M318I). Хотя эти два мутанта AK III способны устранять ингибирование аспартаткиназы лизином по принципу обратной связи, они не могут обеспечить высокопродуктивные штаммы-продуценты лизина со значительным увеличением выхода лизина из-за их низкой эффективности продукции лизина.
В ссылочном документе 2 раскрыты мутанты аспартаткиназы из Corynebacterium glutamicum, включая 279T, A279V, S301F, T308I, S301Y, G345D, R320G, T311I и S381F. Эти мутантные AK III могут устранять ингибирование аспартаткиназы лизином по принципу обратной связи, но кардинально различаются по обеспечиваемой эффективности продукции лизина. T311I представляет собой мутант, который, как сообщается, обладает наилучшей производительностью при применении для получения лизина и может значительно повысить выход продукции лизина штаммами. Получение мутанта аспартаткиназы, устраняющего ингибирование лизином по принципу обратной связи при одновременном достижении более высокой производительности в отношении продукции лизина, является задачей, требующей решения специалистом в данной области техники.
Ссылочные документы:
Ссылочный документ 1: EP1394257
Ссылочный документ 2: EP1590463A2
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Решаемая задача
Ввиду проблем, присущих уровню техники, таких как проблема, заключающаяся в том, что мутанты аспартаткиназы не могут продуцировать лизин стабильным и высокоэффективным образом, в настоящем изобретении предложен полипептид с аспартаткиназной активностью, который представляет собой мутант аспартаткиназы дикого типа. По сравнению с аспартаткиназой дикого типа мутантный полипептид согласно настоящему изобретению устраняет ингибирование аспартаткиназы лизином по принципу обратной связи, обладает высокой аспартаткиназной активностью и может применяться для стабильного и эффективного получения лизина.
Решение задачи
(1) Полипептид с аспартаткиназной активностью, выбранный из группы, состоящей из любого из (i)-(iv):
(i) мутант полипептида, имеющего последовательность, представленную в SEQ ID NO: 1, где по сравнению с последовательностью, представленной в SEQ ID NO: 1, мутант содержит мутацию по меньшей мере в одном или более положениях, соответствующих положениям 293, 294 и 307 последовательности, представленной в SEQ ID NO: 1;
(ii) полипептид, обладающий по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% идентичностью последовательности с последовательностью, представленной в (i), и не содержащий полипептид, имеющий последовательность, представленную в SEQ ID NO: 1;
(iii) полипептид, кодируемый полинуклеотидом, где полинуклеотид гибридизуется с полинуклеотидом, представленным в (a) или (b), в очень высокожестких условиях:
(a) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, представленную в (i);
(b) полноразмерный полинуклеотид, комплементарный (a);
(iv) фрагмент полипептида, представленного в (i), (ii), (iii), где фрагмент сохраняет аспартаткиназную активность.
(2) Полипептид согласно (1), который представляет собой полипептид, содержащий мутацию, представленную в по меньшей мере одной из следующих групп (c)-(e):
(c) аминокислота в положении, соответствующем положению 293 последовательности, представленной в SEQ ID NO: 1, мутирована из изолейцина (I) в серин (S), глицин (G), глутаминовую кислоту (E), пролин (P), триптофан (W), тирозин (Y), гистидин (H), метионин (M), глутамин (Q), цистеин (C) или аргинин (R);
(d) аминокислота в положении, соответствующем положению 294 последовательности, представленной в SEQ ID NO: 1, мутирована из аспарагиновой кислоты (D) в тирозин (Y), триптофан (W) или фенилаланин (F);
(e) аминокислота в положении, соответствующем положению 307 последовательности, представленной в SEQ ID NO: 1, мутирована из треонина (T) в тирозин (Y), глицин (G) или фенилаланин (F).
(3) Полипептид согласно (1) или (2), который содержит делецию или добавление по меньшей мере одного аминокислотного остатка на N-конце или С-конце полипептида, имеющего последовательность, представленную в (i).
(4) Рекомбинантный полипептид, содержащий полипептид согласно любому из (1)-(3) и экзогенный полипептид, слитый с указанным полипептидом; необязательно где экзогенный полипептид содержит полипептидную метку; предпочтительно где экзогенный полипептид содержит полипептидную метку и спейсерный полипептид, связывающий полипептидную метку с полипептидом с аспартаткиназной активностью.
(5) Выделенный полинуклеотид, содержащий нуклеотидную последовательность, кодирующую полипептид согласно любому из (1)-(3), или содержащий нуклеотидную последовательность, кодирующую рекомбинантный полипептид согласно (4).
(6) Конструкция нуклеиновой кислоты, содержащая полинуклеотид согласно (5), где полинуклеотид функционально связан с одной или более регуляторными последовательностями, при этом регуляторная последовательность управляет продукцией полипептидов в экспрессирующем хозяине.
(7) Рекомбинантный вектор экспрессии, содержащий полинуклеотид согласно (5) или конструкцию нуклеиновой кислоты согласно (6).
(8) Рекомбинантная клетка-хозяин, содержащая полипептид согласно любому из (1)-(3), рекомбинантный полипептид согласно (4), полинуклеотид согласно (5), конструкцию нуклеиновой кислоты согласно (6) или рекомбинантный вектор экспрессии согласно (7).
(9) Рекомбинантная клетка-хозяин согласно (8), которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia; предпочтительно клетка-хозяин представляет собой Corynebacterium glutamicum или Escherichia coli.
(10) Применение полипептида согласно любому из (1)-(3), рекомбинантного полипептида согласно (4), полинуклеотида согласно (5), конструкции нуклеиновой кислоты согласно (6), рекомбинантного вектора экспрессии согласно (7) или рекомбинантной клетки-хозяина согласно (8) или (9) для получения аминокислоты;
предпочтительно где указанная аминокислота выбрана из лизина, треонина, изолейцина и производной из них аминокислоты, где производная аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
(11) Способ получения аминокислоты, включающий стадии получения аминокислоты с помощью полипептида согласно любому из (1)-(3), рекомбинантного полипептида согласно (4), полинуклеотида согласно (5), конструкции нуклеиновой кислоты согласно (6), рекомбинантного вектора экспрессии согласно (7) или рекомбинантной клетки-хозяина согласно (8) или (9);
необязательно где способ дополнительно включает стадию очистки или выделения указанной аминокислоты;
предпочтительно где указанная аминокислота выбрана из лизина, треонина, изолейцина и производной из них аминокислоты, где производная аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
Эффекты
В некоторых вариантах осуществления настоящее изобретение раскрывает мутант аспартаткиназы дикого типа. Указанный мутант устраняет ингибирование аспартаткиназы лизином по принципу обратной связи, обладает высокой аспартаткиназной активностью и может значительно повышать выход лизина при применении для получения лизина и обеспечивать стабильное и высокоэффективное получение лизина. Кроме того, мутант аспартаткиназы согласно настоящему изобретению является высокоэффективным в отношении получения треонина, изолейцина, а также производных аминокислот, таких как пентандиамин, 5-аминовалериановая кислота, глутаровая кислота и гидроксиизолейцин.
В некоторых вариантах осуществления каждый из рекомбинантного полипептида, выделенного полинуклеотида, конструкции нуклеиновой кислоты и рекомбинантного вектора экспрессии согласно настоящему изобретению включает или экспрессирует вышеупомянутый полипептид с аспартаткиназной активностью и применим для получения лизина и его производных.
В некоторых вариантах осуществления рекомбинантная клетка-хозяин, полипептид с аспартаткиназной активностью, устраняющий ингибирование лизином по принципу обратной связи, и рекомбинантная клетка-хозяин согласно настоящей заявке могут накапливать избыточное количество лизина, и, таким образом, они подходят для промышленного производства лизина и его производных.
В некоторых вариантах осуществления за счет использования полипептида с аспартаткиназной активностью, рекомбинантного полипептида или рекомбинантной клетки-хозяина способ получения аминокислоты согласно настоящему изобретению может обеспечивать стабильное и высокоэффективное получение аминокислоты. При применении для получения аминокислот способ согласно настоящему изобретению может обеспечивать высокий выход лизина, треонина, изолейцина и их производных.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
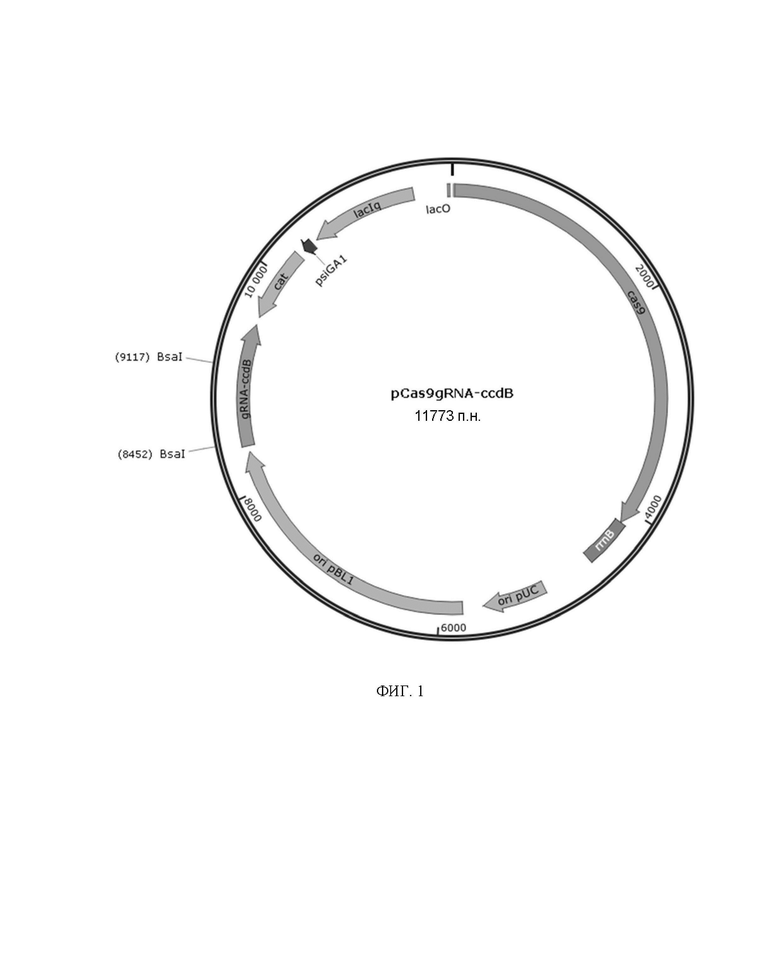
На фиг. 1 представлено схематическое изображение плазмиды pCas9gRNA-ccdB;
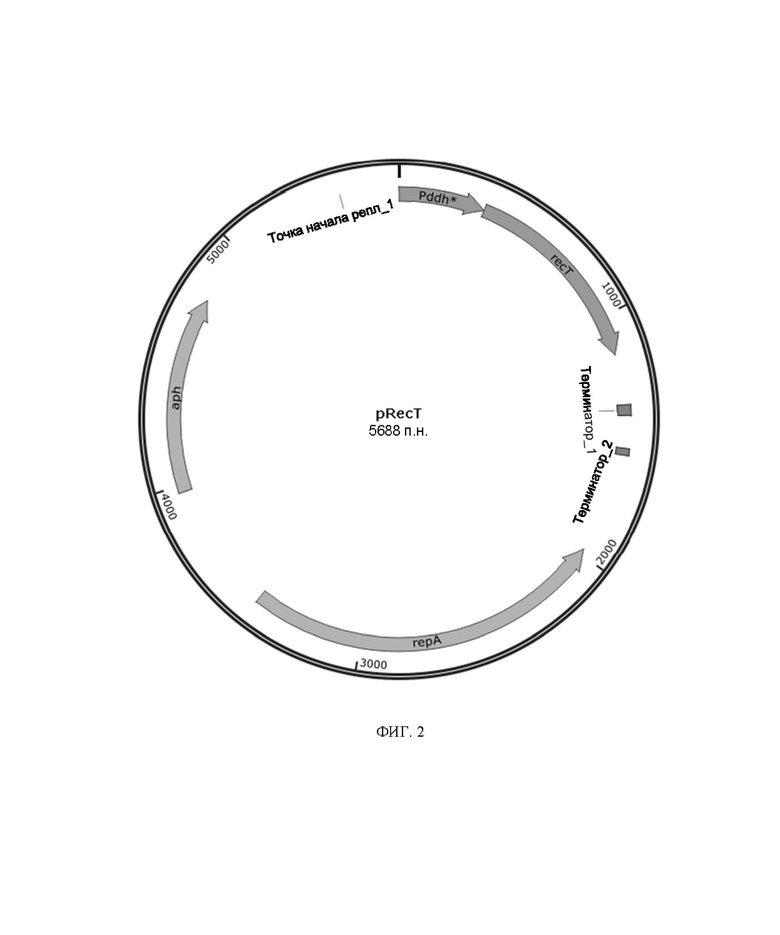
На фиг. 2 представлено схематическое изображение плазмиды pRecT.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения терминов
При использовании в сочетании с термином «включающий» в формуле и/или описании изобретения слово в единственном числе может относиться к «одному» или относиться к «одному или более», «по меньшей мере одному» и «одному или более чем одному».
В контексте формулы и описания изобретения термин «включающий», «имеющий» или «содержащий» подразумевается включающим или открытым и не исключающим дополнительные или неуказанные элементы или способы и стадии.
Во всем тексте заявки термин «приблизительно» означает, что значение включает в себя ошибку или стандартное отклонение, вызванное устройством или методом, используемым для измерения значения.
К содержимому, раскрытому в настоящем документе, применимо, что термин «или» определен только как альтернативы и «и/или», но термин «или» в настоящем документе относится к «и/или», если прямо не указано, что он относится только к альтернативам, или альтернативы являются взаимоисключающими.
Выбранный/необязательный/предпочтительный «числовой диапазон», когда он используется в формуле или описании изобретения, включает не только числовые конечные точки на обоих концах диапазона, но также и все натуральные числа, находящиеся между указанными выше числовыми конечными точками по отношению к этим числовым конечным точкам.
В контексте настоящего документа, хотя может быть использован и другой органический или неорганический катализ, термин «превращение» относится к химическому превращению одной молекулы в другую молекулу, катализируемому главным образом одним или более полипептидами (ферментами); в качестве альтернативы, данный термин может относиться к отношению (в %) молярной массы ожидаемого продукта к молярной массе лимитирующего субстрата.
В контексте настоящего документа термин «аспартаткиназа» и его аббревиатура «AK» относятся к полипептиду (ферменту), который может катализировать фосфорилирование аспарагиновой кислоты в аспартилфосфат. Как первый ключевой фермент пути биосинтеза лизина, аспартаткиназа контролирует путь биосинтеза аминокислот семейства аспартата.
В контексте настоящего документа термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо и представляют собой полимер аминокислот любой длины. Этот полимер может быть линейным или разветвленным. Он может включать модифицированные аминокислоты и может включать вставки неаминокислот. Этот термин также включает полимеры аминокислот, которые уже были модифицированы (например, путем образования дисульфидных связей, гликозилирования, липидизации, ацетилирования, фосфорилирования или любых других манипуляций, таких как конъюгация с меченым компонентом).
В контексте настоящего документа термин «фрагмент» означает полипептид или каталитический или углеводсвязывающий модуль, в котором с аминоконца и/или карбоксиконца зрелого пептида или домена удалена одна или более (например, несколько) аминокислот. Согласно настоящему изобретению фрагмент обладает аспартаткиназной активностью.
В контексте настоящего документа термин «дикий тип» относится к объекту, который встречается в природе. Например, полипептидная или полинуклеотидная последовательность, присутствующая в организме, которая может быть выделена из природного источника и не была преднамеренно модифицирована человеком в лаборатории, является встречающейся в природе. В контексте настоящего документа термины «встречающийся в природе» и «дикий тип» являются синонимами.
Термин «мутант» в контексте настоящего документа относится к полинуклеотиду или полипептиду, включающему изменение(ия) (т. е. замену, инсерцию и/или делецию) в одном или более (например, нескольких) положениях по сравнению с «диким типом» или «сравнительным» полинуклеотидом или полипептидом. Здесь замена относится к замене другого нуклеотида или аминокислоты нуклеотидом или аминокислотой, который(ая) занимает одно положение; делеция относится к удалению нуклеотида или аминокислоты, который(ая) занимает определенное положение; и вставка относится к добавлению нуклеотида или аминокислоты после нуклеотида или аминокислоты, прилегающего(ей) к занятому положению и непосредственно следующего(ей) за ним. Например, «мутант» согласно настоящему изобретению представляет собой полипептид с повышенной аспартаткиназной активностью.
В контексте настоящего документа термин «аминокислотная мутация» или «нуклеотидная мутация» включает «замену, повтор, делецию или добавление одной или более аминокислот или нуклеотидов». В настоящем изобретении термин «мутация» относится к изменению нуклеотидной последовательности или аминокислотной последовательности. В частном варианте осуществления термин «мутация» означает «замену».
В некоторых вариантах осуществления «мутация» согласно настоящему изобретению включает замену аминокислот в одном или более положениях, соответствующих положениям 293, 294 и 307 последовательности, представленной в SEQ ID NO: 1. По сравнению с полипептидом, имеющим последовательность, представленную в SEQ ID NO: 1, мутант с аминокислотной заменой в вышеуказанных положениях устраняет ингибирование ферментативной активности лизином по принципу обратной связи и улучшает степень превращения аспарагиновой кислоты в аспартилфосфат, тем самым повышая продукцию лизина.
В настоящем изобретении «мутация» также включает добавление, делецию или замену аминокислот в одном или более положениях, соответствующих последовательности, представленной в SEQ ID NO: 1, без влияния на аспартаткиназную активность. Известно, что изменение нескольких аминокислотных остатков в какой-либо области полипептида, например, в несущественной области, по существу не повлияет на биологическую активность. Например, последовательность, полученная соответствующей заменой, добавлением или делецией некоторых аминокислот, не будет характеризоваться измененной биологической активностью[2]. Например, «мутация» согласно настоящему изобретению включает делецию или добавление по меньшей мере одного аминокислотного остатка в положении, соответствующем по меньшей мере одному с С-конца и N-конца полипептида, имеющего последовательность, представленную в SEQ ID NO: 1, и мутант обладает аспартаткиназной активностью. В некоторых вариантах осуществления «мутация» согласно настоящему изобретению включает делецию или добавление с С-конца или N-конца полипептида, имеющего последовательность, представленную в SEQ ID NO: 1, от 1 до 20 аминокислот, предпочтительно от 1 до 15 аминокислот, более предпочтительно от 1 до 10 аминокислот, более предпочтительно от 1 до 3 аминокислот и наиболее предпочтительно 1 аминокислоты, и мутант обладает аспартаткиназной активностью.
В некоторых вариантах осуществления «мутация» согласно настоящему изобретению может быть выбрана из «консервативной мутации». Согласно настоящему изобретению термин «консервативная мутация» относится к мутации, при которой сохраняется нормальная функция белков. Типичным примером консервативной мутации является консервативная замена.
В контексте настоящего документа термин «консервативная замена» относится к замене аминокислотного остатка аминокислотным остатком, имеющим схожую боковую цепь. В настоящей области техники определены семейства аминокислотных остатков со схожими боковыми цепями, включая имеющие основные боковые цепи (например, лизин, аргинин и гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженную полярную боковую цепь (например, глицин, аспарагин, глутамин, серин, треонин, тирозин и цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан), β-разветвленные боковые цепи (например, треонин, валин и изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан и гистидин).
В контексте настоящего документа «консервативная замена» обычно включает замену одной аминокислоты в одном или более положениях белка. Такая замена может быть консервативной. Примеры замен, считающихся консервативными заменами, включают замены Ala на Ser или Thr; замены Arg на Gln, His или Lys; замены Asn на Glu, Gln, Lys, His или Asp; замены Asp на Asn, Glu или Gln; замены Cys на Ser или Ala; замены Gln на Asn, Glu, Lys, His, Asp или Arg; замены Glu на Gly, Asn, Gln, Lys или Asp; замены Gly на Pro; замены His на Asn, Lys, Gln, Arg или Tyr; замены Ile на Leu, Met, Val или Phe; замены Leu на Ile, Met, Val или Phe; замены Lys на Asn, Glu, Gln, His или Arg; замены Met на Ile, Leu, Val или Phe; замены Phe на Trp, Tyr, Met, Ile или Leu; замены Ser на Thr или Ala; замены Thr на Ser или Ala; замены Trp на Phe или Tyr; замены Tyr на His, Phe или Trp; и замены Val на Met, Ile или Leu. Кроме того, консервативная мутация также включает естественные мутации, возникающие из-за индивидуальных различий, а также различий между штаммами или видами, от которых происходят гены.
В контексте настоящего документа термин «рекомбинантный полипептид» относится к экспрессии слияния двух или более полипептидов с помощью генно-инженерного подхода. В некоторых вариантах осуществления рекомбинантный полипептид представляет собой рекомбинантный полипептид, полученный путем слияния мутанта полипептида, имеющего последовательность, представленную в SEQ ID NO: 1, с экзогенным полипептидом. В некоторых вариантах осуществления экзогенный полипептид содержит полипептидную метку. В некоторых вариантах осуществления экзогенный полипептид содержит полипептидную метку и спейсерный полипептид, связывающий мутант с полипептидной меткой. В частности, спейсерный полипептид может иметь менее 10 спейсерных аминокислотных остатков.
Например, полипептидная метка представляет собой полипептид, имеющий последовательность метки, представленную в таблице 1.
Таблица 1. Последовательность метки
В некоторых вариантах осуществления рекомбинантный полипептид содержит, от N-конца к С-концу: мутант полипептида, имеющего последовательность, представленную в SEQ ID NO: 1, спейсерный полипептид и полипептидную метку; где полипептидная метка может представлять собой полипептид, имеющий последовательность метки, представленнуюдля His6, спейсерный полипептид имеет менее 10 спейсерных аминокислотных остатков. Например, аминокислотная последовательность спейсерного полипептида представляет собой «LE».
В контексте настоящего документа термин «идентичность последовательностей» или «процент идентичности» при сравнении двух нуклеиновых кислот или полипептидов означает, что при сравнении и выравнивании при максимальном соответствии с помощью алгоритма выравнивания последовательностей или измерения путем визуального осмотра они одинаковы, или у них измерен определенный процент идентичности последовательностей. То есть, идентичность последовательностей нуклеотидов или аминокислотных остатков может быть определена как отношение, которое представляет собой отношение количества нуклеотидов или аминокислотных остатков, которые являются идентичными, к общему количеству нуклеотидов или аминокислотных остатков в двух или большем количестве нуклеотидов или аминокислотных остатков, выровненных таким образом, чтобы они имели максимальное количество идентичных нуклеотидов или аминокислотных остатков, при необходимости с включением гэпов.
Способ измерения «идентичности последовательностей» или «процента идентичности», используемый в настоящем изобретении, включает, не ограничиваясь перечисленным: Lesk, A.M. (Ed.). (1988). Computational Molecular Biology. New York: Oxford University Press.; Smith, D.W. (Ed.). (1993). Biocomputing Informatics and Genome Projects. New York: Academic Press.; Griffin, A.M. & Griffin, H.G. (Ed.). (1994). Computer Analysis of Sequence Data, Part I. New Jersey: Humana Press.; von Heinje G. (1987). Sequence Analysis in Molecular Biology. Academic Press.; Gribskov, M. & Devereux, J. (Ed.). (1991) Sequence Analysis Primer. New York: M Stockton Press.; и Carillo, H. & Lipman, D., SIAM J. Applied Math. 48:1073 (1988). Предпочтительный метод измерения идентичности требует получения максимального соответствия последовательностей. Метод измерения идентичности представлен в общедоступной компьютерной программе. Предпочтительный метод измерения идентичности двух последовательностей, реализуемый с помощью компьютерной программы, включает, не ограничиваясь перечисленным: пакет программ GCG (Devereux, J. et. al., 1984), BLASTP, BLASTN и FASTA (Altschul, S. F. et. al., 1990). Программа BLASTX общедоступна в NCBI и других источниках (Altschul, S. et. al. BLAST Manual. NCBI NLM NIH Bethesda, Md.20894; Altschul, S. et. al., 1990). Для измерения идентичности также может быть использован известный алгоритм Смита-Ватермана.
В некоторых вариантах осуществления полипептид с аспартаткиназной активностью согласно настоящему изобретению обладает по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% «идентичностью последовательности» или «процентом идентичности» аминокислотных остатков с мутантом полипептида, имеющего последовательность, представленную в SEQ ID NO: 1. В некоторых других вариантах осуществления полинуклеотид согласно настоящему изобретению для кодирования полипептида с аспартаткиназной активностью обладает по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% «идентичностью последовательности» или «процентом идентичности» нуклеотидов с полинуклеотидом, кодирующим мутант полипептида, имеющего последовательность, представленную в SEQ ID NO: 1. Определение/вычисление «идентичности последовательностей» или «процента идентичности» может быть основано на любой подходящей области последовательности, такой как область длиной по меньшей мере приблизительно 50 остатков, по меньшей мере приблизительно 100 остатков, по меньшей мере приблизительно 200 остатков, по меньшей мере приблизительно 400 остатков или по меньшей мере приблизительно 500 остатков. В некоторых вариантах осуществления последовательность по существу идентична по всей длине любого одного или двух подлежащих сравнению биополимеров (например, нуклеиновой кислоты или полипептида).
В контексте настоящего документа термин «полинуклеотид» относится к полимеру, состоящему из нуклеотидов. Полинуклеотид может иметь вид отдельного фрагмента или компонента более крупной структуры нуклеотидной последовательности, и он получен из нуклеотидной последовательности, разделенной по меньшей мере один раз по количеству или концентрации, и может быть распознан, подвергнут манипуляциям и восстановлен из последовательности и составляющих его нуклеотидных последовательностей стандартными методами молекулярной биологии (такими как использование клонирующего вектора). Когда нуклеотидная последовательность представлена последовательностью ДНК (т. е. A, T, G, C), это также включает последовательность РНК (т. е. A, U, G, C), где «U» заменяет «T». Другими словами, «полинуклеотид» относится к полимеру нуклеотидов, который был отделен от других нуклеотидов (отдельного фрагмента или целого фрагмента), или может быть составной частью или компонентом более крупной нуклеотидной структуры, такой как вектор экспрессии или полицистронная последовательность. Полинуклеотид включает последовательности ДНК, РНК и кДНК.
В контексте настоящего документа термин «выделенный» относится к веществу в форме или среде, не встречающихся в природе. Неограничивающие примеры выделенных веществ включают (1) любое вещество, не встречающееся в природе, (2) любое вещество, включая, не ограничиваясь перечисленным, любой фермент, мутант, нуклеиновую кислоту, белок, пептид или кофактор, который по меньшей мере частично отделен от одного или более, или всех встречающихся в природе компонентов, связанных с его природой; (3) любое вещество, искусственным образом модифицированное по сравнению с встречающимся в природе веществом; или (4) любое вещество, модифицированное путем увеличения количества вещества относительно других компонентов, связанных с его природой (например, рекомбинантное получение в клетке-хозяине, множественные копии гена, кодирующего вещество, и использование промотора сильнее, чем промотор, естественным образом связанный с геном, кодирующим вещество). Выделенное вещество может присутствовать в образце ферментационного бульона. Например, клетки-хозяева могут быть генетически модифицированы для экспрессии полипептида согласно настоящему изобретению. Образец ферментационного бульона из клеток-хозяев будет содержать выделенные полипептиды. «Рекомбинантный полинуклеотид» относится к «полинуклеотиду».
В контексте настоящего документа термин «рекомбинантный полинуклеотид» относится к полинуклеотиду, имеющему последовательность, не связанную в природе. Рекомбинантный полинуклеотид может быть включен в подходящий вектор, который может быть трансформирован в подходящую клетку-хозяина. Клетка-хозяин, содержащая рекомбинантный полинуклеотид, называется «рекомбинантной клеткой-хозяином». Затем полинуклеотид экспрессируется в рекомбинантной клетке-хозяине с образованием, например, «рекомбинантного полипептида».
В контексте настоящего документа термин «экспрессия» включает любую стадию, относящуюся к продукции полипептидов, включая, не ограничиваясь перечисленным: транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
В контексте настоящего документа термин «вектор экспрессии» относится к линейной или кольцевой молекуле ДНК, содержащей полинуклеотид, кодирующий полипептид, причем полинуклеотид эффективно связан с регуляторной последовательностью для его экспрессии.
В контексте настоящего документа термин «рекомбинантный вектор экспрессии» относится к структуре ДНК для экспрессии, например, полинуклеотида, кодирующего желаемый полипептид. Рекомбинантный вектор экспрессии может включать, например, i) набор генетических элементов, регулирующих экспрессию генов, таких как промотор и энхансер; ii) структуры или кодирующие последовательности, транскрибируемые в мРНК и транслируемые в белки; и iii) субъединицы транскрипции, которые должным образом транскрибируют и транслируют последовательности инициации и терминации. Рекомбинантный вектор экспрессии может быть сконструирован любым подходящим методом. Природа вектора не важна; можно использовать любой вектор, включая плазмиду, вирус, фаг и транспозон. Возможные векторы, используемые в настоящем изобретении, включают, не ограничиваясь перечисленным, хромосомы, ахромосомы и синтезированные фрагменты ДНК, такие как бактериальная плазмида, фаговые ДНК, дрожжевые плазмиды и векторы, полученные из комбинации плазмид и фаговых ДНК, вирусные ДНК из, например, коровьей оспы, аденовируса, оспы птиц, бакуловируса, SV40 и вируса псевдобешенства.
В контексте настоящего документа термин «рекомбинантный ген» относится к генам, которые не встречаются в природе. Рекомбинантный ген включает кодирующую белок последовательность, функционально связанную с последовательностью регуляции экспрессии. Примеры включают, не ограничиваясь перечисленным: экзогенные гены, вводимые в микроорганизмы, последовательности, кодирующие эндогенные белки, функционально связанные с гетерологичным промотором, и гены, имеющие модифицированную последовательность, кодирующую белок. Рекомбинантные гены хранятся в геномах микробиомов, плазмидах в микробиомах или фагах в микробиомах.
В контексте настоящего документа термин «функционально связанный» относится к конструкции, в которой регуляторная последовательность размещена в правильном положении по отношению к кодирующей последовательности полинуклеотида, так что регуляторная последовательность управляет экспрессией кодирующей последовательности. Например, регуляторная последовательность может быть выбрана из последовательности, кодирующей промотор и/или энхансер.
В контексте настоящего документа термин «конструкция нуклеиновой кислоты» включает полинуклеотид, эффективно связанный с подходящей регуляторной последовательностью и кодирующий полипептид, или домен, или модуль, при этом регуляторная последовательность необходима для экспрессии полинуклеотида в выбранных клетках или штаммах. В настоящем изобретении регулятор транскрипции содержит промотор. Кроме того, он может содержать такой элемент, как энхансер, сайленсер и инсулятор.
Термин «клетка-хозяин» в контексте настоящего документа относится к любому типу клеток, которые можно легко трансформировать, трансфицировать или трансдуцировать мутантным полипептидом согласно настоящему изобретению, полинуклеотидом, кодирующим мутантный полипептид, или рекомбинантным вектором экспрессии. Термин «рекомбинантная клетка-хозяин» охватывает клетку-хозяина, которая отличается от родительских клеток после введения полинуклеотида, кодирующего мутантный полипептид, или рекомбинантного вектора экспрессии. Клетка-хозяин согласно настоящему изобретению может быть прокариотической клеткой или эукариотической клеткой при условии, что она является клеткой, в которую можно ввести полинуклеотид, кодирующий полипептид, и рекомбинантный полипептид с аспартаткиназной активностью согласно настоящему изобретению. В одном из вариантов осуществления клетка-хозяин относится к прокариотической клетке. Более конкретно, клетка-хозяин происходит из микробиомов, пригодных для получения аминокислот путем ферментации, таких как род Corynebacterium, род Brevibacterium, род Microbacterium или род Escherichia. Предпочтительно клетка-хозяин происходит от Corynebacterium glutamicum рода Corynebacterium или происходит от Escherichia coli рода Escherichia.
Термины «трансформация, трансфекция, трансдукция» в контексте настоящего документа имеют значение, под которым они обычно понимаются специалистом в данной области техники, т. е. процесс введения экзогенной ДНК в хозяина. Методы трансформации, трансфекции и трансдукции включают любой метод введения нуклеиновой кислоты в клетку. Эти методы включают, не ограничиваясь перечисленным, электропорацию, осаждение с фосфатом кальция (CaPO4), осаждение с хлоридом кальция (CaCl2), микроинъекцию, метод с полиэтиленгликолем (PEG), метод с DEAE-декстраном, метод с катионными липосомами и метод с лития ацетатом в ДМСО.
В настоящем изобретении клетки-хозяева могут быть культивированы общепринятыми методами в данной области техники, включая, не ограничиваясь перечисленным, культуру в луночных планшетах, культуру в шейкере, периодическую культуру, непрерывную культуру, культуру с подпиткой и т. д. Кроме того, различные условия культивирования, такие как температура, время и значение pH среды, могут быть надлежащим образом отрегулированы в соответствии с реальными ситуациями.
В контексте настоящего документа термин «высокожесткие условия» означает, что в соответствии со стандартными процедурами блоттинга ДНК зонд длиной по меньшей мере 100 нуклеотидов подвергается предварительной гибридизации или гибридизации в течение от 12 до 24 часов при 42 °C в 5X SSPE (хлорид натрия-фосфат натрия-ЭДТА), 0,3% SDS, 200 мкг/мл расщепленной и денатурированной ДНК спермы лосося и 50% формамида. Наконец, векторный материал трижды промывают при 65 °C с помощью 2X SSC и 0,2% SDS, каждый раз в течение 15 мин.
В контексте настоящего документа термин «очень высокожесткие условия» означает, что в соответствии со стандартными процедурами блоттинга ДНК зонд длиной по меньшей мере 100 нуклеотидов подвергается предварительной гибридизации или гибридизации в течение от 12 до 24 часов при 42 °C в 5X SSPE (хлорид натрия-фосфат натрия-ЭДТА), 0,3% SDS, 200 мкг/мл расщепленной и денатурированной ДНК спермы лосося и 50% формамида. Наконец, векторный материал трижды промывают при 70 °C с помощью 2X SSC и 0,2% SDS, каждый раз в течение 15 мин.
Если иное не определено или четко не указано в общей информации, все технические и научные термины, используемые в настоящем документе, имеют те же значения, под которыми они обычно понимаются специалистом в области техники, к которой относится настоящее изобретение.
Мутанты аспартаткиназы
В некоторых вариантах осуществления настоящего изобретения создана библиотека мутантов гена LysC, кодирующих аспартаткиназу в Corynebacterium glutamicum, посредством сайт-направленного мутагенеза. Из библиотеки были отобраны мутанты, которые могли устранять ингибирование лизином по принципу обратной связи и, таким образом, повысить аспартаткиназную активность.
В некоторых вариантах осуществления настоящего изобретения положения мутаций в мутантах, устраняющие ингибирование лизином по принципу обратной связи, включают аминокислоты, замененные в одном или более положениях, соответствующих положениям 293, 294 и 307 последовательности, представленной в SEQ ID NO: 1.
Например, мутация в положении 293 включает аминокислоту, мутированную из изолейцина (I) в серин (S), глицин (G), глутаминовую кислоту (E), пролин (P), триптофан (W), тирозин (Y), гистидин (H), метионин (M), глутамин (Q), цистеин (C) или аргинин (R).
Мутация в положении 294 включает аминокислоту, мутированную из аспарагиновой кислоты (D) в тирозин (Y), триптофан (W) или фенилаланин (F).
Мутация в положении 307 включает аминокислоту, мутированную из треонина (T) в тирозин (Y), глицин (G), фенилаланин (F).
В некоторых вариантах осуществления настоящее изобретение относится к полипептиду с аспартаткиназной активностью, обладающему по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% идентичностью последовательности с полипептидом, имеющим последовательность, представленную в SEQ ID NO: 1, и имеющему аминокислотную последовательность, отличную от SEQ ID NO: 1.
В некоторых вариантах осуществления настоящее изобретение относится к полипептиду с аспартаткиназной активностью, включающему добавление или делецию аминокислот по меньшей мере с одного из N-конца и С-конца мутанта аспартаткиназы.
В некоторых частных вариантах осуществления мутант аспартаткиназы имеет делецию или добавление от 1 до 20 аминокислот, предпочтительно от 1 до 15 аминокислот, более предпочтительно от 1 до 10 аминокислот, более предпочтительно от 1 до 3 аминокислот и наиболее предпочтительно 1 аминокислоты по меньшей мере с одного из N-конца и C-конца, и обладает аспартаткиназной активностью.
В некоторых вариантах осуществления настоящее изобретение относится к полинуклеотиду, кодирующему мутант аспартаткиназы, где полинуклеотид кодирует мутант полипептида, имеющего последовательность, представленную в SEQ ID NO: 1. В частности, полинуклеотид представляет собой мутант гена LysC с высокой продукцией лизина, который был отобран из библиотеки мутантов гена LysC. Нуклеотидная последовательность гена LysC представлена в SEQ ID NO: 2.
В некоторых вариантах осуществления соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 293, выбрана из любой из следующих групп: TCC; GGC; GAA; CCA; TGG; TAC; CAC; ATG; CAA; TGC; CGC. Предпочтительно соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 293, выбрана из любой из следующих групп: TCC; GGC; GAA; CCA; TGG; TAC; CAC; ATG; CAA.
В некоторых вариантах осуществления соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 294, выбрана из любой из следующих групп: TAC; TGG; TTC. Предпочтительно соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 294, выбрана из любой из следующих групп: TGG; TTC.
В некоторых вариантах осуществления соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 307, выбрана из любой из следующих групп: TAC; GGC; TTC. Предпочтительно соответствующая нуклеотидная последовательность полинуклеотида, кодирующего аминокислоту в положении 307, выбрана из любой из следующих групп: TAC; GGC.
Конструирование библиотеки мутантов гена LysC
Используя плазмиду pCas9[3] в качестве матрицы и cas9-1/cas9-2 в качестве праймеров для амплификации, амплифицировали амплифицированный фрагмент 1, содержащий Cas9, при этом в праймеры cas9-1/cas9-2 была введена мутация оператора lacO и мутация RBS.
Используя pnCas9(D10A)-AID-gRNA-ccdBTS [4] в качестве матрицы и гРНК-1/гРНК-2 в качестве праймеров для амплификации, амплифицировали амплифицированный фрагмент 2, содержащий кассету экспрессии gRNA-ccdB и термочувствительную точку начала репликации.
Амплифицированный фрагмент 1 и амплифицированный фрагмент 2 были рекомбинантно связаны с получением плазмиды pCas9gRNA-ccdB. Полученная плазмида pCas9gRNA-ccdB имела карту плазмидного вектора, представленную на фиг. 1, и последовательность, представленную в SEQ ID NO: 3.
Используя геном Corynebacterium glutamicum ATCC13032 в качестве матрицы и Pddh-1/ Pddh-2 в качестве праймеров, амплифицировали мутант промотора, содержащий ген ddh, в качестве амплифицированного фрагмента 3.
Используя геном Escherichia coli MG1655 в качестве матрицы и recT-1/recT-2 в качестве праймеров, амплифицировали ген recT в качестве амплифицированного фрагмента 4.
Используя плазмиду pEC-XK99E в качестве матрицы и rrnB-1/rrnB-2 в качестве праймеров, амплифицировали терминатор rrnB в качестве амплифицированного фрагмента 5.
Используя плазмиду pEC-XK99E в качестве матрицы и PEC-1/ PEC-2 в качестве праймеров, амплифицировали фрагмент плазмидного остова, из которого был нокаутирован ген per, в качестве амплифицированного фрагмента 6.
Амплифицированный фрагмент 3, амплифицированный фрагмент 4, амплифицированный фрагмент 5 и амплифицированный фрагмент 6 были рекомбинантно связаны с получением плазмиды pRecT, экспрессирующей RecT. Плазмида pRecT имела карту плазмидного вектора, представленную на фиг. 2, и последовательность, представленную в SEQ ID NO: 5.
Плазмиды pCas9gRNA, нацеленные соответственно на положения 293/294 и 307 гена lysC, были сконструированы методом клонирования Goldengate, где целевая ДНК-связывающая область гРНК-1 представляла собой TGCAGAAATCAACATTGACA, целевая ДНК-связывающая область гРНК-2 представляла собой GCAGGTGAAGGTGATGTCGG. А именно, lysC-F1/lysC-R1, lysC-F2/lysC-R2 денатурировали и отжигали, а затем подвергали клонированию по Goldengate вместе с плазмидой pCas9gRNA-ccdB, соответственно, с получением плазмиды pCas9gRNA-lysC1 и плазмиды pCas9gRNA-lysC2.
Плазмиду pRecT подвергали электротрансформации в Corynebacterium glutamicum ATCC13032 с получением штамма ATCC13032 (pRecT). Были сконструированы одноцепочечные ДНК с 293-1 по 293-9, с 294-1 по 294-9 и одноцепочечные ДНК с 307-1 по 307-9 соответственно в качестве рекомбинационных матриц для конструирования мутантов. Плазмиду pCas9gRNA-lysC1 и одноцепочечные ДНК с 293-1 по 293-9, с 294-1 по 294-9, а также плазмиду pCas9gRNA-lysC2 и одноцепочечные ДНК с 307-1 по 307-9 соответственно вводили в компетентные клетки ATCC13032 (pRecT). Компетентные клетки, трансфицированные плазмидами и одноцепочечными ДНК, соответственно наносили на планшет. Моноклональные штаммы, содержащие аминокислотные мутации в положениях 293, 294, 307, подвергали скринингу с получением библиотеки мутантов гена LysC.
В некоторых вариантах осуществления компетентные клетки, трансфицированные целевой ДНК, добавляли в 1 мл жидкой среды TSB, предварительно нагретой до 46 °C, подвергали тепловому шоку при 46 °C в течение 6 мин, инкубировали при 30 °C в течение 3 ч, наносили на планшеты с TSB, добавляли 5 мкг/мл хлорамфеникола и 0,05 мМ IPTG и инкубировали в течение 2 дней для выращивания сотен клонов, которые подвергали скринингу для получения библиотеки мутантов по аминокислотным положениям 293, 294, 307.
Ингредиенты (г/л) жидкой среды TSB были следующими: глюкоза, 5 г/л; сухие дрожжи, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота 0,5 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин 0,01 мг/л; витамин B1, 0,1 мг/л; МОПС (3-[N-морфолино]пропансульфоновая кислота), 20 г/л. В твердую среду добавляли 15 г/л порошка агара.
Конкретная использованная Corynebacterium glutamicum представляет собой Corynebacterium glutamicum ATCC 13032 (Corynebacterium glutamicum ATCC 13032, Gene ID: 2830649).
Процесс получения аминокислот
(1) Моноклональные штаммы с высоким уровнем продукции лизина подвергали скринингу в библиотеке мутантов гена LysC с аминокислотными мутациями в положениях 293, 294, 307 методом, который воспроизводимо давал результаты скрининга,и использовали в качестве рекомбинантных клеток-хозяев для получения аминокислот.
(2) Рекомбинантные клетки-хозяева подвергали ферментационному культивированию. Аминокислоты собирали из рекомбинантных клеток-хозяев или культурального бульона рекомбинантных клеток-хозяев, тем самым завершая получение аминокислот.
Во время описанного выше процесса получения аминокислот мутантные гены LysC, содержащиеся в рекомбинантных клетках-хозяевах, могли кодировать аспартаткиназу, устраняющую ингибирование лизином. Рекомбинантные клетки-хозяева могли накапливать огромное количество лизина, обеспечивая стабильное и высокоэффективное получение лизина, треонина, изолейцина и их производных.
Что касается полученных аминокислот, полученные аминокислоты выбраны из лизина, треонина, изолейцина и производной из них аминокислоты, где производная из них аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
Что касается рекомбинантных клеток-хозяев, рекомбинантная клетка-хозяин может также содержать другие ферменты, связанные с синтезом аминокислот. Например, ферменты, связанные с синтезом аминокислот, включают комбинацию одного или двух из: аспартаткиназы, аспартатполуальдегиддегидрогеназы, аспартат-аммоний-лиазы, дигидродипиколинатсинтазы, дигидродипиколинатредуктазы, сукцинилдиаминопимелатаминотрансферазы, тетрагидродипиколинатсукцинилазы, сукцинилдиаминопимелатдеацилазы, эпимеразы диаминопимелиновой кислоты, деацилазы диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназы, транспортера лизина, транскетолазы, диаминопимелатдегидрогеназы и пируваткарбоксилазы.
В некоторых вариантах осуществления активность или экспрессия фермента, связанного с синтезом аминокислот, может быть усилена с помощью генной инженерии, например, путем введения сильных промоторов или посредством экспрессии свободными плазмидами для увеличения интенсивности экспрессии генов, кодирующих ферменты, связанные с синтезом аминокислот, или путем хромосомной интеграции для интеграции генов от других видов, кодирующих ферменты, связанные с синтезом аминокислот, обладающие более высокой ферментативной активностью.
В некоторых вариантах осуществления клетка-хозяин представляла собой Corynebacterium glutamicum. В некоторых других вариантах осуществления клетка-хозяин представляла собой Escherichia coli. Оба из Corynebacterium glutamicum и Escherichia coli являются важными штаммами для получения лизина. Путем экспрессии мутанта аспартаткиназы, устраняющего ингибирование лизином по принципу обратной связи в Corynebacterium glutamicum и Escherichia coli, можно реализовать высокоэффективное получение лизина и его производных.
В некоторых вариантах осуществления условия скрининга рекомбинантных клеток-хозяев были следующими: штаммы инокулировали зубочистками в 96-луночный планшет, содержащий 200 мкл ферментационной среды в каждой лунке, и культивировали при 30 °С в течение 24 ч. Скорость вращения планшетного шейкера составляла 800 об/мин.
В некоторых вариантах осуществления условия ферментационного культивирования были следующими: рекомбинантные клетки-хозяева инокулировали в жидкую среду TSB и культивировали в течение 6-8 ч. Культуры инокулировали в виде посевов в 24-луночный планшет, содержащий 600 мкл ферментационной среды в каждой лунке, с исходной OD600 (оптическая плотность при 600 нм), контролируемой на уровне приблизительно 0,1, и культивировали при 30 °C в течение 17 ч. Скорость вращения планшетного шейкера составляла 800 об/мин. Для каждого штамма готовили по три образца. После ферментации измеряли OD600 и выход лизина.
Ингредиенты ферментационной среды были следующими: глюкоза, 80 г/л; сухие дрожжи, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина 8 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,45 г/л; FeSO4·7H2O, 0,05 г/л; биотин 0,4 мг/л; витамин B1, 0,1 мг/л; МОПС, 40 г/л; и начальный рН 7,2.
В некоторых вариантах осуществления для извлечения аминокислот из рекомбинантных клеток-хозяев или культурального бульона рекомбинантных клеток можно использовать обычный метод в данной области техники, включая, не ограничиваясь перечисленным, фильтрацию, анионообменную хроматографию, кристаллизацию и ВЭЖХ.
Ферменты, катализирующие некоторые или все реакции, описанные в настоящем изобретении, могут быть экспрессированы в неприродных, сконструированных гетерологичных организмах. В частности, гены, кодирующие фермент для пути синтеза, могут быть выделены, вставлены в векторы экспрессии организмов, используемых для получения трансформации, и включены в геном, и непосредственно экспрессируют фермент. В данной области техники известен метод подвергания микроорганизмов манипуляциям, например, как описано в Current Protocols in Molecular Biology (Online ISBN: 9780471142720, John Wiley and Sons, Inc.), Microbial Metabolic Engineering: Methods and Protocols (Qiong Cheng Ed., Springer), и Systems Metabolic Engineering: Methods and Protocols (Hal S. Alper Ed., Springer).
Примеры
Дополнительные предметы, признаки и преимущества настоящего изобретения очевидны из последующего подробного описания. Однако следует принимать во внимание, что подробное описание и конкретные примеры (хотя и раскрывающие конкретные варианты осуществления настоящего изобретения) приведены только в иллюстративных целях. На основании подробного описания специалистам в данной области техники станут очевидны различные изменения и модификации в рамках сущности и объема настоящего изобретения.
Все методики эксперимента и методы эксперимента, использованные в примерах, если не указано иное, представляют собой общепринятые методики и методы, например, методы эксперимента, для которых в следующих примерах не указаны конкретные условия, обычно осуществляли в соответствии с общепринятыми условиями, такими как описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989), или рекомендованными производителями. Все материалы, реагенты и т.д., использованные в примерах, если не указано иное, являются коммерчески доступными.
Пример 1. Конструирование библиотеки мутантов гена lysC Corynebacterium glutamicum
Основываясь на последовательности и структурных характеристиках LysC Corynebacterium glutamicum и на понимании авторами изобретения его функций, было высказано предположение, что мутации аминокислот в положениях 293, 294, 307 могут устранять ингибирование лизином по принципу обратной связи LysC и повышать выход L-лизина Corynebacterium glutamicum.
Для быстрой сайт-направленной мутации Corynebacterium glutamicum в настоящем изобретении сначала была создана система редактирования генома CRISPR/Cas9 на основе одноцепочечной рекомбинации. Используя плазмиду pCas9 [3] в качестве матрицы и cas9-1/cas9-2 в качестве праймеров, в праймеры вводили мутацию оператора lacO (TGTGTGGAATTGTGAGCGGATAACAATTTCACACA мутирована в TGTGTGGAATTGTGAGCGCTCACAATTTCACACA) и мутацию RBS (AAAGGAGTTGAGA мутирована в AAAGGCACCCGAT) для амплификации фрагментов, содержащих cas9; затем, используя плазмиду pnCas9(D10A)-AID‐gRNA‐ccdBTS[4] в качестве матрицы и гРНК-1/гРНК-2 в качестве праймеров, амплифицировали фрагмент плазмидного остова, содержащий кассету экспрессии gRNA‐ccdB и термочувствительную точку начала репликации. Вышеупомянутые 2 фрагмента лигировали с помощью набора One Step Cloning Kit от Vazyme для получения высокоэффективно сконструированной плазмиды pCas9gRNA-ccdB. Плазмида имела карту плазмидного вектора, представленную на фиг. 1, и последовательность, представленную в SEQ ID NO: 3. Используя геном Corynebacterium glutamicum ATCC13032 в качестве матрицы и Pddh-1/ Pddh-2 в качестве праймеров, амплифицировали мутантный промотор гена ddh (ATGCATCTC мутирована в ACAAAAGGT), последовательность которого представлена в SEQ ID NO: 4; используя геном Escherichia coli MG1655 в качестве матрицы, амплифицировали ген recT; используя плазмиду pEC-XK99E в качестве матрицы и rrnB-1/rrnB-2 в качестве праймеров, амплифицировали фрагмент терминатора rrnB; используя плазмиду pEC-XK99E в качестве матрицы и PEC-1/ PEC-2 в качестве праймеров, амплифицировали фрагмент плазмидного остова, из которого был нокаутирован ген per. Вышеупомянутые 4 фрагмента лигировали с помощью набора One Step Cloning Kit от Vazyme для получения плазмиды pRecT, экспрессирующей RecT. Плазмида имела карту плазмидного вектора, представленную на фиг. 2, и последовательность, представленную в SEQ ID NO: 5.
Две плазмиды pCas9gRNA, нацеленные соответственно на положения 293/294 и 307 гена lysC, были сконструированы методом клонирования Goldengate[4], описанным в литературе. Целевая ДНК-связывающая область гРНК1 представляла собой TGCAGAAATCAACATTGACA, целевая ДНК-связывающая область гРНК2 представляла собой GCAGGTGAAGGTGATGTCGG. Праймеры lysC-F1/lysC-R1, lysC-F2/lysC-R2 денатурировали и отжигали, соответственно, а затем подвергали клонированию по Goldengate вместе с плазмидой pCas9gRNA-ccdB с получением плазмиды pCas9gRNA-lysC1 и pCas9gRNA-lysC2, соответственно.
На основе системы редактирования генома CRISPR/Cas9 на основе одноцепочечной рекомбинации была сконструирована библиотека мутантов гена lysC в аминокислотных положениях 293, 294 и 307. Плазмиду pRecT подвергали электротрансформации в Corynebacterium glutamicum ATCC13032 с получением штамма ATCC13032 (pRecT). Компетентные клетки [5] получали из штамма ATCC13032 (pRecT) по методике, описанной в литературе. Для осуществления 19 мутаций, отличных от мутаций дикого типа, в аминокислотных положениях 293, 294 и 307 гена lysC, были сконструированы одноцепочечные ДНК с 293-1 по 293-9, с 294-1 по 294-9 и с 307-1 по 307-9 в качестве рекомбинационных матриц для конструирования мутантов. Компетентные клетки ATCC13032 (pRecT) подвергали электротрансформации соответственно 1-2 мкг плазмиды pCas9gRNA-lysC1 и 10 мкг одноцепочечных ДНК эквимолярной концентрации теоретических 19 мутантов с 293-1 по 293-9, 1-2 мкг плазмиды pCas9gRNA-lysC1 и 10 мкг одноцепочечных ДНК эквимолярной концентрации теоретических 19 мутантов с 294-1 по 294-9, и 1-2 мкг плазмиды pCas9gRNA-lysC2 и 10 мкг одноцепочечных ДНК эквимолярной концентрации теоретических 19 мутантов с 307-1 по 307-9, а затем добавляли в 1 мл культуральной среды TSB, предварительно нагретой до 46 °C, подвергали тепловому шоку при 46 °C в течение 6 мин, инкубировали при 30 °C в течение 3 ч, наносили на планшеты с TSB, добавляли 5 мкг/мл хлорамфеникола и 0,05 мМ IPTG и инкубировали в течение 2 дней для выращивания сотен клонов, с получением библиотеки мутантов по аминокислотным положениям 293, 294 и 307, соответственно. Ингредиенты (г/л) жидкой среды TSB были следующими: глюкоза, 5 г/л; сухие дрожжи, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота 0,5 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин 0,01 мг/л; витамин B1, 0,1 мг/л; МОПС, 20 г/л. В твердую среду добавляли 15 г/л порошка агара FO. Последовательности использованных выше праймеров приведены в таблице 2.
Таблица 2
Пример 2. Скрининг и секвенирование библиотеки мутантов гена lysC Corynebacterium glutamicum
Для скрининга библиотеки мутантов гена lysC Corynebacterium glutamicum из библиотеки мутантов отбирали по 60 клонов по каждому из положений 293, 294 и 307 и подвергали ферментации для скрининга мутантов с высоким выходом L-лизина. Ингредиенты ферментационной среды были следующими: глюкоза, 80 г/л; сухие дрожжи, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина 8 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,45 г/л; FeSO4·7H2O, 0,05 г/л; биотин 0,4 мг/л; витамин B1, 0,1 мг/л; МОПС, 40 г/л; и начальный рН 7,2. Штаммы инокулировали зубочистками в 96-луночный планшет, содержащий 200 мкл ферментационной среды в каждой лунке, и культивировали при 30 °С в течение 24 ч. Скорость вращения планшетного шейкера составляла 800 об/мин. После завершения ферментации измеряли выход L-лизина. Все клоны из библиотеки мутантов по положению 293 имели выход выше 0,5 г/л; некоторые клоны из библиотеки мутантов по положению 294 и мутантов по положению 307 имели выход выше 0,5 г/л, что свидетельствует о том, что мутанты с мутациями в вышеуказанных положениях могут устранять ингибирование лизином по принципу обратной связи и повышать продукцию лизина. Мутанты, для которых был получен выход лизина выше 0,5 г/л, и некоторые мутанты из библиотеки мутантов по положению 294 и мутантов по положению 307, не продуцировавших лизин, подвергали секвенированию с помощью ПЦР-амплификации целевой полосы с использованием праймеров lysC-C1/ lysC-C2 (таблица 2). Выход мутантов и результаты секвенирования приведены в таблице 3. Некоторые клоны имели идентичные мутации. Наконец, 11 мутантов были получены из мутантов по положению 293, 6 – из мутантов по положению 294 и 5 – из мутантов по положению 307.
Таблица 3
Примечание:
–: лизин не был продуцирован; +: выход лизина от 0,5 до 1,0 г/л; ++: выход лизина от 1,0 до 2,0 г/л; +++: выход лизина от 2,0 до 3,0 г/л; ++++: выход лизина от 3,0 до 4,0 г/л.
Пример 3. Оценка продукции лизина мутантами гена lysC Corynebacterium glutamicum
Поскольку штаммы, ранее использованные для скрининга мутантов по выходу лизина, включали pRecT и плазмиду pCas9gRNA-lysC1 или pCas9gRNA-lysC2, в этом примере вышеуказанные плазмиды были удалены, и были получены штаммы, имеющие в геноме только мутации, и оценен выход лизина для этих штаммов. Относительно высокопродуктивные со штамма 293-M1 по штамм 293-M9, со штамма 293-M1 по штамм 293-M3, со штамма 307-M1 по штамм 307-M2 культивировали в среде TSB, не содержащей хлормицетин, с удалением двух плазмид, с получением соответственно мутантных штаммов с ZCgLJ1 по ZCgLJ9, с ZCgLJ11 по ZCgLJ13, с ZCgLJ14 по ZCgLJ15 с удаленными плазмидами. С целью сравнения эффектов одновременно было сконструировано огромное количество мутантов lysCT311I, описанных в литературе, которые эффективно устраняют ингибирование лизиномпо принципу обратной связи. Такие штаммы получали путем введения аминокислотной мутации T311I (т. е. оснований, мутированных из ACC в ATC) в ген lysC, кодирующий аспартаткиназу Corynebacterium glutamicum ATCC13032 (ссылочный документ 2). Кроме того, Corynebacterium glutamicum ATCC13032 дикого типа использовали в качестве контрольного штамма (WT). Для оценки продукции лизина штаммами использовали 24-луночный планшет. Штаммы сначала инокулировали в жидкую среду TSB и культивировали в течение 6-8 ч. Культуры инокулировали в виде посевов в 24-луночный планшет, содержащий 600 мкл ферментационной среды в каждой лунке (такой же, как в примере), с исходной OD600, контролируемой на уровне приблизительно 0,1, и культивировали при 30 °C в течение 17 ч. Скорость вращения планшетного шейкера составляла 800 об/мин. Для каждого штамма готовили по три образца. После ферментации измеряли выход лизина. Результаты приведены в таблице 4. Все 11 мутантов с мутацией в положении 293 имели более высокий выход, чем контрольный мутант T311I. Мутанты D294F (штамм ZCgLJ13) с мутацией в положении 294 и мутанты T307G (ZCgLJ15) с мутацией в положении 307 также имели более высокий выход, чем контрольный мутант T311I. Мутации в этих аминокислотных положениях были более перспективны в отношении применения для получения аминокислот и их производных, чем T311I, в частности, при получении лизина, треонина и изолейцина и их производных, таких как пентандиамин, 5-аминовалериановая кислота, глутаровая кислота, гидроксиизолейцин, всем из которых необходим LysC для катализа реакций.
Таблица 4
Все технические признаки, раскрытые в настоящем документе, могут быть объединены в любую комбинацию. Каждый признак, раскрытый в настоящем документе, может быть заменен признаком, выполняющим идентичную, эквивалентную или схожую функцию. Следовательно, если не указано иное, каждый признак, раскрытый в настоящем документе, является просто практическим примером ряда эквивалентных или схожих признаков.
Кроме того, из приведенного выше описания настоящего изобретения специалисту в данной области техники ясно известны ключевые признаки настоящего изобретения. Не выходя за рамки сущности и объема настоящего изобретения, в изобретение может быть внесен ряд изменений для адаптации к различным целям и условиям применения. Следовательно, предполагается, что такие изменения также входят в объем прилагаемой формулы изобретения.
Цитируемые источники
[1] Bearer CF, Neet KE; Stadtman, E. R., Cohen, G. N., LeBras, G., Robichon-Szulmajster, H. (1961). “Feed-back Inhibition and Repression of Aspartokinase Activity in Escherichia coli and Saccharomyces cerevisiae”. J. Biol. Chem.
[2] Watson et. al. (1987) Molecular Biology of the Gene. Fourth Edition. Benjamin/Cummings Pub. Co. P224.
[3] LIU, Jiao, et al. “Development of a CRISPR/Cas9 genome editing toolbox for Corynebacterium glutamicum”. Microbial cell factories, 2017, 16.1: 205.
[4] WANG, Yu, et al. “Expanding targeting scope, editing window, and base transition capability of base editing in Corynebacterium glutamicum”. Biotechnology and bioengineering, 2019, 116: 3016-3029.
[5] Ruan Y, Zhu L, Li Q. “Improving the electro-transformation efficiency of Corynebacterium glutamicum by weakening its cell wall and increasing the cytoplasmic membrane fluidity”. Biotechnol Lett. 2015; 37: 2445–52.
Изобретение относится к биотехнологии и представляет собой полипептид с аспартаткиназной активностью и его применение для получения аминокислоты. Предложен новый полипептид с аспартаткиназной активностью, рекомбинантный полипептид, полинуклеотид, конструкция нуклеиновой кислоты, рекомбинантный вектор экспрессии, рекомбинантная клетка-хозяин и способ получения аминокислоты. Полипептид с аспартаткиназной активностью представляет собой мутант, мутированный в одном или более положениях, соответствующих положениям 293, 294 и 307 аминокислотной последовательности, представленной в SEQ ID NO: 1. По сравнению с полипептидом, имеющим последовательность, представленную в SEQ ID NO: 1, указанный мутантный полипептид устраняет ингибирование аспартаткиназы лизином по типу обратной связи, обладает высокой аспартаткиназной активностью и может применяться для стабильного и эффективного получения аминокислот. 9 н. и 3 з.п. ф-лы, 2 ил., 4 табл., 3 пр.
1. Полипептид с аспартаткиназной активностью, который представляет собой полипептид, содержащий мутацию, представленную в по меньшей мере одной из следующих групп (c)-(e):
(c) аминокислота в положении, соответствующем положению 293 последовательности, представленной в SEQ ID NO: 1, мутирована из изолейцина (I) в серин (S), глицин (G), глутаминовую кислоту (E), пролин (P), триптофан (W), тирозин (Y), гистидин (H), метионин (M), глутамин (Q), цистеин (C) или аргинин (R);
(d) аминокислота в положении, соответствующем положению 294 последовательности, представленной в SEQ ID NO: 1, мутирована из аспарагиновой кислоты (D) в тирозин (Y), триптофан (W) или фенилаланин (F);
(e) аминокислота в положении, соответствующем положению 307 последовательности, представленной в SEQ ID NO: 1, мутирована из треонина (T) в тирозин (Y), глицин (G) или фенилаланин (F).
2. Рекомбинантный полипептид с аспартаткиназной активностью, содержащий полипептид по п. 1 и экзогенный полипептид, слитый с указанным полипептидом; где экзогенный полипептид содержит полипептидную метку.
3. Рекомбинантный полипептид по п. 2, где экзогенный полипептид содержит полипептидную метку и спейсерный полипептид, связывающий полипептидную метку с полипептидом по п. 1.
4. Выделенный полинуклеотид, кодирующий полипептид по п. 1, содержащий нуклеотидную последовательность, кодирующую указанный полипептид.
5. Выделенный полинуклеотид, кодирующий рекомбинантный полипептид по п. 2 или 3, содержащий нуклеотидную последовательность, кодирующую указанный рекомбинантный полипептид.
6. Конструкция нуклеиновой кислоты для экспрессии полипептида по любому из пп. 1-3, содержащая полинуклеотид по п. 4 или 5, где полинуклеотид функционально связан с одной или более регуляторными последовательностями, при этом регуляторная последовательность управляет продукцией полипептидов в экспрессирующем хозяине.
7. Рекомбинантный вектор экспрессии, содержащий полинуклеотид по п. 4 или 5 или конструкцию нуклеиновой кислоты по п. 6.
8. Рекомбинантная клетка-хозяин для продукции аминокислоты, содержащая полипептид по п. 1, рекомбинантный полипептид по п. 2 или 3, полинуклеотид по п. 4 или 5, конструкцию нуклеиновой кислоты по п. 6 или рекомбинантный вектор экспрессии по п. 7,
где указанная аминокислота выбрана из лизина, треонина, изолейцина и производной из них аминокислоты, где производная из них аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
9. Рекомбинантная клетка-хозяин по п. 8, которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia.
10. Рекомбинантная клетка-хозяин по п. 9, где клетка-хозяин представляет собой Corynebacterium glutamicum или Escherichia coli.
11. Применение полипептида по п. 1, рекомбинантного полипептида по п. 2 или 3, полинуклеотида по п. 4 или 5, конструкции нуклеиновой кислоты по п. 6, рекомбинантного вектора экспрессии по п. 7 или рекомбинантной клетки-хозяина по любому из пп. 8-10 для получения аминокислоты,
где указанная аминокислота выбрана из лизина, треонина, изолейцина и производной из них аминокислоты, где производная из них аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
12. Способ получения аминокислоты, включающий стадии экспрессии полипептида по п. 1 или рекомбинантного полипептида по п. 2 или 3 в рекомбинантной клетке-хозяине по любому из пп. 8-10 при помощи конструкции нуклеиновой кислоты по п. 6 или рекомбинантного вектора экспрессии по п. 7, и подвергания указанной клетки-хозяина, экспрессирующей указанный полипептид, ферментационному культивированию с получением указанной аминокислоты,
где способ дополнительно включает стадию очистки или выделения указанной аминокислоты,
где указанная аминокислота выбрана из лизина, треонина, изолейцина и производной из них аминокислоты, где производная из них аминокислота включает по меньшей мере одно из пентандиамина, 5-аминовалериановой кислоты, глутаровой кислоты и гидроксиизолейцина.
| CN 106062176 A, 26.10.2016 | |||
| WO 2004069996 A2, 19.08.2004 | |||
| CN 104099308 B, 31.05.2019 | |||
| US 7345220 B2, 18.03.2008 | |||
| CN 104334728 A, 04.02.2015 | |||
| СПОСОБ ПРОДУЦИРОВАНИЯ АМИНОКИСЛОТ СЕМЕЙСТВА АСПАРТАТА С ИСПОЛЬЗОВАНИЕМ МИКРООРГАНИЗМОВ | 2010 |
|
RU2535973C2 |
Авторы
Даты
2024-06-27—Публикация
2021-09-09—Подача