Данное изобретение имеет отношение к новым ингибиторам протеазы ВИЧ или их депо-формам, способу их получения, фармацевтическим композициям и применению таких соединений в медицине. В частности, соединения являются имитаторами гидроксиэтиламинтрипептидов, которые действуют как ингибиторы аспартилпротеазы ВИЧ, фермента, играющего существенную роль в репликативном жизненном цикле ВИЧ. Следовательно, соединения по данному изобретению могут быть с пользой применены в лечении вызываемой ВИЧ инфекции, или одни, или в комбинации с другими ингибиторами вирусной репликации ВИЧ, или с фармакологическими модификаторами, такими как ингибиторы цитохрома Р450.
Человеческий вирус иммунодефицита ВИЧ является возбудителем синдрома приобретенного иммунодефицита (AIDS), заболевания, характеризующегося разрушением иммунной системы, особенно клеток CD4+Т, с сопутствующей чувствительностью к оппортунистическим инфекциям. Инфекция, вызванная ВИЧ, ассоциирована также с предшественником родственного AIDS комплекса (ARC), синдромом, характеризующимся такими симптомами, как устойчивая генерализованная лимфаденопатия, лихорадка и потеря веса.
Как в случае и других ретровирусов, геном ВИЧ кодирует белковые предшественники, известные как gag и gag-pol, которые при процессинге вирусной протеазы дают протеазу, обратную транскриптазу (RT), эндонуклеазу/интегразу и зрелые структурные белки вирусного кора. Прерывание данного процессинга предотвращает образование обычного инфекционного вируса. Значительные усилия были направлены на то, чтобы контролировать ВИЧ путем ингибирования кодируемых вирусом ферментов. В частности, много усилий было направлено на ингибирование протеазы ВИЧ, и ингибиторы протеазы ВИЧ (Pis) саквуинавир, ритонавир, нелфинавир, индинавир, ампренавир и лопинавир были приняты для лечения инфекций, вызванных ВИЧ. Из-за того что при монотерапии возникает устойчивый вирус, в настоящее время в клинической практике применяют такие ингибиторы протеазы в комбинированной терапии обычно с ингибиторами RT.
Возникновение устойчивого вируса может быть объяснено ошибками, вносимыми обратной транскриптазой ВИЧ, в сочетании с высокой скоростью репликации вируса. Очевидно, что мутации, которые приводят к устойчивому вирусу, происходят спонтанно, но остаются недетектируемыми до тех пор, пока стимулирование терапии не приведет к селективному воздействию на появление вируса с репликативным преимуществом над популяцией дикого типа. В контексте ингибирования протеазы ВИЧ накопление мутаций, которые вызывают снижение связывания ингибитора при поддержании достаточного оборота субстрата, может привести к лекарственной устойчивости. И хотя начало лекарственной устойчивости может быть до некоторой степени отсрочено путем применения комбинаций препаратов, остается необходимость в более эффективных ингибиторах протеазы ВИЧ, которые сохранят активность против вирусов с простой и множественной устойчивостью к ингибиторам протеазы.
Следовательно, цель изобретения состоит в обеспечении новых соединений, которые являются мощными ингибиторами аспартилпротеазы ВИЧ и которые, соответственно, обладают способностью эффективного лечения связанных с ВИЧ заболеваний. Поэтому соединения по изобретению могут также обладать способностью подавлять репликацию вируса, который устойчив к применяемым обычно ингибиторам протеазы.
Данная цель могла быть достигнута с помощью новых соединений общей формулы I
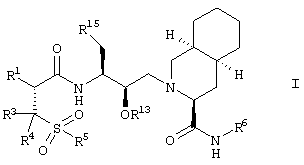
где
R1 означает водород, гидрокси или NHR2,
R2 означает водород, алкил, алкенил, алкинил, арилалкил, гетероциклилалкил, циклоалкилалкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, гетероциклилалкилкарбонил, арилалкилкарбонил, алкилоксикарбонил, арилалкилоксикарбонил, гетероциклилалкилоксикарбонил, арилгетероциклилсульфонил, алкилсульфонил, арилсульфонил, гетероциклилсульфонил или группу формулы
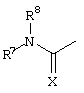
где
Х означает кислород или серу, и
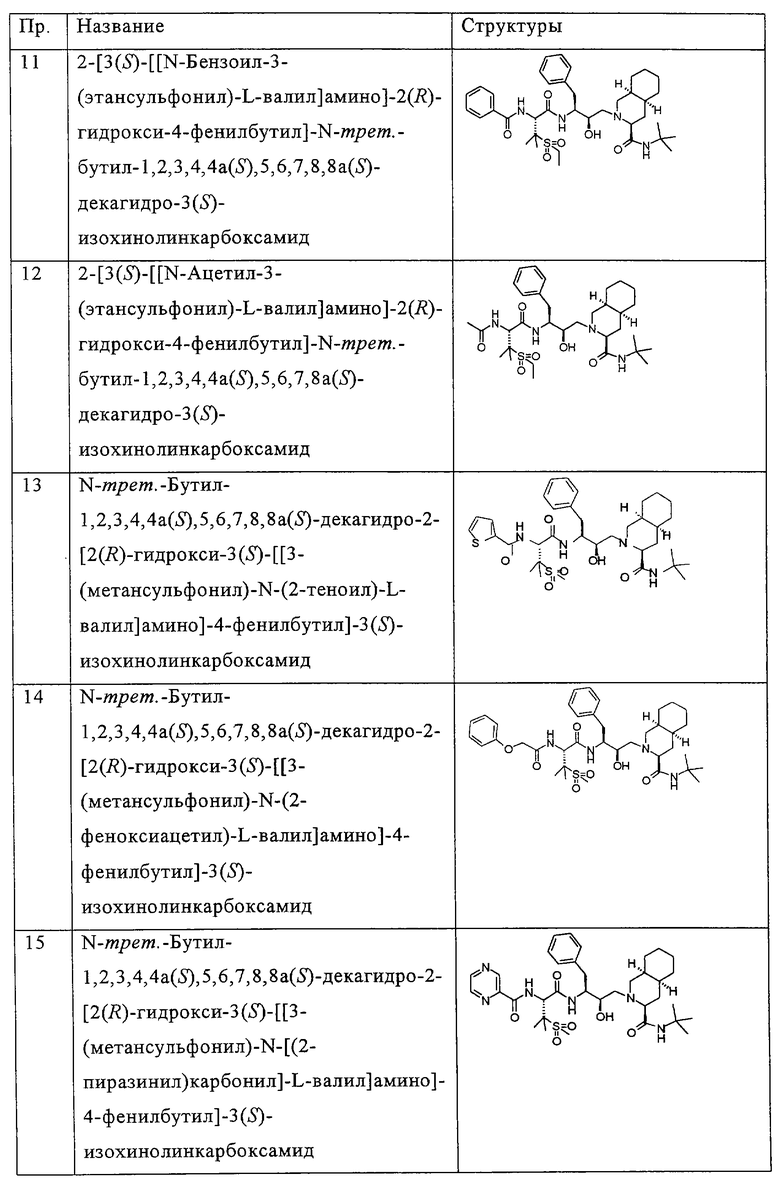
R7 и R8 означают независимо друг от друга водород, алкил, арил, гетероциклил, арилалкил, гетероциклилалкил, или
R7 и R8 образуют вместе с атомом азота, к которому они присоединены, насыщенный цикл, необязательно содержащий дополнительный гетероатом или группу
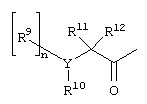
где
n означает 0,
Y означает кислород или серу и
R10 означает водород, алкил, арилалкил, гетероциклилалкил, арил, гетероциклил или
где
n означает 1,
Y означает азот,
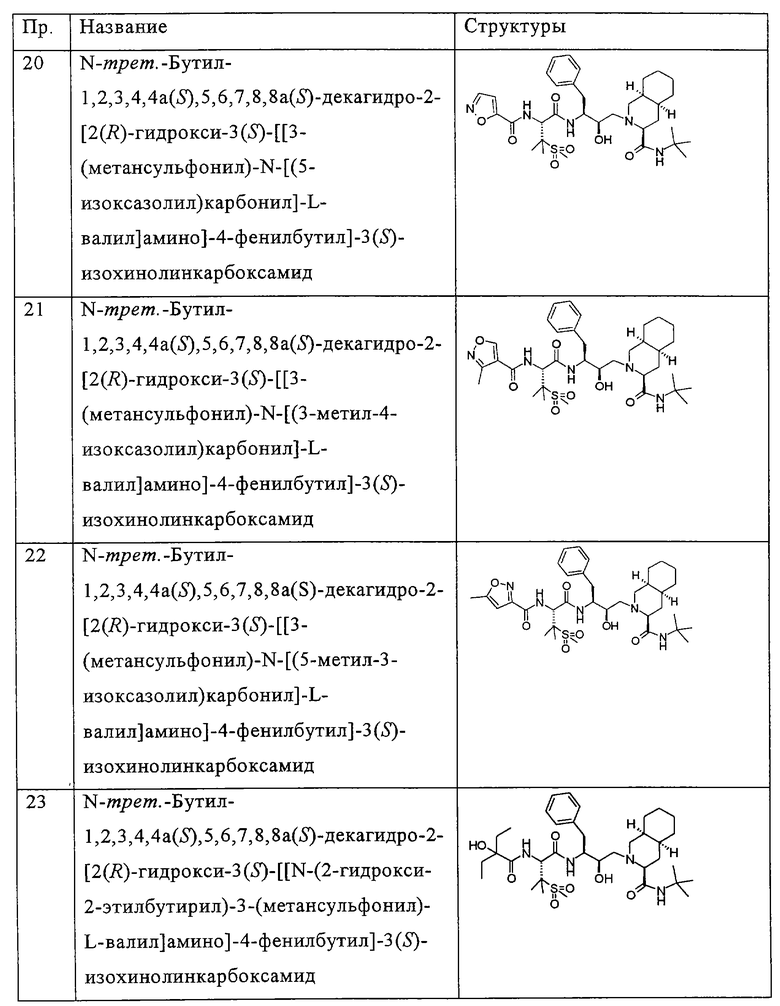
R9 означает водород или алкил, и
R10 означает водород, алкил, арилалкил, гетероциклилалкил, арил, гетероциклил, или
R9 и R10 образуют вместе с гетероатомом, с которым они связаны, гетероцикл,
R11 и R12 означают независимо друг от друга водород или алкил, или
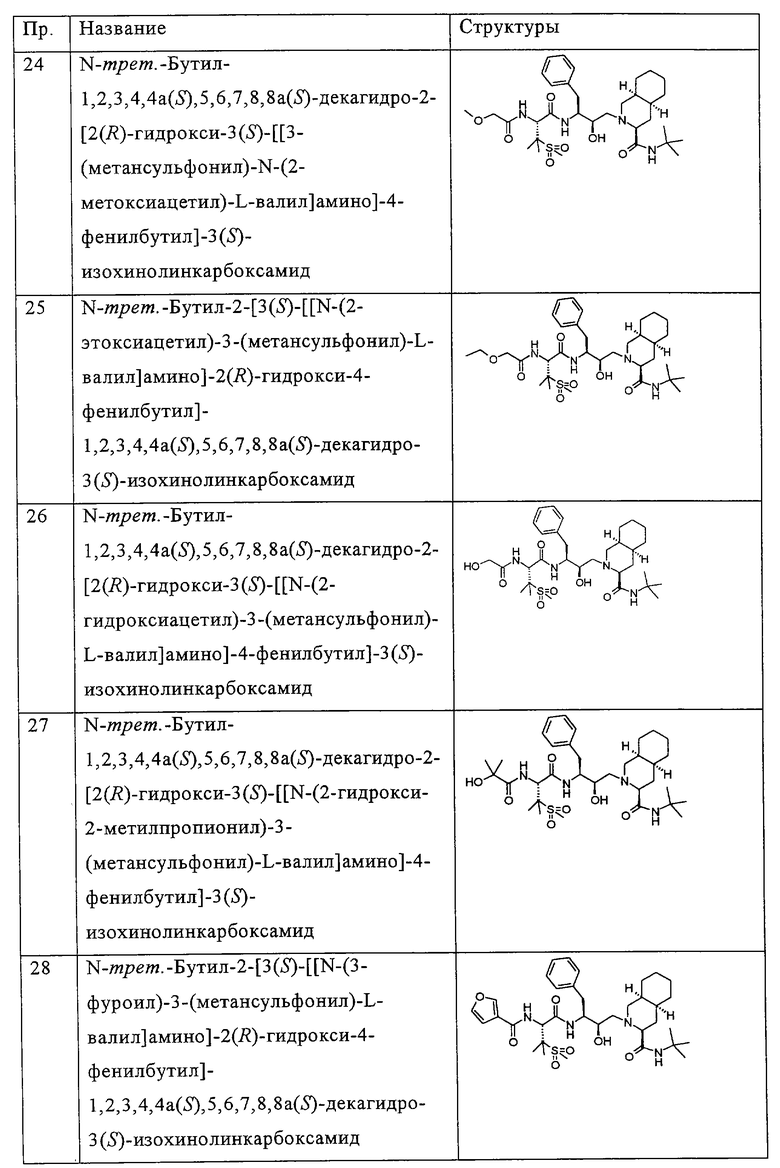
R11 и R12 образуют вместе с атомом углерода, с которым они связаны, цикл,
R3, R4 означают независимо друг от друга алкил или образуют вместе с атомом углерода, с которым они связаны, карбоцикл,
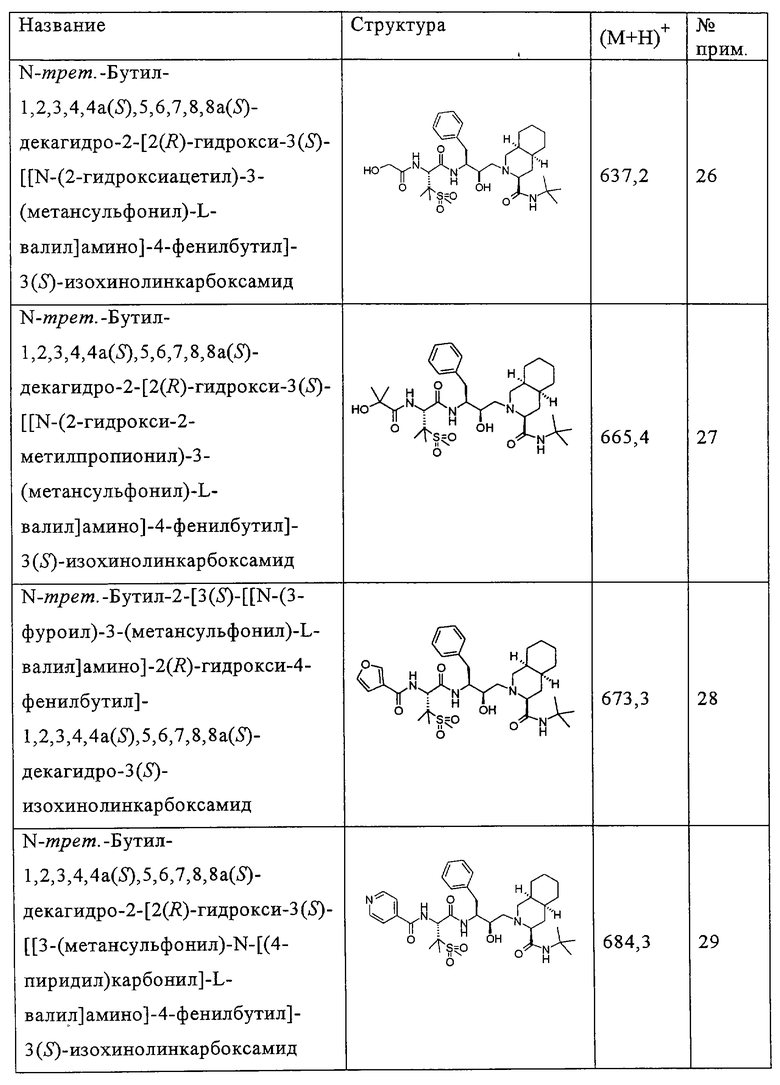
R5 означает алкил, арилалкил, гетероциклилалкил, или
R4 и R5 образуют вместе с атомом углерода или серы, с которым они связаны, гетероцикл,
R6 означает алкил, арилалкил, гетероциклилалкил, алкилоксиалкил, гидроксиалкил, аминоалкил, фторалкил,
R13 означает водород или остаток неорганического или органического сложного эфира,
R15 означает арил,
и их фармацевтически приемлемые соли,
при условии, что если R3, R4 и R5 означают метил, R6 означает трет-бутил, R13 означает водород, и если R15 означает фенил, R2 не означает бензилоксикарбонил и не означает 2-хинолинкарбонил.
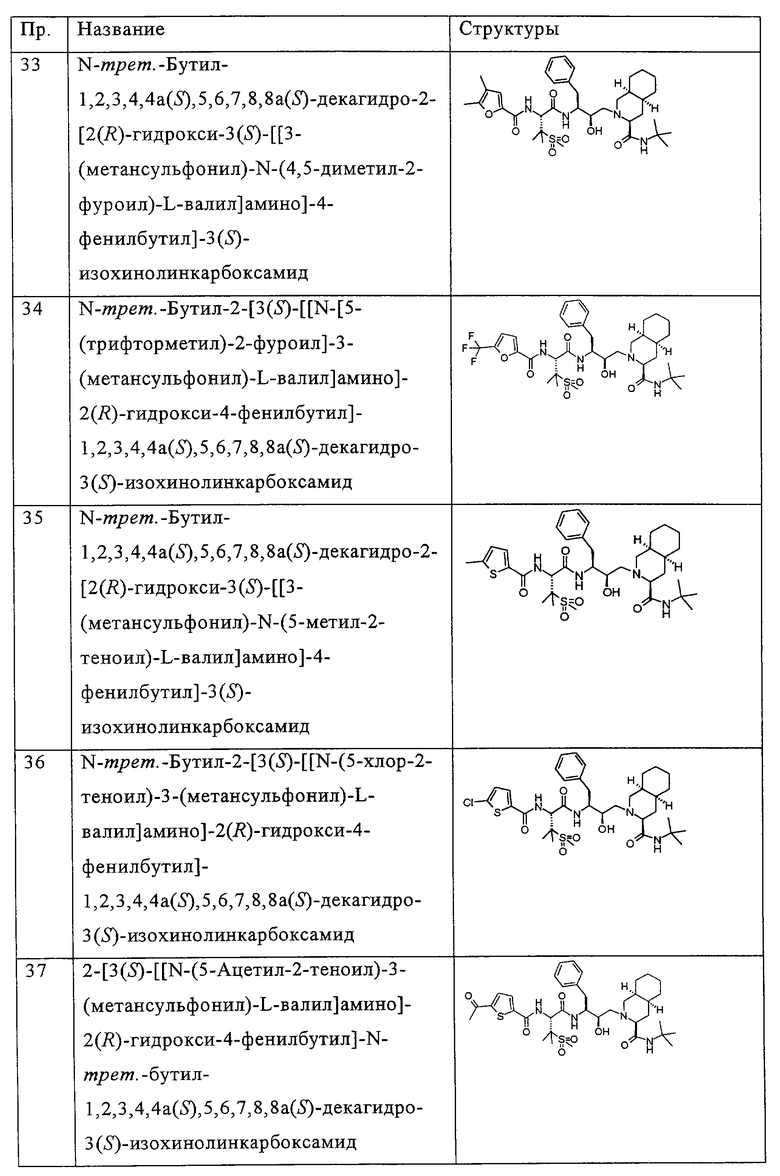
Термин «алкил» определяет необязательно замещенную линейную или разветвленную алкильную цепь, содержащую 1-6 атомов углерода, предпочтительно 1-4 атома углерода.
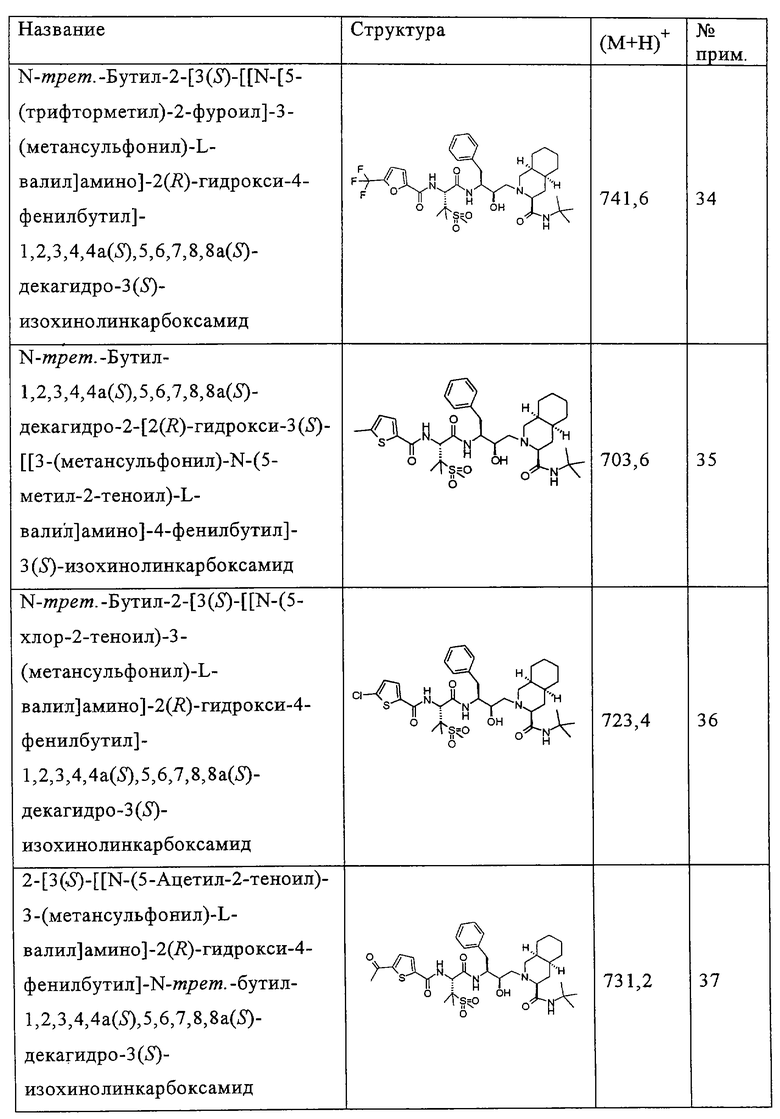
Термин «алкенил» определяет необязательно замещенную линейную или разветвленную алкенильную цепь, содержащую 2-6 атомов углерода, предпочтительно 2-4 атома углерода.
Термин «алкинил» определяет необязательно замещенную линейную или разветвленную алкинильную цепь, содержащую 2-6 атомов углерода, предпочтительно 2-4 атома углерода.
Соответственно алкил предпочтительно означает метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил.
Соответственно алкенил предпочтительно означает винил, 1-пропенил, 2-пропенил, изопропенил и бутенил и его изомеры.
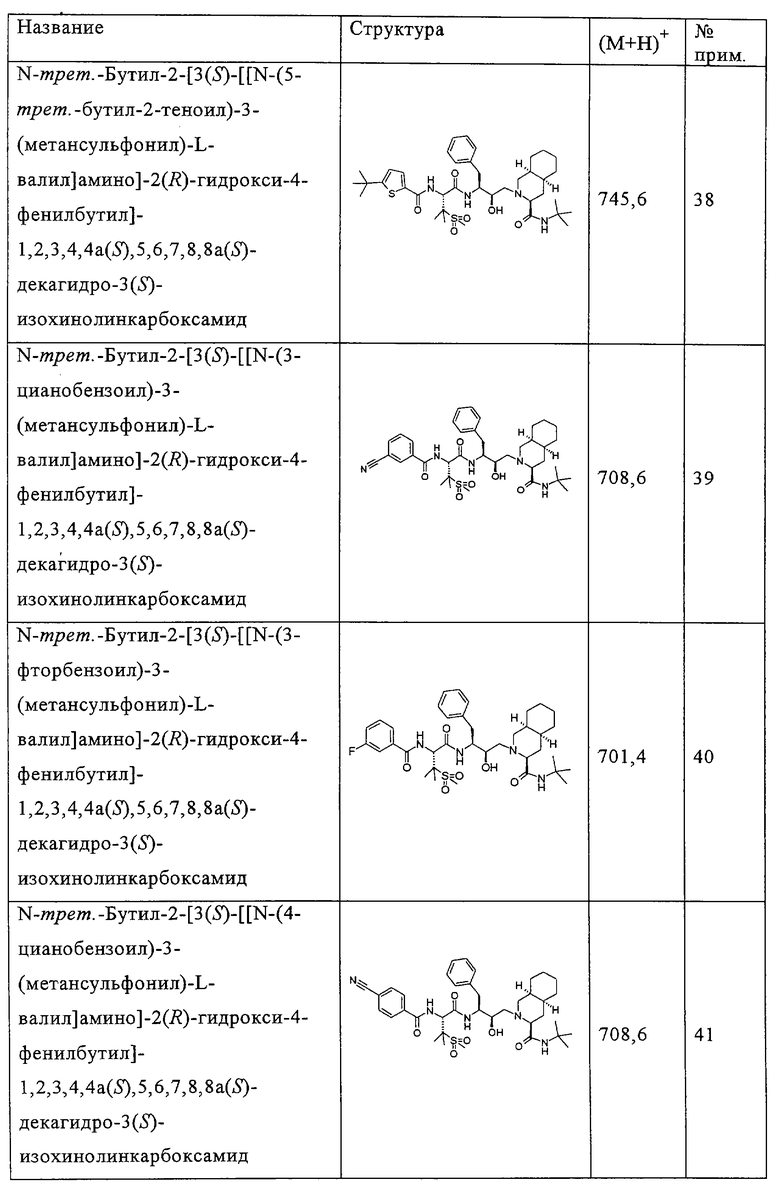
Соответственно алкинил предпочтительно означает этинил, пропинил и его изомеры и бутинил и его изомеры.
Соответствующие один или несколько заместителей алкила, алкенила или алкинила могут быть выбраны из арила, гетероциклила, карбокси, циано, алкокси, циклоалкилокси, арилокси, гетероциклилокси, гидрокси, алкилкарбонила, циклоалкилкарбонила, арилкарбонила, гетероциклилкарбонила, алкоксикарбонила, циклоалкилоксикарбонила, арилоксикарбонила, гетероциклилоксикарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, циклоалкиламинокарбонила, ариламинокарбонила, гетероциклиламинокарбонила, амино, алкиламино, диалкиламино, алкениламино, алкиниламино, циклоалкиламино, ариламино, гетероциклиламино, алкилкарбониламино, диалкилкарбониламино, циклоалкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, циклоалкилоксикарбониламино, арилоксикарбониламино, гетероциклилоксикарбониламино, алкиламинокарбониламино, диалкиламинокарбониламино, циклоалкиламинокарбониламино, ариламинокарбониламино, гетероциклиламинокарбониламино, алкилсульфониламино, циклоалкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, нитро, алкилсульфонила, циклоалкилсульфонила, арилсульфонила, гетероциклилсульфонила, тио, алкилтио, циклоалкилтио, арилтио, гетероциклилтио или галоида.
Во всех упомянутых выше случаях, где есть группы NH, водород может быть также замещен, предпочтительно (низш.)алкилом.
Циклоалкил означает необязательно замещенную циклоалкильную группу, содержащую 3-8 атомов углерода, предпочтительно 3-6 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил или адамантил, которая может быть также бензконденсированной с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим, бициклическим или трициклическим гетероциклом или карбоциклом, например фенилом.
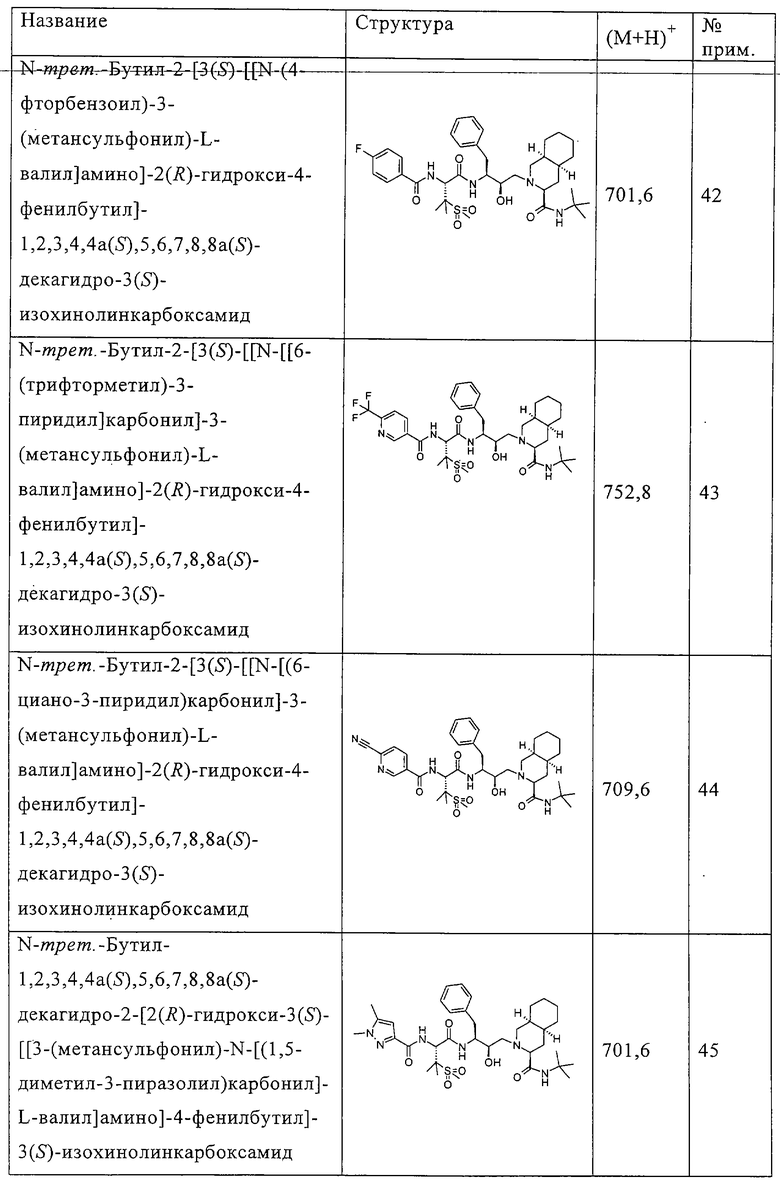
Термин «арил» означает необязательно замещенные фенил или нафтил, оба необязательно бензконденсированные с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим, бициклическим или трициклическим гетероциклом или карбоциклом, например циклогексилом или циклопентилом.
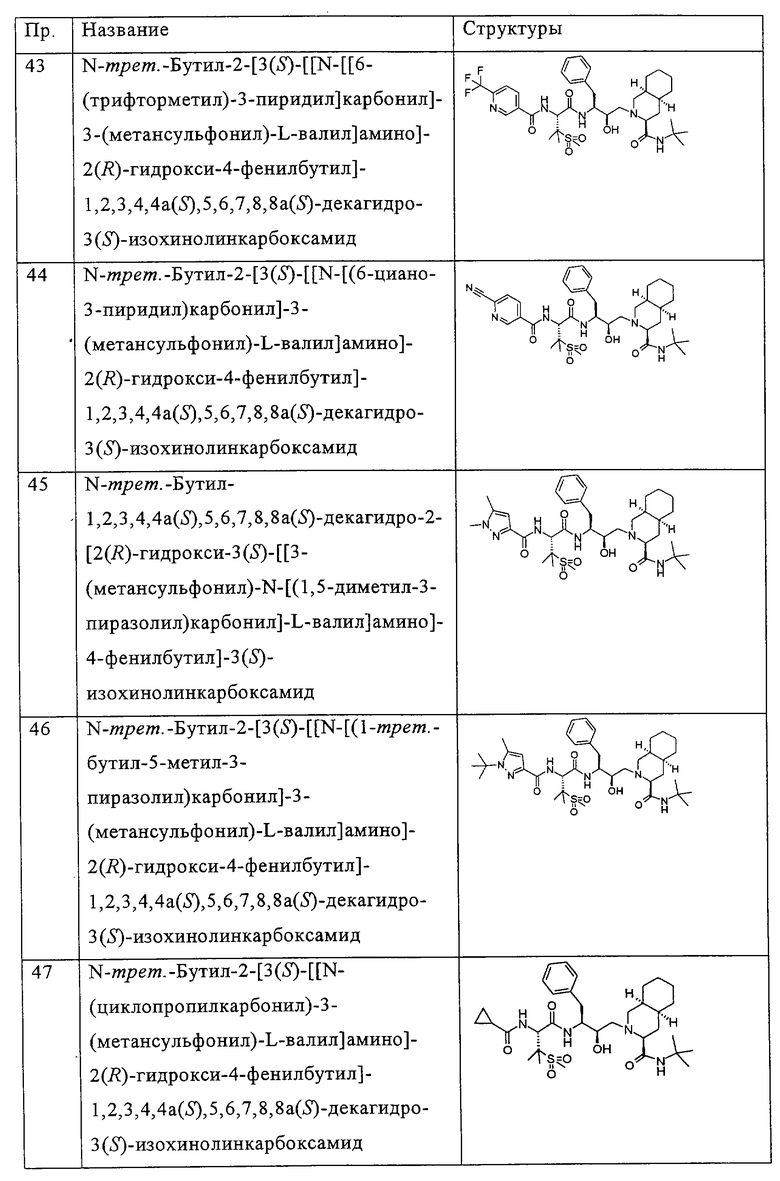
Термин «гетероциклил» означает необязательно замещенный насыщенный, частично ненасыщенный или ароматический моноциклический, бициклический или трициклический гетероцикл, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, который может быть также бензконденсированным с необязательно замещенным, насыщенным, частично ненасыщенным или ароматическим моноциклическим, бициклическим или трициклическим карбоциклом или гетероциклом.
Примерами соответствующих гетероциклов являются оксазолил, изоксазолил, фурил, тетрагидрофурил, 1,3-диоксоланил, дигидропиранил, тиенил, пиразинил, изотиазолил, изохинолинил, индолил, индазолил, хинолинил, дигидрооксазолил, пиримидинил, бензофуранил, тетразолил, пирролидиноил, (N-оксид)пиридинил, пирролил, триазолил, например 1,2,4-триазолил, пиразолил, бензотриазолил, пиперидинил, морфолинил, тиазолил, пиридинил, дигидротиазолил, имидазолидинил, пиразолинил, бензотиенил, пиперазинил, имидазолил, тиадиазолил, например 1,2,3-тиадиазолил и бензотиазолил.
Соответствующие заместители для циклоалкила, арила, гетероциклила могут быть выбраны из тех, которые упомянуты для алкила, однако, кроме выбранных, должны быть добавлены алкильные, алкенильные и алкинильные заместители.
Термин «галоид» означает фтор, хлор, бром или йод.
Термин «остаток эфира неорганической кислоты» означает сульфат формулы -SO2OH или фосфат формулы -РО(ОН)2.
Термин «остаток сложного эфира органической кислоты» означает ацильную группу, как, например, та, которая описана в заявке на европейский патент ЕР А1 0594540 для группы R1.
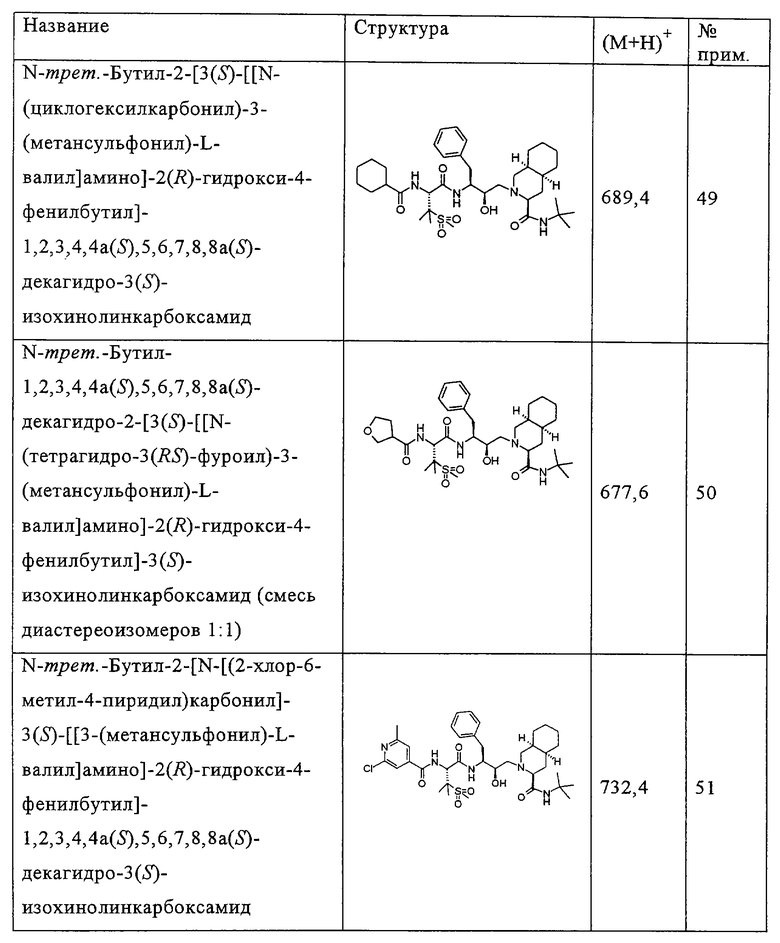
Соответствующие остатки сложных эфиров органических кислот определены в R13 как группа формулы
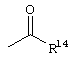
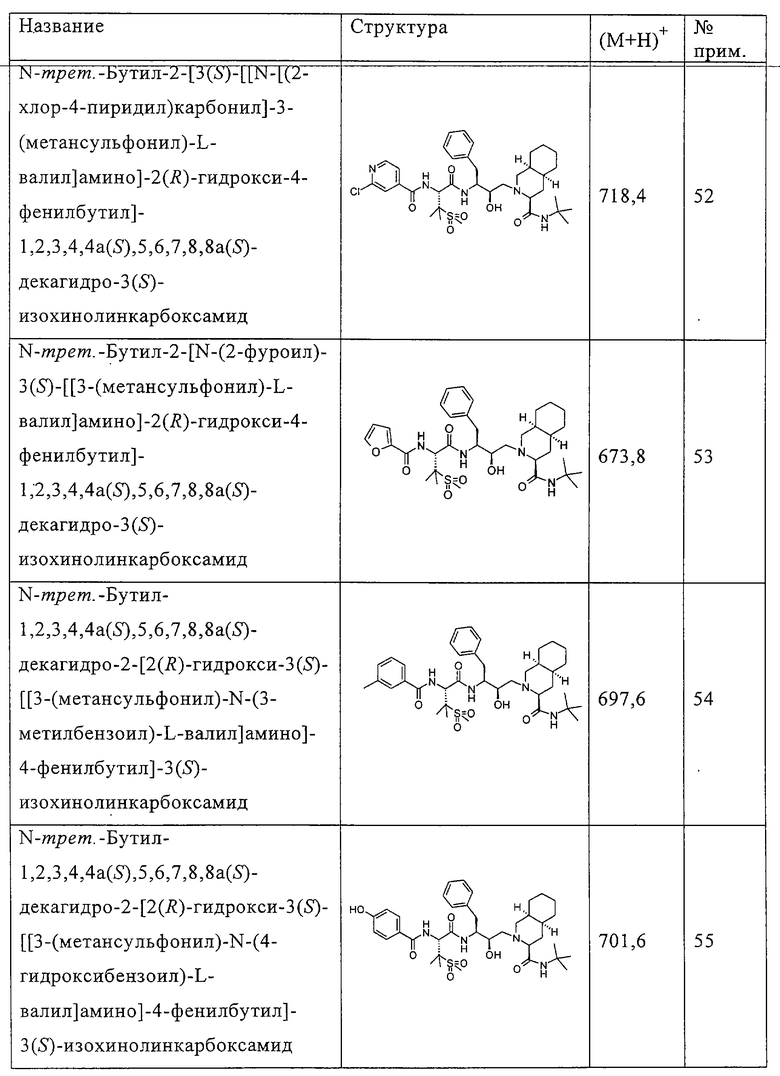
где
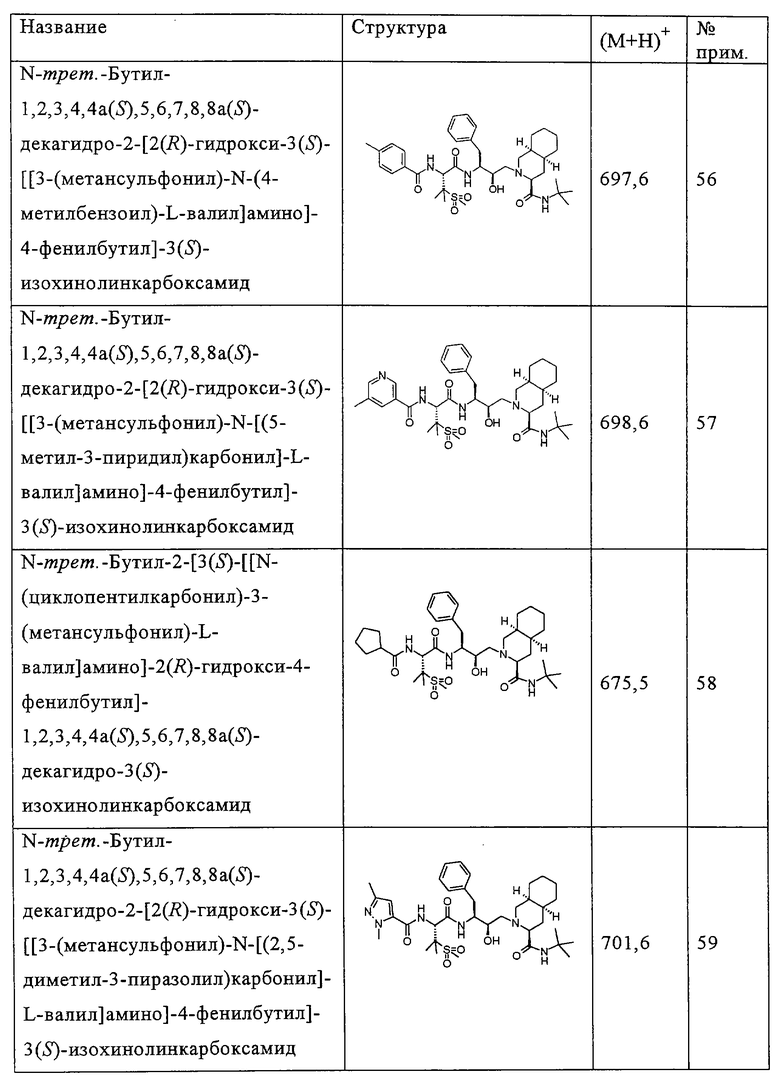
R14 означает алкил, алкенил, циклоалкил, арил, арилалкилгетероциклил, группу -СН2(СН2СН2O)mСН3, в которой m означает целое число 0-10, или связанный карбонильной группой радикал аминокислоты.
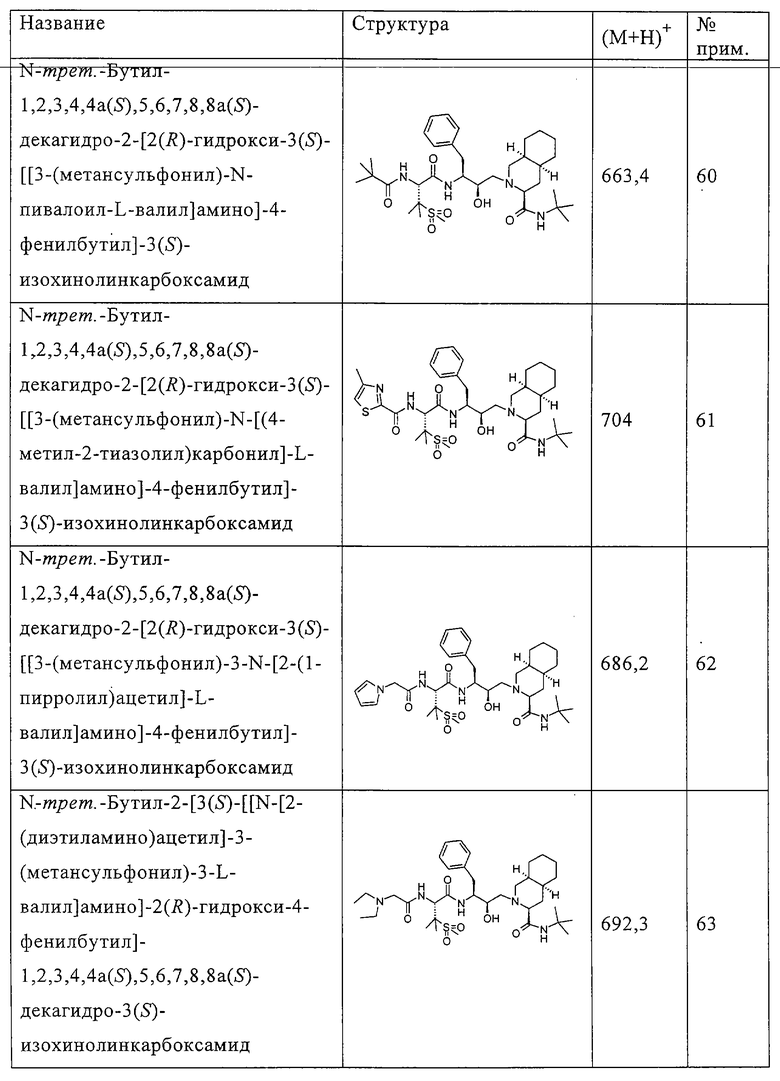
За исключением того, что алкильная и алкенильная цепь могут содержать до 20 атомов углерода, значение терминов «алкил», «алкенил», «циклоалкил», «арил», «гетероциклил» такое, как описано выше.
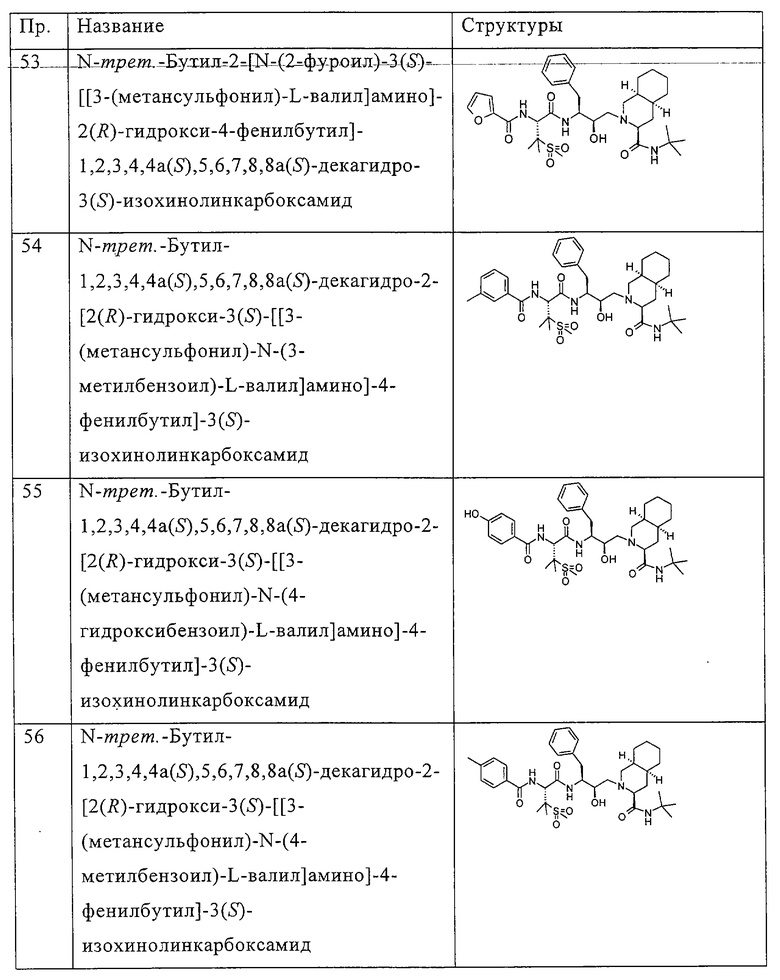
Термин «связанный карбонильной группой радикал аминокислоты» означает радикал природной или неприродной аминокислоты, выбранный, например, из глицина, аланина, лейцина, изолейцина, фенилаланина, лизина, метионина, треонина, триптофана, валина, серина, глутамина и т.д., который связан с карбонилом группы

Любая функциональная (т.е. реакционноспособная) группа, присутствующая в боковой цепи, может быть защищена с использованием фактически известных защитных группировок, например, как описано в "Protective Groups in Organic Synthesis", 2nd Ed., T.W.Greene и P.G.M.Wuts, John Wiley & Sons, New York, NY, 1991. Например, аминогруппа может быть защищена трет-бутоксикарбонильной (ВОС), формильной, тритильной, бензилоксикарбонильной (Z), 9-флуоренилметоксикарбонильной (FMOC), трифторацетильной, 2-(бифенилил)изопропоксикарбонильной или изоборнилоксикарбонильной группой либо в форме фталимидной группы; или гидроксильная группа может быть защищена трет-бутилдиметилсилильной, тетрагидропиранильной, 4-метоксибензильной или бензильной либо ацетильной группой; или карбоксильная группа может быть защищена в виде сложного эфира, например, такого как метиловый, бензиловый или трет-бутиловый сложный эфир. Защитная группа может сохраняться в конечном соединении или необязательно удаляться с помощью известных в данной области методик.
Соединения по данному изобретению отличаются структурой ядра с закрепленной стереохимией, как показано в общей формуле.
Остатки R1-R15 в соединениях по данному изобретению могут содержать один или несколько асимметрических атомов углерода и, следовательно, могут существовать в виде одиночных энантиомеров, рацематов и рацемических смесей, индивидуальных диастереомеров и диастереомерных смесей. Кроме того, если соединение по изобретению содержит олефиновую двойную связь, она может иметь (Е)- или (Z)-конфигурацию. К тому же каждый хиральный центр может быть R- или S-конфигурации. Все такие изомерные формы данных соединений охвачены настоящим изобретением.
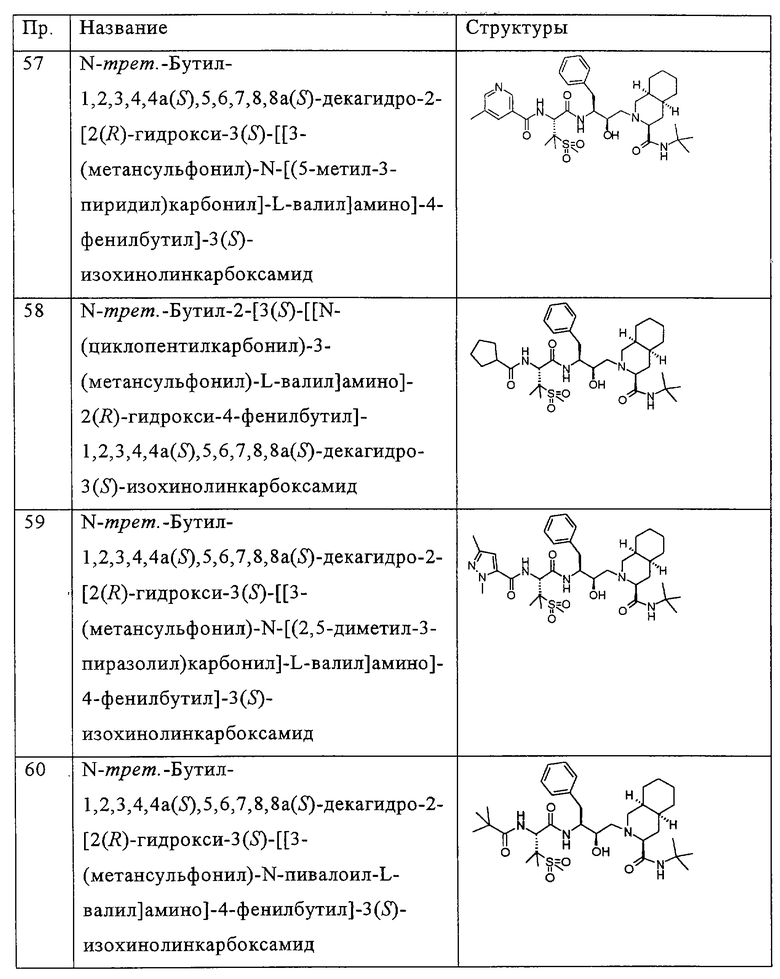
Соединения формулы I, которые имеют кислотные свойства, могут образовать фармацевтически приемлемые соли с основаниями, такими как гидроксиды щелочных металлов, например гидроксид натрия, гидроксид калия и тому подобное; гидроксиды щелочно-земельных металлов, например гидроксид кальция, гидроксид бария, гидроксид магния и тому подобное; с органическими основаниями, например N-этилпиперидином, дибензиламином и тому подобным. Те соединения формулы I, которые являются основными, могут образовать фармацевтически приемлемые соли с неорганическими кислотами, например галоидводородными кислотами, такими как хлористоводородная кислота и бромистоводородная кислота, с серной кислотой, азотной кислотой, фосфорной кислотой и тому подобным; и с органическими кислотами, например с уксусной кислотой, винной кислотой, янтарной кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, салициловой кислотой, лимонной кислотой, метансульфоновой кислотой, n-толуолсульфоновой кислотой и тому подобным. Образование и выделение таких солей может осуществляться в соответствии со способами, известными специалистам.
Предпочтительными соединениями формулы (I) являются соединения, имеющие формулу

где R2, R3, R4, R5, R6, R13 и R15 имеют приведенные выше значения.
В дополнительном предпочтительном варианте воплощения изобретения R3, R4 и R5 означают метил, R6 означает трет-бутил или гидрокси-трет-бутил, и R15 означает фенил.
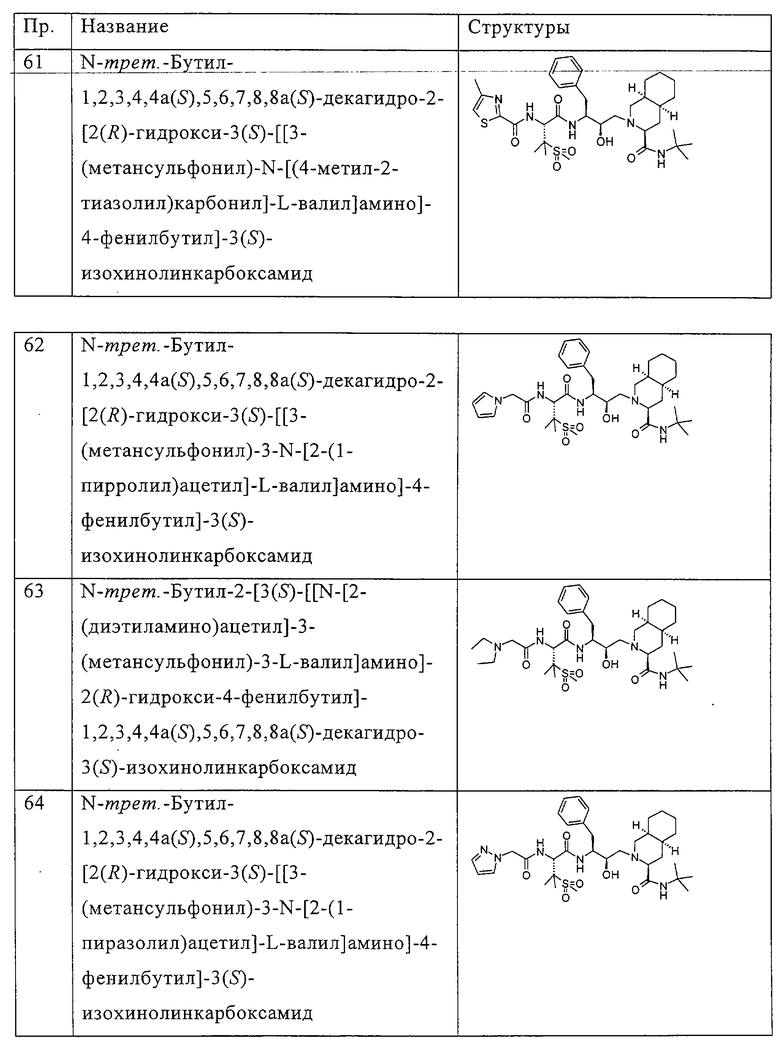
В дополнительном предпочтительном варианте воплощения R2 означает алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, гетероциклилалкилкарбонил или группу формулы

где, если
n означает 0,
Y означает кислород или серу и
R10 означает алкил, арилалкил, гетероциклилалкил, арил, гетероциклил, или
если
n означает 1,
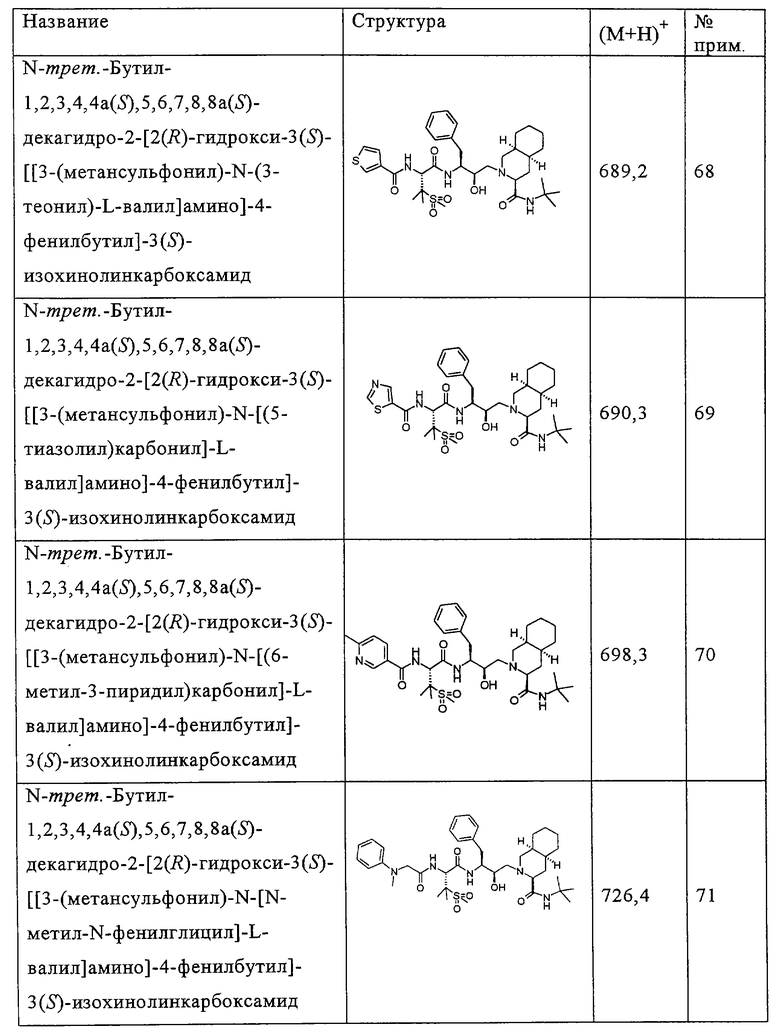
Y означает азот,
R9 означает водород и
R10 означает алкил, арилалкил, гетероциклилалкил, арил, гетероциклил, и
где
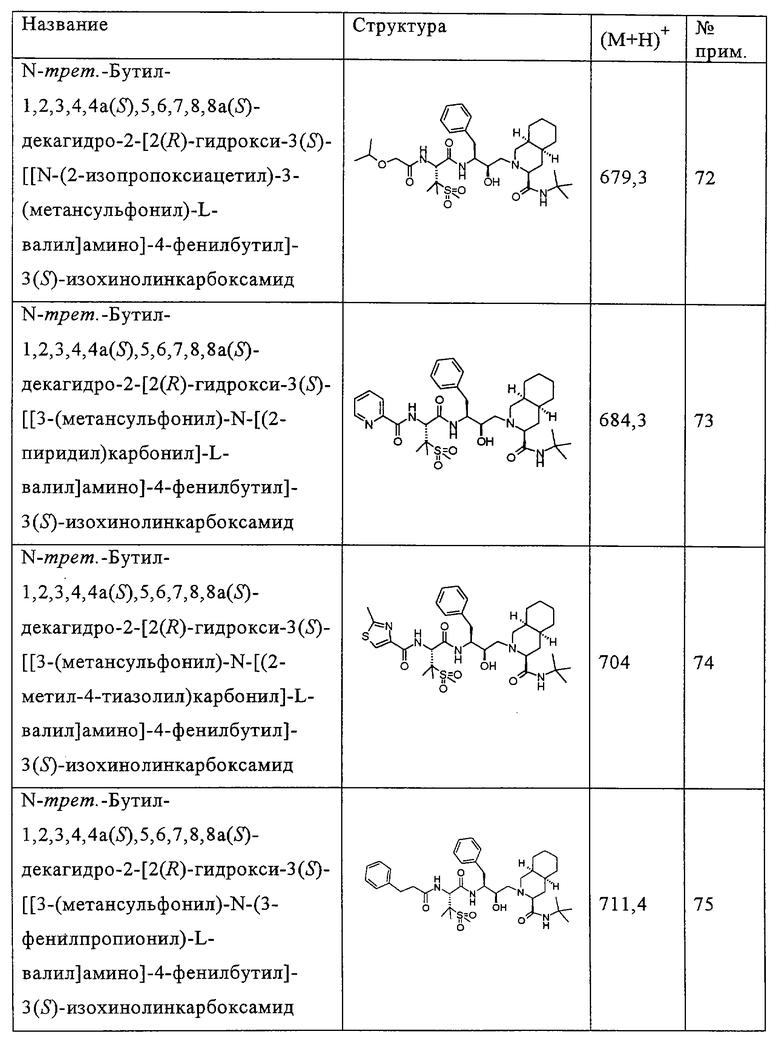
R11 и R12 означают независимо водород.
Более того, предпочтительными являются соединения, в которых R3, R4, R5 означают метил, R6 означает трет-бутил, R15 означает фенил и R2 означает алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, гетероциклилалкилкарбонил или группу формулы
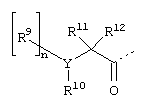
где, если
n означает 0,
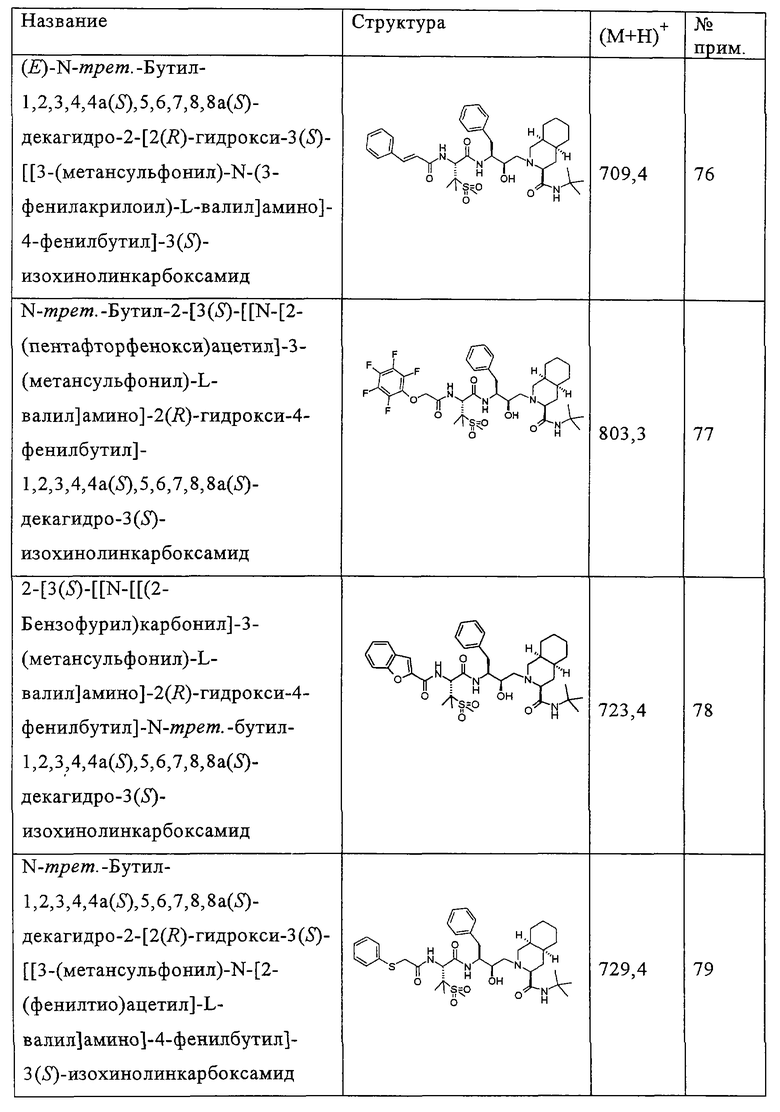
Y означает кислород или серу, и
R10 означает алкил, арилалкил, гетероциклилалкил, арил, гетероциклил, или
если
n означает 1,
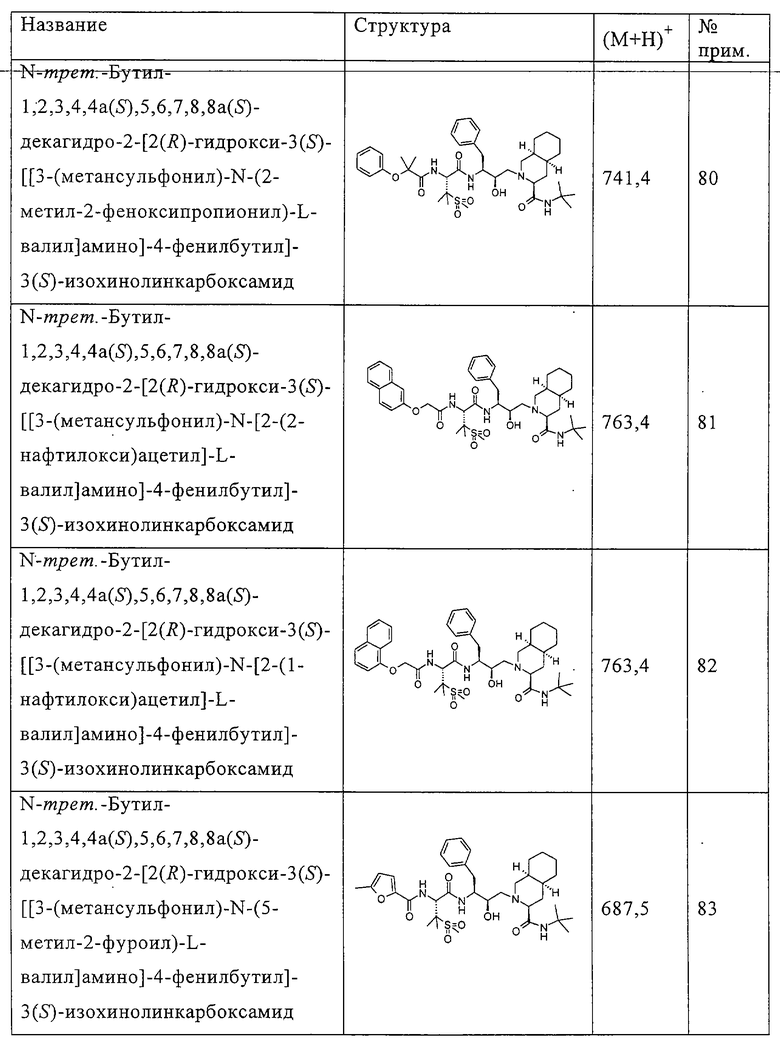
Y означает азот,
R9 означает водород и
R10 означает алкил, арилалкил, гетероциклилалкил, арил, гетероциклил, и
где
R11 и R12 означают независимо водород.
Более того, предпочтительными являются соединения, в которых R3, R4, R5 означают метил, R6 означает трет-бутил, R15 означает фенил и R2 означает арилкарбонил, гетероциклилкарбонил или группу формулы
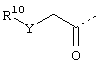
где
Y означает кислород, NH, S, СН2 и
R10 означает арил, гетероциклил.
В еще более предпочтительном варианте воплощения R13 означает водород.
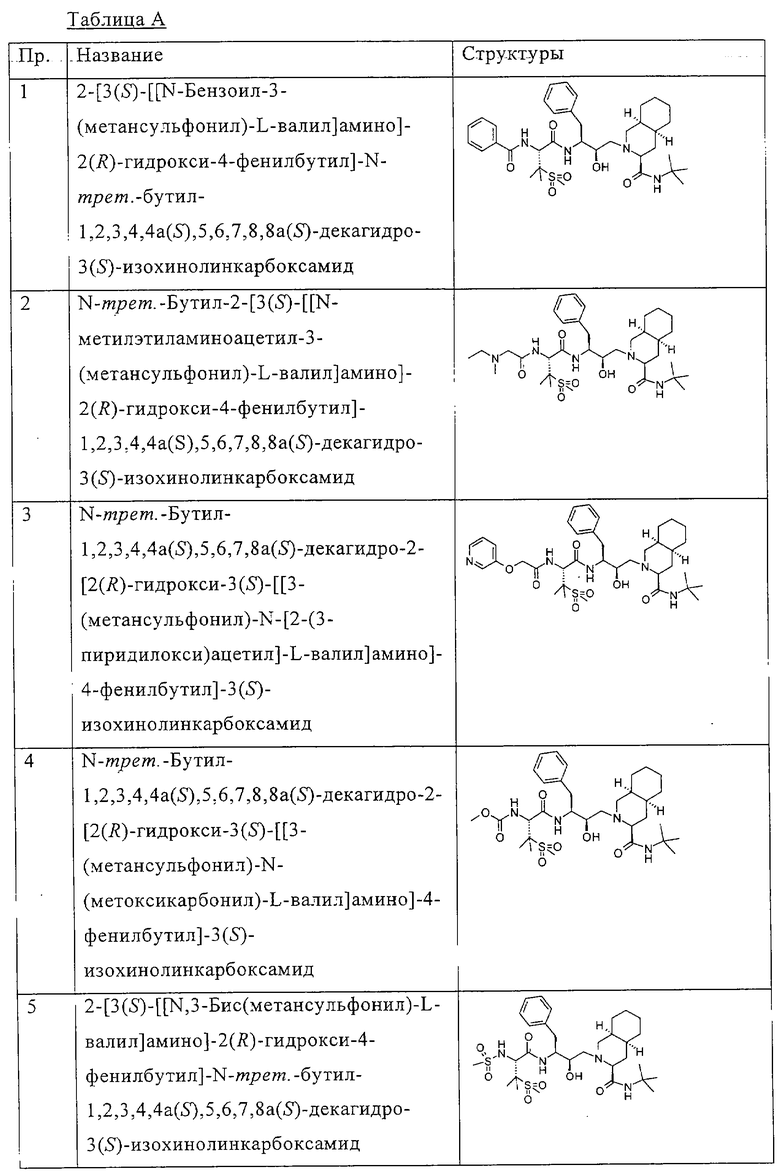
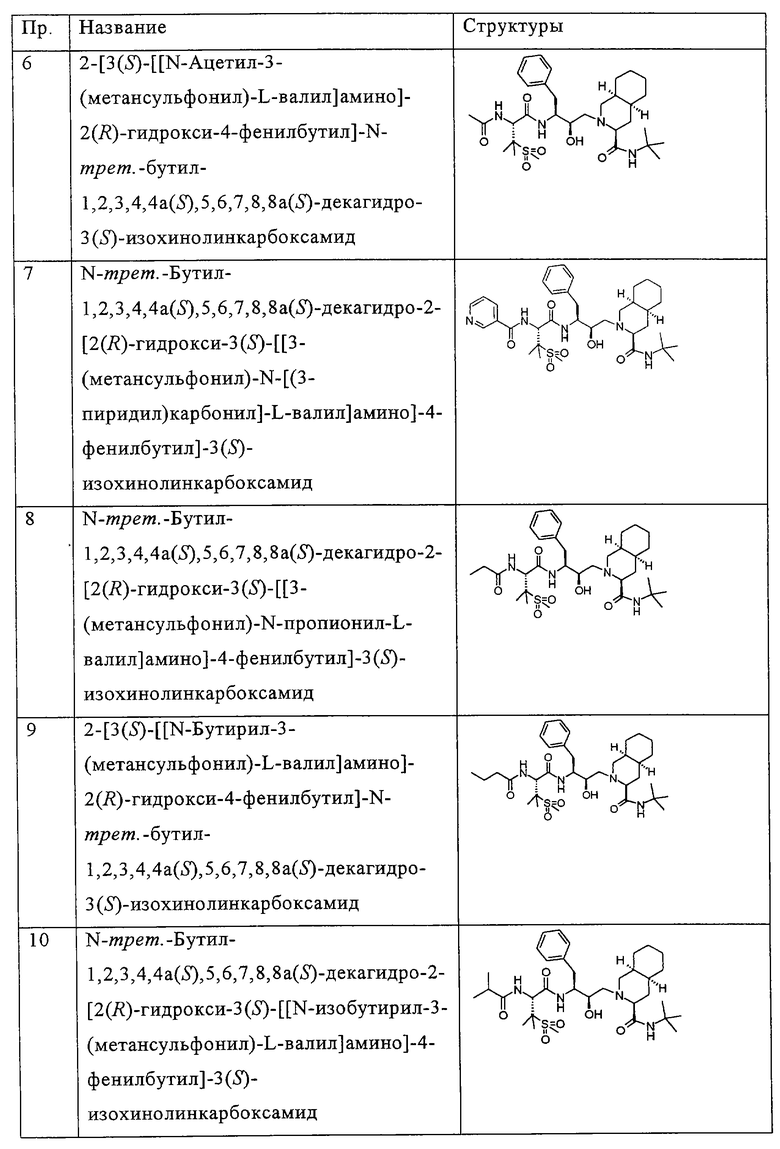
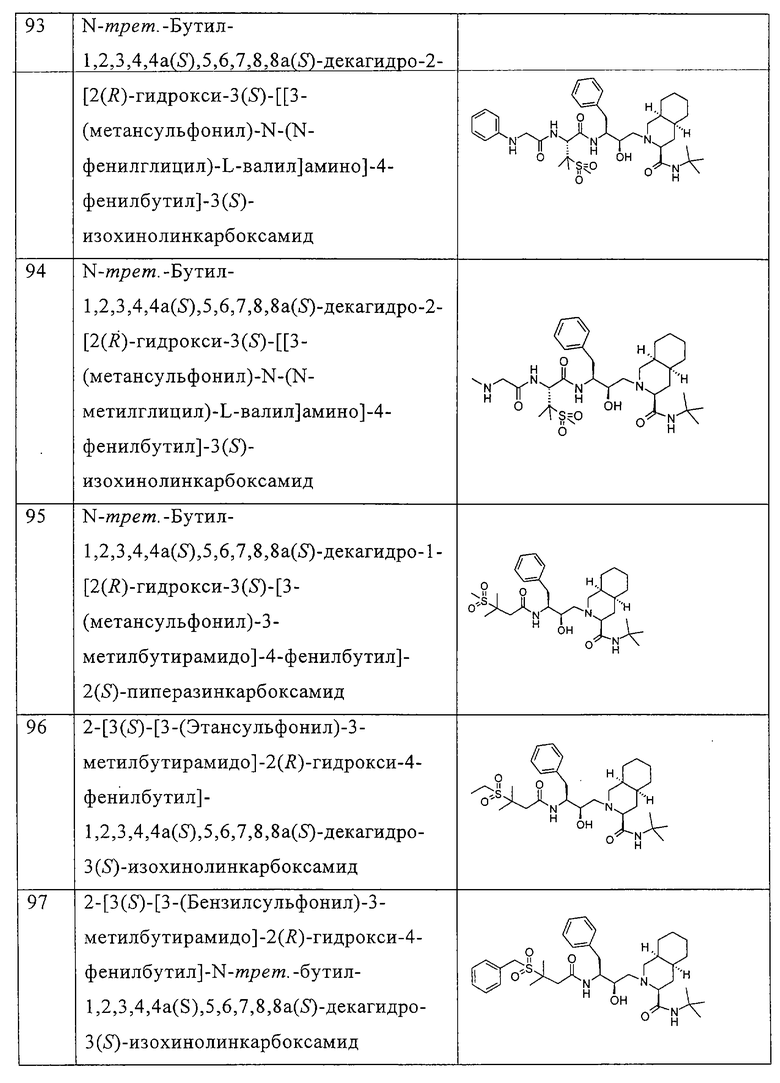
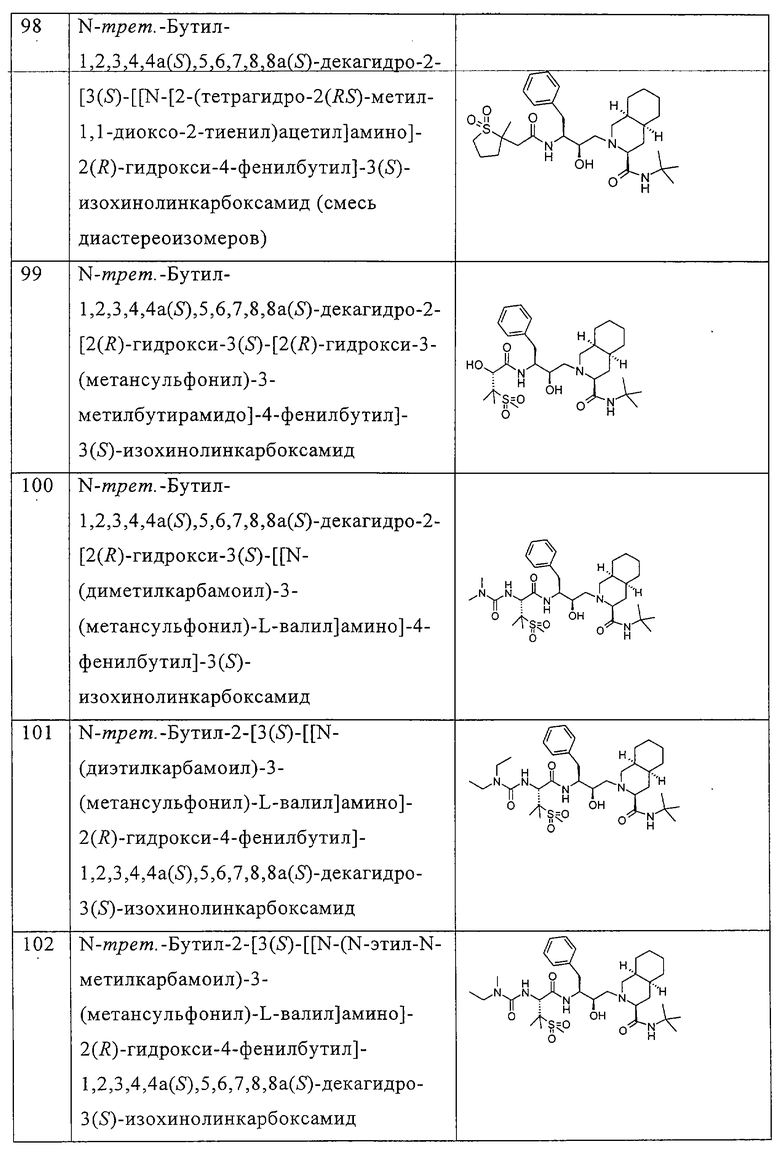
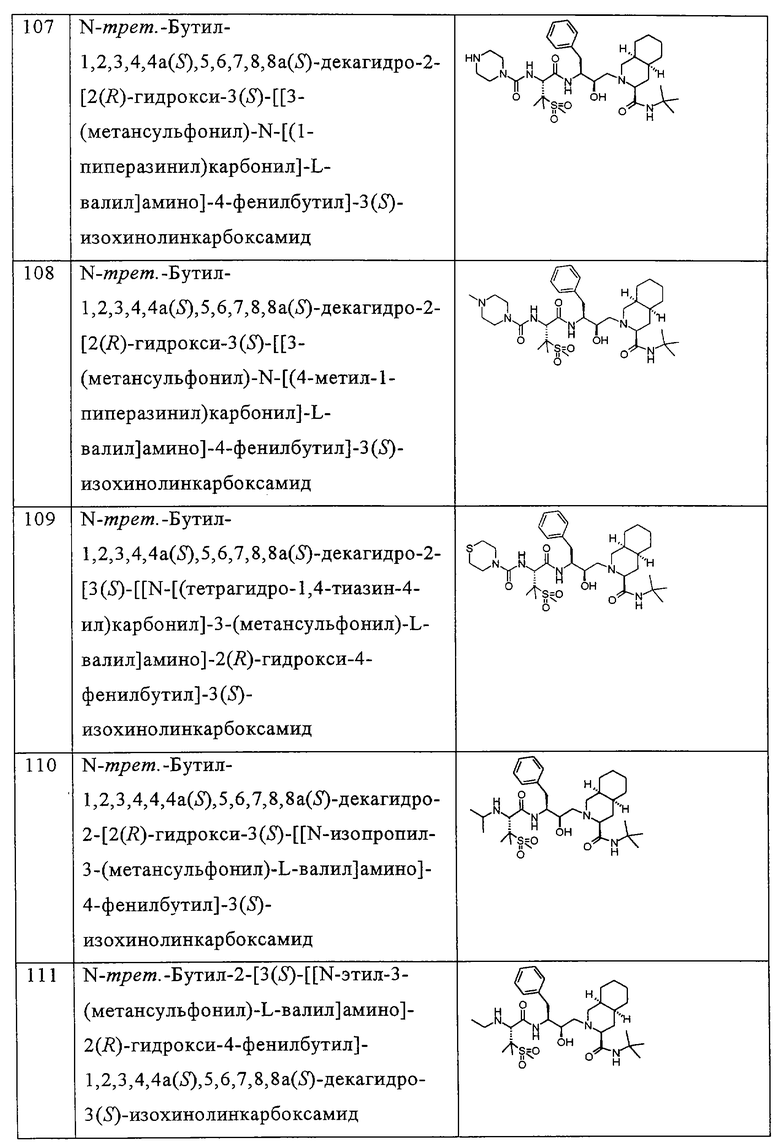
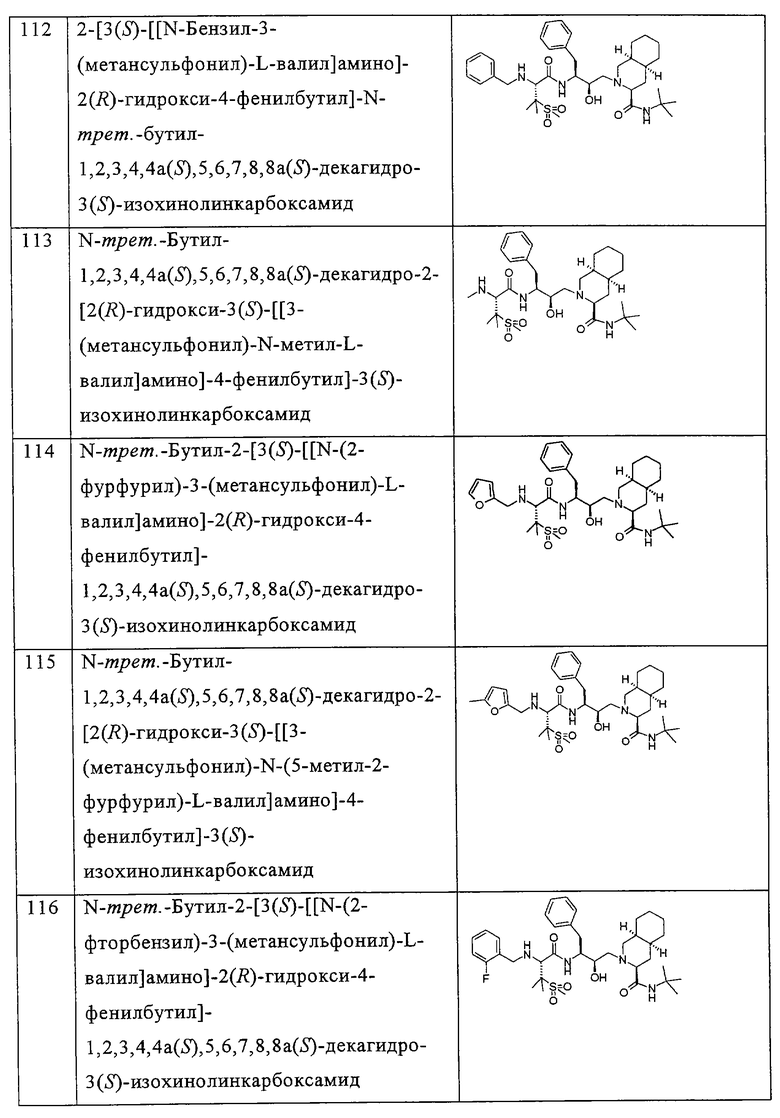
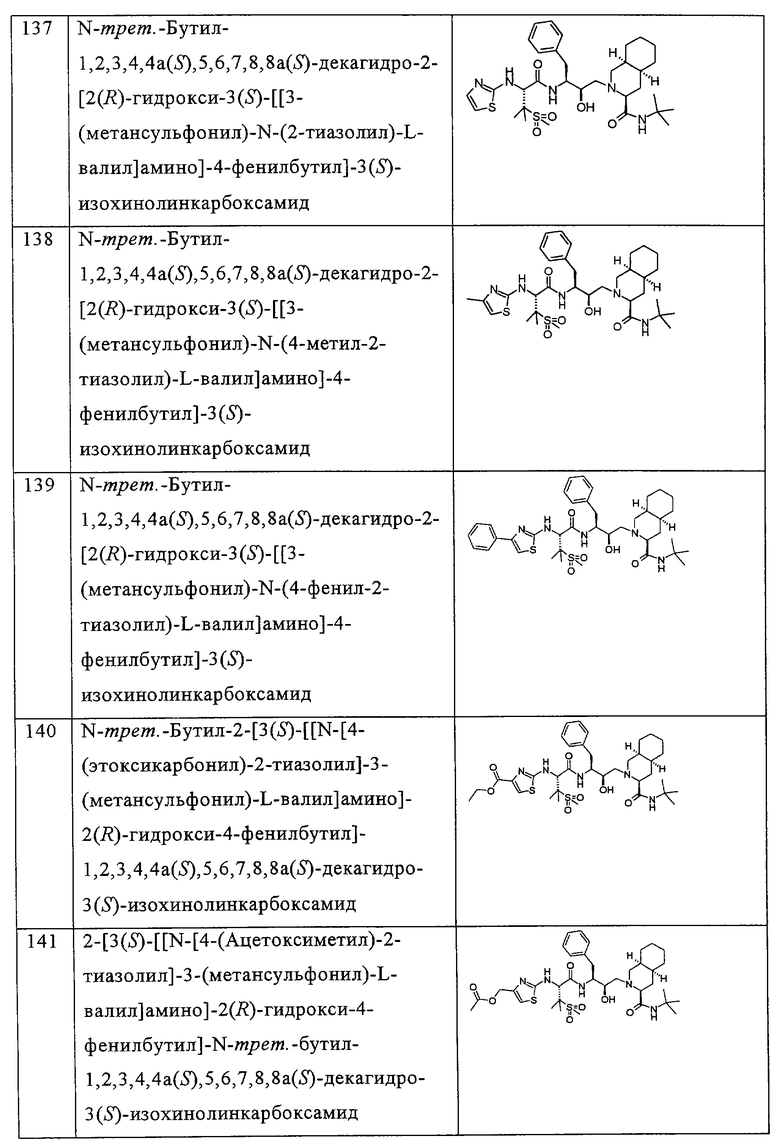
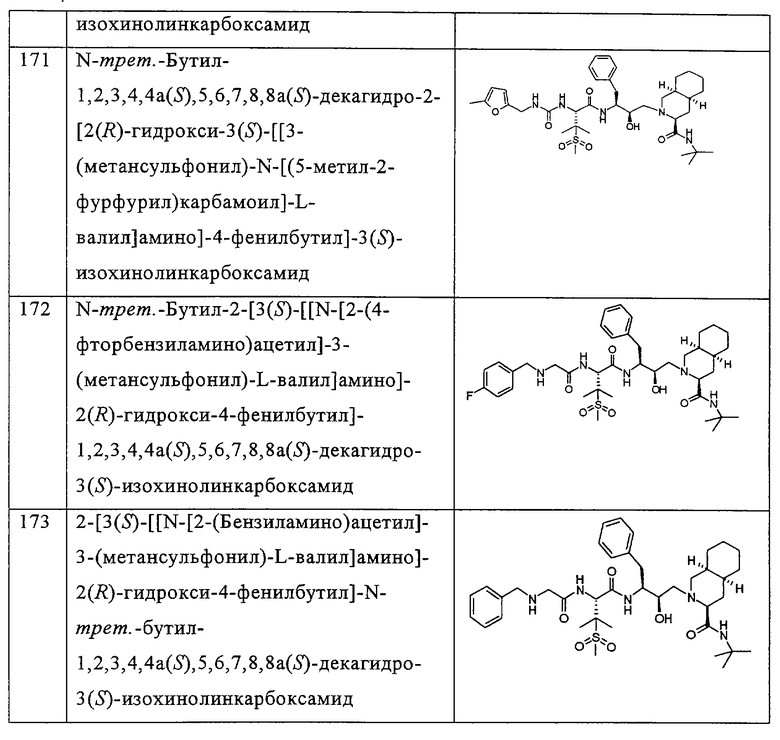
Примеры соединений формулы I или II при R13, означающем водород, приведены ниже в таблице А.




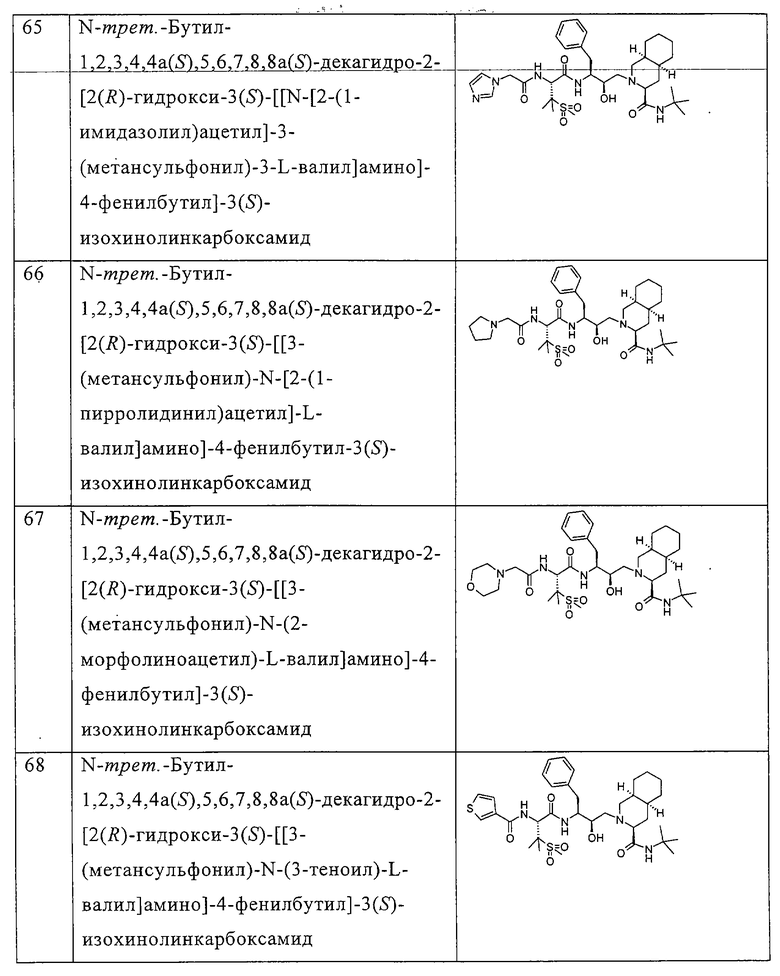
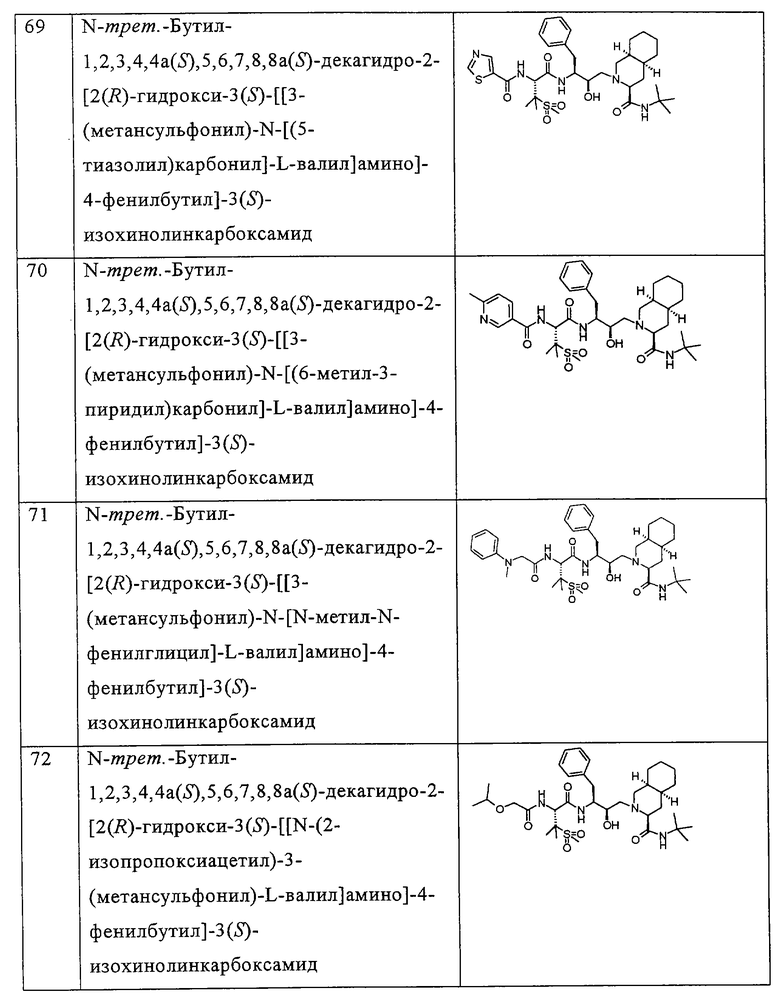
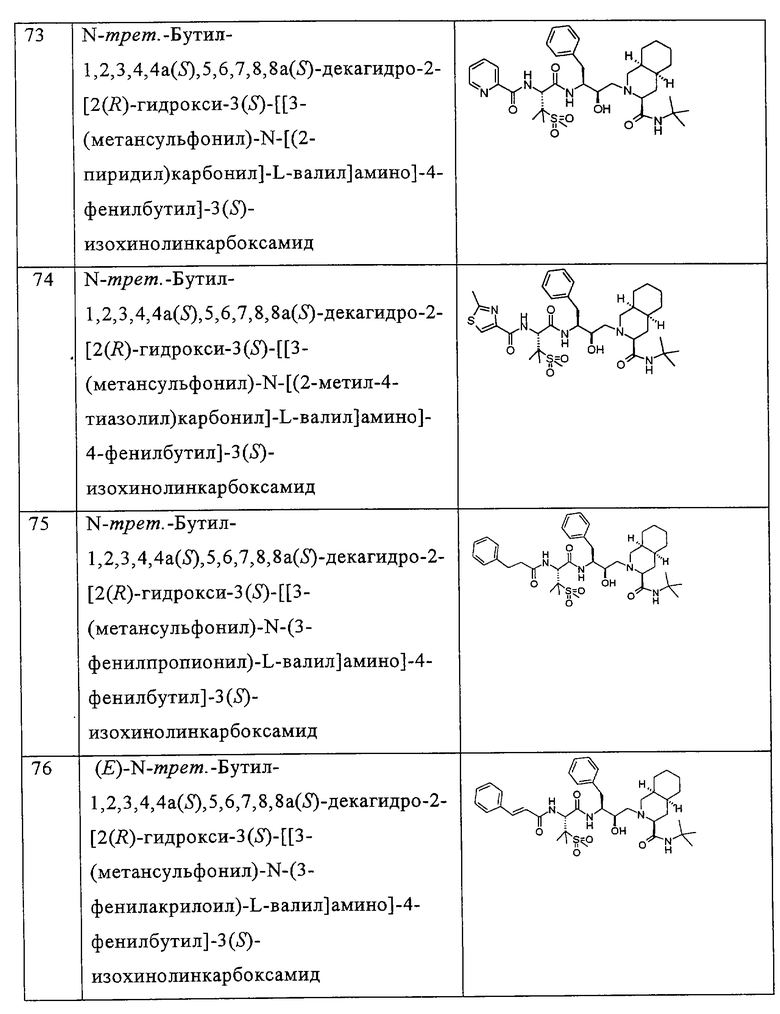


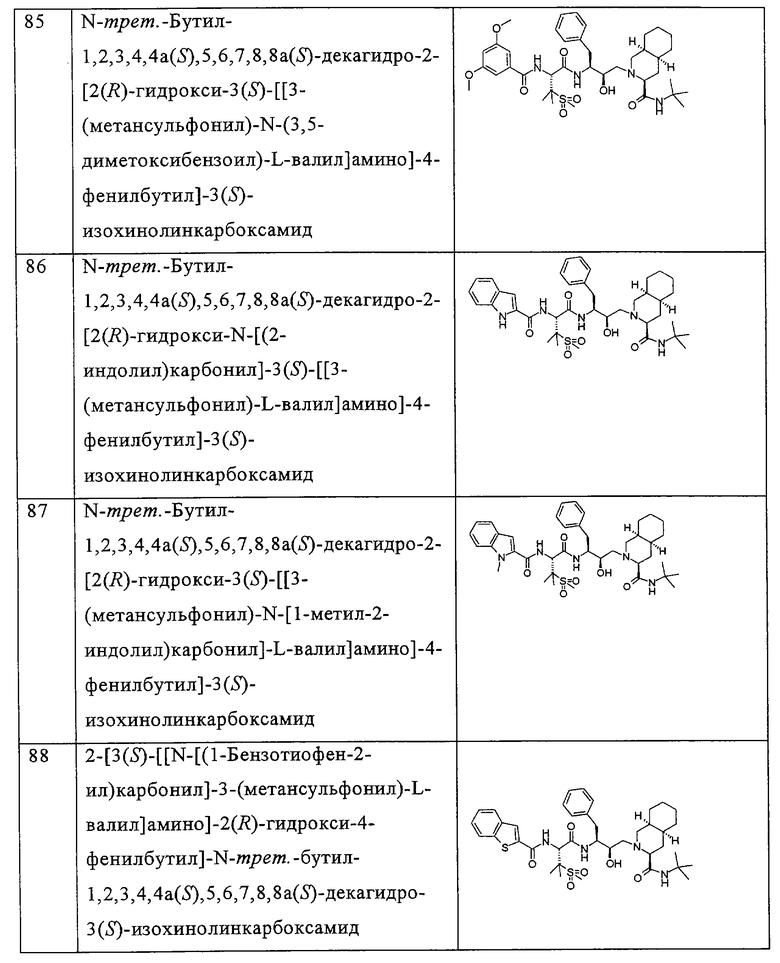






В другом предпочтительном варианте воплощения R13 означает -SO2OH, -РО(ОН)2 или группу

где
R14 означает алкил, алкенил, циклоалкил, арил, арилалкил, гетероциклил, группу -СН2(СН2СН2O)m, в которой m означает целое число 0-10 или связанный карбонильной группой радикал аминокислоты.
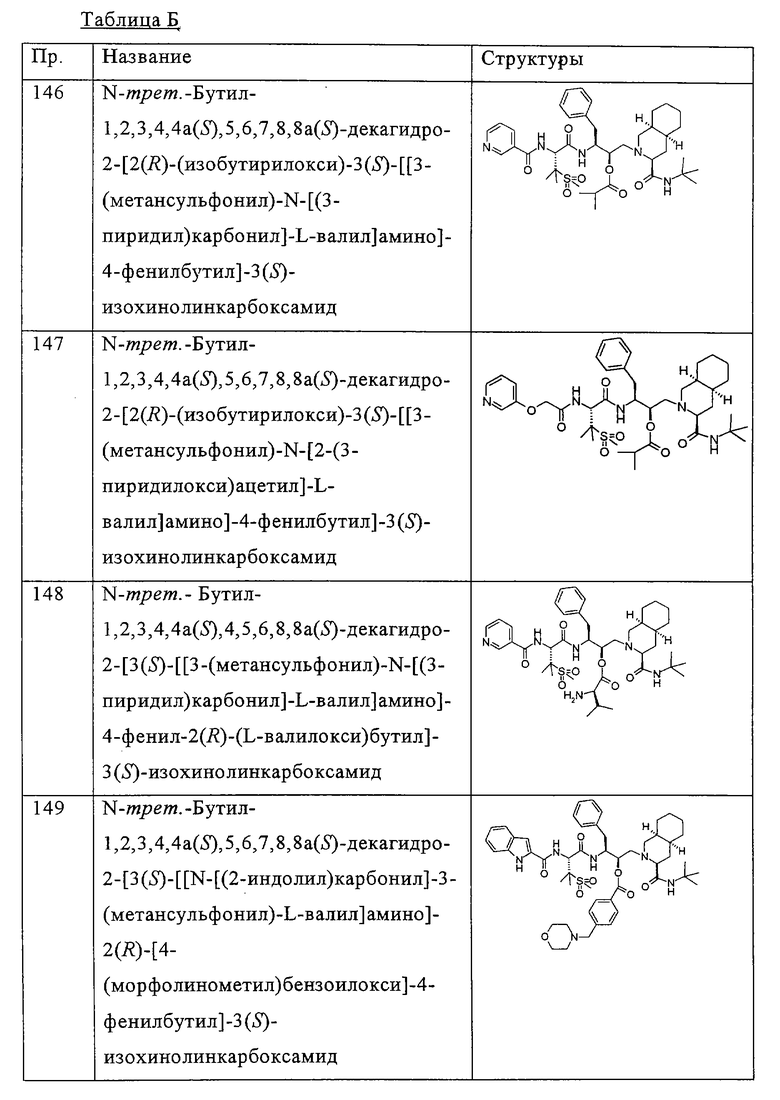
Примеры соединений формулы I или II с R13, не означающем водород, приведены ниже в таблице Б.

Дополнительными предпочтительными соединениями формулы I являются соединения, имеющие формулу
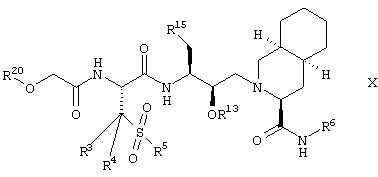
где R3, R4, R5, R6, R13 и R15 имеют значения, описанные выше, и R20 означает гетероциклил.
Более предпочтительными соединениями формулы (X) являются такие, где R3, R4 и R5 означают метил, R6 означает трет-бутил, R13 означает водород и R15 означает фенил.
Примеры таких предпочтительных соединений формулы (X) приведены ниже.
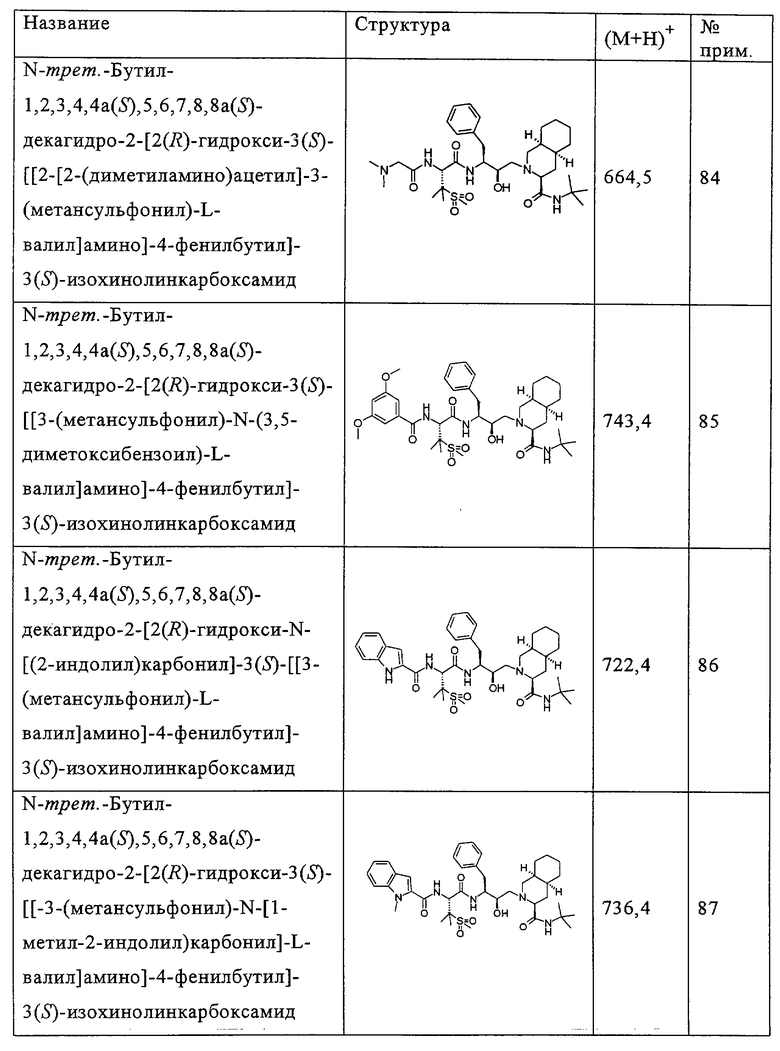
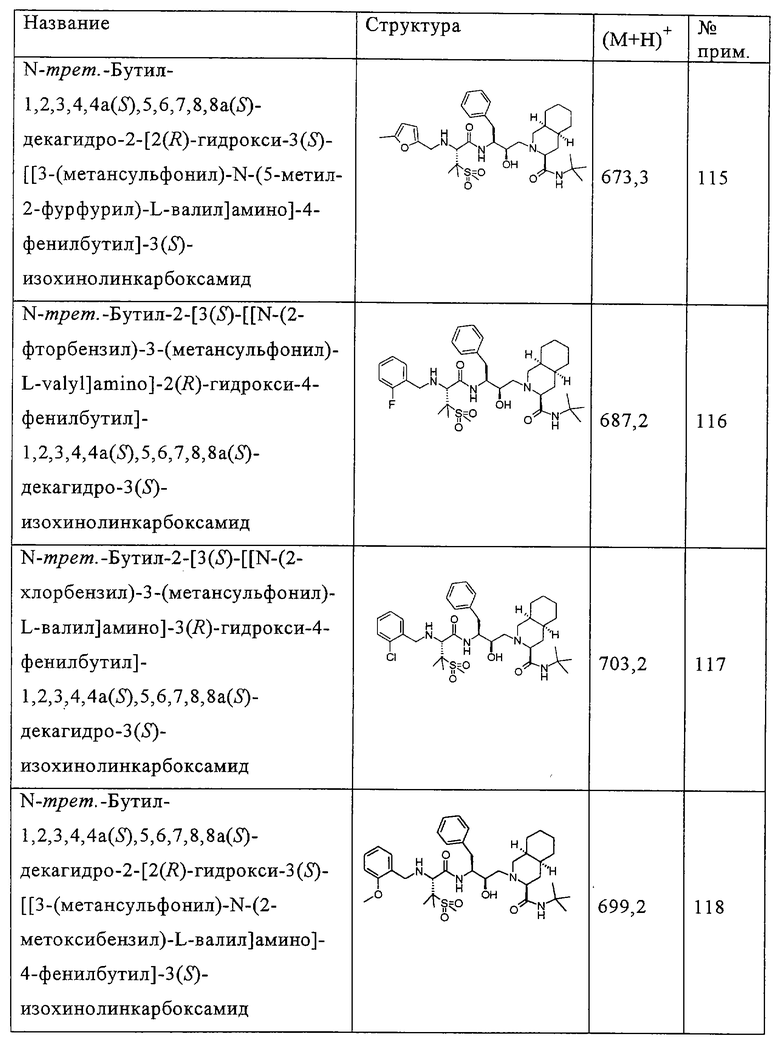
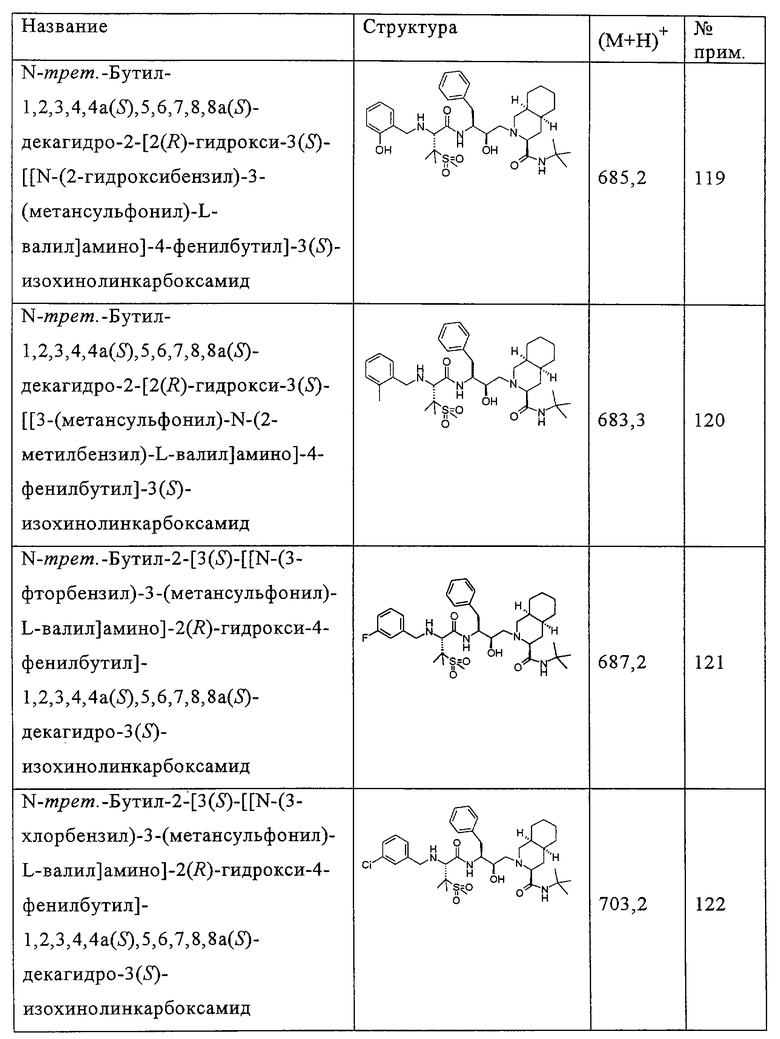
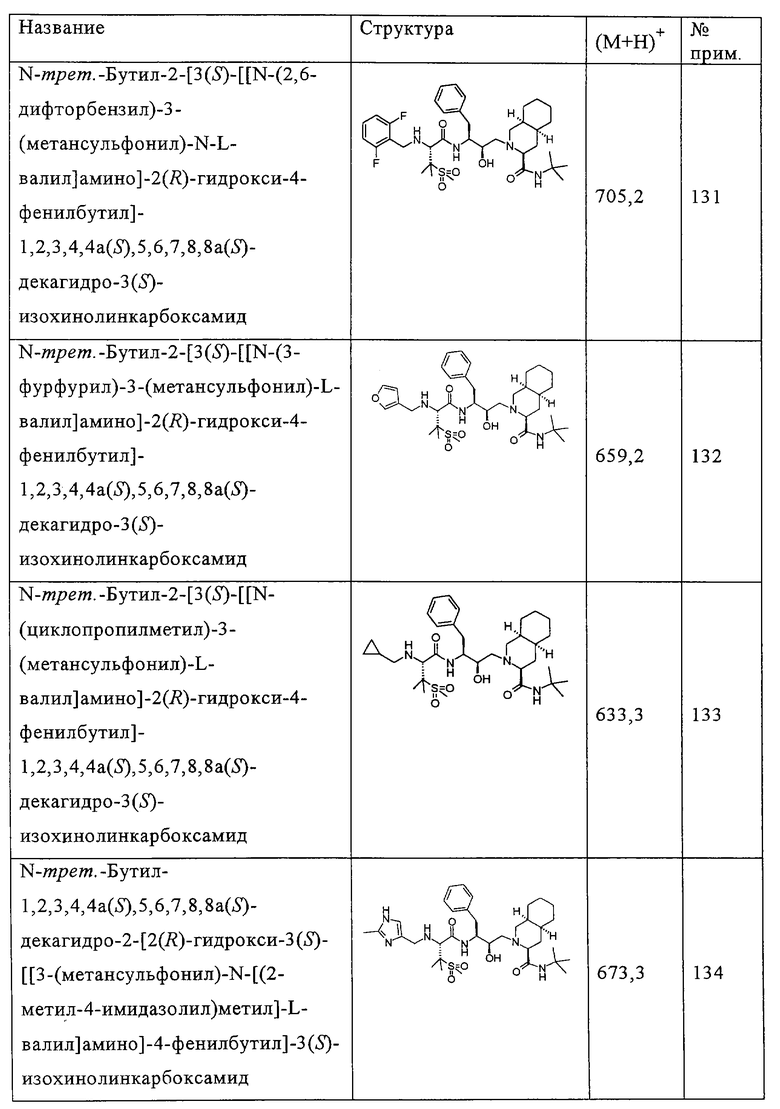
- N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
- N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(2-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
- N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(6-метил-3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
- N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиразинилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
- трет-Бутиламид 2-(2-гидрокси-3-{3-метансульфонил-3-метил-2-[2-(пиримидин-2-илокси)ацетиламино]бутириламино}-4-фенилбутил)декагидроизохинолин-3-карбоновой кислоты.
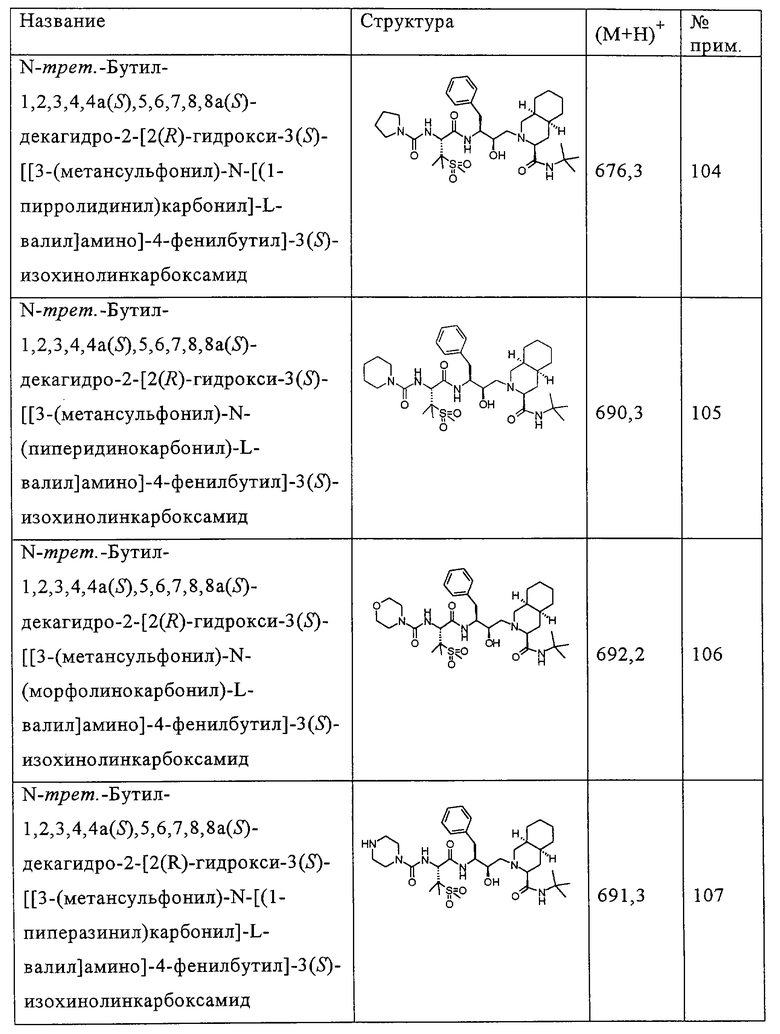
Наиболее предпочтительным соединением является N-трет-бутил-1,2,3,4,4а(S),5,6,7,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид, его фармацевтически приемлемые соли и сложные эфиры.
Производные гидроксиэтиламина, обеспечиваемые настоящим изобретением, являются мощными ингибиторами или депо-формами ингибиторов аспартилпротеазы ВИЧ, фермента, играющего существенную роль в репликативном цикле ВИЧ. Соответственно они являются терапевтически активными веществами в лечении опосредованных ВИЧ заболеваний и поэтому могут применяться в качестве лекарственных средств, или одни, или в комбинации с другими терапевтически активными агентами.
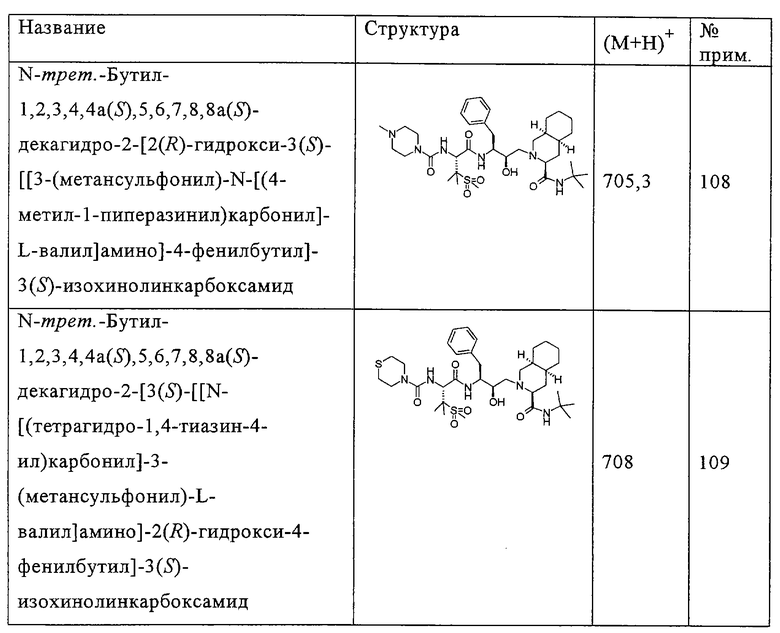
Производные гидроксиэтиламина, обеспечиваемые настоящим изобретением, являются, в частности, полезными в борьбе с болезненными состояниями, вызванными ВИЧ, такими как синдром приобретенного иммунодефицита.
Соединения по изобретению формулы I, где R1 означает NHR2, могут быть получены из соединения формулы III
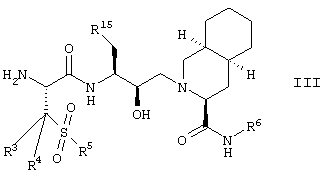
где R3, R4, R5, R6 и R15 имеют приведенные выше значения.
(а) В случае соединения формулы I, где R1 означает группу NHR2, в которой R2 означает алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, гетероциклилалкилкарбонил, арилалкилкарбонил, алкилоксикарбонил, арилалкилоксикарбонил, гетероциклилалкилоксикарбонил, сульфонил, алкилсульфонил, арилсульфонил, гетероциклилсульфонил или группу формулы

где R9, R10, R11 и R12 имеют приведенные выше значения, соединение формулы III реагирует с соответствующим производным кислоты, таким как хлорангидрид, смешанный ангидрид и т.д. Альтернативно, когда n означает 1, Y означает азот, R9 означает водород и R10 означает алкил, арилалкил, гетероциклилалкил, соединение III реагирует с N-защищенным глицином, деблокируется и реагирует с альдегидом или кетоном в восстановительных условиях, как описано в варианте воплощения (б) способа.
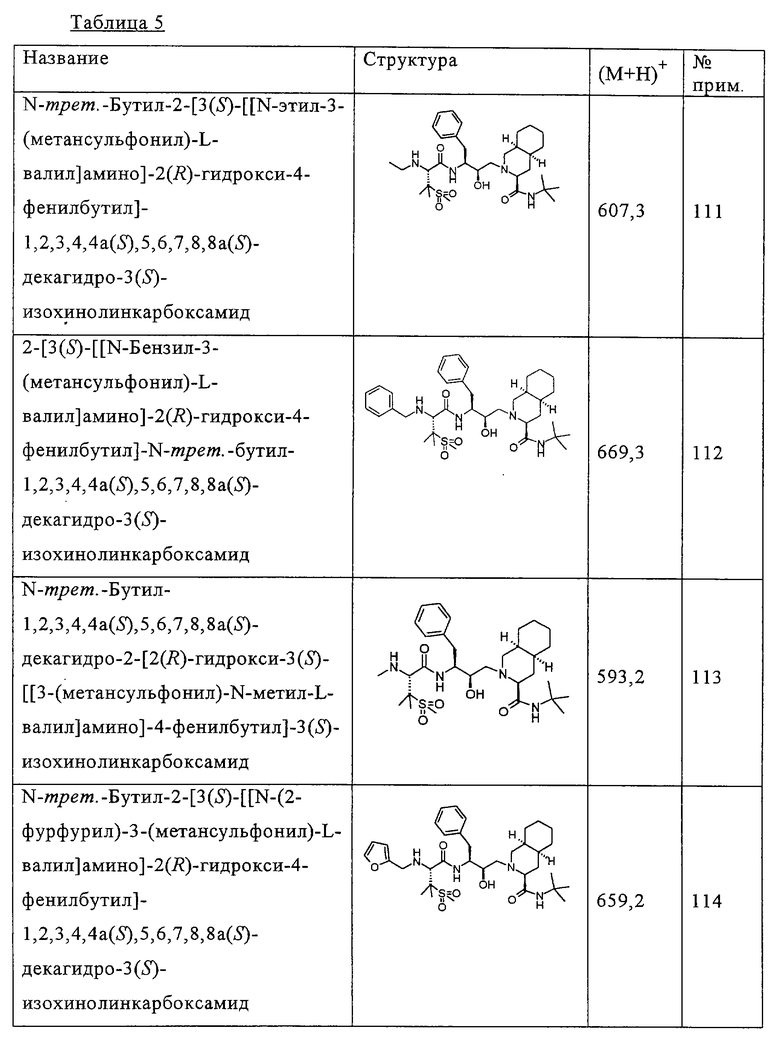
(б) В случае соединения формулы I, где R1 означает группу NHR2, в которой R2 означает алкил, алкенил, алкинил, арилалкил, гетероциклилалкил, циклоалкил, соединение формулы III реагирует с альдегидом или кетоном в восстановительных условиях.
(в) В случае соединения формулы I, где R1 означает NHR2, где R2 означает группу формулы

в которой X, R7 и R8 имеют такие же значения, как описанные ранее, соединение формулы III взаимодействует с реагентами, описанными в данной области для образования мочевин и тиомочевин.
(г) В случае соединения формулы I, где R1 означает группу NHR2, в которой R2 означает гетероцикл, соединение формулы III реагирует в соответствии со способами, описанными в данной области для образования гетероциклов. Например, в случае, где R7 означает тиазол, с использованием синтеза Ганча согласно схеме 1, путем превращения соединения формулы III в тиомочевину IV, сопровождаемым реакцией соединения IV с требуемым α-галоидкетоном или α-галоидальдегидом.
Схема 1
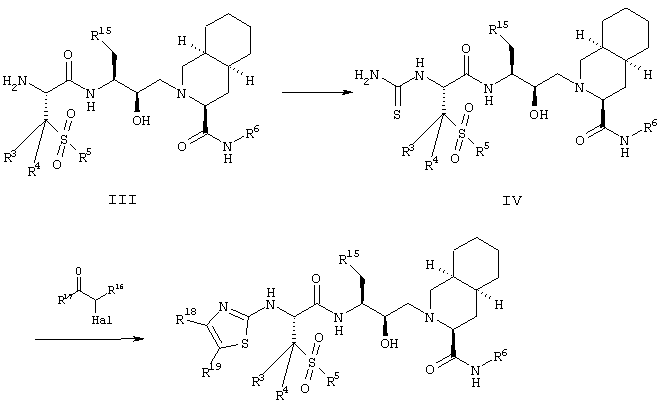
В упомянутой схеме R2, R3, R4, R5, R6 и R15 имеют ранее описанные значения; R16 означает водород, алкил, алкоксикарбонил, арил, гетероциклил; R17 означает водород, алкил, арил, гетероциклил; R18 означает то же, что R16, и R19 означает то же, что R19. Hal означает атом галоида, выбираемый из хлора, брома и йода.
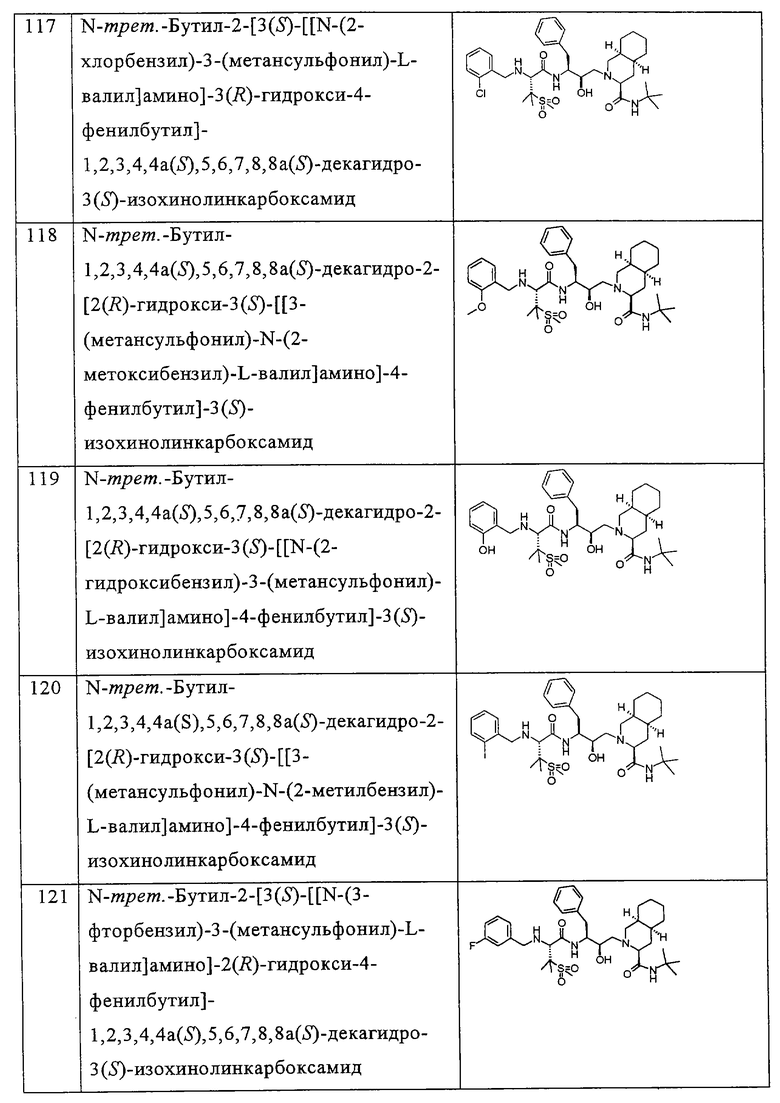
(д) В случае соединения формулы I, где R1 означает группу NHR2, в которой R2 означает арил, соединение формулы III реагирует с арилгалоидами в условиях катализа переходными металлами, известными в данной области. Альтернативно производное аминокислоты, полученное деблокированием соединения V (схема 3), может реагировать с арилгалоидами в подобных условиях до конденсации с соединениями формулы VI (схема 3).
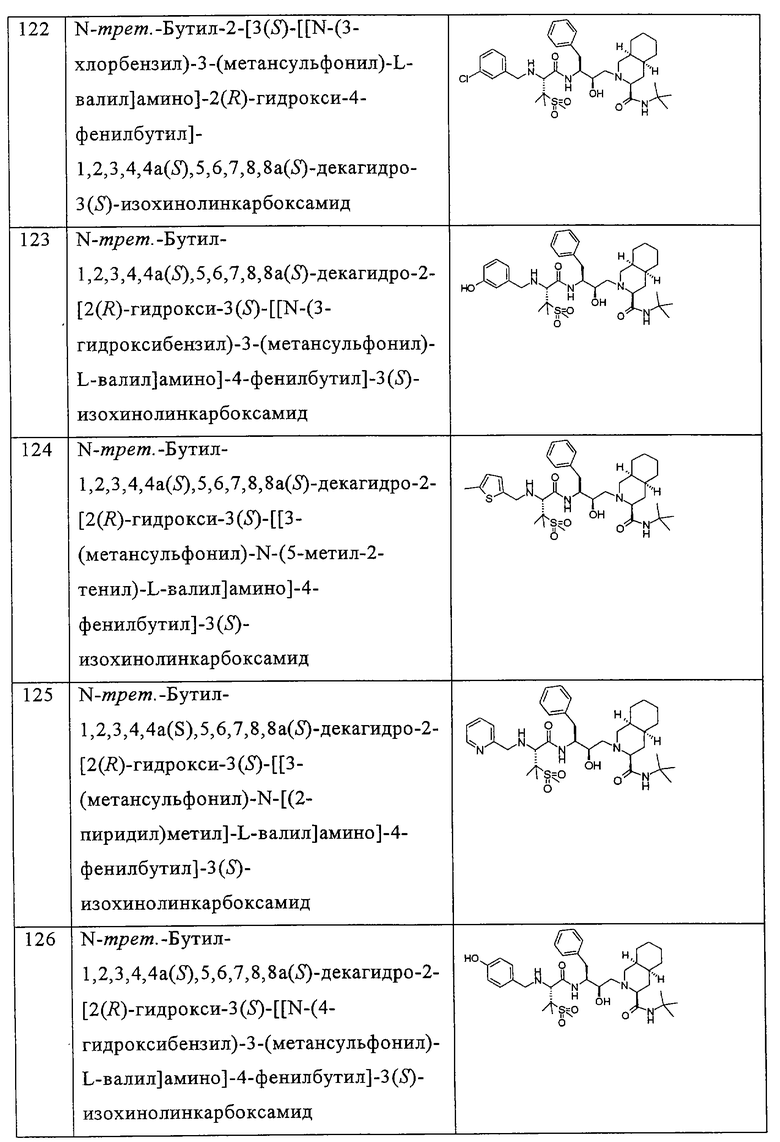
(е) В случае соединения формулы I, в которой R6 означает алкил, арилалкил, гетероциклилалкил, алкилоксиалкил, гидроксиалкил, аминоалкил, фторалкил, соединение формулы IVa (схема 2) реагирует с соответствующим амином в условиях катализа кислотой Льюиса.
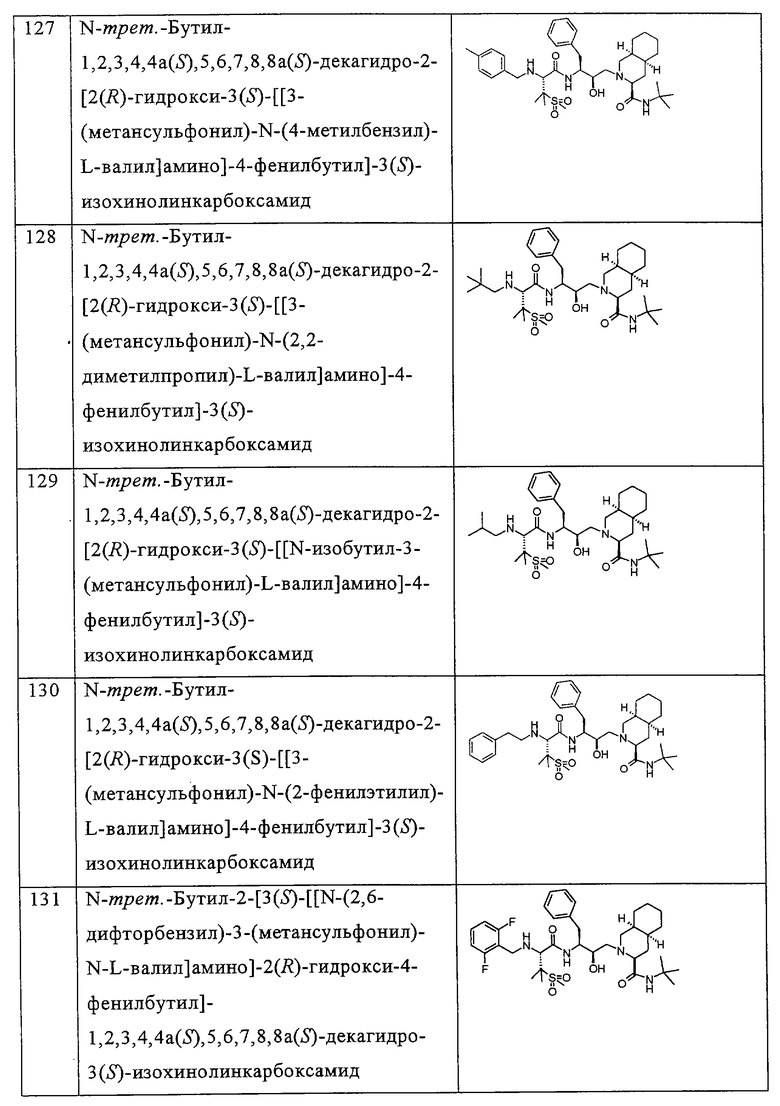
Схема 2
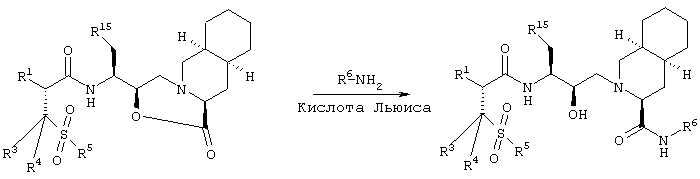
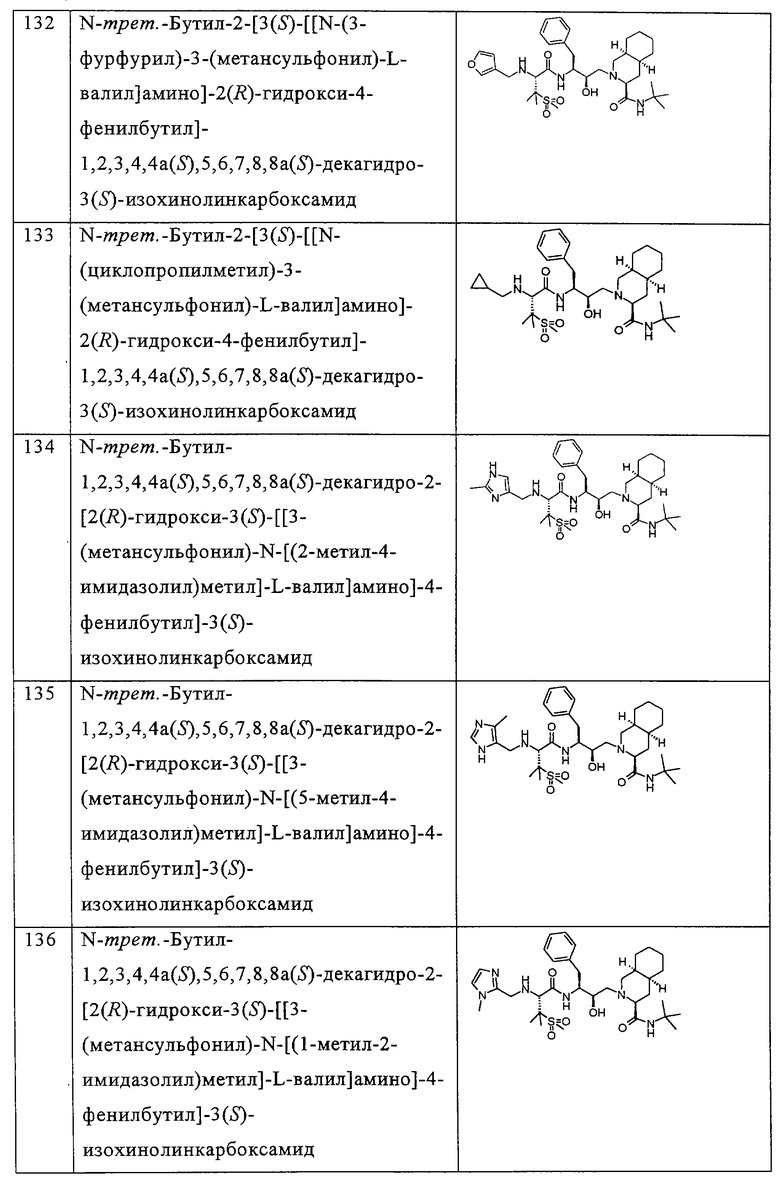
В упомянутой схеме R1, R3, R4, R5, R6 и R15 имеют приведенные ранее значения.
(ж) В случае соединения формулы I, в которой R означает -SO2OH, -РО(ОН)2 или группу
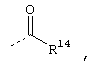
где R14 имеет приведенное ранее значение, соединение формулы I, в которой R13 означает водород, реагирует с соответствующим активированным производным кислоты или в случае аминокислоты - с ее аминозащищенной формой согласно методикам, описанным в данной области для образования сложных эфиров.
В соответствии с вариантом воплощения (а) способа подходящие реагенты, которые образуют алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, арилалкилкарбонил, гетероциклилалкилкарбонил, алкилоксикарбонил, арилалкилоксикарбонил, гетероциклилалкилоксикарбонил, сульфонил, алкилсульфонил, арилсульфонил, гетероциклилсульфониламин или группу формулы
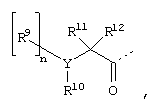
где R9, R10, R11 и R12 имеют описанные ранее значения, являются соответствующими кислотами или их реакционноспособными производными, такими как соответствующие галоидпроизводные кислот (например, хлорангидриды кислот), ангидриды кислот, смешанные ангидриды, активированные сложные эфиры и т.д. Реакцию соединения III с вышеупомянутыми реагентами проводят в соответствии с методиками, описанными в данной области, например, в руководствах по органической химии, таких как J. March (1992) "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th ed. John Wiley & Sons. Так, когда используют кислоту, реакцию предпочтительно проводят в присутствии конденсирующих агентов, таких как гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDAC·HCl), в присутствии гидроксибензтриазола (НОВТ). Данную реакцию удобно проводить в инертном органическом растворителе, таком, как тетрагидрофуран (ТГФ), дихлорметан или диметилформамид при температуре от -10°С до +25°С. Когда используют реакционноспособное производное, реакцию можно проводить в инертном растворителе, таком как дихлорметан или тетрагидрофуран в присутствии органического основания (например, N-этилморфолина, триэтиламина и т.д.) при температуре от -10°С до +25°С.
В соответствии с вариантом воплощения (б) способа реакцию соединений формулы III с альдегидом или кетоном можно проводить согласно методикам, описанным в данной области для восстановительного аминирования альдегидов или кетонов. Например, можно обращаться за справкой к руководствам по органической химии, таким как J. March (1992) "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th ed. John Wiley & Sons. Так, например, реакцию удобно проводить с триацетоксиборгидридом натрия в инертном галоидсодержащем растворителе, таком как дихлорэтан, в присутствии уксусной кислоты согласно способу, описанному А.F. Abdel-Magid и др.; Tetrahedron Letters 1990, 31, 5595.
В соответствии с вариантом воплощения (в) способа реакцию можно проводить согласно методикам, известным в данной области, например в руководствах по органической химии, таких как J. March (1992) "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th ed. John Wiley & Sons. Так, например, для соединения, в котором Х означает кислород, реакция может осуществляться взаимодействием соединений формулы III с n-нитрофенилхлорформиатом в присутствии неорганического основания, такого как бикарбонат натрия, с последующей реакцией с амином R7R8NH, где R7 и R8 имеют приведенные ранее значения, в присутствии органического основания, такого как триэтиламин (смотри, например, N.Choy и др. Org. Prep. Proced. Int. 1996, 28(2), 173-7). Реакцию удобно проводить в инертном растворителе, таком как ацетонитрил, при температуре 0-25°С. Если Х означает кислород или серу и один из R7 или R8 означает водород, реакцию можно удобно провести взаимодействием соединения формулы III с изоцианатом (R7N=C=O или R8N=C=O) или изотиоцианатом (R7N=C=S или R8N=C=S) согласно методикам, описанным в данной области.
В соответствии с вариантом воплощения (г) способа реакцию можно провести согласно методикам, описанным в руководствах по гетероциклической химии, таких как T.L.Gilchrist (1992) "Heterocyclic Chemistry", 2nd ed. John Wiley and Sons. Например, когда R2 означает тиазол, реакцию можно провести нагреванием смеси соединения IV и α-галоидкарбонильного соединения в соответствующем растворителе, таком как алканол (например, этанол). Соединение IV может быть легко получено из соединения III в соответствии с известными методиками, например реакцией с бензоилизотиоцианатом в ацетоне при кипении с последующим гидролизом с неорганическим основанием, таким как карбонат калия, в смеси полярного органического растворителя и воды (смотри, например, N.M.Oiken и др., J.Med. Chem. 1992, 35, 1137).
В соответствии с вариантом воплощения (д) способа реакция аминокислот (полученных деблокированием соединений формулы V) с арилгалоидами, например бромбензолом, может быть осуществлена в присутствии солей меди, например йодида меди в диметилацетамиде. Смотри, например, D. Ма и др., J.Amer. Chem. Soc. 1998, 120, 12467.
В соответствии с вариантом воплощения (е) способа реакцию соединений формулы IVa с аминами R6NH2 проводят, используя методики, описанные в данной области, например используя реагент, полученный из амина и кислоты Льюиса на основе производного алюминия, например триметилалюминия, при температуре окружающей среды в инертном растворителе, таком как дихлорметан или толуол (смотри, например, S.M.Weinreb и др., Tetrahedron Letters 1977, 4171).
В соответствии с вариантом воплощения (ж) способа реакция может быть осуществлена согласно методикам, известным в данной области, для образования сложных эфиров, смотри, например, руководства по органической химии, такие как J.March (1992) "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4th ed. John Wiley & Sons. Например, реакцию удобно проводить при температуре окружающей среды, используя производное карбоновой кислоты и конденсирующий реагент для пептидов, такой как EDAC·HCl, в инертном растворителе, таком как дихлорметан, в присутствии в качестве катализатора 4-диметиламинопиридина. Альтернативно хлорангидрид кислоты может быть использован в инертном растворителе в присутствии пиридина и 4-диметиламинопиридина в качестве катализатора при температуре 0-25°С.
Соединения формулы III, которые используются в качестве исходных веществ в вариантах воплощения (а)-(е), или известны, или могут быть получены в соответствии со схемой 3. Так, реакция соединения формулы V с соединением формулы VI может быть осуществлена согласно методикам, известными в химии пептидов, с образованием соединения формулы VII (смотри J. Jones (1994), "The Chemical Synthesis of Peptides", Oxford University Press). Термин «аминозащитная группа» (Prot), используемая в контексте, относится к используемым в химии пептидов группам, таким как трет-бутоксикарбонильная группа (ВОС) или 9-флуоренилметилоксикарбонильная группа (FMOC). Предпочтительной аминозащитной группой (Prot) для данной реакции является 9-флуоренилметилоксикарбонильная группа. Данную реакцию предпочтительно осуществляют взаимодействием соединения формулы V с хлорформиатом (например, изобутилхлорформиатом) в присутствии органического основания, такого как N-этилморфолин, чтобы вызвать образование смешанного ангидрида, который впоследствии реагирует с соединением формулы VI. Реакцию удобно проводить в инертном растворителе, таком как простой эфир (например, диэтиловый эфир, тетрагидрофуран и т.д.) или в алифатическом галоидированном растворителе (например, дихлорметане) при низкой температуре, удобно примерно при -10-5°С. Превращение соединений формулы VII в соединения формулы III осуществляют, используя известные методики, применяемые в пептидной химии, для деблокирования аминогруппы в аминокислотах. Например, если аминозащитной группой является FMOC, реакцию удобно проводить взаимодействием соединений формулы VII с пиперидином в диметилформамиде или дихлорметане при комнатной температуре.
Схема 3
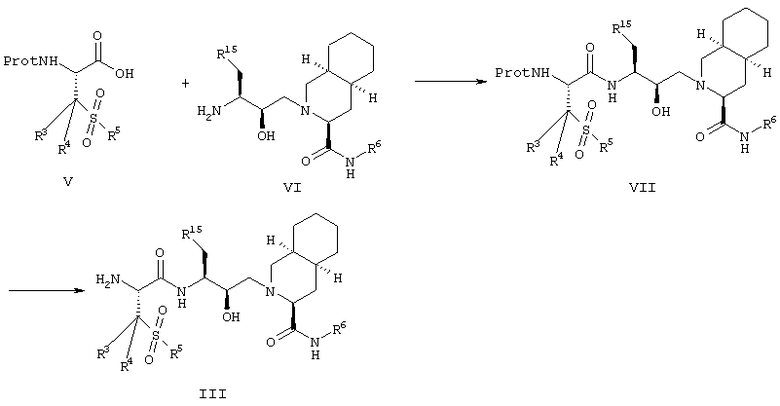
В упомянутой схеме R3, R4, R5, R6 и R15 имеют ранее описанные значения. Соединения формулы V, где R3 и R4 означают метил, могут быть получены из пеницилламина согласно схеме 4.
Схема 4
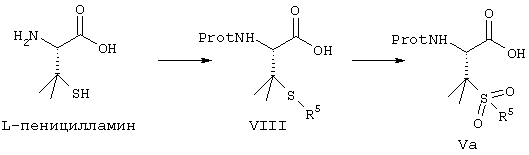
В упомянутой схеме R5 имеет ранее описанное значение.
Так, реакция L-пеницилламина с алкилгалоидом R5X, где R5 имеет данное ранее значение, и Х означает галоид (например, бром), в присутствии неорганического основания, такого как карбонат калия, с последующим взаимодействием с реагентом для введения аминокислотной защитной группы [например, FMOCONSu (N-9-флуоренилметоксикарбонил)сукцинимид) или ВОС2О] дает соединения формулы VIII. Реакция может быть проведена при комнатной температуре в смеси растворителей, состоящей из воды и органического растворителя, предпочтительно диоксана. Соединения формулы VIII окисляют в соединения формулы Va согласно известным методикам, предпочтительно по реакции с оксоном (K.S. Webb, Tetrahedron Lett. 1994, 35(21), 3457-60).
Другие соединения формулы V могут быть получены аналогичными путями из аналогов пеницилламина, описанных в данной области.
Соединения формулы VI могут быть получены согласно известным методикам, описанным в данной области, например в ЕР 432695 А2.
Соединения формулы I, в которой R1 означает гидроксигруппу, могут быть получены согласно методикам, описанным в данной области, например A.N.Cook и др.; J.Chem. Soc. 1949, 1022. Например, деблокирование аминокислот V с последующим диазотированием, гидролизом и сочетанием с соединениями формулы VI согласно методикам, описанным выше, дает соединения формулы I, в которой R означает гидроксигруппу.
Соединения формулы I, в которой R означает водород, могут быть получены из соединений формулы VI и соединений формулы IX (схема 5) способом, аналогичным уже описанному.
Соединения формулы IX могут быть получены из соответствующей акриловой кислоты и тиола согласно методикам, описанным в данной области и представленным на схеме 5 (смотри, например, G. Pattenden и др., J. Chem. Soc., Perkin TranS. 1, 1992, (10), 1215-21).
Схема 5
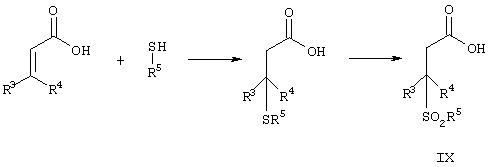
В упомянутой схеме R3, R4 и R5 имеют ранее описанные значения.
Исходные вещества формул V, VI, IX и их реакционноспособные производные, поскольку они являются неизвестными соединениями или аналогами известных соединений, могут быть получены подобно известным соединениям, или как описано ниже в примерах, или по аналогии с этим. Более того, реагенты, используемые в вариантах воплощения (а)-(ж), обычно являются известными соединениями. Реагенты, требуемые для введения групп формулы
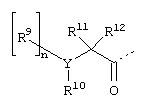
где R9, R10, R11 и R12, такие как описано ранее, являются соответствующими карбоновыми кислотами или их активированными производными, которые сами являются известными соединениями или могут быть легко получены по аналогии с известными соединениями. Например, когда n означает 0, Y означает кислород или серу, и R10 означает арил или гетероциклил, реагент получают взаимодействием соответствующего спирта (например, 3-гидроксипиридина) с трет-бутилбромацетатом в основных условиях (например, гидрид натрия в диметилформамиде или карбонат калия в ацетоне) с последующим деблокированием, катализируемым кислотой (например, хлористоводородной кислотой в эфире, бромистоводородной кислотой в уксусной кислоте или трифторуксусной кислотой в дихлорметане). Также, когда n означает 1, Y означает азот, реагент может быть получен по подобным методикам, в которых используют амин R9R10NH вместо спирта и без добавления основания.
Альтернативно трет-бутиловый эфир глицина может быть подвергнут восстановительному аминированию с альдегидом или кетоном в условиях, аналогичных тем, которые описаны в варианте воплощения (б) способа, с последующим деблокированием кислотной карбоксильной группы, катализируемым кислотой; предпочтительно с HBr в уксусной кислоте.
Методики анализа
Анализ ингибирования протеазы ВИЧ
Ингибирующую активность в отношении протеазы ВИЧ оценивали, используя адаптацию методики Matayoshi и др. [Matayoshi E.D. и др. (1990). Science. 247. 954-958].
Неочищенную протеазу ВИЧ-1 получали из Е.coli рРТΔN. Культуры выращивали при 30°С в среде М9 с добавлением 0,2% казаминовых кислот, 100 мкг/мл ампициллина и 25 мкг/мл тиамина до OD600=0,5-0,6 и повышали температуру до 42°С, чтобы вызвать экспрессию протеазы. Через 1,5 ч клетки собирали и хранили осадки при -70°С до использования.
Протеазу получали лизисом клеток в ячейке высокого давления French с последующим осаждением фермента с сульфатом аммония при 30% насыщении.
Анализ основан на внутримолекулярном переносе энергии флуоресценции с использованием флуорогенного субстрата тушения DABCYL-[4-(4-диметиламинофенилазо)бензоил]-Ser-Gln-Asn-Tyr-Pro-Ile-Val-Gln-EDANS[5-(2-аминоэтиламино)-1-нафталинсульфоновая кислота], пептидная последовательность которого получена из одного из природных полипептидных процессинговых сайтов протеазы ВИЧ-1.
Пептидный субстрат растворяли в диметилсульфоксиде (ДМСО) для спектроскопии с целью получения 500 мкМ исходного раствора. Ингибиторы растворяли в смеси ДМСО-0,1% водный твин-20 (1:9), получая концентрацию игибитора в 20 раз больше требуемой конечной концентрации. Буфер для анализа включал 0,1 М ацетат натрия с рН 4,7, 8 мМ EDTA (этилендиаминтетрауксусную кислоту), 0,2 М хлористый натрий.
Разбавленные 1:1 10 мкл протеазы ВИЧ-1 в смеси 0,1% твин-буфер для анализа (концентрацию регулировали, чтобы привести приблизительно к 20% обороту субстрата) прибавляли к смеси, содержащей 455 мкл буфера для анализа, 25 мкл раствора ингибитора, 10 мкл раствора субстрата.
Пробирки инкубировали в течение 2 ч при 37°С, реакцию останавливали прибавлением 500 мкл смеси ДМСО-50 мМ трицин (2:1), рН 8,5. Флуоресценцию измеряли на флуоресцентном спектрофотометре, возбуждение при λ=340 нм, излучение при λ=492 нм.
Методика противовирусного анализа
Противовирусную активность в отношении ВИЧ оценивали, используя адаптацию методики Pauwels и др. [Pauwels и др., 1988, J.Virol. Methods 20: 309-321]. Методика основана на способности соединений защищать Т-лимфобластные клетки (клетки МТ4), инфицированные ВИЧ, от клеточной гибели, опосредованной инфекцией. Концевую точку анализа рассчитывали как концентрацию соединения, при которой жизнеспособность клеток в культуре сохранялась на 50% (50% ингибирующая концентрация, IC50). Жизнеспособность клеток в культуре определяли по поглощению растворимого желтого красителя МТТ [бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия] и его восстановления в пурпурную нерастворимую соль формазана. После растворения использовали спектрофотометрические методики для измерения количества производного формазана.
Клетки МТ4 подготавливали в логарифмической фазе роста, и количество из 2×106 клеток инфицировали или клонами вируса дикого типа, или сайт-направленными мутантными клонами ВИЧ-НХВ2 при множественности приблизительно 0,0001 инфекционных единиц вируса на клетку в общем объеме 200-500 мкл. Клетки инкубировали с вирусом в течение 1 ч при 37°С, затем промывали 0,01 М ЗФР, рН 7,2 и снова суспендировали в культуральной среде для инкубации в культуре с серийными разведениями исследуемого соединения. Используемой культуральной средой была RPMI 1640 без фенола красного и с добавлением пенициллина, стрептомицина, L-глутамина и 10% эмбриональной бычьей сыворотки (GM10).
Исследуемые соединения готовили в виде 2 мМ растворов в диметилсульфоксиде (ДМСО). Затем получали четыре повторяющихся серийных 2-кратных разведении в GM10 и количества, составляющие 50 мкл, помещали в 96-луночные планшеты при диапазоне конечных концентраций 625-1,22 нМ. Затем в каждую ячейку прибавляли 50 мкл GM10 и 3,75×104 инфицированных клеток. Были приготовлены также контрольные культуры, не содержащие клеток (слепой опыт), неинфицированных клеток (100% жизнеспособность; 4 повтора) и инфицированных клеток без соединения (тотальная гибель клеток, опосредованная вирусом). Затем культуры инкубировали при 37°С в увлажненной атмосфере 5% СО2 на воздухе в течение 5 суток.
Готовили свежий раствор 5 мг/мл МТТ в 0,01 М ЗФР, рН 7,2 и к каждой культуре прибавляли 20 мкл. Культуры инкубировали дополнительно, как описано выше, в течение 2 ч. Затем их смешивали путем забора с помощью пипетки и спуска из нее, прибавляли 170 мкл тритона Х-100 в подкисленном изопропаноле (10% об./об. тритона Х-100 в смеси концентрированной хлористоводородной кислоты и изопропанола, 1:250), и культуры снова перемешивали путем пипетирования. Когда отложение формазана полностью растворилось при дополнительном смешивании, измеряли поглощение (OD) культур при длинах волн 540 нм и 690 нм (замеры при 690 нм использовали в качестве контролей для артефактов между лунками). Процент защиты для каждой обработанной культуры затем вычисляли по уравнению
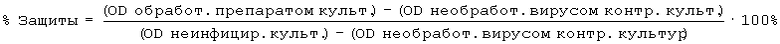
Значения IC50 затем получали из графиков зависимости процента защиты от log10 концентрации препарата.
Значения IC50 соединений по настоящему изобретению, как правило, находятся в диапазоне 1-10000 нМ, предпочтительно в диапазоне 1-60 нМ.
Некоторые репрезентативные данные активности приведены ниже в таблице 9.
Ингибирующая фермент концентрация IC50 округлена после запятой до десятой, противовирусная концентрация IC50 округлена до ближайшего целого числа.
Соединения по настоящему изобретению, а также их фармацевтически приемлемые кислотно-аддитивные соли могут применяться в качестве лекарственных средств, например в форме фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с нанесенным покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в виде суппозиториев, или парентерально, например, в виде инъекционных растворов.
Соединения по настоящему изобретению и их фармацевтически приемлемые кислотно-аддитивные соли могут подвергаться обработке с фармацевтически инертными неорганическими и органическими наполнителями для получения таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.д. могут применяться в качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул.
Соответствующими наполнителями для мягких желатиновых капсул являются растительные масла, воск, жиры, полутвердые и жидкие полиолы и т.д.
Соответствующими наполнителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Соответствующими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Соответствующими наполнителями для суппозиториев являются, например, природные или отвержденные масла, воск, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, вещества, способствующие растворению, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически ценные вещества.
Дозы могут изменяться в широких пределах и, конечно, будут соответствовать индивидуальным требованиям в каждом особом случае. Обычно в случае перорального введения суточная доза примерно 10-2500 мг соединения формулы I на пациента должна быть подходящей, хотя упомянутый верхний предел может быть также превышен при необходимости.
Суточная доза может вводиться как одна доза или в разделенных дозировках. Лечение может проводиться в сочетании с введением одного или нескольких дополнительных терапевтически активных веществ, и такое введение может быть конкурентным или последовательным по отношению к введению соединений формулы I. Так, конкурентное введение, как оно используется в контексте, включает введение агентов в сочетании или комбинации, вместе либо до или после друг друга.
Примеры
Масс-спектры записаны в условиях ионизации электрораспылением на одном из следующих приборов: (a) THERMOQUEST SSQ 7000 [растворитель 0,085% ТФК (трифторуксусная кислота) в смеси 90% ацетонитрил/вода; скорость потока 100 мкл/мин; температура капилляра 250°С; напряжение распыления 5 KB; газ-носитель 80 фунтов/дюйм2] или (б) система ЖХ-МС (жидкостной хроматограф, соединенный с масс-спектрометром) THERMOQUEST 7000 ELECTROSPRAY или MICROMASS PLATFORM ELECTROSPRAY (градиент 0,1% ТФК в воде до 0,085% ТФК в ацетонитриле).
Что касается исходных веществ, которые являются известными соединениями, то некоторые из них могут быть приобретены у торговых поставщиков. Другие известные исходные вещества и их аналоги могут быть получены способами, известными в данной области. Примеры соединений, доступных от торговых поставщиков, и ссылки на синтез других соединений и их аналогов предусмотрены в дальнейшем.
Следующие примеры иллюстрируют настоящее изобретение.
Пример 1
2-[3(S)-[[N-Бензоил-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
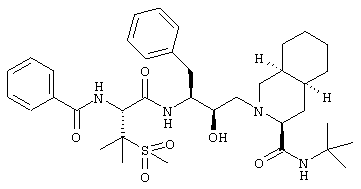
Перемешиваемый раствор 105 мг (0,13 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 4 мл безводного диметилформамида при комнатной температуре обрабатывали 0,4 мл (4 ммоля) пиперидина. Через 2,5 ч летучие вещества упаривали, остаток обрабатывали гексаном, получая N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 3 мл дихлорметана и охлаждали до 0°С. Прибавляли 0,035 мл (0,26 ммоля) N-этилморфолина (NEM), затем 0,016 мл (0,13 ммоля) бензоилхлорида (Aldrich 24,054-0). Через 2 ч раствор разбавляли 20 мл дихлорметана и промывали последовательно 10% водным раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Раствор сушили над сульфатом магния и упаривали при пониженном давлении, получая твердое вещество, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (37:3), получая 60 мг (67%) продукта в виде белого твердого вещества, tпл 212-18°C, (M+H)+ 683,2.
Исходное вещество получали следующим образом.
N-трет-Бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
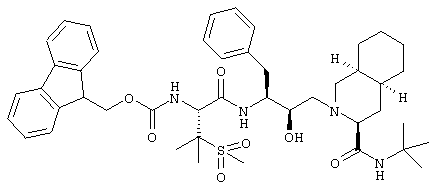
(А) Перемешиваемый раствор 596 мг (4 ммоля) L-пеницилламина (Aldrich 19,631-2) в 40 мл смеси вода/диоксан (1:1) обрабатывали при комнатной температуре 11,04 г (80 ммолей) карбоната калия с последующей обработкой 710 мг (5 ммолей) йодметана и после нее через 1 ч 5,39 г (20 ммолей) N-(9-флуоренилметилоксикарбонил)-оксисукцинимидом (Advanced Chemtech RC8015). После дополнительных 2 ч летучие вещества упаривали, остаток распределяли между водой и эфиром. Раствор подкисляли 2 н. хлористоводородной кислотой, экстрагировали эфиром и объединенную органическую фазу сушили над сульфатом магния. Упаривание досуха дало желтую пену, которую хроматографировали на силикагеле, элюировали смесью дихлорметан/метанол (9:1), получая 4,8 г (78%) N-[(9-флуоренил)метоксикарбонил]-3-(метилтио)-L-валина в виде белой пены, (M+H)+ 385,9.
(Б) Энергично перемешиваемый раствор 4,8 г (12,4 ммоля) N-[(9-флуоренил)метоксикарбонил]-3-(метилтио)-L-валина, полученный выше в разделе (А), в 36 мл воды, содержащей 600 мг (15 ммолей) гидроксида натрия, обрабатывали 8,43 г (99 ммолей) бикарбоната натрия и 12 мл ацетона. Прибавляли по каплям 10,26 г (16,88 ммоля) OXONE® (пероксимоносульфата калия) (Aldrich 22,803-6) в 36 мл 0,0004 М раствора EDTA, и раствор энергично перемешивали в течение 2 ч. Затем прибавляли раствор 6,3 г метабисульфита натрия в 12,6 мл воды, и раствор перемешивали в течение следующих 15 мин. Прибавляли этилацетат, водную фазу подкисляли до рН 2 с 6 н. хлористоводородной кислотой, насыщенной хлористым натрием, и экстрагировали этилацетатом. Объединенную органическую фазу промывали последовательно водой, насыщенным раствором соли, сушили над сульфатом магния и упаривали при пониженном давлении, получая желтую смолу. Растирание со смесью петролейный эфир (tкип 40-60°С)/эфир дало твердое вещество кремового цвета, которое промывали дополнительно эфиром, получая 3,18 г (61%) N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валин в виде белого твердого вещества, tпл 189-92°C, (M+H)+ 417,8.
(В) Раствор 8,34 г (20 ммолей) N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валина, полученного выше в разделе (Б), в безводном тетрагидрофуране охлаждали до -10°С и прибавляли 2,8 мл (20 ммолей) триэтиламина, после этого 2,6 мл (20 ммолей) изобутилхлорформиата (Aldrich 17,798-9). Затем прибавляли 8,02 г (20 ммолей) 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4a(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида (полученного согласно известным методикам, например, Martin, Joseph Armstrong; Redshaw, Sally; EP 432695 A2), и смесь перемешивали при -10°С в течение дополнительных 2 ч, затем давали нагреться до комнатной температуры в течение ночи. Летучие вещества упаривали, остаток распределяли между 100 мл дихлорметана и 100 мл 10% раствора лимонной кислоты. Водную фазу экстрагировали дихлорметаном, объединенную органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая твердое вещество, которое растирали с эфиром, после чего со смесью эфир/этилацетат (10:1), получая 10,84 г (68%) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (M+H)+ 801,4.
Пример 2
N-трет-Бутил-2-[3(S)-[[N-метилэтиламиноацетил-3-(метансульфонил)-L-валил]амино]-2(S)-гидрокси-4-фенилметил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
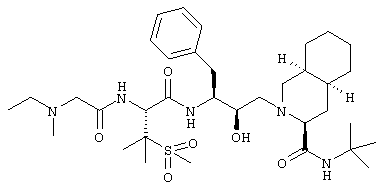
Раствор 38 мг (0,2 ммоля) гидробромида N-этил-N-метилглицина и 116 мг (0,2 ммоля) N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилметил]-3(S)-изохинолинкарбоксамида в 5 мл дихлорметана обрабатывали 28 мг (0,2 ммоля) 1-гидрокси-7-азабензтриазола (НОАТ), 0,05 мл (0,4 ммоля) N-этилморфолина (NEM) и 38 мг (0,2 ммоля) гидрохлорида N-этил-N′-(3-диметиламинопропил)карбодиимида (EDAC·HCl) при 0°С и давали нагреться до комнатной температуры в течение ночи. Реакционную смесь разбавляли дихлорметаном, промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая смолу, которую хроматографировали на силикагеле, элюировали смесью хлороформ/метанол (19:1), получая 65 мг N-трет-бутил-2-[3(S)-[[N-(N-этил-N-метилглицил)-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде белой пены, (М+Н)+ 678,4.
Исходное вещество гидробромид N-этил-N-метилглицина (1:1) получали следующим образом.
(А) Перемешиваемый раствор 0,6 мл (7 ммолей) N-этилметиламина и 0,97 мл (7 ммолей) триэтиламина в 7 мл дихлорметана обрабатывали 1 мл (7 ммолей) трет-бутилбромацетата (Aldrich 12,423-0) и перемешивали в течение ночи. Летучие вещества упаривали, остаток растирали с этилацетатом, и твердое вещество удаляли фильтрованием. Растворитель упаривали, получая 459 мг желтого масла, которое обрабатывали при комнатной температуре 2 мл 45% бромистоводородной кислотой в уксусной кислоте и перемешивали в течение 6 ч. Летучие вещества удаляли при пониженном давлении, остаток тщательно растирали с этилацетатом, получая 413 мг гидробромида N-этил-N-метилглицина в виде белого твердого вещества.
Пример 3
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
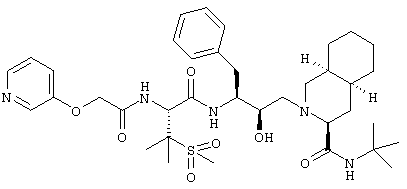
Получали способом, аналогичным тому, который описан в примере 2, но исходя из трифторацетата 2-(3-пиридилокси)уксусной кислоты. (М+Н)+ 714,4.
Исходное вещество трифторацетат 2-(3-пиридилокси)уксусной кислоты получали следующим образом.
(А) Раствор 9,5 г (0,1 моля) 3-гидроксипиридина в 50 мл безводного диметилформамида при 0°С обрабатывали порциями суспензии гидрида натрия в гексане (полученной промыванием гексаном 4 г 60% дисперсии гидрида натрия в минеральном масле). Через 30 мин прибавляли по каплям 19,4 г (0,1 моль) трет-бутилбромацетата, и раствор перемешивали в течение ночи. Летучие вещества упаривали, остаток распределяли между дихлорметаном и водой. Органическую фазу промывали водой, сушили над сульфатом магния и упаривали при пониженном давлении, получая масло, которое хроматографировали на силикагеле, элюировали дихлорметаном, получая 8,9 г зелено-коричневого масла. Масло растворяли в дихлорметане, охлаждали до 0°С, обрабатывали 18 мл трифторуксусной кислоты и давали нагреться до комнатной температуры в течение ночи. Летучие вещества упаривали, остаток растирали с эфиром, получая 9,2 г трифторацетата 2-(3-пиридилокси)уксусной кислоты в виде, светло-коричневого твердого вещества.
Пример 4
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(метоксикарбонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
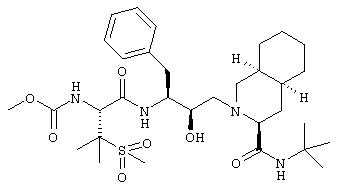
Перемешиваемый раствор 200 мг (0,25 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 5 мл безводного диметилформамида при комнатной температуре обрабатывали 0,63 мл (6,3 ммоля) пиперидина. Через 2,5 ч летучие вещества упаривали, остаток растирали с гексаном, получая N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 5 мл дихлорметана и обрабатывали 0,2 мл (1,5 ммоля) N-этилморфолина (NEM) и 0,02 мл (0,25 ммоля) метилхлорформиата (Aldrich, M3, 530-4) и перемешивали в течение ночи. Прибавляли дополнительные 0,02 мл (0,25 ммоля) метилхлорформиата и перемешивали реакционную смесь в течение дальнейших 3 ч. Раствор разбавляли дихлорметаном и промывали 10% раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Лимоннокислый раствор переводили в основный путем прибавления твердого бикарбоната натрия и экстрагировали дихлорметаном. Объединенную органическую фазу сушили над сульфатом магния и упаривали при пониженном давлении, получая остаток, который хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (19:1), растирали с эфиром, получая 75 мг N-трет-бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(метоксикарбонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, tпл 190-194°С, (M+H)+ 637,4.
Пример 5
2-[3(S)-[[N,3-Бис(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
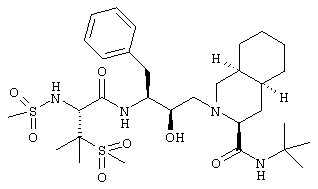
Перемешиваемый раствор 200 мг (0,25 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 5 мл безводного диметилформамида при комнатной температуре обрабатывали 0,63 мл (6,3 ммоля) пиперидина. Через 2,5 ч летучие вещества упаривали, и остаток растирали с гексаном, получая N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 5 мл дихлорметана и обрабатывали 0,12 мл (1,5 ммоля) пиридина, после чего 0,02 мл (0,25 ммоля) метансульфонилхлорида. Через 2 ч раствор разбавляли дихлорметаном, промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая смолу, которую растирали с эфиром и затем хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (19:1) и получая 105 мг 2-[3(S)-[[N,3-бис(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, tпл 135-160°C (вспенивается), 230-235°С (снова плавится, разл.), (М+Н)+ 657,2.
Способом, аналогичным тому, который описан в примере 1, получены также соединения, представленные в таблице 1. Соединения примеров 6, 7, 8, 9, 10 получены из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида, соединения примеров 11 и 12 получены по аналогии с примером 1, но с использованием йодэтана вместо йодметана в разделе (А). Все хлорангидриды кислот, использованные в качестве исходных веществ, приобретены у коммерческих источников, таких как Aldrich и Lancaster.
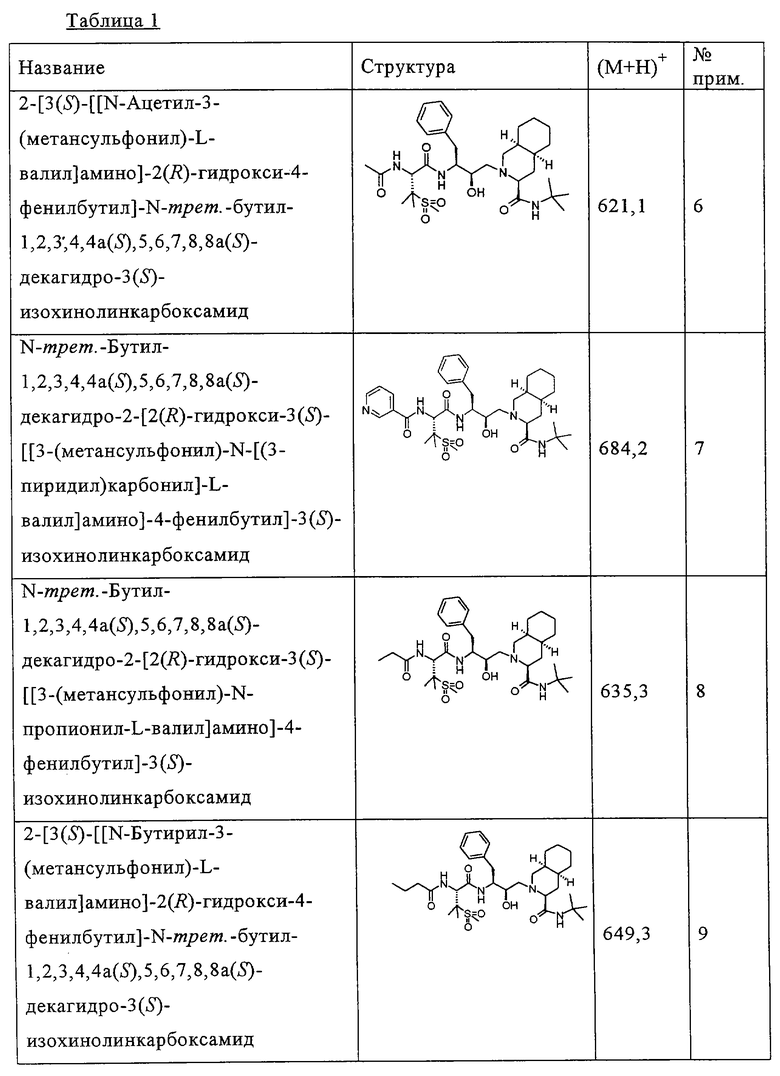
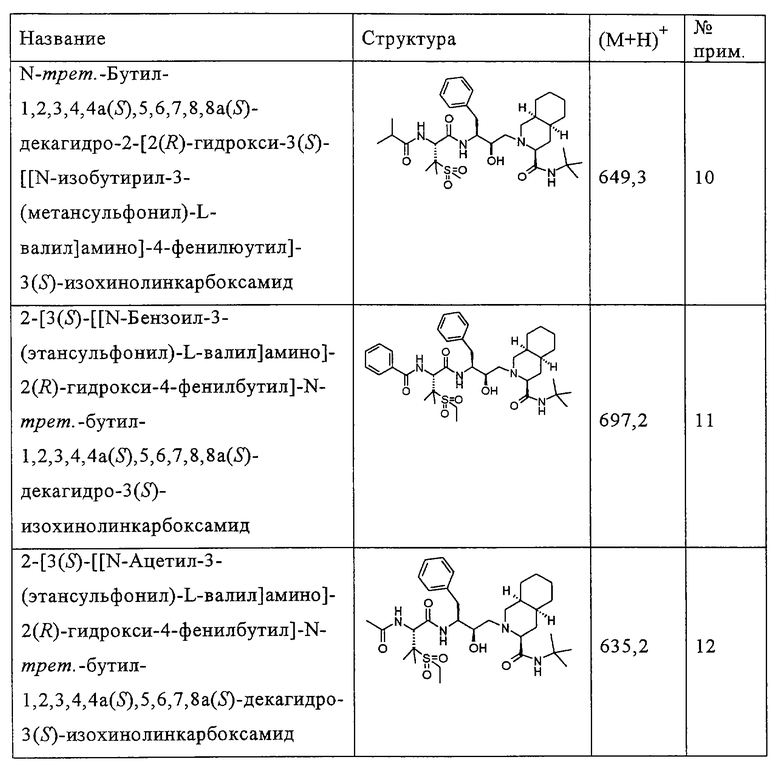
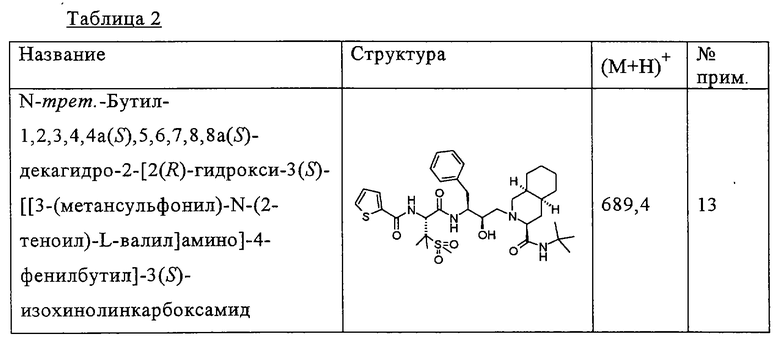
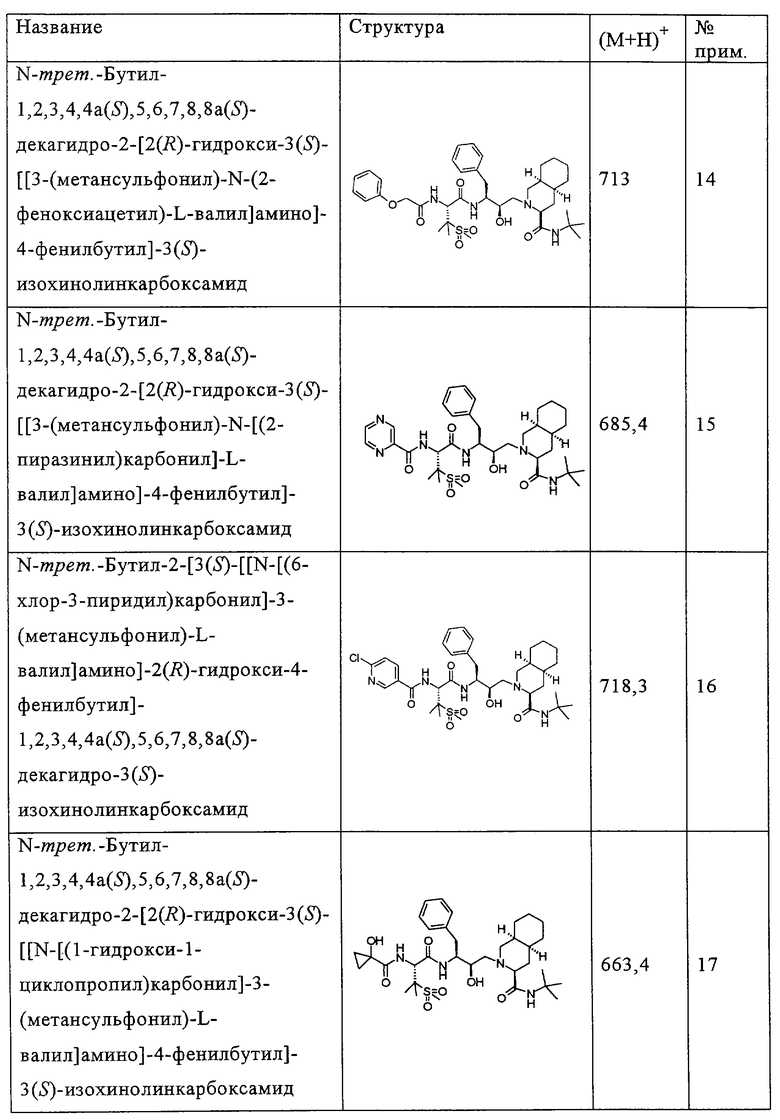
Способом, аналогичным тому, который описан в примерах 2 и 3, были получены соединения таблицы 2, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида.
Другие реагенты, использованные в синтезе соединений таблицы 2, были получены из коммерческих источников, таких как Aldrich, Lancaster и Maybridge Int., или синтезированы способами, описанными в данной области или аналогичными тем, которые описаны.
Например, феноксиуксусная кислота (пример 14), 3-фуранкарбоновая кислота (пример 28), 2-этил-2-гидроксимасляная кислота (пример 23) и 5-бром-2-фуранкарбоновая кислота (пример 32) приобретены у фирмы Aldrich (номера по каталогу 15,851-8; 16,339-2; 13843-6; В6,740-6), 4,5-диметил-2-фуранкарбоновая кислота (пример 33) и 5-(трифторметил)-2-фуранкарбоновая кислота (пример 34) приобретены у фирмы Maybridge Int. (номера по каталогу ВТВ 08890; РС8012), тиофен-3-карбоновая кислота (пример 68) и 5-хлортиофен-2-карбоновая кислота (пример 36) приобретены у фирмы Lancaster (номера по каталогу 1089; 5453).
Тиазол-5-карбоновую кислоту (пример 69) получали согласно методике, описанной в WO 97/14687, и 5-метилтиазол-2-карбоновую кислоту (пример 61) получали аналогично. 2-Метилтиазол-4-карбоновую кислоту (пример 74) получали по аналогии с методикой W.R.Tully и др., J.Med. Chem; 1991, 34, 2060. 2-Изопропоксиуксусную кислоту (пример 72) получали согласно методике, описанной в J.Chem. Soc., 1969, 2698. 2-Метил-2-феноксипропионовую кислоту (пример 80) получали по методике, описанной в патенте Румынии RO 69-61256.
Другие арилоксиуксусные кислоты получали по аналогии с методикой Mertes и др., J.Heterocycl. Chem., 1968, 5, 281 или по методике, описанной в примере 3А для получения трифторацетата 2-(3-пиридилокси)уксусной кислоты. Подобным образом 2-(1-пирролил)уксусную кислоту (пример 62), пиразол-1-уксусную кислоту (пример 64), 1-пирролидинуксусную кислоту (пример 66) и т.д. получали по аналогии с методикой, описанной в примере 2А для получения гидробромида N-этил-N-метилглицина.






Способом, аналогичным тому, который описан в примере 4, соединения таблицы 3 получены, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида и доступных в продаже хлорформиатов.


Пример 92
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-[2-(изопропиламино)ацетил]-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
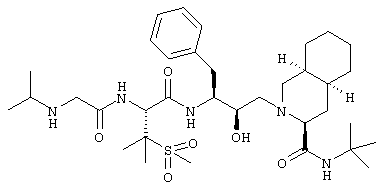
Раствор 0,123 г 2-[3(S)-[[N[N-(бензилоксикарбонил)-N-изопропилглицил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 30 мл этанола в присутствии 10% палладия на угле гидрировали в атмосфере водорода в течение ночи.
Катализатор удаляли фильтрованием, и летучие вещества упаривали при пониженном давлении, получая бесцветное стеклообразное вещество, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (25:1) и получая масло. Масло растирали со смесью петролейный эфир (tкип 40-60°С)/эфир, получая 29 мг N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-[2-(изопропиламино)ацетил]-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 678,5.
Исходное вещество получали следующим образом.
Раствор 1,04 мл (7,6 ммоля) трет-бутилового эфира глицина и 0,11 мл (8,38 ммоля) ацетона в 30 мл этанола в присутствии 10% палладия на угле (Fluka) гидрировали в атмосфере водорода в течение ночи. Катализатор удаляли фильтрованием, летучие вещества упаривали при пониженном давлении, получая 1,08 г (82%) непрозрачного подвижного масла, которое обрабатывали при 0°С 7 мл трифторуксусной кислоты и давали нагреться до комнатной температуры. Через 5 ч летучие вещества упаривали, получая 2,65 г бледно-желтого масла, 1,44 г которого растворяли в 10 мл 2 М раствора гидроксида натрия при 0°С и обрабатывали одновременно 0,89 мл (6,23 ммоля) бензилхлорформиата и 10 мл 2 М раствора гидроксида натрия. Реакционной смеси давали нагреться до комнатной температуры в течение ночи и промывали эфиром. Раствор подкисляли и экстрагировали этилацетатом, объединенную органическую фазу промывали водой, сушили над сульфатом магния и упаривали при пониженном давлении, получая 0,338 г N-(бензилоксикарбонил)-N-изопропилглицина в виде бесцветного масла. Часть этого масла, 0,043 г, вводили в реакцию с 0,1 г (1,73 ммоля) N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида по методике, аналогичной той, которая описана в примере 2, получая 0,123 г 2-[3(S)-[[N-[N-(бензилоксикарбонил)-N-изопропилглицил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде желтого стеклообразного вещества.
Пример 93
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(N-фенилглицил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
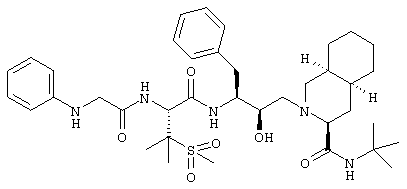
Получали способом, аналогичным тому, который описан в примере 92, исходя из N-фенилглицина (Aldrich 33,046-9). (М+Н)+ 712,5.
Пример 94
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(N-метилглицил)-L-валил]амино1-4-фенилбутил]-3(S)-изохинолинкарбоксамид
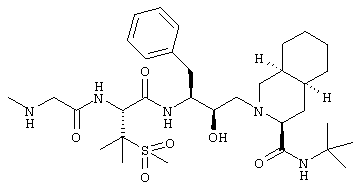
Получали способом, аналогичным тому, который описан для примера 92, исходя из N-(бензилоксикарбонил)саркозина (Bachem C-2570), исключая стадию защиты при получении исходного вещества. (М+Н)+ 650,4.
Пример 95
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-1-[2(R)-гидрокси-3(S)-[3-(метансульфонил)-3-метилбутирамидо]-4-фенилбутил]-2(S)-пиперазинкарбоксамид
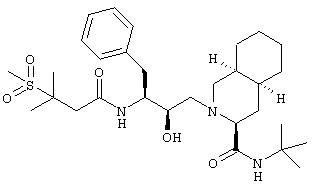
3-(Метансульфонил)-3-метилмасляную кислоту вводили в реакцию с 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4а(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамидом способом, аналогичным тому, который описан в примере 2, получая продукт в виде белого твердого вещества, tпл 95-110°С (вспенивание), (М+Н)+ 564,3.
Исходное вещество 3-(метансульфонил)-3-метилмасляную кислоту получали следующим образом. Перемешиваемый раствор 0,81 г (6 ммолей) 3-меркапто-3-масляной кислоты, полученной из 3,3-диметилакриловой кислоты (Aldrich D13,860-6) согласно методике, описанной G. Pattenden и др., Chem. Soc. Perkm Trans. 1, 1992, 10, 1215-21, в 25 мл смеси диоксан/вода (3:2) обрабатывали 4,14 г (30 ммолей) карбоната калия в 5 мл воды, после чего 1,14 г (8 ммолей) йодметана, экстрагировали эфиром, органическую фазу сушили над сульфатом магния и упаривали при пониженном давлении, получая 0,57 г (64%) 3-метил-3-(метилтио)масляной кислоты в виде бледно-оранжевого масла. Масло растворяли в 12 мл воды, содержащей 188 мг (4,63 ммоля) гидроксида натрия, и обрабатывали 2,59 г (31 ммоль) бикарбоната натрия и 4 мл ацетона, после чего по каплям прибавляли 3,16 г (5,13 ммоля) OXONE® (Aldrich 17,798-9), растворенного в 12 мл 0,0004 М раствора EDTA. Через 2 ч прибавляли 2 г метабисульфита натрия, и раствор перемешивали в течение 15 мин. Раствор подкисляли до рН 2 и экстрагировали этилацетатом. Органическую фазу промывали водой, насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 585 мг бесцветного масла, (М+Н)+ 181 (химическая ионизация с образованием положительных ионов).
Пример 96
2-[3(S)-[3-(Этансульфонил)-3-метилбутирамидо]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
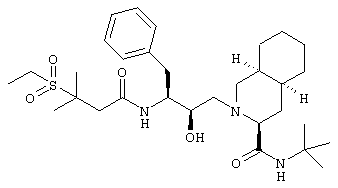
Получали способом, аналогичным тому, который описан в примере 2, взаимодействием 3-(этансульфонил)-3-метилмасляной кислоты с 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4a(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамидом (М+Н)+ 578,2.
Исходное вещество 3-(этансульфонил)-3-метилмасляную кислоту получали способом, аналогичным тому, который описан для получения 3-(метансульфонил)-3-метилмасляной кислоты, исходного вещества из примера 95, используя йодэтан вместо йодметана.
Пример 97
2-[3(S)-[3-(Бензилсульфонил)-3-метилбутирамидо]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
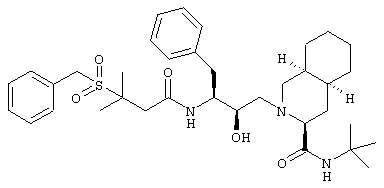
Получали способом, аналогичным тому, который описан в примере 2, взаимодействием 3-(бензилсульфонил)-3-метилмасляной кислоты с 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4а(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамидом. (М+Н)+ 640.
Исходное вещество 3-(бензилсульфонил)-3-метилмасляную кислоту получали из 3-(бензилтио)-3-метилмасляной кислоты (G.Pattenden и др., J.Chem. Soc., Perkin Trans. 1, 1992, 10, 1215-21) способом, аналогичным тому, который описан для получения исходного вещества в примере 95.
Пример 98
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[3(S)-[[N-[2-(тетрагидро-2(RS)-метил-1,1-диоксо-2-тиенил)ацетил]амино]-2(R)-гидрокси-4-фенилбутил]-3(S)-изохинолинкарбоксамид (смесь диастереоизомеров)

Получали способом, аналогичным тому, который описан в примере 2, взаимодействием S,S-диоксида тетрагидро-2(RS)-метил-2-тиофенуксусной кислоты с 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4а(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамидом. (М+Н)+ 576,3.
Исходное вещество S,S-диоксид тетрагидро-2(RS)-метил-2-тиофенуксусной кислоты получали из тетрагидро-2-метилтиофенуксусной кислоты (R.A.Bunce и др., J.Org. Chem. 1992, 57(6), 1727-33) способом, аналогичным тому, который описан для получения исходного вещества в примере 95.
Пример 99
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[2(R)-гидрокси-3-(метансульфонил)-3-метилбутирамидо]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
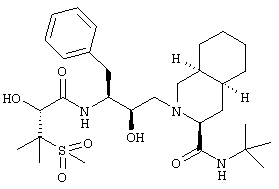
Получали способом, аналогичным тому, который описан в примере 2, взаимодействием 2(R)-гидрокси-3-(метансульфонил)-3-метилмасляной кислоты с 2-(3(S)-амино-2(R)-гидрокси-4-фенилбутил)-N-трет-бутил-1,2,3,4,4а(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамидом. (М+Н)+ 580,4.
Исходное вещество 2(R)-гидрокси-3-(метансульфонил)-3-метилмасляную кислоту получали следующим образом.
Перемешиваемый раствор 2,25 г (5,3 ммоля) защищенной аминокислоты из примера 1 (часть Б) в 20 мл безводного диметилформамида обрабатывали 1,1 мл (11 ммолей) пиперидина. Через 1 ч летучие вещества упаривали, и остаток затирали с эфиром, после чего с этилацетатом, получая 1 г смолы, которую растворяли в 8 мл 10% об./об. серной кислоты и нагревали до 50°С. Прибавляли по каплям раствор 1,3 г нитрита натрия в 3 мл воды и через 30 мин прибавляли дополнительно 0,7 г нитрита натрия в 2 мл воды. Реакционную смесь охлаждали и экстрагировали этилацетатом, объединенную органическую фазу промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 200 мг 2(R)-гидрокси-3-(метансульфонил)-3-метилмасляную кислоту в виде смолы.
Пример 100
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-(диметилкарбамоил-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид

Перемешиваемый раствор 0,4 г (0,5 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 10 мл безводного диметилформамида при комнатной температуре обрабатывали 1 мл (10 ммолей) пиперидина. Через 1 ч летучие вещества упаривали, и остаток растирали с гексаном, получая N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 5 мл ацетонитрила и обрабатывали 100 мг (0,5 ммоля) n-нитрофенилхлорформиата (Aldrich 16,021-0), после чего 84 мг (1 ммоль) твердого бикарбоната натрия. Через 15 мин прибавляли 0,25 мл 2 М раствора диметиламина в тетрагидрофуране (Aldrich 39,195-6) и 0,14 мл триэтиламина, и реакционную смесь перемешивали в течение 2 ч. Летучие вещества упаривали при пониженном давлении, и остаток распределяли между водой и дихлорметаном, водную фазу экстрагировали дихлорметаном. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая масло, которое хроматографировали на силикегеле, элюируя смесью дихлорметан/метанол (19:1) и получая 62 мг (20%) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-(диметилкарбамоил-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 650,4.
Способом, аналогичным тому, который описан в примере 100, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида, получали также соединения, приведенные в таблице 4. Другие реагенты, использованные в синтезе соединений таблицы 4, были получены из коммерческих источников, таких, как Aldrich и Lancaster.

Пример 110
N-трет-Бутил-1,2,3,4,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-изопропил-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
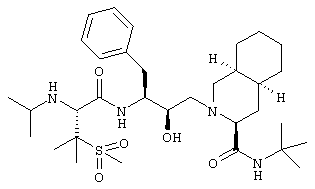
Перемешиваемый раствор 0,4 г (0,5 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 10 мл безводного диметилформамида при комнатной температуре обрабатывали 1 мл (10 ммолей) пиперидина. Через 1 ч летучие вещества упаривали, и остаток растирали с гексаном, получая N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 8 мл дихлорметана и обрабатывали в атмосфере азота 0,037 мл (0,5 ммоля) ацетона, 0,028 мл (0,5 ммоля) ледяной уксусной кислоты и 160 мг (0,75 ммоля) триацетоксиборгидрида натрия. Реакционную смесь перемешивали в течение ночи, затем летучие вещества упаривали. Остаток распределяли между дихлорметаном и водой и экстрагировали дихлорметаном. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая смолу, которую хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (4:1), затем растирали с гексаном, получая 127 мг (41%) N-трет-бутил-1,2,3,4,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-изопропил-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества. (М+Н)+ 621,3.
Способом, аналогичным тому, который описан в примере 110, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8a(S)-декагидро-3(S)-изохинолинкарбоксамида, были получены также соединения, представленные в таблице 5. Другие реагенты, использованные в синтезе соединений таблицы 5, были получены из коммерческих источников, таких как Aldrich, Lancaster и Maybridge Int., например, фурфураль (пример 114)и 2-фторбензальдегид (пример 116) приобретены у Aldrich, номера по каталогу (31б991-0), (А480-7), 4(5)-формил-2-метилимидазол (пример 134) приобретен у Maybridge Int. (SB 01361).



Пример 137
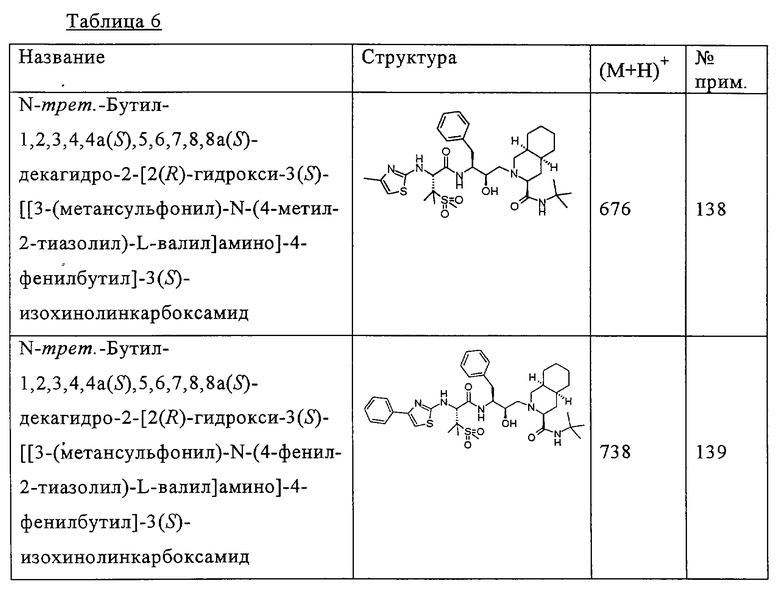
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(2-тиазолил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид

Перемешиваемый раствор 255 мг (0,4 ммоля) N-трет-бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(тиокарбамоил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в 5 мл этанола обрабатывали 0,1 мл хлорацетальдегида (50% раствор в воде) и нагревали при кипении в течение 4 ч. Летучие вещества упаривали, остаток распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Водную фазу экстрагировали дихлорметаном, и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая твердое вещество, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (19:1) и получая 100 мг (38%) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(2-тиазолил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 662,2.
Исходное вещество N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(тиокарбамоил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид получали следующим образом.
(А) Перемешиваемый раствор 1,6 г (2 ммоля) N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в 40 мл безводного диметилформамида при комнатной температуре обрабатывали 4 мл (40 ммолей) пиперидина. Через 1 ч летучие вещества упаривали, и остаток растирали с гексаном, получая N-трет-бутил-1,2,3;4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид в виде смолы, которую растворяли в 5 мл ацетона и обрабатывали 0,28 мл (2,1 ммоля) бензоилизоцианата (Aldrich 26,165-3). Перемешиваемую реакционную смесь нагревали при кипении в течение 4 ч и затем охлаждали. Летучие вещества упаривали при пониженном давлении, и остаток растирали с гексаном, получая смолу, которую затем хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (2:1) и получая 765 мг (52%) 2-[3(S)-[[N-(бензоилтиокарбамоил)-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4a(S), 5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде желтовато-коричневой пены, (М+Н)+ 742,3, которая была объединена с другой серией вещества и использована на следующем этапе.
(Б) Перемешиваемый раствор 850 мг (1,15 ммоля) 2-[3(S)-[[N-(бензоилтиокарбамоил)-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида, полученного выше в разделе (А), в 6 мл смеси метанол/ацетон (1:1) обрабатывали 115 мг (1,15 ммоля) бикарбоната калия и 0,5 мл воды. Через 5 ч прибавляли 1 мл уксусной кислоты, и смесь перемешивали в течение дополнительных 10 мин.
Летучие вещества упаривали при пониженном давлении, оставшуюся воду удаляли повторным соупариванием с этанолом, получая смолообразное масло, которое хроматографировали на силикагеле, элюируя смесью хлороформ/метанол (19:1), получая 710 мг (97%) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(тиокарбамоил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белой пены, (М+Н)+ 638.
Способом, аналогичным тому, который описан в примере 137, исходя из N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(тиокарбамоил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида, получены также соединения, представленные в таблице 6. Другие реагенты получены из коммерческих источников.
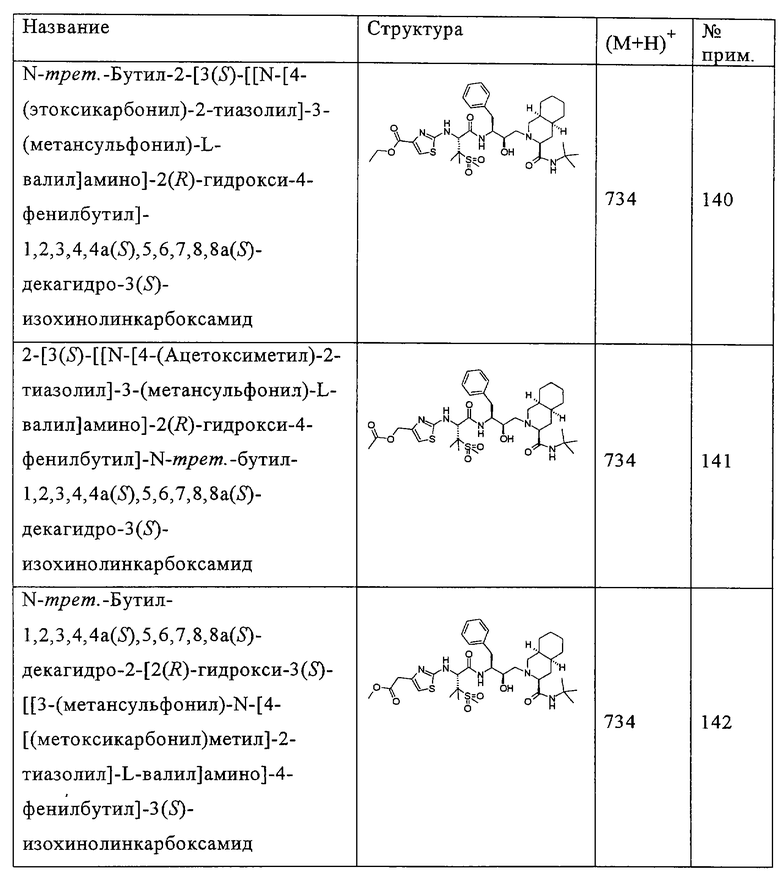
Пример 143
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-[4-(гидроксиметил)-2-тиазолил]-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
Перемешиваемый раствор 73 мг (0,1 ммоля) 2-[3(S)-[[N-[4-(ацетоксиметил)-2-тиазолил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида (пример 141) в 7 мл смеси метанол/вода (5:2) обрабатывали 700 мг карбоната калия. Через 15 ч летучие вещества упаривали, и остаток распределяли между этилацетатом и водой. Водную фазу экстрагировали этилацетатом, объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая смолу, которую хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (40:3) и получая 32 мг (48%) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[N-[4-(гидроксиметил)-2-тиазолил]-3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде твердого вещества, tпл 126°С, (M+H)+ 692.
Пример 144
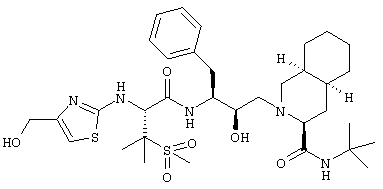
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[3(S)-[2(R)-(2,3-дигидро-2-оксо-1H-имидазол-3-ил)-3-(метансульфонил)-3-метилбутирамидо]-2(R)-гидрокси-4-фенилбутил]-3(S)-изохинолинкарбоксамид
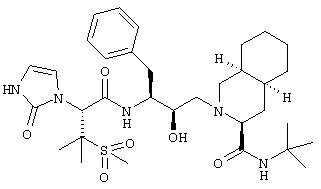
Перемешиваемый раствор 0,578 г (1 ммоль) N-трет-бутил-1,2,3,4,4а(S),5,5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида растворяли в 20 мл ацетонитрила и обрабатывали 201 мг (1 ммоль) n-нитрофенилхлорформиата, после чего 168 мг (21 ммоль) бикарбоната натрия. Через 15 мин прибавляли 0,11 мл диметилацеталя аминоацетальдегида (Lancaster 7520) и 0,28 мл (2 ммоля) триэтиламина, и реакционную смесь перемешивали в течение 2 ч. Летучие вещества упаривали при пониженном давлении, и остаток распределяли между водой и дихлорметаном. Водную фазу экстрагировали дихлорметаном, объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая желтую смолу, которую растирали с гексаном, после чего с этилацетатом, получая 466 мг (66%) твердого вещества кремового цвета, tпл 228-30°С, (М+Н)+ 710. Растворяли 420 мг (0,59 ммоля) твердого вещества в 20 мл ацетона и обрабатывали 5 мл 10% хлористоводородной кислоты и перемешивали в течение ночи. Раствор обрабатывали насыщенным раствором бикарбоната натрия и частично упаривали. Раствор экстрагировали дихлорметаном, и объединенную органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали, получая твердое вещество кремового цвета, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (38:1), получая 50 мг(13%) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[3(S)-[2(R)-(2,3-дигидро-2-оксо-1H-имидазол-2-ил)-3-(метансульфонил)-3-метилбутирамидо]-2(R)-гидрокси-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 646.
Пример 145
N-Бензил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(метоксикарбонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
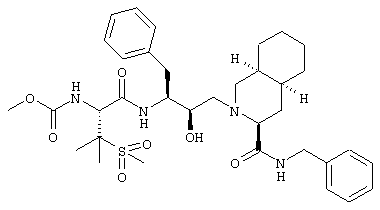
Раствор 0,13 мл (1,2 ммоля) бензиламина в 5 мл дихлорметана обрабатывали 0,6 мл триметилалюминия (2 М раствор в толуоле) и перемешивали при комнатной температуре в течение 15 мин. Прибавляли по каплям раствор 68 мг лактона N1-[1(S)-(1,3,4,6,6a(S),7,8,9,10,10a(S),11,11a(S)-додекагидро-1-оксо-1,4-оксазино[4,3-b]изохинолин-3(R)-ил)-2-фенилэтил]-3-(метансульфонил)-N2-(метоксикарбонил)-L-валинамида, растворенного в 5 мл дихлорметана, после чего прибавляли 5 мл толуола, и раствор перемешивали в течение ночи. Прибавляли по каплям разбавленную хлористоводородную кислоту, и раствор экстрагировали дихлорметаном. Объединенную органическую фазу промывали разбавленной хлористоводородной кислотой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая остаток, который кристаллизовали из смеси дихлорметан/метанол с образованием 15 мг N-бензил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-(метоксикарбонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 671.
Исходное вещество N1-[1(S)-(1,3,4,6,6a(S),7,8,9,10,10a(S),11,11a(S)-додекагидро-1-оксо-1,4-оксазино[4,3-b]изохинолин-3(R)-ил)-2-фенилэтил]-3-(метансульфонил)-N2-(метоксикарбонил)-L-валинамид получали следующим образом.
(А) Суспендировали 23,8 г (0,1 моля) N-трет-бутил-1,2,3,4,4a(S),4,5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида, полученного согласно известным методикам, например Martin, Joseph Armstrong; Redshaw, Sally, EP 432695 A2, в 100 мл 6 н. хлористоводородной кислоты и перемешивали при кипении в течение 23 ч. Реакционную смесь упаривали досуха, получая 23,1 г белого твердого вещества, которое растворяли в 200 мл воды и обрабатывали 30 мл 4 н. раствора гидроксида натрия. Раствор охлаждали до 4°С и энергично перемешивали по мере того, как одновременно прибавляли 15,5 мл (0,11 моля) бензилхлорформиата и 4,4 г (0,11 моля) гидроксида натрия в 15 мл воды. Реакционную смесь перемешивали в течение следующего 1 ч, доводя значение рН до 9 прибавлением 4 н. раствора гидроксида натрия, и затем нагревали до комнатной температуры. Через 2 ч раствор разбавляли водой и экстрагировали гексаном. Водную фазу подкисляли концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Объединенную органическую фазу промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 29,6 г смолы, которую растворяли в 300 мл этилацетата и энергично перемешивали, прибавляя по каплям 10,7 мл (0,093 моля) циклогексиламина. Прибавляли следующие 200 мл этилацетата, и смесь перемешивали в течение ночи и затем фильтровали, получая 28,9 г твердого вещества, которое объединяли с 10,4 г того же вещества из другой серии и распределяли между 400 мл этилацетата и 250 мл 2 н. хлористоводородной кислоты. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали, получая смолу. Перемешиваемый раствор смолы в 50 мл дихлорметана обрабатывали раствором 41,3 г (0,18 ммоля) трет-бутилтрихлорацетимидата (Aldrich) в 400 мл циклогексана, после чего 1,9 мл диэтилэфирата трехфтористого бора (Fluka). Смесь перемешивали в течение ночи, прибавляли бикарбонат натрия, и через 30 мин раствор фильтровали. Летучие вещества упаривали, получая смолу, которую растворяли в 500 мл этилацетата и промывали 2 н. раствором карбоната натрия, водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 28 г смолы. Раствор 18,8 г смолы в 500 мл этанола гидрировали в присутствии 1,9 г 5% палладия на угле (Fluka). Катализатор отделяли фильтрованием, летучие вещества упаривали при пониженном давлении, получая белое твердое вещество, которое распределяли между 300 мл метил-трет-бутилового эфира и 250 мл насыщенного раствора бикарбоната натрия. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 10 г (0,042 моля) бледно-желтой смолы, которую растворяли в 200 мл этанола. Прибавляли 12,43 г (0,042 моля) 2(S)-[1(S)-(бензилоксиформамидо)-2-фенилэтил]оксирана (полученного согласно известным методикам (ЕР 346847 А2)), и смесь нагревали при кипении в течение 10 ч. Летучие вещества упаривали, и остаток хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (1:2) и получая 19,5 г твердого вещества кремового цвета, из которого 1,072 г (2,0 ммоля) растворяли в 5 мл ледяной уксусной кислоты и обрабатывали 10 мл 45% бромистого водорода в уксусной кислоте, перемешивали в течение 1,5 ч. Летучие вещества упаривали почти досуха, твердое вещество отделяли фильтрованием и промывали ледяной уксусной кислотой, после чего эфиром. Твердое вещество распределяли между этилацетатом и водным раствором карбоната натрия, органическую фазу промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 493 мг гидробромида 3(R)-(1(S)-амино-2-фенилэтил)-3,4,6а(S),7,8,9,10,10a(S),11,11а(S)-декагидро-1,4-оксазино[4,3-b]изохинолин-1(6H)-она в виде белой пены, (М+Н)+ 329,0.
(Б) Перемешиваемую суспензию 417 мг (1 ммоль) N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валина, полученного выше в примере 1(Б), в 5 мл тетрагидрофурана обрабатывали 115 мг (1 ммоль) N-этилморфолина (NEM) и охлаждали до 0°С в атмосфере азота. Прибавляли 0,13 мл (1 ммоль) изобутилхлорформиата, и реакционную смесь перемешивали в течение 15 мин. Прибавляли раствор 295 мг (0,9 ммоля) гидробромида 3(R)-(1(S)-амино-2-фенилэтил)-3,4,6а(S),7,8,9,10,10а(S),11,11а(S)-декагидро-1,4-оксазино[4,3-b]изохинолин-1(6H)-она, полученного выше в разделе (А), в 5 мл тетрагидрофурана и давали раствору нагреться до комнатной температуры в течение ночи. Раствор распределяли между этилацетатом и водой, и органическую фазу промывали 10% раствором лимонной кислоты, водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая желтую смолу. Смолу хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (1:1) и получая 281 мг продукта, (М+Н)+ 729, который растворяли в 5 мл дихлорметана и обрабатывали 1 мл пиперидина, перемешивали при комнатной температуре в течение 2 ч. Раствор разбавляли гексаном и фильтровали, фильтрат упаривали при пониженном давлении. Остаток хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (19:1) и затем кристаллизовали из смеси эфир/гексан, получая 120 мг (0,24 ммоля) белого твердого вещества, (М+Н)+ 506, которое растворяли в 4 мл смеси диоксан/вода (1:1) и обрабатывали 66 мг карбоната калия и 0,19 мл метилхлорформиата. Раствор перемешивали в течение ночи и затем распределяли между этилацетатом и водой. Органическую фазу промывали водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая 68 мг N1-[1(S)-(1,3,4,6,6a(S),7,8,9,10,10a(S),11,11a(S)-додекагидро-1-оксо-1,4-оксазино[4,3-b]изохинолин-3(R)-ил)-2-фенилэтил]-3-(метансульфонил)-N2-(метоксикарбонил)-L-валинамида в виде белого твердого вещества, (М+Н)+ 564.
Пример 146
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-(изобутирилокси)-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
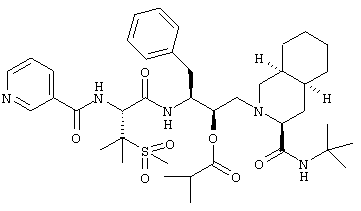
Раствор 0,15 г (0,21 ммоля) N-трет-бутил-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида (пример 7) в 1 мл пиридина обрабатывали 0,092 мл (0,21 ммоля) изобутирилхлорида при 0°С и в течение ночи давали достичь комнатной температуры. Летучие вещества упаривали, и остаток распределяли между дихлорметаном и насыщенным раствором бикарбоната натрия. Органическую фазу сушили над сульфатом натрия и упаривали при пониженном давлении, получая смолу, которую хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (25:1), и растирали со смесью эфир/петролейный эфир с tкип 40-60°С, получая 83 мг N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-(изобутирилокси)-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 754,5.
Пример 147
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-(изобутирилокси)-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
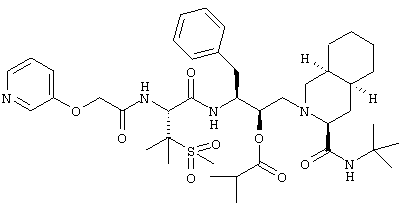
Перемешиваемый раствор 190 мг (2,66 ммоля) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида (пример 3) и 26 мг (2,66 ммоля) изомасляной кислоты в 3 мл дихлорметана обрабатывали 36 мг (2,92 ммоля) 4-(диметиламино)пиридина (DMAP) и 56 мг (2,92 ммоля) EDAC·HCl и оставляли при комнатной температуре в течение ночи. Прибавляли новую порцию 26 мг изомасляной кислоты, 36 мг DMAP и 56 мг EDAC·HCl, и реакционную смесь перемешивали дополнительные 2 ч. Раствор разбавляли дихлорметаном, и органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая бесцветное стеклообразное вещество, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (97:3), получая 153 г N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-(изобутирилокси)-3(S)-[[3-(метансульфонил)-N-[2-(3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида в виде белой пены, (М+Н)+ 784,6.
Пример 148
N-трет-Бутил-1,2,3,4,4а(a),4,5,6,8,8(S)-декагидро-2-[3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенил-2(R)-(L-валилокси)бутил]-3(S)-изохинолинкарбоксамид
Перемешиваемый раствор 150 мг (2,19 ммоля) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида (пример 7), 61 мг (2,41 ммоля) карбобензилокси-L-валина (ВАСНЕМ С-2805) и 33 мг (2,41 ммоля) 1-гидроксибензтриазола (НОВТ) в 2 мл дихлорметана обрабатывали 0,026 мл (2,1 ммоля) NEM и 46 мг (2,41 ммоля) EDAC·HCl. Дополнительные эквивалентные порции карбобензилокси-L-валина, НОВТ и EDAC·HCl прибавляли ежедневно в течение 11 дней. Раствор разбавляли дихлорметаном и промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали при пониженном давлении, получая оранжевую смолу, которую хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (97:3), получая 137 мг белой пены. Пену растворяли в 20 мл этанола и гидрировали с 10% палладием на угле в атмосфере водорода в течение 1 ч. Катализатор удаляли фильтрованием, летучие вещества упаривали при пониженном давлении, получая белое твердое вещество, которое хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (47:2), растирали со смесью эфир/петролейный эфир с tкип 40-60°С, получая 14 мг N-трет-бутил-1,2,3,4,4а(a),4,5,6,8,8(a
)-декагидро-2-[3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенил-2(R)-(L-валилокси)бутил]-3(S)-изохинолинкарбоксамида в виде белого твердого вещества, (М+Н)+ 783,5.
Пример 149
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[3(S)-[[N-[(2-индолил)карбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-[4-(морфолинометил)бензоилокси]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
Получали способом, аналогичным описанному для примера 157, исходя из N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-N-[(2-индолил)карбонил]-3(S)-[[3-(метансульфонил)-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида (пример 86) и 4-(морфолинометил)бензойной кислоты, которую получали согласно методике, описанной Н.Bundgaard и др., J.Med. Chem. 1989, 32, 2503. (М+Н)+ 925,6.
Пример 150
N-трет-Бутил-2-[3(S)-[[N-(3-цианобензоил)-3-(метансульфонил)-L-валил]амино]-2(R)-[2-[2-(2-метоксиэтокси)этокси]ацетокси]-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид

Получали способом, аналогичным описанному в примере 147, исходя из N-трет-бутил-2-[3(S)-[[N-(3-цианобензоил)-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида (пример 39) и 2-[2-(2-метоксиэтокси)этокси]уксусной кислоты (Aldrich 40,7000-3). (М+Н)+ 868,5.
Пример 151
N-трет-Бутил-2-[2(R)-(3-карбоксипропионилокси)-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
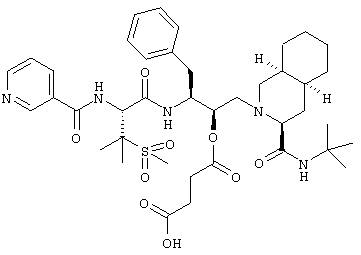
Раствор 68 мг (0,1 ммоля) N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамида (пример 7) в 10 мл тетрагидрофурана обрабатывали 10 мг (1 ммоль) ангидрида янтарной кислоты (Aldrich 23,960-0) и нагревали при кипении в течение ночи. Летучие вещества упаривали при пониженном давлении, и остаток хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол (19:1) и получая 53 мг N-трет-бутил-2-[2(R)-(3-карбоксипропионилокси)-3(S)-[[3-(метансульфонил)-N-[(3-пиридил)карбонил]-L-валил]амино]-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида в виде пены, (М+Н)+ 784,5.
Пример 152
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(2-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
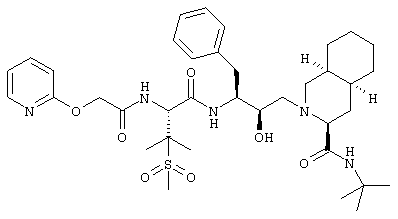
Получали способом, аналогичным тому, который описан в примере 2, но исходя из 2-(2-пиридилокси)уксусной кислоты. (М+Н)+ 714.
Исходное вещество 2-(2-пиридилокси)уксусную кислоту получали согласно методикам, описанным в данной области. Например, следуя методикам Hill и Мс Graw, J. Org.Chem., 1949, 14, 783-787 и Maas и др., Rec. Trav. Chim. Pays-Bas, 1955,74, 175-179.
Пример 153
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(6-метил-3-пиридилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
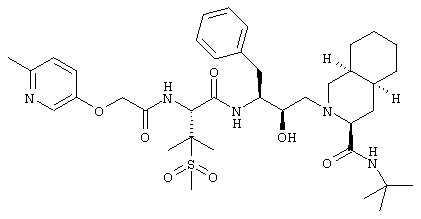
Получали способом, аналогичным тому, который описан в примере 2, но исходя из гидробромида 2-(6-метил-3-пиридилокси)уксусной кислоты.
Исходное вещество гидробромид 2-(6-метил-3-пиридилокси)уксусной кислоты получали следующим образом.
Прибавляли 1,09 г (0,01 моля) 3-гидрокси-6-метилпиридина к перемешиваемой суспензии 440 мг гидрида натрия (60% дисперсия в минеральном масле) в 20 мл безводного диметилформамида при 0°С в атмосфере азота. После того, как выделение пузырьков газа ослабло, прибавляли по каплям 1,94 г (0,01 моля) трет-бутилбромацетата, и раствор перемешивали в течение ночи. Летучие вещества упаривали, и остаток распределяли между дихлорметаном и 10% раствором лимонной кислоты. Органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Объединенную органическую фазу сушили над сульфатом магния и упаривали при пониженном давлении, получая 1,8 г смолы, (М+Н)+ 224, которую обрабатывали 3 мл 45% бромистоводородной кислоты в уксусной кислоте при 0°С. Прибавляли 5 мл уксусной кислоты, и суспензию перемешивали в течение ночи. Летучие вещества упаривали, и остаток растирали с петролейным эфиром с tкип 40-60°С, получая гидробромид 2-(6-метил-3-пиридилокси)уксусной кислоты в виде желтовато-коричневого твердого вещества.
Пример 154
N-трет-Бутил-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(3-пиразинилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
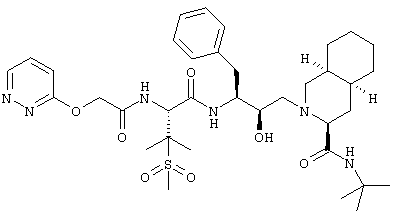
Получали способом, аналогичным тому, который описан в примере 2, но исходя из трифторацетата 2-(3-пиразинилокси)уксусной кислоты.
Исходное вещество трифторацетат 2-(3-пиразинилокси)уксусной кислоты получали следующим образом.
Перемешиваемую суспензию 88 г (2,2 ммоля) гидрида натрия (60% дисперсия в минеральном масле) в 5 мл безводного диметилформамида при -5°С в атмосфере азота обрабатывали 264 мг (2 ммоля) трет-бутилгликолята. Через 10 мин прибавляли 298 мг (2 ммоля) 3,6-дихлорпиридазина (Aldrich D7, 320-0), раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Летучие вещества упаривали при пониженном давлении, и остаток хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (1:2) и получая 210 мг смолы, которую растворяли в 20 мл этанола и гидрировали в атмосфере водорода с 10% палладием на угле (Fluka) в течение ночи. Катализатор удаляли фильтрованием, летучие вещества упаривали при пониженном давлении, получая смолу, которую хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (1:2), затем этилацетатом, получая 50 мг смолы (M+H+MeCN)+ 252. Смолу растворяли в 2 мл дихлорметана и обрабатывали 1 мл трифторуксусной кислоты. Через 10 мин летучие вещества упаривали, и остаток растирали с толуолом и снова упаривали, получая смолу, которую дополнительно растирали с петролейным эфиром с tкип 40-60°С, получая трифторацетат 2-(3-пиразинилокси)уксусной кислоты.
Пример 155
N-трет-Бутил-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-2-[2(R)-гидрокси-3(S)-[[3-(метансульфонил)-N-[2-(2-пиримидинилокси)ацетил]-L-валил]амино]-4-фенилбутил]-3(S)-изохинолинкарбоксамид
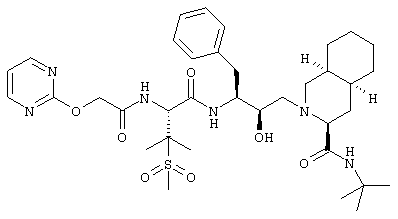
Получали способом, аналогичным тому, который описан в примере 2, но исходя из трифторацетата 2-(пиримидин-2-илокси)уксусной кислоты. (М+Н)+ 715.
Исходное вещество трифторацетат 2-(пиримидин-2-илокси)уксусной кислоты получали следующим образом.
Перемешиваемую суспензию 88 мг (2,2 ммоля) гидрида натрия (60% дисперсия в минеральном масле) в 5 мл диметилформамида при -5°С в атмосфере азота обрабатывали 264 мг (2 ммоля) трет-бутилгликолята. Через 30 мин прибавляли 318 мг (2 ммоля) 2-бромпиридина, раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Летучие вещества упаривали, и остаток распределяли между дихлорметаном и 10% раствором лимонной кислоты. Органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Объединенную органическую фазу сушили над сульфатом магния и упаривали при пониженном давлении, получая 360 мг смолы. Смолу хроматографировали на силикагеле, элюируя смесью этилацетат/гексан (1:1) и получая 105 мг смолы, которую растворяли в 3 мл дихлорметана и обрабатывали 1,5 мл трифторуксусной кислоты. Через 1,5 ч летучие вещества упаривали, и остаток растирали с толуолом и снова упаривали, получая смолу, которую дополнительно растирали с петролейным эфиром с tкип 40-60°С, получая 60 мг трифторацетата 2-(пиримидин-2-илокси)уксусной кислоты в виде белого твердого вещества.
Пример 156
N-трет-Бутил-2-[3(S)-[[N-[2-(3-фторфенокси)ацетил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8a(S)-декагидро-3(S)-изохинолинкарбоксамид
Получали способом, аналогичным тому, который описан в примере 3, но исходя из 3-фторфенола вместо 3-гидроксипиридина. (М+Н)+ 731,6, tпл 197-199°С.
Пример 157
N-трет-Бутил-2-[3(S)-[[N-[2-(4-фторфенокси)ацетил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4a(S),5,6,7,8,8a(S)-декагидро-3(S)-изохинолинкарбоксамид
Получали способом, аналогичным тому, который описан в примере 3, но исходя из 4-фторфенола вместо 3-гидроксипиридина. (М+Н)+ 731.
Способом, аналогичным тому, который описан в примерах 2 и 3, получали соединения таблицы 7, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида.
Другие реагенты, использованные в синтезе соединений таблицы 7, получали из коммерческих источников, таких как Aldrich, Lancaster и Maybridge Int., или синтезировали, используя методики, описанные в данной области или аналогичные тем, которые описаны.
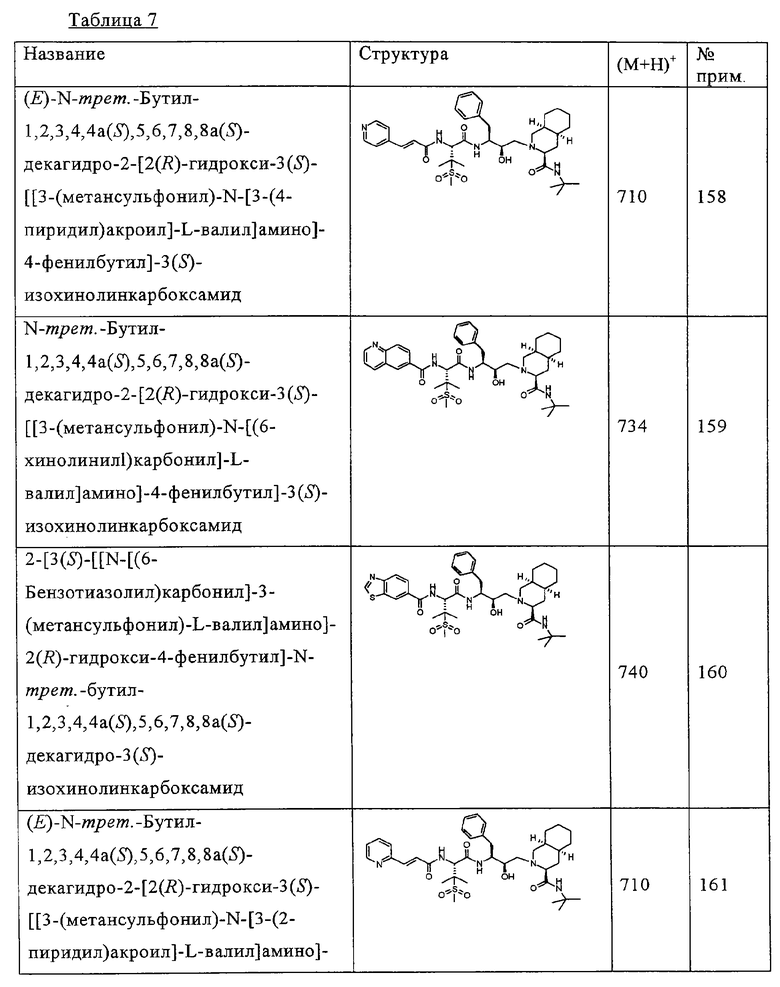
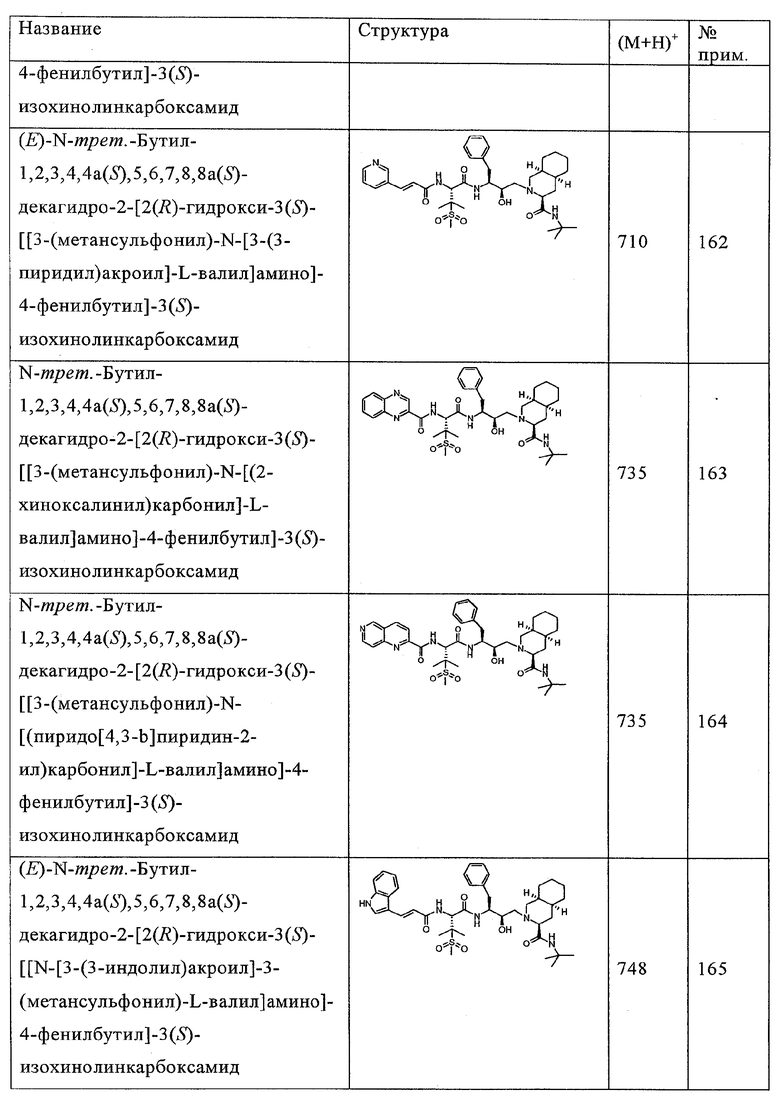
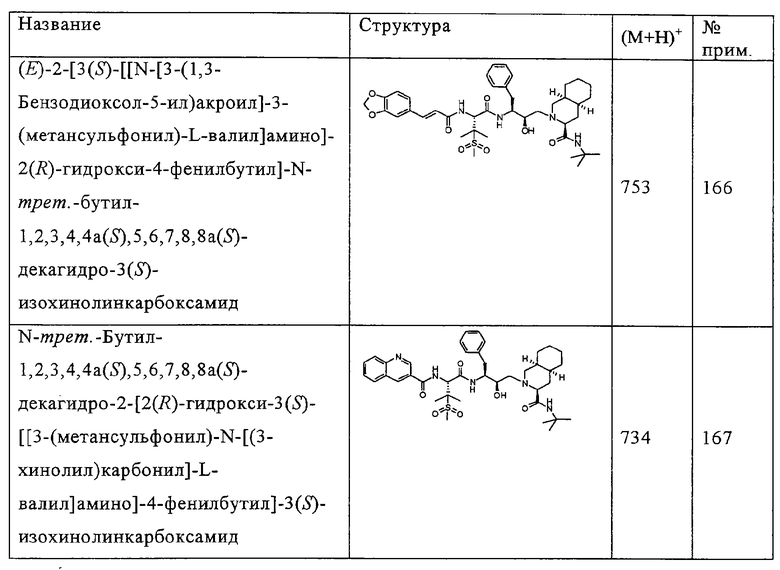
Способом, аналогичным тому, который описан в примере 100, получали также соединения таблицы 8, исходя из N-трет-бутил-2-[3(S)-[[N-[(9-флуоренил)метоксикарбонил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида. Другие реагенты, использованные в синтезе соединений таблицы 8, получали из коммерческих источников, таких как Aldrich и Lancaster, или синтезировали, используя методики, описанные в данной области или аналогичные тем, которые описаны.
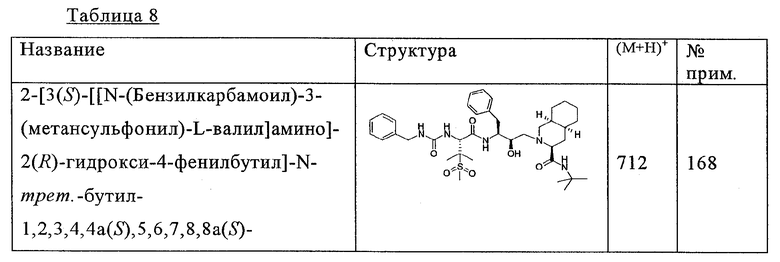
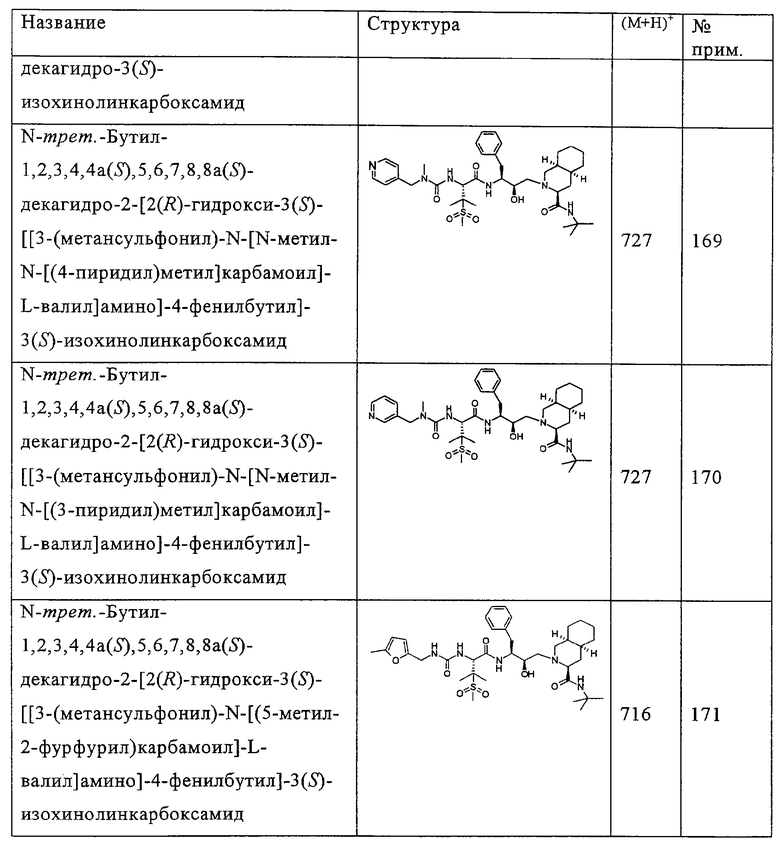
Пример 172
N-трет-Бутил-2-[3(S)-[[N-[2-(4-фторбензиламино)ацетил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид
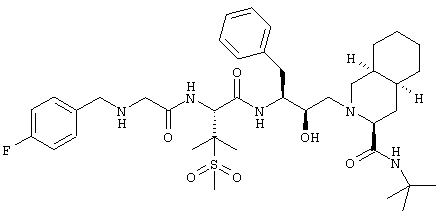
Получали способом, аналогичным тому, который описан в примере 121, исходя из 4-фторбензальдегида и N-трет-бутил-2-[3(S)-[[N-глицил(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4а(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамида. (М+Н)+ 744.
Исходное вещество N-трет-бутил-2-[3(S)-[[N-глицил(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-1,2,3,4,4a(S),5,6,7,8,8а(S)-декагидро-3(S)-изохинолинкарбоксамид получали способом, аналогичным тому, который описан в примере 94, исходя из N-(бензилоксикарбонил)глицина.
Пример 173
2-[3(S)-[[N-[2-(Бензиламино)ацетил]-3-(метансульфонил)-L-валил]амино]-2(R)-гидрокси-4-фенилбутил]-N-трет-бутил-1,2,3,4,4а(S),5,6,7,8,8a(S)-декагидро-3(S)-изохинолинкарбоксамид
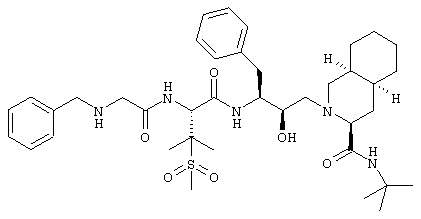
Получали способом, аналогичным тому, который описан в примере 172, исходя из бензальдегида вместо 4-фторбензальдегида. (М+Н)+ 726.
ПРИЛОЖЕНИЕ
Методика получения:
1. Компоненты 1, 2, 3 и 4 смешивают и гранулируют с очищенной водой.
2. Сушка гранул при температуре 50°С.
3. Измельчение гранул с использованием подходящего измельчающего оборудования.
4. Добавляют компонент 5 и перемешивают в течение 5 минут; прессование с использованием подходящего оборудования.
Состав капсулы
Методика получения.
1. Смешивают компоненты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют компоненты 4 и 5 и перемешивают в течение 3 минут.
3. Заполняют капсулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТ И ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ | 1990 |
|
RU2071470C1 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, КОТОРЫЕ ЯВЛЯЮТСЯ ОСНОВНЫМИ, СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АМИНОКИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИВИРУСНОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2109731C1 |
| АМИНОПРОИЗВОДНЫЕ ОКСО- ИЛИ ГИДРОКСИЗАМЕЩЕННЫХ ГИДРАЗИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ РЕТРОВИРУСНОЙ ПРОТЕАЗЫ | 1993 |
|
RU2126794C1 |
| ПРОИЗВОДНЫЕ ПИРИДО(2,1-А)ИЗОХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ DPP-IV | 2002 |
|
RU2297417C2 |
| ПРОИЗВОДНЫЕ ПИПЕКОЛИНОВОЙ КИСЛОТЫ И ИХ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2140911C1 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ Е3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2666530C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ E3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2781452C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО ПО КРАЙНЕЙ МЕРЕ С АКТИВНОСТЬЮ KSP, И СПОСОБ ИНГИБИРОВАНИЯ KSP | 2006 |
|
RU2413721C9 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИИ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2259202C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ КАТЕПСИНА S | 2001 |
|
RU2278863C2 |
Изобретение относится к новым изохинолинкарбоксамиды формулы
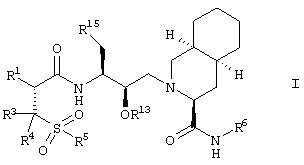
и к их фармацевтически приемлемым солям, где R1 означает водород, гидрокси или NHR2, R2 означает алкил, арилалкил, гетероциклилалкил, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, циклоалкил, алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, арилалкилкарбонил, гетероциклилалкилкарбонил, который содержит один или несколько гетероатомов, выбранных из азота и кислорода, алкилоксикарбонил, арилалкилоксикарбонил, гетероциклилалкилоксикарбонил, который содержит один или несколько гетероатомов, выбранных из азота, гетероциклил, который содержит один или несколько гетероатомов, выбранных из азота и серы, алкилсульфонил, арилсульфонил или группу формулы
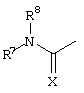
R3, R4 означают независимо друг от друга алкил, R5 означает алкил, или R4 и R5 образуют вместе с атомом углерода и серы, с которыми они связаны, гетероцикл, и R6 означает алкил, арилалкил, и R13 означает водород или группу
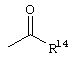
и R15 означает арил при условии, что если R3, R4 и R5 означают метил, R6 означает трет-бутил, R13 означает водород, и если R15 означает фенил, R2 не означает бензилоксикарбонил и не означает 2-хинолинкарбонил (остальные значения радикалов указаны в п.1 формулы изобретения). Изобретение также относится к лекарственному средству на основе этих соединений для применения в лечении заболеваний, опосредованных ВИЧ. Технический результат - получение новых соединений и лекарственного средства на их основе в целях лечения заболеваний, опосредованных ВИЧ. 2 н. и 12 з.п. ф-лы, 11 табл.
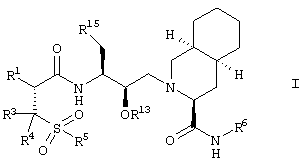
и их фармацевтически приемлемые соли,
где R1 означает водород, гидрокси или NHR2,
R2 означает алкил, арилалкил, гетероциклилалкил, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, циклоалкил, алкилкарбонил, циклоалкилкарбонил, арилкарбонил, гетероциклилкарбонил, который содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, арилалкилкарбонил, гетероциклилалкилкарбонил, который содержит один или несколько гетероатомов, выбранных из азота и кислорода, алкилоксикарбонил, арилалкилоксикарбонил, гетероциклилалкилоксикарбонил, который содержит один или несколько гетероатомов, выбранных из азота, гетероциклил, который содержит один или несколько гетероатомов, выбранных из азота и серы, алкилсульфонил, арилсульфонил, или группу формулы

где Х означает кислород и
R7 и R8 означают независимо друг от друга водород, алкил, арил, гетероциклил, который содержит один или несколько гетероатомов, выбранных из азота или кислорода, арилкил, или
R7 и R8 образуют вместе с атомом азота, к которому они присоединены, насыщенный цикл, необязательно содержащий дополнительный гетероатом, выбранный из азота, кислорода и серы, или группу

где n означает 0;
Y означает кислород или серу и
R10 означает алкил, арил, арилалкил, гетероциклил, гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, или
где n означает 1;
Y означает азот;
R9 означает водород или алкил и
R10 означает водород, алкил, арил, арилалкил, гетероциклил, гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, или
R9 и R10 образуют вместе с гетероатомом, с которым они связаны, гетероциклил, необязательно содержащий дополнительный гетероатом, выбранный из азота или кислорода;
R11 и R12 означают независимо друг от друга водород или алкил, или
R11 и R12 образуют вместе с атомом углерода, с которым они связаны, циклоалкил;
R3, R4 означают независимо друг от друга алкил;
R5 означает алкил, или
R4 и R5 образуют вместе с атомом углерода и серы, с которым они связаны, гетероцикл и
R6 означает алкил, арилалкил и
R13 означает водород или группу
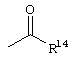
где R14 означает алкил, арил, группу -СН2(СН2СН2O)mСН3, в которой m означает целое число 0-10 или связанный карбонильной группой радикал аминокислоты, и
R15 означает арил,
при условии, что если R3, R4 и R5 означают метил, R6 означает трет.-бутил, R13 означает водород, и если R15 означает фенил, R2 не означает бензилоксикарбонил и не означает 2-хинолинкарбонил.

где R2, R3, R4, R5, R6, R13 и R15 имеют приведенные выше значения.

где n означает 0;
Y означает кислород или серу и
R10 означает алкил, арил, арилалкил, гетероциклил, гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, или
где n означает 1;
Y означает азот;
R9 означает водород и
R10 означает алкил, арил, арилалкил, гетероциклил, гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, и где R11 и R12 означают независимо водород.

где n означает 0;
Y означает кислород или серу и
R10 означает алкил, арил, арилалкил, гетероциклил, гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, или
где n означает 1;
Y означает азот;
R9 означает водород и
R10 означает алкил, арил, арилалкил, гетероциклил гетероциклилалкил, где гетероциклил содержит один или два гетероатома, представляющих собой азот, и
где R11 и R12 означают независимо водород.

где Y означает кислород, NH, S и
R10 означает арил, гетероциклил, который содержит один или два гетероатома, представляющих собой азот.
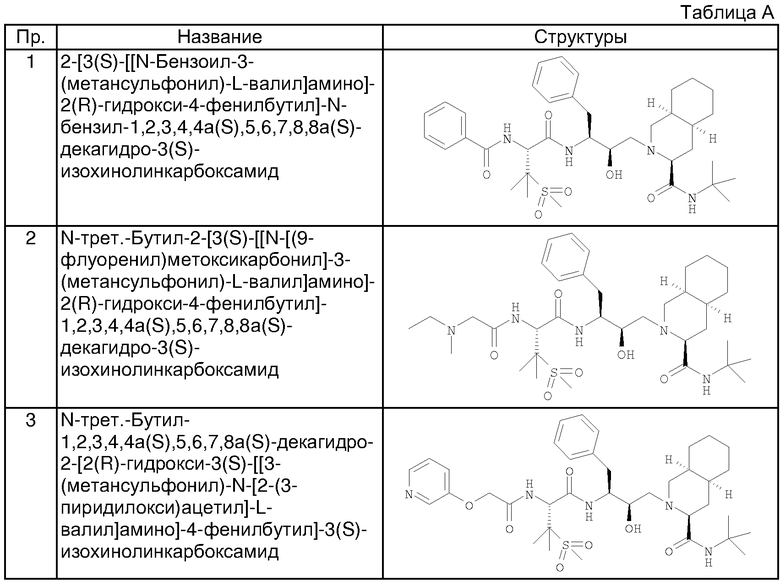
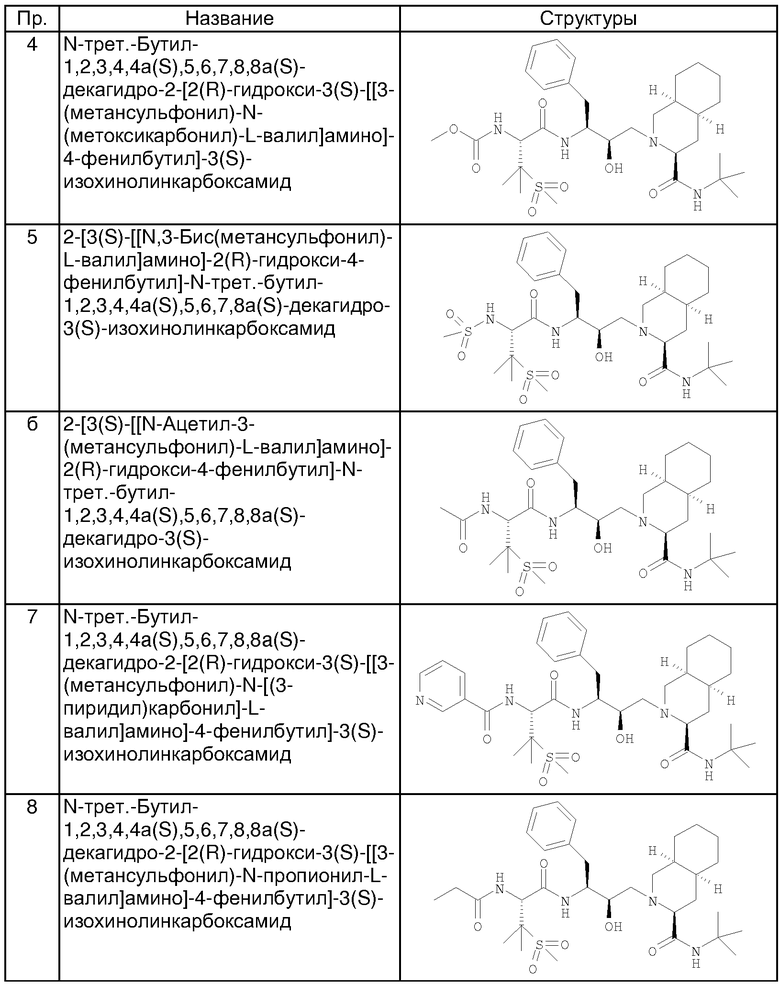


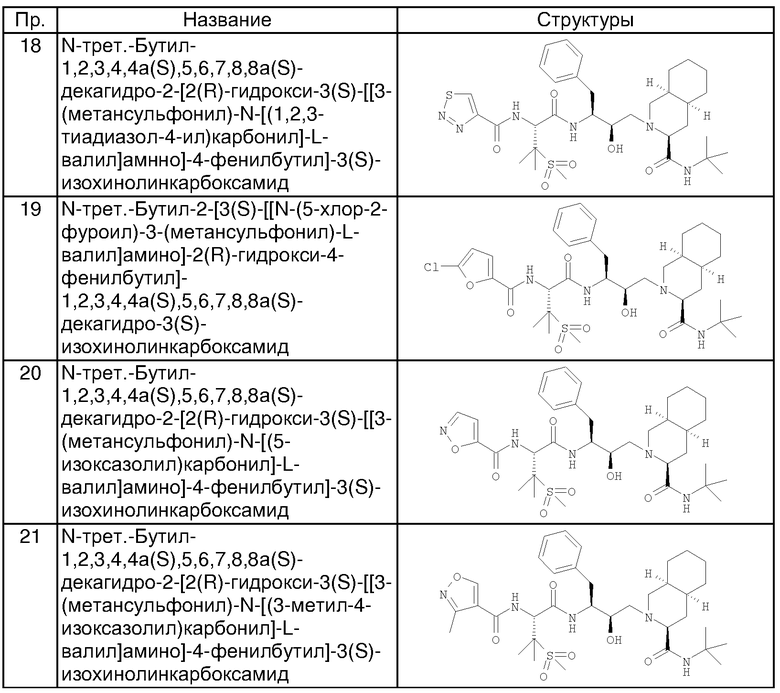
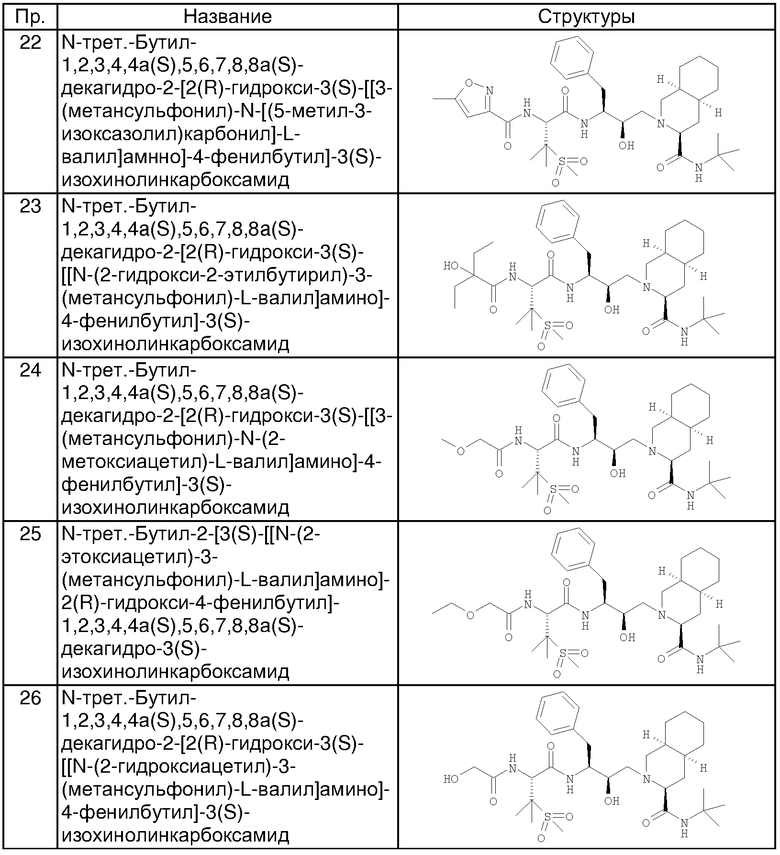

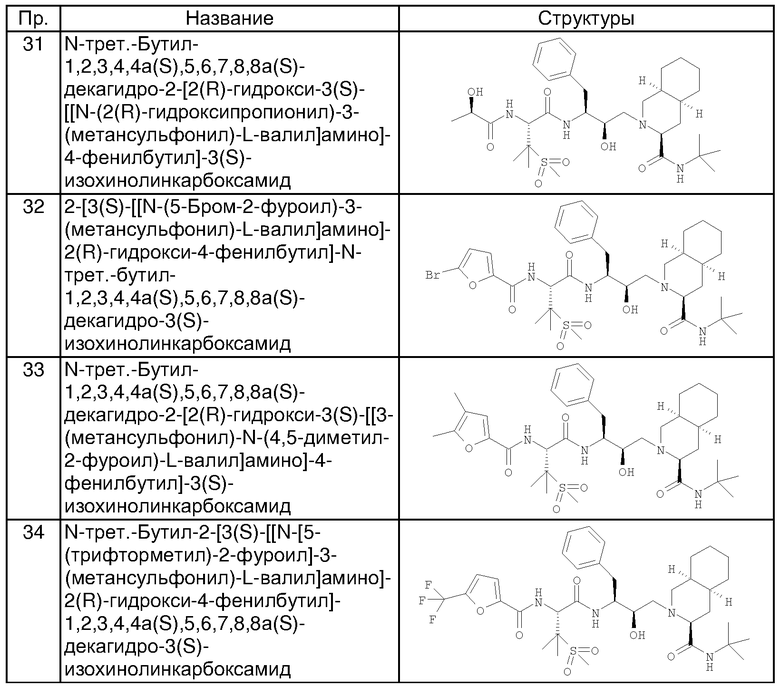
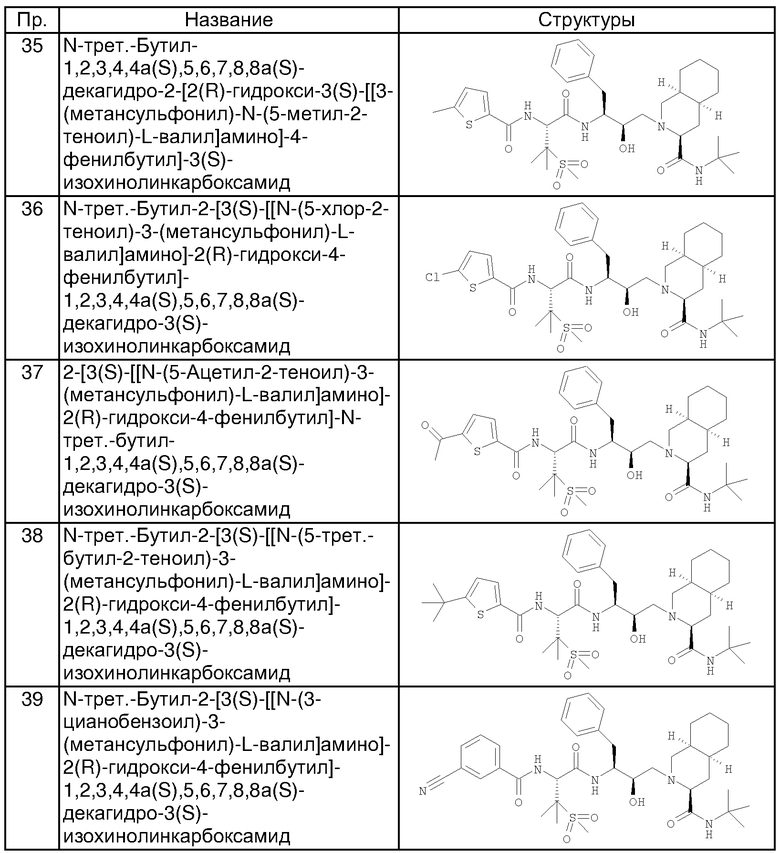
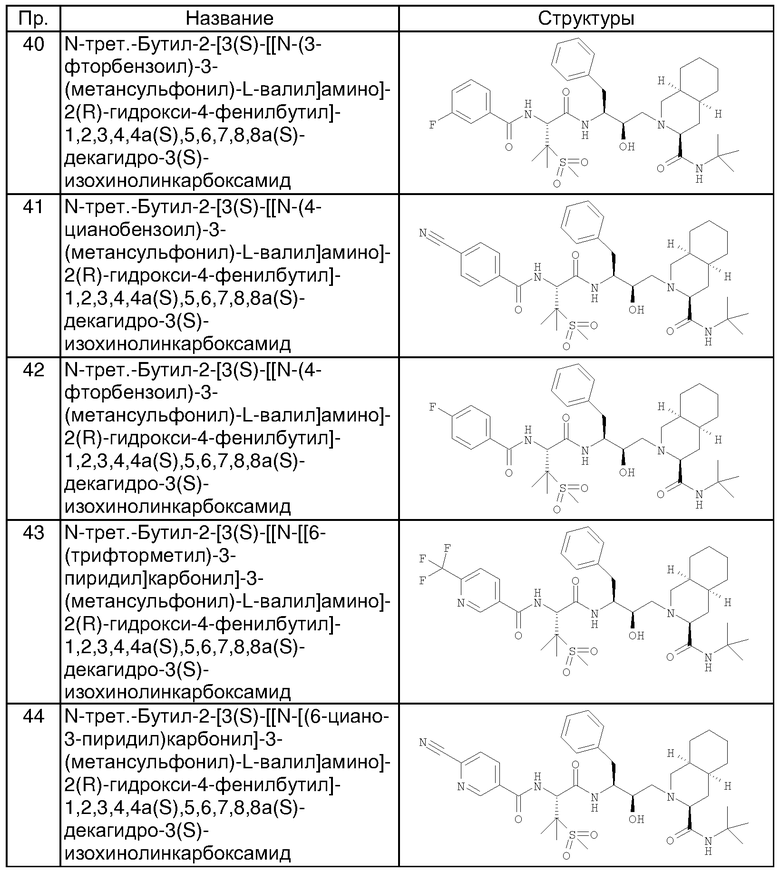
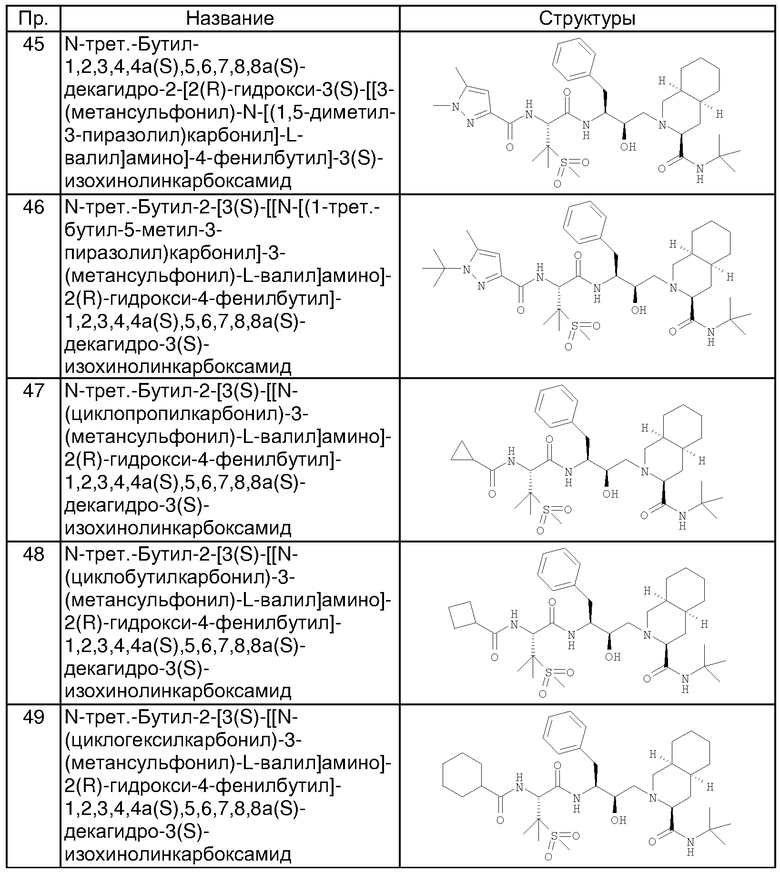
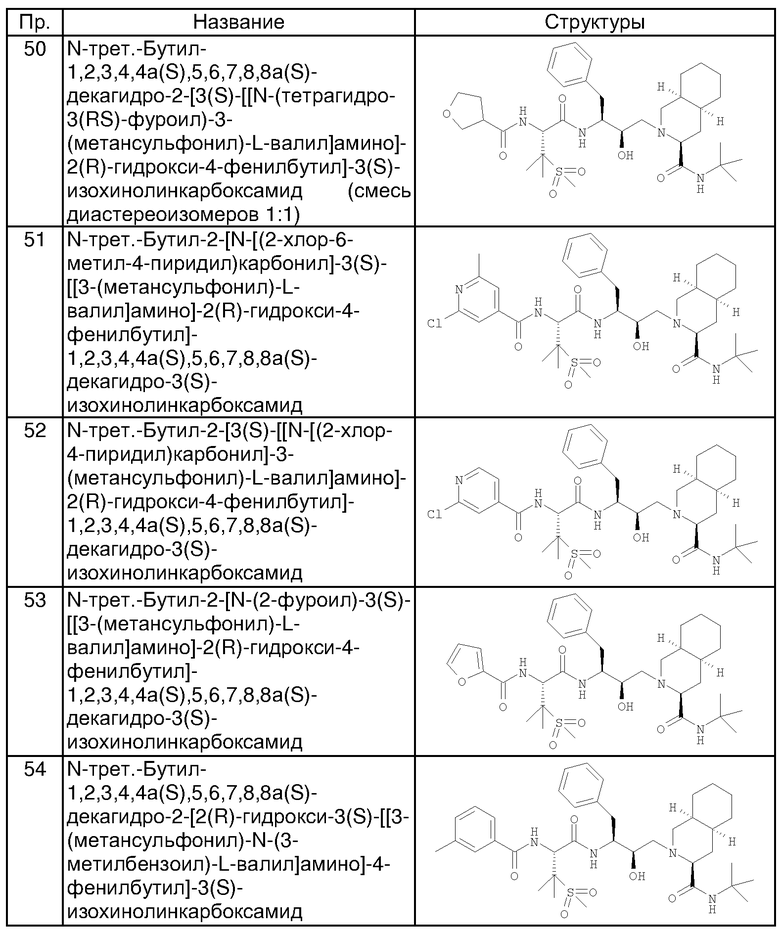
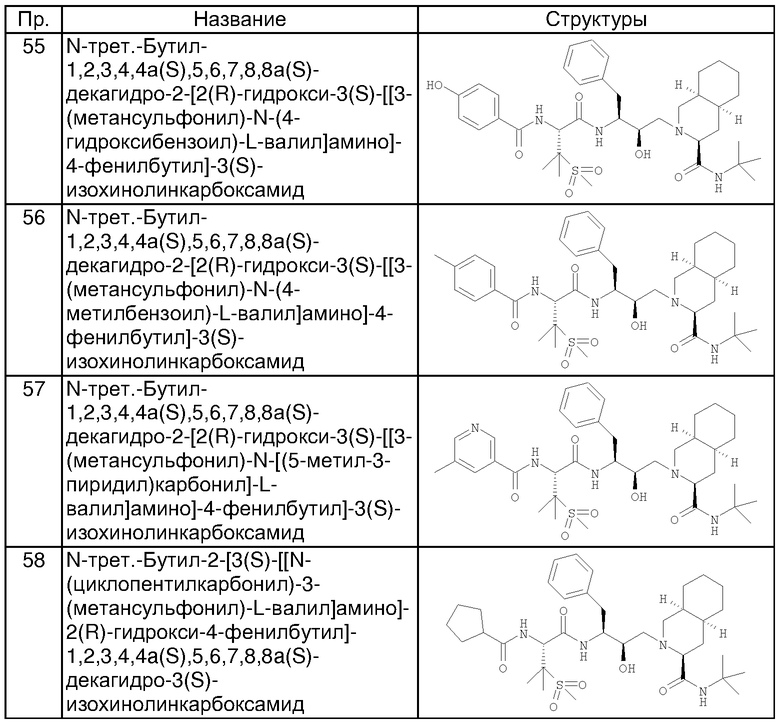
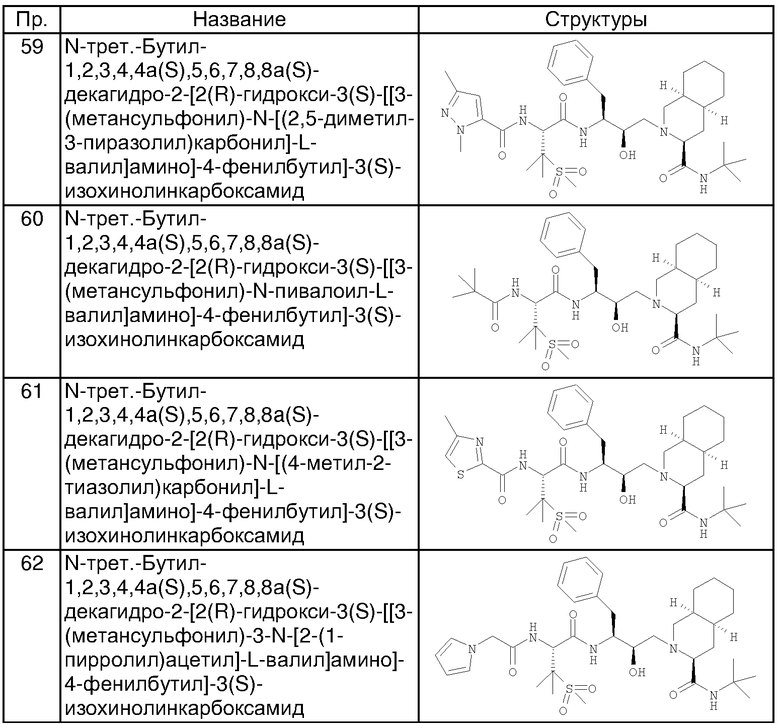
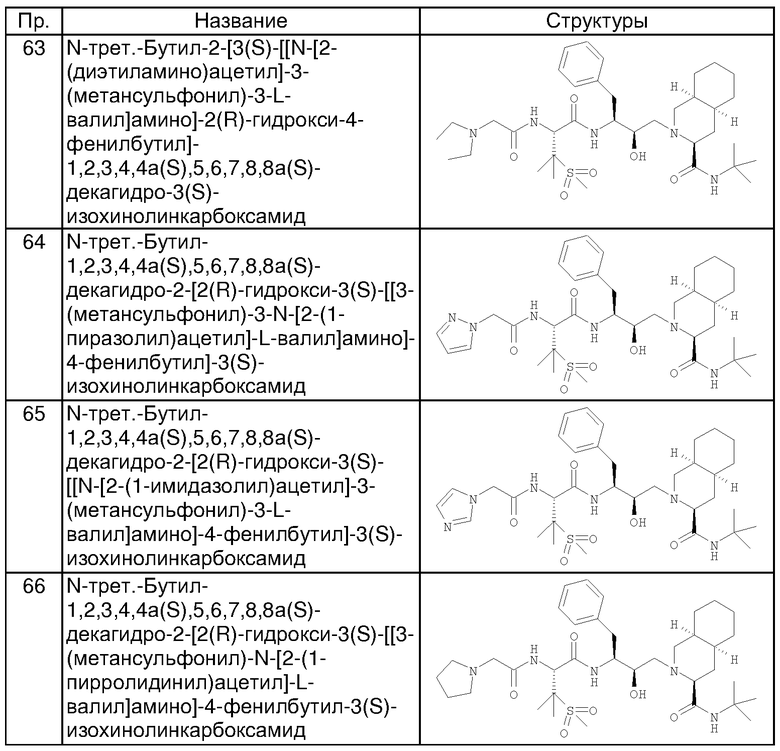

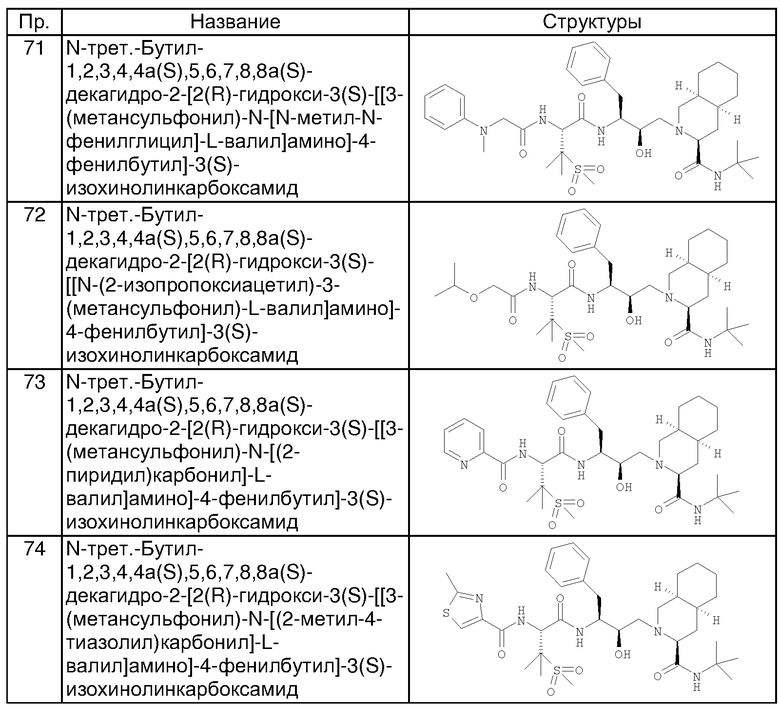
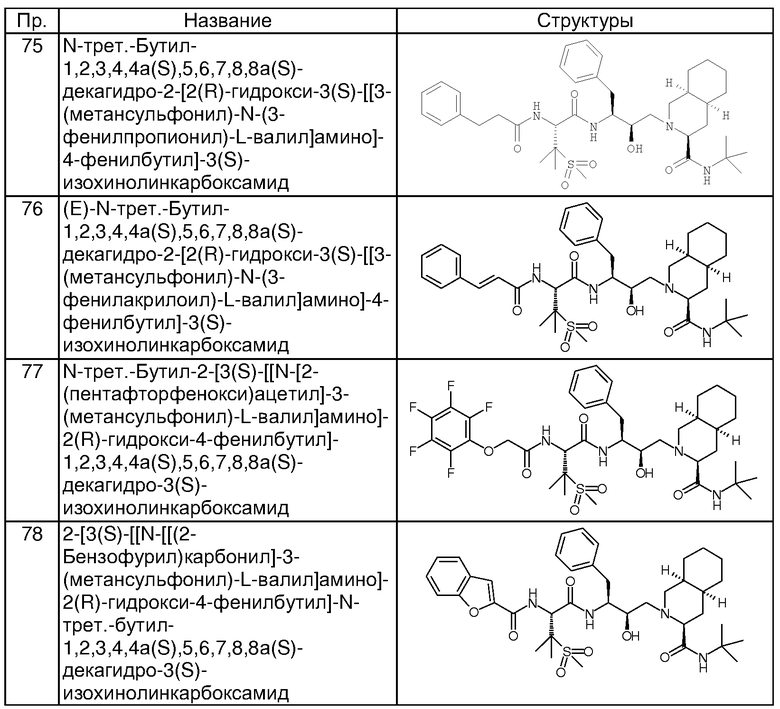
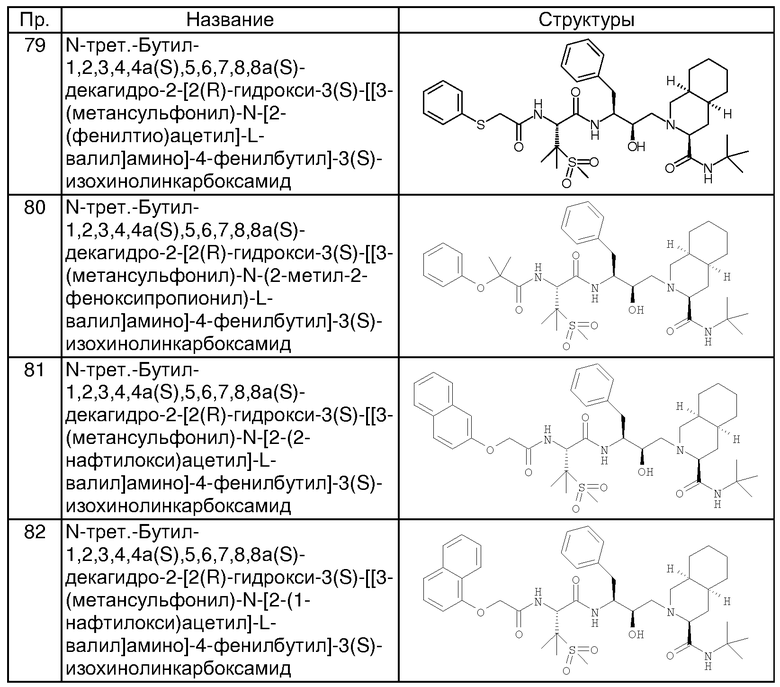
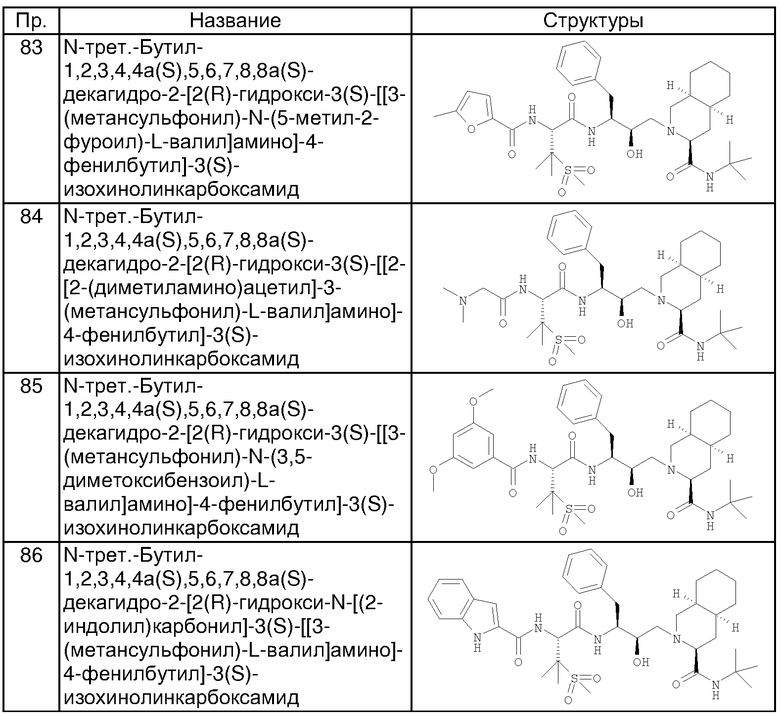

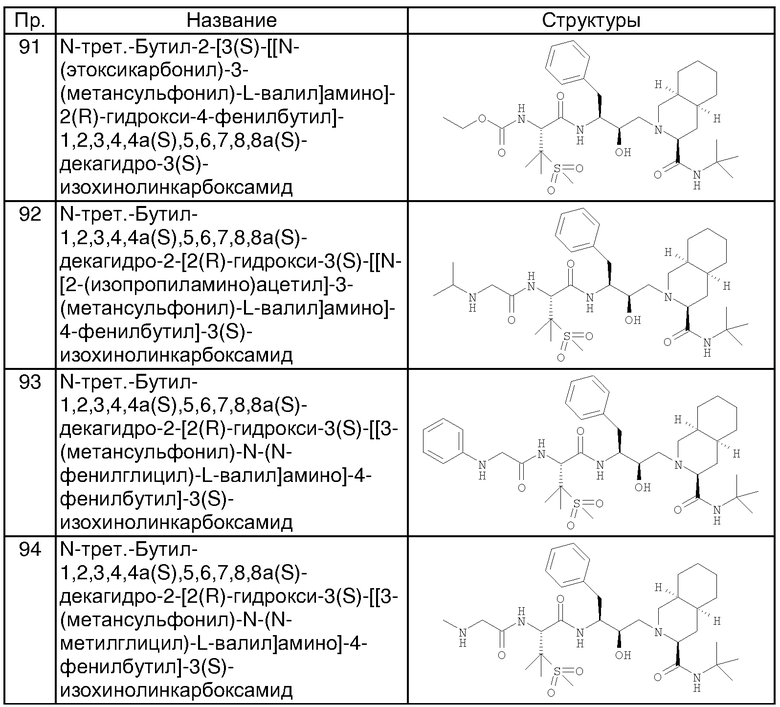
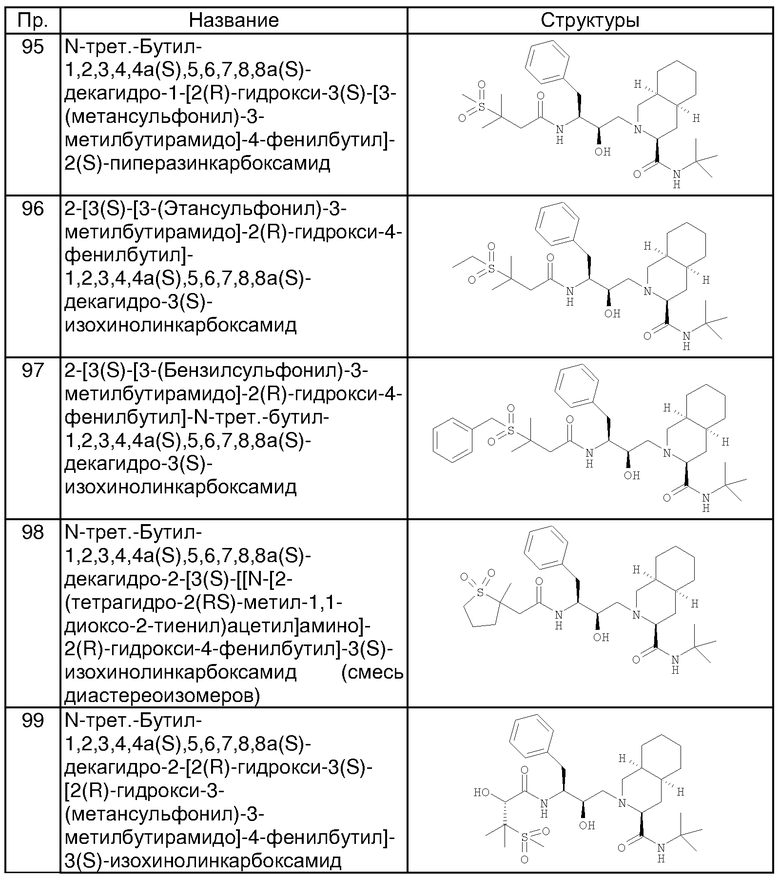
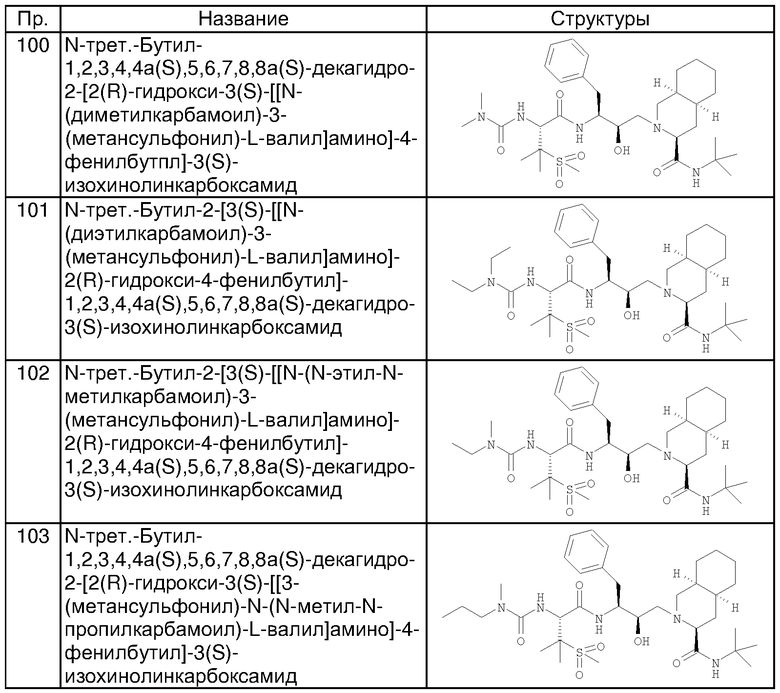
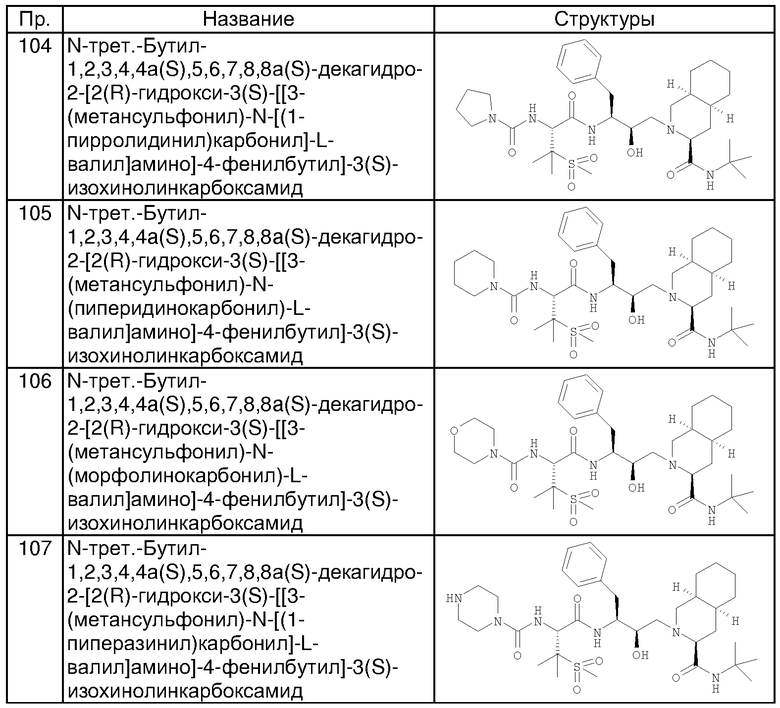
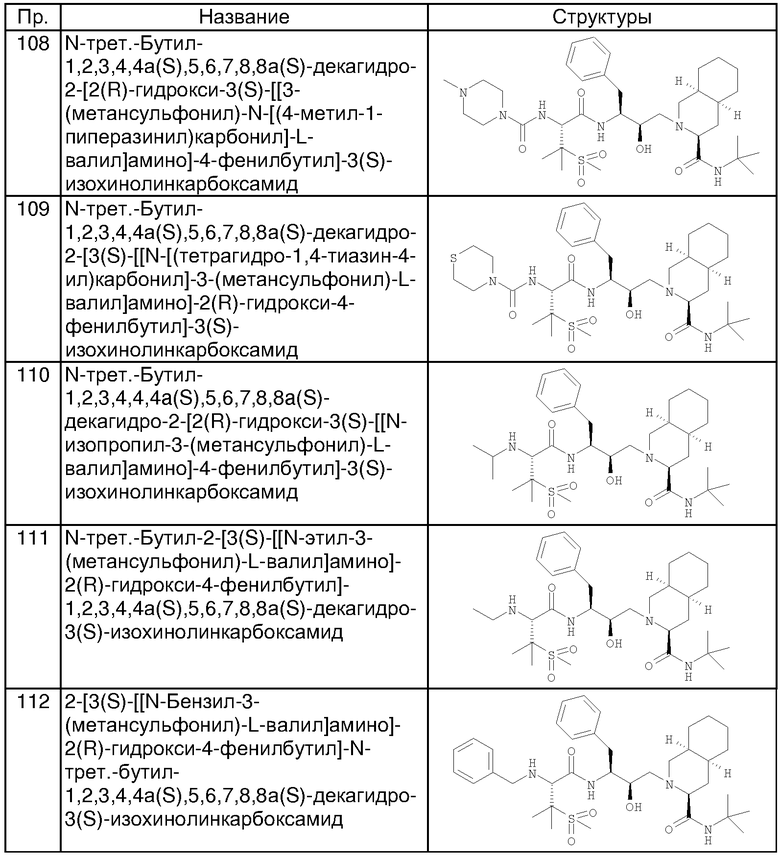
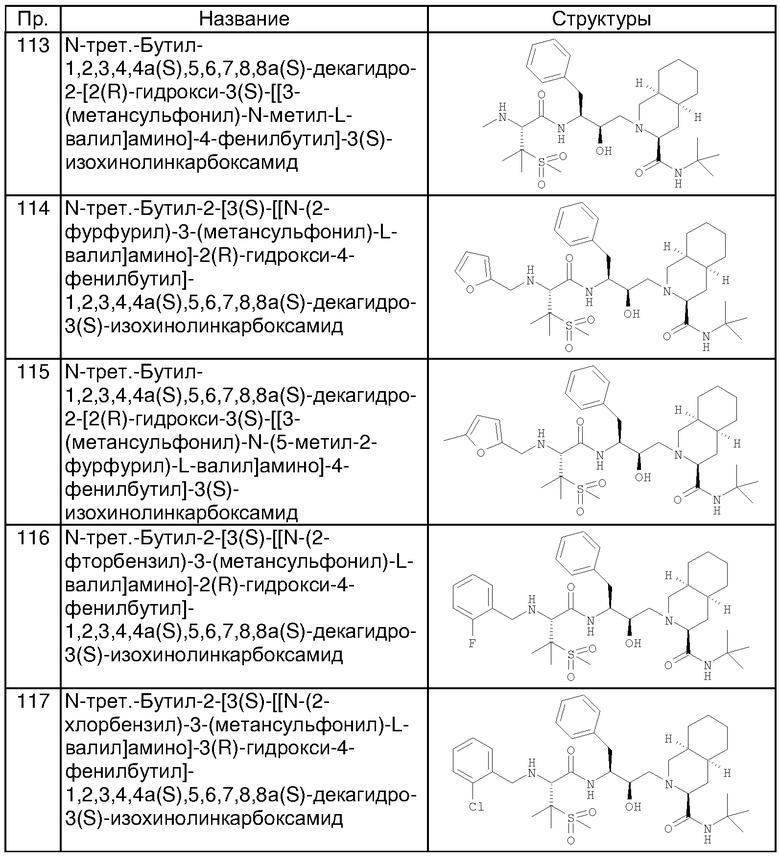


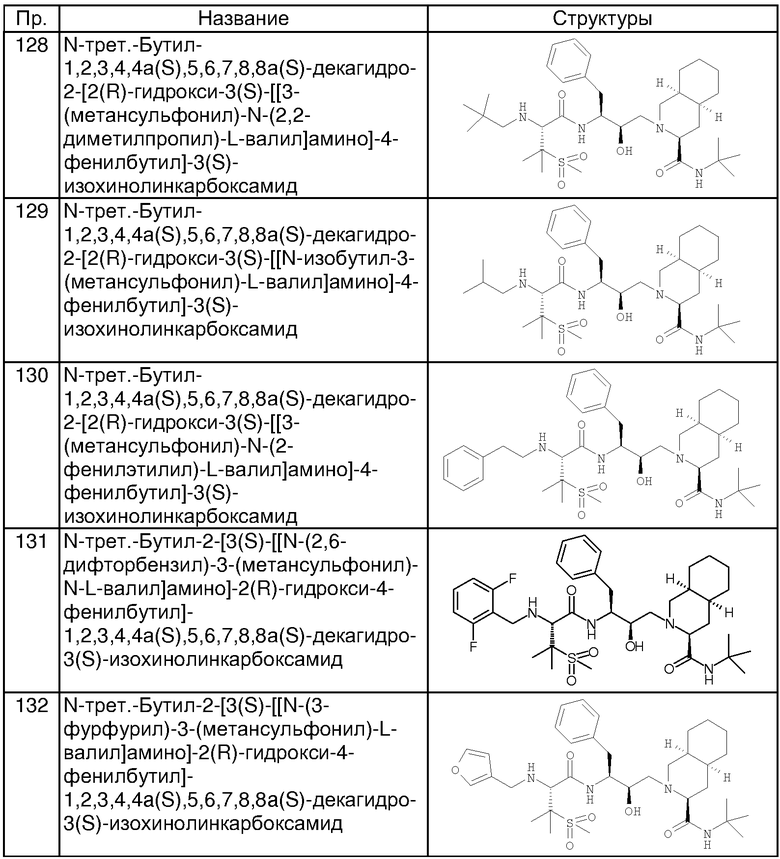

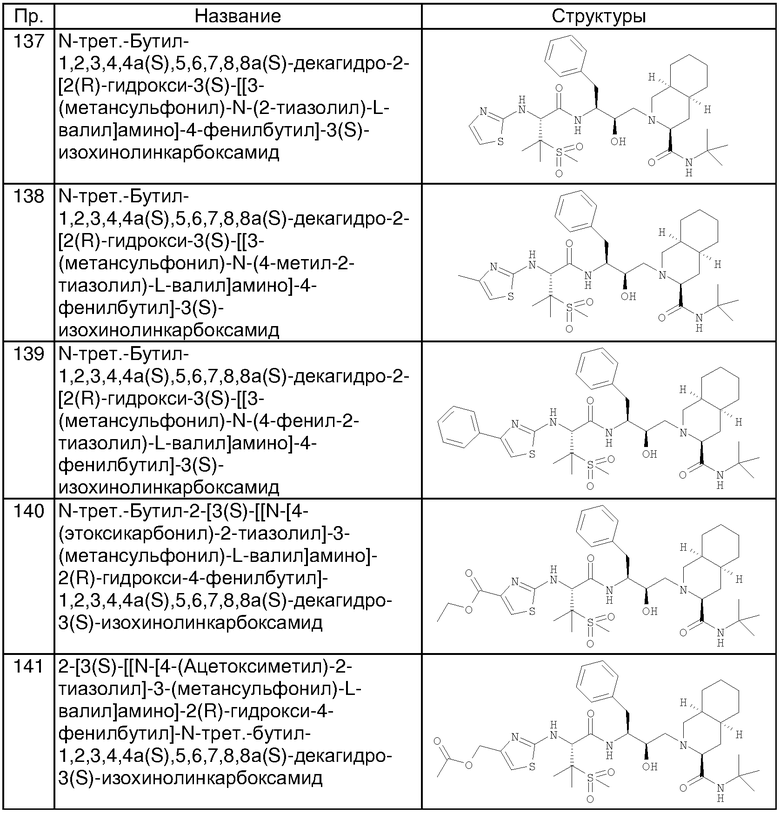
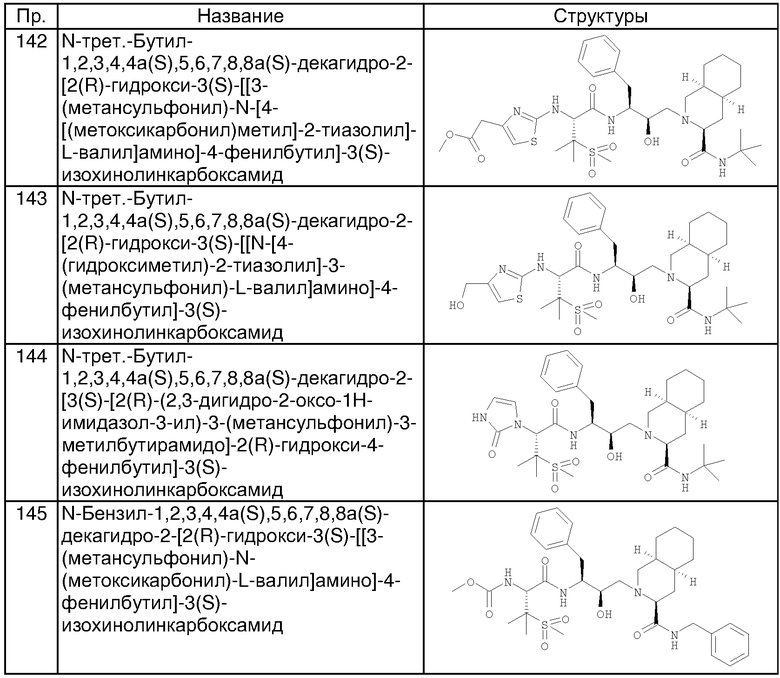
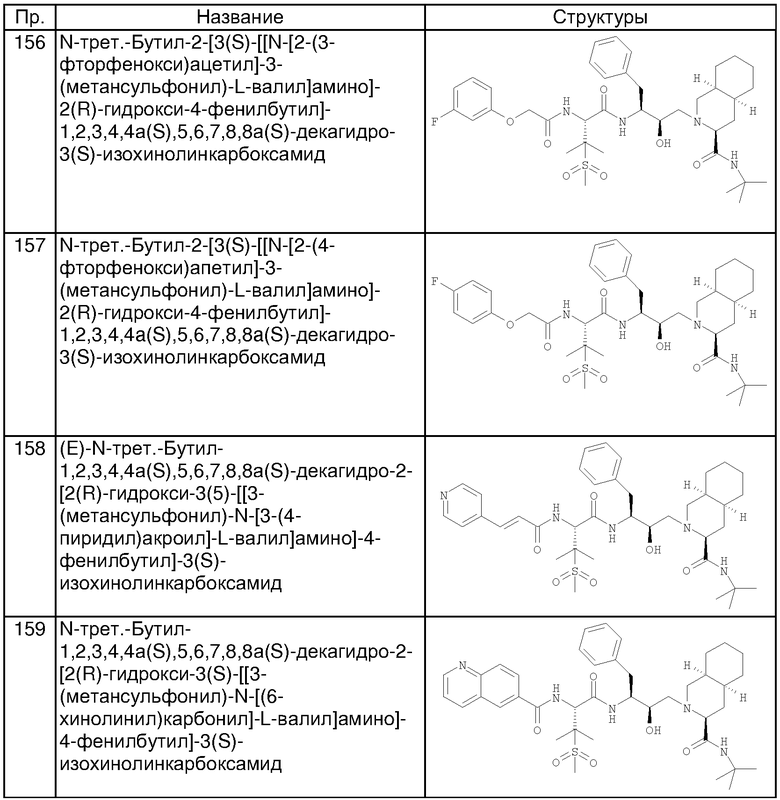
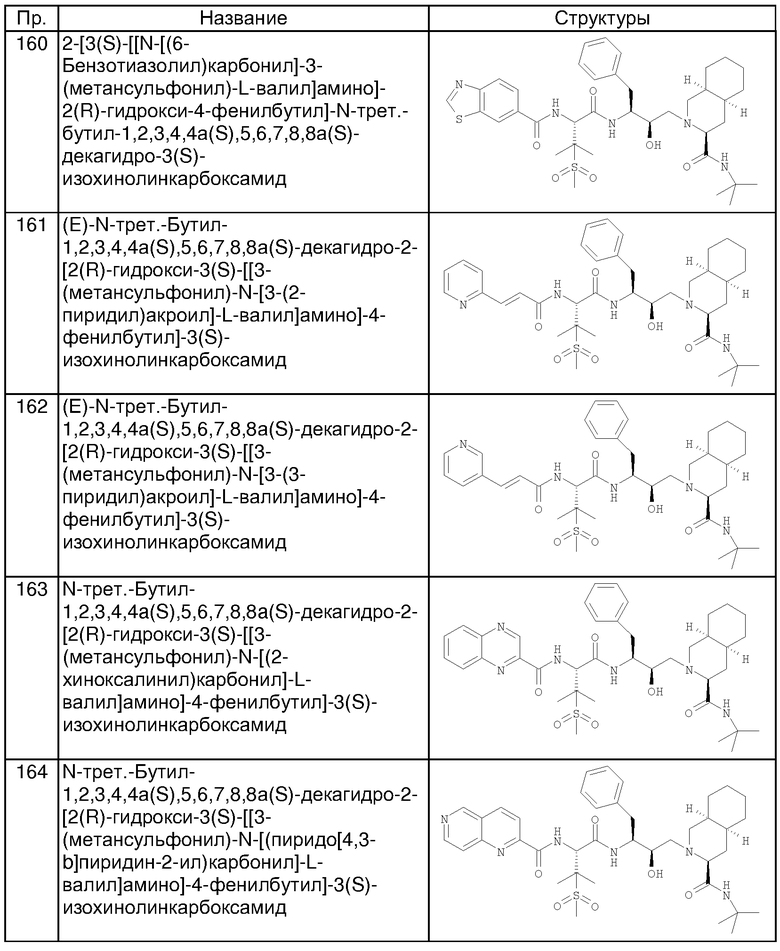

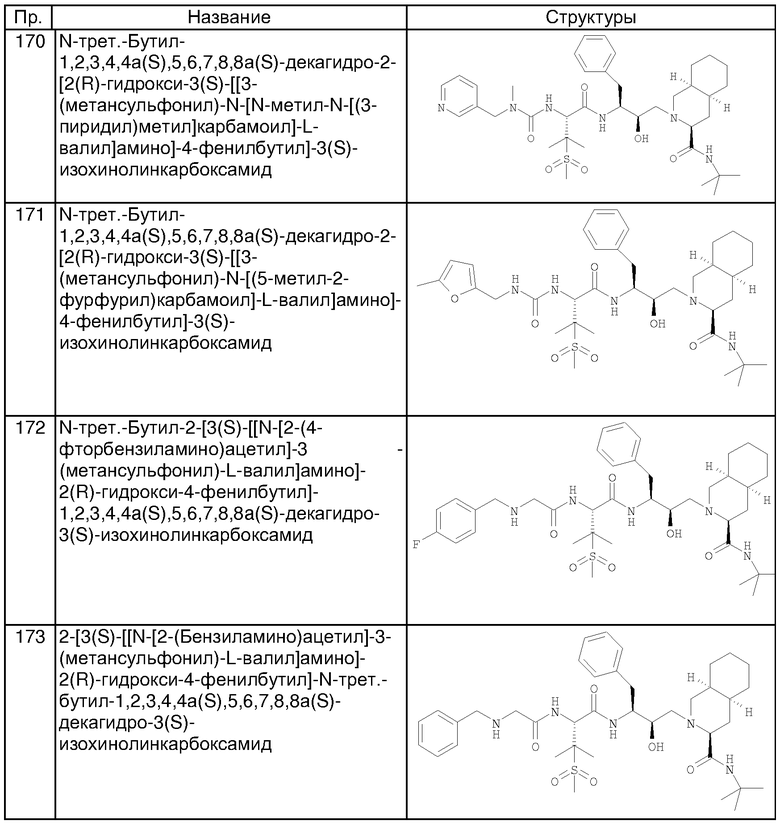
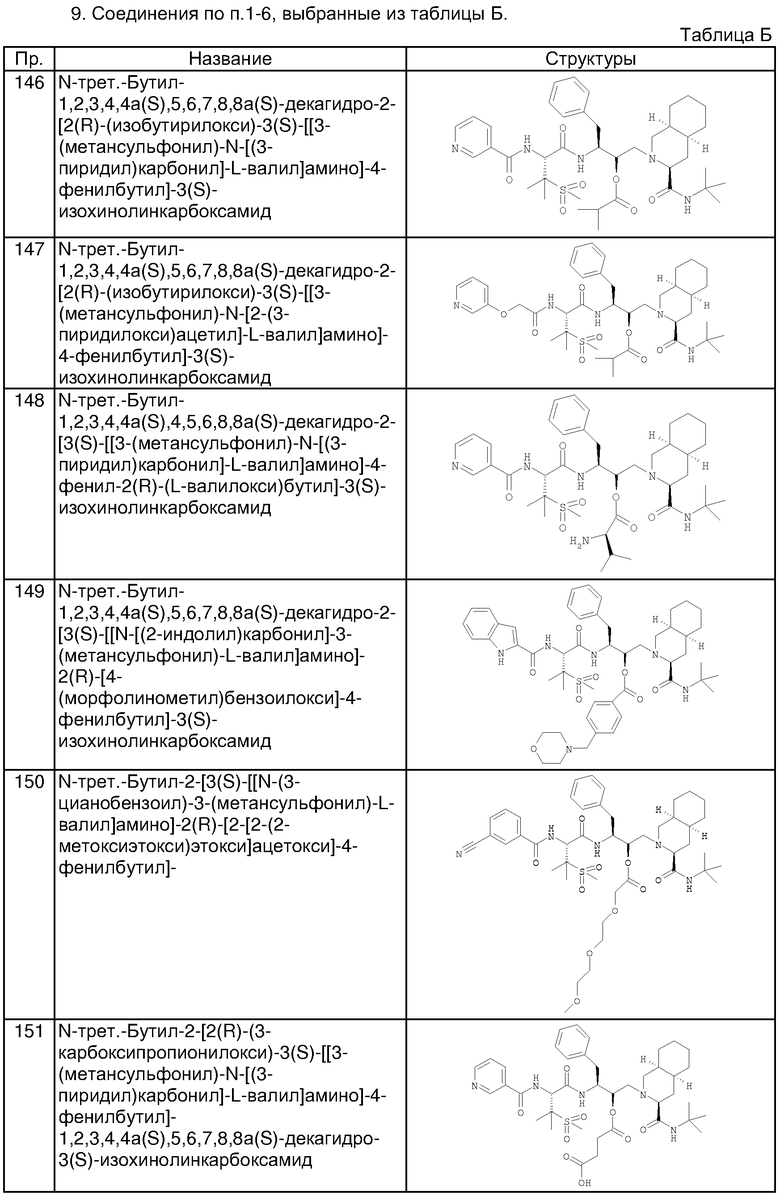
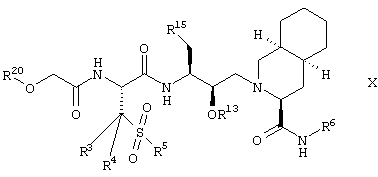
где R3, R4, R5, R6, R13 и R15 имеют значения, описанные выше, и R20 означает гетероциклил, который содержит один или два гетероатома, представляющих собой азот.
| PARK С., Bioorganic & medicinal chemistry letters, 1996, vol.6, no.6, p.585-588 | |||
| MUNROE J., Bioorganic & medicinal chemistry letters, 1995 vol.5, no.23, p.2897-2902 | |||
| Синхронизатор телевизионной развертки | 1974 |
|
SU604185A1 |
| СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ПРОТЕАЗЫ ВИЧ | 1994 |
|
RU2139280C1 |
Авторы
Даты
2005-11-27—Публикация
2001-11-12—Подача