Изобретение относится к биотехнологии, генной инженерии, а также медицине и представляет собой плазмиду pR752, кодирующую модульный рекомбинантный полипептид и штамм Е.coli - М15 (Rep4, pR752) - продуцент модульного пептида.
Известна композиция для фотодинамического повреждения клеток-мишеней, состоящая из фотосенсибилизатора, компонента-носителя фотосенсибилизатора, компонента для узнавания клеток-мишеней и транспорта фотосенсибилизатора внутрь клетки-мишени путем специфического рецептор-опосредуемого эндоцитоза и компонента, обладающего способностью направленного транспорта фотосенсибилизатора внутри клеток-мишеней. На основе этой композиции разработан способ фотодинамического повреждения клеток, который заключается в добавлении предлагаемой композиции к клеткам и выдерживании их при температуре, нормальной для жизнедеятельности клеток. При облучении клеток светом происходит фотохимическая реакция, в результате которой клетки-мишени гибнут (Патент РФ №2066552, 1996).Получение таких многокомпонентных транспортных композиций для использования в клинической практике - слишком дорогостоящая и трудозатратная процедура. Более приемлемый способ получения аналогичных транспортных носителей включает в себя конструирование, наработку в E-coli и очистку модульных рекомбинантных транспортеров (МРТ) для фотосенсибилизаторов (ФС), несущих:
лигандный модуль, оптимизированный большой Т-антиген вируса SV-40 в качестве сигнала ядерной локализации, модуль-носитель - гемоглобиноподобный белок НМР Е-coli, эндосомолитический модуль - амфипатический полипептид. Эти МРТ осуществляют доставку ФС в ядра меланомных клеток мишеней и значительно усиливают фотоцитотоксическое действие ФС (Генетика, 2003, том 39, №2, С.259-268). Описанные в этой работе МРТ недостаточно эффективно доставляют ФС в ядра клеток.
Задача изобретения - получить рекомбинантную плазмиду, кодирующую модульный полипептид, который обеспечит увеличение эффективности доставки фотосенсибилизатора, и штамм - продуцент модульного полипептида.
Поставленная задача решается получением плазмиды pR752, кодирующей модульный рекомбинантный полипептид (МРП), состоящий из 6 гистидиновых остатков (6His), гемоглобиноподобного белка E.coli (НМР), модифицированного фрагмента большого Т-антигена вируса SV-40 (NLS), фрагмента дифтерийного токсина, содержащего транслокационный домен и собственный междоменный спейсер (DTox), a также имеющий дополнительный спейсер - (Gly-Ser)5 и эпидермальный фактор роста человека (EGP), и штамма Е. coli - М15 (Rep4, pR752) - продуцента модульного пептида, полученного трансформацией штамма М15 (Rep4) плазмидой pR752.
Сущность изобретения заключается в создании новой конструкции рекомбинантной плазмиды pR752 для кодирования модульного полипептида (SEQ ID №1) длиной 694, М. м. 76306 Д, имеющего следующую структуру: 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF, в которой аа 5-10 - 6His, aa 14-409 - НМР, аа 439-624 - DTox 198-384 с заменами, аа 628-638 (Gly-Ser)5, 642-694 EGF.
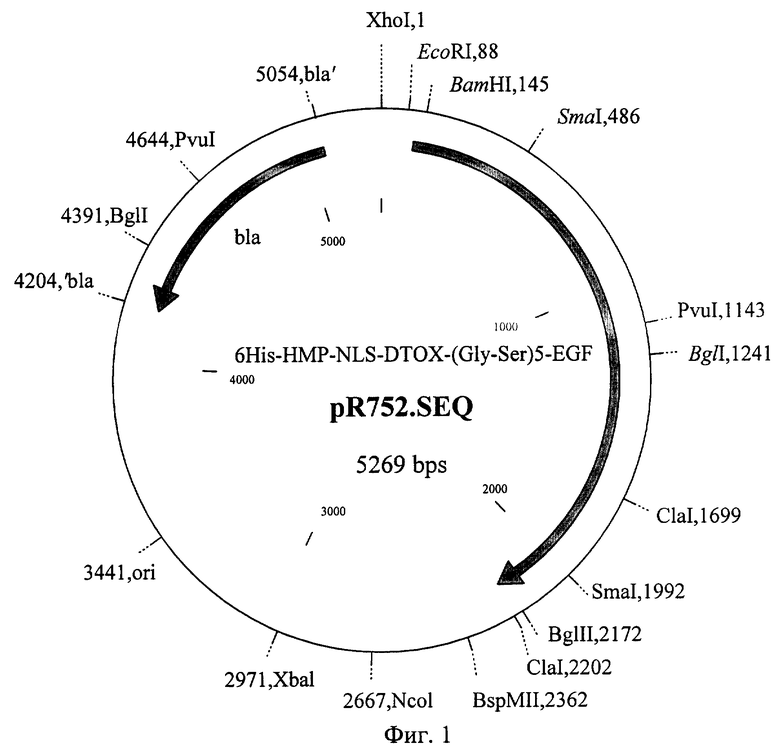
Плазмида pR752 имеет размер 5269 оснований (SEQ ID №2) и содержит следующие регуляторные области и кодирующие участки:
- искусственный бактериальный оперон, содержащий промоторную область бактериофага Т5 и ген, кодирующий мультидоменный белок 6His-HMP-NLS-DTox- (Gly-Ser)5-ЕСР,(кодирующая область - 115-2199 н.п.);
- бактериальный оперон bla, кодирующий белок бета-лактамазу, являющийся селективным маркером для трансформации штаммов Е.Coli (кодирующая область 5064-4204 н.п. в комплементарной цепи);
- бактериальный участок инициации репликации типа Col E1 3206-4196 н.п., обеспечивающий репликацию плазмиды в штаммах Е.Coli.
Для получения модульного полипептида предлагается штамм Е.Coli - М15 (Rep4, pR752), коллекционный номер ВКПМ В-8356, полученный трансформацией штамма М15 (Rep4) плазмидой pR752.
Штамм депонирован во Всесоюзной Коллекции Промышленных Микроорганизмов (ВКПМ), ФГУП ГосНИИ генетика 17.07.2002 г.
Существенным отличием предлагаемой плазмиды pR752 является наличие гена, кодирующего мультидоменный белок 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF.
При культивировании рекомбинантного штамма Е.Coli - М15 (Rep4, pR752) получают модульный рекомбинантный полипептид (МРП) для доставки фотосенсибилизатора, отличающийся от известных наличием в его структуре спейсера (Gly-Ser)5, который отделяет лиганд от объемной общей конструкции, обеспечивая тем самым эффективное взаимодействие лиганда с рецептором на поверхности клетки, а также наличием перед модулем НМР последовательности 6His, для упрощения процесса выделения МРТ.
Характеристики штамма Е.Coli - M15 (Rep4, pR752)
Штамм получен трансформацией плазмидой pR752 штамма M15 (Rep4), предоставленного фирмой QIAGEN.
Культурально-морфологические характеристики штамма
При выращивании штамма на LB агаре (на 1 л - 10 г бактотриптона, 5 г бактодрожжевого экстракта, 10 г NaCl, 15 г бактоагара, рН 7, 5 - NaOH) в течение 18 часов при 37°С получают:
- колонии округлой формы,
- бесцветные,
- непрозрачные,
- поверхность гладкая,
- профиль выпуклый,
- край колонии - волнистый,
- структура однородная,
- консистенция вязкая,
- способность к эмульгированию - равномерная,
- пигмент в среду не выделяет.
Продукт, синтезируемый штаммом, - модульный рекомбинантный полипептид 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF
Активность штамма: уровень экспрессии модульного рекомбинантного полипептида 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF составляет 32% от тотального белка, растворимость - 70%.
Генетические особенности штамма: устойчив к ампициллину и канамицину, метаболические маркеры - способен сбраживать лактозу, арабинозу, галактозу и маннитол.
Краткое описание чертежей.
Фиг.1 Карта плазмиды pR752 с указанием сайтов рестрикции.
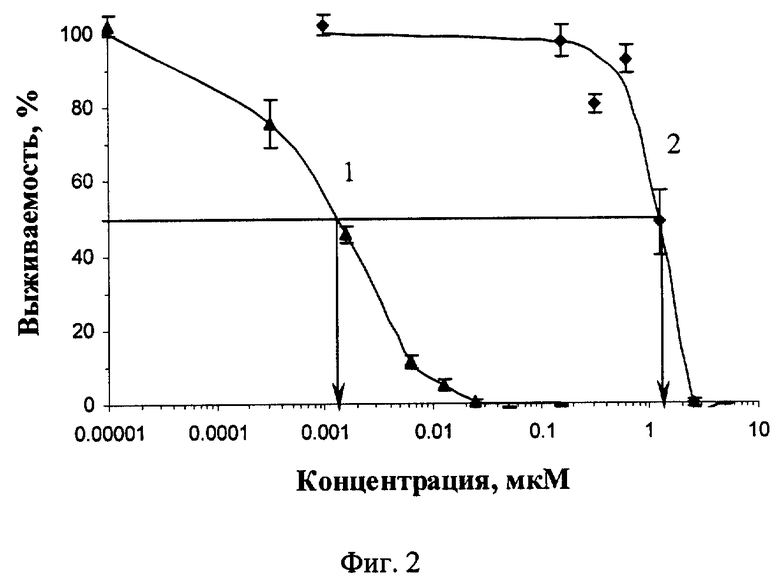
Фиг.2 Зависимость выживаемости клеток А431 от концентрации добавленных хлорина е6 и его конъюгата с МРП, облучение в дозе 288 кДж/м2 без фильтров.
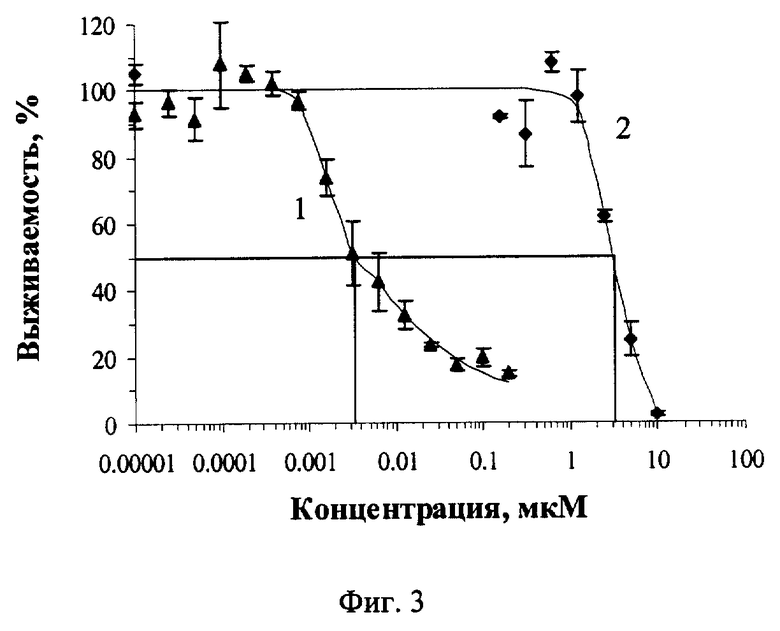
Фиг.3 Зависимость выживаемости клеток А431 от концентрации бактериохлорина р6 и его конъюгата с 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF при облучении в дозе 75 кДж/м2 с комбинацией фильтров, обеспечивающих пропускание в области 730-800 нМ.
Примеры осуществления изобретения
Все стандартные геноинженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам (Маниатис Т., Фрич Э., Сэмбрук Дж., Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., Москва, Мир, 1988; The QIAexpressionist. QUIAGEN Inc., 1991; The QIAexpressionist. Second edition. QUIAGEN Inc., 1992).
Пример 1. Способ получения плазмиды pR752
а) Химический синтез олигодезоксирибонуклеотидов
Олигодезоксирибонуклеотиды были синтезированы твердофазным аминофосфитным методом с помощью синтезатора АСМ 100-2 (Новосибирск) и очищены электрофорезом в 12%-ном ПААГ геле.
б) Клонирование участка, обеспечивающего фотосенсибилизатор (порфирин)-связывающую активность
В качестве фотосенсибилизатор-связывающего белка был взят гемоглобиноподобный белок НМР Е.Coli. Для клонирования НМР были спланированы праймеры, соответствующие концам кодирующей области гена. Продукт был проклонирован в Е.Coli так, чтобы перед белком находилось 6His для возможного выделения продуктов экспрессии с помощью аффинной хроматографии на Ni-агарозе.
Используя в качестве ДНК-матрицы хромосомную ДНК Е.Coli, содержащую ген НМР, методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров состава (сайты рестриктаз BamHI, XbaI и BgIII подчеркнуты)
5'-gcaaaaaaagggatcccatatgcttgacgctc
5'-ccggcaactctagatctcagcaccttatgcg
соответствующих начальной и концевой части ДНК, кодирующей НМР, амплифицировали последовательность нуклеотидов. Реакцию проводили в 25 мкл реакционной смеси, содержащей 2 мкг ДНК, 10 пкМ каждого праймера, 67 мМ трис-HCl буфер (рН 8,8 при 25°С), 15 мМ сульфат аммония, 2,5 мМ хлористый магний, 0,01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 1 ед. Taq-полимеразы. Реакцию амплификации проводили под вазелиновым маслом в течение 5 циклов: 93°С - 1 мин, 45°С - 1 мин и 72°С - 2 мин, а затем 30 циклов: 93°С - 1 мин, 55°С - 1 мин и 72°С - 2 мин. Продукты амплификации разделяли с помощью электрофореза в 1% геле агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК размером 1213 н.п., содержащий ген НМР, вырезали и выделяли из геля с помощью центрифугирования через стекловату. ДНК осаждали тремя объемами этанола и растворяли в бидистиллированной воде. Полученная ДНК была обозначена как pCRHMP и состояла из 1213 н.п. С целью создания вектора, экспрессирующего НМР, полученную ДНК pCRHMP, а также ДНК плазмиды pQE13 гидролизовали рестрикционными эндонуклеазами BamHI и XbaI при 37°C в буфере, содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1,5 часов. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагменты ДНК, соответствующие гену НМР размером 1199 н.п и фрагменту плазмиды pQE13 размером 2443 н.п., вырезали, выделяли из геля с помощью центрифугирования через стекловату и смешивали. Полученную смесь рестрикционных фрагментов лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ дитиотрейтола (ДТТ) и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15[REP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и XbaI, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны, ДНК которых содержала в своем составе ген НМР. Данная плазмида получила название pR507.
в) Клонирование участка, обеспечивающего лиганд-специфическую активность
В качестве специфического лиганда был использован эпидермальный фактор роста - epidermal growth factor (EGF). Ген, кодирующий данный пептид, был выделен с помощью ПЦР из плазмиды, предоставленной нам Вертиевым Ю.В. Используя в качестве ДНК-матрицы плазмиду, содержащую клонированный ген EGF, методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров состава (сайты рестриктаз BamHI и Крn21 подчеркнуты)
5'-gggggcccgggatccaattccgatagcgagtgtcctc
5'-caaggagatggatcccaacagtcctccggacacggggcc
соответствующих началу гена EGF и ДНК амплифицируемой плазмиды после его конца, амплифицировали последовательность нуклеотидов. Реакцию проводят в 25 мкл реакционной смеси, содержащей 2 мкг ДНК, 10 пкМ каждого праймера, 67 мМ трис-HCl буфер (рН 8,8 при 25°С), 15 мМ сульфат аммония, 2,5 мМ хлористый магний, 0.01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2.5 мМ) и 1 ед. Taq-полимеразы. Реакцию амплификации проводили под вазелиновым маслом в течение 30 циклов: 93°С - 1 мин, 65°С - 1 мин и 72°С - 30 сек. Продукты амплификации разделяли с помощью электрофореза в 1% геле агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК размером 355 н.п. вырезали и выделяли из геля с помощью центрифугирования через стекловату. ДНК осаждали тремя объемами этанола и растворяли в бидистиллированной воде. Полученная ДНК обозначена как pCREGF и состоит из 355 н.п.
Для создания вектора, экспрессирующего EGF, полученную ДНК pCREGF, а также ДНК плазмиды pQE16 гидролизовали рестрикционными эндонуклеазами BamHI и Крn21 при 37°С в буфере, содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1,5 часов. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагменты ДНК, фрагмент, включающий ген EGF размером 340 н.п., и фрагмент плазмиды pQE16 размером 3052 н.п. вырезали, выделяли из геля с помощью центрифугирования через стекловату и смешивали. Полученную смесь рестрикционных фрагментов лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15[REP4] (Nals, Strs, rirs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и Крn21, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны, ДНК которых содержала в своем составе ген EGF. Полученная плазмида названа pR700.
г) Клонирование участка, обеспечивающего эндосомолитическую активность (Dtox).
В качестве эндосомолитического модуля был использован транслокационный домен (Т) дифтерийного токсина с прилегающим к нему природным спейсером, разделяющим Т и L домены нативного дифтерийного токсина. Для его клонирования были спланированы праймеры, соответствующие концам кодирующей области Т-домена, но N-конец Т-домена модифицирован - 199Leu заменен на Gly, a 201Cys- на Ser.
Используя в качестве ДНК-матрицы плазмиду, содержащую клонированный ген дифтерийного токсина, методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров состава (сайты рестриктаз BamHI и Крn21 подчеркнуты)
5'-gtaggtggatccgggtcatccataaatcttgattgg
5'-cccgtcatccggaaatggttaagatctatgccccgg
соответствующих начальной и концевой части ДНК, кодирующей Т-домен гена дифтерийного токсина, амплифицировали последовательность нуклеотидов. Реакцию проводили в 25 мкл реакционной смеси, содержащей 2 мкг ДНК, 10 пкМ каждого праймера, 67 мМ трис-HCl буфера (рН 8,8 при 25°С), 15 мМ сульфат аммония, 2,5 мМ хлористый магний, 0.01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 1 ед. Taq-полимеразы. Реакцию амплификации проводили под вазелиновым маслом в течение 5 циклов: 93°С - 1 мин 30 сек, 45°С - 2 мин и 72°С - 40 сек, а затем 30 циклов: 93°С - 1 мин, 55°С - 1 мин и 72°С - 40 сек. Продукты амплификации разделяли с помощью электрофореза в 1% геле агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК (pCRDTox) размером 599 н.п.вырезали и выделяли из геля с помощью центрифугирования через стекловату. ДНК осаждали тремя объемами этанола и растворяли в бидистиллированной воде. Для создания вектора, экспрессирующего Т-домен дифтерийного токсина, полученную ДНК pCRDTox, а также ДНК плазмиды pQE16 гидролизовали рестрикционными эндонуклеазами BamHI и Крn21 при 37°С в буфере, содержащем 33 мМ трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1,5 часов. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагменты ДНК, соответствующие гену дифтерийного токсина размером 584 н.п и ДНК плазмиды pQE16 размером 3052 н.п. вырезали, выделяли из геля с помощью центрифугирования через стекловату и смешивали. Полученную смесь рестрикционных фрагментов лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15[REP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и Крn21, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны, ДНК которых содержала в своем составе ген Т-домена дифтерийного токсина. Полученная плазмида названа pR670.
д) Клонирование участка, включающего сигнал ядерной локализации (NLS)
В качестве сигнала ядерной локализации была использована последовательность большого Т-антигена вируса SV-40. В качестве матрицы использовали плазмиду р10, любезно предоставленную нам доктором Д. Янсом. Для стандартизации последовательности NLS в соответствии с концепцией модуля были разработаны праймеры, вводящие сайт BgIII в область, кодирующую С-конец структуры и производящую замену в несущественной области Asp на Glu. Данная замена произведена для удаления сайта кислотного гидролиза Asp-Pro.
Используя в качестве ДНК-матрицы плазмиду, содержащую клонированный ген NLS, методом ПЦР с использованием олигонуклеотидных праймеров состава
5'-gtgagatctgggttcttctacctttctcttc
5'-gtgagatctgcgcgtaatgagctccttgcaaac
соответствующих последовательности матричной плазмидной ДНК перед геном NLS и конец гена NLS, амплифицирвали последовательность нуклеотидов. Сайт рестриктазы BgIII, расположенный в обратном праймере, подчеркнут. Сайт рестриктазы BamHI содержится в плазмиде, являющейся матрицей, а прямой праймер для удобства клонирования в связи с небольшим размером NLS (25 аминокислот или 75 п.н.) был отодвинут более чем на 700 п.н. Реакцию проводили в 25 мкл реакционной смеси, содержащей 2 мкг ДНК, 10 пкМ каждого праймера, 67 мМ трис-HCl буфера (рН 8,8 при 25°С), 15 мМ сульфат аммония, 2,5 мМ хлористый магний, 0.01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2.5 мМ) и 1 ед. Taq-полимеразы (Deep Vent). Реакцию амплификации проводили под вазелиновым маслом в течение 30 циклов: 94°С - 1 мин, 57°С - 1 мин и 72°С - 1 мин. Продукты амплификации разделяли с помощью электрофореза в 1% геле агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК (pCRNLS) размером 809 н.п. вырезали и выделяли из геля с помощью центрифугирования через стекловату. ДНК осаждали тремя объемами этанола и растворяли в бидистиллированной воде. Полученную ДНК pCRNLS лигировали с плазмидой pGEM4Z, гидролизованной рестриктазой HincII при 37°С в буфере, содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1,5 часов. Лигирование проводили с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli DH5α [F- (φ80dlacZ) recA1 endA1 gyrA96 thi-1 hsdR17 (rk -mk +) supE44 relA1 deoR Δ(lacZYA-argF) U169] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл). Были отобраны рекомбинантные клоны с прямой ориентацией клонируемого фрагмента, подтвержденной рестрикционным картированием (плазмида pR402dir). С целью создания вектора, экспрессирующего NLS, ДНК плазмид pR402dir и pQE16 гидролизовали рестрикционными экзонуклеазами BamHI и Bg1I при 37°C в буфере, содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1,5 часов. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК, включающий ген NLS размером 1507 н.п., а также фрагмент ДНК плазмиды pQE16 размером 993 н.п. вырезали, выделяли из геля с помощью центрифугирования через стекловату и смешивали. Полученную смесь рестрикционных фрагментов лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15 [REP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и Bg1I, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны, ДНК которых содержала в своем составе ген NLS. Полученную плазмиду назвали pR407.
е) Клонирование спейсера (Gly-Ser)5
Спейсер (Gly-Ser)5 предназначен для пространственного отделения лиганда от объемной общей конструкции, чтобы обеспечить взаимодействие лиганда с рецептором на поверхности клетки, который может быть расположен в глубине мембраны. Данная последовательность получена из химически синтезированных олигонуклеотидов.
Последовательность фланкирована полусайтами рестриктаз BamHI и HindIII, на С-конце перед сайтом HindIII предусмотрен сайт рестриктазы Bg1II, а также сайты рестриктаз SmaI и EheI для легкости тестирования (Все сайты рестриктаз подчеркнуты). Каждую из цепей химически синтезированных олигонуклеотидов
5'-gatccccgggttctggctccggctctggttccggttctggcgccagatcta
5'-agcttagatctggcgccagaaccggaaccagagccggagccagaacccggg
фосфорилировали отдельно. Реакцию проводили в 10 мкл буфера трис-HCl рН 9,5, содержащего 10 мМ хлорид магния, 50 мМ ДТТ, 1 мМ АТФ, 100 пмоль олигонуклеотида, 1 ед. полинуклеотидкиназы фага Т4, в течение 30 мин при 37°С. После окончания реакции пробы объединяли, прогревали при 90°С в течение 10 мин и медленно охлаждали до 25°С. Для создания вектора, экспрессирующего спейсер (Gly-Ser)5, ДНК плазмиды pQE13 гидролизовали рестрикционными экзонуклеазами BamHI и HindIII при 37°С в буфере содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в Bg1II. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК плазмиды pQE13 размером 3420 н.п. вырезали, выделяли из геля с помощью центрифугирования через стекловату и объединяли со смесью кинированных олигонуклеотидов. Полученную смесь лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15 [REP4] (Nals, Strs, rifs, lac-, ara, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и HindIII, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны, плазмидная ДНК которых содержала в своем составе ген пептида (Gly-Ser)5. Полученную плазмиду назвали pR703
ж) Получение плазмиды pR689 (блок модулей НМР-NLS)
Для получения плазмиды, экспрессирующей МРТ, содержащей модули HMP-NLS, ДНК плазмиды pR407 гидролизовали рестрикционными эндонуклеазами BamHI, ЕсоO1091, а ДНК плазмиды pR507 гидролизовали рестрикционными эндонуклеазами BglII, ЕсоO1091 при 37°С в буфере, содержащем 33 мМ Трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1 часа. Выделенные из геля рестрикционные фрагменты: фрагмент ДНК плазмиды pR407, включающий модуль NLS размером 2363 н.п, а также фрагмент ДНК плазмиды рР507,включающий ген НМР размером 1358 н.п. лигировали с помощью ДНК-лигазы фага Т4. Полученной лигированной смесью трансформировали клетки Е.coli M15 [REP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI, Bg1II и ЕсоO1091, а также рестриктаз сайтов, находящихся внутри клонируемого фрагмента, и отбирали клоны (pR689), плазмидная ДНК которых содержала в своем составе блок модулей НМР-NLS.
з) Получение плазмиды pR711v (блок модулей Dtox-(Gly-Ser)5)
Для получения плазмиды pR711v, содержащей блок модулей Dtox-(Gly-Ser)5, ДНК плазмиды pR703 гидролизовали рестрикционными эндонуклеазами BamHI и Pvul при 37°С в буфере 66 мМ Трис-ацетат (рН 7,9 при 37°С), 20 мМ ацетат магния, 132 мМ ацетат калия и 0,2 мг/мл бычьего сывороточного альбумина (БСА) в течение 1 часа, а ДНК плазмиды pR670 гидролизовали рестрикционными эндонуклеазами Bg1II и Pvul при 37°С в буфере, содержащем 50 мМ Трис-HCl (рН 7,5 при 37°С), 10 мМ хлорид магния, 100 мМ хлорид натрия и 0,1 мг/мл БСА в течение 1 часа. Выделенные из геля рестрикционные фрагменты: фрагмент ДНК плазмиды pR703, включающий модуль (Gly-Ser)5 размером 2704 н.п, а также фрагмент ДНК плазмиды pR670, включающий модуль Dtox размером 1307 н.п., лигировали с помощью ДНК-лигазы фага Т4. Полученной лигированной смесью трансформировали клетки Е.Coli M15 [REP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК выделяли методом щелочного лизиса, анализировали с помощью рестриктаз Pvul, BamHI и Bg1II, a также рестриктаз сайтов, находящихся внутри клонируемых фрагментов, и отбирали клоны pR711v (размером 4011 н.п.), плазмидная ДНК которых содержала блок модулей Dtox-(Gly-Ser)5.
и) Получение плазмиды pR727v (блок модулей Dtox-(Gly-Ser)5-EGF)
Для получения плазмиды, экспрессирующей МРТ, содержащий модули Dtox-(Gly-Ser)5, ДНК плазмиды и pR700 гидролизовали рестрикционньши эндонуклеазами BamHI, Bg1I, а ДНК плазмиды pR711v гидролизовали рестрикционньши эндонуклеазами Bg1II и Bg1I при 37°С в буфере, содержащем 33 мМ трис-ацетат (рН 7,9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия в течение 1 часа. Выделенные из геля рестрикционные фрагменты: фрагмент ДНК плазмиды pR700, включающий ген EGF размером 2365 н.п, а также фрагмент ДНК плазмиды pR711v, включающий блок модулей Dtox-(Gly-Ser)5 размером 1602 н.п. лигировали с помощью ДНК-лигазы фага Т4. Полученной лигированной смесью трансформировали клетки Е.Coli M15 [REP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI, Bg1I и Bg1II, а также рестриктаз сайтов, находящихся внутри клонируемых фрагментов, и отбирали клоны (pR727v), плазмидная ДНК которых содержала в своем составе блок модулей Dtox-(Gly-Ser)5-EGF.
к) Получение плазмиды pR752, кодирующей МРТ
Для ее получения плазмиду, содержащую блок модулей Dtox-(Gly-Ser)5-EGF (pR 727v) гидролизовали рестриктазами XhoI и BamHI (в буфере, содержащем 10 мМ трис-HCl, рН 8,5 при 37°С, 10 мМ MgCl2, 100 мМ КС1, 0,1 мг/мл БСА), а плазмиду, содержащую блок модулей HMP-NLS (pR689) - рестриктазами XhoI и Bg1II (в буфере, содержащем 50 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 100 мМ NaCl, 0,1 мг/мл БСА) в течение 1 часа при 37°С. Продукты рестрикции разделяли с помощью электрофореза в геле 1% агарозы, окрашивали раствором бромистого этидия и фрагмент ДНК плазмиды pR727v, включающий блок модулей Dtox-(Gly-Ser)5-EGF размером 3847 н.п., а также фрагмент плазмиды pR689, включающий блок модулей HMP-NLS размером 1422 н.п., вырезали, выделяли из геля с помощью центрифугирования через стекловату и смешивали. Полученную смесь рестрикционных фрагментов лигировали с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ MgCl2, 10 мМ ДТТ и 5 мМ АТФ. Лигированную ДНК использовали для трансформации клеток Е.Coli M15 [REP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл). Плазмидную ДНК (pR752) из устойчивых к антибиотикам колоний выделяли методом щелочного лизиса, анализировали с помощью рестриктаз XhoI, BamHI и Bg1II, а также рестриктаз, находящихся внутри клонируемых фрагментов, и отбирали клоны, ДНК которых содержит в своем составе нужные последовательности. Таким образом была получена плазмида pR 752, кодирующая МРТ 6His-НМР-NLS-Dtox-(Gly-Ser)5-EGF.
Первичную структуру полученной плазмиды подтвердили секвенированием дидезоксиметодом Сэнгера.
Пример 2. Получение штамма-продуцента МРП 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF и микробиологический синтез МРП.
Клетки Е.Coli M15 (REP 4) (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) трансформировали плазмидой pR752 методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мл).
Индукцию синтеза МРТ проводили в соответствии со стандартным протоколом фирмы QUIAGEN. Среду LB с ампициллином (100 мкг/мл) и канамицином (25 мкг/мг) инокулировали свежей ночной культурой клеток штамма M15 [REP4], несущих плазмиду, кодирующую МРТ, и выращивали при 37°С с аэрацией, определяя оптическую плотность при 600 нм каждый час до достижения плотности 0.9-1.2. В клеточную суспензию добавляли индуктор изопропилтиогалактозид (IPTG) до концентрации 0,2 мМ и выращивали 5 часов при 30°С с аэрацией. Клетки собирали центрифугированием в течение 15 мин при 5000 g; полученный осадок хранили при -20°С. Уровень экспрессии МРТ 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF, кодируемого плазмидой pR752, составил 32%, растворимость - около 65%.
Пример 3. Очистка МРП
Клетки, выращенные, как правило, в 1 литре среды, лизировали в буфере следующего состава: 10 мМ HEPES-Na буфер, рН 7,5, 0,1 мМ ЭДТА, 1 мМ ДТТ, 3 мМ фенилметилсульфонилфторид, 10 мкг/мл лизоцим. Количество буфера определялось соотношением: 10 мл буфера на 10 г клеток. После обработки ультразвуком суспензию центрифугировали 25 мин при 17000 об/мин (ротор JA-20 к центрифуге "Beckman" J2-21). Супернатант подвергали дальнейшей очистке на сорбенте Blue Sepharose CL-6B ("Pharmacia"). Элюировали белок градиентом концентрации NaCl 0,2-1,6 М. Фракции 0,7-1,6 М NaCl содержали искомый препарат 96%-ной чистоты. Выход - 20 мг на 1 г биомассы. Гомогенность и молекулярный вес МРТ оценивали по результатам электрофореза в системе Laemmly.
Пример 4. Определение эффективности фотодинамического действия конъюгатов МРП с ФС
Для оценки взаимодействия модульного рекомбинантного полипептида с раковыми клетками проведено исследование фотодинамического действия конъюгатов МРП с фотосенсибилизаторами (ФС) на клетках в культуре. В качестве раковых клеток были использованы клетки эпидермоидной карциномы человека линии А431, в качестве ФС - хлорин е6 с длинноволновьм пиком поглощения в районе 660 нм и бактериохлорин р6 с длинноволновым пиком поглощения в районе при 760 нм.
Синтез и очистка конъюгатов МРП с фотосенсибилизаторами - хлорином е6 и бактериохлорином р6
К раствору хлорина е6 или бактериохлорина p6 в 5 мМ Na-фосфатном буфере (рН 8,0) добавляли раствор бифункционального кросс-сшивающего агента 1-этил-3-(3-диметиламинопропил)-карбодиимида (30 мг/мл) в воде и раствор N-гидроксицукцинимида (100 мг/мл) в тетрагидрофуране (соотношение порфирин:карбодиимид: N-гидроксицукцинимид 1:30:30). Реакционную смесь тщательно перемешивали и инкубировали в течение 3 часов при комнатной температуре. Все операции с ФС проводили в темноте в атмосфере инертного газа. Для получения конъюгата МРП-ФС к раствору белка в 0,1 М боратном буфере (рН 9,0) добавляли раствор активированного ФС в соотношении 1:15 и инкубировали на льду в течение 19 часов при постоянном перемешивании. Для очистки конъюгата от несвязавшегося ФС и сшивающих агентов использовали гель-фильтрацию (Сефадекс G-50). Для этого 1 мл раствора конъюгата, предварительно проинкубированного в течение 30 минут при температуре 0°С в 3 М гуанидине с добавлением 1 мМ ЭДТА, наносили на колонку диаметром 1 см, длиной 10 см. Очистку проводили в буфере, содержащем 50 мМ Na-фосфат, 150 мМ NaCl, 3 М гуанидин хлорида, 1 мМ ЭДТА, рН 8,0. Фракции, содержащие белок, были сразу же диализованы против буфера, содержащего 5 мМ Na-фосфат, 150 мМ NaCl, 1 мМ ЭДТА, рН 8,0, последний диализ вели против буфера, не содержащего ЭДТА.
Проведенный таким образом синтез конъюгатов 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF с ФС - хлорином е6 позволил получить препарат с молярным соотношением ковалентно присоединенного ФС к МРП 1,5 к 1, конъюгат с бактериохлорином р6 получен с молярным соотношением ковалентно присоединенного ФС к МРП как 1 к 1.
Исследование фотодинамического действия ФС и конъюгатов МРП-ФС
Клетки А431 рассевали в 48-луночные плашки по 5 тысяч клеток в лунку в среде DMEM с 10% фетальной сывороткой, через 24 часа к клеткам добавляли различные концентрации свободного ФС или конъюгатов МРП-ФС в среде DMEM с 2 мг/мл БСА и инкубировали 20 часов. По окончании инкубации клетки 3 раза отмывали от свободного ФС или конъюгатов раствором Хенкса, добавляли среду DMEM с 10% фетальной сывороткой и инкубировали в течение 2 часов. После инкубации клетки трижды отмывали раствором Хенкса, добавляли среду DMEM для воздуха и облучали необходимой дозой света с помощью графопроектора Пеленг-2400 (Россия). При облучении клеток, инкубированных с бактериохлорином р6 и соответствующим конъюгатом, была использована комбинация фильтров (КС17+СС4) с пропусканием в диапазоне 730-800 нм. Клетки, инкубированные с хлорин е6 и его конъюгатом с белком, облучали аналогичным образом без фильтра. Далее клетки инкубировали в среде DMEM с 10% фетальной сывороткой в течение 48 часов в СО2-инкубаторе при 37°С и 5% СО2. Затем клетки трижды отмывали раствором Хенкса, добавляли 0,5% раствор метиленового синего в 50% этиловом спирте и инкубировали при комнатной температуре в течение 30 минут. Избыток краски отмывали дистиллированной водой, поглощенной клетками краситель экстрагировали 0,5 мМ раствором HCl в 50% этиловом спирте и измеряли оптическую плотность на спектрофотометре Multiscan (Labsystem, Швеция) при длине волны 650 нм.
Изучение фотодинамического действия фотосенсибилизаторов и их конъюгатов 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF через 22 часа после добавления действующего компонента показало, что при включении ФС в состав МРП увеличивает их эффективность на 3 порядка. Результаты экспериментов приведены на фиг.2 и фиг.3. На фиг.2 приведена зависимость выживаемости клеток А431 от концентрации добавленных хлорина e6 и его конъюгата с МРП, облучение в дозе 288 кДж/м2 без фильтров, где 1 - конъюгат 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF с ФС - хлорином е6, 2 - хлорин е6. На фиг.3 представлена аналогичная зависимость для конъюгата 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF с бактериохлорином р6 при облучении в дозе 75 кДж/м2 с комбинацией фильтров, обеспечивающих пропускание в области 730-800 нМ, где 1 - конъюгат 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF с бактериохлорином р6, 2 - бактериохлорин р6.
Таким образом, тестирование конъюгатов 6His-HMP-NLS-Dtox-(Gly-Ser)5-EGF с ФС хлорином е6 и бактериохлорином р6 показало, что ковалентное присоединение ФС к предложенному МРП обеспечивает увеличение эффективности ФС на культуре клеток А431 на 3 порядка. Это является хорошей предпосылкой для создания средств, которые могут быть использованы при фотодинамической терапии злокачественных опухолей.




Изобретение относится к области биотехнологии, в частности к генной инженерии, и может быть использовано в медико-биологической промышленности для получения средств, обеспечивающих направленный транспорт фотосенсибилизирующих агентов в ядра опухолевых клеток. Предложена новая рекомбинантная плазмида pR752 (5269 п.о), в которой под контролем промотора бактериофага Т5 находится генетическая конструкция, кодирующая модульный полипептид, состоящий из 6 остатков гистидина, гемоглобиноподобного белка E.coli, модифицированного фрагмента большого Т-антигена SV-40, транслокационного домена дифтерийного токсина, спейсерной последовательности (Gly-Ser)5 и эпидермального фактора роста человека (6 His-HMP-NLS-DTox-(Gly-Ser)5-EGF) и предназначенный для направленного переноса фотосенсибилизаторов в ядра клеток-мишеней. Путем трансформации штамма E.coli M 15 (Rep 4) плазмидой pR752 получен рекомбинантный штамм E.coli ВКПМ В-8356 - продуцент нового полипептидного вектора, применение которого способно на несколько порядков повысить эффективность действия фотосенсибилизаторов. 3 ил.
искусственный бактериальный оперон, содержащий промоторную область бактериофага Т5 и нуклеотидную последовательность, кодирующую мультидоменный белок 6 His-HMP-NLS-DTox-(Gly-Ser)5-EGF с SEQ ID №1;
бактериальный оперон bla, кодирующий белок бета-лактамазу, используемый в качестве селективного маркера;
бактериальный участок инициации репликации типа Col E1, обеспечивающий репликацию плазмиды в штаммах Е.coli.
| РОЗЕНКРАНЦ А.А | |||
| и др | |||
| Генетика, 39, №2, 259-268, 2003 | |||
| CHEN B.P, HAI Т., Gene, 139(1), 73-75, 1994 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2005-11-27—Публикация
2004-01-05—Подача