Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, в частности генной инженерии, а также к медицине и фармакологии и представляет собой штамм-продуцент модульного нанотранспортера (МНТ), обеспечивающего направленный транспорт лекарств в ядра раковых клеток, с улучшенными характеристиками экспрессии и стабильности синтезируемого белка.
Штамм-продуцент МНТ может быть использован для генной терапии, а также радио- и фототерапии новообразований различной природы.
Предшествующий уровень техники
Описаны модульные транспортеры: системы направленной доставки лекарств в клетки-мишени [1-10]. Для доставки локально действующих лекарств (например, фотосенсибилизаторов, радионуклидов с коротким пробегом испускаемых частиц) эффективность данного подхода недостаточна ввиду того, что данный класс лекарств наиболее токсичен для клеток, будучи доставленным непосредственно в клеточное ядро. В рамках этой концепции ранее был предложен штамм-продуцент модульного транспортера - модульного рекомбинантного полипептида для доставки фотосенсибилизатора (патент РФ №2265055, 2004, [3]), продуцирующий модульный рекомбинантный полипептид 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF, состоящий из нескольких модулей, который позволяет доставлять фармакологический агент не только в клетки-мишени, но и в наиболее подверженный воздействиям клеточный компартмент - клеточное ядро.
Ранее [3] для очистки модульного транспортера использовали метод градиентной колоночной хроматографии на колонке с голубой сефарозой. Данный модульный транспортер позволяет использование аффинной хроматографии на Ni-NTA агарозе, однако штамм-продуцент МНТ - модульного рекомбинантного полипептида, описанный в патенте №2265055, не является пригодным для наработки МНТ в больших количествах и с высокой чистотой при условии использования для очистки аффинной хроматографии.
Задачей данного изобретения стало создание штамма-продуцента, обеспечивающего получение МНТ 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF с большим выходом и стабильностью конечного продукта.
Раскрытие изобретения
Заявляемая задача решается путем использования прокариотической экспрессионной системы МНТ с улучшенными свойствами для создания нового штамма-продуцента, дефицитного по протеазам. Важным отличием предлагаемого штамма-продуцента от ближайшего аналога (Патент РФ №2265055, 2004) является увеличение выхода и степени очистки получаемого продукта с использованием аффинной хроматографии при полном сохранении его функциональных характеристик. Для экспрессии МНТ использовали плазмиду pR752, несущую:
- искусственный бактериальный оперон, содержащий промоторную область бактериофага Т 5 и ген, кодирующий МНТ (фиг. 1) 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF (кодирующая область 115-2199 нуклеотидных пар, модули выделены полужирным шрифтом), где:
6His - последовательность из 6 гистидинов, обеспечивающая очистку МНТ при помощи аффинной хроматографии;
НМР - модуль-носитель, который включает последовательность гемоглобиноподобного белка Escherichia coli;
DTox - эндосомолитический модуль, включающий транслокационный домен дифтерийного токсина;
NLS - модуль для транспорта в ядро клетки, включающий оптимизированную последовательность сигнала ядерной локализации большого Т-антигена вируса обезьяньего вируса ОВ40;
EGF - лигандный модуль, включающий последовательность эпидермального фактора роста в качестве интернализуемого лиганда для связывания с рецепторами ErbB1, сверхэкспрессированными на клетках рака головы и шеи, рака пищевода, мочевого пузыря и ряда др. злокачественных новообразований.
- бактериальный оперон bla, кодирующий белок бета-лактамазу, являющийся селективным маркером для трансформации штаммов Е. coli (кодирующая область 5064-4204 нуклеотидных пар в комплементарной цепи)
- бактериальный участок инициации репликации типа Col El (3206-4196 нуклеотидных пар), обеспечивающий репликацию плазмиды в штаммах Е. coli.
Улучшенные свойства обеспечиваются путем трансформации штамма Е. coli плазмидой pR752, кодирующей МНТ, и дальнейшим использованием трансформированного штамма как продуцента целевого химерного белка с последующим выделением и очисткой целевого продукта.
Штамм-продуцент Е. coli Rosetta™ (F-ompT hsdSB(rB- mB-) gal dcm pRARE2 (CamR) с плазмидой-помощником pRARE2. Штамм Rosetta™, производный штамма BL21 штамм для экспрессии белков, дефицитный по протеазам lon и ompT, что улучшает чистоту экспрессируемого белка. Плазмида-помощник pRARE2 кодирует редкие тРНК для кодонов AUA, AGG, AGA, CUA, ССС, GGA и CGG, что ведет к снятию ограничений при трансляции, вызванных недостатком данных тРНК в клетках Е. coli. Штамм-продуцент Е. coli Rosetta™ fpRARE2, pR752) депонирован в Коллекции Промышленных Микрооганизмов Федерального Государственного Унитарного предприятия «НИИ генетика» (г.Москва). Дата депонирования: 17 июля 2012 г. Регистрационный номер ВКПМ: В-11308.
Сущность изобретения состоит в создании нового штамма-продуцента, позволяющего получать МНТ 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF с улучшенными чистотой и выходом.
Культурально-морфологические характеристики штамма: Аэроб. При росте на LB-агаре колонии гладкие, круглые, прижаты, блестящие, сероватые, мутные, край ровный. При росте в жидкой среде LB образуют интенсивную муть. Клетки прямые, палочковидной формы, подвижные, грамотрицательные.
Продукт, синтезируемый штаммом: модульный нанотранспортер 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF.
Генетические особенности штамма: Е. coli Rosetta™ [pRARE2] (F-ompT hsdSB(rB-mB-) gal dcm pRARE2 (CamR)
Краткое описание иллюстраций
Фиг. 1. Схема расположения модулей МНТ.
НМР - модуль-носитель с последовательностью гемоглобиноподобного белка Escherichia coli; DTox - эндосомолитический модуль, включающий транслокационный домен дифтерийного токсина; NLS - модуль для транспорта в ядро клетки, включающий оптимизированную последовательность сигнала ядерной локализации большого Т-антигена вируса обезьяньего вируса ОВ40; EGF - лигандный модуль, включающий последовательность эпидермального фактора роста человека.
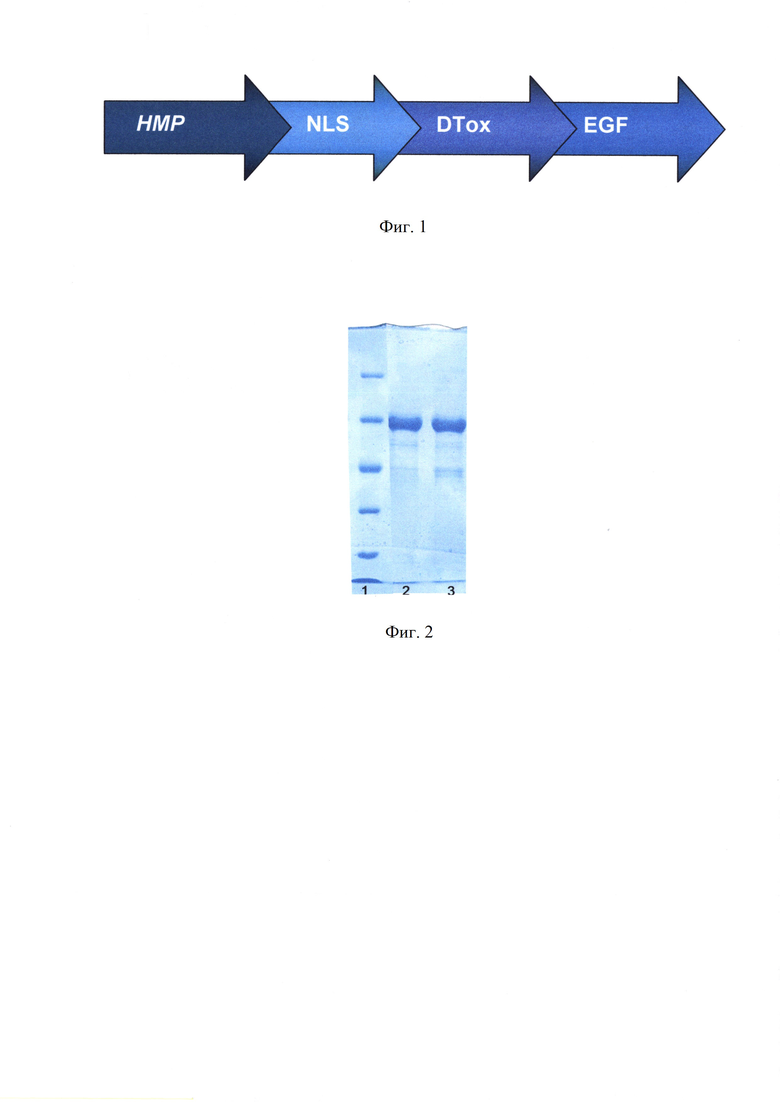
Фиг. 2. Электрофореграмма очищенного МНТ.
1 дорожка - стандарты, сверху вниз: бета-галоктозидаза Е. coli, бычий сывороточный альбумин, овальбумин из куриных яиц, лактат дегидрогеназа мышцы свиньи, REase BSP98IЕ. coli; 2 дорожка - МНТ, выделенный из заявляемого штамма Е. coli Rosetta™ (pRARE2, pR752), ВКПМ B-11308; 3 дорожка - МНТ выделенный из штамма E.coli - 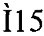 (Rep4, pR752), ВКПМ В-8356.
(Rep4, pR752), ВКПМ В-8356.
Примеры осуществления изобретения
Молекулярно-биологические процедуры (трансформация ДНК в клетки E.coli, экспрессия белков и ее анализ) - выполнены по стандартным методикам [11-12].
В качестве штамма Е. coli для трансформации был выбран штамм Rosetta™ с плазмидой-помощником pRARE2, дефицитный по протеазам lon и ompT, улучшающих чистоту экспрессируемого белка и кодирующий редкие в клетках Е. coli тРНК для кодонов AUA, AGG, AGA, CUA, ССС, GGA и CGG.
Пример 1. Получение штамма - продуцента МНТ
Клетки Е. coli Rosetta™ [pRARE2] (F-ompT hsdSB(rB- mB-) gal dcm pRARE2 (CamR) трансформировали плазмидой pR752, кодирующей МНТ 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF (фиг. 1), кальциевым методом. Трансформированные клетки отбирали на агаризованной среде LB с помощью антибиотиков ампициллина (100 мкг/мл) и хлорамфеникола (34 мкг/мл), в результате чего получали штамм-продуцент МНТ - Е. coli Rosetta™ (pRARE2, pR752).
Пример 2. Получение МНТ: микробиологический синтез МНТ и очистка МНТ
Ночную культуру клеток, трансформированных соответствующими плазмидами, разбавляли в 100 раз средой LB (Luria broth base - Miller's LB broth base), 25 г/л (Amresco, США), содержащей 34 мкг/мл хлорамфеникола и 100 мкг/мл ампициллина, и растили при температуре 37°С в течение 3-4 часов при покачивании. После достижения значения мутности суспензии, равного 0,6-0,9 относительных единиц (при λ=550 нм), температуру суспензии и окружающей среды снижали до 15-17°С и индуцировали экспрессию МНТ с помощью добавления изопропил-β-D-тиогалактопиранозида (ИПТГ, «СибЭнзим», Россия) до концентрации 0,2 мМ. Через 2 часа после начала индукции клетки осаждали центрифугированием в течение 15 минут при температуре 4°С и 7500 × g (центрифуга «Beckman J2-HS», «Beckman Instruments Inc.», США).
Полученную биомассу лизировали на льду в буфере, содержащем 50 мМ фосфат натрия («Sigma») рН 8,0, 300 мМ NaCl, 0,5% Тритон Х-100 («Serva», Германия), 5 мг/мл лизоцим («Sigma»), 1 мМ фенилметилсульфонилфторид (ФМСФ, «Sigma») и 1,5 мкг/мл апротинин («Sigma»), и центрифугировали в течение 25 минут при температуре 4°С (45000 × g, центрифуга «Beckman J2-HS»).
Выделение МНТ проводили с помощью аффинной хроматографии на Ni-NTA-агарозе («QIAGEN», Германия) при температуре 4°С. Иммобилизованный на Ni-NTA-агарозе МНТ сначала промывали буфером, содержащим 50 мМ фосфат натрия рН 8,0, 300 мМ NaCl, 20 мМ имидазол («АррliChem», Германия), 1% глицерин («ICN», США), 0,5% Тритон Х-100, затем инкубировали 30 мин при температуре 4°С при постоянном перемешивании, а затем центрифугировали в течение 10-20 мин при 1 тыс. × g. После центрифугирования супернатант сливали, а к осадку добавляли 45 мл буфера, содержащего 50 мМ фосфат натрия, 300 мМ NaCl, рН 8,0. Осадок с буфером перемешивали, а затем центрифугировали в течение 10-20 мин при 1 тыс. × g. Процедуру повторяли 3 раза. После центрифугирования супернатант сливали, а к осадку добавляли 25 мл буфера, содержащего 50 мМ фосфат натрия, 300 мМ NaCl, 20 мМ имидазол рН 8,0. Белок элюировали, добавив к Ni-NTA-агарозе необходимое количество элюирующего буфера, содержащего 50 мМ фосфат натрия, 300 мМ NaCl, 700 мМ имидазол рН 8,0, после чего инкубировали в течение 20 мин при температуре 4°С и постоянном перемешивании, а затем центрифугировали в течение 10-20 мин при 1 тыс. × g.
Полученный таким образом элюат, содержащий целевой белок, диализовали против 10 мМ натрий-фосфатного буфера рН 8,0, с 150 мМ NaCl.
Чистоту и молекулярную массу полученных препаратов МНТ проверяли с помощью электрофореза белков в 10% полиакриламидном геле по Лэммли (фиг. 2). Оценку чистоты белковых препаратов проводили с помощью программы Kodak ID v. 3.5.4. («Eastman Kodak Company», США).
Выход МНТ составил 4,60 мг целевого белка с чистотой 95% на 1 л клеточной суспензии с оптической плотностью 0,6 при 550 нм. Экспрессия и очистка в таких же условиях с использованием штамма-продуцента - ближайшего аналога (Патент РФ №2265055, 2004) приводит к получению 2,2 мг целевого белка с чистотой 83% на 1 л клеточной суспензии. Таким образом, использование нового штамма-продуцента приводит к более чем двукратному увеличению выхода существенно более чистого целевого белка по сравнению с ранее использованным штаммом.
Источники информации
1. Розенкранц А.А., Лунин В.Г., Сергиенко О.В., Гилязова Д.Г., Шумянцева М.А., Воронина О.Л., Янс Д.Э., Кофнер А.А., Миронов А.Ф., Соболев А.С.. Направленная внутриклеточная доставка локально действующих лекарств: Специфическая доставка фотосенсибилизаторов в ядра клеток меланомы. Генетика, 39, 2, 259-268, 2003.
2. Rosenkranz А.А., Lunin V.G., Gulak P.V., Sergienko O.V., Shumiantseva M.A., Voronina O.L., Gilyazova D.G., John A.P., Kofher A.A., Mironov A.F., Jans D.A., Sobolev A.S. Recombinant modular transporters for cell-specific nuclear delivery of locally acting drugs enhance photosensitizer activity. FASEB J. 17, 9, 1121-3. 2003.
3. Лунин В.Г., Сергиенко O.B., Воронина О.Л., Рязанова Е.М., Розенкранц А.А., Соболев А.С. Рекомбинантная плазмида, экспрессирующая модульный полипептид для доставки фотосенсибилизатора, и штамм Escherichia coli ВКПМ В-8356 - продуцент модульного полипептида. Патент RU 2265055.
4. Gilyazova D.G., Rosenkranz А.А., Gulak P.V., Lunin V.G, Sergienko O.V., Grin M.A., Mironov A.F., Rubin A.B., Sobolev A.S. Recombinant modular transporters on the basis of epidermal growth factor for targeted intracellular delivery of photosensitizers. Proceedings of SPIE (The International Society for Optical Engeneering). V. 5973, p. 101-110, 2005.
5. Артеменко E.O., Гилязова Д.Г., Розенкранц A.A., Лунин В.Г., Сергиенко О.В., Тимофеев К.Н., Грин М.А., Миронов А.Ф., Рубин А.Б., Соболев А.С. Влияние присоединения бактериохлорина p к модульным рекомбинантным транспортерам для направленной внутриклеточной доставки на эффективность его фото динамического действия. Молекулярная медицина, №4, 43-47, 2005.
6. Gilyazova D.G., Rosenkranz А.А., Gulak P.V., Lunin V.G., Sergienko O.V., Khramtsov Y.V., Timofeyev K.N., Grin M.A., Mironov A.F., Rubin A.B., Georgiev G.P., Sobolev A.S. Targeting cancer cells by novel engineered modular transporters. Cancer Res., 66, 21, 10534-10540, 2006.
7. Rosenkranz A.A., Vaidyanathan G., Pozzi O.R., Lunin V.G., Zalutsky M.R., Sobolev A.S. Engineered Modular Recombinant Transporters: Application of New Platform for Targeted Radiotherapeutic Agents to alpha-Particle Emitting (211) At. Int J Radiat Oncol Biol Phys.; 72 (1): 193-200, 2008.
8. Slastnikova ТА, Rosenkranz AA, Gulak PV, Schiffelers RM, Lupanova TN, Khramtsov YY, Zalutsky MR, Sobolev AS. Modular nanotransporters: a multipurpose in vivo working platform for targeted drug delivery. Int J Nanomedicine. 2012; 7: 467-82.
9. Соболев A.C. Модульные нанотранспортеры - многоцелевая платформа для доставки противораковых лекарств. Вестник РАН, 2013, 83: 685-697.
10. Koumarianou Е, Slastnikova ТА, Pruszynski М, Rosenkranz AA, Vaidyanathan G, Sobolev AS, Zalutsky MR. Radiolabeling and in vitro evaluation of 67Ga-NOTA-modular nanotransporter - A potential Auger electron emitting EGFR-targeted radiotherapeutic. Nucl. Med. Biol. 2014, 41: 441-449.
11. Sambrook J., Russel D.W. Molecular Cloning, Third Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor Laboratory, New York, 2001.
12. The QIAexpressionist. QIAGEN Inc., Fifth Edition, 2003.
Изобретение относится к области биохимии, генной инженерии и биотехнологии, в частности штамму Е. coli RosettaTM (pRARE2, pR752), ВКПМ B-11308. Указанный штамм является продуцентом модульного нанотранспортера для увеличения специфичности и эффективности противоопухолевых веществ 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF. Настоящее изобретение позволяет получать модульный нанотранспортер 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF, используемый для увеличения специфичности и эффективности противоопухолевых веществ. 2 ил., 2 пр.
Штамм Е. coli RosettaTM (pRARE2, pR752), ВКПМ B-11308 - продуцент модульного нанотранспортера для увеличения специфичности и эффективности противоопухолевых веществ 6His-HMP-NLS-DTox-(Gly-Ser)5-EGF.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ЭКСПРЕССИРУЮЩАЯ МОДУЛЬНЫЙ ПОЛИПЕПТИД ДЛЯ ДОСТАВКИ ФОТОСЕНСИБИЛИЗАТОРА, И ШТАММ ESCHERICHIA COLI ВКПМ В-8356 - ПРОДУЦЕНТ МОДУЛЬНОГО ПОЛИПЕПТИДА | 2004 |
|
RU2265055C2 |
| NOVY RD et al., Overcoming the codon bias of E | |||
| coli for enhanced protein expression, Innovations, 2001 | |||
| GLOVER DJ et al., Multifunctional protein nanocarriers for targeted nuclear gene delivery in nondividing cells, The FASEB Journal, 2009. | |||
Авторы
Даты
2017-12-21—Публикация
2015-10-28—Подача