Изобретение относится к области органической химии и медицинской вирусологии и касается разработки нового соединения - димерного производного нетропсина: 15-Лиз-бис-нетропсина и создание на его основе новых комбинаций, обладающих избирательной противогерпесвирусной активностью.
Проблема поиска ингибиторов репродукции ДНК-содержащих вирусов, способных взаимодействовать с вирусной ДНК, разработана совершенно недостаточно. Одним из подходов к решению этой проблемы может быть использование бис-производных нетропсина, состоящих из двух ковалентно связанных с помощью различных линкеров производных нетропсина. Противовирусная активность и механизм действия противоопухолевых антибиотиков нетропсина и дистамицина хорошо известны. Они связываются в узкой бороздке ДНК в области связывания транскрипционных факторов с сайтами, состоящими из 4-5 пар АТ-оснований, соответственно, ингибируя инициацию транскрипции [1, 2]. Они также ингибируют активность ДНК-топоизомераз I и II [3, 4], обратной транскриптазы и интегразы вируса иммунодефицита человека [5]. Однако эти антибиотики не нашли применения в клинической практике из-за высокой токсичности.
Одним из путей повышения селективности (избирательности) связывания этих соединений с ДНК является синтез димерных соединений, в частности бис-нетропсинов, в молекулах которых два мономера ковалентно связаны друг с другом в различных ориентациях. Начиная с 80х годов известная группа Е. DeClercq с соавторами изучала активность бис-производных нетропсина, соединенных алифатической цепочкой, состоящей из 0-10 метиленовых звеньев, в ориентации хвост-к-хвосту [6] и производных нетропсина, содержащих дополнительные пиррольные циклы [7]. Было установлено, что эта группа соединений обладает противоопухолевой активностью, способна селективно ингибировать репродукцию вируса вакцины (химиотерапевтический индекс (ХТИ) до 500). Была обнаружена невысокая активность этих соединений в отношении вируса герпеса простого типа 2 (ХТИ 6 и ниже). В отношении вируса герпеса простого типа 1 (ВПГ-1) активность практически отсутствовала. В ряде случаев минимальная цитотоксическая концентрация была снижена в 5-10 раз по сравнению с нетропсином.
Нами был синтезирован ряд новых бис-производных нетропсина [8-10], являющихся высокоселективными ингибиторами репродукции ВПГ-1, в том числе вариантов вируса, резистентных к базовым лекарственным препаратам [9]. Была проверена их способность усиливать противогерпетическую активность известных лекарственных препаратов, что могло позволить также снизить токсический эффект благодаря снижению активных концентраций [9].
В доступной нам литературе не обнаружено данных о создании 15-Лиз-бис-нетропсина (15-Lys-bis-Nt), его биологической активности и об изучении противовирусной активности комбинации 15-Lys-bis-Nt с модифицированными нуклеозидами: ацикловиром (9-(2-гидроксиэтоксиметил)-гуанин, ациклогуанозин, зовиракс), ганцикловиром (9[(1,3-дигидрокси-2-пропокси)-метил]-гуанин), Е-5-(2-бромвинил)-2'-дезоксиуридин (БВДУ, бривудин), видарабином (Ара-А, 9-β-D-аденинарабинозид) или аналогами пирофосфата (фосфоноуксусной, фосфономуравьиной кислотами (ФУК, ФМК)).
Сущность изобретения заключается в создании нового димерного производного нетропсина - 15-Лиз-бис-нетропсина: 4-[4-[4-[4-[α,ω-бис[α,ω-бис(α,ω-дилизиллизил)лизил]лизил]глицилглицил]амино-1-пропилпиррол-2-карбоксамидо]-1-пропилпиррол-2-карбонил]глицилглицилглициламино]-1-пропилпиррол-2-карбоксамидо]-2-(3-диметиламинопропиламинокарбонил)-1-пропилпиррол трифторацетат, имеющего структурную формулу
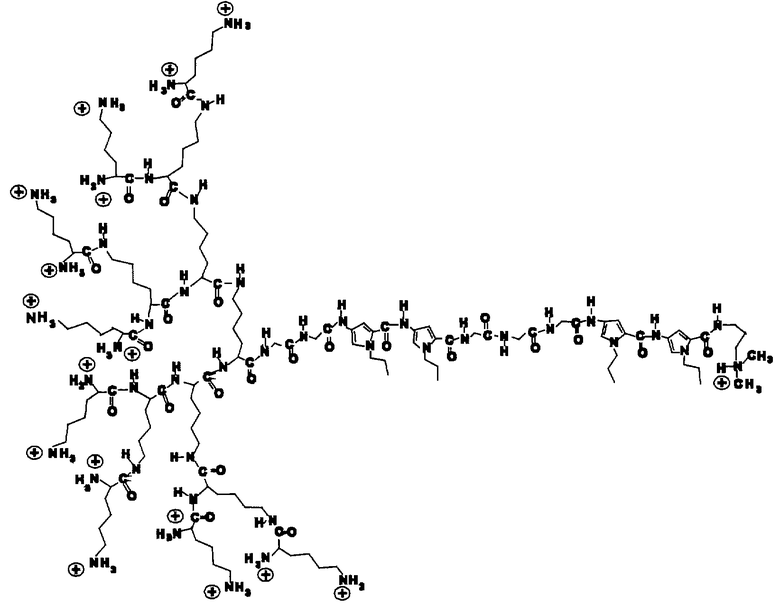
и двухкомпонентных комбинаций этого соединения, обладающего антивирусной активностью, с модифицированными нуклеозидами или фосфоноуксусной/фосфономуравьиной кислотой, обеспечивающих значительное усиление противогерпетического действия по сравнению с каждым из комбинируемых противовирусных соединений, взятым в отдельности, и приводящих к увеличению избирательности (специфичности) противогерпетического действия.
Такие новые комбинации, обеспечивающие высокоэффективное ингибирование инфекции, вызываемой вирусом герпеса простого типа 1, созданы на основе использования двух классов соединений, обладающих принципиально различным механизмом подавления герпесвирусной инфекции: с одной стороны производного нетропсина и с другой стороны модифицированных нуклеозидов или фосфоноуксусной/фосфономуравьиной кислоты.
Химическая формула предлагаемого димерного производного нетропсина: 15-Лиз-бис-нетропсина (15-Lys-bis-Nt), содержащего кластер лизиновых остатков на N-конце, представлена ниже
(((H-Lys)2-Lys)2-Lys)2-Lys-Gly2-Apc2-Gly3-Apc2-NH-(CH2)3-NMe2
где Арс - остаток 1-пропил-4-амино-пиррол-2-карбоновой кислоты.
Это соединение получено путем многостадийного синтеза известными в органической химии методами. Синтез исходного бис-нетропсина (Gly2-bis-Nt), содержавшего два остатка глицина на N-конце и три глициновых остатка между нетропсиновыми блоками, был проведен конденсацией двух блоков, каждый из которых содержал два 1-пропилпирролкарбоксамидных фрагмента.
H-Gly2-Apc2-Gly3-Apc2-NH-(CH2)3-NMe2 Gly2-bis-Nt
Синтез С-концевого блока H-Gly-Apc2-NH-(CH2)3-NMe2 был описан нами ранее [10]. К этому фрагменту мы присоединили еще один остаток глицина. N-концевой блок Z-Gly2-Apc2-Gly-OEt получали конденсацией Z-Gly2-Apc-OH с H-Apc-Gly-OEt.
Z-, -OEt - защитные группы. Синтез Z-Gly2-Apc-OH проводился аналогично описанному ранее синтезу соединения Z-Gly-Apc-OH [11]. Соединение H-Apc-Gly-OEt получали из Npc-Gly-OEt каталитическим гидрированием, где Npc - остаток 1-пропил-4-нитро-пиррол-2-карбоновой кислоты. Npc-Gly-OEt был получен конденсацией Npc-Cl, синтез которого был описан нами ранее [12], с этиловым эфиром глицина. После гидролиза эфирной связи в соединении Z-Gly2-Apc2-Gly-OEt этот блок конденсировали с H-Gly2-Apc2-NH-(CH2)3-NMe2 и после снятия защитной группы получали Gly2-bis-Nt.
С целью синтеза 15-Lys-bis-Nt диВос-лизин конденсировали с Gly2-bis-Nt. После удаления Вос-защитных групп трифторуксусной кислотой соединение выделяли на колонке с сефадексом LH-20 в метаноле, а затем с помощью обращенно-фазовой ВЭЖХ - на колонке с силикагелем С-18 в градиенте ацетонитрила. Полученное соединение H-Lys-Gly2-Apc2-Gly3-Apc2-NH-(CH2)3-N(CH3)2 опять конденсировали с диВос-лизином и очищали на колонках в тех же условиях (см. пример 1).
Пример 1. Синтез (H-Lys)2-Lys-Gly2-Apc2-Gly3-Apc2-NH-(CH2)3-N(CH3)2
К смеси 0,5 ммоль (173 мг) Boc-Lys(Boc)-OH (Sigma, США) и 0,5 ммоль (68 мг) 1-гидроксибензотриазола (Fluka, Швейцария) в 1 мл диметилформамида прибавляли 0,5 ммоль (103 мг) дициклогексилкарбодиимида (Fluka, Швейцария) в 0,5 мл диметилформамида и выдерживали при 20°С 30 мин. Осадок отфильтровывали и раствор прибавили к раствору 0,1 ммоль (146 мг трифторацетата) соединения H-Lys-Gly2-Apc2-Gly3-Apc2-NH-(СН2)3-N(СН3)2 в смеси 0,5 мл диметилформамида и 50 мкл триэтиламина, оставляли при 20°С на 20 ч и реакционную смесь наносили на колонку. Для хроматографии использовали колонку 3×150 см с сефадексом LH-20 (Pharmacia, Швеция) в метаноле; элюцию проводили метанолом при 4°С со скоростью 15 мл/ч, отбирали фракции объемом по 15 мл. Контроль элюатов при колоночной хроматографии осуществляли с помощью УФ регистрирующего проточного денситометра Uvicord II - 8300 (Швеция). После упаривания фракций, содержавших тетра-Вос-производное, было получено 233 мг вещества в виде масла. Его растворяли в смеси 3 мл трифторуксусной кислоты и 0,2 мл тиоанизола (Fluka, Швейцария), выдерживали 1 ч при 25°С, упаривали и дважды хроматографировали на колонке с сефадексом LH-20. После упаривания фракций, содержавших продукт реакции, было получено 187 мг вещества в виде масла. Окончательную очистку соединения и проверку его гомогенности проводили с помощью обращенно-фазовой ВЭЖХ на колонке (250×15 мм) "СКБ ИОХ РАН" с силикагелем С-18 (6 мкм). Выделенные фракции упаривали и лиофилизовали из воды. Выход соединения 157 мг (67% в пересчете на пентатрифторацетат). Чистоту полученного соединения проверяли с помощью тонкослойной хроматографии на пластинках Silufol UV-254 (ЧР) в следующих системах: н-бутанол - уксусная кислота - вода, (4:1:1) - Rf 0.04 и 1М ацетат аммония (рН 7,6) - этанол (3:7) - Rf 0,17. Вещества на хроматограммах обнаруживали по поглощению при 254 нм и при проявлении нингидрином.
Масс-спектр получен на времяпролетном масс-спектрометре с лазерной десорбцией и ионизацией пробы КОМРАСТ MALDI 4 (фирма "KRATOS Analytical", Великобритания) в линейном режиме регистрации положительных ионов; матрица - 2,5-дигидроксибензойная кислота; N2-лазер, 337 нм.
Масс-спектр, m/z: 1374,2 [М+Н]+, рассчитано 1372,7 (C65H105N21O12).
Спектр 1Н-ЯМР регистрировали на приборе АМХ-400 (Brucker, Германия) с рабочей частотой 400 МГц при 23°С. В качестве растворителя использовали d6-диметилсульфоксид; внутренний стандарт - сигнал d6-диметилсульфоксида. Химические сдвиги протонов приведены в м.д. Сокращения: с - синглет, д - дублет, т - триплет, м - мультиплет.
Спектр 1Н-ЯМР: 9,922 (с, 3Н, NHCH2CONH), 9,884 (с, 2Н, CONH), 8,475 (т, 1Н, CONHCH2СН2СН2N(СН3)2), 8,363 (м, 1Н, CHCONHCH2CO), 8,262 (м, 5Н, NHCH2CH2+NHCH2CO), 8,156 (м, 8Н, NH2), 7,212 (д, 2Н, H5A), 7,162 (д, 2Н, H5B), 6,917 (д, 2Н, Н3A), 6,867 (д, 2Н, Н3B), 4,214 (m, 8H, NCH2), 3,832-3,790 (м, 13Н, NHCH2CO+CHCO), 3,224 (m, 2Н, СН2СН2CH2N(СН3)2), 3,058 (m, 2Н, CH2СН2СН2N(СН3)2), 2,784 (m, 6H, N(CH3)2), 1,827 (м, 2Н, CH2CH2CH2N(CH3)2), 1,648 (м, 12Н, СН2CH2CH2СН2), 1,648 (м, 8H, CH2СН3), 1,536 (м, 6H, CH2СН2СН2СН2), 1,313 (м, 6H, СН2СН2СН2CH2), 0,794 (т, 12Н, СН2CH3).
Для синтеза 15-Lys-bis-Nt полученное соединение (H-Lys)2-Lys-Gly2-Apc2-Gly3-Apc2-NH-(СН2)3-N(СН3)2 опять конденсировали с диВос-лизином, очищали на колонках в тех же условиях и затем эти стадии повторяли еще раз.
Кроме конденсации методом активации диВос-лизина с помощью дициклогексилкарбодиимида в присутствии 1-гидроксибензотриазола, были также опробованы реакции конденсации с имидазолидом диВос-лизина, которые приводили к аналогичным продуктам реакции со сходными выходами.
Идентификацию конечного и промежуточных продуктов синтеза проводили методами ЯМР на ядрах 1Н и 13С и масс-спектрометрией. В масс-спектрах промежуточных и конечного продукта присутствовал один доминирующий пик, соответствующий молекулярному иону.
Биологическая активность 15-Lys-bis-Nt. При исследовании противовирусной активности в работе использовали вирус герпеса простого типа 1 (ВПГ-1) штамм L2, a также вариант ВПГ, устойчивый к ацикловиру (АЦВR-ВПГ-1), штамм, устойчивый к действию фосфономуравьиной/фосфоноуксусной кислоты (ФМКR-ВПГ-1) и ВПГ-1, устойчивый к действию комбинации АЦВ и ФМК/ФУК ((АЦВ/ФМК)R-ВПГ-1). В работе также использовали образцы ВПГ-1, изолированные из клинического материала (моча, слюна, сперма).
Ацикловир (АЦВ, 9-(2-гидроксиэтоксиметил-гуанин, ациклогуанозин, зовиракс) производства "GlaxoWellcome", Великобритания. Ганцикловир (ГЦВ, 9-[(1,3-дигидрокси-2-пропокси)-метил]-гуанин) производства "Hoffman La Roch ltd", Швейцария. Е-5-(2-бромвинил)-2'-дезоксиуридин (БВДУ, бривудин) производства "Berlin Hemie", Германия. Фосфоноуксусная кислота, фосфономуравьиная кислота в виде тринатриевых солей (ФМК, фоскавир), производства "Astra", Швеция. Ара-А (9-β-D-аденинарабинозид, видарабин) производства "Calbiochem", США.
Цитотоксичность 15-Lys-bis-Nt и его комбинаций оценивали в культуре клеток Vero с использованием метода окрашивания клеток трипановым голубым, основанным на способности мертвых клеток окрашиваться красителем. После 72-часовой инкубации клеток в присутствии изучаемых соединений или их комбинаций клетки подсчитывали с помощью гемоцитометра и определяли величину ЦД50 - концентрацию соединений, в присутствии которой погибает не более 50% клеток по сравнению с контролем, инкубируемым без препаратов.
При изучении противогерпетической активности соединений и их комбинаций in vitro культуру клеток Vero инфицировали ВПГ-1 штамм L2 с множественностью 0,1 БОЕ/кл (где БОЕ - бляшкообразующая единица) и инкубировали под жидкой средой поддержки, содержащей препараты или их комбинации в известных концетрациях. После 48 часов инкубации, когда в контроле вируса развивался 95-100% цитопатический эффект (ЦПЭ), определяли концентрации, на 50% ингибирующие развитие вирусиндуцированного цитопатического эффекта по сравнению с контролем - ИД50 и практически полностью - ИД95.
Пример 2. Изучение цитотоксичности и антивирусного действия 15-Лиз-бис-нетропсина.
В таблице 1 представлены результаты изучения цитотоксического действия и антивирусной активности нетропсина и 15-Lys-bis-Nt в культуре клеток Vero.
Изучение цитотоксичности и антивирусного эффекта нетропсина и 15-Lys-bis-Nt на модели вируса герпеса простого типа 1 (ВПГ-1) штамм L2
[мкг/мл]
[мкг/мл]
Из таблицы 1 видно, что 15-Lys-bis-Nt характеризуется существенно меньшей цитотоксичностью, чем антибиотик нетропсин.
15-Lys-bis-Nt эффективно подавляет репродукцию эталонного штамма вируса ВПГ-1 L2. Величина химиотерапевтического индекса (ХТИ), вычисляемого как отношение ЦД50 к ИД50, и характеризующая уровень селективности 15-Lys-bis-Nt, равна 35, в то время как ХТИ нетропсина равен 7,5. Существенно, что нетропсин способен полностью предотвращать развитие вирус-индуцированного ЦПЭ (ИД95) только в субтоксичной концентрации, тогда как величина ИД95 для нового соединения - 15-Lys-bis-Nt лежит в диапазоне нетоксичных концентраций.
Пример 3. Изучение антивирусной активности 15-Lys-bis-Nt на моделях вариантов ВПГ-1, резистентных к ацикловиру и фосфономуравьиной кислоте
В таблице 2 представлены результаты изучения антивирусной активности 15-Lys-bis-Nt на моделях вируса герпеса с измененной лекарственной чувствительностью в отношении стандартных лекарственных препаратов. 15-Lys-bis-Nt эффективно ингибирует репродукцию штамма ВПГ-1, устойчивого к действию АЦВ, и штамма ВПГ-1, резистентного к ФМК/ФУК. 15-Lys-bis-Nt эффективно подавляет репродукцию варианта ВПГ-1, резистентного к АЦВ и ФМК/ФУК одновременно (таблица 2).
Изучение антивирусной активности 15-Lys-bis-Nt на модели вариантов ВПГ-1, резистентных к ацикловиру и фосфономуравьиной кислоте
Практически идентичные результаты были получены при исследовании образцов, изолированных из клинического материала, устойчивых к ацикловиру (ИД50 ацикловира в диапазоне от 12,5 до 50,0 мкг/мл).
Пример 4. Изучение биологической активности комбинации 15-Lys-bis-Nt с модифицированными нуклеозидами и фосфоноуксусной/фосфономуравьиной кислотой на модели ВПГ-1 в культуре клеток
Эффект комбинации соединений оценивали путем вычисления индекса FIC (fractional inhibitory concentration) как сумму отношений ИД50 каждого из комбинируемых соединений в комбинации к ИД50 соединения при использовании отдельно. При величине FIC<0,5 эффект комбинации оценивался как выраженный синергидный, при FIC<0,9 - как синергидный, при FIC=1,0 - как аддитивный, при FIC>1,0 - индифферентный или антагонизм [13].
Комбинация 15-Lys-bis-Nt с ацикловиром, ганцикловиром, БВДУ, Ара-А и фосфоноуксусной кислотой приводит к усилению противогерпетического эффекта. 50%-ное ингибирование вирусиндуцированного цитопатического эффекта достигается при сочетанном применении 15-Lys-bis-Nt (таблица 3) в неэффективной концентрации 0,075 мкг/мл (что в 66 раз меньше, чем ИД50), и ацикловира в неэффективной концентрации, в 3 раза меньшей, чем ИД50. Аналогичный результат был получен при сочетанном применении 15-Lys-bis-Nt и ганцикловира: развитие вирус-индуцированного ЦПЭ ингибировалось на 50% в концентрациях, в 8 и 5 раз меньших, чем ИД50, соответственно. При использовании комбинации 15-Lys-bis-Nt с БВДУ величины ИД50 соединений в комбинации были в 5 и 4 раза меньше, чем при использовании каждого из рассматриваемых соединений в отдельности. Использование комбинации 15-Lys-bis-Nt и видарабина обеспечивало возможность снижения концентраций обоих соединений в 4 раза. Соответствующие данные приведены в таблице 3. Полученный эффект можно оценить как выраженный синергидный (FIC<0,5) для комбинации 15-Lys-bis-Nt с ацикловиром, ганцикловиром БВДУ и Ара-А.
Как видно из данных таблицы 3, комбинированное использование 15-Lys-bis-Nt с ФУК и ФМК обеспечивало достижение 50% ингибирования развития вирус-индуцированного ЦПЭ при использовании соединений в концентрациях, равных 1/3 и 1/4 ИД50. Эффект комбинации соответствует синергидному (FIC<1,0).
Пример 5. Изучение цитотоксического действия 15-Lys-bis-Nt и его комбинаций in vitro.
В таблице 3 представлены результаты изучения токсического действия 15-Lys-bis-Nt, а также его комбинаций в культуре клеток Vero с использованием метода окрашивания клеток трипановым голубым, основанным на способности мертвых клеток окрашиваться красителем. После 72-часовой инкубации клеток в присутствии изучаемых соединений или их комбинаций клетки подсчитывали с помощью гемоцитометра и определяли величину ЦД50 - концентрацию соединений, в присутствии которых погибает не более 50% клеток по сравнению с контролем, инкубируемым без препаратов. Как видно из таблицы 3, 15-Lys-bis-Nt характеризуется низкой цитотоксичностью, чем антибиотик нетропсин, и предлагаемые на его основе комбинации малотоксичны: при их использовании в диапазоне концентраций, обеспечивающих активное подавление герпесвирусной инфекции, величина ЦД50 не достигается.
Комбинированный эффект 15-Lys-bis-Nt на модели герпесвирусной инфекции в культуре клеток Vero
[мкг/мл]
[мкг/мл]
В основе усиления противогерпетического эффекта комбинаций бис-нетропсинов и модифицированных нуклеозидов лежит различный механизм их действия на синтез вирусной ДНК. Подобно нетропсину 15-Lys-bis-Nt специфически связывается в узкой бороздке ДНК с кластерами из нескольких АТ-пар оснований, препятствуя таким образом связыванию белков, участвующих в регуляции процессов транскрипции или репликации ДНК. Модифицированные нуклеозиды, являясь аналогами природных нуклеозидов в виде трифосфатов, включаются в состав синтезируемой цепочки вирусной ДНК, приводя к терминации синтеза ДНК, ингибируют активность ДНК-полимеразы. Фосфоноуксусная или фосфономуравьиная кислоты конкурируют с обменом пирофосфата из дезоксинуклеозидтрифосфата, связываясь с ДНК-полимеразой, ингибируют ДНК-полимеразу. Создание комбинаций 15-Lys-bis-Nt с модифицированными нуклеозидами или фосфоноуксусной/фосфономуравьиной кислотой обеспечивает значительное усиление противогерпетического действия по сравнению с каждым из комбинируемых противовирусных веществ, взятых в отдельности.
Литература
1. Baily Ch., Chairs J.B. //Bioconjugate Chem. 1998. V. 9, P.513-638.
2. Kopka M.L., Yoon D., Goodsell D. et al. //Proc. Nat. Acad. Sci. USA, 1985, V. 82, P.1376-1380.
3. Beerman T.A., Woynarowski J.M., Sigmund R.D. et al. //Biochim. Biophys. Acta, 1991, 1090, P.52-60.
4. Burkhardt G., Simon H., Storl K. et al. //J. Biomol. Struct. Dyn., 1997, V. 15, P.81-95.
5. Filipowsky M.E., Kopka M.L., Brazil-Zison M. et al. //Biochemistry, 1996, V. 35, P.15397-15410.
6. Lown J.W., Krowicki K., Balzarini J. et al. //J. Med. Chem., 1989, V. 32, P.2368-2375.
7. Baraldi P.G., Balboni G., Pavani M.G. et al. //J. Med. Chem., 2001, V. 44, P.2536-2543.
8. Grokhovsky S.L., Surovaya A.N., Burkhardt G. et al., //FEBS Let., 1998, V. 439, P.346-350.
9. Андронова В.Л., Гроховский С.Л., Суровая А.Н. и др. //ДАН, 2001, Т. 380, с.548-551.
10. Гроховский С.Л., Готтих Б.П., Жузе А.Л. //Биоорган. химия, 1992, Т. 18, с.570-583.
11. Гроховский С.Л., Николаев В.А., Готтих Б.П. и Жузе А.Л. //Биоорган. химия, 2002, т. 28, с.502-517.
12. Гроховский С.Л., Жузе А.Л., Готтих Б.П. //Биоорган. химия, 1975, T. 1, с.1616-1623.
13. Allen L.B., Vanderslise L.K., Fingal C.M. //Antiviral Res. 1982, V. 2, P.203-216.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ НА ОСНОВЕ НЕТРОПСИНА ИЛИ ЕГО БИС-ПРОИЗВОДНОГО, ОБЛАДАЮЩИЕ АНТИГЕРПЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2240792C2 |
| ПРОИЗВОДНЫЕ НЕТРОПСИНА, ОБЛАДАЮЩИЕ АНТИВИРУСНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2394838C2 |
| 2-Амино-5,6-дифтор-1-(бета-D-рибофуранозил)-бензимидазол, способ получения и противовирусная активность его в отношении вируса герпеса простого 1-го типа | 2016 |
|
RU2629670C2 |
| ПРИМЕНЕНИЕ ГИДРОХЛОРИДА (3-ГИДРОКСИ-1-АДАМАНТИЛ)-1-ЭТИЛАМИНА В КАЧЕСТВЕ ИНГИБИТОРА ВИРУСА ГЕРПЕСА ПРОСТОГО ТИПА 1 | 2001 |
|
RU2269338C1 |
| (3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью | 2016 |
|
RU2644351C1 |
| 3-Бутилтио-1-(бета-D-2-дезоксирибофуранозил)-5-фенил-(4Н)-1,2,4-триазол, синтез, противогерпесвирусное действие | 2023 |
|
RU2815137C1 |
| 4-((Z)-4'-ГИДРОКСИБУТЕН-2'-ИЛ)-2-R-6-ФЕНИЛ-1,2,4-ТРИАЗОЛО[5,1-c][1,2,4]ТРИАЗИН-7-ОНЫ | 2008 |
|
RU2376307C1 |
| 4,6-ДИ(3,12-ДИАЗА-6,9-ДИАЗОНИАДИСПИРО[5.2.5.2]ГЕКСАДЕКАН-1-ИЛ)-2-МЕТИЛ-5-НИТРОПИРИМИДИН ТЕТРАХЛОРИД ДИГИДРОХЛОРИД ГЕКСАГИДРАТ ДЛЯ ЛЕЧЕНИЯ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2573977C9 |
| ФОСФОНАТНЫЕ ПРОИЗВОДНЫЕ АЦИКЛОВИРА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2239638C2 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ГЕРМАНИЯ С ПРОИЗВОДНЫМИ АЗОТИСТЫХ ОСНОВАНИЙ ПУРИНОВОГО РЯДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2012 |
|
RU2487878C1 |
Изобретение относится к новому соединению - димерному производному нетропсина-15-Лиз-бис-нетропсину: 4-[4-[4-[4-[α,ω-бис[α,ω-бис(α,ω)-дилизиллизил)лизил]лизил]глицилглицил]амино-1-пропилпиррол-2-карбоксамидо]-1-пропилпиррол-2-карбонил]глицилглицилглициламино]-1-пропилпиррол-2-карбоксамидо]-2-(3-диметиламинопропиламинокарбонил)-1-пропилпиррол трифторацетату, обладающего антивирусной активностью, а также его комбинаций с модифицированными нуклеозидами или фосфоноуксусной/фосфономуравьиной кислотой. Представленные комбинации позволяют обеспечить избирательность противогерпетического действия, а также значительно усилить противогерпетическое действие по сравнению с каждым из отдельно взятых комбинируемых противовирусных соединений. 2 н. и 1 з.п. ф-лы, 3 табл.
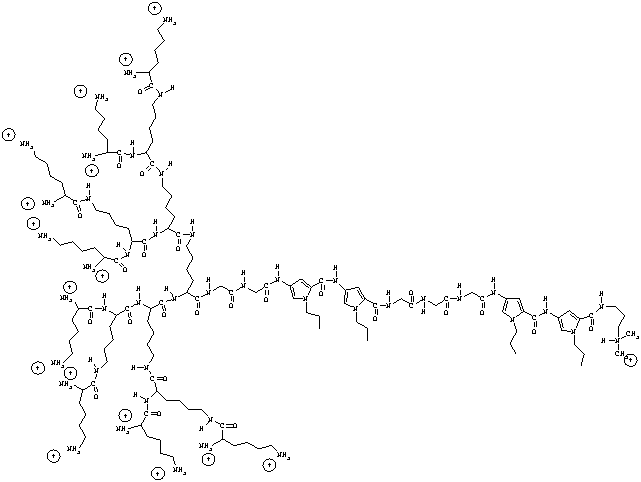

и ацикловира (9-(2-гидроксиэтоксиметил)-гуанин, ациклогуанозин, зовиракс), или ганцикловира (9-[(1,3-дигидрокси-2-пропокси)-метил]-гуанин), или Е-5-(2-бромвинил)-2-дезоксиуридин (бривудин), или видарабина (Ара-А, 9-β-D-аденинарабинозид), или фосфоноуксусной кислоты, или фосфономуравьиной кислоты (фоскавир).
| US 6683189 B1, 27.01.2004 | |||
| С.Л | |||
| Гроховский , Б.П | |||
| Готтих, А.Л | |||
| Жузе, «Лиганды, обладающие сродством к определенным последовательностям пар оснований ДНК IX* | |||
| Синтез аналогов нетропсина и дистамицина А, содержащих остаток сарколизина или атом платины (II)» | |||
| Биоорганическая химия, 1992 г., т.18, №4, стр | |||
| Секретный замок | 1923 |
|
SU570A1 |
Авторы
Даты
2005-12-10—Публикация
2004-04-20—Подача