Изобретение относится к биотехнологии, а именно к генетической инженерии, и может быть использовано в ветеринарной вирусологии для выявления инфекционных заболеваний сельскохозяйственных животных, в частности инфекционного ринотрахеита крупного рогатого скота (ИРТ КРС) и оценки эффективности противоэпизоотических мероприятий, основанных на использовании аттенуированных вакцин на основе штамма ТК-А.
Известен способ выявления ДНК вируса при помощи метода молекулярной гибридизации, включающий клонирование Hind111 фрагмента ДНК вируса ИРТ КРС в вектор, в который затем вводится биотин. При этом в качестве вектора используют однонитиевую ДНК фага М13mp8, а в качестве метки используют биотин, который вводится в вектор путем химической модификации ДНК по цитозиновым звеньям. Чувствительность выявления ДНК вируса ИРТ КРС при этом составляет 104-5ТЦД50/мл (См. патент РФ № 2054487, кл. C 12 Q 1/68, от 1996 г.).
К недостаткам данного способа можно отнести длительную процедуру клонирования фрагмента ДНК вируса в векторную ДНК и мечения биотином, недостаточную чувствительность выявления ДНК вируса, равную 104-5 ТЦД50/мл, а также невозможность определения различий между штаммами вируса и проведения дифференциации между вакцинным штаммом и полевыми штаммами и изолятами вируса.
Наиболее близким решением, принятым за прототип, является следующий способ выявления ДНК вируса ИРТ КРС, а также родственных герпесвирусов жвачных, основанный на полимеразной цепной реакции (ПЦР), включающий выделение ДНК вируса из вируссодержащей суспензии, синтез олигонуклеотидных праймеров на ген гликопротеина В (gB), амплификацию ДНК вируса в гнездовой ПЦР, специфическую идентификацию ДНК вирусов с помощью электрофореза, которую проводят при помощи обработки продуктов ПЦР рестриктазами Fnu4H1 и Sau961. Полученные продукты разделяют путем электрофореза в 3% геле агарозы. Праймеры для первого раунда амплификации:
5'-TCGAARGCCGAGTACCTGCG-3';
5'-CCAGTCCCAGGCRACCGTCAC-3'; положение 56494.
Праймеры для второго раунда:
5'-TGGTGGCCTTYGACCGCGAC-3';
5'-GCTCCGGCGAGTAGCTGGTGTG-3'; положение 56378.
Выбор позиций основывается на анализе полного генома BHV-1 (генБанк) (С.Ros and S.Belak. Studies of Genetic Relationship between Bovine, Caprine, Cervine, and Rangiferine Alphaherpesviruses and Improved Molecular Methods for Virus Detection and Identification // Journal of Clinical Microbiology. - 1999, vol.37. № 5. - Р. - 51247-1253).
К недостаткам данного способа можно отнести то, что он проводится методом гнездовой ПЦР, требующей синтез двух пар праймеров (внутренних и наружных) и соответственно проведения реакции в два раунда. Кроме того, данный способ разработан только для выявления и дифференциации ДНК серологически родственных герпесвирусов: крупного рогатого скота (ИРТ КРС, герпес-вирус 2 и 4 типов), коз и оленей, и не позволяет проводить дифференциацию штаммов и изолятов внутри вида (ИРТ КРС), в частности отличать вакцинный штамм от эпизоотических штаммов и изолятов вируса ИРТ КРС.
Технической задачей изобретения является разработка нового эффективного метода выявления вируса инфекционного ринотрахеита крупного рогатого скота (ИРТ КРС) с последующей дифференциацией вакцинного штамма ТК-А от эпизоотических штаммов и изолятов вируса при помощи ПЦР-ПДРФ-анализа (анализ полиморфизма длин рестрикционных фрагментов, ПДРФ-анализ).
Техническим результатом изобретения является повышение степени специфичности и чувствительности выявления ДНК вируса за счет проведения ПЦР, а также возможность проведения дифференциации вакцинного штамма от эпизоотических штаммов и изолятов вируса в ПДРФ анализе при помощи рестрикции продуктов диагностической ПЦР. При анализе продуктов диагностической ПЦР эндонуклеазой рестрикции Sac II в 2% геле агарозы штаммы и изоляты вируса образуют разное количество полос: ДНК вакцинного штамма ТК-А образует одну полосу размером 464 п.н., ДНК эпизоотических штаммов и изолятов - две размером 343 и 121 н.п.
Сущность изобретения заключается в том, что выявление вируса ИРТ КРС проводят методом полимеразной цепной реакции (ПЦР) с последующей дифференциацией вакцинного штамма ТК-А от эпизоотических штаммов и изолятов при помощи ПЦР-ПДРФ-анализа, включающий амплификацию ДНК вируса инфекционного ринотрахеита, на синтетических олигонуклеотидных праймерах, комплементарных району гена гликопротеина В (gB) вируса инфекционного ринотрахеита крупного рогатого скота, перенос продукта амплификации на гель агарозы и оценку проведения реакции, согласно изобретению праймеры имеют нуклеотидные последовательности:
В1 - 5'-ACGTGCTGCTCAACGTGTAC-3'
B2 - 5'-AGGACGAGCTCGCGGATATA-3'.
Сущность заключается также в том, что оценку проведения диагностической реакции осуществляют по размеру продукта ПЦР, при этом результат реакции считается положительным, если продукт ПЦР соответствует размеру фрагмента в 464 пар оснований
Сущность заключается также в том, что для определения различий между вакцинным и эпизоотическими штаммами и изолятами вируса проводят рестрикционный анализ продуктов диагностической ПЦР с использованием эндонуклеазы рестрикции Sac II.
Изобретение иллюстрируется следующими примерами.
На чертеже изображен ПДРФ-анализ ампликонов вакцинного штамма ТК-А и эпизоотических штаммов и изолятов вируса ИРТ КРС при помощи эндонуклеазы рестрикции Sac II.
1 - Маркер молекулярного веса; 2 - вакцинный штамм ТК-А; 3 - изолят ПВМ; 4 - эпизоотический штамм ТК; 5 - изолят П; 6 - изолят ЛК; 7 - эпизоотический штамм Оренбург; 8 - эпизоотический штамм 4016.
Пример 1. Амплификация участка ДНК вируса ИРТ КРС, кодирующего гликопротеин В.
Полимеразная цепная реакция. Инкубационная смесь конечным объемом 25 мкл содержит: буфер - 60 mM Tris-HCl pH 8.5, 1,5 mM MgCl2, 25 mM KCl, 10 mM 2-меркаптоэтанол, 0,1% Тритон Х-100, 2 mM dNTP mix - смесь дезоксинуклеозидтрифосфатов, 2 mM праймеров (прямой и обратный), 5 ед. термостабильной Taq ДНК-полимеразы (1u/μ1), 0,03γ ДНК-матрицы (5 мкл).
Температурный режим проведения ПЦР: денатурация при 95°С в течении 5 мин - 1 цикл, далее проводят 30 циклов при следующих температурных режимах: 95°С - 1 мин, 54°С - 1 мин, 72°С - 1,5 мин, завершающий синтез при 72°С в течение 5 мин.
Пример 2. Определение размера продуктов диагностической ПЦР.
Продукты диагностической ПЦР анализируют методом электрофореза в 1-2%-ном агарозном геле в стандартном трис-ацетатном или трис-боратном буфере (рН 8,0).
10 мкл продукта ПЦР смешивают с 2 мкл буфера для нанесения образца и вносят в лунку агарозного геля. Электрофорез проводят при напряжении 10 В/см длины геля до тех пор, пока краситель не пройдет от старта не менее половины геля (примерно 40-60 минут). Результаты электрофореза учитывают, просматривая гель в ультрафиолетовом свете с длиной волны 254 нм на приборе «Трансиллюминатор».
Маркер молекулярного веса состоит из продуктов расщепления ДНК плазмиды pUC 19 эндонуклеазой рестрикции Msp1. Результат ПЦР считают положительным, если продукт ПЦР соответствует размеру фрагмента в 464 нуклеотидные пары.
Чувствительность ПЦР в таких условиях составляет 102 ТЦД50/мл.
Пример 3. Определение специфичности ПЦР на основе синтетических праймеров, синтезированных на ген гликопротеина В.
Результаты опытов по определению специфичности реакции представлены в табл.1.
Пример 4. Выявление ДНК Российских референтных штаммов и изолятов вируса ИРТ КРС, типированных в реакции нейтрализации в культуре клеток.
К 250 мкл осветленной суспензии вируса добавляют 30 мкл 10-кратного ТЕ, 15 мкл протеиназы К (конц. 2 мг/мл), 30 мкл 10%-ного SDS. Инкубируют в суховоздушном микротермостате при 50-56°С в течение 1-2 часов. Затем добавляют равный объем (300 мкл) фенола, перемешивают и осаждают центрифугированием при 9000 об/мин в течение 10 мин. Отбирают супернатант в чистую пробирку, приливают по 0,5 объема фенола и хлороформа, повторяют центрифугирование. Отобранный супернатант смешивают с равным объемом хлороформа, центрифугируют при 9000 об/мин в течение 5 мин. К отобранному супернатанту добавляют 2,5 объема 96%-ного охлажденного этанола и 0,1 объема 3М ацетата натрия и выдерживают при -20°С в течение 2-12 часов. После этого содержимое пробирки центрифугируют при 12000 об/мин в течение 10 мин, сливают супернатант, а осадок промывают 2 раза 70%-ным этанолом и высушивают. Затем к осадку добавляют 30 мкл деионизованной воды или ТЕ-буфера и ресуспендируют. ПЦР проводят согласно примеру 1, в качестве матрицы используют 5 мкл полученной пробы.
Результаты тестирования штаммов и изолятов вируса представлены в табл.2.

Результаты показали, что ПЦР выявляет ДНК всех исследованных штаммов и изолятов вируса, выделенных в культуре клеток от больных и инфицированных животных и типированных в реакции нейтрализации. Результаты были сходными во всех повторностях.
Пример 5. Проведение дифференциации между вакцинным штаммом ТК-А и эпизоотическими штаммами вируса.
Продукты амплификации штаммов вируса ИРТ КРС подвергают гидролизу эндонуклеазой рестрикции Sac II с целью определения различий между ними.
Для этого к 5 мкл амплифицированного фрагмента ДНК каждого штамма вируса добавляют 10 единиц активности эндонуклеазы рестрикции и инкубируют при 37°С в течение 2 ч.
Состав реакционной смеси: буферный раствор, прилагаемый к рестриктазе, 10 единиц активности фермента, 1-2 γ амплифицированной ДНК вируса.
Визуализацию проводят при помощи электрофореза в 2%-ном геле агарозы при силе тока 35 мА.
В результате ДНК вакцинного штамма ТК-А после обработки ферментом образует одну полосу размером 464 п.н., а ДНК эпизоотических штаммов Оренбург, 4016, ТК и М40 - две полосы размером 343 и 121 п.н.
Пример 6. Проведение дифференциации между вакцинным штаммом ТК-А и эпизоотическими изолятами вируса, выделенными от больных животных при вспышках ИРТ КРС.
Из проб носовых и вагинальных выделений, спермы, кусочков внутренних органов больных животных готовят 10%-ные суспензии. Суспензии центрифугируют при 3000 об/мин в течение 15 мин, затем проводят процедуру выделения в чувствительной культуре клеток и типируют при помощи моноспецифической сыворотки к вирусу ИРТ КРС. При положительных результатах типирования изолята в реакции нейтрализации в культуре клеток проводят выделение ДНК полученного изолята согласно примеру 4, затем проводят амплификацию в диагностической ПЦР согласно примерам 1 и 2. При наличии амплифицированного фрагмента размером 464 п.н. проводят его гидролиз эндонуклеазой рестрикции Sac II согласно примеру 5.
В случае получения в геле агарозы одной полосы размером 464 п.н. выделенный изолят относят к вакцинному, а в случае получения 2-х полос размером 343 и 121 п.н. его относят к эпизоотическому.
Результаты типирования изолятов, выделенных от больных животных, представлены в табл.3.
Таким образом, изобретение обеспечивает возможность более эффективного выявления ДНК вируса ИРТ КРС, а также дифференциации вакцинного штамма от эпизоотических штаммов и изолятов вируса.
Повышается экономическая эффективность противоэпизоотических мероприятий за счет сокращения сроков исследования и расходных материалов.
Изобретение относится к области биотехнологии и генетической инженерии. Предложен способ выявления вируса ИРТ КРС в полимеразной цепной реакции. Способ предусматривает проведение полимеразной цепной реакции с праймерами В1 и В2, с последующей дифференциацией выявленной ДНК в случае положительного результата реакции ПЦР. Результат считается положительным, если продукт ПЦР соответствует размеру фрагмента в 464 пар оснований. Для дифференциации продукт ПЦР обрабатывают эндонуклеазой Sac II. В результате чего наличие одного фрагмента длиной 464 пар оснований соответствует вакцинному штамму ТК-А, а двух фрагментов размером 343 и 121 пар оснований соответствует эпизоотическим штаммам и изолятам. 1 ил., 3 табл.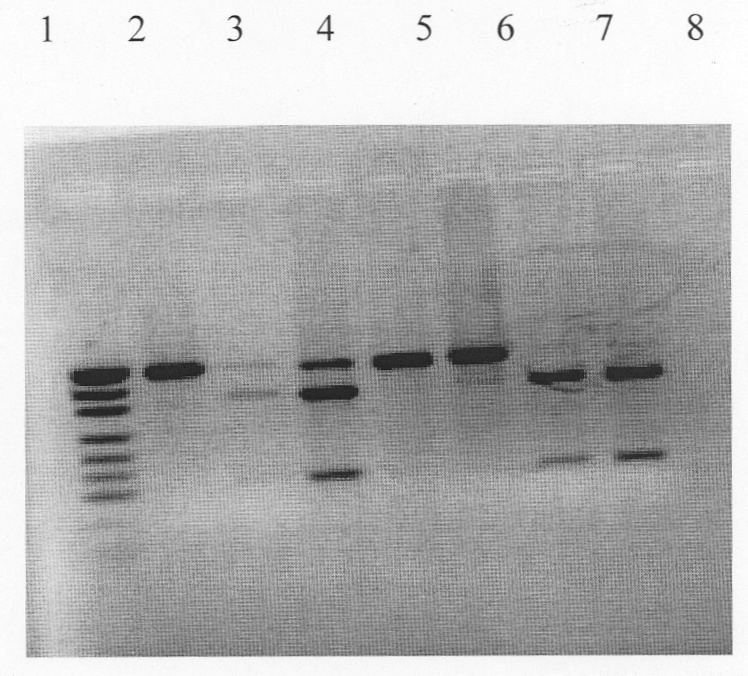
Способ выявления вируса инфекционного ринотрахеита крупного рогатого скота методом полимеразной цепной реакции (ПЦР) с последующей дифференциацией вакцинного штамма ТК-А от эпизоотических штаммов и изолятов при помощи ПЦР-ПДРФ-анализа, включающий амплификацию ДНК вируса инфекционного ринотрахеита на синтетических олигонуклеотидных праймерах, комплементарных району гена гликопротеина В (gB) вируса инфекционного ринотрахеита крупного рогатого скота, перенос продукта амплификации на гель агарозы и оценку проведения реакции, отличающийся тем, что праймеры имеют нуклеотидные последовательности
B1 - 5'-ACGTGCTGCTCAACGTGTAC-3'
B2 - 5'-AGGACGAGCTCGCGGATATA-3';
оценку проведения диагностической реакции осуществляют по размеру продукта ПЦР, при этом результат реакции считается положительным, если продукт ПЦР соответствует размеру фрагмента в 464 пар оснований, а для определения различий между вакцинным и эпизоотическими штаммами и изолятами вируса проводят рестрикционный анализ продуктов диагностической ПЦР с использованием эндонуклеазы рестрикции Sac II, при этом наличие одного фрагмента ДНК размером 464 п.н. соответствует вакцинному штамму ТК-А, а двух фрагментов размером 343 и 121 п.н. соответствует эпизоотическим штаммам и изолятам.
| ROS С | |||
| et al., "Studies of genetic relationships between bovine, caprine, cervine, and rangiferine alphaherpesviruses and improved molecular methods for virus detection and identification", J Clin Microbiol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТА | 1991 |
|
RU2054487C1 |
| KIBENGE F.S | |||
| et al., "Amplification of strains of bovine herpesvirus l by use of | |||
Авторы
Даты
2005-12-10—Публикация
2003-12-24—Подача