Изобретение относится к медицине, касается лабораторной диагностики одного из глубоких микозов - кокцидиоидомикоза.
В микологической практике при определении видовой принадлежности грибов используют различные подходы. В основе отдельных концепций лежат фактически различные методы, используемые для достижения цели. Наиболее распространенной является морфологическая (фенетическая или фенотипическая) концепция. Это классический прием, используемый для определения единицы вида на основе морфологических характеристик оптимально путем различий между ними. В отличие от бактериальных классификаций, которые используют питательные и биохимические различия, практические микологи чаще всего изучают макро- и микроморфологию. Возбудитель кокцидиоидомикоза Coccidioides immitis - диморфный гриб, который хорошо растет на обычных средах, через неделю после инкубации при 25°С образует сероватые плесневые колонии; гифы формируют толстостенные артроспоры, содержащие бочкообразные артроконидии (4-6 мкм длиной). Образование артроконидий свойственно не только С. immitis, но и некоторым дрожжеподобным грибам и дерматофитам. Мицелиальная фаза считается сапрофитной или природной формой. При попадании артроконидий в макроорганизм гриб переходит в тканевую фазу. Она представлена сферулами - округлыми образованиями от 10 до 200 мкм в диаметре, заполненными эндоспорами (от единичных до нескольких сотен). Эндоспоры имеют овальную или неправильную форму. Двойная стенка сферул достигает 2 мкм в поперечнике. Основной компонент клеточной стенки - хитин, являющийся полимером аминопроизводного L-глюкозы.
Таким образом, окончательным подтверждением диагноза кокцидиоидомикоза служит выявление артроконидий, трансформирующихся в сферулы в питательных средах или в тканях зараженных лабораторных животных. Следует учитывать, что незрелые сферулы, то есть недифференцированные образования, не могут приниматься во внимание в связи с отсутствием типичных признаков.
Культивирование грибов в тканевой (паразитарной) фазе на питательных средах достаточно сложно. Эта проблема сопряжена прежде всего с условиями выращивания грибов, в том числе с элективными факторами используемой среды. Кроме того, для получения сферул iv vitro требуются высокопитательные дорогостоящие среды и многократные пересевы в атмосфере углекислого газа. В частности, для получения сферул in vitro предложен способ культивирования на среде RPMI 1640, содержащей 10% инактивированной сыворотки, 2,835 mg Na2PO4·7Н2O на литр, 0,8 mg N-Tamol, 40 ед. пенициллина и 40 mg стрептомицина на миллилитр, в атмосфере 5% СО2 при 37°С. Через 48 ч после первичного посева грибная взвесь фильтруется и вновь засевается в свежую порцию питательной среды того же состава. Созревание сферул и вытеснение гифальных элементов обеспечивается после семи пассажей (Alan F. Petkus, Linda L. Baum, Robert B. Ellis, Malvin Stem and David L. Danley «Pure Spherules of Coccidioides immitis in continuous culture», Journal of Clinical Microbaiology, Aug., 1985, p.165-167).
Наиболее близким аналогом является способ получения сферул in vivo, который заключается в том, что белых мышей заражают интраназально 50 LD50 Coccidioides immitis 36-S. Павших мышей вскрывают, забирают легкие и замораживают. Ткань легких измельчают на гомогенизаторе, заливают физиологическим раствором и оставляют в цилиндре емкостью 0,5 л в течение 10 мин. Осадок отбирают и вновь подвергают гомогенизации, растворению и отстаиванию. Данную процедуру повторяют 10-15 раз. (С.М.Лихолетов, Н.И.Нарбутович, А.В.Липницкий, Е.И.Прокофьева «Иммунологическая характеристика антигенов паразитарной фазы Coccidioides immitis». - Журнал гигиены, эпидемиологии, микробиологии и иммунологии 23, №4, с.380-385, 1979 г.). Однако оба представленные способы являются продолжительными во времени, трудоемкими и регламентируют использование 3-4-х месячных культур для исследования. Кроме того, в последнем способе применение гомогенизатора на этапе многократной процедуры измельчения образцов не исключает возможности механического разрушения сферул.
Целью предлагаемого изобретения является разработка простого и эффективного способа обнаружения возбудителя кокцидиоидомикоза.
Поставленная цель достигается тем, что находящуюся в мицелиальной форме культуру С.immitis (возраст культуры 2 недели) смывают с агаровой поверхности физиологическим раствором и готовят взвесь, соответствующую 5 ЕД по отраслевому стандартному образцу (ОСО) мутности ГИСК им. Тарасевича. Полученной взвесью по 0,5 мл внутрибрюшинно заражают белых мышей. Через 7 суток с момента заражения мышей умерщвляют с помощью хлороформа, вскрывают без соблюдения правил асептики и целиком извлекают печень, которую заливают раствором КОН и прогревают на водяной бане. Полученные суспензии обеззараживают формалином, разделяют при помощи центрифугирования, удаляют супернатант, а из осадка готовят нативные мазки, которые затем исследуют методом световой микроскопии. Выявляемая при данном способе специфическая структура сферул надежно позволяет установить диморфизм изучаемого гриба и идентифицировать его как Coccidioides immitis.
Пример 1 (оптимальный):
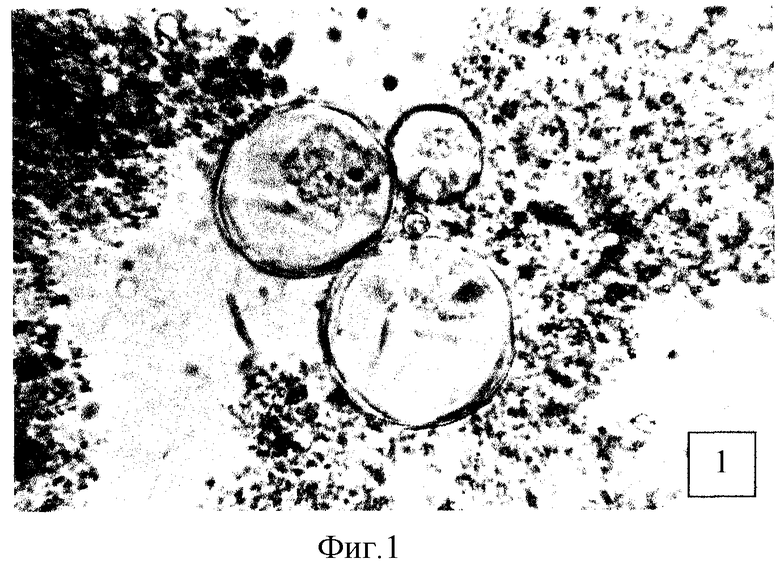
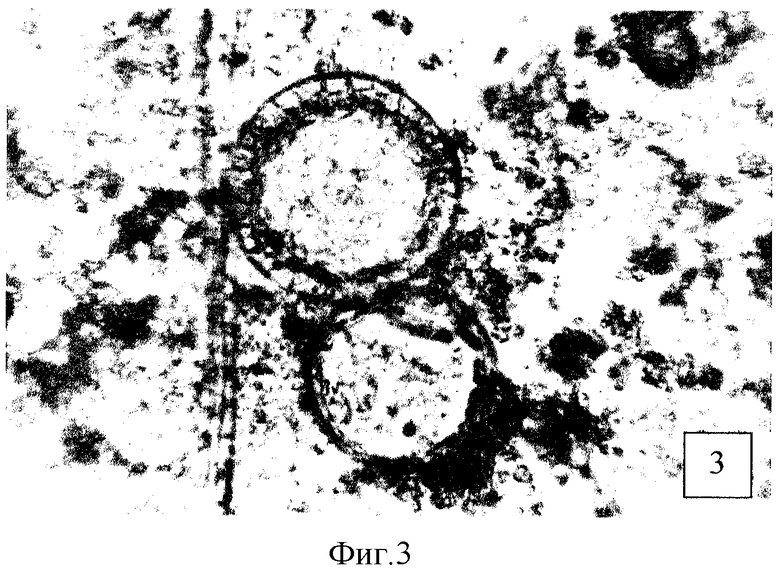
Штамм С. immitis C-5 засевают на поверхность агаровой среды Сабуро и выращивают в течение 2-х недель при 28°С. Выросшую мицелиальную культуру смывают 0,15 М раствором хлорида натрия, рН 6,8 и готовят клеточную суспензию из расчета 5 ЕД по отраслевому стандарту мутности. Полученной суспензией в объеме 0,5 мл заражают трех белых мышей. Через 7 суток мышей умерщвляют с помощью хлороформа, вскрывают без соблюдения правил асептики и в качестве исследуемого образца забирают печень. Объединенные органы (печень от трех животных) заливают 10 мл 10%-ного раствора КОН и прогревают на кипящей водяной бане в течение 15 мин. После полного растворения биопробного материала добавляют 2 мл цельного формалина и суспензию выдерживают 24 часа при комнатной температуре. Затем отбирают 1,5 мл обеззараженной суспензии, которую центрифугируют при 5000 об/мин в течение 15 минут (ротор РУ 180Л). Супернатант удаляют, а из 0,05 мл осадка готовят мазки, которые микроскопируют без окрашивания при увеличении ×100, ×400. В результате в подавляющем числе полей зрения наблюдаются сферулы - специфические двухконтурные образования от 50 до 200 мкм в диаметре с различной степенью дифференцированности внутренней структуры (фиг.1-3). Сравнительные данные по эффективности визуализации сферул при использовании известного метода механической гомогенизации (Лихолетов с соавт., 1979) и щелочного гидролиза биологических проб (предлагаемый способ) приведены в таблице.
Пример 2: Исследование органов раньше или, наоборот, позже, чем через 7 суток с момента заражения биопробных животных, приводит к резкому сокращению или полному отсутствию выявляемых при световой микроскопии сферул (таблица).
Пример 3: Использование при заражении белых мышей 4-х месячной культуры кокцидиоидного гриба, состоящей практически из артроспор без мицелиальных элементов, не позволяет обнаруживать сферулы при данном способе заражения независимо от продолжительности жизни лабораторных животных.
Эффективность обнаружения паразитарной фазы Coccidioides immitis (C-5) в неокрашенных мазках при световой микроскопии
Таким образом, предложенный способ обнаружения и идентификации возбудителя кокцидиоидомикоза отличается простотой, эффективностью, надежностью, не требует больших временных затрат, обеспечивает диагностику характерных для тканевой (паразитарной) фазы морфологических форм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ МИКРОСКОПИЧЕСКИХ ГРИБОВ РОДА Coccidioides poasadasii 36 S И Coccidioides immitis C-5 | 2012 |
|
RU2503715C2 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ ДНК ВОЗБУДИТЕЛЕЙ КОКЦИДИОИДОМИКОЗА COCCIDIOIDES IMMITIS И COCCIDIOIDES POSADASII | 2015 |
|
RU2583001C1 |
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ ДЛЯ ИДЕНТИФИКАЦИИ Coccidioides posadasii | 2007 |
|
RU2346045C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЖИВЫХ ПРЕПАРАТОВ МИКРОСКОПИЧЕСКИХ ГРИБОВ РОДА COCCIDIOIDES ДЛЯ СВЕТОВОЙ МИКРОСКОПИИ | 2012 |
|
RU2496863C1 |
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ ДЛЯ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ КОКЦИДИОИДОМИКОЗА Coccidioides immitis И Coccidioides posadasii | 2007 |
|
RU2346046C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК COCCIDIOIDES IMMITIS ДЛЯ ПРОВЕДЕНИЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2295569C1 |
| Способ трихоскопии с использованием искусственных нейронных сетей для диагностики поврежденных спорами дерматофитов волос у кошек | 2022 |
|
RU2796767C1 |
| ФЛУОРЕСЦЕНТНО-МЕЧЕНЫЙ ОЛИГОНУКЛЕОТИДНЫЙ ЗОНД PR-SOW ДЛЯ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЯ КОКЦИДИОИДОМИКОЗА Coccidioides posadasii | 2013 |
|
RU2539108C1 |
| МАЗЬ ДЛЯ ЛЕЧЕНИЯ КОЖНОГО ПЕЦИЛОМИКОЗА | 2011 |
|
RU2475245C1 |
| СПОСОБ ПОСТАНОВКИ БИОПРОБЫ ПРИ ДИАГНОСТИКЕ ЧУМЫ | 2001 |
|
RU2218410C2 |

Изобретение относится к области медицины, касается лабораторной диагностики одного из глубоких микозов - кокцидиоидомикоза. В способе из мицелиальной культуры C.immitis определенного возраста готовят взвесь и этой взвесью заражают белых мышей. Через 7 суток мышей умерщвляют и извлекают печень, которую заливают раствором КОН, прогревают и полученную обеззараженную суспензию центрифугируют при 5000 об/мин в течение 15 мин. Супернатант удаляют, а из осадка готовят мазки для световой микроскопии без окрашивания. Способ обеспечивает простоту, экономичность и эффективность при обнаружении тканевой (паразитарной) фазы гриба - возбудителя кокцидиоидомикоза. 1 табл., 3 ил.
Способ обнаружения возбудителя кокцидиоидомикоза, включающий заражение белых мышей клетками культуры Coccidioides immitis, выделение тканевых сферул и их идентификацию, отличающийся тем, что для получения тканевых сферул предварительно выращивают культуру С. immitis в мицелиальной фазе в течение 2 недель, из этой культуры готовят взвесь, соответствующую 5ЕД стандартного образца мутности и затем взвесью в объеме 0,5 мл заражают белых мышей, а на 7 сутки от начала заражения мышей умерщвляют, извлекают печень у трех животных и добавляют 10 мл 10%-ный раствора КОН, прогревают на кипящей водяной бане 15 мин, после растворения биопробного материала обеззараживают формалином, затем обеззараженную суспензию в объеме 1,5 мл центрифугируют при 5000 об/мин в течение 15 мин, супернатант удаляют, а из осадка готовят мазки для световой микроскопии без окрашивания, проводят микроскопирование, и при обнаружении сферул в виде округлых двухконтурных образований заполненных эндоспорами, судят о наличии возбудителя кокцидиоидомикоза.
Авторы
Даты
2005-12-10—Публикация
2004-05-26—Подача