Изобретение касается трансгенных животных. Более конкретно, настоящее изобретение касается животного, трансгенного по пресенилину, содержащего внесенный мутантный ген пресенилина, обусловливающий болезнь Альцгеймера у человека.
Предпосылки изобретения
Симптомом болезни Альцгеймера является прогрессирующее слабоумие. Ее патогистология характеризуется возникновением огромного количества сенильных бляшек в головном мозге и нарастающей дегенерацией нейрофибрилл в нейронах. Данное заболевание является нейродегенеративным, при котором нейроны постепенно гибнут. Как правило, болезнь Альцгеймера развивается в пожилом возрасте, а ее встречаемость растет со старением. В настоящее время надежное лечение болезни Альцгеймера невозможно. Следовательно, с точки зрения подготовки к резкому возрастанию пожилого населения в будущем желательной является как можно скорейшая разработка способов терапевтического и профилактического лечения болезни Альцгеймера и разработка эффективного лекарственного средства, предназначенных для профилактического и терапевтического лечения данного заболевания.
Сенильная бляшка является отложением вещества вне нейронов, состоящим из различных компонентов, а их основным компонентом является пептид, состоящий из 39-42 аминокислотных остатков, называемый β-амилоидным белком (Аβ). Амилоидный белок-предшественник (АРР) расщепляется с участием протеаз, которые предположительно называют β-секретазой и γ-секретазой, в результате чего образуется зрелый β-амилоидный белок. В сенильной бляшке β-амилоид откладывается в виде регидного образования, обладающего β-складчатой структурой. Такая сенильная бляшка вначале образуется в виде пятноподобного отложения, называемого диффузной сенильной бляшкой. На этом этапе нейродегенеративные процессы еще не происходят. Считается, что по мере того, как диффузная сенильная бляшка превращается в более жесткое отложение, происходит и дегенерация или гибель нейронов, в результате чего проявляются такие симптомы болезни Альцгеймера, как деменция. Существуют Аβ40, состоящий из 40 аминокислотных остатков, и Аβ42, состоящий из 42 аминокислотных остатков, такой как амилоид β. Большая часть амилоида-β, вырабатываемого клетками, представлена изоформой Аβ40, и при этом присутствует лишь небольшое количество Аβ42. Однако Аβ42 характеризуется свойствами более интенсивной агрегируемости, и, таким образом, Аβ42 играет более выраженную роль в образовании сенильной бляшки по сравнению с Аβ40 (Tamaoka, Naika, Intern. Med., vol. 77, P843, 1996).
При болезни Альцгеймера имеет место семейное развитие по аутосомно-доминантному типу наследования. Ген, который был в 1991 году первым идентифицирован в качестве гена, обусловливающего семейную манифестацию болезни Альцгеймера, - это мутантный ген АРР: этот ген локализован в 21 хромосоме, а в аминокислотной последовательности мутация обусловливала замену валина на изолейцин в 717-м положении (A.Goate et al., 1991, Nature, vol. 349, p.704).
В качестве причины, как причины болезни Альцгеймера, были идентифицированы и другие мутанты АРР такие как обусловливающие замену указанного аминокислотного остатка в положении 717 на фенилаланин (J.Murrell et al., 1991, Science, vol. 254, р.97); обусловливающие замену аминокислотного остатка в том же положении на глицин (Chartier, Harlin et al., 1991, Nature, vol. 353, p.844); обусловливающие замену двух аминокислотных остатков - лизин - метионин на аспарагин-лейцин (M.Mullan et al., 1992, Nature Genet., vol. 1, p.345); и обусловливающие замену аланина на глицин в 692-м положении (L.Hendrisk et al., 1992, Nature Genet., vol. 1, p.218), и подобные.
В 1993 году сообщалось что аполипопротеин-Е (аро Е), является этиологическим фактором или фактором риска развития семейной болезни Альцгеймера. У пациентов с болезнью Альцгеймера аллель ароЕ4, в котором аминокислотный остаток в положении 112 представляет собой аргинин, и аминокислотный остаток в положении 158 представляет собой аргинин, идентифицируется с существенно большей частотой по сравнению со здоровыми лицами среди других аллелей ароЕ, гены которых локализованы в 19 хромосоме (E.H.Corder et al., 1993, Science, vol. 261, p.921).
После этого мутация в гене «пресенилина-1» (PS1, исходно обозначавшегося как S182), картированном в 14 хромосоме (R.Sherrington et al., 1995, vol. 375, р. 754), и мутация в гене «пресенилина-2» (PS2, исходно обозначавшегося как Е5-1 или STM-2), картированном в 1 хромосоме (B.Sherrington et al.. Nature, 1995, vol. 375, р. 754), были в 1995 году идентифицированы как новые гены, вызывающие болезнь Альцгеймера (в данной заявке каждый из этих генов определен как «ген пресенилина-1» и «ген пресенилина-2», соответственно, а каждый из продуктов этих генов обозначается как «белок пресенилин-1» и «белок пресенилин-2», или «PS1» и «PS2», соответственно).
Белок пресенилин-1 и белок пресенилин-2, состоящие, соответственно, из 467 и 448 аминокислотных остатков, включают семи- или восьмискладчатую трансмембранную структуру: следовательно, они предположительно являются мембранными белками. Гомология этих двух белков на уровне аминокислотных последовательностей существенна - 67% общей и 84% только по трансмембранным доменам. Что касается функций пресенилин-1, существует предположение, что функции данного белка схожи с таковыми белка sel-12 нематоды или с белка SPE-4, на что указывает высокая гомология данных белков. Белок SPE-4 участвует в процессах сперматогенеза у нематоды, и предполагается, что он вовлечен в транспортировку и запасание белков.
Соответственно, считается, что пресенилин-1, по-видимому, участвует в процессинге мембранных белков, таких как АРР, аксоплазматическом транспорте и слиянии мембранных пузырьков с мембранами. Для гена sel-12 было установлено, что он устраняет эмбриональную аномалию, вызванную мутацией lin-12, которая подавляет развитие нематоды. Считается, что lin-12 вовлечен в межклеточную передачу сигнала, следовательно, также существует предположение, что белок пресенилин-1 участвует в определенной стадии внутриклеточной передачи сигналов.
В первом же описании белка пресенилин-1 было указано на то, что мутации, обусловливающие проявление семейной болезни Альцгеймера, являются заменами аминокислотных остатков по пяти положениям. После этого сообщения гены, мутантные по различным их участкам, были идентифицированы во многих семьях с диагнозом семейной болезни Альцгеймера, включая OS-2 (замена изолейцина на треонин в 213-м положении) и OS-3 (замена валина на фенилаланин в 96-м положении), причем обе эти мутации описаны авторами настоящего изобретения (K.Kamino et al., 1996, Neurosci. Lett., vol. 208, р.195), а к настоящему времени известно более 40 различных вариантов аминокислотных замен более чем по 30 положениям (Hardy, 1997, TINS, vol. 20, р.154).
В настоящее время 70-80%. случаев семейной болезни Альцгеймера, как считается, обусловливается мутациями в белке пресенилин-1. Сообщалось о мутациях мутации по двум сайтам белка пресенилин-2. Как объяснялось выше, генетический анализ подтвердил, что мутации пресенилин-1 и пресенилин-2 самым непосредственным образом вовлечены в этиологию семейной болезни Альцгеймера.
Механизмы, по которым мутантные белки пресенилин-1 и пресенилин-2 вызывают начало болезни Альцгеймера, в настоящее время интенсивно изучаются. Было сообщено, что белок AJ340 находится на том же уровне, что и уровни белков пресенилин-1 и пресенилин-2, в то время как количество Аβ42 в существенной степени увеличивается по сравнению с нормальными уровнями пресенилин-1 и пресенилин-2 в сыворотке или в культуральной среде культуры фибробластов кожи, взятых у пациента с болезнью Альцгеймера, при наличии указывавшихся выше мутаций (D.Scheuner et al., 1996, Nature Med., vol. 2, p.864), в культуральной среде клеточной линии, трансформированной мутантными вариантами белков пресенилин-1 и пресенилин-2 (W.Xia et al., 1997, J. Biol. Chem., vol. 272, p.7977; D.R.Borchelt et al., 1996, Neuron, vol. 17, p.1005; M. Citron et al., 1997, Nature Med., vol. 3, p.67) и в ткани головного мозга у пациента с диагнозом семейной болезни Альцгеймера, несущего мутантный белок пресенилин-1 (C.A.Lemere et al., 1996, Nature Med., vol. 2, p.1146).
В этих сообщениях было показано, что мутации белков пресенилин-1 и пресенилин-2, которые обусловливают семейную болезнь Альцгеймера, по-видимому, обеспечивают манифестацию болезни Альцгеймера за счет обусловливания повышения количества белка Аβ42, что, как считается, играет существенную роль в образовании сенильных бляшек. Трансгенная мышь, несущая ген, который кодирует мутантный белок пресенилин-1, была ранее создана (К.Duff et al., 1996, Nature, vol. 383, р.710; D.R.Borchelt et al., 1996, Neuron, vol. 17, p.1005; M.Citron et al., 1997, Nature Med., vol, 3, p.67). Было сообщено, что содержание Аβ42 в головном мозге такой трансгенной мыши селективно возрастало. Эти данные несомненно подтвердили вероятность того, что мутации в белках пресенилин-1 и пресенилин-2 обусловливают проявление семейной болезни Альцгеймера вследствие обусловливания увеличения количества Aβ42, который предположительно играет важную роль в образовании сенильных бляшек, тем самым инициируя болезнь Альцгеймера. Однако не было опубликовано данных о гистологических параметрах головного мозга упоминавшихся выше трансгенных мышей: считается, что причиной этого является отсутствие существенных гистологических изменений в головном мозге таких трансгенных мышей.
В целом, трансгенные животные применимы в качестве моделей анализа функций гена-мишени in vivo. Однако технически весьма затруднительно проконтролировать экспрессию перенесенного гена на количественном уровне, оценить тканеспецифичность и специфичность в ходе индивидуального развития. Также существует проблема в том, что два генных продукта присутствуют в смеси в организме трансгенных животных, потому что ген, наследуемый этими животными, сохраняет нормальную экспрессию, а функции переносимого гена не могут быть достоверно проанализированы. Более того, когда переносимый ген подвергается избыточному экспрессированию, то функции, в норме не наследуемые in vivo, могут возникать у трансгенного животного, в результате чего образовавшийся дефект может привести к недостоверности в анализе животных, несущих мутантный ген.
Помимо трансгенных животных нокаут-животные также могут быть использованы в качестве модели для изучения функций гена-мишени. У нокаут-животных ген-мишень, в норме наследуемый данным животным, искусственным путем выводится из строя таким образом, чтобы стать полностью нефункциональным (т.е. «выключается»). Подробный анализ нокаут-животных может помочь установить функции гена-мишени in vivo. Однако конкретные изменения у нокаут-животных, являющихся гомозиготами, иногда не проявляются, поскольку функции других генных продуктов у нокаут-животных могут заменять функции «выключенных» разрушенных генных продуктов. Более того, также существует проблема в том, что гомозиготное животное может иногда оказываться летальным из-за того, что генный продукт существен с точки зрения индивидуального развития и роста данного животного, в результате чего анализ функций гена у животного являющегося жизнеспособной гетерозиготой, практически невозможен.
Описание настоящего изобретения
Объектом настоящего изобретения является получение (с точки зрения создания животной патогенетической модели болезни Альцгеймера) животного, являющегося патогенетической моделью, патологические свойства которой близки к таковым у пациента с болезнью Альцгеймера, вместо трансгенного животного, для которого свойственны указанные выше недостатки. Более конкретно объектом настоящего изобретения является получение генетически мутированного животного, способного экспрессировать мутантный белок пресенилин в их головном мозге, путем переноса мутантного гена пресенилина, который, как считается, является причиной болезни Альцгеймера (мутантный пресенилиновый ген) с использованием процесса гомологичной рекомбинации. Другим объектом настоящего изобретения является представление способа получения указанного генетически мутированного животного, несущего мутантный ген, плазмиды, применимой для упомянутого выше способа получения, и способа оценки субстанции или агента, эффективного с точки зрения профилактики и (или) лечения болезни Альцгеймера с использованием указанного выше генетически мутированного животного.
С целью установления роли пресенилин-1 и выяснения механизма манифестации болезни Альцгеймера в ответ на мутацию гена пресенилина-1 заявители настоящего изобретения создали нокин-мышь, у которой нормально наследуемый ген пресенилина-1 заменен на указанный выше ген пресенилина-1, включающий мутацию OS-2. В результате заявителями было установлено, что мышь, несущая мутантный ген, успешно избегает дефектов, характерных для трансгенной мыши и нокаут-мыши, а также то, что животное применимо для исследований причин и патологии болезни Альцгеймера, обусловливаемой мутацией в гене пресенилина-1. Далее заявители продолжили исследования и пришли к описываемому далее изобретению.
Таким образом настоящее изобретение относится к отличному от человека генетически мутированному животному, несущему мутантный ген пресенилина-1, а более предпочтительно настоящее изобретение относится к генетически мутированному животному, несущему мутантный ген пресенилина-1, который включает ДНК, характеризующуюся последовательностью, кодирующей белок пресенилин-1, в последовательности которого одна аминокислота заменена на другую аминокислоту.
Также настоящее изобретение относится к
отличному от человека генетически мутированному животному, несущему мутантный ген пресенилина-1, который включает последовательность ДНК, характеризующуюся последовательностью, кодирующей мутантный белок пресенилин-1, характеризующийся аминокислотной последовательностью, в составе которой одна или большее число аминокислот по положениям, которые выбирают из группы, включающей следующие аминокислотные положения - 79, 82, 96, 115, 120, 135, 139, 143, 146, 163, 209, 213, 231, 235, 246, 250, 260, 263, 264, 267, 269, 280, 285, 286, 290, 318, 384, 392, 410, 426 и 436, - заменены на другую(ие) аминокислоту(ы) в последовательностях пресенилин-1, предпочтительно являющегося белком пресенилин-1 мыши; и
отличному от человека генетически мутированному животному, несущему мутантный ген пресенилина-1, который включает последовательность ДНК, характеризующуюся последовательностью, кодирующей мутантный белок пресенилин-1, в составе которого имеется одна или несколько мутаций, выбираемых из группы, включающей A79V, V82L, V96F, У115Н, У115С, Е120К, E120D, N135D, M139V, М139Т, M139I, I143F, I143T, M146L, M146V, Н163У, H163R, G209V, I213T, А231Т, A231V, L235P, А246Е, L250S, A260V, C263R, P264L, P267S, R269G, R269H, Е280А, E280G, A285V, L286V, S290C, E318G, G384A, L392V, С410У, А426Р и P436S, в аминокислотной последовательности белка пресенилин-1, более предпочтительно являющегося белком пресенилин-1 мыши (каждая буква алфавита соответствует аминокислоте, обозначаемой однобуквенным символом, а каждый номер соответствует номеру положения аминокислоты, считая от N-конца полипептида пресенилин-1, а применяемое описание указывает на то, что аминокислота дикого типа, отмеченная слева от цифры, заменяется на аминокислоту, обозначенную справа от номера. В данной заявке мутантный белок пресенилин-1 и мутантный белок пресенилин-2 охарактеризованы одинаковым образом).
Далее настоящее изобретение относится к отличному от человека генетически мутированному животному, несущему, мутантный ген пресенилина-1, который включает ДНК, характеризующуюся последовательностью, кодирующей мутантный белок пресенилин-1, в составе которого изолейцин по положению 213 белка пресенилин-1 заменен на отличную от изолейцина аминокислоту, а также отличное от человека генетически мутированное животное, несущее мутантный ген пресенилина-1, включающий ДНК, характеризующуюся последовательностью, кодирующей мутантный белок пресенилин-1, в составе которого изолейцин по 213-му положению в аминокислотной последовательности пресенилин-1 заменен на треонин.
Предпочтительные варианты указанных выше вариантов изобретения относятся к:
указанному выше генетически мутированному животному, несущему мутантный ген пресенилина-1, причем последовательность ДНК, кодирующая участок вокруг 213-й аминокислоты в аминокислотной последовательности пресенилин-1, мутирована с образованием такой последовательности - 5'-TGTGGTCGGGATGATMGCCANCCACTGGAAAGGCCC-3', причем N соответствует любому нуклеотиду кроме Т, М соответствует Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту, находящуюся в 213-м положении, указанное выше генетически мутированное животное, несущее мутантный ген пресенилина-1, причем последовательность ДНК, кодирующая участок вокруг 213-й аминокислоты в аминокислотной последовательности пресенилин-1, мутирована с образованием такой последовательности - 5'-TGTGGTCGGGATGATMGCCANCCACTGGAAAGGCCC-3', причем N соответствует С, М соответствуют Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту, находящуюся в 213-м положении, и
указанному выше генетически мутированному животному, несущему мутантный ген пресенилина-1, причем последовательность ДНК, кодирующая участок вокруг 213-й аминокислоты в аминокислотной последовательности пресенилин-1, мутирована с образованием такой последовательности - 5'-TGTGGTCGGGATGATMGCCXYZCACTGGAAAGGCCC-3', причем XYZ представляет триплет (кодон), кодирующий отличную от изолейцина, аминокислоту, М соответствует Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту, находящуюся в 213-м положении.
В другом своем аспекте настоящее изобретение относится к отличному от человека генетически мутированному животному, несущему мутантный ген пресенелина-2, который включает ДНК, характеризующуюся последовательностью, кодирующей белок, в котором аминокислоты по положениям 141 и (или) 436 заменены иными аминокислотами в составе аминокислотной последовательности белка пресенилин-2. Предпочтительный вариант настоящего изобретения относится к указанному выше отличному от человека генетически мутированному животному, причем мутантный ген пресенелина-2, включает ДНК, характеризующуюся последовательностью, кодирующей мутантный белок пресенилин-2, который включает мутацию N141I и (или) M239V в аминокислотной последовательности белка пресенилин-2.
Предпочтительные варианты настоящего изобретения относятся к указанному выше генетически мутированному животному, несущему мутантный ген причем сверхэкспрессия β-амилоидного белка обусловливается мутантным геном пресенилина-1 и (или) мутантным геном пресенилина-2; указанное выше генетически мутированное животное, несущее мутантный ген которое способно экспрессировать мутантный белок пресенилин, причем экспрессия упомянутого белка индуцирует выработку β-амилоидного белка в количестве, достаточном для развития прогрессирующей нейропатии в периферических отделах коры головного мозга данного животного; указанное выше генетически мутированное животное, несущее мутантный ген причем животное является грызуном, предпочтительно мышью; указанное выше генетически мутированное животное, несущее мутантный ген, причем, указанный выше мутантный ген преселин-1 и (или) указанный выше мутантный ген преселин-2 переносят с применением гомологичной рекомбинации; указанное выше генетически мутированное животное, несущее мутантный ген, причем количество амилоидного белка, экспрессируемого в ткани головного мозга под влиянием указанного выше гена пресенилина-1, достаточно для того, чтобы обусловить снижение ответа в тесте на тренировку памяти по сравнению с нормальным животным с индукцией нейропатии в периферических отделах коры головного мозга и гиппокампа головного мозга данного животного; и указанному выше генетически мутированному животному, несущему ДНК, которая включает мутантный ген пресенилина-1, кодирующий мутантный белок пресенилин-1, в составе которого одна или несколько аминокислот заменены на отличающиеся аминокислоты в составе аминокислотной последовательности белка пресенилин-1, наряду с ДНК, характеризующейся нуклеотидной последовательностью, кодирующей маркерный белок.
В другом своем аспекте настоящее изобретение относится к плазмиде, включающей ДНК характеризующуюся последовательностью мутантного гена пресенилина-1, причем последовательность ДНК, кодирующая участок вокруг 213-го аминокислотного положения пресенилин-1 следующая - 5'-TGTGGTCGGGATGATMGCCANCCACTGGAAAGGCCC-3', причем N соответствует A, G или С, М соответствуют Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту, находящуюся в 213-м положении; и
плазмиде, включающей ДНК, характеризующуюся последовательностью мутантного гена пресенилина-1, который кодирует мутантный белок пресенилин-1, причем, аминокислота в 213-м положении заменена на отличную от изолейцина аминокислоту в аминокислотной последовательности белка пресенилин -1, а последовательность ДНК, кодирующая участок вокруг 213-го аминокислотного положения в составе пресенилин -1 такова - 5'-TGTGGTCGGGATGATMGCCXYZCACTGGAAAGGCCC-3', причем М соответствует Т или С, XYZ представляет триплет (кодон), кодирующий отличную от изолейцина аминокислоту, а подчеркнутые нуклеотиды кодируют аминокислоту, находящуюся в 213-м положении. Кроме того, настоящее изобретение относится к геномной (хромосомной) ДНК, включающей 8-й экзон мутантного гена пресенилина-1, кодирующий мутантный белок пресенилин-1, причем аминокислота в 213-м положении заменена на отличную от изолейцина аминокислоту в составе аминокислотной последовательности белка пресенилин-1.
Далее настоящее изобретение относиться к плазмиде, включающей ДНК, в состав которой Sau2АI-сайт внесен в нуклеотидную последовательность, включающую полную или мутировавшую часть кДНК или геномной ДНК мутантного гена пресенилина-1, кодирующего мутантный белок пресенилин-1, в аминокислотной последовательности которого аминокислота по 213-му положению заменена на отличную от изолейцина аминокислоту. Также изобретение относится к указанной выше плазмиде, причем замена аминокислоты по 213-му положению является заменой изолейцина на треонин, а также плазмиде, включающей ДНК, представленную следующей нуклеотидной последовательностью - 5'-TGTGGTCGGGATGATMGCCACCCACTGGAAAGGCCC-3', - в которой М соответствует Т или С.
В дополнение к указанным выше вариантам настоящее, изобретение относится к гену, кодирующему мышиный мутантный белок пресенилин-1, причем изолейцин в 213-м положении заменен на отличную от изолейцина аминокислоту в аминокислотной последовательности пресенилин-1 мыши, а также указанный выше ген, причем такой заменой является замена изолейцина на треонин. Также относится к плазмиде, включающей: (1) ген, кодирующий мышиный мутантный белок пресенилин-1 в котором изолейцин по 213-му положению заменен на отличную от изолейцина аминокислоту в аминокислотной последовательности пресенелин-1 мыши и (2) неомициновую экспрессионную кассету, фланкированную последовательностями loxPs; а также указанную выше плазмиду, причем заменой является замена изолейцина на треонин (loxPs представляются открытой японской патентной публикацией N4-501501, стр.4).
В соответствии с другим аспектом настоящее изобретение относится к эмбриону, несущему плазмиду, включающую ДНК, представленную нуклеотидной последовательностью 5'- TGTGGTCGGGATGATMGCCACCCACTGGAAAGGCCC-3', в которой М соответствует Т или С; эмбрион, полученный путем гомологичной рекомбинации с использованием каждой из упоминавшихся выше плазмид; и указанный выше эмбрион, представляющий вид грызунов, предпочтительно эмбрион мыши. Также настоящее изобретение относится к первичной клеточной культуре или пересеваемой клетке, полученным путем выделения клетки от указанного генетически мутированного животного, несущего мутантный ген, и культивированию клетки по типу тканевой культуры; способу получения отличного от человека генетически мутированного животного, несущего мутантный ген, причем такой способ включает этап внесения мутантного гена пресенилина-1 с помощью гомологичной рекомбинации в эмбрион животного, причем мутантный ген пресенилина-1 способен экспрессировать мутантный белок пресенилин-1, индуцируя тем самым выработку β-амилоидного белка в количестве, достаточном для развития прогрессирующей нейропатии в периферических отделах коры головного мозга; и указанный выше метод получения, причем мутантный белок пресенилин-1, который может быть экспрессирован, включает замену изолейцина в 213-м положении на отличную от изолейцина аминокислоту.
Кроме того, настоящее изобретение относится к способу оценки средства, применяемого для лечения и (или) профилактики болезни Альцгеймера, который включает этап обработки указанного генетически мутированного животного, несущего мутантный ген, которому вводят тест-средство с целью сравнения с генетически мутированным животным, несущим мутантный ген, которому такое тест-соединение не вводили. Типичным примером способа оценки является тест-скрининг. Предпочтительные варианты настоящего изобретения относятся к указанному выше способу оценки, в котором для сравнения используется тест на тренировку памяти, указанному выше способу оценки, причем сравнение осуществляется в патогенетическом тесте; указанному выше способу оценки, в котором для сравнения применяется патогенетический тест, основанный на параметрах невропатологии периферических отделов коры головного мозга; указанному выше способу оценки, причем для сравнения используется невропатологический тест при сравнении с одним или несколькими такими тестами, выбираемыми из группы, которая включает подавление снижения интенсивности глиоза (разрастания астроглии) в периферических отделах коры головного мозга, подавление снижения поглощения 2-дезоксиглюкозы в периферических отделах коры головного мозга и подавление снижения доступности 2-дезоксиглюкозы в периферических отделах коры головного мозга; а также указанному выше способу оценки, в котором сравнение осуществляется по ряду параметров, выбираемых из группы, которая включает продолжительность выживания, параметры поискового и двигательного поведения.
Еще, кроме того, настоящее изобретение относится к способу оценки лекарственного средства, предназначенного для лечения болезни Альцгеймера, который включает этап культивирования первичной клеточной культуры или пересеваемой клетки in vitro в присутствии тестируемого соединения; способу диагностики болезни Альцгеймера или риска развития болезни Альцгеймера, который включает использование частичной нуклеотидной последовательности мутантного гена пресенилина-1, кодирующего мутантный пресенилин-1, вариант OS-2; субстанцию, применяемую для лечения и (или) профилактики болезни Альцгеймера, выбираемую с применением любого из указанных выше способов; и лекарственное средство, предназначенное для лечения и (или) профилактики болезни Альцгеймера, включающее указанную выше субстанцию в качестве активного компонента.
Также настоящее изобретение относится к генетически мутированному животному, несущему мутантный ген пресенилина-1, причем это животное является гибридным животным или его потомством, получаемыми в результате скрещивания указанного выше генетически мутированного животного, несущего мутантный ген с животным, несущим ген, который кодирует мутантный амилоидный белок-предшественник, характеризующимся высоким уровнем выработки β-амилоидного белка, а более предпочтительно это животное является гибридом мыши или его потомством, которое получают в результате скрещивания или которое рождается в результате указанного скрещивания. Предпочтительный вариант настоящего изобретения относится к указанному выше генетически мутированному животному, причем животное несет ген, кодирующий мутантный амилоидный белок-предшественник, характеризуется высоким уровнем выработки β-амилоидного белка и является PS1-мутантной мышью.
Краткое описание чертежей
На фиг.1 показана рестрикционная карта Pα-фрагмента геномной ДНК, включающего 8-й экзон гена пресенилина-1 мыши, который был получен путем клонирования геномной клонотеки мыши.
На фиг.2 показана схема способа конструирования плазмиды ртХ-1, включающей сегмент 8-го экзона гена пресенилина-1 мыши, в составе которого находится участок, в который с применением методов направленного мутагенеза была внесена мутация OS-2.
На фиг.3 показан способ конструирования направляющего вектора.
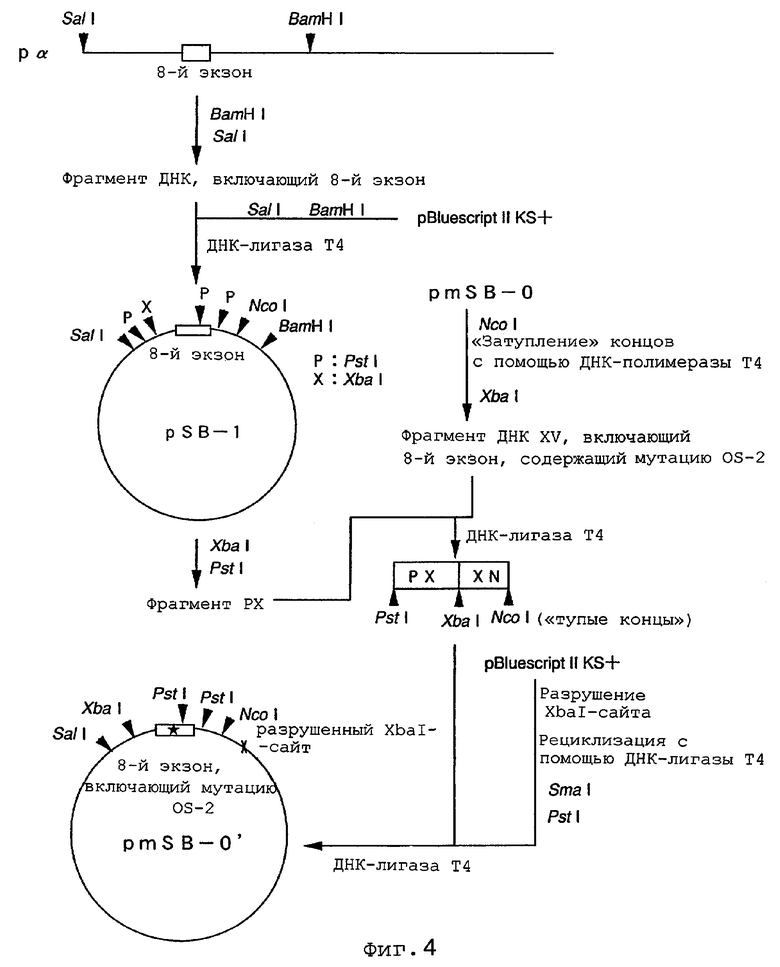
На фиг.4 показан способ конструирования направляющего вектора.
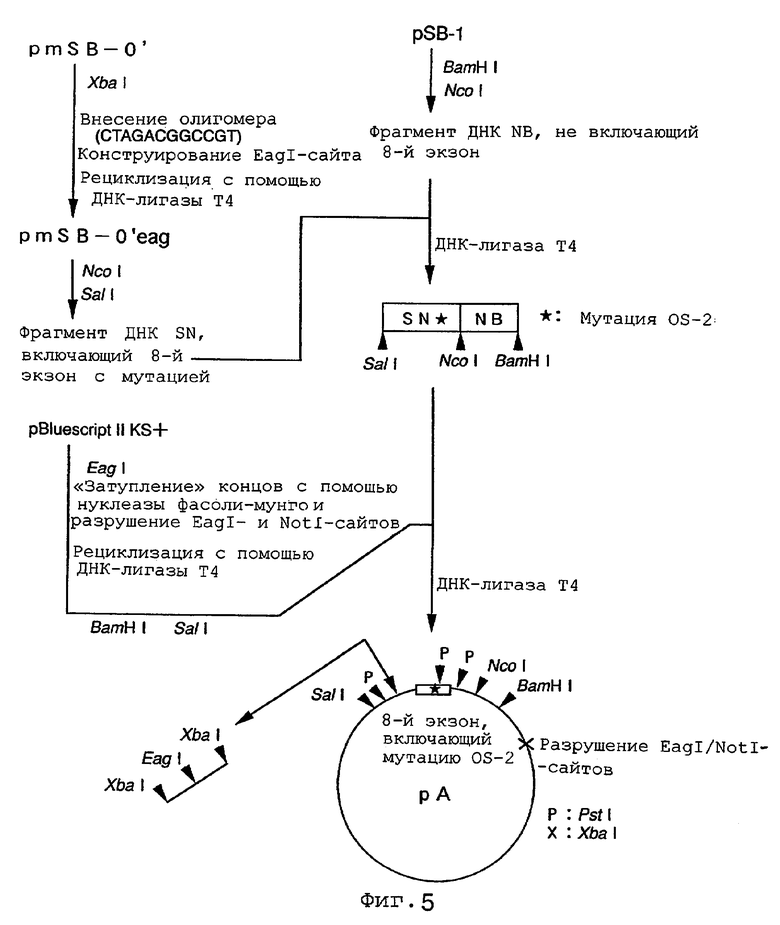
На фиг.5 показан способ конструирования направляющего вектора.
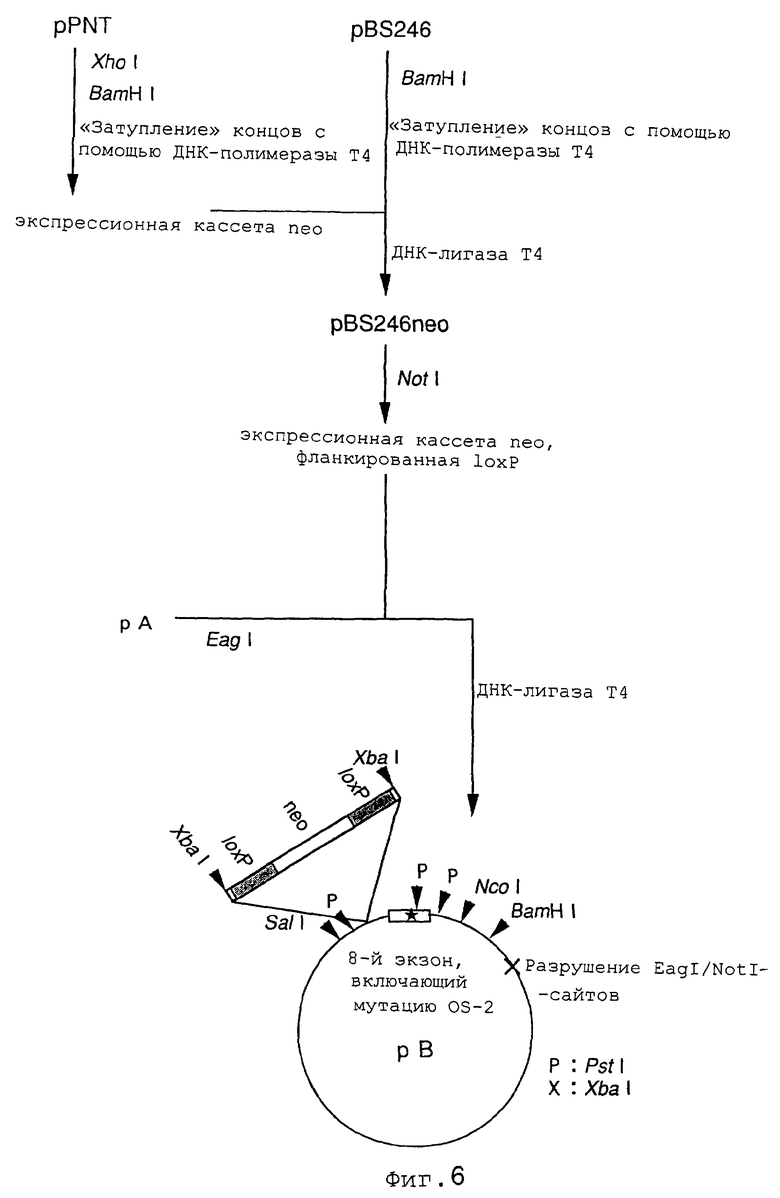
На фиг.6 показан способ конструирования направляющего вектора.
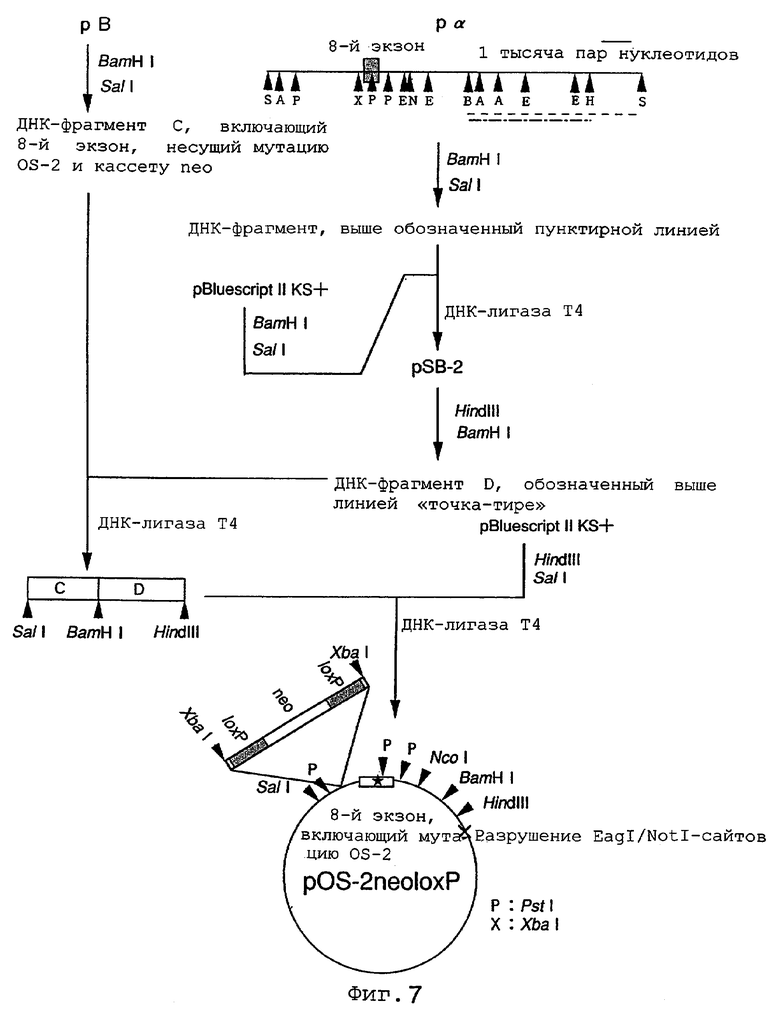
На фиг.7 показан способ конструирования направляющего вектора и структура направляющего вектора pOS-2 neoloxP.
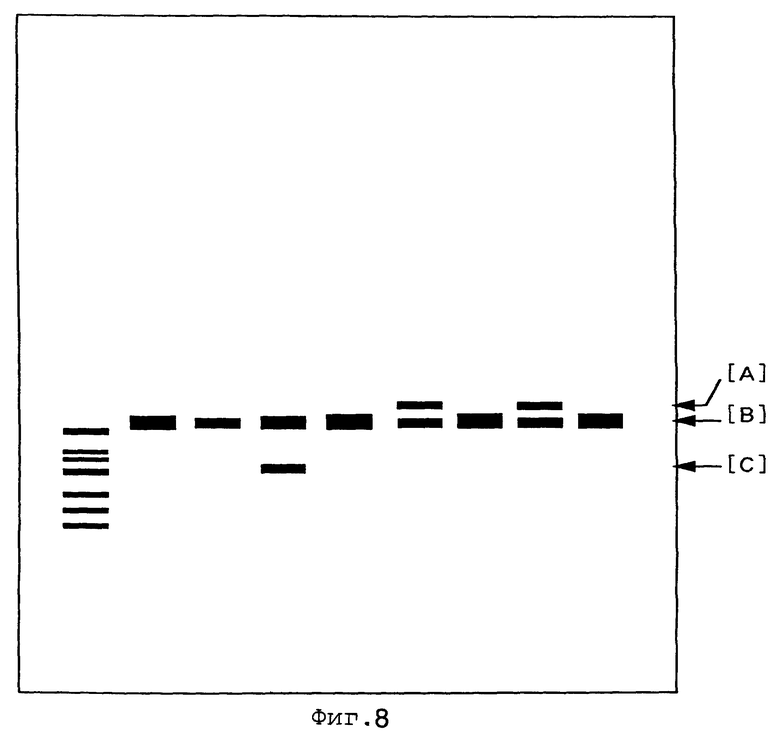
На фиг.8 показаны результаты применения электрофореза в 1%-ном агарозном геле в отношении продукта ПЦР, полученного после скрещивания мыши №2 (самец), несущей мутантный по OS-2 ген пресенилина-1, с мышью CAG-cre, №13 в F4 (самка), отрезания кусочка ткани хвоста у полученного потомка, выделения ДНК из этого образца и проведения ПЦР в соответствии с описанным в примере 10. Как видно, у мышей, которым соответствуют 2-я и 4-я дорожки, считая справа, не проявляют экспрессии гена neo с их геномной ДНК. На этой фигуре крайняя левая дорожка соответствует маркеру молекулярной массы. [А] отмечены бэнды, характерные для дефицита neo в составе геномной ДНК. [В] отмечены бэнды, соответствующие ДНК дикого типа. И [С] показывает бэнды, соответствующие присутствию гена neo в составе хромосомной (геномной) ДНК.
Наилучший способ осуществления настоящего изобретения
Мутантным геном пресенилина, используемым для получения генетически мутированного животного по настоящему изобретению, является ген, кодирующий мутантный белок пресенилин, а по использованию в данном тексте термин «мутантный ген пресенилина» обозначает как мутантный ген пресенилина-1 и мутантный ген пресенилина-2 в отдельности, так и их оба вместе, а термин «мутантный белок пресенилин» обозначает как мутантный белок пресенилин-1 и мутантный белок пресенилин-2 в отдельности, так и их оба вместе. Свойством мутантного гена пресенилина является обеспечение повышенного уровня выработки β-амилоидного белка. Генетически мутированным животным по настоящему изобретению является млекопитающее, трансформированное с использованием указанного выше мутантного гена пресенилина, для чего используется, например, гомологичная рекомбинация. Мутацией, происходящей в составе мутантного белка, предпочтительно является замена аминокислотных остатков. Число таких мутаций не ограничивается, а предпочтительно оно равно 1.
Полноразмерная последовательность пресенилина-1 млекопитающего описана, например, у Е.Levy-Lahad et al., 1995, Science, 269, pp.973-977. Полноразмерные последовательности белков пресенилин-1 человека и мыши и примеры последовательностей ДНК, которые кодируют эти белки, показаны в SEQ ID NO 1-4. Например, сайтом для мутирования пресенилина-1 мыши предпочтительно может быть сайт, выбираемый из положений №№79, 82, 96, 115, 120, 135, 139, 143, 146, 163, 209, 213, 231, 235, 246, 250, 260, 263, 264, 267, 269. 280, 285, 286, 290, 318, 384, 392, 410, 426 и 436.
Более предпочтительными мутациями являются одна или большее число мутаций, выбираемых из группы, которая включает мутации A79V, V82L, V96F, Y115H, Y115C, Е120К, E120D, N135D, M139V, М139Т, M139I, I143F, I143T, M146L, M146V, H163Y, H163R, G209V, I213T, А231Т, A231V, L235P, А246Е, L250S, A260V, C263R, P264L, P267S, R269G, R269H, Е280А, E280G, A285V, L286V, S290C, E318G, G384A, L392V, C410Y, А426Р и P436S в аминокислотной последовательности белка пресенилина-1, а более предпочтительно - аминокислотной последовательности белка пресенилин-1 мыши. Среди этих мутаций, в частности, предпочтительными являются замены 213-й аминокислоты на другую аминокислоту (в ряде разделов настоящего текста они обозначаются как «мутации типа OS-2»). Например, наиболее предпочтительной является мутация, в результате которой изолейцин в 213-м положении заменяется на какую-либо иную аминокислоту, кроме изолейцина, или мутация, в результате которой изолейцин-213 заменяется на треонин.
Полноразмерная последовательность белка пресенилин-2 млекопитающего описана, например, в Science, 1995, 269, pp.973-977. Предпочтительными сайтами мутирования являются 141-я и (или) 436-я аминокислоты, а в последовательности мыши более предпочтительными являются мутации N141I и M239V. Одна или большее число мутаций могут иметь место либо в одном из белков пресенилин (-1 или -2), или в обоих этих белках.
Генетически мутированное животное по настоящему изобретению характеризуется наличием одной из вышеуказанных мутаций гена пресенилина-1 и (или) гена пресенилина-2 в составе его геномной ДНК. Генетически мутированное животное не ограничено ни чем иным, кроме того, что оно является млекопитающим, а вид животного при этом специально не ограничивается. Например, пригодным для использования является вид грызунов. В частности, предпочтительным видом является мышь. Генетически мутированное животное по настоящему изобретению может быть получено путем конструирования плазмиды с использованием ДНК, характеризующейся последовательностью длиной примерно 10 тысяч пар нуклеотидов, включающей мутантный пресенилиновый ген, с последующим внесением этой плазмиды в эмбриональную стволовую клетку, что тем самым обусловливает прохождение внутриклеточной гомологичной рекомбинации.
Генетически мутированное животное по настоящему изобретению характеризуется тем, что аминокислотная мутация имеет место в основном в единственном сайте в результате внесения указанных выше мутантных генов пресенилина-1 и (или) пресенилина-2 с применением гомологичной рекомбинации. В случае так называемого «трансгенного животного» последовательность ДНК, включающая мутантный сегмент, вносится в состав геномной ДНК случайным образом, а по множеству различных сайтов оказываются внесенными десятки копий повторяющейся последовательности. Генетически мутированное животное по настоящему изобретению позволяет избежать такой проблемы: возможным является точный анализ патогенеза болезни Альцгеймера на генетическом уровне. Когда ДНК, включающая маркер или подобное, вносится в организм генетически мутированного животного по настоящему изобретению, такое животное может иметь маркерный сайт и последовательность для внесения такого маркера. Например, для внесения по сайту, распознаваемому рестриктазой Sau3AI, может быть заменен один нуклеотид, а такая замена может быть проверена путем расщепления ПЦР-продукта рестриктазой Sau3AI с последующим анализом полученных фрагментов электрофоретически и подобным образом.
Генетически мутированное животное по настоящему изобретению характеризуется своеобразным свойством вырабатывать β-амилоидный белок в большом количестве по сравнению с животным дикого типа в результате генетической мутации. Увеличенное количество β-амилоидного белка, достигаемое у генетически мутированного животного по настоящему изобретению, ни чем специально не ограничивается: предпочтительно это количество должно быть достаточным для установления отчетливой разницы в оценках степени нарушения памяти, патологических параметров и различных невропатологии по сравнению с нормальными животными.
ДНК, плазмиды, клеточные культуры и эмбрионы млекопитающих, представляемые настоящим изобретением, характеризуются наличием мутантного гена пресенилина-1 и (или) мутантного гена пресенилина-2. Например, в объем настоящего изобретения попадают кДНК или полноразмерная геномная ДНК мутантного гена пресенилина-1, кодирующего мутантный белок пресенилин-1, предпочтительно мутантный по мутации OS-2 белок пресенилин-1, или последовательность ДНК, включающая один или несколько мутантных сайтов; плазмида, включающая ДНК, которая является указанной выше кДНК или полноразмерной геномной ДНК, или указанной выше ДНК, включающей один или несколько мутантных сайтов, в которую дополнительно встроен рестрикционный Sаu3АI-сайт; геномная ДНК, включающая 8-й экзон мутантного гена пресенилина-1, кодирующей мутантный белок пресенилин-1 с мутацией OS-2. Далее настоящее изобретение охватывает указанный выше ген или ДНК, которые дополнительно включают один или больше, а предпочтительно от 1 до 20, а более предпочтительно от 1 до нескольких нуклеотидных замен.
Примерами ДНК и плазмид по настоящему изобретению являются:
1) ДНК, включающая мутантный ген пресенилина-1, кодирующий мутантный белок пресенилин-1, причем изолейцин в 213-м положении пресенилин-1 заменен на треонин, или плазмида, включающая упомянутую ДНК;
2) ДНК, включающая мутантный ген пресенилина-1, причем нуклеотидная последовательность, кодирующая аминокислоты вокруг 213-го остатка аминокислотной последовательности мутантного белка пресенилин-1, является следующей последовательностью - 5'-TGTGGTCGGGATGAT M GCCA N CCACTGGAAAGGCCC-3', - при том, что N соответствует любому нуклеотиду кроме Т, а М соответствуют Т или С, или плазмида, включающая упомянутую ДНК;
3) ДНК, включающая мутантный ген пресенилина-1, причем нуклеотидная последовательность ДНК, кодирующая аминокислоты вокруг 213-го остатка аминокислотной последовательности мутантного по OS-2 белка пресенилина-1, является следующей последовательностью - 5'-TGTGGTCGGGATGAT M GCC XYZ CACTGGAAAGGCCC-3', причем М соответствует Т или С, XYZ соответствует кодону, кодирующему аминокислоту, отличную от изолейцина, или плазмида, включающая эту ДНК;
4) любая ДНК или плазмида, включающая упомянутые ДНК, соответствующие упомянутым выше пп.(1)-(4), причем в их состав внесен рестрикционный Sаu3АI-сайт;
5) ДНК или плазмида, включающая упомянутую ДНК, причем рестрикционный Sаu3АI-сайт вносят в последовательность, включающую полноразмерную кДНК или геномную ДНК мутантного гена пресенилина-1, кодирующего мутантный белок пресенилин-1, причем изолейцин в 213-м положении заменен на треонин в аминокислотной последовательности белка пресенилин-1, или в состав мутантного сегмента упомянутой последовательности;
6) ДНК, включающая 8-й экзон мутантного гена пресенилина-1 мыши, кодирующего мутантный по OS-2 белок пресенилин-1, и неомициновую экспрессионную кассету, фланкированную loxP, или плазмида, включающая упомянутую ДНК; и
7) ДНК, включающая 8-й экзон мутантного гена пресенилина-1, кодирующего мутантный белок пресенилин-1, причем изолейцин в 213-м положении заменен на треонин в аминокислотной последовательности белка пресенилин-1, и неомициновую экспрессионную кассету, фланкированную loxP, или плазмида, включающая упомянутую ДНК. Однако масштаб настоящего изобретения не ограничивается этими конкретными примерами.
Эмбрионы или клетки, представляемые настоящим изобретением, включают эмбрион или клетку, в которые внесена указанная плазмида, например плазмида, включающая нуклеотидную последовательность PRL-104 или PRL-105. Предпочтительными клетками по настоящему изобретению являются те клетки, которые трансформированы геном, кодирующим мутантный белок пресенилин, который характеризуется мутацией в 213-м положении аминокислотной последовательности белка пресенилин-1, путем гомологичной рекомбинации с использованием указанной выше плазмиды. Типы эмбрионов и клеток ни чем не ограничены, кроме того, чтобы они были производными от млекопитающего, а предпочтительными являются те, которые производны от грызуна, предпочтительно от мыши.
Получение генетически мутированного животного
После получения ДНК, кодирующей мутантный пресенилин человека, генгетически мутированное животное по настоящему изобретению, несущее мутантный ген пресенилина, может быть получено в соответствии со способом, описанным здесь далее. Приводимый пример выстроен таким образом, что используемым млекопитающим является мышь, а используемым мутантным геном пресенилина является мутантный ген пресенилина-1 человека. Однако генетически мутированное животное по настоящему изобретению не ограничивается теми животными, которые получаются с использованием указанных компонентов. Далее, данный способ является примером способа получения генетически мутированного животного по настоящему изобретению, а сам способ по настоящему изобретению не ограничивается описываемым далее способом. Основываясь на базовом способе, описываемом далее, и на конкретных способах, описанных в примерах, путем подходящего модифицирования или изменения этих способов, если это оказывается необходимым, специалист в данной области техники легко сможет получить генетически мутированное животное по настоящему изобретению.
С целью конструирования зонда, предназначаемого для использования в методе ПЦР, фрагмент ДНК, который включает сайт для мутирования 8-го экзона гена пресенилина-1, производного от того животного, получение которого осуществляется, получают на материале геномной клонотеки мыши. Может быть использована геномная клонотека ДНК мышей любой линии, включая геномную клонотеку мыши линии 129, описываемой в примерах. Когда мышь является тем животным, в геном которого вносят мутацию, то используют 8-й экзон гена пресенилина-1 мыши. Когда используют другие виды животных, то необходимо подобрать соответствующий сегмент.
После того, как полученный в описанном выше способе фрагмент ДНК помечают (32Р) методом случайного прайминга, скрининг геномной клонотеки осуществляют с использованием помеченного зонда, а затем клонируют фрагмент геномной ДНК, включающий 8-й экзон клонированного гена пресенилина-1. Далее субклонируют предназначенный для мутирования сегмент 8-го экзона клонированного гена пресенилина-1, а затем вносят мутацию.
Направляющий вектор конструируют таким образом, чтобы он включал геномную ДНК, включающую 8-й экзон гена пресенилина-1 мыши, в последовательность которого была внесена мутация. В качестве селективного маркера экспрессионную кассету neo вносят в состав направляющего вектора с целью облегчения того, чтобы те клетки, геном которые не включил данный вектор, уничтожались после добавления антибиотика G418 в культуральную среду. После того, как направляющий вектор был внесен в клетки ES с применением метода электропорации или с помощью какого-либо иного метода, служащего для доставки гена в клетку, клетки ES культивируют в присутствие и отбирают образующиеся колонии. Каждую из полученных колоний разделяют на две части. Одну из половин оставляют для культивирования, пересева или замораживания. Другую половину используют для анализа клеток ES, в геном которых желаемая мутация 8-го экзона гена пресенилина-1 мыши вносится с помощью гомологичной рекомбинации. Запасенную половину колонии клеток ES, несущую желаемую внесенную мутацию, отбирают и используют в процессе, описанном ниже.
У беременной самки мыши выделяют эмбрион на стадии 8 бластомеров. На этот эмбрион наносят примерно 20 указанных выше сохраненных клеток ES и затем реимплантируют в матку самки мышей с ложной беременностью. Среди родившегося потомства отбирали мышат с мозаичной окраской шерсти. Мозаичную (химерную) мышь скрещивали с мышью линии C57DL/6, а особь, несущая желаемую мутацию, может быть получена в результате отбора среди полученного потомства мышат тех особей, у которых имеется окраска дикого типа («агути»). Полученная в потомстве мышь является гетерозиготной по отношению ко внесенному гену пресенилина-1 с мутацией, в то время как аллель гена пресенилина-1 на другой хромосоме представлен диким типом и лишен мутации.
В качестве исходных материалов для конструирования зонда, необходимого для клонирования геномной ДНК, включающей последовательность 8-го экзона гена пресенилина-1 мыши из состава геномной клонотеки мыши может быть использована кДНК гена пресенилина-1, который является производным от млекопитающего, отличного от мыши и человека, нуклеотидная последовательность которой известна, равно как и те фрагменты, которые, в частности, упомянуты в примерах. В качестве методов получения фрагмента ДНК, используемого в качестве зонда, может быть применен метод крупномасштабного воспроизводства плазмиды, которая включает геномную ДНК мыши, включающую сегмент, соответствующий 8-му экзону гена пресенилина-1 геномной ДНК, или кДНК гена пресенилина-1, производного от млекопитающего, отличного от мыши и человека, или подобное, нуклеотидная последовательность чего известна, равно как применены и ПЦР-амплификация, описанная в примерах. Далее, после того, как плазмиду расщепили рестриктазой, желательный фрагмент ДНК может быть получен путем отделения части, являющейся фрагментом ДНК, с применением электрофореза в агарозном геле и подобного.
В качестве метода мечения ДНК-фрагмента могут быть использованы такие методы, как те, которые основаны на ПЦР в присутствие 132P-dNTP, равно как и метод случайного прайминга, описанного в примерах. Далее, метка может быть внесена с помощью ПЦР или случайного прайминга с использованием в качестве затравки предварительно помеченного олигонуклеотида. Также для мечения может быть использована хемолюминесценция на основе комплекса авидинабиотина или щелочной фосфатазы или подобного, равно как и радиоактивные изотопы, описанные в примерах. Фрагмент РНК, помеченный с использованием РНК-полимераз нечетных фагов Т3 или Т7, также может быть использован в качестве зонда. Кроме указанных выше известны и другие методы конструирования зонда, и желательный зонд может быть получен с применением любого из этих методов.
Для внесения в ДНК желательной мутации могут быть применены методы, описанные, в частности, в примерах. Кроме того, плазмиду, производную от бактериофага, такого как фаг М13, или плазмиду, дуплицированную с использованием ung- Escherichia coli, связывают комплементарным образом с олигонуклеотидом, синтезированным с целью внесения мутации по желательному сайту (нуклеотиды того сайта, по которому собственно вносится мутация, не являются комплементарными), а полученный в результате комплекс используют в качестве затравки для получения гетеродуплексной плазмиды с применением ДНК-полимеразы, а затем ung-позитивные клетки Escherichia coli трансформируют с использованием полученной в результате плазмиды с получением плазмиды, включающей желаемую мутацию. Применяется и другой подход («кассетный метод») для получения плазмиды, несущей желаемую мутацию: он включает этапы синтеза двух олигонуклеотидов, которые характеризуются модификацией нуклеотидов таким образом, чтобы внести желаемую мутацию и способны пройти отжиг по комплементарному типу, будучи сконструированными таким образом, чтобы внести рестрикционные сайты, и лигирование олигонуклеотида на плазмиду с целью внесения мутации, для чего используется ДНК-лигаза. В ряде случаев искомый результат может быть достигнут с большей эффективностью путем внесения подходящих модификаций или изменений в описанные выше методы в зависимости от конкретной поставленной цели. Кроме того, в качестве метода внесения мутации в данной области техники известны различные доступные методы: следовательно, любой из таких методов может быть применен для достижения указанного результата.
Направляющий вектор предпочтительно может включать экспрессионную кассету селективного маркера, рассматриваемую в качестве необходимого компонента, который включает фрагмент геномной ДНК мыши, включающий мутацию, ДНК-фрагмент, кодирующий селективный маркер, промотор, обеспечивающий их транскрипцию, и терминатор. Фрагмент геномной ДНК мыши, включающий мутацию, является необходимой частью с точки зрения обеспечения гомологичной рекомбинации в клетках ES, причем также необходимы фрагменты геномной ДНК мыши, фланкирующие мутационный сайт по обеим сторонам от него. Следовательно, направляющий вектор включает фрагмент ДНК, в составе которого только мутировавшие нуклеотиды отличаются от нативной нуклеотидной последовательности генома мыши. Длина такого фрагмента предпочтительно может составлять 10 тысяч пар нуклеотидов: в принципе, допустимы и некоторые его удлинение или укорочение. Однако, если данный фрагмент оказывается слишком коротким, то частота гомологичной рекомбинации иногда может снижаться.
В качестве селективных маркеров известны позитивные селективные маркеры, такие как ген резистентности к неомицину и ген резистентности к гигромицину, и негативные селективные маркеры, такие как ген тимидинкиназы простого герпесвируса и фрагмент А генома дифтерийного токсина. В приложении к клеткам ES они могут быть использованы при культивировании клеток в качестве маркеров. В случае использования негативного селективного маркера необходимо размещать его за пределами фрагмента геномной ДНК мыши в составе направляющего вектора. При использовании позитивного селективного маркера необходимо встраивать его экспрессионную кассету в последовательность интрона фрагмента геномной ДНК мыши в составе направляющего вектора. При встраивании гена позитивного маркера в последовательность экзона встроенный ген обычно утрачивает свои функции, и поэтому иногда не удается получить особей, которые можно было бы тестировать по влиянию анализируемой мутации в качестве заключительной цели анализа.
Что касается линии клеток Е3, то обычно используются клеточные линии, производные от мышей линии 129. Клетки ES являются производными от указанной линии мыши: могут быть использованы такие клетки ES (т.е. эмбриональные стволовые клетки), как клетки D3, ССЕ, J1 и АВ1, равно как и клетки R1, описанные в примерах. Например, производные от мыши клетки ES, такой как линия мышей C57BL/6, также могут быть использованы помимо клеток мышей линии 129. Что касается методов внесения направляющего вектора в клетки ES, то в принципе может быть применен метод электропорации в соответствии с описанным в примерах. Может быть применен любой метод, лишь бы он обеспечивал проникновение плазмиды внутрь находящейся в культуре клетки, например метод осаждения с фосфатом кальция или липосомный метод. Когда клетки ES, в которые был внесен направляющий вектор, культивируют в присутствие селективного маркера, то те клетки ES, которые сохраняют жизнеспособность и образуют колонии, по-видимому, претерпели гомологичную рекомбинацию. Метод ПЦР обычно применяется для установления того, произошла ли гомологичная рекомбинация в тех клетках ES, которые образовали колонии. В качестве зонда могут быть использованы фрагмент ДНК, фрагмент РНК, синтетический олигонуклеотид, антитело или подобное.
После того, как клетки ES смешивают с оплодотворенной яйцеклеткой на ранних стадиях ее развития с последующим продолжением этого развития, может быть получена мышь от спермия или яйца, производного от клетки ES. Для смешивания клеток ES, в которых произошла гомологичная рекомбинация, с оплодотворенной яйцеклеткой на ранней стадии ее развития может быть применен метод, описанный в примерах. Кроме того, также может быть применен метод, который включает этапы выделения оплодотворенной яйцеклетки на стадии бластулы из тела беременной самки мыши, инъецирование 10-20 клеток ES в полученное яйцо с помощью микропипетки, реимплантации проинъецированного яйца в матку ложнобеременной самки с последующим продолжением развития до рождения мышонка.
Оплодотворенное яйцо на ранней стадии развития, предназначенное для использования в смешивании с клетками ES, может быть выделено из самок мышей любой линии. С целью облегчения установления того, попали ли в тела потомков клетки ES, предпочтительным является использование оплодотворенного яйца линии мышей, характеризующейся отличающейся окраской шерсти от окраски шерсти у тех мышей, на материале которых были получены клетки ES. Например, клетки ES, используемые в примерах, происходят от мышей линии 129, характеризующихся окраской шерсти «агути» (дикий тип), а мыши, от которых получают оплодотворенные яйцеклетки (линия C57BL/6), окрашены в черный цвет. При использовании такого материала возможным становится проведение простого отбора мышат, несущих клетки, производных от клеток ES, путем отбора потомков с мозаичной окраской. В этом случае мышата, характеризующиеся наибольшей долей окраски дикого типа, являются наиболее вероятными носителями половых клеток, производных от клеток ES. В качестве ложнобеременных самок мышей можно использовать мышей любой линии.
Мышью, которую используют для получения путем скрещивания потомств, несущих желательную встроенную мутацию и являющихся искомыми мозаиками, предпочтительно может быть мышь такой линии, которая характеризуется окраской шерсти, отличной от таковой у мышей линии, от которой были получены клетки ES. Обычно мозаичных самцов мыши скрещивают с самкой отличающейся линии: если получают потомство с окраской шерсти дикого типа, то это значит, что полученные в результате мыши несут желаемую мутацию в гетерозиготном состоянии. Если мышь, несущая мутацию OS-2 в мутантном гене пресенилина-1, также несет экспрессионную кассету neo, фланкированную последовательностями loxP, то возможным является получить мышь, у которой экспрессионная кассета neo удалена: для этой цели осуществляют скрещивание с трансгенной мышью, несущей встроенный ген cre.
Как было охарактеризовано выше в данном тексте, считается, что мутация белка пресенилина-1 и пресенилина-2 способствует образованию сенильных бляшек в результате повышения выработки амилоидного белка Аβ42, тем самым приводя к развитию болезни Альцгеймера. В группе трансгенных мышей, которым был внесен ген, кодирующий мутантный АРР, обусловливающий семейную болезнь Альцгеймера, у некоторых мышей отмечалось отложение амилоидных белков в головном мозге (D.Games et al., 1995, Nature, vol. 373, р.523; K.Hsiao et al., 1996, Science, vol. 274, p.99; С.Sturchler-Pierrat et al., 1997, Proc. Natl. Acad. Sci. USA, vol. 94, p.13287). Предполагается, что у таких трансгенных мышей амилоидные отложения индуцируют повышение количества белка Аβ, вырабатываемого в головном мозге.
Путем скрещивания трансгенного животного, трансформированного геном, кодирующим мутантный белок-предшественник АРР, способного проявлять амилоидные отложения в головном мозге (это животное может быть гомо- или гетерозиготным по отношению ко внесенному трансгену), с животным по настоящему изобретению, несущим мутантный ген пресенилина-1 (это животное может быть гомо- или гетерозиготным по отношению ко внесенному трансгену), может быть получено гибридное животное. Такое животное предпочтительно является мышью. Для использования в скрещивании любое из указанных выше животных может быть самцом.
У потомства отрезают кусочек ткани хвоста, на материале которого экстрагируют геномную (хромосомную) ДНК. Используя эту экстрагированную ДНК в качестве субстрата, осуществляют ПЦР с использованием в качестве затравок двух олигонуклеотидов, нуклеотидная последовательность каждого из которых выстраивается таким образом, чтобы фланкировать мутируемый сайт гена, кодирующего мутантный АРР, и двух олигонуклеотидов, характеризующихся нуклеотидной последовательностью, фланкирующей сайт мутирования мутантного гена пресенилина-1.
Возможным является определение того, попали ли в состав экстрагированной ДНК ген, кодирующий мутантный АРР, и мутантный ген пресенилина-1 по настоящему изобретению, для чего ПЦР-продукт разгоняют методом электрофореза в агарозном геле с последующим выявлением, например, присутствия или отсутствия бэндов и оценки подвижности бэндов в геле, анализируя конкретный бэнд, соответствующий данной мутации, путем гибридизации с использованием олигонуклеотида, нуклеотидная последовательность которого включает данную мутацию. ПЦР может быть осуществлена в соответствии с методом, описанным в примере 8. Нуклеотидные последовательности олигонуклеотидов, используемых в качестве затравок для ПЦР, могут иметь произвольную длину, лишь бы они позволяли детектировать ген, кодирующий мутантный АРР или мутантный ген PS1. Основываясь на результатах ПЦР, животное, у которого оба этих гена находятся в гетерозиготном состоянии, может быть получено путем отбора животных, несущих ген, кодирующий мутантный АРР, и мутантный ген пресенилина-1 по настоящему изобретению.
С целью получения животных, несущих оба гена, кодирующих мутантный АРР и мутантный пресенилин-1 по настоящему изобретению, находящихся в гомозиготном состоянии, отдельное животное, у которого оба этих гена гомозиготны, выбирают из потомства, полученного от скрещивания самца и самки, отобранных в группе животных, характеризующихся гетерозиготностыо этих генов. Для подтверждения того, что ген, кодирующий мутантный АРР, находится в гомозиготном состоянии, кусочек ткани хвоста такого потомства отбирают для экстрагирования из него геномной ДНК, а после расщепления этой геномной ДНК рестриктазами проводят электрофорез в агарозном геле или полиакриламидном геле. Затем ДНК промакивают на мембранный фильтр и проводят Саузерн-блоттинг с использованием в качестве зонда олигонуклеотида, последовательность которого обеспечивает специфичное связывание с геном, кодирующим мутантный АРР; затем анализируют плотность полученных в результате бэндов.
Аналогично указанным выше процессам может быть проверено присутствие в гомозиготном состоянии мутантного гена пресенилина-1 по настоящему изобретению. Олигонуклеотиды, применяемые в качестве зондов в методе Саузерн-блоттинга, могут быть использованы после их мечения в соответствии со способами, принятыми для прописей Саузерн-блоттинга, например, с помощью радиоактивного изотопа и флуоресцентного красителя. Таким образом может быть получена мышь, несущая оба гена, кодирующих мутантный АРР и мутантный пресенилин-1 по настоящему изобретению. Гибридная мышь, полученная с помощью описанного выше способа, характеризуется высоким уровнем выработки β-амилоидных белков в головном мозге и ускоренным амилоидным отложением.
С использованием генетически мутированного животного, клеток, трансформированных мутантным геном пресенилина, плазмиды, включающей мутантный ген пресенилина, и подобного возможным является осуществлять скрининг субстанций, применяемых для профилактики и (или) лечения болезни Альцгеймера и для оценки их применимости. Накопление β-амилоидных белков у здорового млекопитающего прогрессирует очень медленно, в то время как генетически мутированному животному по настоящему изобретению свойственен высокий уровень выработки β-амилоидных белков. Следовательно, путем введения различных тестируемых субстанций генетически мутированному животному по настоящему изобретению и сравнения с животным, которым их не вводили, или с животными, которым вводили контрольные субстанции, возможным является оценить эти субстанции по их применимости для профилактики и (или) лечения болезни Альцгеймера. Типичным примером такой оценки является скрининг тест-субстанций, и такому анализу могут быть подвергнуты условия, патологические параметры, фармакологические тесты и подобное.
В случае использования клеток по настоящему изобретению эти клетки выделяют из тела животного по настоящему изобретению и ставят в первичную культуру, а затем эти клетки могут быть стабилизированы и пересеяны в субкультуру с помощью иммортализации первичной клеточной культуры путем обработки соответствующим вирусом или подобного, пересеяны путем выделения фрагмента полученной культуры и далее прокультивированы с использованием свежей порции культуральной среды. Клетки по настоящему изобретению включают первичные культивируемые клетки, такие как нервные клетки, выделенные из тела генетически мутированного животного, равно как и пересеянные клетки, например, т.н. «клеточные линии», получаемые в результате постоянного пересева (субкультивирования) исходной первичной культуры. Когда нервная клетка используется в качестве клетки по настоящему изобретению, эта клетка экспрессирует высокий уровень β-амилоидных белков в результате экспрессии этой клеткой мутантного белка пресенилин-1. Субстанция, которая предотвращает или задерживает гибель нервной клетки вследствие накопления β-амилоидных белков, может быть протестирована, а также может быть оценена ее применимость путем добавления тестируемой субстанции в культуральную систему in vitro таких нервных клеток с последующим сравнением, например, продолжительности выживания клеток или числа выживаемых клеток через некоторый период времени.
Примеры
Настоящее изобретение может быть более детально охарактеризовано с помощью примеров. Однако, масштаб настоящего изобретения не ограничивается этими примерами. В нижеследующих примерах ген пресенилина-1 иногда обозначается как PS1.
Пример 1
Клонирование геномной ДНК, включающей 8-й экзон гена пресенилина-1 (PS1) мыши
Для конструирования зонда, предназначенного для выделения геномной ДНК, включающей 8-й экзон гена PS1 мыши, были синтезированы следующие два олигонуклеотида:
PR-8-U: 5'-GGAATTTTGGTGTGGTCGGGATGAT-3' (25);
PR-8-L: 5'-GGTCCATTCGGGGAGGTACTTGA-3' (23).
ПЦР осуществляли с использованием этих двух олигонуклеотидов в качестве затравок, а ДНК экстрагировали из геномной клонотеки мышей линии 129/SVJ (Stratagene) с получением амплифицированного ДНК-фрагмента длиной примерно 130 пар нуклеотидов. Затем этот фрагмент помечали методом случайного прайминга в присутствие 32Р-дЦТФ и затем использовали в качестве зондов для скрининга геномной клонотеки мышей линии 129/SVJ. Полученные в результате позитивные фаговые клоны были протестированы с подтверждением того, что они включают желаемую геномную ДНК, включающую последовательность 8-го экзона гена PS1 мыши. Клонированную ДНК обозначили как Рα и подвергали рестрикционному картированию (фиг.1).
Пример 2
Конструирование плазмиды, предназначенной для внесения мутации
ДНК была экстрагирована из клонированного фага, несущего Рα, и расщеплена рестриктазой Sall и затем подвергнута электрофорезу в 1%-ном геле с целью отбора фрагмента Рα. После расщепления рестриктазами PstI и Xbal полученный продукт подвергали электрофорезу в 1%-ном агарозном геле с целью сбора ДНК-фрагмента длиной примерно 600 пар нуклеотидов, включая нуклеотидную последовательность, которая кодирует изолейцин по 213-му положению последовательности PS1 мыши. Полученный ДНК-фрагмент был обозначен как Х-1. Фрагмент Х-1 лигировали с использованием ДНК-лигазы Т4 в состав плазмиды pBluescript II KS+ (Stratagene), которую предварительно расщепляли рестриктазами PstI и XbaI, а затем использовали для трансформации клеток E.coli с получением плазмиды рХ-1.
Пример 3
Внесение мутации OS-2
Мутация OS-2 и рестрикционный Sau3AI-сайт были «заново» внесены в состав плазмиды рХ-1 с использованием следующих двух олигонуклеотидов - PRL-104 и PRL-105. Олигонуклеотиды PRL-104 и PRL-105 были 36-нуклеотидными и комплементарными друг другу:
PRL-104: 5'-TGTGGTCGGGA TGATC* GCCA С CCACTGGAAAGGCCC-3';
PRL-105: 5'-GGGCCTTTCCAGTGG G TGGCG* ATCATCCCGACCACA-3'.
(Подчеркнутый нуклеотид изменен по отношению к последовательности дикого типа с целью внесения мутации OS-2: а именно дикий тип соответствует Т для PRL-104 и А для PRL-105. Нуклеотиды, отмеченные звездочкой, изменены по отношению к последовательности дикого типа с целью внесения рестрикционного Sau3AI-сайта: а именно, дикий тип соответствует Т для PRL-104 и А для PRL-105).
Внесение данной мутации было осуществлено с использованием набора реактивов Quick Change Site-Directed Mutagenesis kit (Stratagene) в соответствии с рекомендациями производителя. Секвенирование полученного продукта подтвердило точное внесение данной мутации. Фрагмент Х-1, несущий мутацию, был обозначен как тХ-1, а плазмиду, несущую mX-1, обозначили как pmX-1 (фиг. 2).
Пример 4
Конструирование геномной ДНК, несущей мутацию OS-2
Полученный в примере 1 фрагмент Рα, включающий 8-й экзон гена PS1 мыши, расщепляли рестриктазой NcoI и затем обрабатывали ДНК-полимеразой Т4 в присутствии 4 типов дезоксирибонуклеотидов (dNTP) с получением «тупых концов». Полученный фрагмент далее расщепляли рестриктазой Asp718I и затем подвергали электрофорезу в 1%-ном агарозном геле с целью отбора включающего 8-й экзон фрагмента ДНК длиной примерно 5 тысяч пар нуклеотидов. Этот фрагмент лигировали с использованием' ДНК-лигазы Т4 в состав плазмиды pBluescript II KS+ (Stratagene), которую предварительно расщепляли рестриктазами SamI и Asp718l, а затем использовали для трансформации клеток E.coli с получением плазмиды pSB-0. Плазмиду pSB-0 полностью расщепляли рестриктазой XbaI с последующим частичным расщеплением рестриктазой PstI. Плазмиду pmX-1 расщепляли рестриктазами Xbal и Pstl и подвергали электрофорезу в 1%-ном агарозном геле с отбором mX-1. Этот фрагмент mX-1 лигировали на PstI-фрагмент с использованием ДНК-лигазы Т4 и затем использовали для трансформации клеток E.coli. Колонии трансформированной E.coli тестировали с целью отбора колонии, несущей такую плазмиду, в составе которой фрагмент Х-1 плазмиды pSB-0 заменен на фрагмент mX-1. Эту отобранную плазмиду обозначили как pmSB-0 (фиг.3).
Отдельно фрагмент Рα расщепляли рестриктазами BamHI и SalI и подвергали электрофорезу в 1%-ном агарозном геле с выделением ДНК-фрагмента длиной примерно 8 тысяч пар нуклеотидов, включающего 8-й экзон. Этот фрагмент с использованием ДНК-лигазы Т4 лигировали в состав плазмиды pBluescript II KS+, которую предварительно расщепляли рестриктазами BamHI и Sall, а затем использовали для трансформации клеток E.coli с получением плазмиды pSB-1. Плазмиду pSB-1 расщепляли рестриктазой NcoI и обрабатывали ДНК-полимеразой в присутствие 4 типов dNTP с образованием «тупых концов». Полученный в результате фрагмент далее расщепляли рестриктазой XbaI и подвергали электрофорезу в 1%-ном агарозном геле. Выделяли фрагмент ДНК длиной примерно 2200 пар нуклеотидов - XN, - включающий 8-й экзон: затем этот фрагмент и плазмиду pSB-1 расщепляли рестриктазами XbaI и PstI и после этого полученные продукты подвергали электрофорезу в 1%-ном агарозном геле. Выделенный фрагмент ДНК длиной примерно 2300 пар нуклеотидов - РХ, - не включающий 8-й экзон, лигировали с использованием ДНК-лигазы Т4. Этот лигированный фрагмент далее лигировали с использованием ДНК-лигазы Т4 в состав плазмиды pBluescript II KS+, которую предварительно расщепляли рестриктазой Xbal, «затупляли» концы с помощью ДНК-полимеразы Т4 в присутствие 4 типов dNTP, религировали с использованием ДНК-лигазы Т4 и расщепляли рестриктазами SmaI и PstI. После этого полученную плазмиду использовали для трансформации E.coli. Колонии трансформированных клеток тестировали с целью получения плазмиды pmSB-0', несущей только один фрагмент ДНК, в котором ДНК-фрагменты XN и ХР были лигированы по Xbal-сайту (фиг.4).
Пример 5
Конструирование основной части направляющего вектора
Для внесения рестрикционного EagI-сайта по XbaI-сайту плазмиды pmSB-0' был синтезирован олигонуклеотид, характеризующийся следующей 12-нуклеотидной последовательностью:
5'-CTAGACGGCCGT-3' (12).
Этот олигонуклеотид способен отжигаться на нуклеотидную последовательность, характеризующуюся комплементарностью по участку CGGCCG с образованием следующей нуклеотидной последовательности после ее внесения по сайту, распознаваемому рестриктазой XbaI:
5'-TCTAGACGGCCGTCTAGA-3'
3'-AGATCTGCCGGCAGATCT-3'
-----------------
XbaI EagI XbaI
После расщепления плазмиды pmSB-0' рестриктазой XbaI указанный выше олигонуклеотид добавляли к продукту и лигировали с использованием ДНК-лигазы Т4, а затем использовали для трансформации E.coli с целью получения плазмиды pmSB-0'eag, в последовательности которой EagI-сайт был встроен по XbaI-сайту плазмиды pmSB-0'. После расщепления плазмиды pmSB-0' рестриктазами NcoI и SalI полученные в результате фрагменты подвергали электрофорезу в 1%-ном агарозном геле с выделением ДНК-фрагмента длиной примерно 5300 пар нуклеотидов - SN, - включающего 8-й экзон. Отдельно плазмиду pSB-1 расщепляли рестриктазами BamHI и NcoI и затем подвергали электрофорезу в 1%-ном агарозном геле с выделением ДНК-фрагмента длиной примерно 2 тысячи пар нуклеотидов - NB, не включающего 8-й экзон. Фрагменты SN и NB лигировали друг на друга с использованием ДНК-лигазы Т4 и обрабатывали рестриктазами BamHI и SalI с получением фрагмента ДНК, в составе которого оба ДНК-фрагмента лигированы по Ncol-сайту. Этот фрагмент ДНК далее лигировали в состав плазмиды pBluescript II KS+ с использованием ДНК-лигазы Т4 и затем использовали для трансформации клеток E.coli с целью получения плазмиды рА (фиг. 5), при том, что предварительно плазмиды pBluescript II KS+ расщепляли рестриктазой NotI, «затупляли» концы с использованием нуклеазы фасоли-мунго, религировали с использованием ДНК-лигазы Т4 с разрушением NotI-сайта и EagI-сайта, перекрывающихся в данном сайте, с последующим расщеплением рестриктазами BamHI и SalI.
Пример 6
Конструирование направляющего вектора
Плазмиду pPNT (L.J.Victor et al., 1991, Cell, 65, р.1153) расщепляли рестриктазами XhoI и BamHI и затем обрабатывали ДНК-полимеразой Т4 с целью получения «тупых концов» и подвергали электрофорезу в 1%-ном агарозном геле. Отобранный ДНК-фрагмент, включающий экспрессионную кассету neo, лигировали с использованием ДНК-лигазы Т4 в состав плазмиды pBS246 (Gibco BRL), которую предварительно расщепляли рестриктазой BamHI и обрабатывали ДНК-полимеразой Т4 с целью «затупления» концов, а затем использовали для трансформации E.coli с целью получения плазмиды pBS246neo. Эту плазмиду расщепляли рестриктазой NotI и затем подвергали электрофорезу в 1%-ном агарозном геле с выделением фрагмента ДНК длиной примерно 2 тысячи пар нуклеотидов, включающего экспрессионную кассету neo, фланкированную последовательностями loxP. Выделенный ДНК-фрагмент с использованием ДНК-лигазы Т4 лигировали в состав плазмиды рА, которую предварительно расщепляли рестриктазой EagI, а затем использовали для трансформации клеток E.coli. Колонии трансформированных клеток затем тестировали на присутствие плазмиды рВ, в составе которой ген neo и ген PS-1 ориентированы одинаково (фиг.6).
После расщепления плазмиды рВ рестриктазами BamHI и SalI полученные в результате фрагменты подвергали электрофорезу в 1%-ном агарозном геле с выделением фрагмента ДНК - С, - включающего мутацию OS-2 и экспрессионную кассету neo, фланкированную последовательностями loxP. Сходным образом фрагмент Pα расщепляли рестриктазами SalI и BamHI и полученный в результате фрагмент ДНК длиной примерно 6,5 тысяч пар нуклеотидов субклонировали в состав плазмиды pBluescript II KS+ с получением плазмиды pSB-2, которую затем расщепляли рестриктазами HindIII и BamHI подвергали электрофорезу в 1%-ном агарозном геле с выделением фрагмента ДНК длиной примерно 4 тысячи пар нуклеотидов - D. Фрагменты ДНК С и D лигировали друг на друга с использованием ДНК-лигазы Т4 и затем полученный продукт расщепляли рестриктазами HindIII и SalI с получением фрагмента ДНК, в составе которого фрагменты С и D лигированы по BamHI-сайту. Полученный ДНК-фрагмент далее был лигирован с использованием ДНК-лигазы Т4 в состав плазмиды pBluescript II KS+, которая предварительно была обработана рестриктазами HindIII и Sail, а затем использован для трансформации клеток E.coli с целью получения направляющего вектора pOS-2neoloxP (фиг.7).
Пример 7
Внесение направляющего вектора в клетки ES
Здесь и далее в описываемых примерах культуры ставили в инкубаторе при 37°С при 5% содержании углекислоты. Направляющий вектор вносили в клетки ES с помощью электропорации (линия R1), которые культивировали в среде DMEM, дополненной 15% плодной телячьей сывороткой и 1000 ед./мл LIF (ESGRO) (культуральная среда DMEM здесь и далее обозначается как среда ES). Культуральную среду заменяли на свежую среду ES за сутки до проведения электропорации и клетки R1 отбирали и промывали с использованием электропорационного буфера (20 мМ HEPES - рН=7,05, 137 мМ NaCI, 5 мМ KCl, 0,7 мМ Na2HPO4, 6 мМ декстрозы). Клетки R1 (107 клеток) смешивали с 25 мкг направляющего вектора pOS-2neoloxP, который предварительно был линеаризован с использованием рестриктазы NotI, а также 0,8 мл линеаризационного буфера с кювете для электропорации. Через 1-2 минуты клетки были подвергнуты обработке на пульсаторе Bio-Rad GenePilser (Bio-Rad) при параметрах пульса 240 В и 500 мкФ. Клетки ES отбирали центрифугированием и суспендировали в 30 мл культуральной среды ES. Суспензию клеток ES (по 2 мл) помещали на каждую из культуральных чашек, в которых размещались клетки-«кормилицы», находящиеся в 8 мл среды ES. К культуре добавляли антибиотик G418 (титр, 150 мкг/мл) через 12-18 часов, после чего культивирование вели неделю. В качестве клеток-«кормилиц» использовали фибробласты, введенные в культуру заявителями, которые были выделены из тел 12-13-дневных эмбрионов, развивающихся после скрещивания «нокаут» по HS1 мышей (I.Taniuchi et al., 1995, EMBO J., vol. 14, p.3664) и мышей линии ICR дикого типа.
Пример 8
Выделение клеток ES с помощью гомологичной рекомбинации
Были отобраны колонии клеток ES, которые образовались в примере 7 в результате недельного культивирования после добавления G418. Каждую колонию разделяли на две части. Одну из этих частей ставили в дальнейшую культуру. Для отбора клонов, в которых имела место гомологичная рекомбинация, Другую часть промывали фосфатно-солевым буфером (ФСБ), обрабатывали протеиназой-К и затем геномную ДНК отбирали и подвергали ПЦР с целью отбора клонов. Нуклеотидные последовательности синтетических затравок, использовавшихся в реакции ПЦР, были следующими:
Prsn-1-2: 5'-CCCAACTCTATTTCTACCCTCGTTCATCTG-3' (нуклеотидная последовательность, находящаяся за пределами сконструированного направляющего вектора);
PKG-1: 5'-TAGTGAGACGTGCTACTTCCATTTGTCACG-3' (нуклеотидная последовательность экспрессионной кассеты neo).
Реакцию ПЦР проводили на протяжении 35 циклов при следующих условиях: 30 секунд при 93°С, 1 минута при 60°С и 3 минуты при 68°С в каждом цикле. Полученный ПЦР-продукт анализировали методом электрофореза в 1%-ном агарозном геле с целью идентификации позитивного клона, который формирует бэнд в ожидаемом положении в геле. Оцененный в качестве позитивного клон далее подвергали ПЦР с использованием олигонуклеотидов PRL-101 и PRL-102. Полученный в результате ПЦР-продукт расщепляли рестриктазой Sau3AI и затем подвергали электрофорезу в 2%-ном агарозном геле. Внесение мутации проверяли с помощью расщепления бэндов и отбирали те клетки ES, в которых имела место желаемая гомологичная рекомбинация. Нуклеотидные последовательности PRL-101 и PRL-102 были следующими:
PRL-101: 5'-TGCTGGAGGAAAATGTGTTATTTAAGAGCA-3';
PRL-102: 5'-TACTGAAATCACAGCCAAGATGAGCCATGC-3'.
Пример 9
Получение «нокин» мыши
Клетки ES, для которых была подтверждена гомологичная рекомбинация, были далее прокультивированы в течение 4 дней и затем обработаны трипсином с целью отделения друг от друга. Из самок мышей линии BDF1 были выделены 8-клеточные эмбрионы (этих самок скрещивали с самцом линии BDF1), после чего удаляли вителлиновый слой (zona pellucida). Отделенные друг от друга клетки ES помещали на открытый безвителлиновый эмбрион (20 клеток ES в расчете на один 8-клеточный эмбрион). Обработанный эмбрион реимплантировали в матку ложнобеременной самки мыши и эмбриональное развитие продолжалось вплоть до появления мозаичной мыши. Полученного в результате мозаичного самца мыши скрещивали с самкой линии C57BL/6. Из потомства такого скрещивания отбирали мышей с окраской дикого типа «агути». Вырезали кусочек ткани хвоста и из каждого такого образца экстрагировали геномную ДНК. ПЦР проводили с использованием затравок PRL-101 и PRL-102 и полученный ПЦР-продукт расщепляли рестриктазой Sаu3АI и затем подвергали электрофорезу в 2%-ном агарозном геле. Присутствие расщепленных бэндов анализировали с целью подтверждения того, что отобранное потомство несет мутацию OS-2. Из проверенного потомства был отобран один самец, которого обозначили как №2.
Пример 10
«Нокин» особь №2, полученная в примере 9, характеризуется гетерозиготностью по экспрессионной кассете neo, фланкированной последовательностями loxP, происходящей из состава направляющего вектора. Эту мышь №2 (самец возраста примерно 4 месяца) скрещивали с самкой мыши трансгенной линии CAG-cre№13 в 4-м поколении (возраст 2 месяца, внесен ген cre, находящийся в гетерозиготном состоянии: K.Sakai et al., 1997, Biochem. Biophys. Res. Commun., 217, p.318). ПЦР осуществляли с использованием олигонуклеотидов PRL-100, PRL-102 и PGK-1 с соблюдением условий, описанных в примере 8. Мышь, из генома которой была удалена экспрессионная кассета neo, была выбрана как мутантная по OS-2 «нокин» мышь, лишенная экспрессионной кассеты neo (фиг.8). Эта мышь была гетерозиготной по мутации OS-2 и несла единственную последовательность loxP. Нуклеотидные последовательности PRL-100, PRL-102 и PGK-1, использовавшиеся для проведения ПЦР, были следующими:
PRL-100: 5'-GGT ССА ТСС CAG СТТ САС АСА GAC AAG ТСТ-3'
PRL-102: 5'-ТАС TGA ААТ САС AGC САА GAT GAG CCA TGC-3'
PKG-1: 5'-TAG TGA GAC GTG СТА СТТ ССА ТТТ GTC ACG-3'.
Промышленное применение
Генетически мутированное животное по настоящему изобретению характеризуется наличием мутантного гена пресенилина-1 и высоким уровнем выработки β-амилоидного белка в результате наличия гена, отличающегося от такового у нормального животного, не имеющего такой мутации, следовательно, это животное проявляет симптомы болезни Альцгеймера, связанные с быстрой гибелью клеток или разрушением нейронов в гиппокампе головного мозга. Следовательно, скрининг субстанций, применимых для профилактики и (или) лечения болезни Альцгеймера, и оценка их применимости могут быть проведены с использованием генетически мутированного животного по настоящему изобретению.


Изобретение относится к области генетической инженерии. Предложен способ получения отличного от человека животного с мутированным нокин-геном пресенилина-1. Способ предусматривает перенос мутантного гена путем гомологичной рекомбинации в эмбрион животного. Полученное животное характеризуется способностью экспрессировать мутантный белок пресенилина-1 и индукцией продукции β-амилоидного белка, что приводит к развитию прогрессирующего нервного заболевания в гиппокампе или периферическом отделе коры головного мозга. Предложено также несколько плазмид, несущих мутированный ген. Раскрыт также способ получения первичной культуры клеток или субкультивируемой клетки из полученных мутированных животных. Кроме того, предложены также несколько способов тестирования веществ на применимость для терапевтического и/или профилактического лечения болезни Альцгеймера. Способы предусматривают введение тестируемого вещества мутированному животному и оценку полученных результатов. Полученные мутированные животные могут быть использованы как модельные животные при исследовании болезни Альцгеймера. 9 н. и 16 з.п. ф-лы, 8 ил.
5'-TGTGGTCGGGATGATMGCC ANC CACTGGAAAGGCCC-3',
причем N соответствует любому нуклеотиду, отличному от Т, М соответствует Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту в положении 213.
5'-TGTGGTCGGGATGATMGCC ANC CACTGGAAAGGCCC-3',
причем N соответствует С, М соответствует Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту в положении 213.
5'-TGTGGTCGGGATGATMGCC XYZ CACTGGAAAGGCCC-3',
причем XYZ представляет триплетный кодон, кодирующий отличную от изолейцина аминокислоту, М соответствует Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту в положении 213.
5'-TGTGGTCGGGATGATMGCC ANC CACTGGAAAGGCCC-3',
причем N соответствует A, G или С, М соответствуют Т или С, а подчеркнутые нуклеотиды кодируют аминокислоту в положении 213.
5'-TGTGGTCGGGATGATMGCC XYZ CACTGGAAAGGCCC-3',
причем М соответствует Т или С, XYZ представляет собой триплетный кодон, кодирующий отличную от изолейцина аминокислоту, а подчеркнутые нуклеотиды кодируют аминокислоту в положении 213.
5'-TGTGGTCGGGATGATMGCCACCCACTGGAAAGGCCC-3',
в которой М соответствует Т или С.
| K.DUFF et al., "Increased amyloid-beta42(43) in brains of mice expressing mutant presenilin 1", Nature, vol.383, p.710-713, 1996. | |||
| D.R.BORCHELT et al., "Familia 1 Alzheimer's disease-linked presenilin 1 variants elevate Abeta 1-42/1-40 ratio in vitro and in vivo" | |||
| Neuron, vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| К.KAMINO et al., "Three different mutations of | |||
Авторы
Даты
2005-12-20—Публикация
1999-01-07—Подача