ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Перекрестная ссылка на родственные заявки
В данной заявке испрашивается приоритет согласно KR 10-2020-0017559, поданной 13 февраля 2020 г. в Корейское агентство по интеллектуальной собственности, полное раскрытие которой включается сюда посредством ссылки.
Предложен микроорганизм, содержащий мутированный LysE, и способ получения L-аминокислоты с его использованием. Указанный мутированный LysE может усиливать способность к осуществлению экспорта и/или продуцирования L-аминокислоты по сравнению с LysE дикого типа.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Микроорганизмы, принадлежащие к роду Corynebacterium, являются грамположительными, и их широко использовали для продуцирования L-аминокислот. L-аминокислоты, особенно L-лизин, находят применения в производстве кормов для животных и в медицинских и косметических производствах для человека. Для промышленных применений L-аминокислоты получают главным образом ферментацией с использованием штаммов Corynebacterium.
Предпринимались многочисленные попытки улучшать способы производства L-аминокислот с использованием штаммов рода Corynebacterium. Среди них находятся исследования по технологии рекомбинантной ДНК, посредством которой осуществляются манипуляции с конкретными генами для нокдауна или ослабленной экспрессии для продуцирования L-аминокислот. Кроме того, имелись исследования, в которых каждый из генов, участвующих в биосинтезе L-аминокислоты, амплифицируется и анализируется на влияние на продукцию L-аминокислоты, модифицируя, посредством этого, штаммы Corynebacterium, продуцирующие L-аминокислоты. Кроме того, были попытки введения чужеродных генов, происходящих из других бактерий.
Тем не менее, все еще имеется потребность в разработке методик для улучшения потенциала производства полезных веществ, таких как L-аминокислоты.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
В одном воплощении предложен мутированный экспортер лизина. Например, указанный мутированный экспортер лизина может представлять собой полипептид, в котором аспарагин (Asn, N), который представляет собой 65-ую аминокислоту от N-конца аминокислотной последовательности SEQ ID NO: 1, заменен другой аминокислотой. Указанный полипептид может обладать активностью экспортера L-аминокислоты (например L-лизина, L-аргинина, их комбинации и т.д.)
Согласно другому воплощению предложен полинуклеотид, кодирующий указанный полипептид (мутированный экспортер лизина).
Согласно другому воплощению предложен рекомбинантный вектор, содержащий указанный полинуклеотид.
Согласно другому воплощению предложен рекомбинантный микроорганизм, содержащий указанный полипептид, полинуклеотид, кодирующий указанный полипептид, или рекомбинантный вектор, содержащий указанный полинуклеотид. Указанный рекомбинантный микроорганизм может обладать способностью экспортировать и/или продуцировать L-аминокислоту или повышенной способностью к осуществлению экспорта и/или продуцирования L-аминокислоты по сравнению со способностью немутантного микроорганизма.
Согласно другому воплощению предложен способ получения L-аминокислоты, включающий культивирование данного рекомбинантного микроорганизма или микроорганизма, продуцирующего L-аминокислоту.
Техническое решение
Согласно одному предложенному здесь воплощению предложена технология модификации штамма для продуцирования аминокислоты на основе исследования того, как амплификация гена, вовлеченного в продуцирование лизина у микроорганизмов Corynebacterium spp., влияет на их потенциал продукции лизина. В общем, стратегии увеличения потенциалов продукции лизина включают улучшение выходов продукции лизина или увеличение выходов (продуктивности) лизина в единицу времени. Как часть этого здесь предложено, что выход и/или продуктивность по лизину могут быть повышены посредством улучшения белка-экспортера L-лизина, который представляет собой мембранный белок, обладающий функцией высвобождения лизина, продуцированного посредством биосинтеза. Согласно одному воплощению настоящей заявки предложена технология, связанная с разработкой штамма, обладающего улучшенной способностью экспортировать L-аминокислоту (например L-лизин, L-аргинин, их комбинацию и т.д.) посредством улучшения белка-экспортера L-лизина и/или кодирующего его гена lysE.
Согласно одному воплощению предложен мутированный экспортер лизина. Например, указанный мутированный экспортер лизина может представлять собой полипептид, в котором аспарагин (Asn, N), который представляет собой 65-ую аминокислоту от N-конца аминокислотной последовательности SEQ ID NO: 1, заменен другой аминокислотой. Указанный полипептид может обладать активностью экспортера L-аминокислоты (например L-лизина, L-аргинина, их комбинации и т.д.).
Согласно другому воплощению предложен полинуклеотид, кодирующий указанный полипептид (мутированный экспортер лизина).
Согласно другому воплощению предложен рекомбинантный вектор, содержащий указанный полинуклеотид. Указанный рекомбинантный вектор может использоваться в качестве экспрессионного вектора.
Согласно другому воплощению предложен рекомбинантный микроорганизм, содержащий указанный полипептид, полинуклеотид, кодирующий указанный полипептид, или рекомбинантный вектор, содержащий указанный полинуклеотид. Указанный рекомбинантный микроорганизм может обладать способностью экспортировать и/или продуцировать L-аминокислоту или повышенной способностью к осуществлению экспорта и/или продуцирования L-аминокислоты по сравнению со способностью немутантного микроорганизма.
Согласно другому воплощению предложен способ получения L-аминокислоты, включающий культивирование рекомбинантного микроорганизма или микроорганизма, продуцирующего L-аминокислоту.
L-аминокислота может представлять собой L-лизин, L-аргинин или их комбинацию.
Указанный микроорганизм может представлять собой микроорганизм рода Corynebacterium или Escherichia.
Будет дано подробное описание настоящего раскрытия.
Термин «белок-экспортер лизина или экспортер лизина (LysE)» в том виде, как он здесь используется, может относиться к одному из трансмембранных белков, который способен высвобождать внутриклеточный биосинтетический продукт, например L-аминокислоту, такую как L-лизин, из клеток. В одном воплощении белок-экспортер лизина может иметь происхождение из штамма, принадлежащего к роду Corynebacterium, например, Corynebacterium glutamicum. Например, экспортер лизина может быть представлен аминокислотной последовательностью SEQ ID NO: 1.
Мутированный экспортер лизина может представлять собой полипептид, в котором в экспортер лизина введена мутация в виде аминокислотной замены. В одном воплощении мутированный экспортер лизина может представлять собой полипептид, в котором в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (N), заменена другой аминокислотой (например полипептид, представленный аминокислотной последовательностью, в которой в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (N), заменена другой аминокислотой). Более конкретно, мутированный экспортер лизина может представлять собой полипептид, в котором в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (N), заменена аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты (Е), глицина (G), аланина (А), серина (S), треонина (Т), цистеина (С), валина (V), лейцина (L), изолейцина (I), метионина (М), пролина (Р), фенилаланина (F), тирозина (Y), триптофана (W), аспарагиновой кислоты (D), глутамина (Q), гистидина (Н), лизина (K) и аргинина (R). В конкретном воплощении мутированный экспортер лизина может представлять собой полипептид, представленный SEQ ID NO: 3 (в котором 65-ая аминокислота SEQ ID NO: 1, аспарагин (N), заменена глутаминовой кислотой (Е)), но не ограничивается им. Такой полипептид с введенной мутацией может обладать функцией экспортера L-аминокислоты (например L-лизина, L-аргинина, их комбинации и т.д.).
Термин «микроорганизм, продуцирующий L-аминокислоту» в том виде, как он здесь используется, может относиться к микроорганизму, который имеет повышенный потенциал осуществления экспорта и/или продуцирования L-аминокислоты посредством введения мутации экспортера лизина, как описано выше, в микроорганизм со способностью осуществления экспорта и/или продуцирования L-аминокислоты, и/или в микроорганизм, который имеет потенциал осуществления экспорта и/или продуцирования L-аминокислоты посредством введения мутации экспортера лизина, как описано выше, в микроорганизм без (дефицитный по) способности осуществлять экспорт и/или продуцировать L-аминокислоту. Может подразумеваться, что термин «микроорганизм» в том виде, как он здесь используется, охватывает одноклеточные бактерии и может использоваться взаимозаменяемо с термином «клетка».
L-аминокислота может представлять собой L-лизин, L-аргинин или их комбинацию.
В одном воплощении микроорганизм может быть выбран из всех микроорганизмов, обладающих способностью экспортировать и/или продуцировать L-аминокислоту (например L-лизин, L-аргинин или их комбинацию). В одном воплощении указанный микроорганизм может представлять собой микроорганизм, обладающий природной способностью экспортировать и/или продуцировать L-аминокислоту, или микроорганизм, приобретший способность экспортировать и/или продуцировать L-аминокислоту посредством введения мутации в родительский штамм без или с очень малой способностью экспортировать и/или продуцировать L-аминокислоту.
Например, указанный микроорганизм может представлять собой по меньшей мере один, выбранный из группы, состоящей из микроорганизмов, принадлежащих к роду Corynebacterium и к роду Escherichia, которые обладают природной способностью экспортировать и/или продуцировать L-аминокислоту, или приобрели способность экспортировать и/или продуцировать L-аминокислоту посредством введения мутации в родительский штамм без или с очень малой способностью экспортировать и/или продуцировать L-аминокислоту. Микроорганизм, принадлежащий к роду Corynebacterium, может включать Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens и тому подобные, но не ограничиваясь ими. Более конкретно, микроорганизм, принадлежащий к роду Corynebacterium, может представлять собой Corynebacterium glutamicum. Микроорганизм, принадлежащий к роду Escherichia, может представлять собой Escherichia coli.
В одном воплощении микроорганизм, продуцирующий L-аминокислоту, в который введена мутация экспортера лизина, может обладать повышенной способностью к осуществлению экспорта и/или продуцированию L-аминокислоты по сравнению с немодифицированным микроорганизмом, принадлежащим к тому же самому виду (гомогенным). Термин «немодифицированный микроорганизм» может относиться к микроорганизму без введения или до введения мутации экспортера лизина.
Термин «микроорганизм до введения мутации экспортера лизина» в том виде, как он здесь используется, может быть выражен как «микроорганизм-хозяин» или «родительский штамм» для того, чтобы отличить его от «микроорганизма, продуцирующего L-аминокислоту», в который введена мутация экспортера лизина, посредством чего он обладает повышенной способностью экспортировать и/или продуцировать L-аминокислоту или приобрел способность экспортировать и/или продуцировать L-аминокислоту.
Термин «введение мутации экспортера лизина» в том виде, как он здесь используется, может относиться к любой манипуляции для введения мутированного экспортера лизина в микроорганизм-хозяин, как описано выше.
Термин «микроорганизм, продуцирующий L-аминокислоту, в который введена мутация экспортера лизина» может относиться к микроорганизму, содержащему:
(1) мутированный экспортер лизина, как описано выше, например полипептид, в котором 65-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1, аспарагин (N), заменена другой аминокислотой,
(2) полинуклеотид, кодирующий указанный полипептид (мутированный экспортер лизина), или
(3) рекомбинантный вектор, содержащий указанный полинуклеотид,
посредством этого обладающему повышенной способностью экспортировать и/или продуцировать L-аминокислоту или приобретшему способность экспортировать и/или продуцировать L-аминокислоту.
Микроорганизм, содержащий полинуклеотид, кодирующий мутированный экспортер лизина, например полипептид, в котором 65-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1, аспарагин (N), заменена другой аминокислотой, или рекомбинантный вектор, содержащий указанный полинуклеотид, может относиться к следующим:
(1) микроорганизм, дополнительно содержащий полинуклеотид или рекомбинантный вектор в дополнение к его собственному геному; и/или
(2) микроорганизм, содержащий полинуклеотид в качестве эндогенного гена, кодирующего экспортер лизина (например, гена LysE).
Выражение (2) «микроорганизм, содержащий полинуклеотид в качестве эндогенного гена, кодирующего экспортер лизина (например, гена LysE)» может относиться к (а) микроорганизму, в котором указанный полинуклеотид содержится (вставлен) посредством замены эндогенного гена, кодирующего экспортер лизина (например, гена LysE), и/или (б) микроорганизму, в котором эндогенный ген, кодирующий экспортер лизина (например, ген LysE) мутирован (модифицирован) таким образом, что он имеет нуклеиново-кислотную последовательность указанного полинуклеотида (т.е. нуклеиново-кислотную последовательность, кодирующую мутированный экспортер лизина) посредством технологии редактирования генома.
В одном воплощении экспортер лизина или кодирующий его ген могут иметь происхождение из микроорганизма-хозяина (эндогенный) или иметь происхождение из другого микроорганизма (экзогенный).
В одном воплощении микроорганизм, продуцирующий L-аминокислоту, может содержать полинуклеотид, кодирующий аминокислотную последовательность, в которой в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (N), заменена аминокислотой, выбранной из группы, состоящей из глутаминовой кислоты (Е), глицина (G), аланина (А), серина (S), треонина (Т), цистеина (С), валина (V), лейцина (L), изолейцина (I), метионина (М), пролина (Р), фенилаланина (F), тирозина (Y), триптофана (W), аспарагиновой кислоты (D), глутамина (Q), гистидина (Н), лизина (K) и аргинина (R), и/или рекомбинантный вектор, содержащий указанный полинуклеотид. В частности, микроорганизм, продуцирующий L-аминокислоту, может содержать полинуклеотид, кодирующий аминокислотную последовательность, где в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (N), заменена глутаминовой кислотой (Е), и/или рекомбинантный вектор, содержащий указанный полинуклеотид. Более конкретно, микроорганизм, продуцирующий L-аминокислоту, может представлять собой микроорганизм рода Corynebacterium, например, Corynebacterium glutamicum, содержащий полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO: 3, и/или рекомбинантный вектор, содержащий указанный полинуклеотид. Например, микроорганизм, продуцирующий L-аминокислоту, может представлять собой микроорганизм, депонированный под номером доступа KCCM12641P.
В отношении полинуклеотида (используется взаимозаменяемо с «геном») или полипептида (используется взаимозаменяемо с «белком»), в том виде, как здесь используется указанный термин, формулировки «содержащий специфическую нуклеиново-кислотную или аминокислотную последовательность», «состоящий из специфической нуклеиново-кислотной или аминокислотной последовательности» и «экспрессируемый в виде специфической нуклеиново-кислотной или аминокислотной последовательности» представляют собой взаимозаменяемые выражения с эквивалентными значениями в том смысле, что указанный полинуклеотид или полипептид по существу содержит специфическую нуклеиново-кислотную или аминокислотную последовательность. Кроме того, данные формулировки могут быть истолкованы как «содержащий по существу эквивалентную последовательность» (или как «не исключающий введения следующей мутации»), что происходит из-за мутации (делеции, замены, модификации и/или присоединения) в отношении специфической нуклеиново-кислотной или аминокислотной последовательности, поскольку указанный полинуклеотид или полипептид сохраняет его исходную функцию и/или желательную функцию.
В одном воплощении предложенная здесь нуклеиново-кислотная или аминокислотная последовательность может содержать мутанты, полученные традиционными способами мутирования, например прямой эволюцией и/или сайт-направленным мутагенезом в такой мере, что мутанты сохраняют исходную функцию или желательную функцию данной последовательности. В одном воплощении выражение, что полинуклеотид или полипептид «содержит или состоит из или экспрессируется специфической нуклеиново-кислотной или аминокислотной последовательностью» может означать, что полинуклеотид или полипептид по существу содержит или по существу состоит из (1) специфической нуклеиново-кислотной или аминокислотной последовательности или (2) нуклеиново-кислотной или аминокислотной последовательности, имеющей идентичность последовательности 60% или больше, 70% или больше, 80% или больше, 85% или больше, 90% или больше, 91% или больше, 92% или больше, 93% или больше, 94% или больше, 95% или больше, 96% или больше, 97% или больше, 98% или больше, 99% или больше, 99,5% или больше, или 99,9% или больше, где указанный полинуклеотид или полипептид сохраняет его исходную функцию и/или желательную функцию. Термин «исходная функция» в том виде, как он здесь используется, означает функцию экспортера лизина как такового (для аминокислотной последовательности) или функцию кодирования белка, имеющего функцию экспортера лизина (для нуклеиново-кислотной последовательности), и термин «желательная функция» означает функцию увеличения способности к продукции и/или экспорту L-аминокислоты (например L-лизина, L-аргинина или их комбинации) у микроорганизма или придания микроорганизму способности к продуцированию и/или экспорту L-аминокислоты (например, L-лизина, L-аргинина или их комбинации).
Для описанных здесь нуклеотидных последовательностей могут быть сделаны разные модификации в кодирующих областях в той мере, пока они не изменяют аминокислотные последовательности и/или функции белка (экспортер лизина), экспрессируемого с данных кодирующих областей, из-за вырожденности кодонов или при рассмотрении кодонов, предпочитаемых микроорганизмами, в которых указанный белок подлежит экспрессии.
В данном раскрытии термины «гомология» или «идентичность» могут относиться к степени родства между двумя данными аминокислотными последовательностями или последовательностями оснований и могут быть выражены в виде процентной доли. Термины «гомология» и «идентичность» часто могут использоваться взаимозаменяемо.
Гомологию или идентичность последовательности консервативного полинуклеотида или полипептида можно определять стандартными алгоритмами выравнивания, и можно совместно использовать штраф за пропуск по умолчанию, установленный применяемой программой. По существу гомологичные или идентичные последовательности могут гибридизоваться друг с другом в условиях умеренной или высокой жесткости вдоль по меньшей мере примерно 50%, 60%, 70%, 80% или 90% всей последовательности или полной длины. Очевидно, что для гибридизации полинуклеотид может включать не только полинуклеотид, содержащий кодон общего типа, но также и полинуклеотид, содержащий кодон с учетом вырожденности кодона.
Имеют ли любые две полинуклеотидные или полипептидные последовательности гомологию, сходство или идентичность, можно определять известным компьютерным алгоритмом, таким как программа «FASTA», например, с использованием параметров по умолчанию, например, представленным в Pearson et al (1988) [Proc. Natl. Acad. Sci. USA 85]: 2444. В качестве альтернативы, ее можно определять с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), как осуществляется в программе Needlema (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя) пакета EMBOSS (такого как программный пакет GCG (Devereux, J., et al, Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.], [ET AL, J MOLEC BIOL 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego, 1994, [CARILLO ETA/.] (1988) SIAM J Applied Math 48: 1073, и тому подобные). Например, гомология, сходство или идентичность могут быть определены с использованием BLAST или ClustalW Национального центра биотехнологической информации.
Гомологию, сходство или идентичность полинуклеотида или полипептида можно определять посредством сравнения информации по последовательности с использованием, например, компьютерной программы GAP, как, например, «Needleman et al. (1970), J Mol Biol. 48: 443», например, как описано в Smith and Waterman, Adv. Appl. Math (1981) 2: 482. В заключение, программа GAP может определять значение посредством деления числа аналогичных выровненных символов (т.е. нуклеотидов или аминокислот) на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать (1) матрицу двоичных сравнений (содержащую значения 1 для идентичности и 0 для неидентичности) и матрицу взвешенных сравнений (или матрицу замен EDNAFULL (EMBOSS версии NCBI NUC4.4)) «Gribskov et al (1986) Nucl. Acids Res. 14: 6745», как раскрыто в «Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979)»; (2) штраф 3,0 для каждого пропуска и дополнительный штраф 0,10 для каждого символа в каждом пропуске (или штраф 10 за открытие пропуска, штраф 0,5 за удлинение пропуска); и (3) отсутствие штрафа за концевые пропуски.
Кроме того, имеют ли любые две полинуклеотидные или полипептидные последовательности гомологию, сходство или идентичность, может быть подтверждено сравнением последовательностей саузерн-гибридизацией в определенных жестких условиях, и подходящие условия гибридизации могут быть определены способом в пределах объема релевантной технологии и хорошо известным специалисту в данной области (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
Для введения полинуклеотида или вектора специалист в данной области может подходящим образом применять способ трансформации, известный в данной области. Термин «трансформация» в том виде, как он здесь используется, может относиться к действию, посредством которого вектор, несущий полинуклеотид, кодирующий белок-мишень (экспортер лизина), вводится в микроорганизм-хозяина для экспрессии белка, кодируемого данным полинуклеотидом в клетке-хозяине. Введенный полинуклеотид может располагаться внутри или вне хромосомы микроорганизма-хозяина, при условии, что он экспрессируется в микроорганизме-хозяине. Кроме того, указанный полинуклеотид может содержать ДНК и/или РНК, кодирующую белок-мишень. Можно применять любые средства доставки, при условии, что они обеспечивают введение и экспрессию полинуклеотида в микроорганизме-хозяине. Например, полинуклеотид может принимать форму экспрессионной кассеты, которая содержит все элементы, необходимые для автономной экспрессии для того, чтобы указанный полинуклеотид вводился в микроорганизм-хозяин. Указанная экспрессионная кассета может содержать традиционные регуляторные элементы экспрессии, связанные функциональным образом с данным полинуклеотидом, такие как промотор, сигнал терминации транскрипции, сайт связывания рибосомы и/или сигнал терминации трансляции. Экспрессионная кассета может представлять собой экспрессионный вектор, который может реплицироваться сам по себе. Кроме того, сам по себе полинуклеотид может вводиться в клетку-хозяина и может связываться функциональным образом с необходимой последовательностью для экспрессии в клетке-хозяине. Термин «связанный функциональным образом» в том виде, как он здесь используется, может означать функциональную связь между регуляторным элементом экспрессии (например промотором) и полинуклеотидом таким образом, что регуляторный элемент экспрессии может контролировать (например инициировать) транскрипцию полинуклеотида, кодирующего белок-мишень (экспортер лизина). Функциональное связывание может осуществляться с использованием технологии генетической рекомбинации, известной в данной области, например, типичного сайт-специфичного расщепления и лигирования ДНК, но не ограничиваясь ей.
Можно использовать любой способ введения, при условии, что он обеспечивает трансформацию полинуклеотида в микроорганизм-хозяина. Известные в данной области методики трансформации могут быть правильно выбраны согласно микроорганизмам-хозяевам. Примеры методик трансформации, известных в данной области, могут включать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, поглощение, опосредованное PEG (полиэтиленгликоль), доставку, опосредованную DEAE(диэтиламиноэтил)-декстраном, способ с катионными липосомами, липофекцию и способ с ацетатом лития-DMSO (диметилсульфоксид), но не ограничиваются ими.
Специалист в данной области может выбрать подходящий способ введения мутации, такой как включение полинуклеотида в геном (хромосому) в клетке-хозяине или введение мутации, которая заставляет эндогенный ген (например, ген LysE) кодировать мутированный экспортер лизина. Например, введение мутации может осуществляться с использованием системы эндонуклеазы, направляемой РНК (например, по меньшей мере одной, выбранной из группы, состоящей из смеси (а) эндонуклеазы, направляемой РНК (например, белок Cas9 и т.д.), кодирующего ее гена или вектора, несущего указанный ген; и (б) РНК-проводника (т.е. единой РНК-проводника (епРНК) и т.д.), кодирующей ее ДНК или вектора, несущего указанную ДНК (например, смесь белка эндонуклеазы, направляемой РНК, и РНК-проводника), комплекса (например, рибонуклеопротеина (РНП)) и вектора (например, рекомбинантный вектор, несущий ген, кодирующий эндонуклеазу, направляемую РНК, и ДНК, кодирующую РНК-проводник, и т.д.), но не ограничиваясь ими.
Согласно другому воплощению предложен способ увеличения способности микроорганизма осуществлять экспорт и/или продуцировать L-аминокислоту, или придания микроорганизму способности осуществлять экспорт и/или продуцировать L-аминокислоту, включающий введение (трансформирование) мутированного экспортера лизина, например полипептида, в котором в аминокислотной последовательности SEQ ID NO: 1, 65-ая аминокислота от N-конца, аспарагин (Asn, N), заменена другой аминокислотой, кодирующего его полинуклеотида или рекомбинантного вектора, содержащего указанный полинуклеотид.
Мутированный экспортер лизина, полинуклеотид и микроорганизм являются такими, как описано выше.
Термин «вектор» в том виде, как он здесь используется, может относиться к конструкции ДНК, содержащей нуклеотидную последовательность, кодирующую белок-мишень, которая функциональным образом связана с подходящей регуляторной последовательностью, способной осуществлять экспрессию белка-мишени в подходящем хозяине. Такие регуляторные последовательности могут включать промотор, способный инициировать транскрипцию, возможную последовательность оператора для контроля такой транскрипции, последовательность, кодирующую подходящие сайты связывания рибосомы с мРНК, и/или последовательности, которые контролируют терминацию транскрипции и/или трансляции. При трансформировании в подходящий микроорганизм-хозяин указанный вектор может реплицироваться и функционировать с экспрессией белка-мишени независимо от генома хозяина или может интегрироваться в геном микроорганизма-хозяина.
Здесь можно использовать любой вектор без конкретных накладываемых на него ограничений, при условии, что он реплицируется в клетке-хозяине. Он может быть выбран из обычно используемых векторов. Примеры таких обычно используемых векторов могут включать плазмиды, космиды, вирусы, бактериофаги и тому подобное, которые могут находиться в природной или рекомбинантной форме. Например, фаговый вектор или космидный вектор иллюстрируется примерами pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A и Charon21A. Плазмидные векторы могут происходить от линий pBR, pUC, pBluescriptII, pGEM, pTZ, pCL и pET. Примеры вектора могут включать pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC, и тому подобные, но не ограничиваются ими.
Доступный здесь вектор может представлять собой известный экспрессионный вектор и/или вектор для включения полинуклеотида в хромосому клетки-хозяина. Включение полинуклеотида в хромосому клетки-хозяина может осуществляться с использованием любого способа, известного в данной области, например, гомологичной рекомбинацией, но не ограничиваясь ей. Указанный вектор может дополнительно нести селективный маркер для определения того, включен ли интересующий ген в хромосому. Указанный селективный маркер служит для отбора клетки, трансформированной вектором, то есть, для определения включения данного полипептида, и может быть выбран среди генов, которые придают селектируемые фенотипы, такие как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим агентам и экспрессия поверхностных белков. При обстоятельствах, когда селективный агент применяется к клеткам, только клетки, способные экспрессировать селективный маркер, могут выживать или проявлять отличительный фенотип так, что такие трансформированные клетки могут быть отобраны.
Согласно другому воплощению предложен способ получения L-аминокислоты, включающий стадию культивирования микроорганизма, продуцирующего указанную L-аминокислоту, в среде. Указанный способ может дополнительно включать стадию выделения L-аминокислоты из культивируемого микроорганизма, среды или обоих из них после стадии культивирования.
В данном способе стадию культивирования микроорганизма можно осуществлять известными способами периодического культивирования, способами непрерывного культивирования, способами культивирования с подпиткой и т.д., но без их конкретного ограничения. Здесь условия культивирования могут поддерживаться при оптимальном рН (например, рН от 5 до 9, в частности, рН от 6 до 8 и, наиболее конкретно, рН 6,8) с использованием основных соединений (например, гидроксид натрия, гидроксид калия или аммиак) или кислотных соединений (например, фосфорная кислота или серная кислота) или в аэробных условиях посредством подачи в культуру клеток кислорода или кислородсодержащей газовой смеси, но без их конкретных ограничений. Может поддерживаться температура культивирования от 20 до 45°С и, в частности, от 25 до 40°С, и клетки могут культивироваться в течение примерно 10-160 часов, но без ограничений в отношении них. L-аминокислота (например L-лизин, L-аргинин или их комбинация), продуцируемая культивированием, может экспортироваться в культуральную среду или оставаться в пределах клеток.
Доступная для культивирования среда может содержать по меньшей мере одно вещество, выбранное из сахара и углевода (например, глюкоза, сахароза, лактоза, фруктоза, мальтоза, мелассы, крахмал и сахароза), масла и жира (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирной кислоты (например, пальмитиновая кислота, стеариновая кислота и линолевая кислота), спирта (например, глицерин и этанол) и органической кислоты (например, уксусная кислота) в качестве источника углерода; по меньшей мере одно вещество, выбранное из азотсодержащих органических соединений (например, пептон, дрожжевой экстракт, мясной сок, солодовый экстракт, жидкий кукурузный экстракт, порошковый соевый жмых и мочевина), неорганических соединений (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония) в качестве источника азота; по меньшей мере одно вещество, выбранное из калия дигидрофосфата, дикалия фосфата или соответствующей им натрийсодержащей соли, в качестве источника фосфора; и по меньшей мере одно вещество, выбранное из других незаменимых стимулирующих рост веществ, таких как соли металлов (например, хлорид магния или сульфат железа), аминокислоты и/или витамины, не ограничиваясь ими.
На стадии выделения L-аминокислоты (например, L-лизина, L-аргинина или их комбинации) желательная аминокислота может быть отобрана из среды, культуры или микроорганизмов с использованием подходящего способа, известного в данной области, согласно способу культивирования. В качестве примера, стадия выделения может проводиться с использованием по меньшей мере одного способа, выбранного из центрифугирования, фильтрования, анионообменной хроматографии, кристаллизации и ВЭЖХ (высокоэффективная жидкостная хроматография), и желательная акриловая кислота может быть выделена из среды или микроорганизма с использованием любого подходящего способа, известного в данной области. Указанный способ может дополнительно включать стадию очистки до, одновременно или после стадии выделения.
Полезные эффекты
Введение мутации в эндогенный ген lysE заставляет штамм, продуцирующий лизин, увеличивать потенциал продукции L-аминокислоты (например L-лизина, L-аргинина или их комбинации).
Способ осуществления изобретения
Ниже настоящее раскрытие будет более подробно описано примерами, но данные примеры служат только иллюстративной цели и не предназначены для ограничения объема данного раскрытия. Специалисту в данной области будет очевидно, что описанные ниже примеры могут быть модифицированы без отступления от сущности данного раскрытия.
Пример 1: Конструирование библиотеки векторов для введения мутации в ОРС (открытая рамка считывания) гена lysE
Для обнаружения ферментов, обладающих улучшенной способностью к экспорту L-лизина, конструировали библиотеку векторов для получения мутированных генов lysE следующим образом.
С использованием набора для случайного мутагенеза GenemorphII (Stratagene) вводили мутации в ДНК фрагменты, включающие ген lysE (711 п.н.; SEQ ID NO: 2), где было введено от 0 до 4,5 мутаций/т.п.н. ДНК фрагмента. Проводили допускающую ошибки ПЦР (полимеразная цепная реакция) с использованием геномной ДНК Corynebacterium glutamicum АТСС 13032 (WT) в качестве матрицы и используя праймеры SEQ ID NO: 5 и 6 в Таблице 1. ПЦР проводили для реакционного раствора, содержащего геномную ДНК (500 нг) штамма WT (дикого типа), праймеры (125 нг каждого), реакционный буфер Mutazyme II (1×), смесь дНТФ (дезоксинуклеотидтрифосфат) (40 мМ) и ДНК-полимеразу Mutazyme II (2,5 U (ед.)) посредством 30 циклов денатурации при 94°С в течение 2 минут, денатурации при 94°С в течение 1 минуты, отжига при 56°С в течение 1 минуты и полимеризации при 72°С в течение 30 секунд, и с последующей полимеризацией при 72°С в течение 10 минут. ДНК фрагменты, полученные, как описано выше, подвергали взаимодействию с ферментом рестрикции BamHI-HF (NEB) при 37°С в течение 1 часа, лигировали с вектором pECCG117 (Корейский патент №10-0057684), который обрабатывали ферментом CIP (NEB) при 37°С в течение 30 минут, трансформировали в Е. coli DH5α, и затем высевали их на чашки на твердую лизогенную среду (LB), дополненную канамицином (25 мг/л).
После отбора 20 колоний трансформантов получали плазмиды и подвергали анализу нуклеиново-кислотной последовательности для подтверждения того, что мутации были введены в разные локусы с частотой 0,5 мутаций/т.п.н. Наконец, отбирали примерно 10000 колоний трансформированной Е. coli, экстрагировали из них плазмиды с использованием набора для получения плазмид (QIAGEN) с присвоением названия библиотека p117-lysE(mt). Кроме того, в качестве контроля для скрининга получали вектор, в котором lysE дикого типа был введен в вектор pECCGl 17. Генные фрагменты lysE дикого типа получали посредством ПЦР с использованием праймеров SEQ ID NO: 5 и 6 с получением вектора p117-lysE(WT), как описано выше. ПЦР проводили следующим образом: денатурация при 94°С в течение 2 минут, 30 циклов денатурации при 94°С в течение 1 минуты, отжиг при 56°С в течение 1 минуты, полимеризация при 72°С в течение 30 секунд и с последующей полимеризацией при 72°С в течение 10 минут.
Нуклеиново-кислотные последовательности использованных праймеров обобщены в Таблице 1:

Пример 2: Получение и скрининг штамма с введенной библиотекой векторов
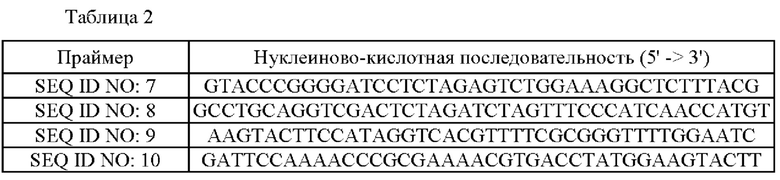
Для получения штаммов, в которых ген lysE был делетирован из Corynebacterium glutamicum АТСС13032 дикого типа, получали вектор для делеции гена lysE. А именно, получали рекомбинантный вектор посредством лигирования фрагментов ДНК (600 п.н. каждый), локализованных на 5' и 3' концах гена lysE, с вектором pDZ (US 9109242 В2). Праймеры SEQ ID NO: 7 и 8 синтезировали на основе нуклеиново-кислотной последовательности (SEQ ID NO: 2) гена lysE, и синтезировали праймеры SEQ ID NO: 9 и 10, соответствующие положениям 600 п.н. от них соответственно (Таблица 2).
Проводили ПЦР с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы и с использованием праймеров SEQ ID NO: 7 и 9 для получения фрагментов ДНК 5' конца гена lysE. Аналогично проводили ПЦР с использованием праймеров SEQ ID NO: 8 и 10 с получением фрагментов ДНК 3' конца гена lysE. ПЦР проводили следующим образом: денатурация при 94°С в течение 2 минут, 30 циклов денатурации при 94°С в течение 1 минуты, отжиг при 56°С в течение 1 минуты, полимеризация при 72°С в течение 30 секунд и с последующей полимеризацией при 72°С в течение 10 минут. Амплифицированные фрагменты ДНК очищали с использованием набора для очистки ПЦР-продуктов (QIAGEN) и затем использовали в качестве вставки ДНК фрагментов для получения вектора.
Вставленный ДНК фрагмент амплифицировали посредством ПЦР, как описано выше, и вектор pDZ (US 9109242 В2), который обрабатывали ферментом рестрикции XbaI и нагревали при 65°С в течение 20 минут, лигировали с использованием набора для клонирования Infusion, трансформировали в Е. coli DH5α, и затем наносили мазком на твердую среду LB, дополненную канамицином (25 мг/л). После отбора колонии, трансформированной вектором, в который был вставлен целевой ген, посредством ПЦР с использованием праймеров SEQ ID NO: 7 и 8, из нее получали плазмиду традиционным способом выделения плазмиды, которую назвали pDZ-ΔlysE.
Нуклеиново-кислотные последовательности использованных праймеров обобщены в Таблице 2:
Полученный вектор pDZ-ΔlysE трансформировали в Corynebacterium glutamicum АТСС13032 способом электрического импульса (Van der Rest et al., Appl. Microbiol. Biotecnol. 52: 541-545, 1999) с получением мутированного штамма, в котором ген lysE был делетирован посредством гомологичной хромосомной рекомбинации. Полученный штамм, в котором был делетирован ген lysE, был назван Corynebacterium glutamicum 13032::ΔlysE.
Штамм 13032::ΔlysE трансформировали библиотекой p117-lysE(mt), полученной в Примере 1, способом электрического импульса и высевали мазком на чашку с комплексной средой, дополненной канамицином (25 мг/л), с получением примерно 1000 колоний. Для получения контроля штамм 13032::ΔlysE трансформировали вектором p117-lysE(WT), как описано выше.
Комплексная среда для чашек (рН 7,0)
Глюкоза 10 г, пептон 10 г, говяжий экстракт 5 г, дрожжевой экстракт 5 г, бульон с сердечно-мозговым экстрактом 18,5 г, NaCl 2,5 г, мочевина 2 г, сорбит 91 г, агар 20 г (на литр дистиллированной воды).
Полученные библиотеки 13032::ΔlysE_p117(lysE(WT)) (контроль) и 13032::ΔlysE_p117(lysE(mt)) инокулировали, соответственно, в 96-луночный планшет с глубокими лунками Dome (Bioneer), содержащий 400 мкл посевной среды, и культивировали в инкубаторе-шейкере для микропланшетов (TAITEC) в следующих условиях: 32°С и 12000 об./мин в течение примерно 12 часов.
Посевная среда (рН 7,0)
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальция пантотенат 2000 мкг, никотинамид 2000 мкг (на литр дистиллированной воды).
1000 колоний, инкубированных выше, серийно разводили комплексной средой для чашек, дополненной 100 г/л L-лизина гидрохлорида, и подвергали определению MIC (минимальная ингибирующая концентрация), получая в результате 9 колоний, имеющих значительно повышенную MIC по сравнению с контрольным штаммом. Каждую колонию подвергали вторичному скринингу. Каждую колонию культивировали в 96-луночном планшете с глубокими лунками Dome (Bioneer), содержащем 400 мкл посевной среды, и культивировали в инкубаторе-шейкере для микропланшетов (TAITEC) при следующих условиях: 32°С и 12000 об./мин в течение примерно 12 часов. Вторичный скрининг проводили, корректируя исходную оптическую плотность (ОП) конечных культивируемых колоний в виде одного и того же значения, серийным разведением комплексной средой для чашек, дополненной 100 г/л L-лизина гидрохлорида, и осуществляли определение MIC. В результате была отобрана одна колония, имевшая значительно повышенную MIC по сравнению с контрольным штаммом, в который был введен ген lysE дикого типа, которая была названа 13032::lysE(mt) и которую использовали в примерах, приведенных ниже.
Пример 3: секвенирование мутированного гена lysE
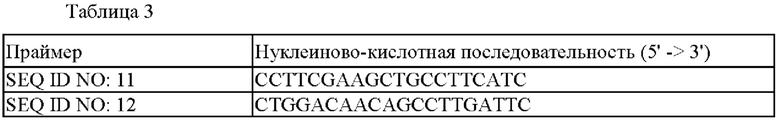
Для анализа нуклеиново-кислотных последовательностей генов, введенных в штамм 13032::lysE(mt), отобранный в Примере 2, амплифицировали генный фрагмент посредством ПЦР с использованием праймеров SEQ ID NO: 11 и 12. ПЦР проводили в таких же условиях, как и в Примере 1, амплифицированный ДНК фрагмент получали с использованием набора GeneAll Expin GEL SV (Сеул, КОРЕЯ) и подвергали анализу для определения нуклеиново-кислотной последовательности.
Нуклеиново-кислотные последовательности использованных праймеров обобщены в Таблице 3:
Результат анализа нуклеиново-кислотной последовательности амплифицированного гена показывает, что штамм 13032::lysE(mt) включает мутированный ген lysE, в котором нуклеиново-кислотная последовательность положений 193~195 от старт-кодона ОРС гена lysE, «ААТ» (WT), заменена на «GAA», кодируя, посредством этого, мутант экспортера L-лизина, в котором аминокислотный остаток в 65-ом положении от N-конца последовательности дикого типа (SEQ ID NO: 1), аспарагин (N), заменен глутаминовой кислотой (Е).
Пример 4: Получение вектора для введения мутированного гена lysE и штамма, в который введен этот мутированный ген lysE
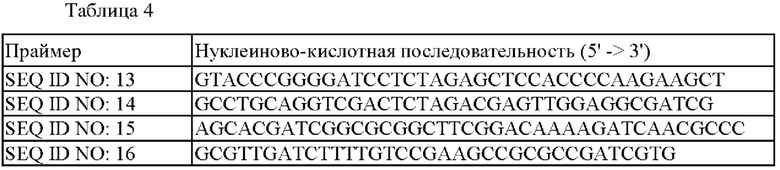
Для того, чтобы ввести мутацию N65E, которая была подтверждена в Примере 3, получали рекомбинантные вектора следующим образом. Используя геномную ДНК, экстрагированную из штамма WT (АТСС13032), в качестве матрицы, синтезировали праймеры SEQ ID NO: 13 и 14, показанные в Таблице 4, где рестрикционный сайт фермента рестрикции Xbal был вставлен в 5' фрагмент и 3' фрагмент, которые удалены примерно на 600 п.н. от области положений 193~195 гена lysE (SEQ ID NO: 2) в направлении выше и ниже соответственно. Кроме того, синтезировали праймеры SEQ ID NO: 15 и 16 для введения мутаций в виде замен нуклеотидов в положениях, удаленных на 600 п.н. от обоих концов данной области.
Нуклеиново-кислотные последовательности использованных праймеров обобщены в Таблице 4:
А именно, получали рекомбинантные вектора посредством лигирования ДНК фрагментов (600 п.н. каждый), расположенных на 5' и 3' концах гена lysE, с вектором pDZ (US 9109242 В2). ПЦР проводили с использованием геномной ДНК штамма WT (дикий тип) в качестве матрицы и с использованием праймеров SEQ ID NO: 13 и 15, с получением 5'-концевого генного фрагмента lysE (расположенного на 5' конце гена lysE). ПЦР проводили следующим образом: денатурация при 94°С в течение 2 минут, 30 циклов денатурации при 94°С в течение 1 минуты, отжиг при 56°С в течение 1 минуты, полимеризация при 72°С в течение 30 секунд и с последующей полимеризацией при 72°С в течение 10 минут. Аналогичным образом проводили ПЦР с использованием праймеров SEQ ID NO: 14 и 16 с получением 3'-концевого генного фрагмента lysE (расположенного на 3' конце гена lysE). Амплифицированные ДНК фрагменты очищали с использованием набора для очистки ПЦР-продуктов (QIAGEN) и затем использовали в качестве вставки ДНК фрагментов для получения вектора.
Вставленный ДНК фрагмент амплифицировали посредством ПЦР, как описано выше, и вектор pDZ, который был обработан ферментом рестрикции XbaI и нагрет при 65°С в течение 20 минут, лигировали с использованием набора для клонирования Infusion и трансформировали в Е. coli DH5α. Затем трансформированные штаммы наносили мазком на твердую среду LB, дополненную канамицином (25 мг/л). После отбора колонии, трансформированной вектором, в который был вставлен целевой ген, посредством ПЦР с использованием праймеров SEQ ID NO: 13 и 14 из нее получали плазмиду традиционным способом экстракции плазмид, которую назвали pDZ-lysE(N65E).
Полученный вектор pDZ-lysE(N65E) трансформировали в штамм Corynebacterium glutamicum KCCM11016P (KR патент №10-0159812), имеющий потенциал продукции лизина, методом электрического импульса. Этот полученный штамм, в котором в ген lysE была введена мутация в виде замены гетерологичным нуклеотидом (N65E), был назван KCCM11016P::lys(N65E).
Пример 5: Анализ потенциала продукции L-лизина мутантных штаммов tysE(mSE)
Штамм KCCM11016P::lysE(H65E), полученный в Примере 4, и родительский штамм KCCM11016P(N65) культивировали следующим образом так, чтобы измерять значения оптической плотности (ОП), выходы продукции L-лизина и скорости потребления сахара. Сначала каждый штамм инокулировали в колбу на 250 мл с угловыми перегородками, содержавшую 25 мл посевной среды, и затем культивировали при 30°С в течение 20 часов со встряхиванием при 200 об./мин. Затем 1 мл раствора посевной культуры инокулировали в колбу на 250 мл с угловыми перегородками, содержавшую 24 мл продукционной среды, и затем культивировали при 32°С в течение 72 часов со встряхиванием при 200 об./мин. Составы посевной среды и продукционной среды были следующими, а результаты культивирования приведены в Таблице 5 ниже.
Посевная среда (рН 7,0)
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальция пантотенат 2000 мкг, никотинамид 2000 мкг (на литр дистиллированной воды).
Продукционная среда (рН 7,0)
Глюкоза 90 г, (NH4)2SO4 30 г, соевый белок 20 г, мелассы, происходящие из сахарной свеклы, 10 г, KH2PO4 1,1 г, MgSO4⋅7H2O 1,2 г, биотин 2 мг, тиамин HCl 10 мг, кальция пантотенат 10 мг, никотинамид 30 мг, MnSO4 20 мг, FeSO4 20 мг, ZnSO4 1 мг, CuSO4 1 мг, СаСО3 30 г (на литр дистиллированной воды)
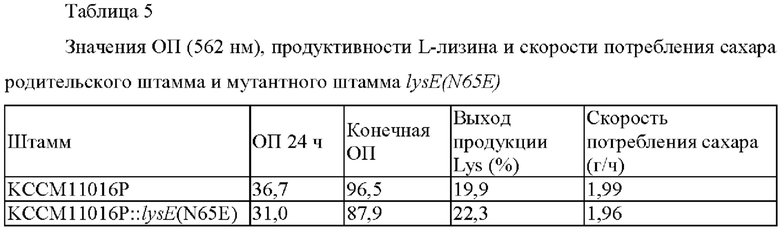
По сравнению с родительским штаммом KCCM11016P, мутант KCCM11016P::lysE(N65E), в который была введена мутация гена lysE, демонстрирует немного пониженное значение ОП и выход продукции L-лизина, повышенный примерно на 12,1%, при сохранении аналогичной скорости потребления сахара. Данные результаты доказывают, что мутация lysE(H65E), которая была отобрана в Примере 2, представляет собой мутацию, усиливающую способность к экспорту экспортера L-лизина. Штамм KCCM11016P::lysE(N65E) (названный «Corynebacterium glutamicum СМ03-1012»), который имеет повышенный потенциал продукции лизина, был депонирован в Корейском центре культур микроорганизмов, расположенный в Hongje-dong, Seodaemun-Gu, Сеул, Корея, 13 декабрая 2019 г., и ему был присвоен номер доступа KCCM12641P.
Пример 6: Получение штаммов, включающих мутированный ген lysE, кодирующий аминокислотные последовательности, содержащие в 65-ом положении аминокислоту, отличную от аспарагина
В аминокислотной последовательности SEQ ID NO: 1 65-ую аминокислоту заменяли каждой из аминокислот (18 аминокислот), отличных как от аспарагина (дикий тип), так и глутаминовой кислоты, активность которых была подтверждена в Примере 5. Для того, чтобы ввести мутацию в виде замены нуклеотида для кодирования каждого из таких 18 мутантов с заменой гетерологичной аминокислотой, каждый из рекомбинантных векторов получали следующим образом.
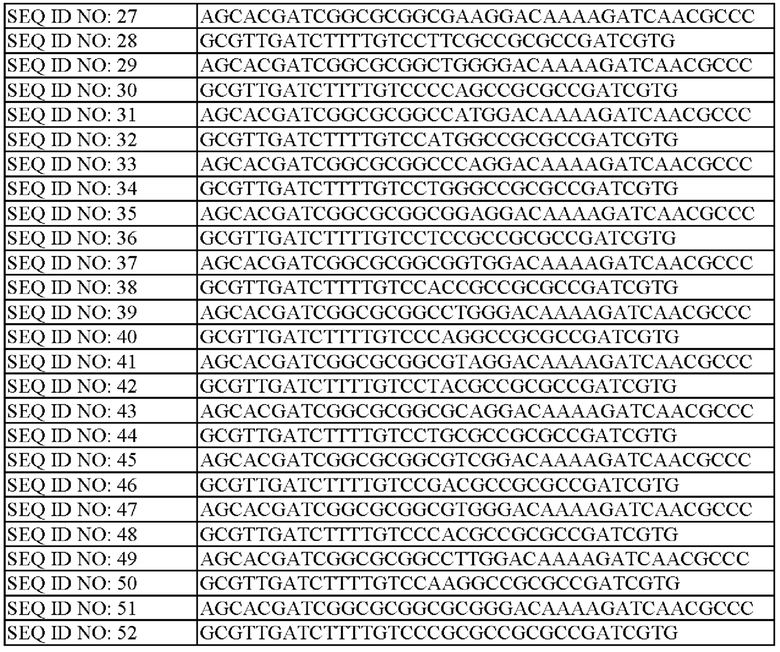
Используя геномную ДНК, экстрагированную из штамма WT (АТСС13032), в качестве матрицы, синтезировали праймеры SEQ ID NO: 17-52 (показаны в Таблице 6) для введения мутаций по замене нуклеотидов в 5' фрагмент и 3' фрагмент, которые удалены примерно на 600 п.н. от области положений 193-195 гена lysE в направлении выше и ниже. А именно, получали рекомбинантные вектора посредством лигирования ДНК фрагментов (600 п.н. каждый), расположенных на 5' и 3' концах гена lysE, с вектором pDZ (US 9109242 B2). Проводили ПЦР с использованием геномной ДНК штамма WT (дикий тип) в качестве матрицы, и используя праймеры SEQ ID NO: 13 и 17, с получением 5'-концевого генного фрагмента гена lysE (расположенного на 5' конце гена lysE). ПЦР проводили следующим образом: денатурация при 94°С в течение 2 минут, 30 циклов денатурации при 94°С в течение 1 минуты, отжиг при 56°С в течение 1 минуты, полимеризация при 72°С в течение 30 секунд и с последующей полимеризацией при 72°С в течение 10 минут. Аналогичным образом проводили ПЦР с использованием праймеров SEQ ID NO: 14 и 18 с получением 3'-концевого генного фрагмента lysE (расположенного на 3' конце гена lysE). Амплифицированные ДНК фрагменты очищали с использованием набора для очистки ПЦР-продуктов (QIAGEN) и затем использовали в качестве ДНК фрагментов для вставки для получения вектора.
Вставленный ДНК фрагмент амплифицировали посредством ПЦР, как описано выше, и вектор pDZ, который был обработан ферментом рестрикции XbaI и нагрет при 65°С в течение 20 минут, лигировали с использованием набора для клонирования Infusion и трансформировали в Е. coli DH5α. Затем трансформированные штаммы наносили мазком на твердую среду LB, дополненную канамицином (25 мг/л). После отбора колонии, трансформированной вектором, в который был вставлен целевой ген, посредством ПЦР с использованием праймеров SEQ ID NO: 13 и 14 из нее получали плазмиду традиционным способом экстракции плазмид, которую назвали pDZ-lysE(N65E).
Аналогичным образом,
получали pDZ-lysE(N65A) с использованием праймеров SEQ ID NO: 13 и 19, и SEQ ID NO: 14 и 20;
получали pDZ-lysE(N65V) с использованием праймеров SEQ ID NO: 13 и 21, и SEQ ID NO: 14 и 22;
получали pDZ-lysE(N65L) с использованием праймеров SEQ ID NO: 13 и 23, и SEQ ID NO: 14 и 24;
получали pDZ-lysE(N65I) с использованием праймеров SEQ ID NO: 13 и 25, и SEQ ID NO: 14 и 26;
получали pDZ-lysE(N65F) с использованием праймеров SEQ ID NO: 13 и 27, и SEQ ID NO: 14 и 28;
получали pDZ-lysE(N65P) с использованием праймеров SEQ ID NO: 13 и 29, и SEQ ID NO: 14 и 30;
получали pDZ-lysE(N65M) с использованием праймеров SEQ ID NO: 13 и 31, и SEQ ID NO: 14 и 32;
получали pDZ-lysE (N65W) с использованием праймеров SEQ ID NO: 13 и 33, и SEQ ID NO: 14 и 34;
получали pDZ-lysE(N65S) с использованием праймеров SEQ ID NO: 13 и 35, и SEQ ID NO: 14 и 36;
получали pDZ-lysE(N65T) с использованием праймеров SEQ ID NO: 13 и 37, и SEQ ID NO: 14 и 38;
получали pDZ-lysE(N65Q) с использованием праймеров SEQ ID NO: 13 и 39, и SEQ ID NO: 14 и 40;
получали pDZ-lysE(N65Y) с использованием праймеров SEQ ID NO: 13 и 41, и SEQ ID NO: 14 и 42;
получали pDZ-lysE(N65C) с использованием праймеров SEQ ID NO: 13 и 43, и SEQ ID NO: 14 и 44;
получали pDZ-lysE(N65D) с использованием праймеров SEQ ID NO: 13 и 45, и SEQ ID NO: 14 и 46;
получали pDZ-lysE(N65H) с использованием праймеров SEQ ID NO: 13 и 47, и SEQ ID NO: 14 и 48;
получали pDZ-lysE(N65K) с использованием праймеров SEQ ID NO: 13 и 49, и SEQ ID NO: 14 и 50; и
получали pDZ-lysE(N65R) с использованием праймеров SEQ ID NO: 13 и 51, и SEQ ID NO: 14 и 52.
Нуклеиново-кислотные последовательности использованных праймеров обобщены в Таблице 6:

Каждым полученным вектором трансформировали штамм Corynebacterium glutamicum KCCM11016P (патент Кореи №10-0159812), имеющий потенциал продукции лизина, способом электрического импульса. 18 штаммов, полученных выше, где в ген lysE были введены мутации замены гетерологичным нуклеотидом, были названы KCCM11016P::lysE(H65G), KCCM11016P::lysE(N65A), KCCM11016P::lysE(N65V), KCCM11016P::lysE(N65L), KCCM11016P::lysE(N65I), KCCM11016P::lysE(N65F), KCCM11016P::lysE(N65VP), KCCM11016P::lysE(N65M), KCCM11016P::lysE(N65W), KCCM11016P::lysE(N65S), KCCM11016P::lysE(N65T), KCCM11016P::lysE(N65Q), KCCM11016P::lysE(N65Y), KCCM11016P::lysE(N65C), KCCM11016P::lysE(N65D), KCCM11016P::lysE(N65H), KCCM11016P::lysE(N65K) и KCCM11016P::lysE(N65R) соответственно.
Пример 7: Анализ потенциала продукции L-лизина мутантных по lysE штаммов
Родительский штамм KCCM11016P(N65), штамм KCCM11016P::lysE(H65E), полученный в Примере 4, и 18 штаммов, полученных в Примере 6, культивировали таким же способом, как и в Примере 5, так, чтобы измерять значения ОП, выходы продукции L-лизина и скорости потребления сахара. Полученные результаты представлены в Таблице 7.

По сравнению с родительским штаммом KCCM11016P, мутант KCCM11016P::lysE(N65E), отобранный в Примере 5, демонстрирует немного пониженное значение ОП и выход продукции L-лизина, повышенный примерно на 15,7%, при сохранении аналогичной скорости потребления сахара, и все 18 штаммов, полученных в Примере 6, также демонстрируют равное или слегка пониженное значение ОП и выход продукции L-лизина, повышенный максимум примерно на 21,7%, при сохранении аналогичной скорости потребления сахара. Данные результаты доказывают, что положение, соответствующее в lysE 65-ой аминокислоте аспарагину, является важным в усилении способности к экспорту L-лизина.
Пример 8: Анализ потенциала продукции L-лизина отобранных мутантных по lysE штаммов
Для того, чтобы проанализировать эффекты мутаций гена lysE на другом родительском штамме, имеющем потенциал продукции L-лизина, использовали другой продуцирующий L-лизин штамм Corynebacterium glutamicum KCCM10770P(N65) (US 9109242 B2) в качестве родительского штамма для введения каждой из 4 мутаций, включая мутацию lysE(N65E), отобранную в Примере 3, и 3 мутации, отобранные из мутаций Примера 7. Каждым из 4 векторов: pDZ-lysE(N65E), полученный в Примере 4, и pDZ-lysE(N65K), pDZ-lysE(N65Q), и pDZ-lysE(N65E), полученные в Примере 6, трансформировали штамм Corynebacterium glutamicum KCCM10770P способом электрического импульса с получением 4 мутантных штаммов: KCCM10770P::lysE(N65E), KCCM10770P::lysE(N65K), KCCM10770P::lysE(N65Q) и KCCM10770P::lysE(N65L). Родительский штамм KCCM10770P и 4 мутантных штамма культивировали таким же способом, как в Примере 5, так, чтобы измерять значения ОП, выходы продукции L-лизина и скорости потребления сахара. Полученные результаты представлены в Таблице 8.

Как показано в Таблице 8, мутантный штамм, полученный введением мутации, отобранной в Примере 5, т.е. аминокислотной заменой 65-ой аминокислоты в SEQ ID NO: 1 на глутаминовую кислоту, в продуцирующий лизин штамм KCCM10770P (родительский штамм), демонстрирует аналогичную скорость потребления сахара, повышенное значение ОП и выход продукции L-лизина, повышенный примерно на 160,3%, по сравнению со значениями родительского штамма. Кроме того, дополнительные 3 мутантных штамма также демонстрируют аналогичную скорость потребления сахара, повышенное значение ОП и выход продукции L-лизина, повышенный примерно на 3,8-17,9% по сравнению со значениями родительского штамма. Данные результаты свидетельствуют о том, что, хотя количественное изменение ОП и увеличение выхода продукции L-лизина и различаются в зависимости от родительских штаммов, положение 65-ой аминокислоты lysE, аспарагина, играет важную роль в улучшении способности к экспорту L-лизина, что согласуется с результатами в Примере 7.
Пример 9: Анализ потенциала продукции L-аргинина отобранного мутантного по lysE штамма
Для того, чтобы проанализировать влияние мутированного экспортера L-лизина на способность к экспорту L-аргинина, вектор pDZ-lysE(N65E), полученный в Примере 4, трансформировали в продуцирующий L-аргинин штамм Corynebacterium glutamicum KCCM10741P(N65) (US 8034602 B2) способом электрического импульса. Такой полученный мутантный штамм, в котором мутация в виде замены гетерологичным нуклеотидом была введена в ген lysE, был назван KCCM10741P::lysE(N65E). Родительский штамм KCCM10741P и полученный штамм KCCM10741P::lysE(N65E) культивировали следующим способом, так, чтобы измерять значения ОП, выходы продукции L-аргинина и скорости потребления сахара. Сначала каждый штамм инокулировали в колбу на 250 мл с угловыми перегородками, содержавшую 25 мл посевной среды, и затем культивировали при 30°С в течение 20 часов со встряхиванием при 200 об./мин. Затем 1 мл раствора посевной культуры инокулировали в колбу на 250 мл с угловыми перегородками, содержавшую 24 мл продукционной среды, и затем культивировали при 32°С в течение 72 часов со встряхиванием при 200 об./мин. Составы посевной среды и продукционной среды были следующими, а результаты культивирования приведены в Таблице 9 ниже.
Посевная среда (рН 7,0)
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1 мг, кальция пантотенат 2 мг, никотинамид 2 мг (на литр дистиллированной воды).
Продукционная среда (рН 7,0)
Глюкоза 60 г, сульфат аммония 30 г, KH2PO4 1 г, MgSO4⋅7H2O 2 г, CSL (жидкий кукурузный экстракт) 15 г, NaCl 10 мг, дрожжевой экстракт 5 г, биотин 100 мг (на литр дистиллированной воды).

Как показано в Таблице 9, по сравнению с родительским штаммом KCCM10741P, штамм KCCM10741P::lysE(N65E) с введенной мутацией по lysE демонстрирует аналогичное значение ОП и скорость потребления сахара, и выход продукции L-аргинина, повышенный примерно на 11,8%. Данные результаты свидетельствуют о том, что мутация lysE(N65E) представляет собой мутацию, способную усиливать способность к экспорту L-аргинина, а также способность к экспорту L-лизина.
Из приведенного выше описания специалистам в данной области будет понятно, что настоящее раскрытие можно осуществлять в других конкретных формах без отступления от его сущности и важных характеристик. В данном отношении следует понимать то, что воплощения, описанные выше, являются во всех аспектах иллюстративными и не ограничивающими. Объем настоящей заявки следует истолковывать как находящийся в пределах объема настоящей заявки, все изменения или модификации происходили из значения и объема приложенной формулы изобретения и из ее эквивалентов, а не из подробного описания.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> МИКРООРГАНИЗМ, СОДЕРЖАЩИЙ ВАРИАНТ LysE, И СПОСОБ ПОЛУЧЕНИЯ L- АМИНОКИСЛОТЫ С ЕГО ИСПОЛЬЗОВАНИЕМ
<130> OPP20203446KR
<150> KR 10-2020-0017559
<151> 2020-02-13
<160> 52
<170> koPatentIn 3.0
<210> 1
<211> 236
<212> PRT
<213> Artificial Sequence
<220>
<223> белок lysE
<400> 1
Met Val Ile Met Glu Ile Phe Ile Thr Gly Leu Leu Leu Gly Ala Ser
1 5 10 15
Leu Leu Leu Ser Ile Gly Pro Gln Asn Val Leu Val Ile Lys Gln Gly
20 25 30
Ile Lys Arg Glu Gly Leu Ile Ala Val Leu Leu Val Cys Leu Ile Ser
35 40 45
Asp Val Phe Leu Phe Ile Ala Gly Thr Leu Gly Val Asp Leu Leu Ser
50 55 60
Asn Ala Ala Pro Ile Val Leu Asp Ile Met Arg Trp Gly Gly Ile Ala
65 70 75 80
Tyr Leu Leu Trp Phe Ala Val Met Ala Ala Lys Asp Ala Met Thr Asn
85 90 95
Lys Val Glu Ala Pro Gln Ile Ile Glu Glu Thr Glu Pro Thr Val Pro
100 105 110
Asp Asp Thr Pro Leu Gly Gly Ser Ala Val Ala Thr Asp Thr Arg Asn
115 120 125
Arg Val Arg Val Glu Val Ser Val Asp Lys Gln Arg Val Trp Val Lys
130 135 140
Pro Met Leu Met Ala Ile Val Leu Thr Trp Leu Asn Pro Asn Ala Tyr
145 150 155 160
Leu Asp Ala Phe Val Phe Ile Gly Gly Val Gly Ala Gln Tyr Gly Asp
165 170 175
Thr Gly Arg Trp Ile Phe Ala Ala Gly Ala Phe Ala Ala Ser Leu Ile
180 185 190
Trp Phe Pro Leu Val Gly Phe Gly Ala Ala Ala Leu Ser Arg Pro Leu
195 200 205
Ser Ser Pro Lys Val Trp Arg Trp Ile Asn Val Val Val Ala Val Val
210 215 220
Met Thr Ala Leu Ala Ile Lys Leu Met Leu Met Gly
225 230 235
<210> 2
<211> 711
<212> DNA
<213> Artificial Sequence
<220>
<223> ген lysE
<400> 2
atggtgatca tggaaatctt cattacaggt ctgcttttgg gggccagtct tttactgtcc 60
atcggaccgc agaatgtact ggtgattaaa caaggaatta agcgcgaagg actcattgcg 120
gttcttctcg tgtgtttaat ttctgacgtc tttttgttca tcgccggcac cttgggcgtt 180
gatcttttgt ccaatgccgc gccgatcgtg ctcgatatta tgcgctgggg tggcatcgct 240
tacctgttat ggtttgccgt catggcagcg aaagacgcca tgacaaacaa ggtggaagcg 300
ccacagatca ttgaagaaac agaaccaacc gtgcccgatg acacgccttt gggcggttcg 360
gcggtggcca ctgacacgcg caaccgggtg cgggtggagg tgagcgtcga taagcagcgg 420
gtttgggtaa agcccatgtt gatggcaatc gtgctgacct ggttgaaccc gaatgcgtat 480
ttggacgcgt ttgtgtttat cggcggcgtc ggcgcgcaat acggcgacac cggacggtgg 540
attttcgccg ctggcgcgtt cgcggcaagc ctgatctggt tcccgctggt gggtttcggc 600
gcagcagcat tgtcacgccc gctgtccagc cccaaggtgt ggcgctggat caacgtcgtc 660
gtggcagttg tgatgaccgc attggccatc aaactgatgt tgatgggtta g 711
<210> 3
<211> 236
<212> PRT
<213> Artificial Sequence
<220>
<223> мутант белка lysE (N65E)
<400> 3
Met Val Ile Met Glu Ile Phe Ile Thr Gly Leu Leu Leu Gly Ala Ser
1 5 10 15
Leu Leu Leu Ser Ile Gly Pro Gln Asn Val Leu Val Ile Lys Gln Gly
20 25 30
Ile Lys Arg Glu Gly Leu Ile Ala Val Leu Leu Val Cys Leu Ile Ser
35 40 45
Asp Val Phe Leu Phe Ile Ala Gly Thr Leu Gly Val Asp Leu Leu Ser
50 55 60
Glu Ala Ala Pro Ile Val Leu Asp Ile Met Arg Trp Gly Gly Ile Ala
65 70 75 80
Tyr Leu Leu Trp Phe Ala Val Met Ala Ala Lys Asp Ala Met Thr Asn
85 90 95
Lys Val Glu Ala Pro Gln Ile Ile Glu Glu Thr Glu Pro Thr Val Pro
100 105 110
Asp Asp Thr Pro Leu Gly Gly Ser Ala Val Ala Thr Asp Thr Arg Asn
115 120 125
Arg Val Arg Val Glu Val Ser Val Asp Lys Gln Arg Val Trp Val Lys
130 135 140
Pro Met Leu Met Ala Ile Val Leu Thr Trp Leu Asn Pro Asn Ala Tyr
145 150 155 160
Leu Asp Ala Phe Val Phe Ile Gly Gly Val Gly Ala Gln Tyr Gly Asp
165 170 175
Thr Gly Arg Trp Ile Phe Ala Ala Gly Ala Phe Ala Ala Ser Leu Ile
180 185 190
Trp Phe Pro Leu Val Gly Phe Gly Ala Ala Ala Leu Ser Arg Pro Leu
195 200 205
Ser Ser Pro Lys Val Trp Arg Trp Ile Asn Val Val Val Ala Val Val
210 215 220
Met Thr Ala Leu Ala Ile Lys Leu Met Leu Met Gly
225 230 235
<210> 4
<211> 711
<212> DNA
<213> Artificial Sequence
<220>
<223> мутант гена lysE, кодирующий мутант белка lysE (N65E)
<400> 4
atggtgatca tggaaatctt cattacaggt ctgcttttgg gggccagtct tttactgtcc 60
atcggaccgc agaatgtact ggtgattaaa caaggaatta agcgcgaagg actcattgcg 120
gttcttctcg tgtgtttaat ttctgacgtc tttttgttca tcgccggcac cttgggcgtt 180
gatcttttgt ccgaagccgc gccgatcgtg ctcgatatta tgcgctgggg tggcatcgct 240
tacctgttat ggtttgccgt catggcagcg aaagacgcca tgacaaacaa ggtggaagcg 300
ccacagatca ttgaagaaac agaaccaacc gtgcccgatg acacgccttt gggcggttcg 360
gcggtggcca ctgacacgcg caaccgggtg cgggtggagg tgagcgtcga taagcagcgg 420
gtttgggtaa agcccatgtt gatggcaatc gtgctgacct ggttgaaccc gaatgcgtat 480
ttggacgcgt ttgtgtttat cggcggcgtc ggcgcgcaat acggcgacac cggacggtgg 540
attttcgccg ctggcgcgtt cgcggcaagc ctgatctggt tcccgctggt gggtttcggc 600
gcagcagcat tgtcacgccc gctgtccagc cccaaggtgt ggcgctggat caacgtcgtc 660
gtggcagttg tgatgaccgc attggccatc aaactgatgt tgatgggtta g 711
<210> 5
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 5
cgggatccat ggtgatcatg gaaatcttca ttac 34
<210> 6
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 6
aaggatccct aacccatcaa catcagtttg 30
<210> 7
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 7
gtacccgggg atcctctaga gtctggaaag gctctttacg 40
<210> 8
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 8
gcctgcaggt cgactctaga tctagtttcc catcaaccat gt 42
<210> 9
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 9
aagtacttcc ataggtcacg ttttcgcggg ttttggaatc 40
<210> 10
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 10
gattccaaaa cccgcgaaaa cgtgacctat ggaagtactt 40
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 11
ccttcgaagc tgccttcatc 20
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 12
ctggacaaca gccttgattc 20
<210> 13
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 13
gtacccgggg atcctctaga gctccacccc aagaagct 38
<210> 14
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 14
gcctgcaggt cgactctaga cgagttggag gcgatcg 37
<210> 15
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 15
agcacgatcg gcgcggcttc ggacaaaaga tcaacgccc 39
<210> 16
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 16
gcgttgatct tttgtccgaa gccgcgccga tcgtg 35
<210> 17
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 17
agcacgatcg gcgcggcgcc ggacaaaaga tcaacgccc 39
<210> 18
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 18
gcgttgatct tttgtccggc gccgcgccga tcgtg 35
<210> 19
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 19
agcacgatcg gcgcggcagc ggacaaaaga tcaacgccc 39
<210> 20
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 20
gcgttgatct tttgtccgct gccgcgccga tcgtg 35
<210> 21
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 21
agcacgatcg gcgcggcgac ggacaaaaga tcaacgccc 39
<210> 22
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 22
gcgttgatct tttgtccgtc gccgcgccga tcgtg 35
<210> 23
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 23
agcacgatcg gcgcggccag ggacaaaaga tcaacgccc 39
<210> 24
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 24
gcgttgatct tttgtccctg gccgcgccga tcgtg 35
<210> 25
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 25
agcacgatcg gcgcggcgat ggacaaaaga tcaacgccc 39
<210> 26
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 26
gcgttgatct tttgtccatc gccgcgccga tcgtg 35
<210> 27
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 27
agcacgatcg gcgcggcgaa ggacaaaaga tcaacgccc 39
<210> 28
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 28
gcgttgatct tttgtccttc gccgcgccga tcgtg 35
<210> 29
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 29
agcacgatcg gcgcggctgg ggacaaaaga tcaacgccc 39
<210> 30
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 30
gcgttgatct tttgtcccca gccgcgccga tcgtg 35
<210> 31
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 31
agcacgatcg gcgcggccat ggacaaaaga tcaacgccc 39
<210> 32
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 32
gcgttgatct tttgtccatg gccgcgccga tcgtg 35
<210> 33
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 33
agcacgatcg gcgcggccca ggacaaaaga tcaacgccc 39
<210> 34
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 34
gcgttgatct tttgtcctgg gccgcgccga tcgtg 35
<210> 35
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 35
agcacgatcg gcgcggcgga ggacaaaaga tcaacgccc 39
<210> 36
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 36
gcgttgatct tttgtcctcc gccgcgccga tcgtg 35
<210> 37
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 37
agcacgatcg gcgcggcggt ggacaaaaga tcaacgccc 39
<210> 38
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 38
gcgttgatct tttgtccacc gccgcgccga tcgtg 35
<210> 39
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 39
agcacgatcg gcgcggcctg ggacaaaaga tcaacgccc 39
<210> 40
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 40
gcgttgatct tttgtcccag gccgcgccga tcgtg 35
<210> 41
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 41
agcacgatcg gcgcggcgta ggacaaaaga tcaacgccc 39
<210> 42
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 42
gcgttgatct tttgtcctac gccgcgccga tcgtg 35
<210> 43
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 43
agcacgatcg gcgcggcgca ggacaaaaga tcaacgccc 39
<210> 44
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 44
gcgttgatct tttgtcctgc gccgcgccga tcgtg 35
<210> 45
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 45
agcacgatcg gcgcggcgtc ggacaaaaga tcaacgccc 39
<210> 46
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 46
gcgttgatct tttgtccgac gccgcgccga tcgtg 35
<210> 47
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 47
agcacgatcg gcgcggcgtg ggacaaaaga tcaacgccc 39
<210> 48
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 48
gcgttgatct tttgtcccac gccgcgccga tcgtg 35
<210> 49
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 49
agcacgatcg gcgcggcctt ggacaaaaga tcaacgccc 39
<210> 50
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 50
gcgttgatct tttgtccaag gccgcgccga tcgtg 35
<210> 51
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 51
agcacgatcg gcgcggcgcg ggacaaaaga tcaacgccc 39
<210> 52
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 52
gcgttgatct tttgtcccgc gccgcgccga tcgtg 35
Изобретение относится к биотехнологии и представляет собой полипептид, вовлеченный в продуцирование L-аминокислоты, в котором 65-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1, аспарагин, заменена другой аминокислотой, и где L-аминокислота представляет собой L-лизин, L-аргинин или их комбинацию. Изобретение относится также к микроорганизму, продуцирующему L-аминокислоту, содержащему такой полипептид или полинуклеотид, кодирующий указанный полипептид, или рекомбинантный вектор, содержащий указанный полинуклеотид, и где L-аминокислота представляет собой L-лизин, L-аргинин или их комбинацию. Изобретение позволяет эффективно получать L-аминокислоту, представляющую собой L-лизин, L-аргинин или их комбинацию. 5 н. и 10 з.п. ф-лы, 9 табл., 9 пр.
1. Полипептид, вовлеченный в продуцирование L-аминокислоты, в котором 65-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1, аспарагин, заменена другой аминокислотой, и где L-аминокислота представляет собой L-лизин, L-аргинин или их комбинацию.
2. Полипептид по п. 1, в котором 65-ая аминокислота, аспарагин, заменена глутаминовой кислотой, аргинином, валином, лизином, гистидином, лейцином, аланином, фенилаланином, аспарагиновой кислотой, изолейцином, триптофаном, пролином, цистеином, тирозином, серином, треонином, метионином, глутамином или глицином.
3. Полинуклеотид, кодирующий полипептид по п. 1 или 2.
4. Полинуклеотид по п. 3, представленный нуклеиново-кислотной последовательностью SEQ ID NO: 4.
5. Рекомбинантный вектор для экспрессии полипептида по п. 1, содержащий полинуклеотид по п. 3.
6. Микроорганизм, продуцирующий L-аминокислоту, содержащий полипептид по п. 1, полинуклеотид, кодирующий указанный полипептид, или рекомбинантный вектор, содержащий указанный полинуклеотид, и где L-аминокислота представляет собой L-лизин, L-аргинин или их комбинацию.
7. Микроорганизм, продуцирующий L-аминокислоту, по п. 6, где указанный полипептид обладает активностью экспортера L-аминокислоты.
8. Микроорганизм, продуцирующий L-аминокислоту, по п. 6, где указанный полипептид или указанный полинуклеотид имеет происхождение из микроорганизма, принадлежащего к тому же самому виду микроорганизма, продуцирующего L-аминокислоту.
9. Микроорганизм, продуцирующий L-аминокислоту, по п. 6, где указанный микроорганизм принадлежит к роду Corynebacterium или Escherichia.
10. Микроорганизм, продуцирующий L-аминокислоту, по п. 6, где указанный микроорганизм представляет собой Corynebacterium glutamicum или Escherichia coli.
11. Микроорганизм, продуцирующий L-аминокислоту, по любому из пп. 6-10, имеющий улучшенные способность к экспорту или потенциал продукции L-аминокислоты по сравнению с немодифицированным микроорганизмом.
12. Микроорганизм, продуцирующий L-аминокислоту, по п. 7, где L-аминокислота представляет собой L-лизин.
13. Способ получения L-аминокислоты, включающий:
культивирование микроорганизма, продуцирующего L-аминокислоту, по любому из пп. 6-10 в среде, и где L-аминокислота представляет собой L-лизин, L-аргинин или их комбинацию.
14. Способ получения L-аминокислоты по п. 13, дополнительно включающий, после стадии культивирования,
выделение L-аминокислоты из культивируемого микроорганизма, среды или из них обоих.
15. Способ получения L-аминокислоты по п. 13, где L-аминокислота представляет собой L-лизин.
| CN 102747025 A, 24.10.2012 | |||
| US 7901913 B2, 08.03.2011 | |||
| US 8445241 B2, 21.05.2013 | |||
| KR 20010112494 A, 20.12.2001 | |||
| Устройство для передачи на расстояние показаний измерительных приборов | 1934 |
|
SU49960A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Кольман Я., Рем К-Г | |||
| Наглядная биохимия, Москва "Мир" 2000, стр | |||
Авторы
Даты
2023-10-11—Публикация
2021-02-10—Подача