ТЕХНИЧЕСКАЯ ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к производным дигидронафталина.
Точнее, данное изобретение относится к
(1) производным дигидронафталина, представленным формулой (I)
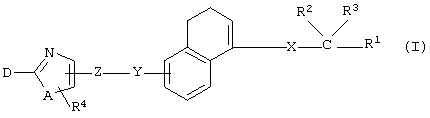
(где все символы имеют значения, определенные ниже) или их нетоксичным солям,
(2) способу их получения и
(3) лекарственному средству, включающему такое производное в качестве активного ингредиента.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ранее при изучении факторов транскрипции, связанных с экспрессией маркерных генов в дифференциации адипоцитов, главным объектом исследования ученых был рецептор, активируемый пролифератором пероксисомы (peroxisome proliferator activated receptor PPAR), который является одним из внутриклеточных рецепторов. Комплементарные ДНК PPAR были клонированы из организмов животных различных видов, и обнаружено большое количество изоформных генов, в частности, известны три типа (α, δ, γ) изоформ млекопитающих (см. J.Steroid Biochem. Molec. Biol., 51, 157 (1994); Gene Expression, 4, 281 (1995); Biochem. Biophys. Res. Commun., 224, 431 (1996); Mol. Endocrinology, 6, 1634 (1992)). Изоформа PPAR γ экспрессируется преимущественно в жировой ткани, иммуноцитах, надпочечниках, селезенке, тонком кишечнике. Изоформа PPAR α экспрессируется, главным образом, в жировой ткани, печени, сетчатке, а изоформа PPAR δ широко экспрессируется без специфичности для определенного вида ткани (см.Endocrinology, 137, 354 (1996)).
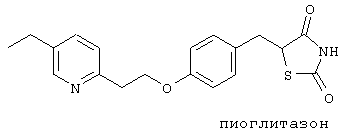
С другой стороны, представленные ниже производные тиазолидина известны в качестве лекарственных средств для лечения инсулиннезависимого сахарного диабета (non-insulin dependent diabetes mellitus NIDDM) и являются гипогликемическими лекарственными средствами для облегчения состояния гипергликемии у пациентов, страдающих сахарным диабетом. Они также эффективны для получения положительной динамики при гиперинсулинемии, толерантности к глюкозе и снижения содержания липидов в сыворотке крови, и поэтому считается, что они весьма полезны в качестве лекарственных средств для лечения инсулинорезистентности.

Одной из белковых мишеней в клетках для данных производных является PPAR γ, и установлено, что они повышают активность транскрипции PPAR γ (см. Endocrinology, 137, 4189 (1996); Cell, 83, 803 (1995), Cell, 83, 813 (1995); J. Biol. Chem., 270, 12953 (1995)). Таким образом, считается, что активатор PPAR γ (агонист), который повышает его транскрипторную активность, может быть полезным в качестве гипогликемического и/или гиполипидемического средства. Кроме того, считается, что поскольку, как известно, агонист PPAR γ способствует экспрессии самого белка PPAR γ (Genes & Development, 10, 974 (1996)), то средство, которое повышает экспрессию самого белка PPAR γ, а также и средство, активирующее PPAR γ, является клинически полезным.
PPAR γ связан с дифференциацией адипоцитов (см. J.Biol. Chem., 272, 5637 (1997), и Cell, 83, 803 (1995)). Известно, что производные тиазолидина, которые активируют данный рецептор, способствуют дифференциации адипоцитов. Ранее сообщалось, что производные тиазолидина увеличивают жировую массу и вызывают у человека повышение массы тела и ожирение (см. Lancet, 349, 952 (1997)). Поэтому полагают, что антагонисты, которые ингибируют активность PPAR γ, и средства, которые повышают экспрессию самого белка PPAR γ, также являются клинически полезными. С другой стороны, описано соединение, которое фосфорилирует белок PPAR γ и снижает его активность (Science, 274, 2100 (1996)). Это подразумевает, что лекарственное средство, которое не соединяется с белком PPAR γ в качестве лиганда, но ингибирует его активность, также может применяться в клинической практике.
Исходя из этого ожидается, что активаторы PPAR γ (агонисты) и регуляторы экспрессии PPAR γ, которые могут повышать экспрессию самого белка, являются полезными в качестве гипогликемических средств, гиполипидемических средств и средств для профилактики и/или лечения заболеваний, связанных с нарушениями обмена веществ, таких как сахарный диабет, ожирение, синдром X, гиперхолестеринемия и гиперлипопротеинемия и т.д., липемии, атеросклероза, гипертензии, болезней, протекающих с расстройством кровообращения, переедания и т.д.
С другой стороны, ожидается, что антагонисты, которые ингибируют транскрипторную активность PPAR γ, или регуляторы PPAR γ, которые ингибируют экспрессию самого белка, полезны в качестве гипогликемических средств и средств для профилактики и/или лечения заболеваний, связанных с нарушениями обмена веществ, таких как сахарный диабет, ожирение, синдром Х и т.д., липемии, атеросклероза, гипертензии, переедания и т.д.
Представленное ниже фибратное соединение (клофибрат как пример) известно в качестве гиполипидемического лекарственного средства.
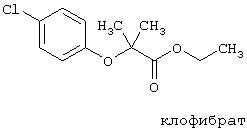
Считается также, что одним из белков-мишеней для фибратных соединений в клетках является PPAR α (см. Nature, 347, 645 (1990); J. Steroid Biochem. Molec. Biol., 51, 157 (1994); Biochemistry, 32, 5598 (1993)). Исходя из этого принято считать, что регуляторы PPAR α, которые могут активироваться фибратными соединениями, обладают способностью снижать содержание липидов в крови, и поэтому ожидается, что они полезны в качестве лекарственных средств для профилактики и/или лечения липемии и т.д.
Кроме того, ранее в публикации WO 9736579 сообщалось, что PPAR α обладает свойством подавления развития тучности. Сообщалось также, что повышение уровня содержания в крови холестерина липопротеинов высокой плотности (high density lipoprotein HDL) и снижение содержания холестерина липопротеинов низкой плотности (low density lipoprotein LDL), холестерина липопротеинов очень низкой плотности (very low density lipoprotein VLDL) и триглицеридов вызывается активацией PPAR α (J.Lipid Res., 39, 17 (1998)). Сообщалось также, что состав жирных кислот в крови, гипертензия и инсулинорезистентность улучшались введением безафибрата, который является одним из соединений класса фибратов (Diabetes, 46, 348 (1997)).
Следовательно, агонисты, которые активируют PPAR α, и регуляторы PPAR α, которые способствуют экспрессии белка PPAR α, полезны в качестве гиполипидемических средств и средств для лечения липемии, и ожидается, что они повышают содержания холестерина HDL, снижают содержание холестерина LDL и/или VLDL, ингибируют развитие атеросклероза и подавляют развитие тучности. Таким образом, предполагается, что они, возможно, могут быть полезными средствами для лечения и/или профилактики диабета в качестве гипогликемических средств, улучшения состояния при гипертензии, ослабления фактора риска синдрома Х и профилактики развития ишемических коронарных заболеваний.
С другой стороны, в ряде публикаций сообщалось о лигандах, которые активируют PPAR δ в значительной степени, или биологических активностях, связанных с PPAR δ. Иногда PPAR δ называют PPAR β или NUC1 в организме человека. Что касается активности PPAR δ, описанной ранее, то в описании WO 9601430 указывается, что hNUC1B (подтип PPAR, структура которого отличается от структуры NUC1 человека на одну аминокислоту) ингибирует активность транскрипции PPAR α человека и рецептора тироидного гормона. Ранее в публикации WO 9728149 сообщалось, что обнаружены соединения, которые обладают высоким сродством к белку PPAR δ и которые могут значительно активировать PPAR δ (то есть агонисты), и что эти соединения обладают активностью снижения содержания холестерина HDL (холестерина липопротеинов высокой плотности). Поэтому ожидается, что агонисты, которые могут активировать PPAR δ, обладают способностью повышать содержание HDL холестерина, и поэтому ожидается, что они полезны для ингибирования развития атеросклероза и его лечения, в качестве гиполипидемических средств и гипогликемических средств для лечения липемии, в качестве гипогликемических средств для лечения диабета, для ослабления фактора риска синдрома Х и для профилактики возникновения ишемических коронарных болезней.
Например, в описании WO 9828254 говорится, что соединение, представленное формулой (А)
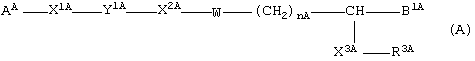
(где АA представляет собой необязательно замещенное арильное или гетероциклическое кольцо, Х1A представляет связь, атом О и т.д., Y1A представляет собой необязательно замещенный С1-8 алкилен, Х2A представляет собой связь, атом О и т.д., W представляет собой необязательно замещенный нафталин и т.д., В1A представляет собой карбоксил и т.д., Х3A представляет собой атом О и т.д., R3A представляет собой необязательно замещенный С1-8 алкил и т.д., nA представляет собой целое число 1-4), или его соль обладает гипогликемической активностью и гиполипидемической активностью (из описания групп выделены необходимые части).
В описании WO 9911255 указывается, что соединение, представленное формулой (В)
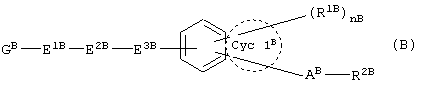
(где R1B представляет собой С1-8 алкил и т.д., R2B представляет собой -COOR3B (где R3B представляет собой водород или С1-4 алкил), АB представляет собой С1-8 алкилен и т.д., GB представляет собой карбоциклическое кольцо или гетероциклическое кольцо (указанное карбоциклическое кольцо и гетероциклическое кольцо являются необязательно замещенным С1-8 алкилом и т.д.), Е1B представляет собой С1-8 алкилен и т.д., Е2B представляет собой -О- и т.д., Е3B представляет собой связь и т.д., Сус1B представляет собой насыщенное, частично насыщенное или ненасыщенное карбоциклическое кольцо и т.д.) или его соль, обладает модулирующей активностью в отношении рецептора, активируемого пролифератором пероксисомы (из описания групп выделены необходимые части).
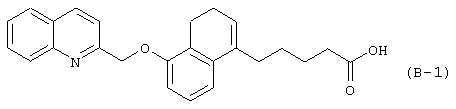
Кроме того, в примере 3 (35) указанного описания представлено соединение формулы (В-1)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для получения соединения, обладающего модулирующей активностью в отношении PPAR (PPAR-модулирующей активностью), авторами данного изобретения проведены серьезные исследования, и в результате было установлено, что соединение формулы (I) может удовлетворять названным целям и, таким образом, было совершено данное изобретение.
Данное изобретение относится к
(1) производному дигидронафталина, представленному формулой (I)
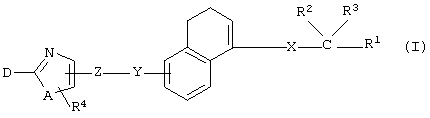
(где Х представляет собой (1) связь или (2) С1-4 алкилен,
Y представляет собой (1) -О- или (2) -S-,
Z представляет собой С1-4 алкилен,
А представляет собой (1) -О- или (2) -S-,
R1 представляет собой (1) COOR5, (2) CONH2, (3) CONHOH, (4) CH2OH, (5) CHO, (6) 1H-тетразол-5-ил или (7) 3,5-диоксоизооксазолин-4-ил,
R5 представляет собой (1) водород или (2) С1-8 алкил,
R2 и R3, каждый независимо, представляют собой (1) водород, (2) С1-8 алкил, (3) С1-8 алкокси или (4) С1-8 алкокси, замещенный фенилом,
R4 представляет собой (1) водород или (2) С1-8 алкил,
D представляет собой D1, D2 или D3,
D1 представляет собой
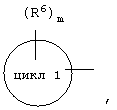
цикл 1 представляет собой частично или полностью необязательно насыщенный С3-10 моно- или бикарбоциклический арил,
D2 представляет собой
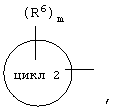
цикл 2 представляет собой частично или полностью необязательно насыщенный 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы,
D3 представляет собой С1-8 алкил,
R6 представляет собой (1) водород, (2) С1-8 алкил, (3) нитро, (4) NR7R8, (5) галоген, (6) С1-8 алкокси, (7) С1-8 алкилтио, (8) CF3, (9) CF3O, (10) частично или полностью необязательно насыщенный С3-10 моно- или бикарбоциклический арил или (11) частично или полностью необязательно насыщенный 3-10-членный моно- или бигетероциклический арил, содержащий 1-4-гетероатома, выбранных из атомов кислорода, азота или серы,
R7 и R8, каждый независимо, представляют собой (1) атом водорода или (2) C1-алкил, m равно 1-3),
или его нетоксичной соли,
(2) способу его получения и
(3) лекарственному средству, включающему такое соединение в качестве активного ингредиента.
Подробное описание изобретения
В описании С1-8 алкильная группа включает метильную, этильную, пропильную, бутильную, пентильную, гексильную, гептильную и октильную группы и их изомеры.
В описании С1-4 алкиленовая группа включает метиленовую, этиленовую, триметиленовую и тетраметиленовую группы и их изомеры.
В данном описании С1-5 алкиленовая группа включает метиленовую, этиленовую, триметиленовую, тетраметиленовую и пентаметиленовую группы и их изомеры.
В данном описании С1-2 алкиленовая группа включает метиленовую и этиленовую группы и их изомеры.
В данном описании С1-3 алкиленовая группа включает метиленовую, этиленовую и триметиленовую группы и их изомеры.
В данном описании С2-3 алкиленовая группа включает этиленовую и триметиленовую группы и их изомеры.
В данном описании С1-8 алкоксигруппа включает метокси, этокси, пропокси, бутокси, пентокси, гексилокси, гептилокси и октилоксигруппы и их изомеры.
В данном описании атом галогена означает атом хлора, атом брома, атом фтора или атом йода.
В данном описании 1-Н-тетразол-5-ильная группа означает
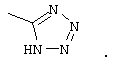
В данном описании 3,5-диоксоизооксазолидин-4-ильная группа означает
В данном описании частично или полностью необязательно насыщенный С3-10 моно- или бикарбоциклический арил, представленный как цикл 1 и R6 означает, например, циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклононан, циклодекан, циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклооктен, циклопентадиен, циклогексадиен, циклогептадиен, циклооктадиен, бензол, пентален, азулен, пергидроазулен, пергидропентален, инден, пергидроинден, индан, нафталин, тетрагидронафталин, пергидронафталин и т.д.
В данном описании в частично или полностью необязательно насыщенном 3-10-членном моно- или бигетероциклическом ариле, содержащем 1-4 гетероатома, выбранных из атомов кислорода, азота или серы, 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы, означает, например, пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, фуран, пиран, оксепин, тиофен, тиин, тиепин, оксазол, изоксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, оксазепин, оксадиазепин, тиадиазол, тиазин, тиадиазин, тиазепин, тиадиазепин, индол, изоиндол, индолизин, бензофуран, изобензофуран, бензотиофен, изобензотиофен, дитианафталин, индазол, хинолин, изохинолин, хинолизин, пурин, фталазин, птеридин, нафтиридин, хиноксалин, хиназолин, циннолин, бензоксазол, бензотиазол, бензимидазол, хромен, бензофуразан, бензотиадиазол, бензотриазол и т.д.
Кроме того, частично или полностью насыщенный 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы, означает азиридин, азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, оксиран, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, тиирран, тиэтан, дигидротиофен, тетрагидротиофен, дигидротиин (дигидротиопиран), тетрагидротиин (тетрагидротиопиран), дигидротиепин, тетрагидротиепин, пергидротиепин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиадиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин, тиоморфолин, оксатиан, индолин, изоиндолин, дигидробензофуран, пергидробензофуран, дигидроизобензофуран, пергидроизобензофуран, дигидробензотиофен, пергидробензотиофен, дигидроизобензотиофен, пергидроизобензотиофен, дигидроиндазол, пергидроиндазол, дигидрохинолин, тетрагидрохинолин, пергидрохинолин, дигидроизохинолин, тетрагидроизохинолин, пергидроизохинолин, дигидрофталазин, тетрагидрофталазин, пергидрофталазин, дигидронафтиридин, тетрагидронафтиридин, пергидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, пергидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, пергидрохиназолин, дигидроциннолин, тетрагидроциннолин, пергидроциннолин, бензоксатиан, дигидробензоксазин, дигидробензотиазин, пиразиноморфолин, дигидробензоксазол, пергидробензоксазол, дигидробензотиазол, пергидробензотиазол, дигидробензимидазол, пергидробензимидазол, диоксолан, диоксан, дитиолан, дитиан, диоксаиндан, безодиоксан, хроман, бензодитиолан, бензодитиан и т.д.
В данном изобретении регуляторы PPAR включают регуляторы всех типов PPAR: α, γ, δ, α+γ, α+δ, γ+δ и α+γ+δ. Предпочтительным видом регулятора является регулятор PPAR α, регулятор PPAR γ, регулятор PPAR δ, регулятор PPAR α+γ, регулятор PPAR α+δ, более предпочтителен регулятор PPAR α+γ. PPAR-регулятор также включает агонист PPAR и антагонист PPAR, предпочтительно агонист PPAR, более предпочтительно агонист PPAR α, агонист PPAR γ, агонист PPAR δ, агонист PPAR α+γ или агонист PPAR α+γ, особенно предпочтителен агонист PPAR α+γ.
Если не указано другого условия, все изомеры включаются в данное изобретение. Например, алкильная, алкокси и алиленовая группы включают прямые или разветвленные группы. Кроме того, изомеры двойной связи, цикла, конденсированного цикла (Е-, Z-, цис-, транс-изомер), изомеры, образующиеся в результате наличия асимметрического(их) атома(мов) углерода (R-, S-, α, β-изомер, энантиомер, диастереомер), оптически активные изомеры (D-, L-, d-, l-изомер), полярные соединения, полученные хроматографическим разделением (более полярное соединение, менее полярное соединение), равновесные соединения, их смеси в произвольных соотношениях и рацемические смеси также включены в данное изобретение.
В соответствии с данным изобретением, если не указано другого условия и, как очевидно для квалифицированного в данной области специалиста, символ

показывает, что данная связь располагается с противоположной стороны листа (то есть имеет место α-конфигурация), символ
 показывает, что данная связь расположена с лицевой стороны листа (то есть имеет место β-конфигурация), символ
показывает, что данная связь расположена с лицевой стороны листа (то есть имеет место β-конфигурация), символ
 показывает, что это α, β- или их смесь, и символ
показывает, что это α, β- или их смесь, и символ
 показывает, что это смесь α-конфигурации и β-конфигурации.
показывает, что это смесь α-конфигурации и β-конфигурации.
Соединение данного изобретения может подвергаться превращению в нетоксичную соль известными способами. Нетоксичная соль предпочтительно является фармацевтически приемлемой и растворимой в воде.
Нетоксичная соль включает, например, соли щелочных металлов (например, калия, натрия, лития и т.д.), соли щелочноземельных металлов (например, кальция, магния и т.д.), аммониевые соли (например, тетраметиламмония, тетрабутиламмония и т.д.), соли органических аминов (например, триэтиламина, метиламина, диметиламина, циклопентиламина, бензиламина, фенетиламина, пиперидина, моноэтаноламина, диэтаноламина, трис(гидроксиметил)метиламина, лизина, аргинина, N-метил-D-глюкамина и т.д.), кислотно-аддитивные соли, например соли неорганических кислот (например, гидрохлорид, гидробромат, гидройодат, сульфат, фосфат и нитрат и т.д.), соли органических кислот (например, ацетат, трифторацетат, лактат, тартрат, оксалат, фумарат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат, глюконат и т.д.) и т.д.
Кроме того, в данное изобретение включается сольват соединения данного изобретения формулы (I) и его солей со щелочными, щелочноземельными металлами, аммонием, органическими аминами и кислотно-аддитивных солей, перечисленных выше.
Сольват предпочтительно является нетоксичным и растворимым в воде. Подходящие сольваты означают, например, гидраты, спиртовые сольваты (например, этанола и т.д.) и т.д.
В данном изобретении Х предпочтительно представляет собой связь или С1-4 алкиленовую группу, более предпочтительно С1-4 алкиленовую группу. С1-4 алкиленовая группа предпочтительно представляет собой метилен (-СН2), этилен (-(СН2)2-) или триметилен (-(СН2)3-), более предпочтительно метилен (-CH2-).
В данном изобретении Y предпочтительно представляет собой группу -О- или группу -S-, более предпочтительно группу -O-.
В данном изобретении Z предпочтительно представляет собой метилен (-СН2-) или этилен (-(СН2)2-), более предпочтительно этилен (-(СН2)2-).
В данном изобретении R1 предпочтительно представляет собой группу COOR5, группу СН2OH, 1-Н-тетразол-5-ильную группу, более предпочтительно группу COOR5.
В данном изобретении R2 и R3 предпочтительно представляют собой атом водорода, С1-8 алкил или С1-8 алкокси, более предпочтительно атом водорода.
В данном изобретении R4 предпочтительно представляет собой С1-8 алкильную группу, более предпочтительно метильную группу.
В данном изобретении D предпочтительно представляет собой D1 или D2, более предпочтительно D1.
В данном изобретении А предпочтительно представляет собой группу -О- или -S-, более предпочтительно группу -O-.
В данном изобретении цикл 1 предпочтительно представляет собой частично или полностью необязательно насыщенный С3-7 монокарбоциклический арил, более предпочтительно С3-7 монокарбоциклический арил, еще более предпочтительно бензол.
В данном изобретении цикл 2 предпочтительно представляет собой частично или полностью необязательно насыщенный 3-10-членный моно- или бигетероциклический арил, содержащий 1-2 гетероатома, выбранных из атомов кислорода, азота или серы, более предпочтительно частично или полностью необязательно насыщенный 3-7-членный моногетероциклический арил, содержащий 1-2 гетероатома, выбранных из атомов кислорода, азота или серы, еще более предпочтительно пиридин, тетрагидропиридин, пиперидин, пиперазин, тиоморфолин, морфолин, пиразол, пиразин, 1,3-диоксаиндан.
Среди соединений, представленных формулой (I), предпочтительными являются соединения, представленные формулой

(где все символы принимают значения, описанные выше),
соединения, представленные формулой (1-В)

(где все символы принимают значения, описанные выше),
соединения, представленные формулой (I-С)
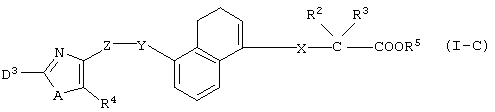
(где все символы принимают значения, описанные выше).
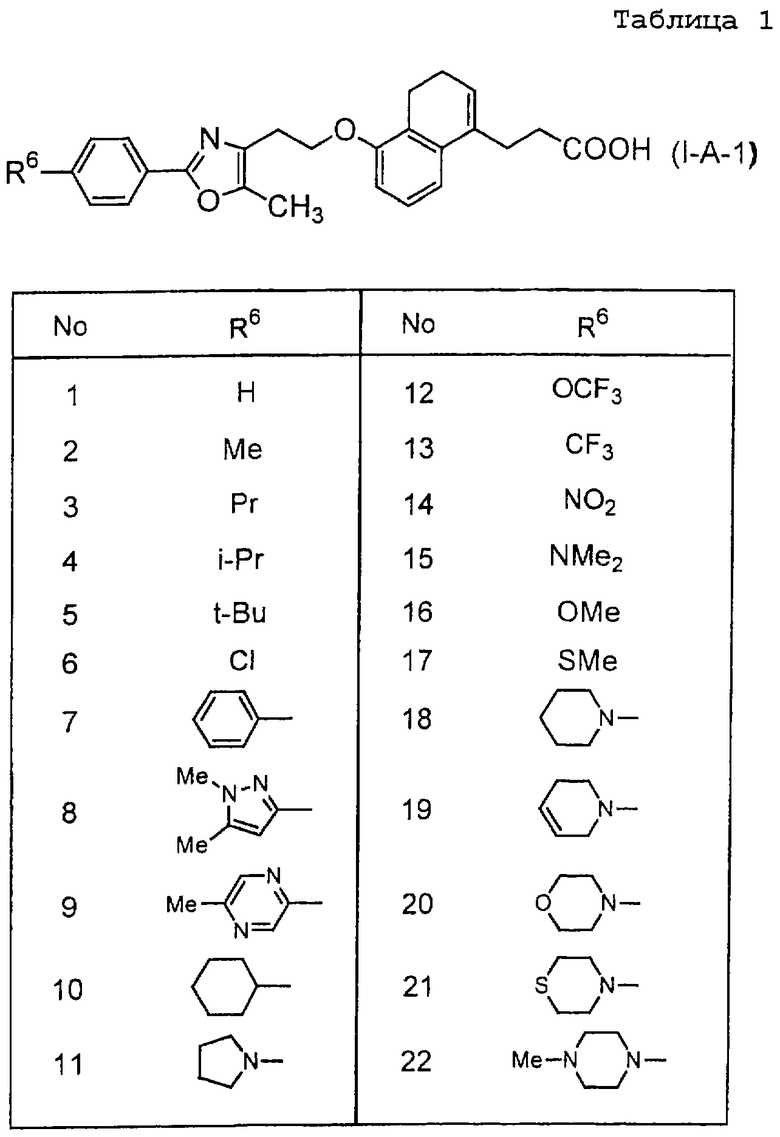
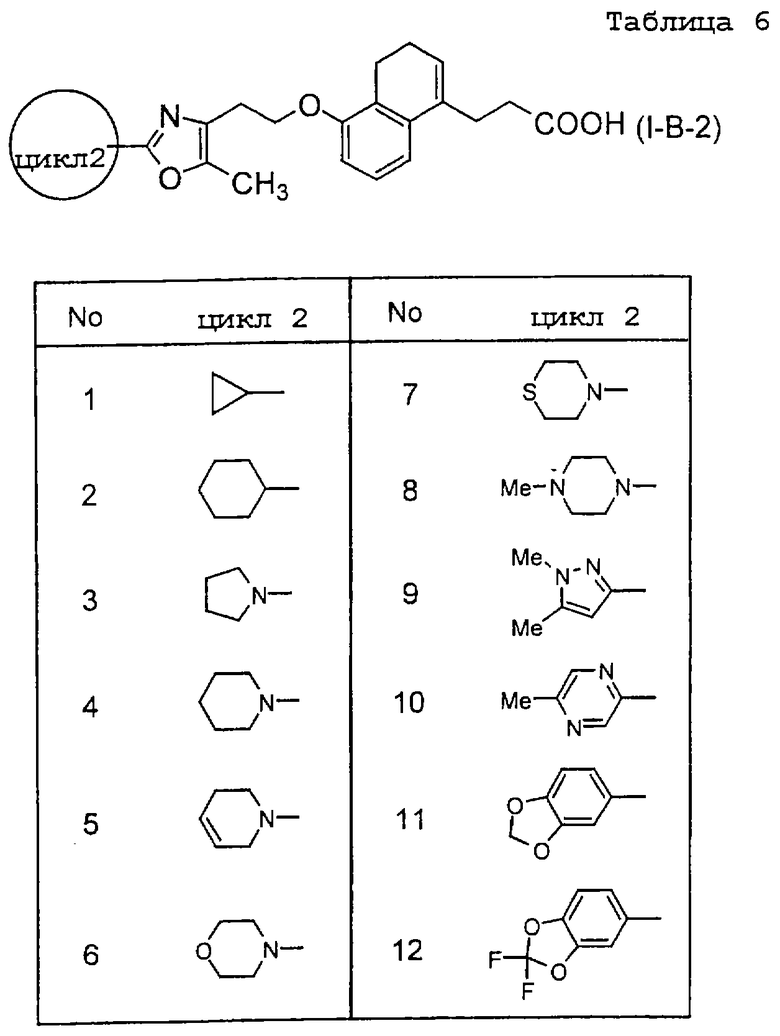
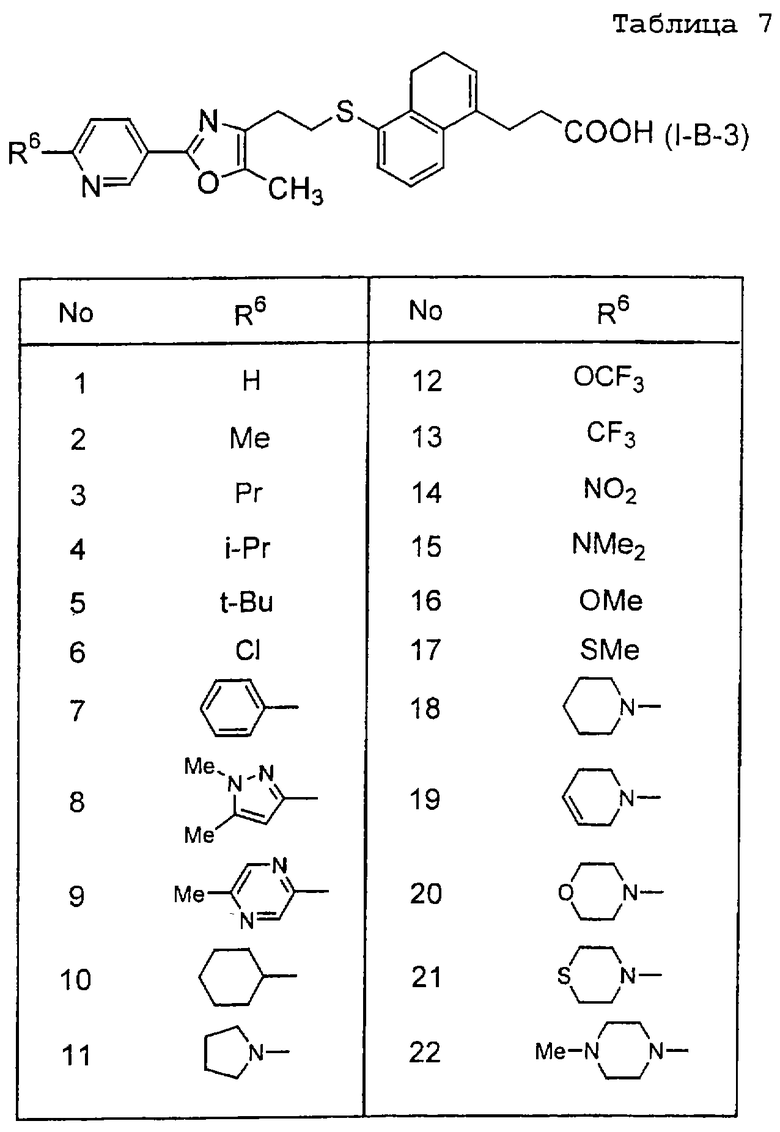
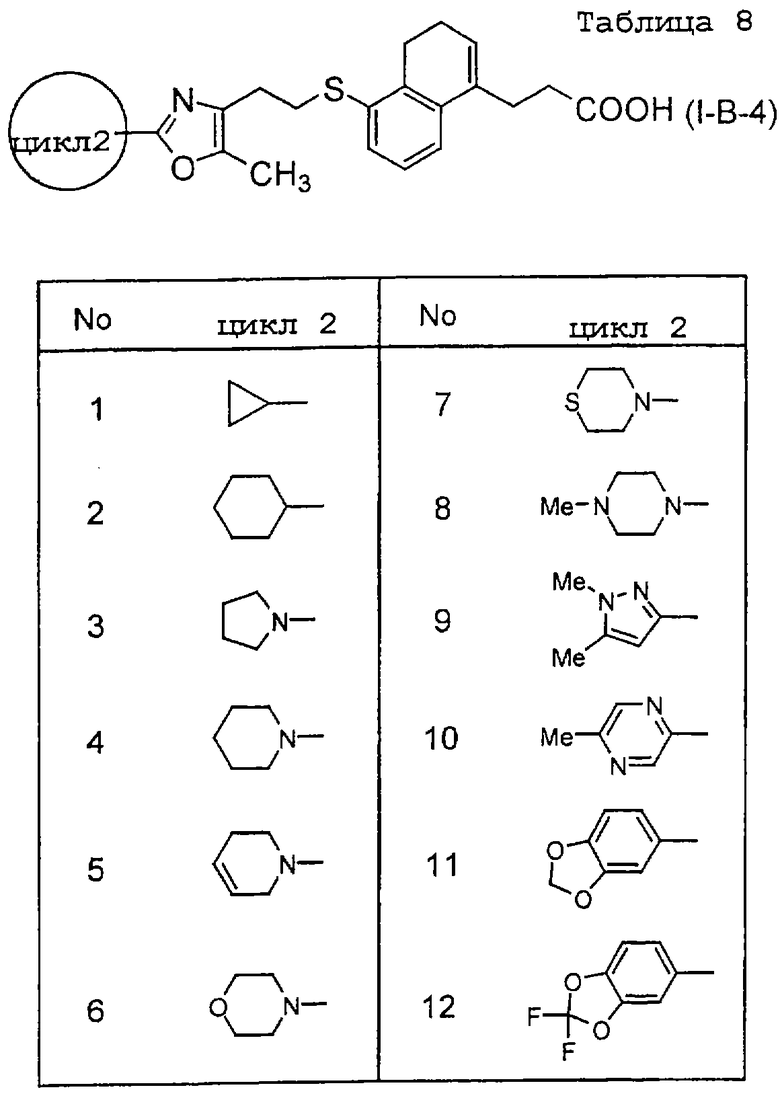
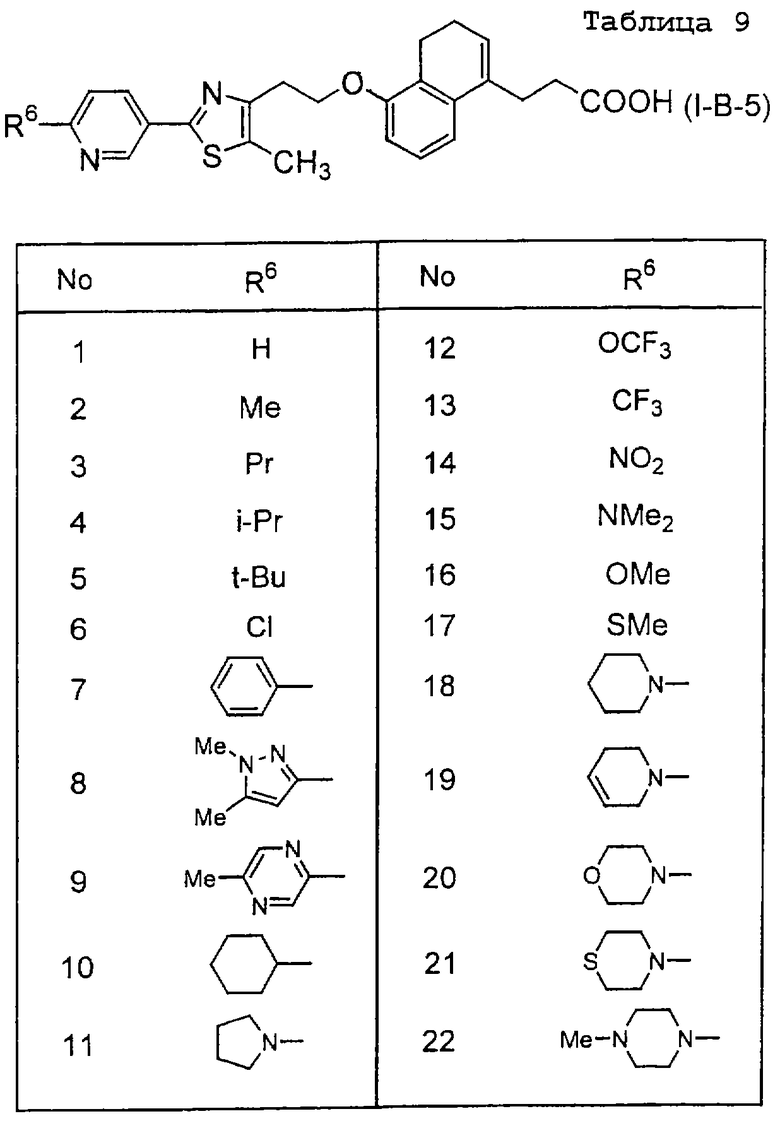
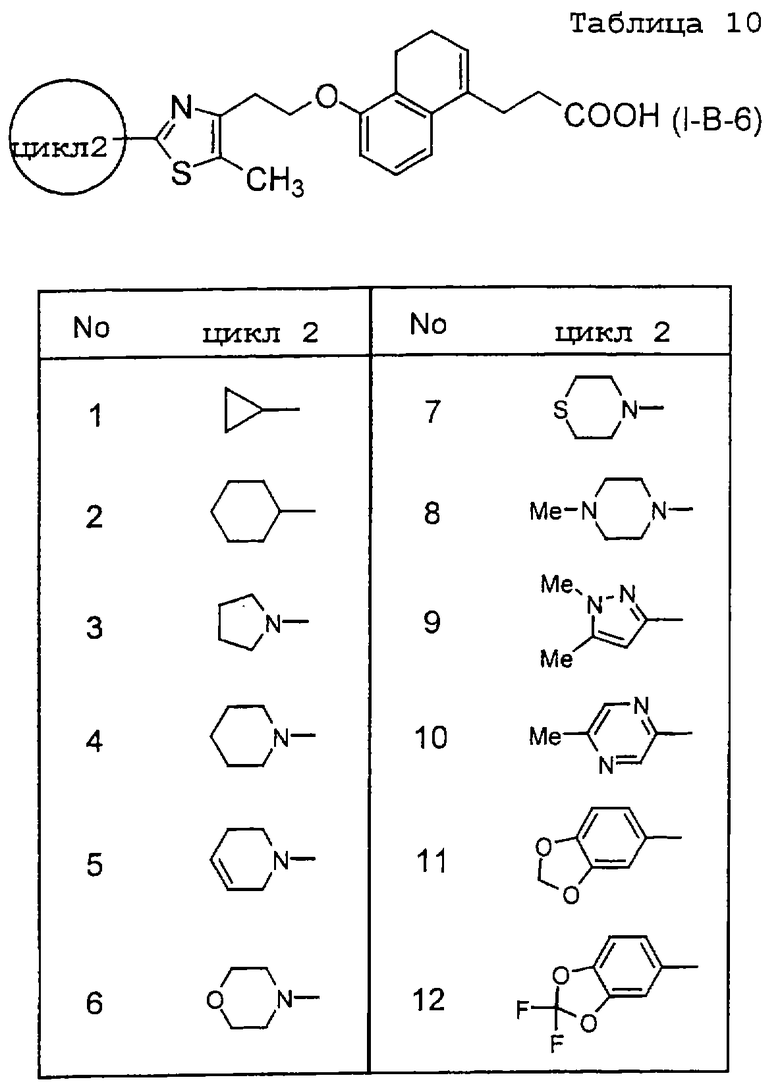
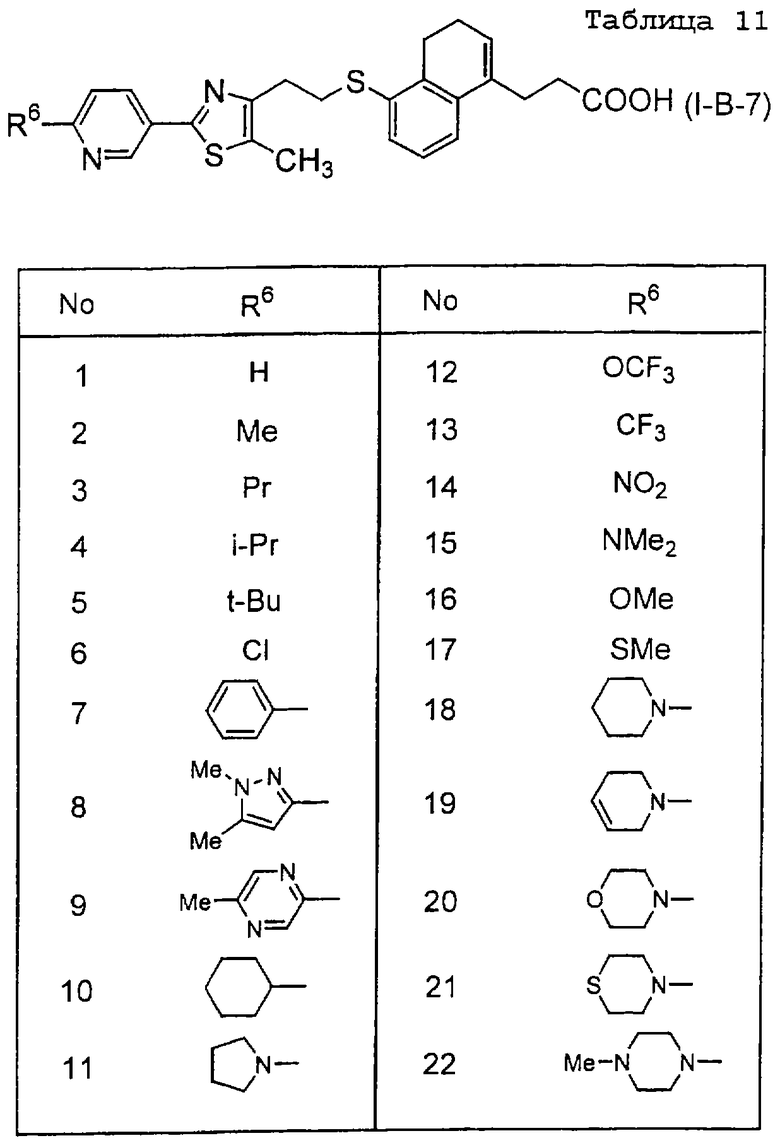
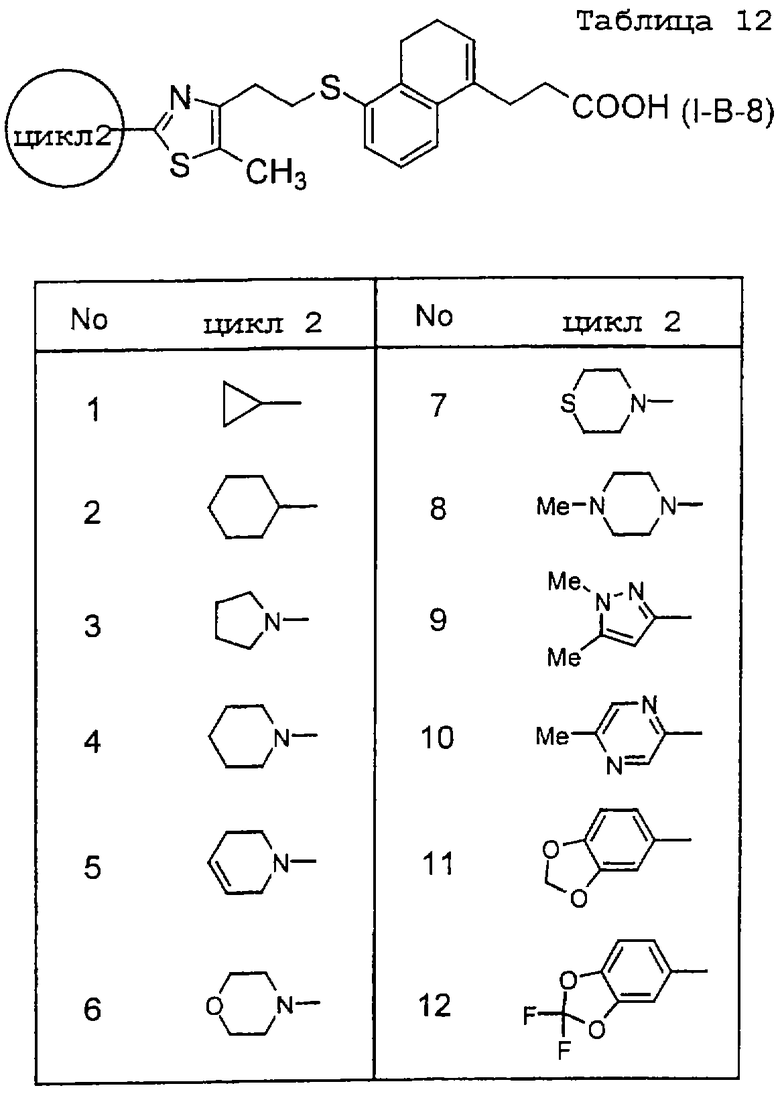
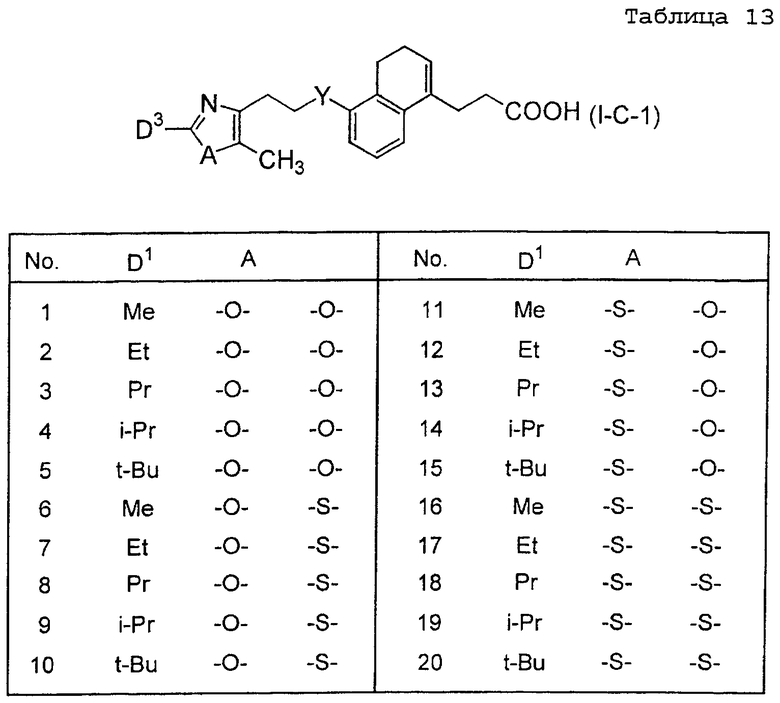
Примеры соединений данного изобретения включают соединения, представленные в таблицах 1-13, соединения описанные в примерах, а также их нетоксичные соли.
В таблицах Me представляет собой метильную группу, Et представляет собой этильную группу, Pr представляет собой пропильную группу, i-Pr представляет собой изопропильную группу, t-Bu представляет собой трет-бутильную группу, а другие символы принимают значения, описанные выше.
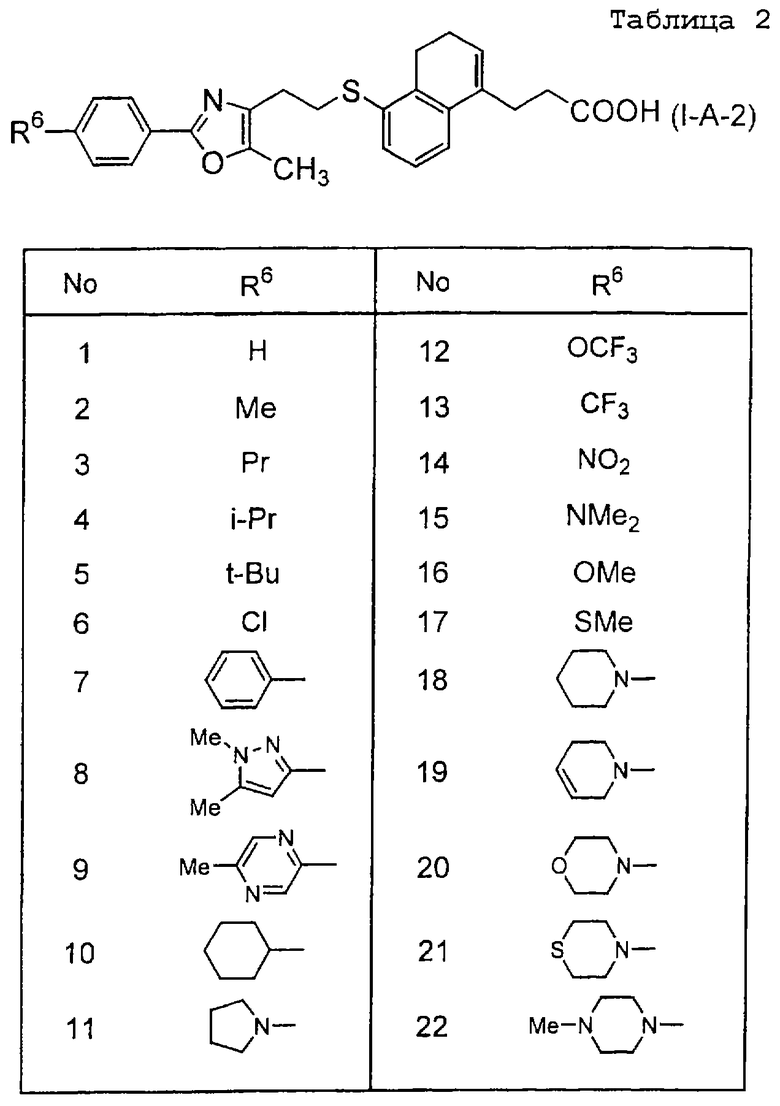
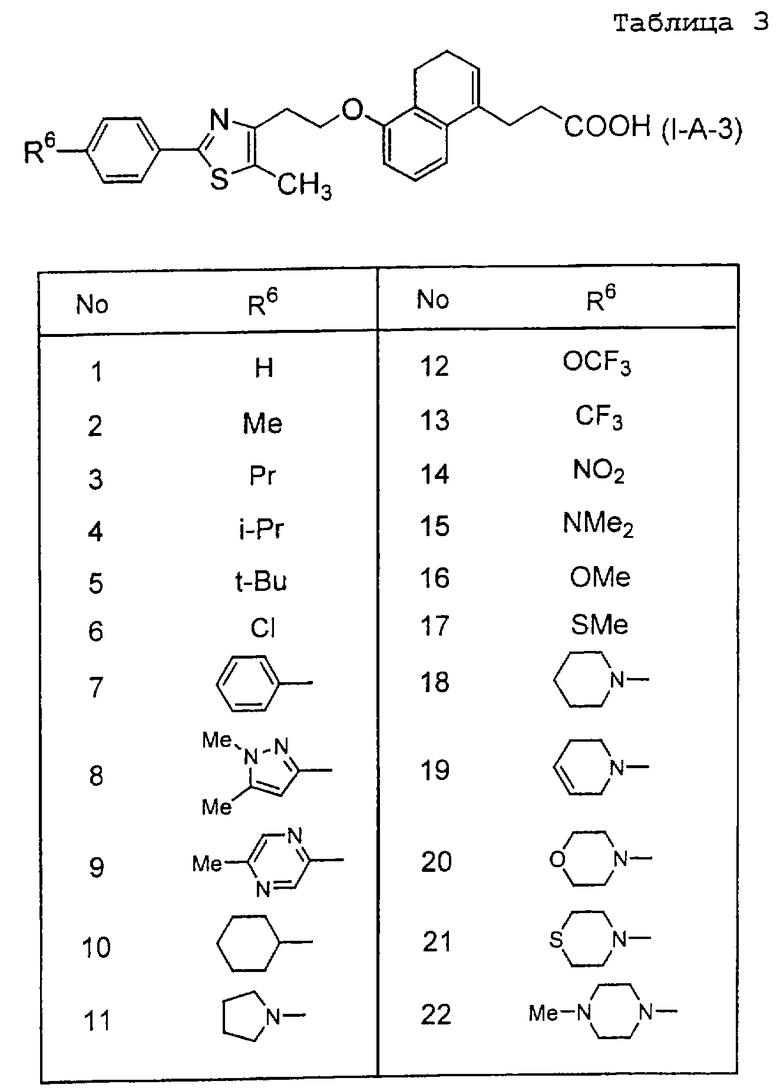
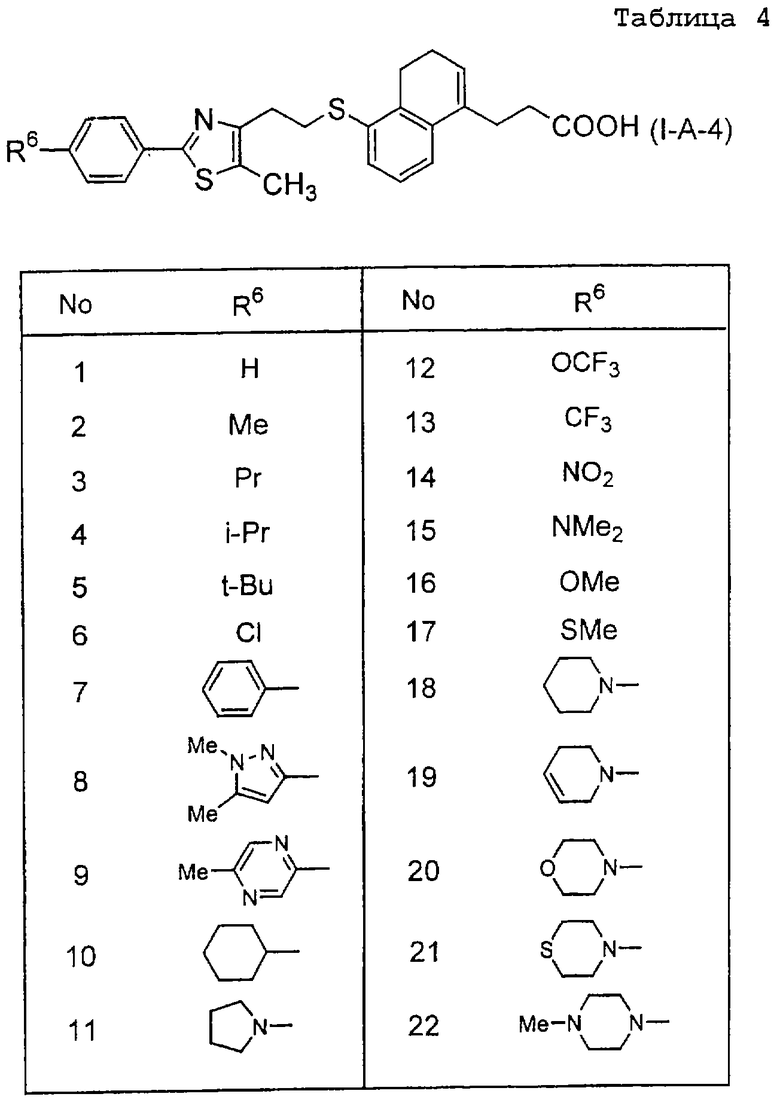
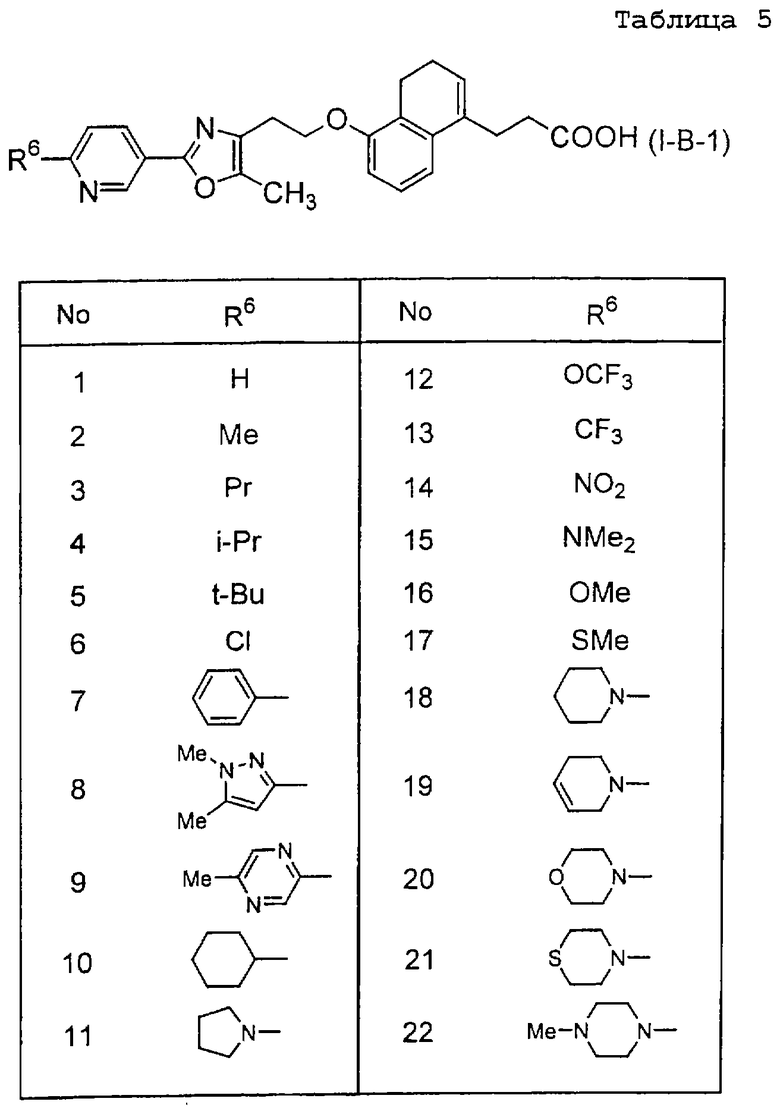
(1) Среди соединений данного изобретения, представленных формулой (I), соединение, в котором R1 представляет собой группу COOR5, R5 представляет собой C1-8 - алкильную группу, то есть соединения формулы (IA)
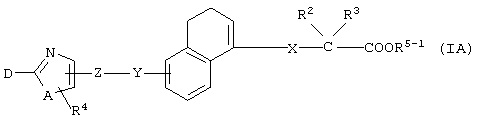
(где R5-1 представляет собой C1-8 алкильную группу, а другие символы принимают значения, описанные выше), могут быть получены следующими способами.
Соединение, представленное формулой (IA), может быть получено взаимодействием соединения формулы (II)
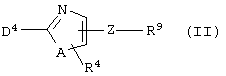
(где R9 представляет собой уходящую группу (например, атом галогена, мезилокси- или тозилоксигруппу и т.д.), D4 принимает те же значения, что и D, при условии, что, когда это необходимо, аминогруппа, входящая в группу D4, является защищенной, а другие символы принимают значения, описанные выше) с соединением формулы (II)
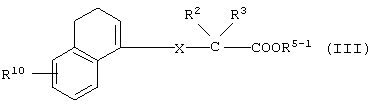
(где R10 представляет собой ОН-группу или SH-группу, а другие символы принимают значения, описанные выше), и, если это необходимо, с последующей реакцией удаления защитной группы.
Данная реакция является известной. Она проводится, например, при температуре 0-80°С в органическом растворителе (например, тетрагидрофуране (ТГФ), диэтиловом эфире, метиленхлориде, хлороформе, четыреххлористом углероде, пентане, гексане, бензоле, толуоле, диметилформамиде (ДМФА), диметилсульфоксиде (ДМСО), гексаметилфосфорамиде (hexamethylphosphoramide НМРА) и т.д.) в присутствии основания (например, гидрида натрия, карбоната калия, триэтиламина, пиридина, йодида натрия, карбоната цезия и т.д.).
Реакция удаления защитных групп может осуществляться следующими способами.
Реакция удаления защитных групп аминогруппы является известной реакцией, и примеры такой реакции включают
(1) реакцию удаления защитной группы в кислотных условиях,
(2) реакцию удаления защитной группы гидрогенолизом и т.п.
Данные способы подробно описаны ниже.
(1) Реакция удаления защитной группы в кислотных условиях проводится, например, в органическом растворителе (например, в метиленхлориде, хлороформе, диоксане, этилацетате, анизоле, метаноле, этаноле, изопропиловом спирте и т.д.) или в отсутствие органического растворителя, или в водном растворе с использованием органической кислоты (например, уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты и т.д.), неорганической кислоты (например, соляной кислоты, серной кислоты и т.д.) или их смеси (например, смеси бромистоводородная кислота/уксусная кислота и т.д.) при температуре в интервале от 0 до 100°С.
(2) Реакция удаления защитной группы гидрогенолизом проводится, например, в растворителе (в эфирной системе (например, в тетрагидрофуране, диоксане, диметоксиэтане, диэтиловом эфире и т.д.), спиртовой системе (например, в метаноле, этаноле), в бензольной системе (например, в бензоле, толуоле и т.п.), в кетоновой системе (например, в ацетоне, метилэтилкетоне и т.д.), в нитрильной системе (например, ацетонитриле и т.д.), в амидной системе (например, диметилформамиде и т.д.), воде, этилацетате, уксусной кислоте или в смешанном растворителе из двух или нескольких веществ и т.д.) в присутствии катализатора (например, палладия на углероде, палладиевой черни, гидроксида палладия, оксида палладия, никеля Ренея и т.д.) при атмосферном или при повышенном давлении в атмосфере водорода или в присутствии формиата аммония при температуре 0-200°С.
Примеры защитных групп аминогруппы включают бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, трифторацетильную группу и 9-флуоренилметоксикарбонильную группу.
Защитные группы аминогруппы не ограничиваются приведенными выше примерами, и могут также использоваться другие группы, которые могут быть легко и избирательно удалены. Например, могут использоваться группы, которые описаны в монографии T.W. Greene, Protective Groups in Organic Synthesis, 3rd edition, Wiley, New York, 1999.
Для квалифицированного специалиста понятно, что целевое соединение данного изобретения может быть легко получено с использованием таких реакций удаления защитной группы.
Кроме того, среди соединений, представленных формулой (IA), соединение, в котором Y представляет собой -О- группу, то есть соединение формулы (IA-1)
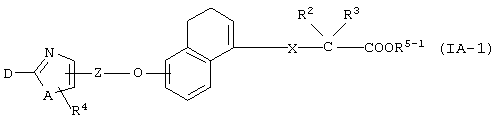
(где все символы принимают значения, описанные выше) может быть получено взаимодействием соединения формулы (IV)
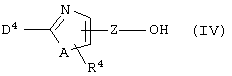
(где все символы принимают значения, описанные выше) с соединением формулы (III-1)
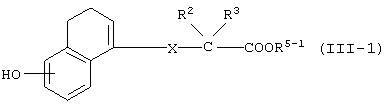
(где все символы принимают значения, описанные выше) и, если это необходимо, с последующим удалением защитной группы.
Данная реакция является известной. Она осуществляется, например, взаимодействием с соответствующим спиртовым соединением в органическом растворителе (например, в дихлорметане, диэтиловом эфире, тетрагидрофуране, ацетонитриле, бензоле, толуоле и т.д.) в присутствии азосоединения (например, диэтилазодикарбоксилата, диизопропилазодикарбоксилата, 1,1'-(азодикарбонил)дипиперидина, 1,1'-азобис(N,N-диметилформамида) и т.д.) и фосфинового соединения (например, трифенилфосфина, трибутилфосфина, триметилфосфина и т.д.).
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(2) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой группу СООН, то есть соединение формулы (IB)
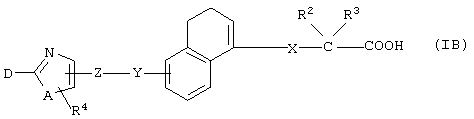
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (IB), может быть получено гидролизом описанного выше соединения формулы (А).
Указанная реакция гидролиза является известной. Она проводится, например,
(1) в органическом растворителе, который может смешиваться с водой (например, ТГФ, диоксане, этаноле, метаноле и т.д.) или в смешанном растворителе с использованием водных щелочных растворов (например, гидроксида калия, гидроксида натрия, гидроксида лития, карбоната калия, карбоната натрия и т.д.) или
(2) в алканоле (например, метаноле, этаноле и т.д.) с использованием указанных выше щелочей в безводных условиях.
Такие реакции обычно могут проводиться при температурах 0-100°С.
Кроме того, среди соединений, представленных формулой (IB), соединение, в котором R2 представляет собой атом водорода и R3 представляет собой С1-8 алкоксигруппу, т.е. соединение формулы
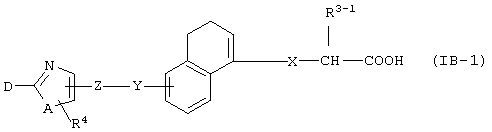
(где R3-1 представляет собой С1-8 алкоксигруппу, а другие символы принимают значения, описанные выше), может быть получено гидролизом соединения формулы (V)
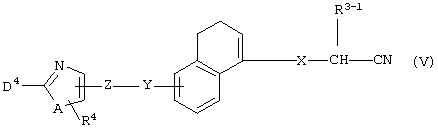
(где все символы принимают значения, описанные выше) и, если это необходимо, последующим удалением защитной группы.
Данная реакция гидролиза является известной. Она проводится, например, в органическом растворителе, смешиваемом с водой (например, (водном) метаноле, диоксане, тетрагидрофуране и т.д.), или смеси таких растворителей в присутствии водного раствора щелочи (например, гидроксида натрия, гидроксида калия, гидроксида лития и т.д.) при температуре в интервале от комнатной до температуры кипения растворителя.
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(3) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой группу СН2ОН, то есть соединение формулы (IC)
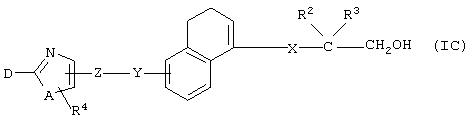
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (IC), может быть получено восстановлением соединения формулы (VI)
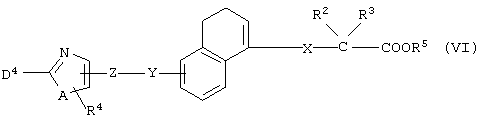
(где все символы принимают значения, описанные выше) и, если это необходимо, последующей реакцией удаления защитной группы.
Эта реакция является известной. Например, она может проводиться в органическом растворителе (например, диэтиловом эфире, тетрагидрофуране, толуоле, метиленхлориде и т.д.) с использованием восстановителя (например, алюмогидрида лития, гидрида диизобутилалюминия, борогидрида лития и т.д.) при температуре от -78 до 80°С.
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(4) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой группу СНО, то есть соединение формулы (ID)
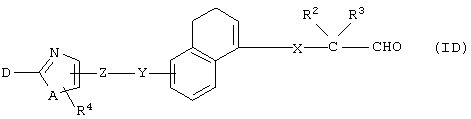
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (ID), может быть получено окислением соединения формулы (VII)
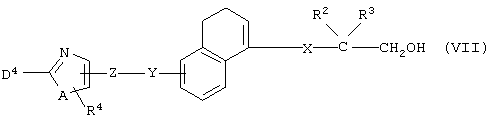
(где все символы принимают значения, описанные выше) и, если это необходимо, последующей реакцией удаления защитной группы.
Данная окислительная реакция является известной. Например, она может осуществляться
(1) способом окисления по Сверну,
(2) с использованием реагента Десса-Мартина,
(3) с использованием реагента TEMPO.
Суть данных способов заключается в следующем.
(1) Окисление по Сверну может осуществляться, например, взаимодействием оксалилхлорида с диметилсульфоксидом в органическом растворителе (например, в хлороформе, метиленхлориде и т.д.) при температуре -78°С, взаимодействием полученного промежуточного продукта со спиртовым производным и последующим взаимодействием полученного соединения с третичным амином (например, триэтиламином и т.д.) при температуре в интервале от -78 до 20°С.
(2) Способ окисления с использованием реагента Десса-Мартина может осуществляться, например, в инертном органическом растворителе (например, хлороформе, дихлорметане и т.д.) с применением реагента Десса-Мартина (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3-(1Н)-она) при температуре в интервале от 0 до 40°С.
(3) Способ окисления с использованием реагента TEMPO может осуществляться, например, в инертном органическом растворителе (например, хлороформе, метиленхлориде и т.д.) в присутствии реагента TEMPO (2,2,6,6-тетраметил-1-пиперидинилокси, свободный радикал) при температуре в интервале от 20 до 60°С.
Реакция, описанная в пунктах (1), (2) и (3), может осуществляться в атмосфере инертного газа (например, аргона, азота и т.д.) для предотвращения попадания влаги и получения предпочтительного результата.
Предпочтительными способами окисления являются также другие способы, с помощью которых можно легко и направленно окислять спирт до кетона, например окисление по Джону, способ с использованием хлорхромата пиридиния (pyridinium chlorochromate РСС), способ с использованием комплекса пиридина и триоксида серы или способы, описанные в монографии Richard С. Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., (1989) [p.604-614].
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(5) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой CONHOH-группу, то есть соединение формулы (IE)
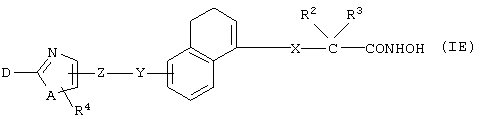
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (IE), может быть получено из соединения формулы (VII)
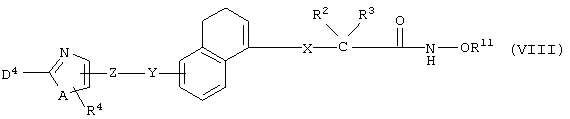
(где R11 представляет собой С1-8 алкил, замещенный фенильной группой или С1-8 алкоксигруппой, а другие символы принимают значения, описанные выше), реакцией удаления защитной группы R11 и, если это необходимо, последующей реакцией удаления защитной группы.
Реакция удаления защитной R11 группы (в кислотных условиях или гидрогенолизом) является известной. Она может осуществляться следующими способами.
Реакция удаления защитной группы в кислотных условиях является известной. Она проводится, например, в органическом растворителе (например, в метиленхлориде, хлороформе, диоксане, этилацетате, анизоле и т.д.) с использованием органической кислоты (например, уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, йодтриметилсилана и т.д.), неорганической кислоты (например, соляной кислоты, серной кислоты и т.д.) или смеси неорганической и органической кислот (например, смеси бромистоводородная кислота/уксусная кислота и т.д.) при температуре в интервале от 0 до 100°С.
Реакция удаления защитной группы гидрогенолизом является известной. Она проводится, например, в растворителе (например, в эфирной системе (например, в тетрагидрофуране, диоксане, диметоксиэтане, диэтиловом эфире и т.д.), в спиртовой системе (например, в метаноле, этаноле), в бензольной системе (например, в бензоле, толуоле и т.д.), в кетоновой системе (например, ацетоне, метилэтилкетоне и т.д.), в нитрильной системе (например, в ацетонитриле и т.д.), в амидной системе (например, в диметилформамиде и т.д.), в воде, этилацетате, уксусной кислоте или в смешанном растворителе из двух или нескольких компонентов и т.д.) в присутствии катализатора гидрирования (например, палладия на углероде, палладиевой черни, палладия, гидроксида палладия, оксида платины, никеля, никеля Ренея и т.д.) в присутствии неорганической кислоты (например, соляной кислоты, серной кислоты, гипохлористой кислоты, борной кислоты, тетрафторборной кислоты и т.д.) или органической кислоты (например, уксусной кислоты, п-толуолсульфоновой кислоты, щавелевой кислоты, трифторуксусной кислоты, муравьиной кислоты и т.д.) или без добавления кислоты при температуре в интервале от 0 до 200°С. В случае, когда используется кислота, может использоваться и соль кислоты.
Реакция удаления защитной группы в группе D4 может осуществляться способами, описанными выше.
(6) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой 1Н-тетразол-5-ильную группу, то есть соединение формулы (IF)
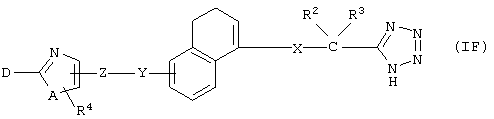
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (IF), может быть получено взаимодействием соединения формулы (IX)
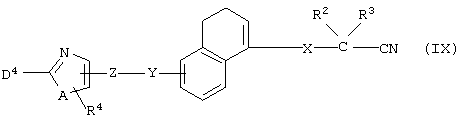
(где все символы принимают значения, описанные выше) с азидным реагентом и, если это необходимо, последующей реакцией удаления защитной группы.
Данная реакция является известной. Она проводится, например, при температуре в интервале от 50°С до температуры кипения в органическом растворителе (например, толуоле, бензоле и т.д.) с использованием азидного реагента (например, азидотриметилолова, триметилсилилазида, азида натрия и т.д.).
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(7) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой 3,5-диоксоизооксазолин-4-ил, то есть соединение формулы (IG)
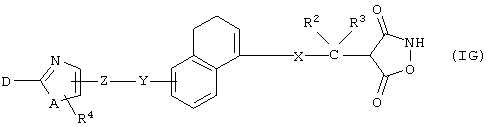
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение формулы (IG) может быть получено взаимодействием соединения формулы (X)
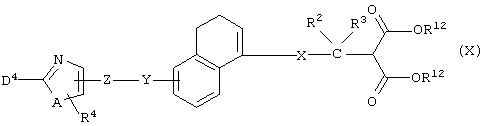
(где R12 представляет собой С1-8 алкильную группу, а другие символы принимают значения, описанные выше) с гидроксиламином и, если это необходимо, последующей реакцией удаления защитной группы.
Данная реакция является известной. Она осуществляется, например, взаимодействием гидроксиламина при температуре в интервале от 0 до 50°С в органическом растворителе (например, метаноле, этаноле и т.д.) в присутствии основания (например, метилата натрия, этилата натрия и т.д.).
Реакция удаления защитной группы может осуществляться способами, описанными выше.
(8) Среди соединений, представленных формулой (I), соединение, в котором R1 представляет собой группу CONH2, то есть соединение формулы (IH)
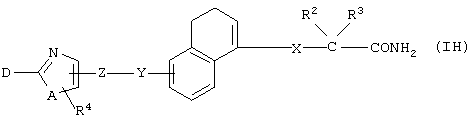
(где все символы принимают значения, описанные выше), может быть получено следующими способами.
Соединение, представленное формулой (IH), может быть получено амидированием соединения формулы (XI)
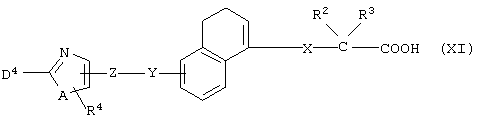
(где все символы принимают значения, описанные выше) аммиаком и, если это необходимо, последующей реакцией удаления защитной группы.
Реакция амидирования является известной реакцией. Она может осуществляться следующими способами:
(1) способ с применением ацилгалогенида,
(2) способ с применением смешанного ангидрида кислоты,
(3) способ с применением конденсирующего агента и т.д.
Суть данных способов заключается в следующем.
(1) Амидирование с применением ацилгалогенида может осуществляться, например, взаимодействием карбоновой кислоты с ацилгалогенидом (например, оксалилхлоридом, тионилхлоридом и т.д.) в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране и т.д.) или без растворителя при температуре в интервале от -20°С до температуры кипения. Затем полученное ацилгалогенидпроизводное может подвергаться взаимодействию с амином в инертном органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране и т.д.) в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина, диметиламинопиридина и т.д.) при температуре в интервале от 0 до 40°С.
В качестве альтернативы, амидирование может осуществляться взаимодействием с ацилгалогенидом при температуре в интервале 0-40°С в органическом растворителе (например, диоксане, тетрагидрофуране и т.д.) с использованием водного раствора щелочи (например, бикарбоната натрия, гидроксида натрия и т.д.) при температуре в интервале 0-40°С.
(2) Способ с применением смешанного ангидрида кислоты может осуществляться, например, взаимодействием карбоновой кислоты с ацилгалогенидом (например, пивалоилхлоридом, тозилхлоридом, мезилхлоридом и т.д.) или с производным кислоты (например, с этилхлорформиатом, изобутилхлорформиатом и т.д.) в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране и т.д.) или без растворителя в присутствии третичного амина (например, пиридина, триэтиламина, диметиланилина, диметиламинопиридина и т.д.) при температуре в интервале 0-40°С. Затем полученный смешанный ангидрид кислоты может подвергаться взаимодействию с амином в органическом растворителе (например, хлороформе, метиленхлориде, диэтиловом эфире, тетрагидрофуране и т.д.) при температуре в интервале 0-40°С.
(3) Способ с использованием конденсирующего агента может осуществляться, например, взаимодействием карбоновой кислоты с амином в органическом растворителе (например, хлороформе, метиленхлориде, диметилформамиде, диэтиловом эфире, тетрагидрофуране и т.д.), или в смешанном растворителе, или без растворителя, в присутствии или в отсутствие третичного амина (например, пиридина, триэтиламина, диизопропилэтиламина, диметиланилина, диметиламинопиридина и т.д.) с использованием конденсирующего агента (например, 1,3-дициклогексилкарбодиимида (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), 1,1'-карбодиимидазола (CDI), йодида 2-хлор-1-метилпиридиния, метил-3-метил-1-фторпиридинийтозилата, метансульфонилоксибензотриазола, циклического ангидрида 1-пропанфосфоновой кислоты (РРА), и т.д.) в присутствии или в отсутствие 1-гидроксибензотиазола-HOBt) при температуре в интервале 0-40°С.
Реакции, описанные в пунктах (1), (2) и (3), могут осуществляться в атмосфере инертного газа (например, аргона, азота) для предотвращения попадания влаги и получения предпочтительного результата.
Реакция удаления защитной группы может осуществляться способами, описанными выше.
Соединения, представленные формулами (II) и (IV), являются известными соединениями и могут быть легко получены известными способами или способами, описанными в примерах.
Например, среди соединений формулы (IV) 2-(5-метил-2-фенилоксазол-4-ил)этанол может быть получен способами, описанными в публикации J.Med.Chem., 35, 1853-1864 (1992).
Например, среди соединений формулы (IV) 2-(5-метил-2-(морфолин-4-ил)оксазол-4-ил)этанол может быть получен способами, описанными в публикации J. Med. Chem., 41, 5037-5054 (1998).
Соединения, представленные формулами (II), (III), (III-1), (IV), (V), (VIII), (IX) и (X), являются известными соединениями или могут быть легко получены известными способами или способами, описанными в примерах.
Например, соединения, представленные формулами (II), (III), (III-1), (IV), (V), (VIII), (IX) и (X), могут быть получены способами, показанными на приведенных ниже схемах реакций 1-10.
На схемах реакций R13 представляет собой защитную группу гидроксильной группы (например, метоксиэтильную группу, 2-тетрагидропиранильную группу, трет-бутилдиметилсилильную группу, ацетильную группу, бензильную группу, 4-метоксибензильную группу, пивалоильную группу и т.д.), R14 представляет собой атом галогена, Х1 представляет собой С1-5 алкиленовую группу, Х2 представляет собой С1-4 алкиленовую группу, Me представляет собой метильную группу, i-Pr представляет собой изопропильную группу, (СН2O)n представляет собой параформальдегид, n-BuLi представляет собой н-бутиллитий, Ph представляет собой фенильную группу, R2-1 представляет собой С1-8 алкильную группу, R3-2 представляет собой С1-8 алкильную группу, LDA представляет собой литийдиизопропиламид, R2-2 представляет собой С1-8 алкоксигруппу, замещенную фенильной группой, p-TsOH представляет собой пара-толуолсульфоновую кислоту, TMSCN представляет собой триметилсилилцианид, Et представляет собой этильную группу, Z1 представляет собой связь или С1-3 алкиленовую группу, Z2 представляет собой С1-2 алкиленовую группу, R4-1 представляет собой С1-8 алкиленовую группу, Z3 представляет собой С2-3 алкиленовую группу, а другие символы принимают значения, описанные выше.
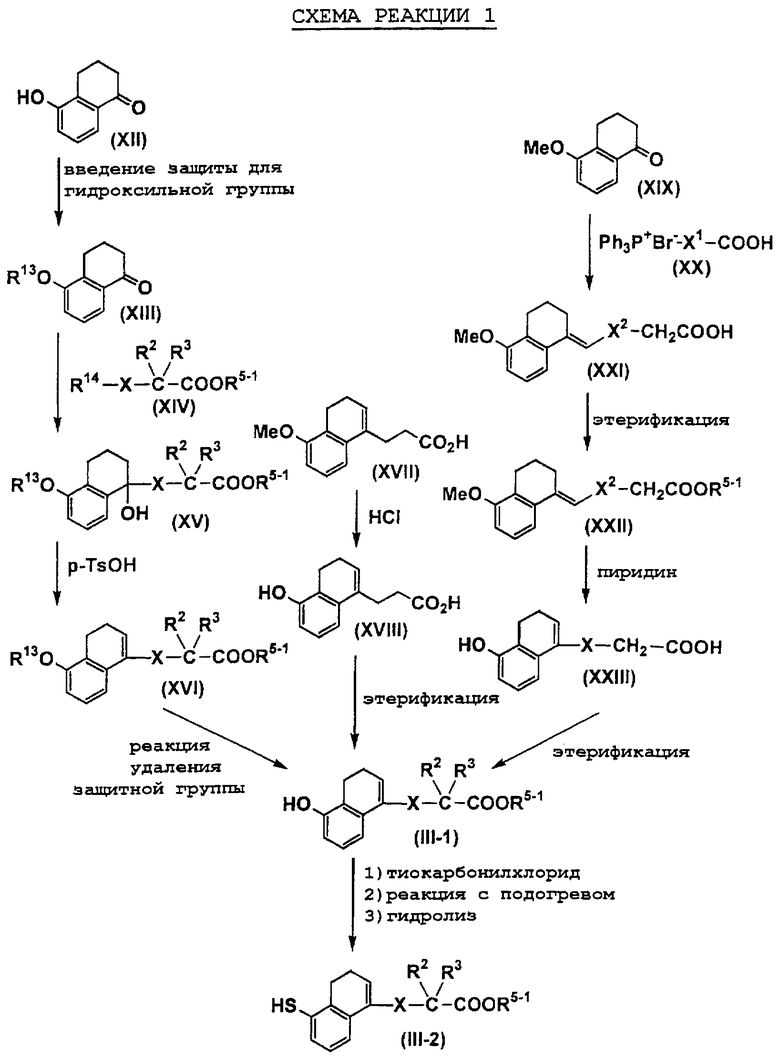
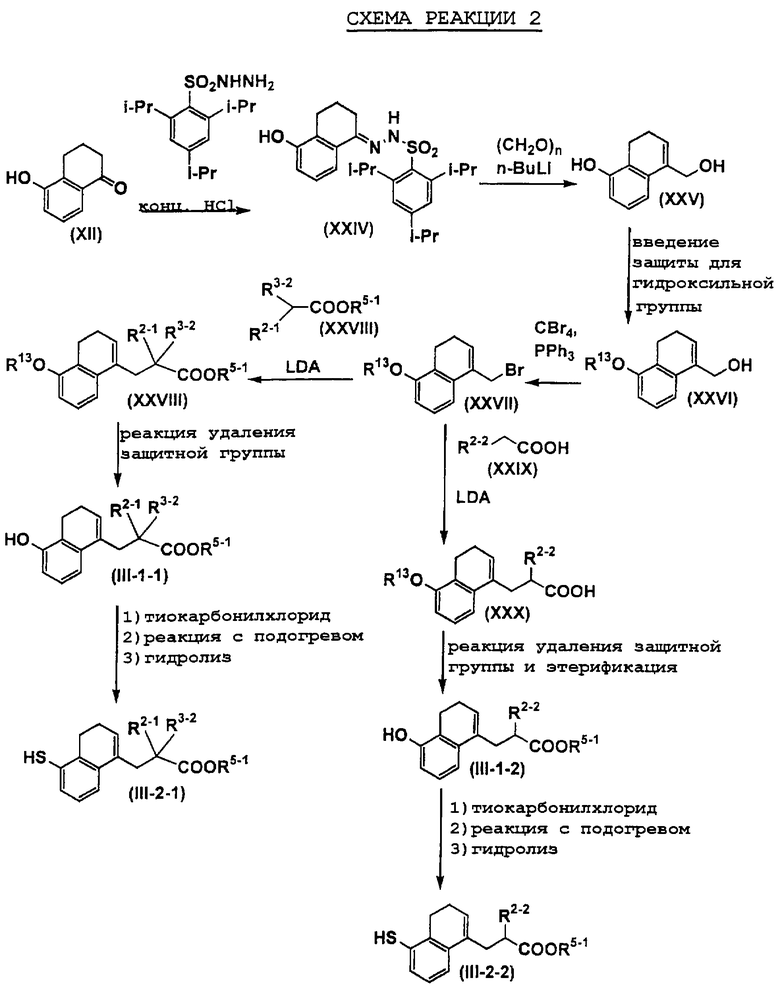
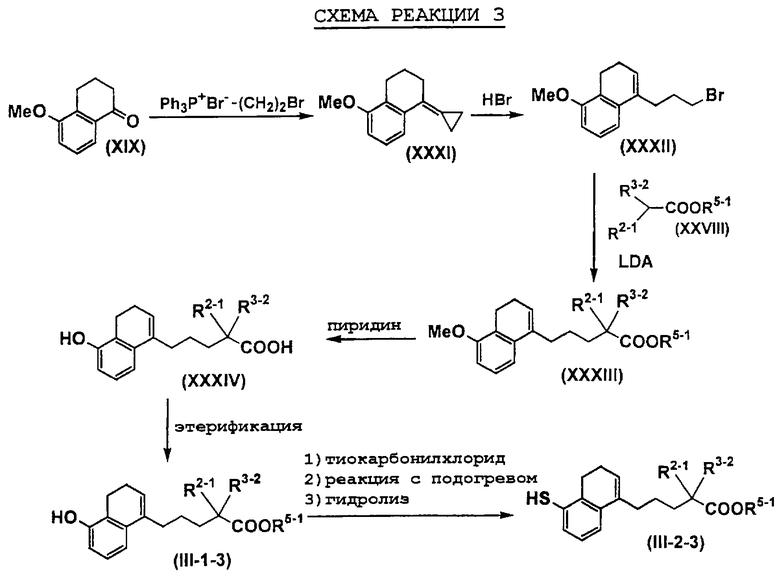
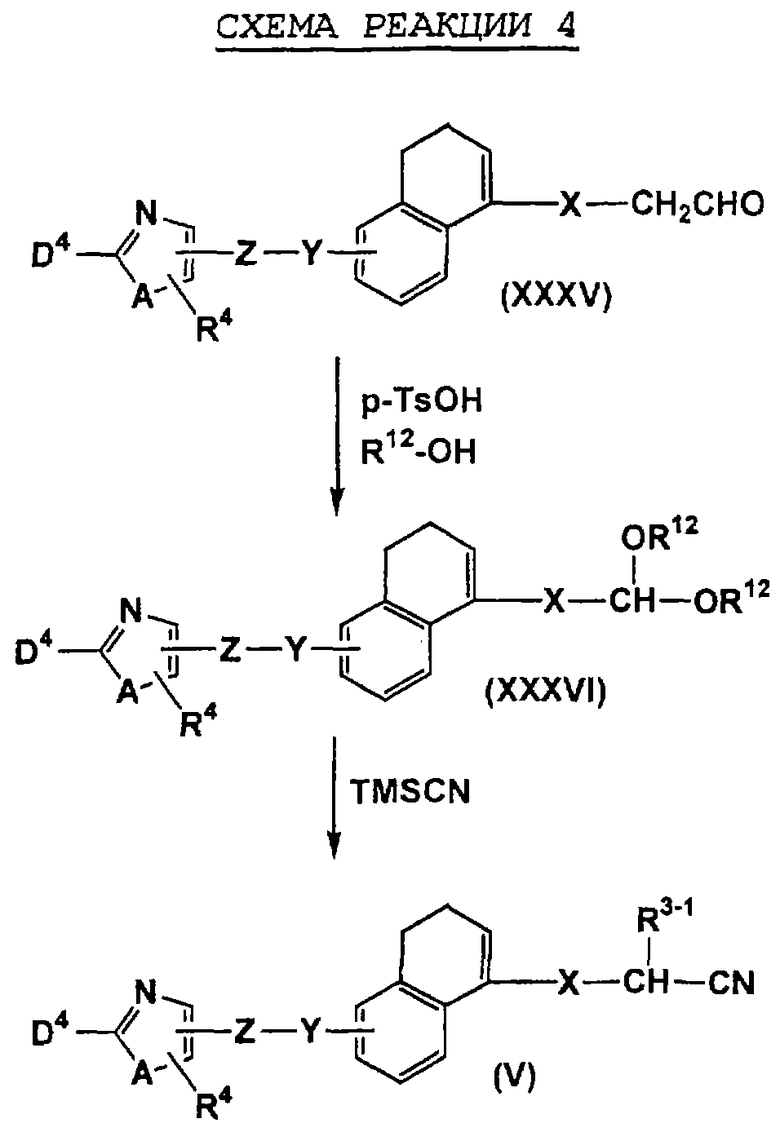
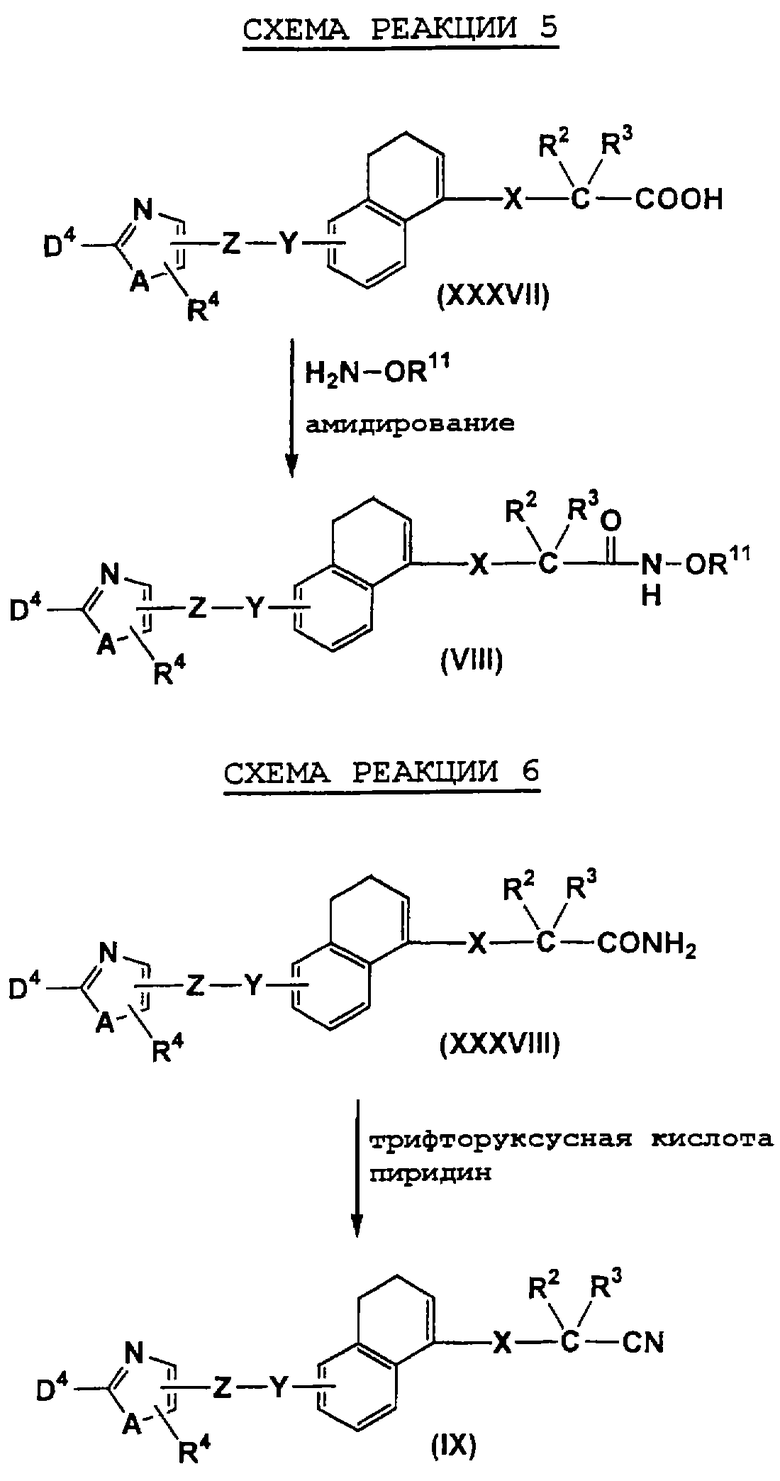
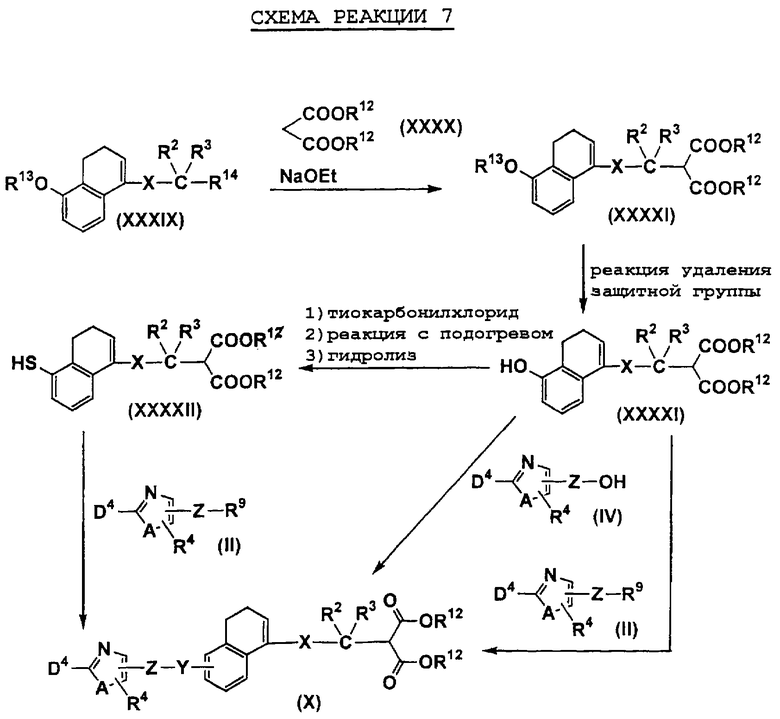
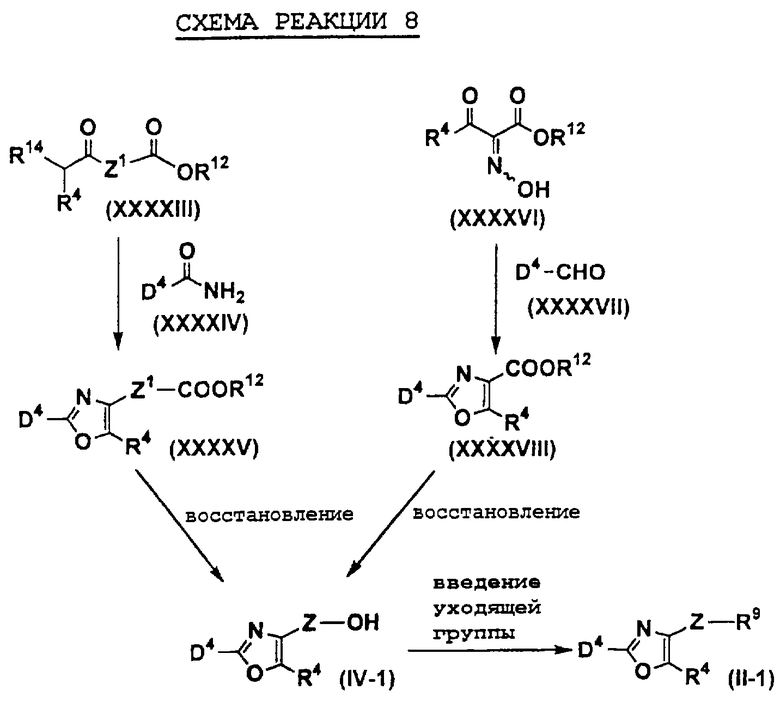
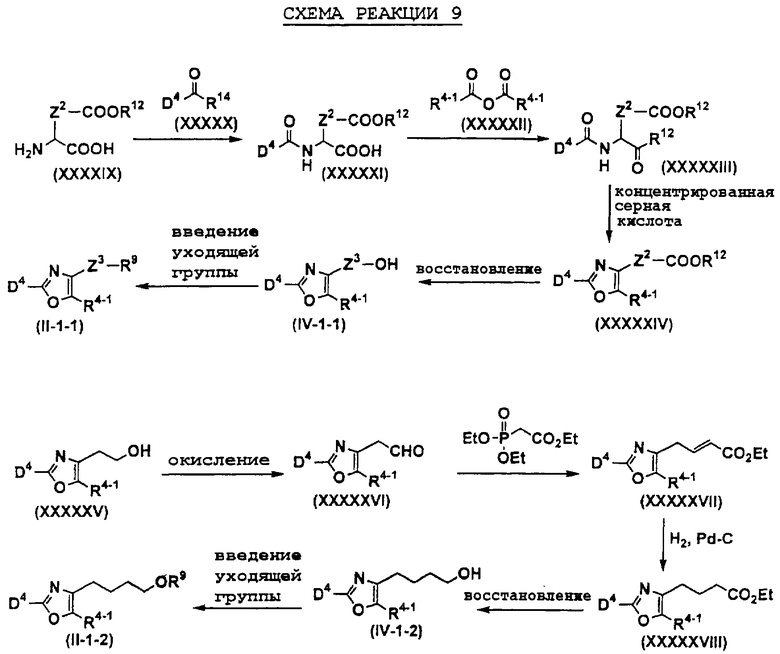
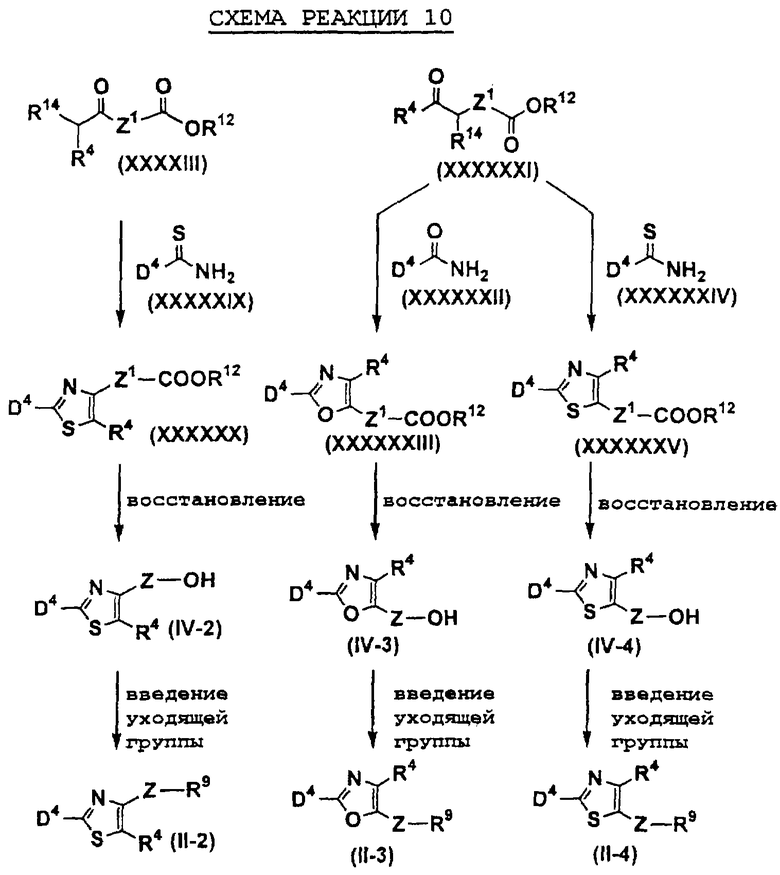
На схемах реакций соединения, используемые в качестве исходных веществ и представленные формулами (XII), (XIV), (XVII), (XIX), (XX), (XXVIII), (XXXV), (XXXVII), (XXXVIII), (XXXIX), (ХХХХ), (XXXXIII), (XXXXIV), (XXXXVI), (XXXXVII), (XXXXIX), (XXXXX), (XXXXXII), (XXXXXIX), (XXXXXXI), (XXXXXXII) и (XXXXXXIV), являются известными соединениями или легко могут быть получены известными способами.
В каждой реакции, описанной в данном изобретении, продукт реакции может подвергаться очистке обычными методами очистки, такими как перегонка при нормальным давлении или при пониженном давлении, высокоэффективная жидкостная хроматография, тонкослойная хроматография или колоночная хроматография с использованием силикагеля или силиката магния, промывка и перекристаллизация. Очистка может проводиться в каждой реакции или после завершения нескольких реакций.
[Фармакологическая активность]
Описанные ниже опыты подтверждают, что соединения данного изобретения формулы (I) обладают активностью по регулированию PPAR.
Количественное определение (PPAR α)-агонистической и (PPAR γ)-агонистической активности
(1) Получение материалов для количественного анализа с использованием люциферазы и α или γ изоформ PPAR человека.
Все операции осуществляются в дрожжевой системе с помощью стандартных методов одинарного гибрида или двойного гибрида.
В качестве вектора экспрессии гена люциферазы под контролем промотора тимидинкиназы (ТК) вырезают структурный ген люциферазы из вектора PicaGene Basic Vector 2 (торговое название, Тоуо Ink Inc., каталог №309-04821) для получения вектора экспрессии гена люциферазы pTK-Luc. под контролем промотора ТК (-105/+51) в качестве минимально необходимой промоторной активности из рТКβ, содержащего промотор ТК (Chrontech Inc., каталог №6179-1). На участке, предшествующем ТК-промотору, для конструирования 4 Х UAS-TK-Luc. в качестве репортерного гена вставляют четырежды повторенную UAS-последовательность, которая является воспринимающим элементом белка Gal4 - основного фактора транскрипции в дрожжах. Используется последовательность энхансера (последовательность №1), представленная ниже.
Последовательность №1: последовательность энхансера, в которой четыре раза подряд повторен отвечающий элемент белка Gal4.
5'-T(CGACGGAGTACTGTCCTCCG)×4 AGCT-3'
Способом, описанным ниже, получают вектор, который экспрессирует химерный рецепторный белок и в котором концевая карбоксильная группа ДНК-связывающего домена белка GAl4 дрожжей слита с лигандсвязывающим α или γ доменом PPAR человека. То есть, вектор PicaGene Basic Vector 2 (торговое название, Тоуо Ink Inc., каталог №309-04821) используют в качестве основного экспрессирующего вектора, структурный ген заменяют на вектор химерного рецепторного белка, в то время как промоторный и энхансерный домены оставляют без изменений.
ДНК, кодирующая слитый белок, составленная из ДНК-связывающего домена Gal4, последовательности аминокислот с 1-й по 147-й, соединенной в рамке считывания с лигандсвязывающим  или γ доменом PPAR человека, вставляют ниже участка промотер/энхансер в вектор PicaGene Basic Vector 2 (торговое название, Тоуо Ink Inc., каталог №309-04821). В данном случае ДНК выпрямляют следующим образом: в содержащий аминогруппу конец лигандсвязывающего α или γ домена PPAR человека добавляют сигнал ядерной транслокации, полученный из Т-антигена SV-40, а именно: Ala Pro Lys Lys Lys Arg Lys Val Gly (последовательность №2), для получения слитого белка, локализующегося внутри ядра. С другой стороны, в конец, содержащий карбоксильную группу, последовательно добавляют эпитоп гемагглютинина вируса гриппа, а именно: Tyr Pro Tyr Asp Val Pro Asp Tyr Ala (последовательность №3), и терминирующий транслокацию кодон для обнаружения экспрессируемой последовательности меченого эпитопа слитого белка.
или γ доменом PPAR человека, вставляют ниже участка промотер/энхансер в вектор PicaGene Basic Vector 2 (торговое название, Тоуо Ink Inc., каталог №309-04821). В данном случае ДНК выпрямляют следующим образом: в содержащий аминогруппу конец лигандсвязывающего α или γ домена PPAR человека добавляют сигнал ядерной транслокации, полученный из Т-антигена SV-40, а именно: Ala Pro Lys Lys Lys Arg Lys Val Gly (последовательность №2), для получения слитого белка, локализующегося внутри ядра. С другой стороны, в конец, содержащий карбоксильную группу, последовательно добавляют эпитоп гемагглютинина вируса гриппа, а именно: Tyr Pro Tyr Asp Val Pro Asp Tyr Ala (последовательность №3), и терминирующий транслокацию кодон для обнаружения экспрессируемой последовательности меченого эпитопа слитого белка.
В соответствии со сравнением структур PPAR человека, описанных в литературе (R. Mukherjee et al., J.Steroid Biochem. Molec. Biol., 51, 157 (1994), M.E. Green et al., Gene Expression, 4, 281 (1995), A. Elbrecht et al., Biochem. Biophys. Res. Commun., 224, 431 (1996), A. Schmidt et al., Mol. Endocrinology, 6, 1634 (1992), часть структурного гена, используемого в качестве лигандсвязывающего α или лигандсвязывающий γ домена PPAR человека, представляет собой кодирующую ДНК для следующего пептида:
лигандсвязывающий α домен PPAR человека: Ser167-Tyr468, лигандсвязывающий γ домен PPAR человека: Ser176-Tyr478 (каждый лигандсвязывающий γ1 домен PPAR человека и лигандсвязывающий γ2 домен PPAR человека представляет собой Ser204-Tyr506, и они являются идентичными друг другу последовательностями). Для количественного определения базального уровня транскрипции получают также вектор экспрессии, содержащий ДНК-связывающий домен белка Gal4, отсутствующий в лигандсвязывающем домене PPAR, который исключительно кодирует последовательность от 1-й до 147-й аминокислот в белке Gal4.
(2) Люциферазная проба с использованием α- или γ- изоформы PPAR человека.
Клетки-CV-1, используемые в качестве клеток-хозяев, выращивают по стандартной методике. То есть в качестве культуры CV-1 клеток используют среду DMEM (модифицированная по Дульбекко среда Игла), дополненную 10% фетальной телячьей сывороткой (GIBCO BRL Inc., каталог №26140-061), 50 ед./мл пенициллина G и 50 мкг/мл сульфата стрептомицина в атмосфере 5% газообразного диоксида углерода при 37°С.
2×106 клеток высевают в чашку диаметром 10 см и один раз промывают средой без сыворотки, а затем добавляют к ним среду (10 мл). Репортерный ген (10 мкг), вектор экспрессии Gal4-PPAR (0,5 мкг) и 50 мкл LipofectAMINE (GIBRO BRL Inc., каталог №18324-012) тщательно смешивают и добавляют в культуру для введения данных ДНК в клетки-хозяева. Их выдерживают в данной среде при 37°С в течение 5-6 часов, затем добавляют 10 мл среды, содержащей 20% диализованной фетальной телячьей сыворотки (GIBRO BRL Inc., каталог №26300-061) и выдерживают в полученной среде при 37°С в течение ночи. Клетки диспергируют с помощью трипсина и затем снова высевают в 96-луночные микропланшеты с плотностью 8000 клеток/100 мл смеси (DMEM - 10% диализированная сыворотка)/лунка. Через нескольких часов культивирования, когда клетки прикрепляются к пластиковой посуде, к ним в каждую лунку добавляют 100 мкл смеси (DMED-10% диализированная сыворотка), содержащей соединения данного изобретения, концентрация которых выше конечной концентрации в два раза. Культуру выдерживают при 37°С в течение 42 часов и клетки растворяют для количественного определения активности люциферазы в соответствии с инструкцией изготовителя.
Результаты определения (PPAR α) агонистической активности представлены в таблице 14, где показана относительная активность соединений данного изобретения (10 мкМ) в условиях, когда за 1,0 принималась люциферазная активность контрольного соединения карбациклина (10 мкМ), который мог значительно активировать транскрипцию люциферазного гена на PPAR α (см. Eur. J.Biochem., 233, 242 (1996); Genes&Development, 10, 974 (1996)).
Результаты определения (PPAR γ) агонистической активности соединений данного изобретения представлены в таблице 15, где показана относительная активность соединений данного изобретения (1 мкМ) в условиях, когда за 1,0 принята люциферазная активность контрольного соединения - троглитазона (10 мкМ), который мог значительно активировать транскрипцию люциферазного гена на PPAR γ (см. Cell, 83, 863 (1995); Endocrinology, 137, 4189 (1996), J.Med.Chem., 39, 665 (1996)) и уже использовался в качестве гипогликемического средства.
Для проверки воспроизводимости результатов и подтверждения зависимости доза - активность биологическое испытание каждого соединения проводят три раза.
В качестве сравнительного соединения используют также представленное ниже соединение, которое описано в примере 4 (35) публикации WO 9911255.
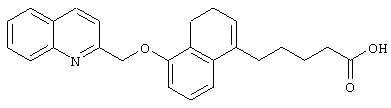
соединение, описанное в примере 3 (35) в публикации WO 9911255.
Например, гипогликемическая активность и гиполипидемическая активность соединения настоящего изобретения может определяться методами, описанными далее.
Действие по снижению содержания в крови сахара и действие
по снижению содержания в крови липидов
Самцов мыши ККАу/Та Jcl возраста 8 недель (пять мышей в каждой группе) предварительно откармливают индивидуально в отдельных клетках в течение приблизительно одной недели и снабжают питанием в виде гранул и водопроводной водой из бутылки, подающей воду, ad libitum. Мышей переводят на измельченную пищу в течение трех дней. В первый день эксперимента (0 день) измеряют массу тела мышей. Из копчиковой вены отбирают образцы крови, используя микрокапилляр, для измерения концентрации глюкозы в плазме. Исходя из концентрации глюкозы в плазме мышей делят на несколько групп (по пять особей в группе), используя метод расслоенной рандомизации. Массу тела измеряют на следующий день утром и, начиная со следующего дня, в течение шести дней животным дают соединения в виде питательной смеси, содержащей 0,03% (мас./мас.). 0,01% (мас./мас.) или 0,003% (мас./мас.) соединения данного изобретения, или только измельченное питание. Утром четвертого дня и утром седьмого дня определяют массы тел мышей и массу потребленной пищи для вычисления среднего значения введенной дозы. Утром шестого дня из копчиковой вены отбирают образцы крови для определения содержания в крови глюкозы и триглицеридов (TG). На седьмой день после измерения массы тела производят отбор образцов крови из брюшного отдела полой вены под анестезией, осуществленной с помощью эфира, для определения содержания в плазме инсулина, неэтерефицированной жирной кислоты (NEFA), GOT и GPT с использованием коммерчески доступных комплектов реагентов. Печень удаляют и взвешивают. Общие РНК готовят из левой доли печени и определяют уровень экспрессии гена бифункционального белка (гидраза-дегидрогеназы, HD) методом Норзер-блоттинга. Фактически нет значительного различия в усвоении пищи между контрольной группой (только измельченное питание) и группой, принимающей в качестве лекарственных средств соединения данного изобретения (измельченное питание, содержащее 0,03%, 0,01% или 0,003% соединений). Вычисленная доза составляет примерно 40 мг/кг/день в группе, принимающей питание, содержащее 0,03% соединения.
Исходя из действия по снижению уровней содержания в плазме глюкозы, инсулина, NEFA или TG у хорошо откормленных мышей ККАу/Та предполагают возможность использования соединений в качестве средства для профилактики и/или лечения сахарного диабета, липемии, атеросклероза и т.д. Вероятно, данный эффект опосредуется через активацию PPAR γ in vivo. Вероятно также, что повышение печеночной массы печени и экспрессии мРНК HD зависит от активации PPAR α in vivo.
Действие по снижению содержания в крови сахара и действие по снижение содержания в крови липидов (2)
Самцов крысы Zucker fa/fa возраста 8 недель (линия Crj-[ZUC]-fa/fa) и здоровых крыс Zucker lean (линия Crj-[ZUC]-lean) для контраста предварительно откармливают индивидуально в отдельных клетках в течение приблизительно двух недель и снабжают питанием в виде гранул и водопроводной водой, подающейся автоматически, ad libitum. За пять дней перед началом лечения крыс переводят на пероральное питание с помощью зонда. В это время наблюдают за их состоянием здоровья, и в эксперименте используются здоровые крысы возраста 10 недель. В первый день эксперимента (0 день) измеряют массу тела каждой крысы и из копчиковой вены с помощью микрокапилляра производят отбор образцов крови для определения концентрации в плазме глюкозы, TG, NEFA и HbAlc. Исходя из содержания HbAlc и массы тела, крыс делят на несколько групп (по пять особей в группе), используя метод расслоенной рандомизации. Необязательно крыс дополнительно обменивают в группах для предотвращения отклонения средних значений других параметров между группами. Массу тела каждого животного измеряют каждое утро, начиная со дня распределения по группам. Исходя из массы тела, вычисляют объемы, подлежащие введению, и пероральное введение через зонд соединений данного изобретения или одного растворителя (0,5% метилцеллюлозу) осуществляют один раз в день в течение 13 дней. Здоровые животные (худые крысы) получают только растворитель.
Потребление пищи определяют утром 1-го, 4-го, 7-го, 10-го и 13-го дня для вычисления среднего значения потребленной пищи. На седьмой день для определения содержания в плазме глюкозы, TG, NEFA и HbAlc с помощью микрокапилляра производят отбор образцов крови из копчиковой вены. На 14-й день проводят опыт определения толерантности к глюкозе при пероральном введении (OGTT) для оценки эффекта улучшения толерантности к глюкозе. За день до этого (13-й день) крыс подвергают голоданию. После отбора образцов крови (14-й день) крысам перорально вводят 40% раствор глюкозы в объеме 2 г/5 мл/кг. Спустя 60 и 120 минут после введения глюкозы для определения содержания глюкозы в плазме отбирают образцы крови из копчиковой вены с использованием микрокапилляра.
После проведения OGTT животным дают пищу, и соединение данного изобретения вводят на 15-й день. Утром 16-го дня после измерения массы тела производят отбор образцов крови из брюшного отдела полой вены под анестезией, произведенной с помощью эфира, для определения содержания в плазме глюкозы, инсулина, TG, NEFA, GOT и GPT. Печень удаляют и взвешивают.
Исходя из действия по снижению уровней содержания в плазме глюкозы, инсулина, TG и NEFA у откормленных крыс Zucker fa/fa предполагают возможность использования соединения в качестве средства для профилактики и/или лечения сахарного диабета, липемии, атеросклероза и т.д. Кроме того, снижение содержание глюкозы в плазме крови натощак и улучшение в отношении непереносимости глюкозы в опыте OGTT предполагает возможность использования соединения в качестве средства для профилактики и/или лечения сахарного диабета. Вероятно, данный эффект опосредуется через активацию in vivo PPAR γ. Вероятно также, что повышение печеночной массы зависит от активации PPAR α in vivo.
Действие по снижению содержания в крови сахара и действие по снижение содержания в крови липидов (3)
Самцов обезьян cynomolgus возраста 3-4 лет (со средней массой тела примерно 3 кг) подвергают тщательному медицинскому осмотру и приучают к получению примерно 100 г питания в виде гранул в день и водопроводной воды из автоматического устройства подачи воды ad libitum в отдельных клетках в течение более одного месяца. После этого животные начинают принимать питание в пределах одного часа. Животных откармливают в течение 14 дней. За 14 и 7 дней перед началом лечения измеряют массу тела животных и затем отбирают образцы крови из подкожной вены задней конечности для определения гематологических (красные кровяные клетки, гематокрит, гемоглобин, тромбоциты и лейкоциты) и биохимических (GOT, GPT, щелочная фосфатаза, общий белок, азот мочевины, крови, креатинин, креатининкиназа, общий билирубин, глюкоза, общий холестерин, HDL, LDL и TG) показателей. Кроме того, наблюдают общее состояние животных в процессе приучения к питанию и откармливания. Потребление питания также оценивается ежедневно.
На основании массы тела, определенной в последний день этого периода, животных делят на несколько групп (по три животных в группе) по методу расслоенной рандомизации. Утром 1-го, 3-го, 7-го, 10-го и 14-го дня определяют массу тела. Объемы, подлежащие введению, вычисляют на основе последнего значения массы тела и один раз в день в течение 14 дней перорально с помощью зонда вводят соединения данного изобретения (3-100 мг/кг/день) или растворитель (разбавленный раствор). В 1-й, 7-й и 14-й день после начала лечения производят отбор образцов крови для определения указанных выше гематологических и биохимических параметров перед введением соединения данного изобретения. Это подтверждает, что содержание глюкозы в крови не изменилось под действием соединения данного изобретения. За три недели до начала лечения и через 14 дней после начала лечения из подкожной вены задней конечности или из вены предплечья в 1-й, 2-й и 3-й часы после перорального введения с помощью зонда, а также в 1-й, 2-й и 4-й часы после получения питания отбирают образцы крови для измерения содержания в плазме глюкозы и TG.
Исходя из действия по снижению уровней содержания TG в плазме крови у обезьян натощак, предполагают возможность использования соединения в качестве средства для профилактики и/или лечения липемии, атеросклероза и т.д. Вероятно, данный эффект опосредуется через активацию PPAR γ in vivo. Наблюдается также подавляющее действие на повышение содержания TG после приема пищи. Кроме того, на основании других биохимических показателей можно определить, является ли данное соединение токсичным.
[Токсичность]
Токсичность соединения данного изобретения, представленного формулой (I), является очень низкой, поэтому считается, что соединение является достаточно безопасным для применения его в качестве фармацевтического средства.
ВОЗМОЖНОСТЬ ПРОМЫШЛЕННОГО ПРИМЕНЕНИЯ
[Применение в фармацевтической промышленности]
Поскольку соединение данного изобретения, представленное формулой (I), и его нетоксичная соль обладают PPAR-модулирующей активностью, ожидается, что они применимы в качестве гипогликемических средств, гиполипидемических средств, в качестве средств для профилактики и/или лечения заболеваний, связанных с нарушениями обмена веществ, таких как диабет, ожирение, синдром X, гиперхолестеринемия и гиперлипопротеинемия и т.д., липемия, атеросклероз, гипертензия, заболевания кровообращения, переедание, коронарные болезни сердца и т.д., в качестве средств, повышающих содержание HDL-холестерина, в качестве средств, снижающих содержание LDL-холестерина и/или VLDL-холестерина, и в качестве средств для ослабления факторов риска диабета и синдрома X.
Кроме того, поскольку соединение данного изобретения, представленное формулой (I), и его нетоксичные соли обладают агонистическим действием в отношении PPAR α и/или PPAR γ, ожидается, что они применимы в качестве гипогликемических средств, гиполипидемических средств, средств для профилактики и/или лечения заболеваний, связанных с нарушениями обмена веществ, таких как диабет, ожирение, синдром X, гиперхолестеринемия, гиперлипопротеинемия и т.д., липемии, атеросклероза, гипертензии, заболеваний, связанных с нарушением кровообращения, и переедания и т.д.; для повышения содержания HDL-холестерина, снижения содержания LDL-холестерина и/или VLDL-холестерина, ингибирования развития атеросклероза и его лечения и ингибирования ожирения. Ожидается также, что они полезны для лечения и/или профилактики диабета в качестве гипогликемических средств, для облегчения симптомов гипертензии, для ослабления факторов риска при синдроме Х и в качестве лекарственных средств для профилактики возникновения коронарных болезней сердца.
Для указанных целей соединения данного изобретения формулы (I) и их нетоксичные соли могут, как правило, вводиться системно или местно, обычно с использованием перорального или парентерального способа введения.
Соединение данного изобретения, представленное формулой (I), и его нетоксичная соль при использовании для указанных выше целей обычно вводится системно или местно и перорально или парентерально.
Режим дозировки определяется в зависимости от возраста, массы тела, симптомов, терапевтического действия, способа введения, продолжительности лечения и т.п. Взрослому обычно вводится при пероральном введении от 1 до 1000 мг один раз или несколько раз в день, при парентеральном введении - от 1 до 100 мг (предпочтительно внутривенным введения) один раз или несколько раз в день или непрерывно в вену в течение от 1 до 24 часов в день.
Поскольку изменение дозы зависит от различных условий, которые определены выше, в некоторых случаях могут использоваться меньшие или большие дозы указанных выше интервалов.
Соединение данного изобретения, представленное формулой (I), может вводиться в форме твердых композиций, жидких композиций и других композиций для перорального введения и в форме инъекций, мазей, свечей и т.п. для парентерального введения.
Твердые композиции для перорального введения включают таблетки, пилюли, капсулы, диспергируемые порошки, гранулы и т.п.
Капсулы включают твердые и мягкие капсулы.
В таких твердых композициях одно или несколько активных соединений смешивается(ются), по меньшей мере, с одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон или метасиликат-алюминат магния. Композиция может также содержать и другие добавки, например смазывающие вещества, такие как стеарат магния, разрыхлители, такие как целлюлоза, кальцийгликолят, стабилизаторы, такие как лактоза, и вспомогательные добавки для растворения, такие как глютаминовая кислота и аспарагиновая кислота, которые добавляются в соответствии с обычными методами. При необходимости таблетки или пилюли могут покрываться пленкой или гастросолюбильными или энтеросолюбильными покрытиями, такими как сахар, желатин, гидроксипропилцеллюлоза и фталат гидроксипропилцеллюлозы, или могут покрываться двумя или несколькими пленками. Кроме того, используются также капсулы из абсорбируемых материалов, таких как желатин.
Жидкие композиции для перорального введения включают фармацевтически приемлемые эмульсии, растворы, сиропы, эликсиры и т.п. В таких жидких композициях обычно используются одно или несколько активных соединений в инертном разбавителе (например, очищенной воде, этаноле). Кроме того, такие композиции могут также содержать вспомогательные добавки, такие как смачивающие агенты или суспендирующие агенты, подсластители, вкусовые добавки и консерванты.
Другие композиции для перорального введения включают спреи, содержащие одно или несколько активных соединений, которые получают известными способами. Такие композиции помимо инертных разбавителей могут содержать стабилизаторы, такие как гидросульфат натрия, буферные добавки для придания изотоничности, изотонические растворы, такие как хлорид натрия, цитрат натрия или лимонная кислота. Способ получения спреев описан в патентах США №2868691 и 3095355.
Инъекции для парентерального введения в данном изобретении включают стерильные водные или неводные растворы, суспензии и эмульсии. Водные растворы и суспензии включают дистиллированную воду для инъекций и физиологический раствор. Неводные растворы или суспензии включают пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, спирты, такие как этанол, POLYSORBATE80 (зарегистрированная торговая марка) и т.п. Стерильные водные и неводные растворы, суспензии и эмульсии могут представлять собой смеси. Такие композиции могут также содержать консерванты, смачивающие агенты, эмульгаторы, диспергирующие добавки и стабилизаторы (например, лактозу), вспомогательные добавки, такие как добавки, способствующие растворению (например, глютаминовую кислоту и аспарагиновую кислоту). Они могут стерилизоваться фильтрованием через бактериальный фильтр, введением стерилизующего вещества или облучением. Например, они могут быть изготовлены из стерильных твердых композиций, которые могут растворяться в стерильной воде или другом стерильном растворителе для инъекций перед применением продукта, высушенного вымораживанием.
Другие композиции для парентерального введения включают жидкости для наружного применения, эндемические линименты, мази, суппозитории для ректального введения, маточные кольца для вагинального введения и т.д., содержащие одно или несколько активных соединений, которые могут быть получены известными способами.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ДАННОГО ИЗОБРЕТЕНИЯ
Далее данное изобретения подробно объясняется с помощью справочных примеров и примеров, однако данное изобретение не ограничивается приведенными примерами.
Растворители, указанные в круглых скобках в описании хроматографического разделения или ТСХ, являются растворителями, выбранными для проявления или элюирования, и указанное соотношение растворителей дано в объемных долях. Растворители, указанные в круглых скобках в данных ЯМР, являются растворителями, используемыми для проведения измерения.
Справочный пример 1
3-(5-Гидрокси-3,4-дигидронафталин-1-ил)пропановая кислота
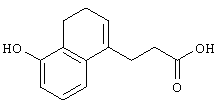
К гидрохлориду пиридина (200 г) добавляют 3-(5-метокси-3,4-дигидронафталин-1-ил)пропановую кислоту (25,1 г; известное соединение (см. J.Chem.Soc. Perkin Trans. I., 1739-1742 (1987)) и полученную смесь перемешивают при 180°С в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой. Водный слой подкисляют концентрированной соляной кислотой. Водный слой экстрагируют этилацетатом. Экстракт экстрагируют насыщенным водным раствором гидрокарбоната натрия. Объединенный водный слой подкисляют концентрированной соляной кислотой и затем экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении с получением указанного в заголовке соединения (11,8 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,42 (хлороформ:метанол = 6:1).
ЯМР (CDCl3) δ: 9,21 (с, 1Н), 6,98 (дд, J=7,8, 7,6 Гц, 1Н), 6,71 (д, J=7,6 Гц, 1Н), 6,70 (д, J=7,8 Гц, 1Н), 5,82 (т, J=4,4 Гц, 1Н), 2,68-2,50 (м, 4Н), 2,36 (м, 2Н), 2,12 (м, 2Н).
Справочный пример 2
Метиловый эфир 3-(5-гидрокси-3,4-дигидронафталин-1-ил)пропановой кислоты
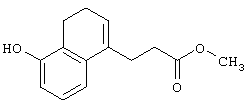
Безводный метанол (40 мл) охлаждают до -10°С, к нему в атмосфере аргона по каплям добавляют тионилхлорид (5,92 мл) и полученную смесь перемешивают при температуре -10°С в течение 20 минут. К полученному раствору добавляют соединение (11,8 г), полученное в справочном примере 1, и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют при пониженном давлении и затем подвергают азеотропной перегонке с толуолом (два раза). Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: хлороформ:метанол = от 100:0 до 50:1) с получением указанного в заголовке соединения (10,6 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,72 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,06 (дд, J=7,8, 7,6 Гц, 1Н), 6,88 (д, J=7,6 Гц, 1Н), 6,70 (д, J=7,8 Гц, 1Н), 5,88 (т, J=4,4 Гц, 1Н), 4,93 (с, 1Н), 3,68 (с, 3Н), 2,82-2,62 (м, 4Н), 2,58-2,49 (м, 2Н), 2,26 (м, 2Н).
Справочный пример 3
5-Пивалоилокси-1,2,3,4-тетрагидронафталин-1-он
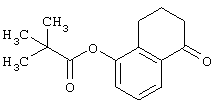
К раствору 5-гидрокси-1-тетралона (30,0 г) в пиридине (180 мл) добавляют 4-диметиламинопиридин (1,13 г), затем при охлаждении на ледяной бане добавляют пивалоилхлорид (25,0 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь охлаждают на ледяной бане, добавляют концентрированную соляную кислоту и экстрагируют этилацетатом. Экстракт промывают водой, затем насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 9:1 до 5:1) с получением указанного в заголовке соединения (45,4 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,42 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,95 (дд, J=7,8, 1,4 Гц, 1Н), 7,33 (т, J=7,8 Гц, 1Н), 7,19 (дд, J=7,8, 1,4 Гц, 1Н), 2,79 (т, J=6,0 Гц, 2H), 2,65 (дд, J=7,6, 6,0 Гц, 2H), 2,19-2,05 (м, 2Н), 1,40 (с, 9Н).
Справочный пример 4
Этиловый эфир 2-(1-гидрокси-5-пивалоилокси-1,2,3,4-тетрагидронафталин-1-ил)уксусной кислоты
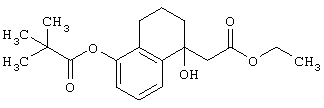
К суспензии цинка (16,9 г) в безводном бензоле (60 мл) добавляют йод (каталитическое количество), полученную смесь кипятят с обратным холодильником и по каплям добавляют раствор соединения (45,4 г), полученного в справочном примере 3, и этилового эфира бромуксусной кислоты в безводном бензоле (120 мл), а затем полученную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры. Реакционную смесь добавляют в ледяную воду, к этой смеси добавляют концентрированную соляную кислоту и экстрагируют этилацетатом. Экстракт промывают водой, затем насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 8:1 до 5:1) с получением указанного в заголовке соединения (33,5 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,52 (гексан:этилацетат = 85:15).
ЯМР (CDCl3): δ 7,42 (дд, J=8,0 2,0 Гц, 1Н), 7,17 (т, J=8,0 Гц, 1Н), 6,85 (дд, J=8,0, 2,0 Гц, 1Н), 4,16 (кв, J=7,0 Гц, 2Н), 4,10-3,90 (шир, 1Н), 2,80 (д, J=14,0 Гц, 1Н), 2,76 (д, J=14,0 Гц, 1Н), 2,68-2,40 (м, 2Н), 2,12-1,44 (м, 4Н), 1,35 (с, 9Н), 1,24 (т, J=7,0 Гц, 3Н).
Справочный пример 5
Этиловый эфир 2-(5-пивалоилокси-3,4-дигидронафталин-1-ил)уксусной кислоты
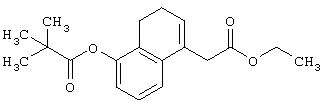
К раствору соединения (33,5 г), полученного в справочном примере 4, в толуоле (80 мл) добавляют п-толуолсульфоновой кислоты моногидрат (1,52 г) и полученную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом, промывают последовательно водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 20:1 до 10:1) с получением указанного в заголовке соединения (13,2 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,56 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 7,18 (т, J=8,0 Гц, 1H), 7,08 (дд, J=8,0, 1,0 Гц, 1H), 6,86 (дд, J=8,0, 1,0 Гц, 1H), 6,01 (т, J=4,5 Гц, 1H), 4,14 (кв, J=7,0 Гц, 2Н), 3,44-3,40 (м, 2Н), 2,63 (т, J=8,0 Гц, 2Н), 2,36-2,23 (м, 2Н), 1,38 (с, 9Н), 1,22 (т, J=7,0 Гц, 3H).
Справочный пример 6
Этиловый эфир 2-(5-гидрокси-3,4-дигидронафталин-1-ил)уксусной кислоты
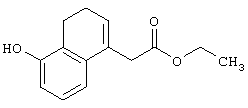
К этанольному (50 мл) раствору соединения (13,2 г), полученного в справочном примере 5, при охлаждении на ледяной бане по каплям добавляют этанольный раствор этилацетата (20 мл, 2,6 М), затем полученную смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь добавляют к смеси 2 н. соляной кислоты со льдом и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 4:1 до 2:1). Полученное масло кристаллизуют из смеси гексана и этилацетата. Затем полученные кристаллы перекристаллизовывают из смеси гексана и этилацетата с получением указанного в заголовке соединения (7,73 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,34 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 7,00 (т, J=8,0 Гц, 1H), 6,78 (д, J=8,0, 1,0 Гц, 1H), 6,63 (дд, J=8,0, 1,0 Гц, 1H), 5,98 (т, J=4,5 Гц, 1H), 5,25 (шир с, 1H), 4,15 (кв, J=7,0 Гц, 2H), 3,44-3,41 (м, 2Н), 2,74 (т, J=8,0 Гц, 2H), 2,36-2,23 (м, 2H), 1,23 (т, J=7,0 Гц, 3Н).
Справочный пример 7
5-(5-Метокси-3,4-дигидронафталин-1(2Н)илиден)пентановая кислота
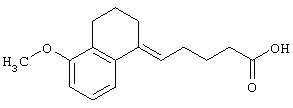
К раствору бромида (4-карбоксибутил)трифенилфосфония (25,0 г) в безводном тетрагидрофуране (200 мл) добавляют трет-бутоксид калия (12,7 г) и полученную смесь перемешивают при 30°С в течение 1 часа. К реакционной смеси добавляют раствор 5-метокси-1-тетралона (5,0 г) в тетрагидрофуране (20 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь добавляют к смеси насыщенного водного раствора хлорида аммония со льдом и затем полученную смесь экстрагируют этилацетатом. Экстракт концентрируют с получением указанного в заголовке соединения в виде неочищенного продукта, имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,34 (гексан:этилацетат = 2:1).
Справочный пример 8
Метиловый эфир 5-(5-метокси-3,4-дигидронафталин-1(2Н)илиден)пентановой кислоты
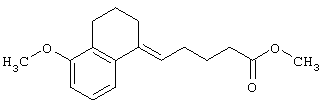
К раствору соединения, полученного в справочном примере 7, в безводном диметилформамиде (40 мл) добавляют метилйодид (5,3 мл) и карбонат калия (17,6 г) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь добавляют в ледяную воду и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 5:1) с получением указанного в заголовке соединения (6,80 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,72 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,18 (дд, J=7,6, 1,2 Гц, 1Н), 7,10 (т, J=7,6 Гц, 1Н), 6,70 (дд, J=7,6, 1,2 Гц, 1Н), 5,96 (шир т, J=7,2 Гц, 1H), 3,81 (с, 3Н), 3,66 (с, 3Н), 2,71 (т, J=6,4 Гц, 2Н), 2,48-2,18 (м, 6Н), 1,89-1,71 (м, 4Н).
Справочный пример 9
5-(5-Гидрокси-3,4-дигидронафталин-1-ил)пентановая кислота
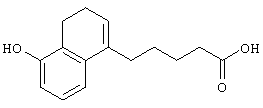
Смесь соединения (6,83 г), полученного в справочном примере 8, и раствора соляной кислоты в пиридине (39 г) перемешивают при 180°С в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, добавляют к ней воду и затем экстрагируют этилацетатом. Экстракт промывают 2 н. соляной кислотой, затем насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением указанного в заголовке соединения в виде неочищенного продукта, имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,12 (гексан:этилацетат = 2:1).
Справочный пример 10
Метиловый эфир 5-(5-гидрокси-3,4-дигидронафталин-1-ил)пентановой кислоты
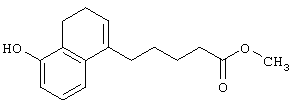
Тионилхлорид (1,9 мл) добавляют к метанолу (25 мл) при температуре -30°С и полученную смесь перемешивают при -20°С в течение 15 минут. К реакционному раствору добавляют раствор соединения, полученного в справочном примере 9, в метаноле (10 мл) и полученную смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь концентрируют. Остаток разбавляют этилацетатом. Разбавленный раствор промывают последовательно насыщенным водным раствором гидрокарбоната натрия, водой, насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 4:1) с получением указанного в заголовке соединения (4,91 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,48 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,08 (т, J=7,8 Гц, 1Н), 6,86 (шир д, J=7,8 Гц, 1H), 6,68 (дд, J=7,8, 1,0 Гц, 1H), 5,85 (т, J=4,4 Гц, 1H), 4,96 (шир с, 1H), 3,66 (с, 3Н), 2,70 (т, J=8,0 Гц, 2H), 2,49-2,17 (м, 6Н), 1,89-1,45 (м, 4Н).
Справочный пример 11
N'-((1Е)-5-Гидрокси-3,4-дигидронафталин-1(2Н)илиден)-2,4,6-триизопропилбензолсульфоногидразид
К раствору 2,4,6-триизопропилбензолсульфонилгидразида (36,8 г) и 5-гидрокси-1,2,3,4-тетрагидронафталин-1-она (20,0 г) в метаноле (250 мл) при комнатной температуре добавляют концентрированную соляную кислоту (4,3 мл) и полученную смесь перемешивают при температуре 40°С в течение 2 часов. Реакционную смесь перемешивают еще 1 час при охлаждении на ледяной бане. Кристаллический осадок отделяют. Кристаллы промывают охлажденным метанолом, сушат при пониженном давлении с получением указанного в заголовке соединения (49,2 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,28 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 7,57 (шир, 1Н), 7,56 (д, J=8,1 Гц, 1H), 7,16 (с, 2Н), 6,99 (т, J=8,1 Гц, 1H), 6,71 (д, J=8,1 Гц, 1H), 4,37-4,24 (м, 2Н), 2,88 (м, 1H), 2,69 (т, J=6,0 Гц, 2Н), 2,43 (т, J=6,6 Гц, 2Н), 1,96-1,85 (м, 2Н), 1,30 (д, J=6,9 Гц, 12H), 1,23 (д, J=6,9 Гц, 6Н).
Справочный пример 12
5-Гидрокси-3,4-дигидронафталин-1-илметанол
К раствору соединения (49,2 г), полученного в справочном примере 11, в безводном тетрагидрофуране (510 мл) при температуре -78°С добавляют н-бутиллитий (221 мл, 1,56 М в гексане) и полученную смесь перемешивают при -78°С в течение 30 минут. Реакционную смесь нагревают до 0°С, затем перемешивают при 0°С в течение 30 минут. К реакционной смеси при охлаждении на ледяной бане добавляют параформальдегид (11,7 г), затем нагревают до комнатной температуры и перемешивают в течение 1 часа. К полученной смеси при охлаждении на ледяной бане добавляют водный раствор хлорида аммония и жидкости разделяют. Водный слой экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 3:1 до 1:1) с получением указанного в заголовке соединения (15,7 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,28 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 9,17 (шир с, 1Н), 6,94 (т, J=8,1 Гц, 1Н), 6,74 (д, J=8,1 Гц, 1Н), 6,68 (дд, J=8,1, 1,2 Гц, 1Н), 6,01 (т, J=4,8 Гц, 1Н), 4,50 (шир с, 1Н), 4,25 (д, J=1,2 Гц, 2H), 2,60 (т, J=7,8 Гц, 2H), 2,22-2,09 (м, 2H).
Справочный пример 13
5-Метоксиметокси-3,4-дигидронафталин-1-илметанол
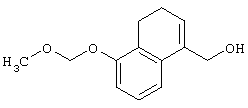
К раствору соединения (15,7 г), полученного в справочном примере 12, в безводном тетрагидрофуране (135 мл) при охлаждении на ледяной бане добавляют гидрид натрия (3,75 г, 63,1%) и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К реакционной смеси по каплям при охлаждении на ледяной бане добавляют простой хлорметилметиловый эфир (7,41 мл) и полученную смесь перемешивают при комнатной температуре в течение 13 часов. К реакционной смеси добавляют ледяную воду и насыщенный водный раствор хлорида аммония, затем смесь экстрагируют этилацетатом. Экстракт промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 4:1 до 2:1) с получением указанного в заголовке соединения (15,1 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,38 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,16 (т, J=7,8 Гц, 1Н), 7,05 (д, J=7,8 Гц, 1Н), 7,00 (д, J=7,8 Гц, 1Н), 6,14 (т, J=4,5 Гц, 1Н), 5,20 (с, 2Н), 4,51 (шир с, 2Н), 3,49 (с, 3Н), 2,82 (т, J=8,1 Гц, 2Н), 2,30 (тд, J=8,1, 4,5 Гц, 2Н), 1,46 (шир с, 1Н).
Справочный пример 14
1-Бромметил-5-метоксиметокси-3,4-дигидронафталин
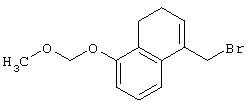
К раствору соединения (7,53 г), полученного в справочном примере 13, и трифенилфосфина (9,59 г) в метиленхлориде (110 мл) при охлаждении на ледяной бане добавляют тетрабромметан (12,1 г) и затем полученную смесь перемешивают при охлаждении на ледяной бане в течение 40 минут. Реакционную смесь концентрируют. К остатку для предотвращения образования оксида трифенилфосфина добавляют смешанный растворитель из диэтилового эфира и гексана (5:1). Полученный неочищенный продукт очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 20:1 до 10:1) с получением указанного в заголовке соединения (6,32 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,76 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,20 (т, J=8,1 Гц, 1Н), 7,12 (д, J=8,1 Гц, 1Н), 7,03 (д, J=8,1 Гц, 1Н), 6,30 (т, J=4,8 Гц, 1Н), 5,20 (с, 2Н), 4,36 (с, 2Н), 3,49 (с, 3Н), 2,83 (т, J=8,7 Гц, 2H), 2,31 (тд, J=8,7, 4,8 Гц, 2Н).
Справочный пример 15
Метиловый эфир 2,2-диметил-3-(5-метоксиметокси-3,4-дигидронафталин-1-ил)пропановой кислоты
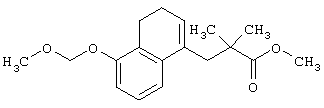
К раствору метилового эфира 2-метилпропановой кислоты (5,11 мл) в безводном тетрагидрофуране (30 мл) при охлаждении на ледяной бане по каплям добавляют диизопропиламид лития (22,3 мл) и полученную смесь перемешивают при 30°С в течение 30 минут. К реакционной смеси при охлаждении на ледяной бане по каплям добавляют раствор соединения (6,32 г), полученного в справочном примере 14, в безводном тетрагидрофуране (20 мл) и полученную смесь перемешивают при комнатной температуре в течение 2 часов. К полученной реационной смеси добавляют насыщенный водный раствор хлорида аммония, затем смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 8:1 до 6:1) с получением указанного в заголовке соединения (7,02 г), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,55 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,10 (т, J=8,1 Гц, 1Н), 6,97 (д, J=8,1 Гц, 1H), 6,94 (д, J=8,1 Гц, 1H), 5,85 (т, J=4,5 Гц, 1H), 3,49 (с, 3Н), 3,47 (с, 3Н), 2,74 (т, J=7,8 Гц, 2Н), 2,72 (с, 2Н), 2,17 (тд, J=7,8, 4,5 Гц, 2H), 1,15 (с, 6Н).
Справочный пример 16
Метиловый эфир 2,2-диметил-3-(5-гидрокси-3,4-дигидронафталин-1-ил)пропановой кислоты
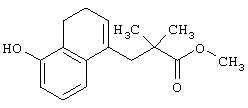
К раствору соединения (6,78 г), полученного в справочном примере 15, в метаноле (110 мл) добавляют 4 н. раствор соляной кислоты в диоксане (8,4 мл) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь концентрируют. Остаток экстрагируют этилацетатом. Экстракт промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют с получением указанного в заголовке соединения (5,78 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,30 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,03 (т, J=8,1 Гц, 1Н), 6,89 (д, J=8,1 Гц, 1H), 6,65 (дд, J=1,2, 8,1 Гц, 1H), 5,85 (т, J=4,5 Гц, 1H), 4,71 (с, 1H), 3,46 (с, 3Н), 2,71 (д, J=1,2 Гц, 2H), 2,67 (т, J=8,1 Гц, 2H), 2,20 (тд, J=8,1, 4,5 Гц, 2H), 1,56 (с, 6Н).
Справочный пример 17
1-Циклопропилиден-5-метокси-1,2,3,4-тетрагидронафталин
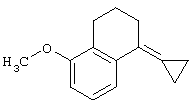
К раствору бромида (3-бромпропил)трифенилфосфиния (19,8 г) в безводном тетрагидрофуране (200 мл) при охлаждении на ледяной бане добавляют трет-бутоксид калия (9,58 г) и полученную смесь перемешивают при комнатной температуре в течение 1,5 часа. К реакционной смеси добавляют 5-метокси-1-тетралон (5,0 г) и полученную смесь перемешивают при комнатной температуре в течение 5 часов. Реационную смесь выливают в насыщенный водный раствор хлорида аммония. Водный слой экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 10:1) с получением указанного в заголовке соединения (5,66 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,86 (гексан:этилацетат = 10:1).
ЯМР (CDCl3): δ 7,56 (д, J=7,8 Гц, 1Н), 7,13 (т, J=7,8 Гц, 1Н), 6,70 (д, J=7,8 Гц, 1Н), 3,83 (с, 3Н), 2,76 (т, J=6,4 Гц, 2Н), 2,66-2,56 (м, 2Н), 1,94-1,80 (м, 2Н), 1,51-1,40 (м, 2Н), 1,12-1,02 (м, 2Н).
Справочный пример 18
1-(3-Бромпропил)-5-метокси-3,4-дигидронафталин
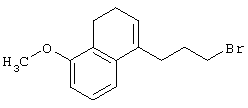
К раствору соединения (5,00 г), полученного в справочном примере 17, в уксусной кислоте (60 мл) добавляют 47% водный раствор бромистого водорода (20 мл) и полученную смесь перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют ледяную воду и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 10:1) с получением указанного в заголовке соединения (7,05 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,69 (гексан:этилацетат = 10:1).
ЯМР (CDCl3): δ 7,16 (т, J = 7,8 Гц, 1Н), 6,90 (д, J=7,8 Гц, 1Н), 6,79 (д, J=7,8 Гц, 1Н), 5,92 (т, J=4,6 Гц, 1Н), 3,83 (с, 3Н), 3,44 (т, J=6,6 Гц, 2Н), 2,74 (т, J=7,6 Гц, 2Н), 2,65-2,55 (м, 2Н), 2,28-2,15 (м, 2Н), 2,13-1,98 (м, 2Н).
Справочный пример 19
Метиловый эфир 2,2-диметил-5-(5-метокси-3,4-дигидронафталин-1-ил)пентановой кислоты
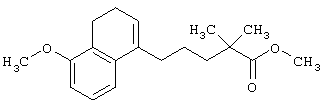
К раствору метилового эфира 2-метилпропановой кислоты (3,30 г) в безводном тетрагидрофуране (15 мл) при охлаждении на ледяной бане добавляют диизопропиламид лития (16,5 мл, 2,0 М) с последующим перемешиванием при 30°С в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры и к полученной смеси добавляют раствор соединения (3,00 г), полученного в справочном примере 18, в безводном тетрагидрофуране (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом:гексан:этилацетат = от 100:1 до 20:1) с получением указанного в заголовке неочищенного соединения (3,68 г), имеющего представленные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,84 (гексан:этилацетат = 2:1).
Справочный пример 20
2,2-Диметил-5-(5-гидрокси-3,4-дигидронафталин-1-ил)пентановая кислота
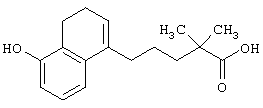
Смесь соединения (3,68 г), полученного в справочном примере 19, и пиридина гидрохлорида (17 г) перемешивают при 180°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, добавляют воду и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением указанного в заголовке соединения в виде неочищенного продукта, имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
TCX: Rf 0,30 (гексан:этилацетат = 2:1).
Справочный пример 21
Метиловый эфир 2,2-диметил-5-(5-гидрокси-3,4-дигидронафталин-1-ил)пентановой кислоты
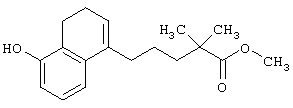
К охлажденному метанолу (11 мл) добавляют тионилхлорид (0,86 мл) с последующим перемешиванием при -20°С в течение 15 минут. К реакционному раствор добавляют раствор соединения, полученного в справочном примере 20, в метаноле и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют. Остаток разбавляют этилацетатом. Разбавленный раствор промывают насыщенным водным раствором гидрокарбоната натрия, затем насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 8:1) с получением указанного в заголовке соединения (2,02 г), имеющего приведенные ниже физические характеристики.
TCX: Rf 0,66 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,05 (т, J=8,0 Гц, 1Н), 6,84 (д, J=8,0 Гц, 1H), 6,68 (дд, J=8,0, 1,0 Гц, 1H), 5,84 (т, J=4,8 Гц, 1H), 5,01 (шир с, 1H), 3,60 (с, 3Н), 2,70 (т, J=8,0 Гц, 2H), 2,44-2,32 (м, 2Н), 2,30-2,17 (м, 2H), 1,75-1,34 (м, 4Н), 1,15 (с, 6Н).
Справочный пример 22
2-Бензилокси-3-(5-метоксиметокси-3,4-дигидронафталин-1-ил)пропановая кислота
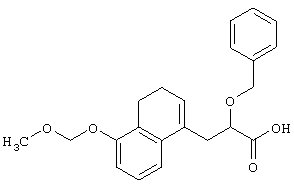
К раствору 2-бензилоксиуксусной кислоты (0,30 мл) в тетрагидрофуране в атмосфере аргона по каплям при температуре -78°С добавляют диизопропиламид лития (2,4 мл) с последующим перемешиванием полученной смеси при 0°С в течение 10 минут. Полученный раствор добавляют к раствору соединения (600 мл), полученного в справочном примере 14, в тетрагидрофуране (3 мл) при -78°С и полученную смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония и два жидких слоя разделяют. Водный слой экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магия и концентрируют. Остаток очищают колоночной хроматографией (силикагель; хлороформ:метанол = 50:1) с получением указанного в заголовке соединения (99 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,33 (гексан:этилацетат = 4:1).
Справочный пример 23
Метиловый эфир 2-бензилокси-3-(5-гидрокси-3,4-дигидронафталин-1-ил)пропановой кислоты

К раствору соединения (99 мг), полученного в справочном примере 22, в метаноле (4 мл) добавляют 4 н. раствор хлористого водорода в диоксане (0,1 мл) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь концентрируют с получением неочищенного указанного в заголовке соединения, имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,48 (гексан:этилацетат = 2:1).
Справочный пример 24
3-Метоксикарбонил-2-(4-метилбензоиламино)пропановая кислота
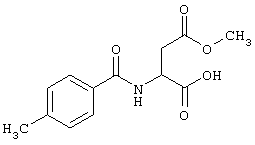
β-Метиловый эфир аспарагиновой кислоты гидрохлорид (184 г) растворяют в воде (1,3 л) и к нему добавляют гидрокарбонат натрия (277 г), к полученной смеси по каплям добавляют тетрагидрофуран (450 мл) и раствор 4-метилбензоилхлорида (146 мл) в тетрагидрофуране (50 л) с последующим перемешиванием полученной смеси при комнатной температуре в течение 15 часов. Реакционную смесь промывают этилацетатом. Водный слой нейтрализуют 2 н. соляной кислотой до рН 2-3 и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением неочищенного указанного в заголовке соединения (255 г), имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,28 (хлороформ:метанол = 5:1).
ЯМР (CDCl3): δ 7,71 (д, J=8,1 Гц, 2Н), 7,34 (д, J=7,8 Гц, 1Н), 7,24 (д, J=8,1 Гц, 2Н), 5,08 (ддд, J=7,5, 4,5, 4,5 Гц, 1Н), 3,73 (с, 3Н), 3,18 (дд, J=17,1, 4,5 Гц, 1Н), 3,00 (дд, J=17,1, 4,5 Гц, 1Н), 2,40 (с, 3Н).
Справочный пример 25
Метиловый эфир 3-ацетил-3-(4-метилбензоиламино)пропановой кислоты
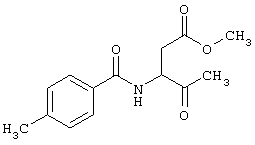
К раствору соединения (255 г), полученного в справочном примере 24, в пиридине (480 мл) добавляют уксусный ангидрид (453 мг) и 4-диметиламинопиридин (3,52 г) с последующим перемешиванием при 90°С в течение часа. Реакционную смесь охлаждают до комнатной температуры и концентрируют. Остаток выливают в ледяную воду и экстрагируют этилацетатом. Экстракт промывают последовательно водой, 2 н. соляной кислотой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением указанного в заголовке соединения в виде неочищенного продукта, имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,23 (гексан:этилацетат = 2:1).
Справочный пример 26
Метиловый эфир 2-(2-(4-метилфенил)-5-метилоксазол-4-ил)уксусной кислоты
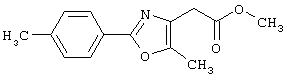
К раствору соединения, полученного в справочном примере 25, в уксусном ангидриде (450 мл) добавляют концентрированную серную кислоту (86 мл) и полученную смесь перемешивают при 90°С в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и выливают в лед. Водный слой нейтрализуют 5 н. водным раствором гидроксида натрия и экстрагируют этилацетатом. Экстракт промывают последовательно 1 н. водным раствором гидроксида натрия, водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Полученное масло оставляют на ночь. Полученное твердое вещество промывают гексаном, отфильтровывают с отсосом и получают указанное в заголовке соединение (183 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0,61 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,87 (д, J=8,1 Гц, 2Н), 7,23 (д, J=8,1 Гц, 2Н), 3,73 (с, 3Н), 3,57 (с, 2Н), 2,38 (с, 3Н), 2,35 (с, 3Н).
Справочный пример 27
2-(2-(4-Метилфенил)-5-метилоксазол-4ил)этанол
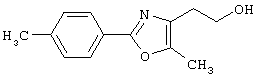
Алюмогидрид лития (18,6 г) при охлаждении на ледяной бане суспендируют в безводном тетрагидрофуране (250 мл) и к полученной смеси по каплям добавляют раствор соединения (120 г), полученного в справочном примере 26, в безводном тетрагидрофуране (250 мл) с последующим перемешиванием в течение 30 минут при охлаждении на ледяной бане. К реакционной смеси по каплям добавляют насыщенный водным раствор сульфата натрия и жидкие слои разделяют. Органический слой сушат над безводным сульфатом магния и фильтруют через целит. Фильтрат концентрируют. Остаток оставляют на ночь. Полученное кристаллическое вещество промывают смесью гексана и этилацетата (10:1) с получением указанного в заголовке соединения (80,0 г), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,18 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (м, 2Н), 7,23 (м, 2Н), 3,92 (шир, 2Н), 2,71 (т, J=6,0 Гц, 2Н), 2,39 (с, 3Н), 2,32 (с, 3Н).
Пример 1
Метиловый эфир 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
К раствору соединения (600 мг), полученного в справочном примере 2, в метиленхлориде (15 мл) добавляют соединение (617 мг), полученное в справочном примере 27, трифенилфосфин (1,02 г) и 1,1'-(азодикарбонил)дипиперидин (978 мг) и полученную смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь разбавляют диэтиловым эфиром и фильтруют через целит. Фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 9:1 до 7:1, затем до 5:1 и затем до 7:2) с получением указанного в заголовке соединения данного изобретения (1,00), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,59 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2Н), 7,23 (д, J=8,1 Гц, 2Н), 7,13 (дд, J=8,0, 8,0 Гц, 1Н), 6,94-6,74 (м, 2Н), 5,87 (дд, J=4,6, 4,6 Гц, 1Н), 4,25 (т, J=6,6 Гц, 2Н), 3,67 (с, 3Н), 2,99 (т, J=6,6 Гц, 2Н), 2,85-2,63 (м, 4Н), 2,60-2,45 (м, 2Н), 2,39 (с, 3Н), 2,36 (с, 3Н), 2,30-2,10 (м, 2Н).
Примеры с 1(1) по 1(46)
Следующие соединения данного изобретения получают в соответствии с методикой примера 1 с использованием соединения, полученного в справочном примере 2, или соответствующего фенольного производного вместо него (справочный пример 6, справочный пример 10, справочный пример 16, справочный пример 21, справочный пример 23 и этиловый эфир 2-(5-гидрокси-3,4-дигидронафталин-1-ил)уксусной кислоты) и соединения, полученного в справочном примере 27, или соответствующего этанольного производного вместо него.
Пример 1 (1)
Метиловый эфир 3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
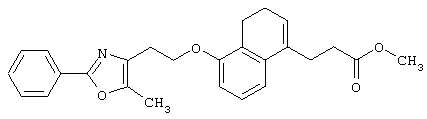
ТСХ: Rf 0,59 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2Н), 7,47-7,37 (м, 3Н), 7,13 (т, J=8,0 Гц, 1H), 6,89 (д, J=8,0 Гц, 1H), 6,80 (д, J=8,0 Гц, 1H), 5,87 (шир т, J=4,5 Гц, 1H), 4,25 (т, J=6,6 Гц, 2Н), 3,67 (с, 3Н), 2,99 (т, J=6,6 Гц, 2Н), 2,82-2,65 (м, 4Н), 2,58-2,47 (м, 2Н), 2,37 (с, 3Н), 2,27-2,11 (м, 2Н).
Пример 1 (2)
Метиловый эфир 3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
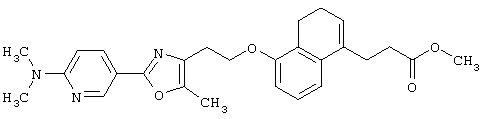
ТСХ: Rf 0,16 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,74 (дд, J=2,4, 0,8 Гц, 1H), 7,99 (дд, J=9,0, 2,4 Гц, 1H), 7,13 (д, J=8,0 Гц, 1H), 6,88 (д, J=8,0 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 6,52 (дд, J=9,0, 0,8 Гц, 1H), 5,87 (шир т, J=4,6 Гц, 1H), 4,24 (т, J=6,8 Гц, 2Н), 3,67 (с, 3Н), 3,14 (с, 6Н), 2,96 (т, J=6,8 Гц, 2Н), 2,82-2,65 (м, 4Н), 2,57-2,47 (м, 2Н), 2,34 (с, 3Н), 2,27-2,11 (м, 2Н).
Пример 1 (3)
Метиловый эфир 3-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,49 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,51 (дд, J=8,2, 1,6 Гц, 1Н), 7,43 (д, J=1,6 Гц, 1Н), 7,13 (дд, J=8,0, 8,0 Гц, 1Н), 6,94-6,76 (м, 3Н), 6,01 (с, 2Н), 5,87 (дд, J=4,5, 4,5 Гц, 1Н), 4,24 (т, J=6,6 Гц, 2Н), 3,67 (с, 3Н), 2,96 (т, J=6,6 Гц, 2Н), 2,84-2,62 (м, 4Н), 2,60-2,45 (м, 2Н), 2,34 (с, 3Н), 2,26-2,10 (м, 2Н).
Пример 1 (4)
Метиловый эфир 3-(5-(2-(2-(4-трет-бутилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,61 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,89 (д, J=8,6 Гц, 2Н), 7,44 (д, J=8,6 Гц, 2H), 7,12 (дд, J=8,2, 8,0 Гц, 1Н), 6,88 (д, J=8,0 Гц, 1Н), 6,80 (д, J=8,0 Гц, 1Н), 5,87 (т, J=6,6 Гц, 1Н), 4,24 (т, J=6,6 Гц, 2Н), 3,67 (с, 3Н), 2,98 (т, J=6,6 Гц, 2Н), 2,82-2,63 (м, 4Н), 2,58-2,47 (м, 2Н), 2,37 (с, 3Н), 2,26-2,10 (м, 2Н), 1,34 (с, 9Н).
Пример 1 (5)
Метиловый эфир 3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,75 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 8,76 (д, J=1,8 Гц, 1Н), 8,04 (дд, J=8,8, 1,8 Гц, 1Н), 7,13 (дд, J=8,0, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,80 (д, J=8,0 Гц, 1Н), 6,64 (д, J=8,8 Гц, 1Н), 5,87 (м, 1Н), 4,23 (т, J=6,4 Гц, 2Н), 3,82 (м, 4Н), 3,59 (м, 4Н), 2,96 (т, J=6,4 Гц, 2H), 2,83-2,63 (м, 4Н), 2,57-2,48 (м, 2H), 2,08 (м, 2Н).
Пример 1 (6)
Метиловый эфир 3-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
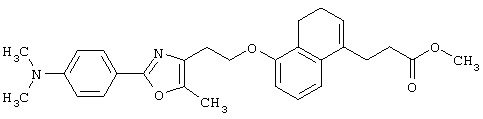
ТСХ: Rf 0,37 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,80 (д, J=9 Гц, 2Н), 7,15 (м, 1Н), 6,90-6,70 (м, 4Н), 5,90 (т, J=4 Гц, 1Н), 4,25 (т, J=7 Гц, 2Н), 3,70 (с, 3Н), 3,00 (с, 6Н), 2,95 (т, J=7 Гц, 2Н), 2,80-2,50 (м, 6Н), 2,35 (с, 3Н), 2,20 (м, 2Н).
Пример 1 (7)
Этиловый эфир 3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,57 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,15 (дд, J=7,5, 7,5 Гц, 1Н), 6,90 (д, J=7,5 Гц, 1Н), 6,80 (д, J=7,5 Гц, 1Н), 5,90 (т, J=4 Гц, 1Н), 4,20-4,10 (м, 4Н), 3,00 (м, 1Н), 2,90 (т, J=6 Гц, 2Н), 2,75 (м, 2Н), 2,65 (т, J=8,5 Гц, 2Н), 2,55 (т, J=8,5 Гц, 2Н), 2,20 (с, 3Н), 2,20 (м, 2Н), 1,35-1,20 (м, 9Н).
Пример 1 (8)
Этиловый эфир 3-(5-(2-(2-(4-трифторметилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,73 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,10 (д, J=8 Гц, 2H), 7,70 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,95-6,80 (м, 2H), 5,85 (м, 1Н), 4,25 (т, J=6 Гц, 2H), 4,15 (кв, J=7 Гц, 2H), 3,00 (т, J=6 Гц, 2H), 2,80-2,65 (м, 4Н), 2,50 (м, 2H), 2,40 (с, 3Н), 2,20 (м, 2H), 1,25 (т, J=7 Гц, 3Н).
Пример 1 (9)
Этиловый эфир 3-(5-(2-(2-(4-трифторметилоксифенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
TCX: Rf 0,74 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,00 (д, J=9 Гц, 2H), 7,25 (д, J=9 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1Н), 6,80 (д, J=8 Гц, 1H), 5,85 (м, 1Н), 4,25 (т, J=6 Гц, 2H), 4,15 (кв, J=7 Гц, 2H), 3,00 (т, J=6 Гц, 2H), 2,80-2,60 (м, 4Н), 2,50 (м, 2H), 2,40 (с, 3Н), 2,20 (м, 2H), 1,25 (т, J=7 Гц, 3Н).
Пример 1 (10)
Этиловый эфир 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
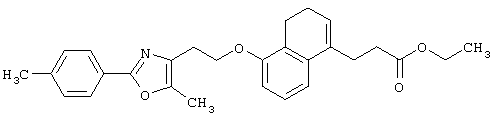
TCX: Rf 0,58 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,85 (д, J=8 Гц, 2H), 7,25 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1H), 6,80 (д, J=8 Гц, 1H), 5,85 (м, 1H), 4,25 (т, J=7 Гц, 2H), 4,15 (кв, J=10 Гц, 2H), 3,00 (т, J=7 Гц, 2H), 2,80-2,65 (м, 4Н), 2,50 (м, 2H), 2,40 (с, 3Н), 2,20 (м, 2H), 1,25 (т, J=10 Гц, 3Н).
Пример 1 (11)
Этиловый эфир 3-(5-(2-(2-(4-хлорфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
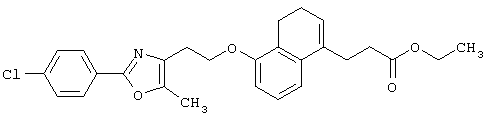
TCX: Rf 0,64 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,95 (д, J=8 Гц, 2Н), 7,40 (д, J=8 Гц, 2Н), 7,15 (дд, J=8,8 Гц, 1H), 6,90 (д, J=8 Гц, 1H), 6,80 (д, J=8 Гц, 1Н), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=6 Гц, 2H), 4,15 (кв, J=7 Гц, 2Н), 3,00 (т, J=6 Гц, 2Н), 2,80-2,65 (м, 4Н), 2,50 (м, 2Н), 2,40 (с, 3Н), 2,20 (м, 2Н), 1,25 (т, J=7 Гц, 3Н).
Пример 1 (12)
Этиловый эфир 3-(5-(2-(2-(4-метилтиофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
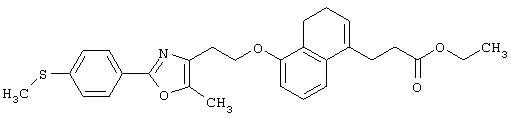
TCX: Rf 0,50 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,85 (д, J=8 Гц, 2Н), 7,30 (д, J=8 Гц, 2Н), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1Н), 6,80 (д, J=8 Гц, 1H), 5,85 (т, J=4 Гц, 1Н), 4,25 (т, J=7 Гц, 2Н), 4,15 (кв, J=7 Гц, 2Н), 3,00 (т, J=7 Гц, 2Н), 2,80-2,65 (м, 4Н), 2,50 (с, 3Н), 2,50 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 2Н), 1,25 (т, J=7 Гц, 3Н).
Пример 1 (13)
Этиловый эфир 3-(5-(2-(2-(4-изопропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
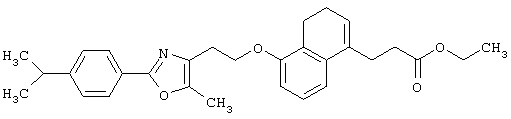
TCX: Rf 0,65 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,90 (д, J=8 Гц, 2Н), 7,25 (д, J=8 Гц, 2Н), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1H), 6,80 (д, J=8 Гц, 1H), 5,85 (т, J=4 Гц, 1Н), 4,25 (т, J=6 Гц, 2H), 4,15 (кв, J=7 Гц, 2H), 3,00-2,90 (м, 3Н), 2,80-2,65 (м, 4Н), 2,50 (м, 2H), 2,35 (с, 3Н), 2,20 (м, 2H), 1,20 (д, J=8 Гц, 6H), 1,20 (т, J=7 Гц, 3Н).
Пример 1 (14)
Этиловый эфир 3-(5-(2-(2-(4-пропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
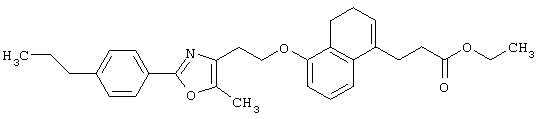
ТСХ: Rf 0,65 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,80 (д, J=8 Гц, 2H), 7,25 (д, J=8 Гц, 2H), 7,10 (м, 1Н), 6,90 (м, 1Н), 6,75 (м, 1Н), 5,85 (м, 1Н), 4,25 (т, J=6 Гц, 2H), 4,15 (кв, J=7 Гц, 2H), 3,00 (т, J=6 Гц, 2H), 2,80-2,60 (м, 8Н), 2,55 (м, 2H), 2,35 (с, 3Н), 2,20 (м, 2H), 1,25 (т, J=7 Гц, 3Н), 0,95 (т, J=8 Гц, 3Н).
Пример 1 (15)
Этиловый эфир 3-(5-(2-(2-(2,2-дифтор-1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
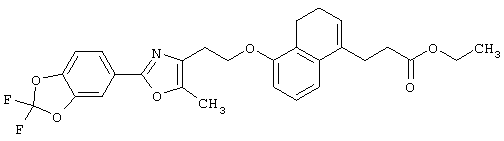
ТСХ: Rf 0,61 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,75 (м, 1Н), 7,70 (м, 1Н), 7,15-7,05 (м, 2H), 6,90 (д, J=8 Гц, 1Н), 6,80 (д, J=8 Гц, 1Н), 5,85 (т, J=4 Гц, 1Н), 4,25 (т, J=7 Гц, 2H), 4,15 (кв, J=7 Гц, 2H), 3,00 (т, J=7 Гц, 2H), 2,80-2,65 (м, 4Н), 2,55 (м, 2Н), 2,35 (с, 3Н), 2,20 (м, 2Н), 1,25 (т, J=7 Гц, 3Н).
Пример 1 (16)
Этиловый эфир 3-(5-(2-(2-(6-диэтиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
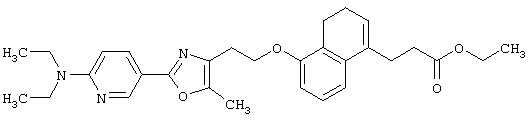
ТСХ: Rf 0,32 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,71 (д, J=2,4 Гц, 1Н), 7,94 (дд, J=9,0, 2,4 Гц, 1Н), 7,13 (дд, J=7,8, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,80 (д, J=7,8 Гц, 1Н), 6,47 (д, J=9,0 Гц, 1Н), 5,87 (т, J=4,5 Гц, 1Н), 4,23 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,55 (кв, J=7,2 Гц, 4Н), 2,96 (т, J=6,6 Гц, 2Н), 2,82-2,62 (м, 4Н), 2,58-2,44 (м, 2Н), 2,33 (с, 3Н), 2,26-2,10 (м, 2Н), 1,34-1,12 (м, 9Н).
Пример 1 (17)
Этиловый эфир 3-(5-(2-(2-пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
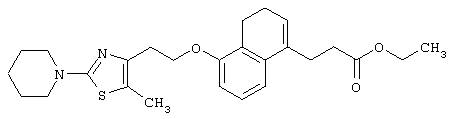
ТСХ: Rf 0,63 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,12 (т, J=7,8 Гц, 1Н), 6,88 (д, J=7,8 Гц, 1Н), 6,79 (д, J=7,8 Гц, 1Н), 5,87 (т, J=4,8 Гц, 1Н), 4,21 (т, J=6,9 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,36 (т, J=4,8 Гц, 4Н), 2,95 (т, J=6,9 Гц, 2Н), 2,76 (т, J=7,2 Гц, 2Н), 2,70 (т, J=8,7 Гц, 2Н), 2,51 (т, J=8,7 Гц, 2Н), 2,25 (с, 3Н), 2,23-2,14 (м, 2Н), 1,70-1,53 (м, 6Н), 1,25 (т, J=7,2 Гц, 3Н).
Пример 1 (18)
Этиловый эфир 3-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
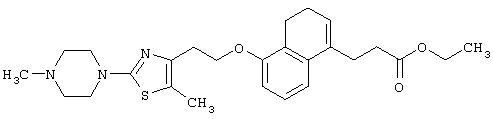
ТСХ: Rf 0,47 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 7,13 (т, J=7,8 Гц, 1Н), 6,88 (д, J=7,8 Гц, 1H), 6,79 (д, J=7,8 Гц, 1H), 5,87 (т, J=4,5 Гц, 1H), 4,21 (т, J=6,9 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,41 (т, J=5,1 Гц, 4H), 2,96 (т, J=6,9 Гц, 2Н), 2,76 (т, J=8,1 Гц, 2Н), 2,69 (т, J=8,4 Гц, 2Н), 2,55-2,45 (м, 6Н), 2,33 (с, 3Н), 2,26 (с, 3Н), 2,23-2,13 (м, 2Н), 1,25 (т, J=7,2 Гц, 3Н).
Пример 1 (19)
Этиловый эфир 3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
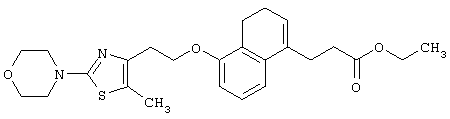
ТСХ: Rf 0,36 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,13 (т, J=8,1 Гц, 1H), 6,89 (д, J=8,1 Гц, 1H), 6,79 (д, J=8,1 Гц, 1H), 5,87 (т, J=4,8 Гц, 1H), 4,21 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,79 (т, J=4,8 Гц, 4H), 3,37 (т, J=4,8 Гц, 4H), 2,96 (т, J=6,6 Гц, 2Н), 2,76 (т, J=7,8 Гц, 2Н), 2,69 (т, J=7,8 Гц, 2Н), 2,51 (т, J=7,8 Гц, 2Н), 2,27 (с, 3Н), 2,24-2,14 (м, 2Н), 1,25 (т, J=7,2 Гц, 3Н).
Пример 1 (20)
Этиловый эфир 3-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
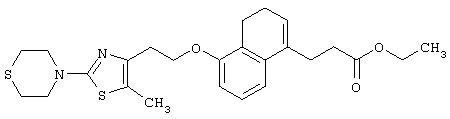
TCX: Rf 0,62 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,13 (т, J=7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 6,79 (д, J=7,8 Гц, 1H), 5,87 (т, J=4,5 Гц, 1Н), 4,20 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,77-3,70 (м, 4Н), 2,94 (т, J=6,6 Гц, 2Н), 2,80-2,64 (м, 8Н), 2,50 (т, J=7,8 Гц, 2Н), 2,25 (с, 3Н), 2,23-2,13 (м, 2Н), 1,25 (т, J=7,2 Гц, 3Н).
Пример 1 (21)
Этиловый эфир 3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
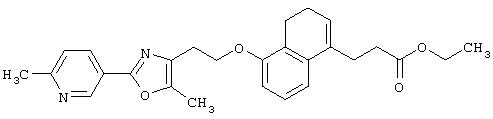
TCX: Rf 0,47 (хлороформ:метанол = 19:1).
ЯМР (CDCl3): 9,07 (д, J=1,8 Гц, 1H), 8,12 (дд, J=8,1, 1,8 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 7,14 (т, J=7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 6,80 (д, J=7,8 Гц, 1H), 5,87 (т, J=4,2 Гц, 1H), 4,25 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 2,99 (т, J=6,6 Гц, 2Н), 2,75 (т, J=9,0 Гц, 2Н), 2,69 (т, J=8,4 Гц, 2Н), 2,60 (с, 3Н), 2,50 (т, J=8,4 Гц, 2Н), 2,38 (с, 3H), 2,24-2,14 (м, 2Н), 1,24 (т, J=7,2 Гц, 3H).
Пример 1 (22)
Этиловый эфир 3-(5-(2-(2-(1,5-диметилпиразол-3-ил)-5-метилоксазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пропановой кислоты
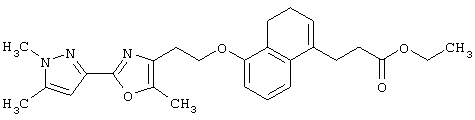
ТСХ: Rf 0,56 (хлороформ:метанол = 19:1).
ЯМР (CDCl3): δ 7,12 (т, J=8,1 Гц, 1Н), 6,88 (д, J=8,1 Гц, 1Н), 6,79 (д, J=8,1 Гц, 1Н), 6,51 (с, 1Н), 5,85 (м, 1Н), 4,24 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,85 (с, 3H), 2,97 (т, J=6,6 Гц, 2Н), 2,75 (т, J=7,5 Гц, 2Н), 2,68 (т, J=8,4 Гц, 2Н), 2,50 (т, J=8,4 Гц, 2Н), 2,35 (с, 3H), 2,31 (с, 3H), 2,23-2,13 (м, 2Н), 1,25 (т, J=7,2 Гц, 3H).
Пример 1 (23)
Этиловый эфир 3-(5-(2-(2-(4-метилпиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,63 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,12 (т, J=7,8 Гц, 1Н), 6,88 (д, J=7,8 Гц, 1H), 6,79 (д, J=7,8 Гц, 1Н), 5,90-5,84 (м, 1Н), 4,21 (т, J=6,9 Гц, 2Н), 4,14 (кв, J=7,2 Гц, 2Н), 3,90-3,72 (м, 2Н), 2,95 (т, J=6,9 Гц, 2Н), 2,94-2,81 (м, 2Н), 2,80-2,65 (м, 4Н), 2,54-2,47 (м, 2Н), 2,24 (с, 3Н), 2,24-2,14 (м, 2Н), 1,74-1,50 (м, 3Н), 1,34-1,20 (м, 2Н), 1,25 (т, J=7,2 Гц, 3Н), 0,96 (д, J=6,6 Гц, 3Н).
Пример 1 (24)
Этиловый эфир 3-(5-(2-(2-(5-метилпиразин-2-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,28 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 9,16 (м, 1Н), 8,51 (м, 1Н), 7,13 (дд, J=7,8, 7,8 Гц, 1Н), 6,90 (д, J=7,8 Гц, 1Н), 6,79 (д, J=7,8 Гц, 1Н), 5,87 (дд, J=4,5, 4,5 Гц, 1Н), 4,28 (т, J=6,3 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2H), 3,03 (т, J=6,3 Гц, 2Н), 2,80-2,60 (м, 7Н), 2,53-2,46 (м, 2Н), 2,44 (с, 3Н), 2,22-2,13 (м, 2Н), 1,24 (т, J=7,2 Гц, 3Н).
Пример 1 (25)
Этиловый эфир 3-(5-(2-(2-(1,2,3,6-тетрагидропиридин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,63 (гексан:этилацетат = 1:1).
Пример 1 (26)
Этиловый эфир 2-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси) 3,4-дигидронафталин-1-ил)уксусной кислоты
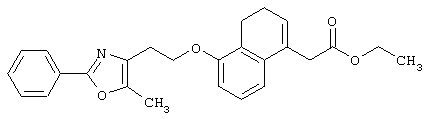
TCX: Rf 0,42 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 8,01-7,94 (м, 2H), 7,48-7,37 (м, 3Н), 7,11 (т, J=8,0 Гц, 1Н), 6,82 (д, J=8,0 Гц, 1H), 6,80 (д, J=8,0 Гц, 1Н), 5,98 (т, J=4,6 Гц, 1H), 4,25 (т, J=6,6 Гц, 2Н), 4,12 (кв, J=7,2 Гц, 2Н), 3,42-3,39 (м, 2Н), 2,99 (т, J=7,2 Гц, 2Н), 2,76 (т, J=8,2 Гц, 2Н), 2,37 (с, 3Н), 2,33-2,19 (м, 2Н), 1,21 (т, J=7,2 Гц, 3Н).
Пример 1 (27)
Этиловый эфир 2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты
TCX: Rf 0,57 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2H), 7,23 (д, J=8,1 Гц, 2H), 7,10 (дд, J=7,8, 7,8 Гц, 1Н), 6,81 (м, 2H), 5,97 (т, J=4,5 Гц, 1H), 4,24 (т, J=6,6 Гц, 2H), 4,13 (кв, J=7,2 Гц, 2H), 3,46 (с, 2H), 2,98 (т, J=6,6 Гц, 2H), 2,76 (т, J=8,4 Гц, 2H), 2,38 (с, 3Н), 2,35 (с, 3Н), 2,27 (м, 2H), 1,21 (т, J=7,2 Гц, 3Н).
Пример 1 (28)
Этиловый эфир 2-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты
TCX: Rf 0,45 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,10 (дд, J=7,8, 7,8 Гц, 1Н), 6,86-6,74 (м, 2Н), 5,98 (дд, J=4,5, 4,5 Гц, 1Н), 4,15 (кв, J=6,9 Гц, 2H), 4,15 (т, J=8,4 Гц, 2H), 3,40 (д, J=1,2 Гц, 2H), 2,99 (септ, J=6,9 Гц, 1Н), 2,88 (т, J=6,6 Гц, 2H), 2,74 (т, J=6,9 Гц, 2H), 2,32-2,20 (м, 2H), 2,24 (с, 3Н), 1,31 (д, J=6,9 Гц, 6Н), 1,22 (т, J=6,9 Гц, 3H).
Пример 1 (29)
Этиловый эфир 2-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты
TCX: Rf 0,63 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,94-7,84 (м, 2H), 7,32-7,22 (м, 2H), 7,10 (дд, J=8,1, 8,1 Гц, 1Н), 6,86-6,76 (м, 2H), 5,98 (т, J=4,5 Гц, 1H), 4,24 (т, J=6,6 Гц, 2H), 4,12 (кв, J=7,2 Гц, 2H), 3,40 (д, J=1,2 Гц, 2H), 2,98 (т, J=6,6 Гц, 2H), 2,76 (т, J=8,1 Гц, 2H), 2,53 (м, 1Н), 2,35 (с, 3Н), 2,32-2,20 (м, 2H), 1,96-1,70 (м, 5Н), 1,54-1,26 (м, 5Н), 1,21 (т, J=7,2 Гц, 3Н).
Пример 1 (30)
Этиловый эфир 2-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты
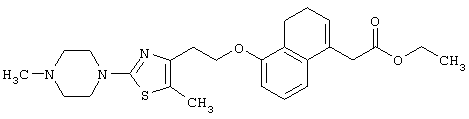
TCX: Rf 0,21 (метанол:этилацетат = 1:10).
ЯМР (CDCl3): δ 7,10 (дд, J=8,1, 8,1 Гц, 1Н), 6,81 (д, J=8,1 Гц, 1Н), 6,79 (д, J=8,1 Гц, 1Н), 5,98 (шир т, 1Н), 4,20 (т, J=6,9 Гц, 2Н), 4,13 (кв, J=6,9 Гц, 2Н), 3,44-3,36 (м, 6Н), 2,96 (т, J=6,9 Гц, 2Н), 2,76 (дд, J=8,4, 8,4 Гц, 2Н), 2,50 (м, 4Н), 2,33 (с, 3Н), 2,26 (с, 3Н), 2,31-2,21 (м, 2Н), 1,22 (т, J=6,9 Гц, 3Н).
Пример 1 (31)
Этиловый эфир 2-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты
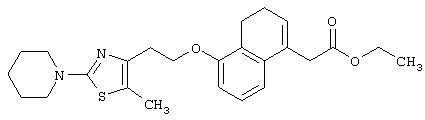
TCX: Rf 0,58 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,10 (дд, J=7,8, 7,8 Гц, 1Н), 6,85-6,76 (м, 2Н), 5,98 (дд, J=4,8, 4,8 Гц, 1Н), 4,20 (т, J=6,6 Гц, 2Н), 4,13 (кв, J=7,2 Гц, 2Н), 3,40 (м, 2Н), 3,36 (м, 4Н), 2,95 (т, J=6,6 Гц, 2H), 2,76 (дд, J=8,4, 8,4 Гц, 2Н), 2,33-2,20 (м, 2Н), 2,24 (с, 3Н), 1,70-1,54 (м, 6Н), 1,20 (т, J=7,2 Гц, 3Н).
Пример 1 (32)
Метиловый эфир 5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты
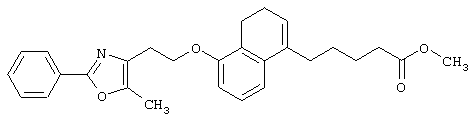
TCX: Rf 0,52 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2Н), 7,48-7,37 (м, 3Н), 7,12 (т, J=8,0 Гц, 1Н), 6,87 (д, J=8,0 Гц, 1Н), 6,79 (д, J=8,0 Гц, 1Н), 5,84 (т, J=4,4 Гц, 1H), 4,25 (т, J=6,6 Гц, 2H), 3,65 (с, 3Н), 2,99 (т, J=6,6 Гц, 2H), 2,71 (т, J=7,8 Гц, 2H), 2,43 (т, J=,6 Гц, 2H), 2,38 (с, 3Н), 2,32 (т, J=7,8 Гц, 2Н), 2,25-2,11 (м, 2Н), 1,86-1,44 (м, 4Н).
Пример 1 (33)
Метиловый эфир 5-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пентановой кислоты
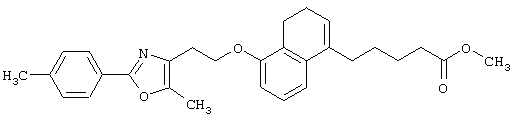
TCX: Rf 0,41 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 7,85 (д, J=8 Гц, 2H), 7,25 (д, J=8 Гц, 2H), 7,10 (м, 1H), 6,90-6,65 (м, 2H), 5,85 (т, J=7 Гц, 1H), 4,25 (т, J=7 Гц, 2H), 3,65 (с, 3Н), 3,00 (т, J=7 Гц, 2H), 2,70 (т, J=8 Гц, 2H), 2,50-2,10 (м, 12Н), 1,80-1,50 (м, 4Н).
Пример 1 (34)
Метиловый эфир 5-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты
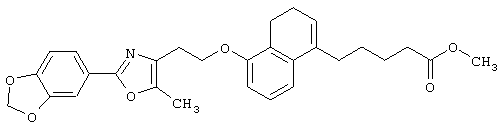
TCX: Rf 0,31 (гексан:этилацетат = 3:1).
ЯМР (CDCl3): δ 7,55 (дд, J=8,1 Гц, 1H), 7,45 (д, J=1 Гц, 1H), 7,10 (дд, J=7,5, 7,5 Гц, 1H), 6,90-6,85 (м, 3Н), 6,00 (с, 2H), 5,85 (т, J=7 Гц, 1H), 4,20 (т, J=6,5 Гц, 2H), 3,65 (с, 3Н), 3,00 (т, J=6,5 Гц, 2H), 2,70, (т, J=8 Гц, 2H), 2,50-2,10 (м, 9Н), 1,80-1,50 (м, 4Н).
Пример 1 (35)
Метиловый эфир 5-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты
ТСХ: Rf 0,33 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,80 (д, J=8 Гц, 2H), 7,10 (м, 1Н), 6,90-6,70 (м, 4Н), 5,85 (м, 1Н), 4,20 (т, J=6,5 Гц, 2H), 3,65 (с, 3Н), 3,00 (с, 6Н), 2,95 (м, 2H), 2,70 (м, 2H), 2,50-2,10 (м, 6Н), 1,80-1,50 (м, 4Н).
Пример 1 (36)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,62 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2H), 7,48-7,34 (м, 3Н), 7,08 (т, J=8,1 Гц, 1Н), 6,90 (д, J=8,1 Гц, 1Н), 6,77 (д, J=8,1 Гц, 1Н), 5,83 (т, J=4,8 Гц, 1Н), 4,24 (т, J=6,6 Гц, 2H), 3,46 (с, 3Н), 2,99 (т, J=6,6 Гц, 2H), 2,71 (с, 2H), 2,68 (т, J=5,1 Гц, 2H), 2,37 (с, 3Н), 2,19-2,09 (м, 2Н), 1,13 (с, 6Н).
Пример 1 (37)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
ТСХ: Rf 0,38 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 8,73 (д, J=2,4 Гц, 1Н), 7,99 (дд, J=9,0, 2,4 Гц, 1Н), 7,08 (дд, J=8,1, 8,1 Гц, 1Н), 6,90 (д, J=8,1 Гц, 1Н), 6,77 (д, J=8,1 Гц, 1Н), 6,52 (д, J=9,0 Гц, 1Н), 5,83 (т, J=4,5 Гц, 1Н), 4,23 (т, J=6,6 Гц, 2H), 3,46 (с, 3Н), 3,14 (с, 6Н), 2,96 (т, J=6,6 Гц, 2Н), 2,71 (с, 2H), 2,68 (т, J=8,1 Гц, 2H), 2,34 (с, 3Н), 2,17-2,10 (м, 2H), 1,13 (с, 6Н).
Пример 1 (38)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
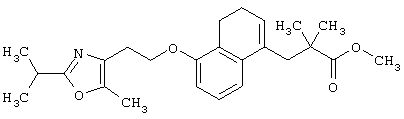
ТСХ: Rf 0,63 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 7,08 (дд, J=8,4, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1H), 6,74 (д, J=8,4 Гц, 1Н), 5,83 (м, 1Н), 4,16 (т, J=6,6 Гц, 2H), 3,46 (с, 3Н), 2,99 (куинт, J=7,2 Гц, 1Н), 2,89 (т, J=6,6 Гц, 2H), 2,71 (с, 2H), 2,66 (т, J=8,1 Гц, 2H), 2,24 (с, 3Н), 2,80-2,40 (м, 2Н), 1,31 (д, J=7,2 Гц, 6Н), 1,14 (с, 6Н).
Пример 1 (39)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-(пиридин-1-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
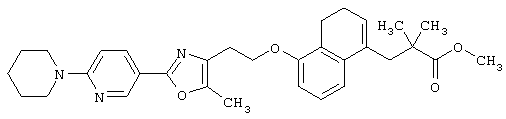
ТСХ: Rf 0,38 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,73 (дд, J=2,4, 0,6 Гц, 1Н), 7,98 (дд, J=9,0, 2,4 Гц, 1Н), 7,08 (дд, J=7,8, 7,8 Гц, 1Н), 6,90 (д, J=7,8 Гц, 1Н), 6,77 (д, J=7,8 Гц, 1Н), 6,65 (дд, J=9,0, 0,6 Гц, 1Н), 5,83 (т, J=4,5 Гц, 1Н), 4,22 (т, J=6,6 Гц, 2Н), 3,68-3,54 (м, 4Н), 3,46 (с, 3Н), 2,96 (т, J=6,6 Гц, 2Н), 2,71 (с, 2Н), 2,74-2,62 (м, 2Н), 2,34 (с, 3Н), 2,20-2,06 (м, 2Н), 1,78-1,54 (м, 6Н), 1,13 (с, 6Н).
Пример 1 (40)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
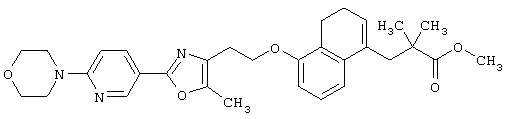
ТСХ: Rf 0,65 (хлороформ:метанол = 8:1).
ЯМР (CDCl3): δ 8,76 (дд, J=2,4, 0,9 Гц, 1Н), 8,04 (дд, J=9,0, 2,4 Гц, 1Н), 7,08 (дд, J=7,8, 7,8 Гц, 1Н), 6,90 (д, J=7,8 Гц, 1H), 6,77 (д, J=7,8 Гц, 1Н), 6,65 (дд, J=9,0, 0,9 Гц, 1Н), 5,83 (т, J=4,5 Гц, 1Н), 4,23 (т, J=6,6 Гц, 2Н), 3,86-3,78 (м, 4Н), 3,64-3,54 (м, 4Н), 3,46 (с, 3Н), 2,97 (т, J=6,6 Гц, 2Н), 2,76-2,62 (м, 4Н), 2,35 (с, 3Н), 2,13 (м, 2Н), 1,78-1,54 (м, 2Н), 1,14 (с, 6Н).
Пример 1 (41)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
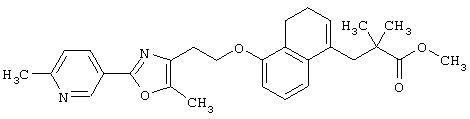
ТСХ: Rf 0,53 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 9,08 (д, J=1,8 Гц, 1H), 8,12 (дд, J=8,1, 1,8 Гц, 1Н), 7,22 (д, J=8,1 Гц, 1H), 7,08 (дд, J=8,1, 8,1 Гц, 1H), 6,90 (д, J=8,1 Гц, 1H), 6,77 (д, J=8,1 Гц, 1H), 5,83 (т, J=4,5 Гц, 1H), 4,24 (т, J=6,6 Гц, 2Н), 2,99 (т, J=6,6 Гц, 2Н), 2,71 (с, 2Н), 2,67 (т, J=8,1 Гц, 2Н), 2,61 (с, 3Н), 2,38 (с, 3Н), 2,14 (м, 2Н), 1,13 (с, 6Н).
Пример 1 (42)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
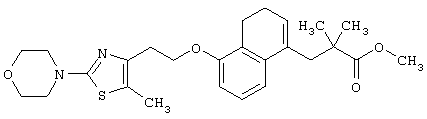
ТСХ: Rf 0,40 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,08 (дд, J=8,1, 7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 6,76 (д, J=8,1 Гц, 1H), 5,83 (т, J=4,8 Гц, 1H), 4,20 (т, J=6,9 Гц, 2Н), 3,79 (т, J=4,8 Гц, 4Н), 3,37 (т, J=4,8 Гц, 4Н), 2,96 (т, J=6,9 Гц, 2Н), 2,71 (с, 2Н), 2,67 (т, J=7,2 Гц, 2Н), 2,27 (с, 3Н), 2,17-2,10 (м, 2Н), 1,14 (с, 6Н).
Пример 1 (43)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
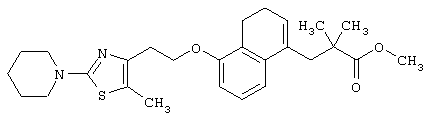
ТСХ: Rf 0,90 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 7,07 (дд, J=7,8, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,76 (д, J=8,1 Гц, 1Н), 5,83 (т, J=4,8 Гц, 1Н), 4,20 (т, J=6,6 Гц, 2Н), 3,46 (с, 3Н), 3,36 (м, 4Н), 2,95 (т, J=6,6 Гц, 2Н), 2,71 (с, 2Н), 2,68 (т, J=8,4 Гц, 2Н), 2,25 (с, 3Н), 2,17-2,10 (м, 2Н), 1,61 (м, 6Н), 1,14 (с, 6Н).
Пример 1 (44)
Метиловый эфир 2,2-диметил-3-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
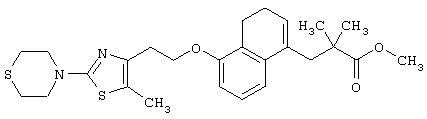
ТСХ: Rf 0,76 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 7,08 (дд, J=8,1, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,75 (д, J=8,1 Гц, 1Н), 5,83 (т, J=4,8 Гц, 1Н), 4,19 (т, J=6,6 Гц, 2Н), 3,76-3,73 (м, 4Н), 3,47 (с, 3Н), 2,94 (т, J=6,6 Гц, 2Н), 2,71-2,67 (м, 8Н), 2,25 (с, 3Н), 2,17-2,10 (м, 2Н), 1,14 (с, 6Н).
Пример 1 (45)
Метиловый эфир 2,2-диметил-5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты
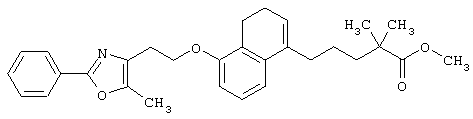
ТСХ: Rf 0,68 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2Н), 7,48-7,37 (м, 3Н), 7,11 (т, J=7,8 Гц, 1Н), 6,85 (д, J=7,8 Гц, 1H), 6,78 (д, J=7,8 Гц, 1H), 5,82 (т, J=4,4 Гц, 1H), 4,25 (т, J=6,6 Гц, 2Н), 3,59 (с, 3Н), 2,99 (т, J=6,6 Гц, 2Н), 2,71 (т, J=7,6 Гц, 2Н), 2,44-2,32 (м, 2Н), 2,24-2,11 (м, 2Н), 1,65-1,33 (м, 4Н), 1,14 (с, 6Н).
Пример 1 (46)
Метиловый эфир 2-бензилокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты
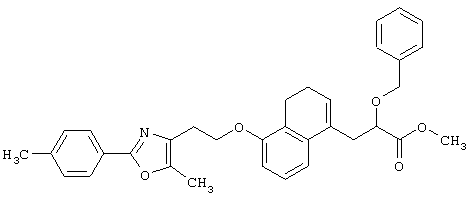
ТСХ: Rf 0,27 (гексан:этилацетат = 4:1).
ЯМР (CDCl3): δ 7,87 (м, 2Н), 7,26-7,18 (м, 7Н), 7,08 (дд, J=8,1, 8,1 Гц, 1H), 6,84 (д, J=8,1 Гц, 1H), 6,79 (д, J=8,1 Гц, 1H), 5,95 (дд, J=4,5, 4,5 Гц, 1H), 4,63 (д, J=1,7 Гц, 1H), 4,34 (д, J=11,7 Гц, 1Н), 4,26 (т, J=6,6 Гц, 2Н), 4,16 (дд, J=9,0, 3,6 Гц, 1Н), 3,70 (с, 3Н), 3,04-2,58 (м, 6Н), 2,38 (с, 3Н), 2,37 (с, 3Н), 2,24-2,14 (м, 2Н).
Пример 2
3-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
Соединение (950 мг), полученное в примере 1, растворяют в метаноле (8,0 мл) и тетрагидрофуране (8,0 мл), к полученной смеси добавляют 2 н. водный раствор гидроксида натрия (3,3 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь подкисляют 1 н. соляной кислотой и экстрагируют смесью этилацетата и тетрагидрофурана. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетата и тетрагидрофурана с получением соединения данного изобретения (745 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,63 (хлороформ:метанол = 8:1).
ЯМР (CDCl3): δ 7,79 (д, J=8,2 Гц, 2Н), 7,29 (д, J=8,2 Гц, 2Н), 7,14 (дд, J=8,0, 8,0 Гц, 1Н), 6,97-6,78 (м, 2Н), 5,84 (шир т, 1Н), 4,19 (т, J=5,8 Гц, 2Н), 2,91 (т, J=5,8 Гц, 2Н), 2,75-2,20 (м, 6Н), 2,33 (с, 3Н), 2,36 (с, 3Н), 2,20-1,94 (м, 2Н).
Примеры с 2 (10) по 2 (41)
Представленные ниже соединения данного изобретения получают способом, описанным в примере 2, при использовании соединения, полученного в примерах 1 (1)-1 (9), в примерах 1 (11)-1 (27) и в примерах 1 (32)-1 (46), вместо соединения, полученного в примере 1, и, если это необходимо, с последующим превращением в соответствующую соль известным способом.
Пример 2 (1)
3-(5-(2-(2-Фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
ТСХ: Rf 0,51 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2Н), 7,46-7, 37 (м, 3Н), 7,13 (т, J=8,0 Гц, 1H), 6,88 (д, J=8,0 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 5,89 (шир т, J=4,6 Гц, 1H), 4,25 (т, J=6,6 Гц, 2Н), 3,00 (т, J=6,6 Гц, 2Н), 2,83-2,52 (м, 6H), 2,37 (с, 3Н), 2,27-2,12 (м, 2Н).
Пример 2 (2)
3-(5-(2-(2-(6-Диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
ТСХ: Rf 0,47 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 8,73 (дд, J=2,4, 0,4 Гц, 1H), 8,00 (дд, J=9,0, 2,4 Гц, 1H), 7,12 (т, J=8,0 Гц, 1H), 6,89 (д, J=8,0 Гц, 1H), 6,80 (д, J=8,0 Гц, 1H), 6,53 (дд, J=9,0, 0,4 Гц, 1H), 5,89 (шир т, J=4,4 Гц, 1Н), 4,23 (т, J=6,6 Гц, 2H), 3,14 (с, 6Н), 2,97 (т, J=6,6 Гц, 2H), 2,83-2,52 (м, 6Н), 2,34 (с, 3Н), 2,26-2,12 (м, 2Н).
Пример 2 (3)
3-(5-(2-(2-(1,3-Диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
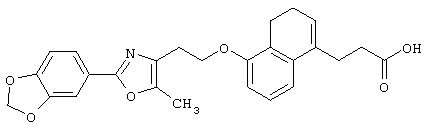
ТСХ: Rf 0,61 (хлороформ:метанол = 8:1).
ЯМР (ДМСО-d6): δ 7,43 (д, J=8,3 Гц, 1Н), 7,35 (с, 1Н), 7,14 (дд, J=8,0, 8,0 Гц, 1Н), 7,01 (д, J=8,3 Гц, 1Н), 6,96-6,75 (м, 2Н), 6,09 (с, 2Н), 5,84 (ширт, 1Н), 4,18 (т, J=6,0 Гц, 2Н), 2,90 (т, J=6,0 Гц, 2Н ), 2,75-2,20 (м, 6Н), 2,31 (с, 3Н), 2,20-1,94 (м, 2Н).
Пример 2 (4)
3-(5-(2-(2-(4-трет-Бутилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота

ТСХ: Rf 0,47 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,90 (д, J=8,6 Гц, 2H), 7,44 (д, J=8,6 Гц, 2H), 7,12 (дд, J=7,8, 7,6 Гц, 1Н), 6,88 (д, J=7,6 Гц, 1Н), 6,80 (д, J=7,8 Гц, 1Н), 5,88 (т, J=6,6 Гц, 1Н), 4,24 (т, J=6,4Гц, 2H), 2,99 (т, J=6,4 Гц, 2H), 2,84-2,50 (м, 6Н), 2,35 (с, 3Н), 2,19 (м, 2H), 1,33 (с, 9Н).
Пример 2 (5)
3-(5-(2-(2-(6-(Морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
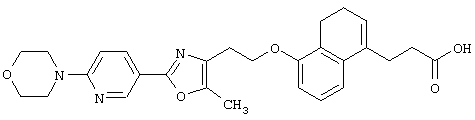
ТСХ: Rf 0,32 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 8,61 (д, J=2,4 Гц, 1H), 7,97 (дд, J=8,8, 2,4 Гц, 1H), 7,13 (дд, J=8,4, 7,4 Гц, 1H), 6,96-6,82 (м, 3Н), 5,84 (т, J=4,4 Гц, 1H), 4,17 (т, J=6,4 Гц, 2H), 3,68 (м, 4Н), 3,53 (м, 4Н), 2,89 (т, J=6,4 Гц, 2H), 2,69-2,45 (м, 4Н), 2,43-2,28 (м, 2H), 2,31 (с, 3Н), 2,10 (м, 2Н),
Пример 2 (6)
3-(5-(2-(2-(4-Диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
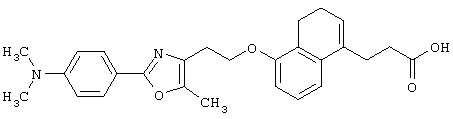
ТСХ: Rf 0,50 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 7,80 (д, J=9 Гц, 2H), 7,15 (м, 1H), 6,90-6,70 (м, 4Н), 5,90 (т, J=4 Гц, 1H), 4,25 (т, J=7 Гц, 2H), 3,00 (с, 6Н), 2,95 (т, J=7 Гц, 2H), 2,80-2,50 (м, 6Н), 2,35 (с, 3Н), 2,20 (м, 2Н).
Пример 2 (7)
3-(5-(2-(2-Изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
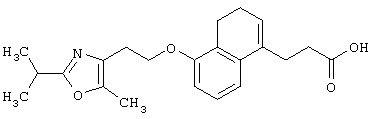
TCX: Rf 0,43 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 7,15 (дд, J=7,5, 7,5 Гц, 1Н), 6,85 (д, J=7,5 Гц, 1Н), 6,80 (д, J=7,5 Гц, 1Н), 5,90 (т, J=4 Гц, 1Н), 4,20 (т, J=6 Гц, 2Н), 3,00(м, 1Н), 2,90 (т, J=6 Гц, 2Н), 2,75 (м, 2Н), 2,65 (т, J=8,5 Гц, 2Н), 2,55 (т, J=8,5 Гц, 2Н), 2,20 (с, 3Н), 2,20 (м, 2Н), 1,30 (д, J=6 Гц, 6Н).
Пример 2 (8)
3-(5-(2-(2-(4-Трифторметилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
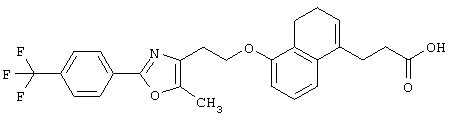
TCX: Rf 0,60 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 8,10 (д, J=8 Гц, 2Н), 7,85 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,95-6,85 (м, 2Н), 5,85 (м, 1Н), 4,20 (т, J=6 Гц, 2Н), 2,95 (т, J=6 Гц, 2Н), 2,70-2,50 (м, 4Н), 2,40 (с, 3Н), 2,40 (м, 2Н), 2,10 (м, 2Н).
Пример 2 (9)
3-(5-(2-(2-(4-Трифторметилоксифенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота

TCX: Rf 0,51 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 8,00 (д, J=9 Гц, 2H), 7,50 (д, J=9 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,95-6,85 (м, 2H), 5,85 (м, 1Н), 4,20 (т, J=6 Гц, 2H), 2,95 (т, J=6 Гц, 2H), 2,70-2,50 (м, 4Н), 2,40 (м, 2H), 2,40 (с, 3Н), 2,10 (м, 2H).
Пример 2 (10)
3-(5-(2-(2-(4-Хлорфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
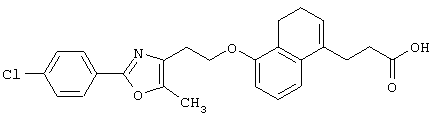
TCX: Rf 0,60 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 7,95 (д, J=8 Гц, 2H), 7,60 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,95 (д, J=8 Гц, 1Н), 6,90 (д, J=8 Гц, 1Н), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=6 Гц, 2H), 2,95 (т, J=6 Гц, 2H), 2,65-2,50 (м, 6Н), 2,40 (с, 3Н), 2,10 (м, 2H).
Пример 2 (11)
3-(5-(2-(2-(4-Метилтиофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
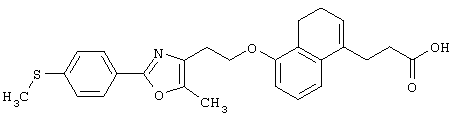
TCX: Rf 0,49 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 7,80 (д, J=8 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,95 (д, J=8 Гц, 1Н), 6,90 (д, J=8 Гц, 1H), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=7 Гц, 2H), 2,95 (т, J=7 Гц, 2H), 2,65-2,55 (м, 4Н), 2,50 (с, 3Н), 2,40 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 2Н).
Пример 2 (12)
3-(5-(2-(2-(4-Изопропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота

ТСХ: Rf 0,58 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 7,80 (д, J=8 Гц, 2Н), 7,35 (д, J=8 Гц, 2H), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1Н), 6,85 (д, J=8 Гц, 1H), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=6 Гц, 2Н), 3,00-2,90 (м, 3Н), 2,65-2,50 (м, 4Н), 2,40-2,35 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 2Н), 1,20 (д, J=8 Гц, 6H).
Пример 2 (13)
3-(5-(2-(2-(4-Пропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
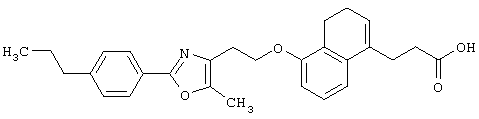
ТСХ: Rf 0,53 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 7,80 (д, J=8 Гц, 2Н), 7,30 (д, J=8 Гц, 2Н), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1Н), 6,85 (д, J=8 Гц, 1Н), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=6 Гц, 2Н), 2,95 (т, J=6 Гц, 2Н), 2,65-2,50 (м, 8Н), 2,40-2,35 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 2Н), 0,90 (т, J=8 Гц, 3Н).
Пример 2 (14)
3-(5-(2-(2-(2,2-Дифтор-1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
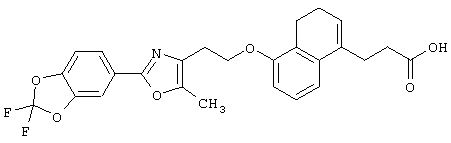
ТСХ: Rf 0,51 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 7,85 (м, 1Н), 7,80 (м, 1Н), 7,55 (д, J=8 Гц, 1Н), 7,15 (дд, J=8,8 Гц, 1Н), 6,90 (д, J=8 Гц, 1H), 6,85 (д, J=8 Гц, 1Н), 5,85 (т, J=4 Гц, 1Н), 4,20 (т, J=7 Гц, 2Н), 2,95 (т, J=7 Гц, 2Н), 2,65-2,50 (м, 4Н), 2,40-2,35 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 2Н).
Пример 2 (15)
3-(5-(2-(2-(6-Диэтиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пропановая кислота

ТСХ: Rf 0,54 (хлороформ:метанол = 8:1).
ЯМР (ДМСО-d6): δ 8,56 (д, J=2,4 Гц, 1Н), 7,88 (дд, J=9,0, 2,4 Гц, 1Н), 7,13 (дд, J=7,8, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,86 (д, J=7,8 Гц, 1Н), 6,65 (д, J=9,0 Гц, 1Н), 5,84 (дд, J=4,2, 4,2 Гц, 1Н), 4,17 (т, J=6,3 Гц, 2Н), 3,51 (кв, J=6,9 Гц, 4Н), 3,32 (шир с, 1Н), 2,88 (т, J=6,9 Гц, 2Н), 2,70-2,46 (м, 4Н), 2,36 (т, J=7,2 Гц, 2Н), 2,30 (с, 3Н), 2,18-2,00 (м, 2Н), 1,10 (т, J=6,9 Гц, 6H).
Пример 2 (16)
3-(5-(2-(2-(Пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид
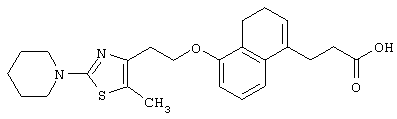
ТСХ: Rf 0,55 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,10 (шир, 1H), 7,13 (т, J=8,1 Гц, 1H), 6,87(д, J=8,1 Гц, 1H), 6,85 (д, J=8,1 Гц, 1H), 5,85 (т, J=4,5 Гц, 1H), 4,13 (т, J=6,6 Гц, 2Н), 3,39-3,22 (м, 4Н), 2,83 (т, J=6,6 Гц, 2H), 2,61 (т, J=7,2 Гц, 2H), 2,55 (т, J=7,8 Гц, 2H), 2,36 (т, J=7,8 Гц, 2H), 2,18 (с, 3Н), 2,14-2,04 (м, 2H), 1,58-1,48 (м, 6Н).
Пример 2 (17)
3-(5-(2-(2-(4-Метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид
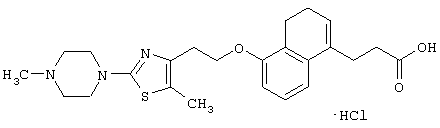
ТСХ: Rf 0,30 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,05 (шир, 1H), 7,13 (т, J=8,1 Гц, 1H), 6,86 (д, J=8,1 Гц, 1H), 6,85 (д, J=8,1 Гц, 1H), 5,85 (т, J=4,2 Гц, 1H), 4,13 (т, J=6,6 Гц, 2H), 3,27 (т, J=4,8 Гц, 4H), 2,84 (т, J=6,6 Гц, 2H), 2,61 (т, J=7,5 Гц, 2H), 2,55 (т, J=8,1 Гц, 2H), 2,41-2,32 (м, 6Н), 2,19 (с, 6Н), 2,14-2,04 (м, 2H).
Пример 2 (18)
3-(5-(2-(2-(Морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид
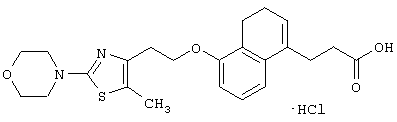
TCX: Rf 0,45 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,02 (шир, 1Н), 7,13 (т, J=7,8 Гц, 1H), 6,86 (д, J=7,8 Гц, 1H), 6,85 (д, J=7,8 Гц, 1H), 5,85 (т, J=4,2 Гц, 1H), 4,14 (т, J=6,3 Гц, 2Н), 3,66 (т, J=4,8 Гц, 4Н), 3,25 (т, J=4,8 Гц, 4H), 2,85 (т, J=6,3 Гц, 2H), 2,61 (т, J=7,5 Гц, 2H), 2,55 (т, J=8,1 Гц, 2H), 2,36 (т, J=8,1 Гц, 2H), 2,20 (с, 3Н), 2,14-2,04 (м, 2H).
Пример 2 (19)
3-(5-(2-(2-(Тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид

TCX: Rf 0,45 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,09 (шир, 1H), 7,13 (т, J=7,8 Гц, 1H), 6,86 (д, J=7,8 Гц, 1H), 6,85 (д, J=7,8 Гц, 1H), 5,85 (т, J=4,2 Гц, 1H), 4,14 (т, J=6,6 Гц, 2H), 3,67-3,58 (м, 4H), 2,84 (т, J=6,6 Гц, 2H), 2,66-2,49 (м, 8Н), 2,36 (т, J=8,1 Гц, 2H), 2,19 (с, 3Н), 2,15-2,05 (м, 2H).
Пример 2 (20)
3-(5-(2-(2-(6-Метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид
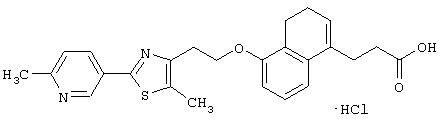
ТСХ: Rf 0,48 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,09 (шир, 1H), 8,94 (д, J=2,1 Гц, 1H), 8,11 (дд, J=8,1, 2,1 Гц, 1Н), 7,37 (д, J=8,1 Гц, 1H), 7,14 (т, J=8,1 Гц, 1H), 6,90 (д, J=8,1 Гц, 1H), 6,85 (д, J=8,1 Гц, 1H), 5,84 (т, J=4,2 Гц, 1H), 4,20 (т, J=6,0 Гц, 2H), 2,93 (т, J=6,0 Гц, 2Н), 2,61 (т, J=7,5 Гц, 2H), 2,56 (т, J=8,4 Гц, 2H), 2,51 (с, 3Н), 2,40 (т, J=7,5 Гц, 2Н), 2,35 (с, 3Н), 2,14-2,04 (м, 2Н).
Пример 2 (21)
3-(5-(2-(2-(1,5-Диметилпиразол-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, гидрохлорид

ТСХ: Rf 0,39 (хлороформ:метанол = 9:1).
ЯМР (ДМСО-d6): δ 12,09 (шир, 1H), 7,14 (т, J=8,1 Гц, 1H), 6,89 (д, J=8,1 Гц, 1H), 6,86 (д, J=8,1 Гц, 1H), 6,45 (с, 1H), 5,84 (т, J=4,2 Гц, 1H), 4,17 (т, J=6,3 Гц, 2H), 3,76 (с, 3Н), 2,88 (т, J=6,3 Гц, 2H), 2,61 (т, J=7,5 Гц, 2H), 2,54 (т, J=7,8 Гц, 2H), 2,36 (т, J=7,5 Гц, 2H), 2,28 (с, 3Н), 2,27 (с, 3Н), 2,14-2,04 (м, 2Н).
Пример 2 (22)
3-(5-(2-(2-(4-Метилпиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
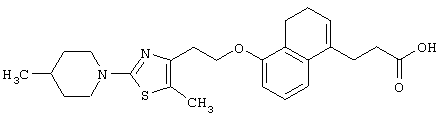
ТСХ: Rf 0,55 (этилацетат).
ЯМР (ДМСО-d6): δ 7, 04 (т, J=7,8 Гц, 1Н), 6,77 (д, J=7,8 Гц, 1H), 6,76 (д, J=7,8 Гц, 1H), 5,78-5,72 (м, 1Н), 4,04 (т, J=6,6 Гц, 2H), 3,70-3,58 (м, 2H), 2,84-2,74 (м, 2H), 2,80 (бс, 1H), 2,74 (т, J=6,6 Гц, 2H), 2,55-2,40 (м, 4Н), 2,30-2,23 (м, 2H), 2,08 (с, 3Н), 2,05-1,95 (м, 2H), 1,60-1,35 (м, 3Н), 1,14-0,94 (м, 2H), 0,80 (д, J=6,6 Гц, 3Н).
Пример 2 (23)
3-(5-(2-(2-(5-Метилпиразин-2-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
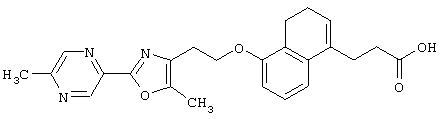
ТСХ: Rf 0,51 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 12,08 (шир, 1H), 9,06 (м, 1H), 8,60 (м, 1H), 7,14 (дд, J=8,1, 8,1 Гц, 1H), 6,90 (д, J=8,1 Гц, 1H), 6,86 (д, J=8,1 Гц, 1H), 5,84 (дд, J=4,5, 4,5 Гц, 1H), 4,22 (т, J=6,3 Гц, 2H), 2,97 (т, J=6,3 Гц, 2H), 2,65-2,52 (м, 7Н), 2,38 (с, 3Н), 2,40-2,32 (м, 2H), 2,13-2,04 (м, 2Н).
Пример 2 (24)
3-(5-(2-(2-(1,2,3,6-Тетрагидропиридин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
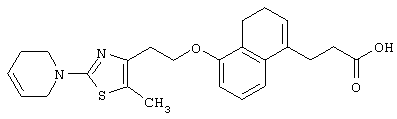
ТСХ: Rf 0,40 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 7,12 (т, J=7,8 Гц, 1H), 6,87 (д, J=7,8 Гц, 1H), 6,80 (д, J=7,8 Гц, 1H), 5,92-5,84 (м, 2Н), 5,78-5,70 (м, 1H), 4,21 (т, J=6,9 Гц, 2H), 3,86 (дт, J=5,4, 2,7 Гц, 2Н), 3,54 (т, J=5,7 Гц, 2H), 2,97 (т, J=6,9 Гц, 2H), 2,80-1,60 (шир, 1H), 2,80-2,72 (м, 2H), 2,70 (т, J=8,1 Гц, 2H), 2,60-2,54 (м, 2H), 2,30-2,18 (м, 4Н), 2,26 (с, 3Н).
Пример 2 (25)
2-(5-(2-(2-Фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусная кислота
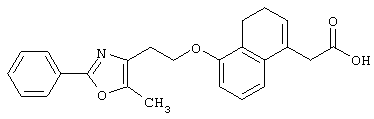
ТСХ: Rf 0,54 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 8,01-7,92 (м, 2H), 7,48-7,36 (м, 3Н), 7,09 (т, J=8,0 Гц, 1H), 6,83 (д, J=8,0 Гц, 1H), 6,76 (д, J=8,0 Гц, 1H), 6,00 (т, J=4,8 Гц, 1H), 4,20 (т, J=6,4 Гц, 2H), 3,43 (ширс, 2H), 2,98(т, J=6,4 Гц, 2H), 2,75 (т, J=8,0 Гц, 2H), 2,35 (с, 3Н), 2,32-2,18 (м, 2H).
Пример 2 (26)
2-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусная кислота
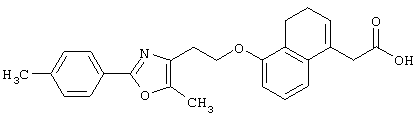
TCX: Rf 0,45 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2H), 7,22 (д, J=8,1 Гц, 2H), 7,09 (дд, J=7,8, 7,8 Гц, 1Н), 6,83 (д, J=7,8 Гц, 1H), 6,78(д, J=7,8 Гц, 1H), 6,00 (т, J=4,5 Гц, 1H), 4,02 (т, J=6,6 Гц, 2H), 3,44 (с, 2H), 2,97 (т, J=6,6 Гц, 2H), 2,75 (т, J=6,6 Гц, 2H), 2,38 (с, 3Н), 2,34 (с, 3Н), 2,26 (м, 2H).
Пример 2 (27)
5-(5-(2-(2-Фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота
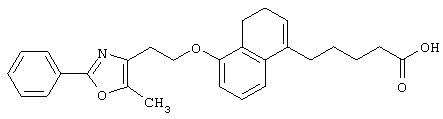
TCX: Rf 0,55 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 8,02-7,94 (м, 2H), 7,48-7,37 (м, 3Н), 7,12 (т, J=8,0 Гц, 1H), 6,87 (т, J=8,0 Гц, 1H), 6,79 (д, J=8,0 Гц, 1H), 5,84 (т, J=4,6 Гц, 1H), 4,25 (т, J=6,4 Гц, 2H), 3,00 (т, J=6,4 Гц, 2H), 2,71 (т, J=7,4 Гц, 2H), 2,50-2,30 (м, 7Н), 2,25-2,10 (м, 2H), 1,78-1,45 (м, 4Н).
Пример 2 (28)
5-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота
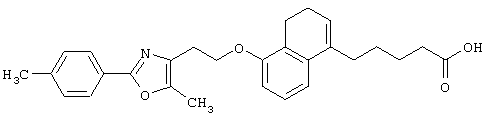
ТСХ: Rf 0,27 (хлороформ:метанол = 20:1).
ЯМР (CDCl3): δ 7,85 (д, J=8 Гц, 2H), 7,20 (д, J=8 Гц, 2H), 7,15 (дд, J=8, 8 Гц, 1H), 6,85 (д, J=8 Гц, 1Н), 6,80 (д, J=8 Гц, 1H), 5,85 (т, J=7 Гц, 1H), 4,25 (т, J=7 Гц, 2H), 3,00 (т, J=7 Гц, 2H), 2,70 (т, J=8 Гц, 2H), 2,50-2,30 (м, 4Н), 2,40 (с, 3Н), 2,30 (с, 3Н), 2,20 (м, 2H), 1,80-1,50 (м, 4Н).
Пример 2(29)
5-(5-(2-(2-(1,3-Диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота
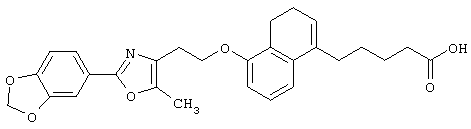
ТСХ: Rf 0,20 (хлороформ:метанол = 20:1).
ЯМР (CDCl3+CD3OD): δ 7,55 (дд, J=8 Гц, 1H), 7,45 (д, J=1 Гц, 1H), 7,15 (дд, J=7,5, 7,5 Гц, 1H), 6,90 (д, J=7,5 Гц, 1H), 6,85 (д, J=8 Гц, 1H), 6,80 (д, J=7,5 Гц, 1H), 6,00 (с, 2H), 5,85 (т, J=4 Гц, 1H), 4,20 (т, J=6,5 Гц, 2H), 2,95 (т, J=6,5 Гц, 2H), 2,70 (т, J=8 Гц, 2H), 2,50-2,20 (м, 4Н), 2,30 (с, 3Н), 2,20 (м, 2H), 1,80-1,45 (м, 4Н).
Пример 2 (30)
5-(5-(2-(2-(4-Диметиламинофенил)-5-метилоксазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пентановая кислота
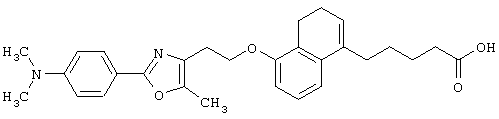
TCX: Rf 0,55 (хлороформ:метанол = 9:1).
ЯМР (CDCl3): δ 7,80 (д, J=8 Гц, 2H), 7,10 (м, 1Н), 6,90-6,70 (м, 4Н), 5,85 (м, 1H), 4,20 (т, J=6,5 Гц, 2Н), 3,00 (с, 6Н), 2,95 (м, 2Н), 2,70 (м, 2Н), 2,50-2,10 (м, 6Н), 1,80-1,50 (м, 4Н).
Пример 2 (31)
2,2-Диметил-3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота

TCX: Rf 0,35 (гексан:этилацетат = 2:1).
ЯМР (ДМСО-d6): δ 12,07 (шир, 1Н), 7,93-7,86 (м, 2Н), 7,53-7,42 (м, 3Н), 7,09 (т, J=8,1 Гц, 1Н), 6,95 (д, J=8,1 Гц, 1H), 6,86 (д, J=8,1 Гц, 1H), 5,84 (т, J=4,2 Гц, 1H), 4,19 (т, J=6,3 Гц, 2H), 2,93 (т, J=6,3 Гц, 2H), 2,65 (с, 2H), 2,55 (т, J=7,8 Гц, 2H), 2,34 (с, 3Н), 2,08-1,98 (м, 2H), 0,99 (с, 6Н).
Пример 2 (32)
2,2-Диметил-3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
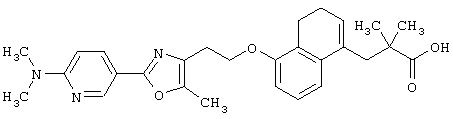
TCX: Rf 0,62 (гексан:этилацетат = 1:19).
ЯМР (CDCl3): δ 8,73 (д, J=2,7 Гц, 1H), 8,05 (дд, J=8,7, 2,7 Гц, 1Н), 7,08 (дд, J=7,8, 7,8 Гц, 1Н), 6,96 (д, J=7,8 Гц, 1H), 6,76 (д, J=7,8 Гц, 1H), 6,58 (д, J=8,7 Гц, 1H), 5,91 (т, J=4,5 Гц, 1H), 4,23 (т, J=6,3 Гц, 2H), 3,20 (с, 6Н), 2,96 (т, J=6,3 Гц, 2H), 2,76 (с, 2Н), 2,68 (т, J=7,5 Гц, 2H), 2,34 (с, 3Н), 2,18-2,11 (м, 2H), 1,15 (с, 6Н).
Пример 2 (33)
2,2-Диметил-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, 1/2 кальциевая соль
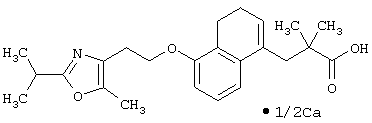
TCX: Rf 0,86 (гексан:этилацетат = 1:19).
ЯМР (ДМСО-d6): δ 7,06 (м, 1H), 7,58 (д, J=7,5 Гц, 1H), 6,80 (д, J=8,1 Гц, 1H), 5,88 (м, 1H), 4,10 (т, J=6, 9 Гц, 2H), 2,94 (куинт, J=6,9 Гц, 1H), 2,79 (т, J=6,6 Гц, 2H), 2,63 (с, 2H), 2,50 (м, 2H), 2,19 (с, 3Н), 2,05 (м, 2H), 1,20 (д, J=6,9 Гц, 6Н), 0,89 (с, 6Н).
Пример 2 (34)
2,2-Диметил-3-(5-(2-(2-(6-пиридин-1-ил)пиридин-3-ил)-5-метилоксзол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, натриевая соль

TCX: Rf 0,59 (хлороформ:метанол = 8:1).
ЯМР (ДМСО-d6): δ 8,57 (д, J=2,1 Гц, 1H), 7,90 (дд, J=9,0, 2,1 Гц, 1Н), 7,06 (дд, J=8,1, 7,5 Гц, 1Н), 6,97 (д, J=7,5 Гц, 1H), 6,87 (д, J=9,0 Гц, 1H), 6,81 (д, J=8,1 Гц, 1H), 5,84 (т, J=4,5 Гц, 1H), 4,15 (т, J=6,3 Гц, 2H), 3,68-3,50 (м, 4Н), 2,88 (т, J=6,3 Гц, 2Н), 2,66-2,48 (м, 4Н), 2,29 (с, 3Н), 2,14-1,92 (м, 2H), 1,70-1,38 (м, 6Н), 0,85 (с, 6Н).
Пример 2 (35)
2,2-Диметил-3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пропановая кислота, натриевая соль
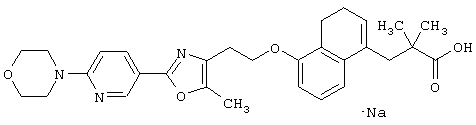
TCX: Rf 0,56 (хлороформ:метанол = 8:1).
ЯМР (ДМСО-d6): 8,61 (д, J=2,1 Гц, 1H), 7,97 (дд, J=9,0, 2,1 Гц, 1H), 7,06 (дд, J=8,1, 7,5 Гц, 1H), 6,97 (д, J=8,1 Гц, 1H), 6,91 (д, J=9,0 Гц, 1H), 6,81 (д, J=7,5 Гц, 1H), 5,84 (т, J=4,5 Гц, 1H), 4,16 (т, J=6,0 Гц, 2H), 3,76-3,62 (м, 4Н), 3,60-3,44 (м, 4Н), 2,89 (т, J=6,0 Гц, 2H), 2,64-2,48 (м, 4Н), 2,31 (с, 3Н), 2,14-1,92 (м, 4Н), 0,84 (с, 6Н).
Пример 2 (36)
2,2-Диметил-3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
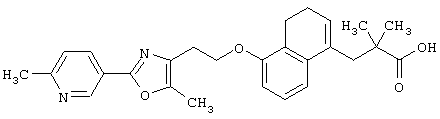
TCX: Rf 0,48 (гексан:этилацетат = 1:19).
ЯМР (CDCl3): δ 9,05 (д, J=1,8 Гц, 1H), 8,13 (дд, J=8,4, 1,8 Гц, 1Н), 7,22 (д, J=8,1 Гц, 1Н), 7,07 (дд, J=8,1, 8,1 Гц, 1Н), 6,96 (д, J=8,1 Гц, 1Н), 6,75 (д, J=8,4 Гц, 1Н), 5,91 (м, 1Н), 4,24 (т, J=6,6 Гц, 2Н), 2,98 (т, J=6,6 Гц, 2Н), 2,76 (с, 2Н), 2,68 (т, J=7,8 Гц, 2Н), 2,60 (с, 3Н), 2,38 (с, 3Н), 2,18-2,11 (м, 2Н), 1,15 (с, 6Н).
Пример 2 (37)
2,2-Диметил-3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
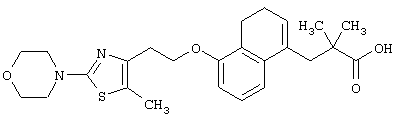
TCX: Rf 0,72 (гексан:этилацетат = 1:19).
ЯМР (CDCl3): δ 7,08 (дд, J=8,1, 7,5 Гц, 1Н), 6,95 (д, J=7,5 Гц, 1Н), 6,76 (д, J=8,1 Гц, 1H), 5,90 (т, J=4,8 Гц, 1H), 4,21 (т, J=6,6 Гц, 2Н), 3,79 (т, J=4,8 Гц, 4Н), 3,39 (м, 4Н), 2,98 (т, J=6,6 Гц, 2Н), 2,76 (с, 2Н), 2,67 (т, J=7,8 Гц, 2H), 2,27 (с, 3Н), 2,18-2,11 (м, 2H), 1,14 (с, 6Н).
Пример 2 (38)
2,2-Диметил-3-(5-(2-(2-пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
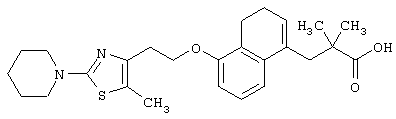
TCX: Rf 0,76 (хлороформ:метанол = 19:1).
ЯМР (CDCl3): δ 7,07 (дд, J=7,8, 7,8 Гц, 1Н), 6,94 (д, J=7,8 Гц, 1Н), 6,76 (д, J=7,8 Гц, 1H), 5,90 (т, J=4,8 Гц, 1H), 4,20 (т, J=6,9 Гц, 2H), 3,36 (м, 4H), 2,95 (т, J=6,9 Гц, 2H), 2,76 (c, 2H), 6,69 (т, J=8,4 Гц, 2H), 2,24 (c, 3H), 2,18-2,11 (м, 2H), 1,62 (м, 6H), 1,14 (с, 6Н).
Пример 2 (39)
2,2-Диметил-3-(5-(2-(2-тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси-3,4-дигидронафталин-1-ил)пропановая кислота
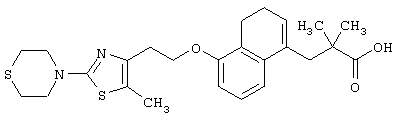
TCX: Rf 0,73 (хлороформ:метанол = 19:1).
ЯМР (CDCl3): δ 7,08 (дд, J=8,7, 8,7 Гц, 1H), 6,95 (д, J=8,7 Гц, 1H), 6,76 (д, J=8,7 Гц, 1H), 5,91 (м, 1H), 4,20 (т, J=6,6 Гц, 2H), 3,75 (м, 4H), 2,94 (т, J=6,6 Гц, 2H), 2,77 (с, 2H), 2,68 (м, 6H), 2,25 (с, 3H), 2,15 (м, 2H), 1,15 (с, 6H).
Пример 2 (40)
2,2-Диметил-5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота
TCX: Rf 0,49 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 8,01-7,92 (м, 2H), 7,48-7,36 (м, 3Н), 7,10 (т, J=8,0 Гц, 1H), 6,86 (д, J=8,0 Гц, 1H), 6,77 (д, J=8,0 Гц, 1H), 5,83 (т, J=4,6 Гц, 1H), 4,24 (т, J=6,6 Гц, 2H), 2, 99 (т, J=6,6 Гц, 2Н), 2,7 0 (т, J=7,8 Гц, 2H), 2,46-2,32 (м, 2Н), 2,36 (с, 3Н), 2,24-2,11 (м, 2H), 1,67-1,40 (м, 4Н), 1,17 (с, 6Н).
Пример 2 (41)
2-Бензилокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
TCX: Rf 0,38(хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,86 (м, 2H), 7,34-7,12 (м, 7Н), 7,08 (дд, J=8,1, 8,1 Гц, 1H), 6,89 (д, J=8,1 Гц, 1H), 6,80 (д, J=8,1 Гц, 1H), 5,99 (дд, J=4,5, 4,5 Гц, 1H), 4,57 (д, J=11,7 Гц, 1H), 4,41 (д, J=11,7 Гц, 1H), 4,29-4,20 (м, 2H), 4,16 (дд, J=9,0, 3,6 Гц, 1H), 3,10 (м, 1H), 3,00 (т, J=6,6 Гц, 2H), 2,90-2,66 (м, 2H), 2,60 (м, 1H), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,25-2,12 (м, 2H).
Пример 3
2-(5-(2-(2-(4-Циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол
К суспензии алюмогидрида лития (147 мг) в тетрагидрофуране (7,0 мл) при 0°С по каплям добавляют раствор соединения (1,93 г), полученного в примере 1 (29), в тетрагидрофуране (12 мл) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. Реакционную смесь охлаждают до 0°С и к полученной смеси добавляют насыщенный водный раствор сульфата натрия. Реакционную смесь сушат над безводным сульфатом магния и концентрируют. Остаток перекристаллизовывают из смеси гексана и этилацетата с получением соединения данного изобретения (1,26 г), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,50 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 7,92-7,84 (м, 2H), 1,30-7,22 (м, 2Н), 7,13 (дд, J=8,1, 8,1 Гц, 1Н), 7,89 (д, J=8,1 Гц, 1H), 6,81 (д, J=8,1 Гц, 1H), 5,95 (т, J=4,5 Гц, 1H), 4,25 (т, J=6,6 Гц, 2H), 3,82-3,68 (м, 2Н), 2,98 (т, J=6,6 Гц, 2H), 2,78-2,66 (м, 4Н), 2,53 (м, 1H), 2,36 (с, 3Н), 2,30-2,16 (м, 2H), 1,96-1,70 (м, 5Н), 1,54-1,14 (м, 5Н).
Примеры с 3 (1) по 3 (5)
Представленные ниже соединения получают в соответствии с методикой примера 3 с использованием соединения, полученного в примере 1 (27), 1 (28), 1 (30), 1 (31) и в примере 2, вместо соединения, полученного в примере 1 (29).
Пример 3 (1)
2-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол
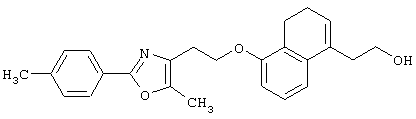
ТСХ: Rf 0,27 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,4 Гц, 2H), 7,23 (д, J=8,4 Гц, 2H), 7,12 (дд, J=8,1, 8,1 Гц, 1Н), 6,89 (д, J=8,1 Гц, 1H), 6,81 (д, J=8,1 Гц, 1H), 5,94 (т, J=4,5 Гц, 1H), 4,25 (т, J=6,6 Гц, 2H), 3,76 (м, 2H), 2,98 (т, J=6,6 Гц, 2H), 2,78-2,67 (м, 4Н), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,22 (м, 2H).
Пример 3 (2)
2-(5-(2-(2-Изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол
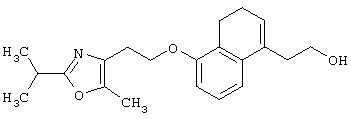
ТСХ: Rf 0,34 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 7,12 (дд, J=7,8, 7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 6,79 (дд, J=7,8, 0,9 Гц, 1H), 5,95 (дд, J=4,5, 4,5 Гц, 1H), 4,17 (т, J=6,6 Гц, 2H), 3,82-3,70 (м, 2H), 2,99 (септ, J=6,9 Гц, 1H), 2,89 (т, J=6,6 Гц, 2H), 2,76-2,66 (м, 4Н), 2,28-2,16 (м, 2H), 2,25 (с, 3Н), 1,31 (д, J=6,9 Гц, 6H).
Пример 3 (3)
2-(5-(2-(2-(4-Метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол
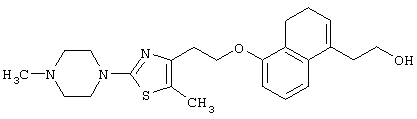
TCX: Rf 0,26 (метанол:этилацетат = 1:5).
ЯМР (CDCl3): δ 7,12 (дд, J=8,1, 8,1 Гц, 1Н), 6,88 (д, J=8,1 Гц, 1Н), 6,80 (д, J=8,1 Гц, 1Н), 5,95 (шир т, 1H), 4,22 (т, J=6,6 Гц, 2H), 3,76 (т, J=6,6 Гц, 2Н), 3,40 (шир т, 4Н), 2,96 (т, J=6,6 Гц, 2H), 2,76-2,67 (м, 4Н), 2,50 (шир т, 4Н), 2,33 (с, 3Н), 2,26 (с, 3Н), 2,26-2,17 (м, 2H).
Пример 3 (4)
2-(5-(2-(2-(Пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол
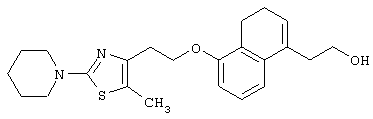
TCX: Rf 0,27 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,12 (дд, J=7,8, 7,8 Гц, 1Н), 6,88 (д, J=7,8 Гц, 1H), 6,81 (д, J=7,8 Гц, 1H), 5,95 (дд, J=4,5, 4,5 Гц, 1Н), 4,21 (т, J=6,9 Гц, 2H), 3,75 (м, 2H), 3,36 (м, 4Н), 2,96 (т, J=6,9 Гц, 2H), 2,77-2,68 (м, 4Н), 2,25 (с, 3Н), 2,27-2,18 (м, 2H), 1,72-1,53 (м, 6Н).
Пример 3 (5)
3-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанол
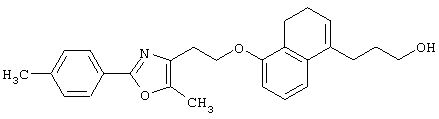
TCX: Rf 0,55 (этилацетат:гексан = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2H), 7,23 (д, J=8,1 Гц, 2H), 7,12 (т, J=7,8 Гц, 1H), 6,91 (д, J=7,8 Гц, 1H), 6,80 (д, J=7,8Гц, 1H), 5,90-5,84 (м, 1H), 4,25 (т, J=6,6 Гц, 2Н), 3,68 (т, J=6,6 Гц, 2Н), 2,99 (т, J=6,6 Гц, 2H), 2,71 (т, J=7,8 Гц, 2H), 2,52 (т, J=7,8 Гц, 2H), 2,39 (с, 3Н), 2,36 (с, 3Н), 2,24-2,14 (м, 2H), 1,78 (куинт, J=7,8 Гц, 2H), 1,58 (с, 1H).
Пример 4
2-(5-(2-(2-(4-Циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид

К раствору соединения (1,20 г), полученного в примере 3, в смешанном растворителе из этилацетата (12 мл) и диметилсульфоксида (5,0 мл) добавляют диизопропилэтиламин (2,7 мл) и затем по каплям добавляют при -10°С раствор комплекса триоксид серы-пиридин (1,25 г) в диметилсульфоксиде (6,5 мл) с последующим перемешиванием при -10°С в течение 2 часов. Реакционную смесь выливают в холодную воду и экстрагируют этилацетатом. Экстрат промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением неочищенного указанного в заголовке соединения (1,57 г), имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,60 (гексан:этилацетат = 2:1).
Примеры 4 (1)-4 (4)
Приведенные ниже соединения данного изобретения получают в соответствии со способом примера 4, используя соединение, полученное в примерах 3(1)-3(4), вместо соединения, полученного в примере 3.
Пример 4 (1)
2-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид
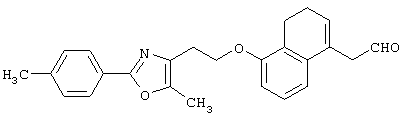
ТСХ: Rf 0,58 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 9,63 (т, J=1,5 Гц, 1H), 7,86 (д, J=8,1 Гц, 2H), 7,24 (д, J=8,1 Гц, 2H), 7,12 (дд, J=7,8, 7,8 Гц, 1H), 6,83 (д, J=7,8 Гц, 1H), 6,73 (д, J=7,8 Гц, 1H), 6,02 (т, J=4,5 Гц, 1H), 4,25 (т, J=6,6 Гц, 2H), 3,43 (м, 2H), 2,98 (т, J=6, 6 Гц, 2H), 2,78 (т, J=8,4 Гц, 2H), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,31 (м, 2H).
Пример 4 (2)
2-(5-(2-(2-Изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид
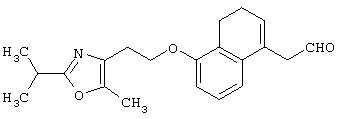
ТСХ: Rf 0,62 (гексан:этилацетат = 1:1).
ЯМР (CDCl3): δ 9,64 (т, J=2,4 Гц, 1H), 7,12 (дд, J=7,8, 7,8 Гц, 1H), 6,81 (д, J=7,8 Гц, 1H), 6,73 (д, J=7,8 Гц, 1H), 6,03 (дд, J=4,5, 4,5 Гц, 1H), 4,18 (т, J=6,6 Гц, 2H), 3,48-3,40 (м, 2H), 2,99 (серт, J=6,9 Гц, 1H), 2,89 (т, J=6,6 Гц, 2H), 2,77 (т, J=8,1 Гц, 2H), 2,36-2,16 (м, 2H), 2,25 (с, 3Н), 1,31 (д, J=6,9 Гц, 6Н).
Пример 4 (3)
2-(5-(2-(2-(4-Метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид
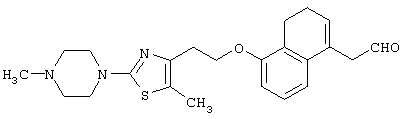
ТСХ: Rf 0,25 (метанол:этилацетат = 1:5).
ЯМР (CDCl3): δ 9,64 (т, J=2,4 Гц, 1H), 7,12 (дд, J=8,1, 8,1 Гц, 1H), 6,82 (д, J=8,1 Гц, 1H), 6,73 (д, J=8,1 Гц, 1H), 6,03 (шир т, 1Н), 4,22 (т, J=6,9 Гц, 2H), 3,46-3,37 (м, 6Н), 2,96 (т, J=6,9 Гц, 2H), 2,78 (дд, J=8,4, 8,4 Гц, 2H), 2,51 (м, 4Н), 2,34 (с, 3Н), 2,26 (с, 3Н), 2,34-2,23 (м, 2H).
Пример 4 (4)
2-(5-(2-(2-(Пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид
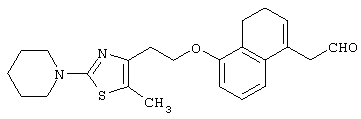
ТСХ: Rf 0,57 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 9,64 (т, J=2,7 Гц, 1H), 7,12 (дд, J=8,1, 8,1 Гц, 1H), 6,82 (д, J=8,1 Гц, 1H), 6,72 (д, J=8,1 Гц, 1H), 6,02 (дд, J=4,5, 4,5 Гц, 1H), 4,22 (т, J=6,9 Гц, 2H), 3,44 (м, 2H), 3,36 (м, 4Н), 2, 96 (т, J=6,9 Гц, 2H), 2,78 (дд, J=8,1, 8,1 Гц, 2H), 2,36-2,26 (м, 2H), 2,25 (с, 3Н), 1,72-1,54 (м, 6Н).
Справочный пример 28
2-(4-Циклогексилфенил)-4-(2-((5-(2,2-диэтоксиэтил)-7,8-дигидронафталин-1-ил)окси)этил)-5-метилоксазол
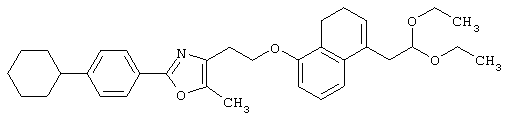
К раствору соединения, полученного в примере 4, в этаноле (7,8 мл) добавляют гидрат п-толуолсульфоновой кислоты (300 мг) с последующим перемешиванием при 90°С в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры, выливают в охлажденный насыщенный водный раствор гидрокарбоната натрия и затем экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 15:1 до 9:1) с получением указанного в заголовке соединения (1,04 г), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,38 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,94-7,84 (м, 2Н), 7,30-7,22 (м, 2Н), 7,12 (дд, J=7,8, 7,8 Гц, 1H), 6,93 (д, J=7,8 Гц, 1Н), 6,79 (д, J=7,8 Гц, 1H), 5,97 (т, J=4,5 Гц, 1H), 4,64 (м, 1H), 4,25 (т, J=6,6 Гц, 2Н), 3,74-3,58 (м, 2Н), 3,52-3,38 (м, 2Н), 2,98 (т, J=6,6 Гц, 2H), 2,80-2,64 (м, 4Н), 2,53 (м, 1H), 2,35 (с, 3Н), 2,26-2,14 (м, 2H), 1,96-1,70 (м, 5Н), 1,52-1,20 (м, 5Н), 1,16 (т, J=6,9 Гц, 6Н).
Справочный пример 29
3-(5-(2-(2-(4-Циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)-2-этоксипропаннитрил
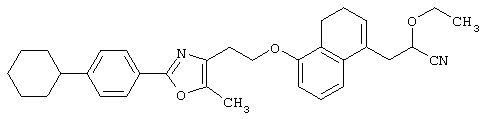
К раствору соединения (1,00 г), полученного в справочном примере 28, в метиленхлориде (9,5 мл) добавляют триметилсилилцианид (0,76 мл) и комплекс трифторид бора-этиловый эфир (0,14 мл) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. Реакционную смесь выливают в охлажденный водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 10:1 до 7:1) с получением указанного в заголовке соединения (837 мг) в виде неочищенного продукта, имеющего представленные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,27 (гексан:этилацетат = 5:1).
ЯМР (CDCl3): δ 7,94-7,84 (м, 2Н), 7,32-7,22 (м, 2Н), 7,14 (дд, J=8,4, 8,4 Гц, 1Н), 6,88-6,76 (м, 2Н), 6,09 (т, J=4,5 Гц, 1H), 4,32-4,18 (м, 3Н), 3,80 (м, 1H), 3,48 (м, 1H), 3,10-2,44 (м, 7Н), 2,36 (с, 3Н), 2,32-2,10 (м, 2Н), 1,96-1,70 (м, 5Н), 1,52-1,14 (м, 8Н).
Пример 5
2-Этокси-3-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
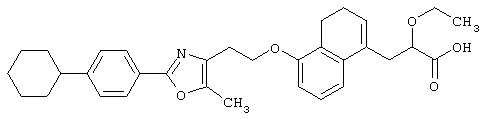
К раствору соединения, полученного в справочном примере 29, в этаноле (11 мл) добавляют 5 н. водный раствор гидроксида натрия (3,8 мл) с последующим перемешиванием смеси при 90°С в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры, выживают в охлажденную воду и промывают трет-бутилметиловым эфиром. Водный слой нейтрализуют 2 н. соляной кислотой и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; хлороформ:метанол = 12:1) с получением соединения данного изобретения (676 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,42 (хлороформ:метанол = 8:1).
ЯМР (CDCl3): δ 7,94-7,84 (м, 2Н), 7,32-7,22 (м, 2Н), 7,13 (дд, J=7,8, 7,8 Гц, 1H), 6,96 (д, J=7,8 Гц, 1H), 6,80 (д, J=7,8 Гц, 1H), 5,98 (т, J=4,5 Гц, 1H), 4,24 (т, J=6,6 Гц, 2Н), 4,04 (дд, J=8,7, 4,2 Гц, 1H), 3,54 (м, 1H), 3,43 (м, 1H), 3,06 (м, 1H), 2,99 (т, J=6,6 Гц, 2Н), 2,90-2,44 (м, 4Н), 2,35 (с, 3Н), 2,26-2,12 (м, 2Н), 1,96-1,68 (м, 5Н), 1,52-1,16 (м, 5Н), 1,12 (т, J=6,9 Гц, 3Н).
Примеры 6 (1)-6 (4)
Представленные ниже соединения данного изобретения получают в соответствии со способом справочного примера 28 → справочного примера 29 → примера 5, используя соединение, полученное в примерах 4(1)-4(4), вместо соединения, полученного в примере 4.
Пример 6(1)
2-Этокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
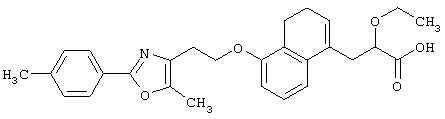
ТСХ: Rf 0,42 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2H), 7,23 (д, J=8,1 Гц, 2H), 7,14 (дд, J=7,8, 7,8 Гц, 1Н), 6,96 (д, J=7,8 Гц, 1H), 6,82 (д, J=7,8 Гц, 1H), 5,98 (т, J=4,5 Гц, 1H), 4,26 и 4,25 (каждый т, J=6,6 Гц, тотал 2H), 4,04 (дд, J=9,0, 3,9 Гц, 1H), 3,49 (м,2Н), 3,08 (м, 1H), 2, 99 (т, J=6,6 Гц, 2H), 2,86 и 2,81 (каждый т, J=6,6 Гц, тотал 1H), 2,72-2,52 (м, 2H), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,21 (м, 2H), 1,12 (т, J=6,9 Гц, 3Н).
Пример 6(2)
2-Этокси-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота, 1/2 кальциевая соль
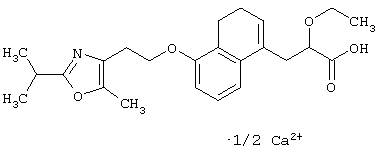
ТСХ: Rf 0,42 (хлороформ:метанол = 8:1).
ЯМР (ДМСО-d6): δ 7,07 (дд, J=7,8, 7,8 Гц, 1H), 6, 98 (д, J=7,8 Гц, 1H), 6,81 (д, J=7,8 Гц, 1H), 5,85 (дд, J=4,2, 4,2 Гц, 1H), 4,09 (т, J=6,3 Гц, 2H), 3,74-3,46 (м, 2H), 3,13 (м, 1H), 3,02-2,56 (м, 5Н), 2, 54-2,30 (м, 2H), 2,18 (с, 3Н), 2,16-1,94 (м, 2H), 1,20 (д, J=6,6 Гц, 6Н), 0,92 (т, J=6,9 Гц, 3Н).
Пример 6 (3)
2-Этокси-3-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
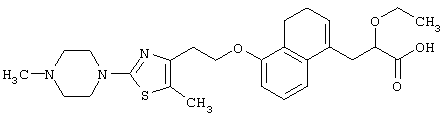
TCX: Rf 0,35 (хлороформ:метанол = 5:1).
ЯМР (CDCl3+CD3OD): δ 7,11 (дд, J=8,1, 8,1 Гц, 1Н), 6,99 (д, J=8,1 Гц, 1H), 6,77 (д, J=8,1 Гц, 1H), 5,98 (дд, J=4,2, 4,2 Гц, 1Н), 4,22 (м, 2H), 3,98 (дд, J=9,0, 4,5 Гц, 1H), 3,66-3,46 (м, 5Н), 3,44-3,32 (м, 1H), 3,02-2,45 (м, 10Н), 2,52 (с, 3Н), 2,27 (с, 3Н), 2,22-2,10 (м, 2H), 1,10 (т, J=6,9 Гц, 3Н).
Пример 6 (4)
2-Этокси-3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота
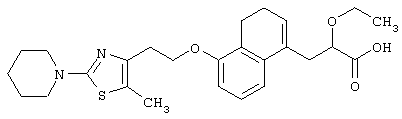
TCX: Rf 0,45 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,12 (дд, J=8,1, 8,1 Гц, 1H), 6,94 (д, J=8,1 Гц, 1H), 6,79 (д, J=8,1 Гц, 1H), 5,98 (дд, J=4,5, 4,5 Гц, 1H), 4,20 (м, 2H), 4,03 (дд, J=9,0, 3,9 Гц, 1H), 3,55 (м, 1H), 3,41 (м, 1H), 3,37 (м, 4Н), 3,06 (м, 1H), 2,97 (т, J=6,9 Гц, 2H), 2,82 (ддд, J=15,9, 7,5, 7,5 Гц, 1H), 2,74-2,51 (м, 2H), 2,24 (с, 3Н), 2,25-2,14 (м, 2H), 1,72-1,55 (м, 6Н), 1,12 (т, J=6,9 Гц, 3Н).
Пример 7
2-Этокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид
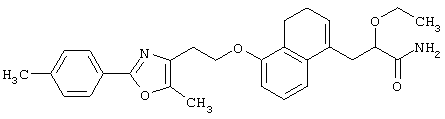
К раствору 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)-2-этоксипропаннитрила (146 мг; данное соединение получают в соответствии со справочным примером 28 → справочным примером 29 при использовании соединения, полученного в примере 4 (1), вместо соединения, полученного в примере 4) в этаноле (4 мл) и тетрагидрофуране (4 мл) добавляют 5 н. водный раствор гидроксида натрия (0,66 мл) и полученную смесь кипятят с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и концентрируют. Остаток разбавляют водой. Разбавленный раствор подкисляют 1 н. соляной кислотой и экстрагируют диэтиловым эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: хлороформ:метанол = от 50:1 до 30:1). Полученное твердое вещество перекристаллизовывают из смеси этилацетата и гексана с получением соединения данного изобретения (75 мг), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,63 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,4 Гц, 2H), 7,23 (д, J=8,4 Гц, 2H), 7,14 (дд, J=7,8, 7,8 Гц, 1Н), 7,04 (д, J=7,8 Гц, 1H), 6,81 (д, J=7,8 Гц, 1H), 6,55 (шир с,1Н), 5,97 (т, J=4,5 Гц, 1H), 5,37 (шир с, 1Н), 4,26 и 4,25 (каждый т, J=6,6 Гц, тотал 2Н), 3,88 (дд, J=9,6, 3,0 Гц, 1Н), 3,41 (м, 2Н), 2,98 (т, J=6,6 Гц, 2Н), 2,89 и 2,84 (каждый т, J=6,6 Гц, тотал 1Н), 2,62-2,48 (м, 2Н), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,22 (м, 2Н),1,07 (т, J=6,9 Гц, 3Н).
Справочный пример 30
N-(1-Метил-1-метоксиэтокси)-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид
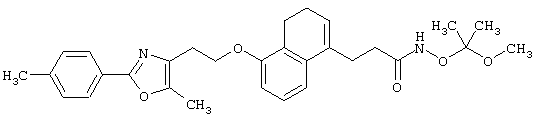
К раствору соединения (208 мг), полученного в примере 2, и 2-аминоокси-2-метоксипропана (57,7 мг) в диметилформамиде (5 мл) добавляют 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг) и триэтиламин (83 мкл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют. Остаток разбавляют метиленхлоридом. Разбавленный раствор промывают последовательно 1 н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; хлороформ:метанол = 50:1) с получением указанного в заголовке соединения (239 мг), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,44 (хлороформ:метанол = 10:1).
ЯМР (CDCl3): δ 7,86 (д, J=7,8 Гц, 2Н), 7,55 (с, 1Н), 7,23 (д, J=7,8 Гц, 2H), 7,13 (дд, J=8,4, 8,4 Гц, 1Н), 6,88 (м, 2Н), 6,81 (д, J=8,4 Гц, 1Н), 5,92 (м, 1Н), 4,24 (т, J=6,6 Гц, 2Н), 3,24 (с, 3Н), 2,98 (т, J=6,6 Гц, 2Н), 2,95 (с, 3Н), 2,88 (с, 3Н), 2,80 (м, 2Н), 2,70 (т, J=8,1 Гц, 2Н), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,17 (м, 2Н).
Пример 8
N-Гидрокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид
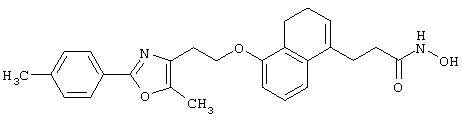
К раствору соединения (239 мг), полученного в справочном примере 30, в метаноле (2 мл) добавляют 4 н. раствор хлористого водорода в диоксане (1,1 мл) и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют и остаток растирают с диэтиловым эфиром. Твердое вещество кристаллизуют из метанола с получением соединения данного изобретения (40 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,48 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 10,35 (с, 1Н), 7,79 (д, J=8,4 Гц, 2Н), 7,29 (д, J=8,4 Гц, 2Н), 7,13 (дд, J=8,1, 8,1 Гц, 1Н), 6,88 (м, 2Н), 5,82 (м, 1Н), 4,19 (т, J=6,3 Гц, 2H), 2,91 (т, J=6,3 Гц, 2H), 2,67-2,53 (м, 4Н), 2,34 (с, 3Н), 2,33 (с, 3Н), 2,15-2,03 (м, 4Н).
Пример 9
N-Гидрокси-2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетамид
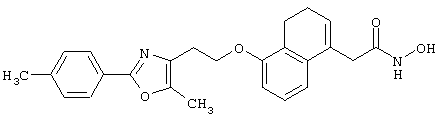
Соединение данного изобретения, имеющее представленные ниже физические характеристики, получают в соответствии с методикой справочного примера 30 - примера 8, используя соединение, полученное в примере 2 (26), вместо соединения, полученного в примере 2.
ТСХ: Rf 0,36 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 10,47 (с, 1Н), 8,73 (с, 1Н), 7,79 (д, J=8,1 Гц, 2Н), 7,29 (д, J=8,1 Гц, 2H), 7,09 (дд, J=7,8, 7,8 Гц, 1Н), 6,89 (д, J=7,8 Гц, 1Н), 6,88 (д, J=7,8 Гц, 1H), 5,91 (т, J=4,5 Гц, 1H), 4,18 (т, J=6,3 Гц, 2Н), 3,07 (с, 2Н), 2,91 (т, J=6,3 Гц, 2H), 2,59 (т, J=8,4 Гц, 2H), 2,34 (с, 3Н), 2,33 (с, 3Н), 2,13 (м, 2H).
Пример 10
3-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид
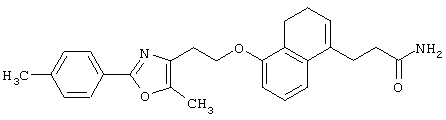
К суспензии соединения (625 мг), полученного в примере 2, в метиленхлориде (15 мл) при охлаждении на ледяной бане добавляют оксалилхлорид (1,31 мл) и диметилформамид (одна капля), полученную смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют. Остаток подвергают азеотропии с бензолом. Полученное масло растворяют в тетрагидрофуране (15 мл) и к полученному раствору добавляют 28% водный гидроксид аммония до появления белого осадка, после чего смесь перемешивают в течение 30 минут. Реакционную смесь концентрируют с получением соединения данного изобретения (408 мг), имеющего представленные ниже физические характеристики. Полученное соединение используют без очистки в последующей реакции.
ТСХ: Rf 0,38 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 7,78 (д, J=8,4 Гц, 2Н), 7,29 (д, J=8,4 Гц, 2Н), 7,13 (дд, J=8,7, 8,7 Гц, 1Н), 6,92-6,85 (м, 2Н), 6,73 (шир, 1Н), 5,82 (т, J=4,5 Гц, 1Н), 4,18 (т, J=6,3 Гц, 2Н), 2,91 (т, J=6,3 Гц, 2Н), 2,62-2,52 (м, 4Н), 2,19 (м, 2Н), 2,07 (м, 2Н).
Справочный пример 31
3-(5-(2-(2-(4-Метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропаннитрил
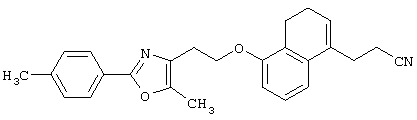
К раствору соединения, полученного в примере 10, в диоксане (15 мл) добавляют пиридин (363 мкл) и трифторуксусную кислоту (423 мкл) и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют и остаток разбавляют этилацетатом. Разбавленный раствор промывают последовательно 1 н. соляной кислотой, водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 4:1) с получением указанного в заголовке соединения (533 мг), имеющего приведенные ниже физические характеристики.
ТСХ: Rf 0,48 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,4 Гц, 2H), 7,26 (д, J=8,4 Гц, 2H), 7,14 (дд, J=7,8, 7,5 Гц, 1H), 6,83 (д, J=7,5 Гц, 1H), 6,77 (д, J=7,5 Гц, 1H), 5,98 (т, J=4,5 Гц, 1H), 4,25 (т, J=6,6 Гц, 2H), 2,98 (т, J=6,6 Гц, 2H), 2,82-2,68 (м, 4Н), 2,53 (т, J=7,8 Гц, 2H), 2,38 (с, 3Н), 2,36 (с, 3Н), 2,24 (м, 2H).
Пример 11
5-(2-(5-(2-(5-Метил-2-(4-метилфенил)оксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этил)-1H-тетразол
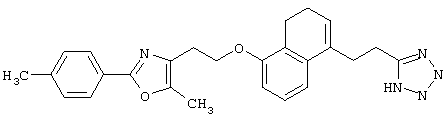
К раствору соединения (212 мг), полученного в справочном примере 31, в толуоле (5 мл) добавляют азидотриметилолово и полученную смесь кипятят с обратным холодильником в атмосфере аргона в течение 6 часов. После охлаждения реакционную смесь очищают колоночной хроматографией (силикагель; хлороформ:метанол = 50:1) с получением соединения данного изобретения (83 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,43 (хлороформ:метанол = 10:1).
ЯМР (ДМСО-d6): δ 7,79 (д, J=8,1 Гц, 2H), 7,29 (д, J=8,1 Гц, 2H), 7,15 (дд, J=7,8, 7,8 Гц, 1H), 6,94 (д, J=7,8 Гц, 1H), 6,92 (д, J=7,8 Гц, 1H), 5,81 (д, J=4,5 Гц, 1H), 4,19 (т, J=6,6 Гц, 2H), 3,02 (м, 2H), 2,91 (т, J=6,6 Гц, 2H), 2,81 (т, J=7,5 Гц, 2H), 2,54 (т, J=8,4 Гц, 2Н), 2,33 (с, 6Н), 2,04 (м, 2Н).
Справочный пример 32
Диэтиловый эфир ((5-метоксиметокси-З,4-дигидронафталин-1-ил)метил)малоновой кислоты
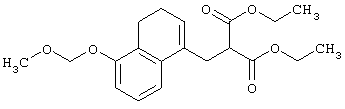
К раствору соединения (400 мг), полученного в справочном примере 14, в этаноле (1,5 мл) добавляют диэтиловый эфир малоновой кислоты (0,28 мл) и этоксид натрия (0,55 мл, 2,6 в EtOH) и полученную смесь перемешивают при 80°С в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры, добавляют в нее уксусную кислоту и воду и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением указанного в заголовке соединения в виде неочищенного продукта, имеющего приведенные ниже физические характеристики. Полученное соединение используют в последующей реакции без очистки.
ТСХ: Rf 0,64 (гексан:этилацетат = 2:1).
Справочный пример 33
Диэтиловый эфир ((5-гидрокси-3,4-дигидронафталин-1-ил)метил)малоновой кислоты
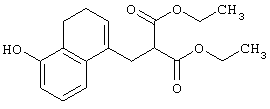
К раствору соединения, полученного в справочном примере 32, в этаноле (5 мл) при охлаждении на ледяной бане добавляют 4 н. раствор соляной кислоты в этилацетате (0,7 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют. Остаток очищают колоночной хроматографией (силикагель; элюирование с градиентом: гексан:этилацетат = от 10:1 до 5:1) с получением указанного в заголовке соединения (428 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,43 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,06 (д, J=7,8 Гц, 1H), 6,86 (д, J=7,8 Гц, 1H), 6,70 (дд, J=7,8, 0,8 Гц, 1H), 5,93 (шир т, J=4,6 Гц, 1H), 5,27 (шир с, 1Н), 4,19 (кв, J=7,2 Гц, 4Н), 3,63 (т, J=7,8 Гц, 1H), 3,06 (дд, J=7,8, 1,0 Гц, 2Н), 2,67 (т, J=7,8 Гц, 2Н), 2,28-2,15 (м, 2Н), 1,25 (т, J=7,2 Гц, 6H).
Справочный пример 34
Диэтиловый эфир ((5-(2-(5-метил-2-(4-метилфенил)оксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)метил)малоновой кислоты

К раствору соединения (456 мг), полученного в справочном примере 33, и соединения (373 мг), полученного в справочном примере 27, в метиленхлориде (10 мл) добавляют трифенилфосфин (561 мг) и 1,1'-(азодикарбонил)дипиперидин (539 мг) и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют. К остатку добавляют диэтиловый эфир и нерастворимый осадок удаляют фильтрованием. Фильтрат концентрируют. Остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 6:1). Полученный твердый продукт перекристаллизовывают из диизопропилового эфира с получением указанного в заголовке соединения (422 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,54 (гексан:этилацетат = 2:1).
ЯМР (CDCl3): δ 7,86 (д, J=8,1 Гц, 2H), 7,23 (д, J=8,1 Гц, 2H), 7,13 (дд, J=7,5, 7,5 Гц, 1H), 6,88 (д, J=7,5 Гц, 1H), 6,81 (д, J=7,5 Гц, 1H), 5,91 (т, J=4,5 Гц, 1H), 4,29 (т, J=6,6 Гц, 2H), 4,17 (кв, J=7,2 Гц, 2H), 4,16 (кв, J=7,2 Гц, 2H), 3,59 (т, J=7,5 Гц, 1H), 3,05 (т, J=7,8 Гц, 2H), 2,98 (т, J=6,6 Гц, 2H), 2,38 (с, 3Н), 2,35 (с, 3Н), 2,16 (м, 2H), 1,23 (т, J=7,2 Гц, 6H).
Пример 12
4-((5-(2-(5-Метил-2-(4-метилфенил)оксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)метил)изооксазолидин-3,5-дион
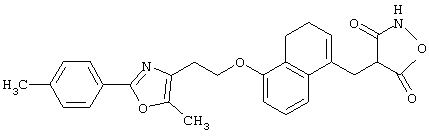
К раствору гидроксиламина гидрохлорида (87,5 мг) в безводном метаноле (10 мл) в атмосфере аргона добавляют метанольный раствор метилата натрия (542 мкл, 25 мас.%) и полученную смесь перемешивают при комнатной температуре в течение 5 минут. Нерастворимые вещества удаляют. К фильтрату в атмосфере аргона добавляют раствор соединения (434 мг), полученного в справочном примере 34, в безводном тетрагидрофуране (5 мл) и полученную смесь перемешивают при 60°С в течение 6 часов. Реакционную смесь концентрируют. Остаток разбавляют 1 н. соляной кислотой. Разбавленный раствор экстрагируют смесью диэтилового эфира и тетрагидрофурана, Экстракт сушат над безводным сульфатом магния и концентрируют. Остаток перекристаллизовывают из метанола с получением соединения данного изобретения (123 мг), имеющего представленные ниже физические характеристики.
ТСХ: Rf 0,36 (хлороформ:метанол:уксусная кислота = 20:2:1).
ЯМР (ДМСО-d6): δ 7,79 (д, J=8,4 Гц, 2H), 7,29 (д, J=8,4 Гц, 2H), 7,12 (дд, J=7,8, 7,8 Гц, 1Н), 6,98 (д, J=7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 5,66 (т, J=4,5 Гц, 1H), 4,18 (т, J=6,3 Гц, 2Н), 3,08 (шир с, 2Н), 2,91 (т, J=6,3 Гц, 2H), 2,56 (т, J=8,1 Гц, 2H), 2,33 (с, 3Н), 2,32 (с, 3Н), 2,09 (м, 2H).
[Примеры композиций]
Пример композиции 1
Компоненты, представленные ниже, смешивают стандартным способом и прессуют с получением 100 таблеток, каждая из которых содержит 50 мг активного ингредиента.
Пример композиции 2
Компоненты, представленные ниже, смешивают стандартным способом, раствор стерилизуют стандартным способом, помещают в ампулы по 5 мл и сушат вымораживанием с получением 100 ампул, каждая из которых содержит 20 мг активного ингредиента.


Изобретение относится к производным дигидронафталина, представленным формулой (I)
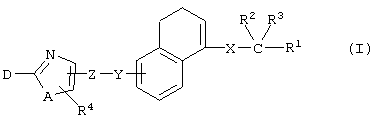
где значения радикалов определены в описании, и к его нетоксичным солям. Указанное соединение является регулятором рецептора, активируемого пролифератором пероксисомы (PPAR) α- и γ- типа, и может быть полезно в качестве гипогликемического средства, гиполипидемического средства, средства для профилактики и/или лечения заболеваний, связанных с нарушениями обмена веществ, средства, повышающего содержание HDL-холестерина и снижающего содержание LDL-холестерина и/или VLDL-холестерина, и средства для ослабления фактора риска диабета и/или синдрома Х. Также заявлено производное дигидронафталина, представляющее собой 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановую кислоту. 9 н. и 12 з.п. ф-лы, 15 табл.
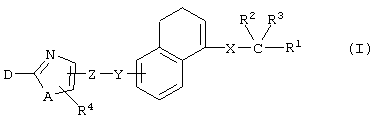
где Х представляет собой (1) связь или (2) С1-4 алкилен;
Y представляет собой -О-;
Z представляет собой С1-4 алкилен;
А представляет собой (1) -О- или (2) -S-;
R1 представляет собой (1) COOR5, (2) CONH2, (3) CONHOH, (4) CH2OH, (5) CHO, (6) 1H-тетразол-5-ил или (7) 3,5-диоксоизооксазолин-4-ил;
R5 представляет собой (1) водород или (2) С1-C8 алкил;
R2 и R3 каждый независимо представляет собой (1) водород, (2) С1-C8 алкил, (3) С1-C8 алкокси или (4) С1-C8 алкокси, замещенный фенилом;
R4 представляет собой С1-8 алкил;
D представляет собой D1, D2 или D3;
D1 представляет собой
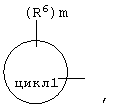
цикл 1 представляет собой С3-10 моно- или бикарбоциклический арил, который может быть частично или полностью насыщенным;
D2 представляет собой
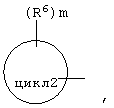
цикл 2 представляет собой 3-10-членный моно- или бигетероциклический арил, который может быть частично или полностью насыщенным и который содержит 1-4 гетероатома, выбранных из атомов кислорода, азота или серы;
D3 представляет собой С1-C8 алкил;
R6 представляет собой (1) водород, (2) С1-C8 алкил, (4) NR7R8, (5) галоген, (6) С1-C8 алкокси, (7) С1-C8 алкилтио, (8) CF3, (9) CF3O, (10) С3-10 моно- или бикарбоциклический арил, который может быть частично или полностью насыщенным или (11) 3-10-членный моно- или бигетероциклический арил, который может быть частично или полностью насыщенным и который содержит 1-4-гетероатома, выбранных из атомов кислорода и азота;
R7 и R8, каждый независимо, представляют собой С1-алкил;
m равно 1-3,
или его нетоксичная соль.
1) метиловый эфир 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
2) метиловый эфир 3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
3) метиловый эфир 3-(5-(2-(2-(4-трет-бутилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
4) метиловый эфир 3-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
5) этиловый эфир 3-(5-(2-(2-(4-трифторметилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
6) этиловый эфир 3-(5-(2-(2-(4-трифторметилоксифенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
7) этиловый эфир 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
8) этиловый эфир 3-(5-(2-(2-(4-хлорфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
9) этиловый эфир 3-(5-(2-(2-(4-метилтиофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
10) этиловый эфир 3-(5-(2-(2-(4-изопропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
11) этиловый эфир 3-(5-(2-(2-(4-пропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
12) этиловый эфир 2-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
13) этиловый эфир 2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
14) этиловый эфир 2-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
15) метиловый эфир 5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты,
16) метиловый эфир 5-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты,
17) метиловый эфир 5-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты,
18) метиловый эфир 2,2-диметил-3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
19) метиловый эфир 2,2-диметил-5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты,
20) метиловый эфир 2-бензилокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
21) 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
22) 3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
23) 3-(5-(2-(2-(4-трет-бутилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
24) 3-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
25) 3-(5-(2-(2-(4-трифторметилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
26) 3-(5-(2-(2-(4-трифторметилоксифенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
27) 3-(5-(2-(2-(4-хлорфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
28) 3-(5-(2-(2-(4-метилтиофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
29) 3-(5-(2-(2-(4-изопропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
30) 3-(5-(2-(2-(4-пропилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
31) 2-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусная кислота,
32) 2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусная кислота,
33) 5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
34) 5-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
35) 5-(5-(2-(2-(4-диметиламинофенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
36) 2,2-диметил-3-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
37) 2,2-диметил-5-(5-(2-(2-фенил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
38) 2-бензилокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
39) 2-этокси-3-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
40) 2-этокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
или его нетоксичная соль.
1) 2-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол,
2) 2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол,
3) 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанол,
4) 2-(5-(2-(2-(4-циклогексилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид,
5) 2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид,
6) 2-этокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид,
7) N-гидрокси-3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид,
8) N-гидрокси-2-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетамид,
9) 3-(5-(2-(2-(4-метилфенил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропанамид,
10) 5-(2-(5-(2-(5-метил-2-(4-метилфенил)оксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этил)-1Н-тетразол или
11) 4-((5-(2-(5-метил-2-(4-метилфенил)оксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)метил)изооксазолидин-3,5-дион,
или его нетоксичная соль.
1) метиловый эфир 3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
2) метиловый эфир 3-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
3) метиловый эфир 3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
4) этиловый эфир 3-(5-(2-(2-(2,2-дифтор-1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
5) этиловый эфир 3-(5-(2-(2-(6-диэтиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
6) этиловый эфир 3-(5-(2-(2-пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
7) этиловый эфир 3-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
8) этиловый эфир 3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
9) этиловый эфир 3-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
10) этиловый эфир 3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
11) этиловый эфир 3-(5-(2-(2-(1,5-диметилпиразол-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
12) этиловый эфир 3-(5-(2-(2-(4-метилпиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
13) этиловый эфир 3-(5-(2-(2-(5-метилпиразин-2-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
14) этиловый эфир 3-(5-(2-(2-(1,2,3,6-тетрагидропиридин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
15) этиловый эфир 2-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
16) этиловый эфир 2-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
17) метиловый эфир 5-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановой кислоты,
18) метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
19) метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-(пиридин-1-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
20) метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
21) метиловый эфир 2,2-диметил-3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
22) метиловый эфир 2,2-диметил-3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
23) метиловый эфир 2,2-диметил-3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
24) метиловый эфир 2,2-диметил-3-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
25) 3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
26) 3-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
27) 3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
28) 3-(5-(2-(2-(2,2-дифтор-1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
29) 3-(5-(2-(2-(6-диэтиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
30) 3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
31) 3-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
32) 3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
33) 2-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
34) 3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
35) 3-(5-(2-(2-(1,5-диметилпиразол-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
36) 3-(5-(2-(2-(4-метилпиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
37) 3-(5-(2-(2-(5-метилпиразин-2-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
38) 3-(5-(2-(2-(1,2,3,6-тетрагидропиридин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
39) 5-(5-(2-(2-(1,3-диоксаиндан-5-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пентановая кислота,
40) 2,2-диметил-3-(5-(2-(2-(6-диметиламинопиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
41) 2,2-диметил-3-(5-(2-(2-(6-(пиридин-1-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
42) 2,2-диметил-3-(5-(2-(2-(6-(морфолин-4-ил)пиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
43) 2,2-диметил-3-(5-(2-(2-(6-метилпиридин-3-ил)-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
44) 2,2-диметил-3-(5-(2-(2-(морфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
45) 2,2-диметил-3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
46) 2,2-диметил-3-(5-(2-(2-(тиоморфолин-4-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
47) 2-этокси-3-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота или
48) 2-этокси-3-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
или его нетоксичная соль.
1) 2-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол,
2) 2-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол,
3) 2-(5-(2-(2-(4-метилпиперазин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид или
4) 2-(5-(2-(2-(пиперидин-1-ил)-5-метилтиазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид,
или его нетоксичная соль.
1) этиловый эфир 3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
2) этиловый эфир 2-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)уксусной кислоты,
3) метиловый эфир 2,2-диметил-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановой кислоты,
4) 3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
5) 2,2-диметил-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота или
6) 2-этокси-3-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)пропановая кислота,
или его нетоксичная соль.
1) 2-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)этанол или
2) 2-(5-(2-(2-изопропил-5-метилоксазол-4-ил)этокси)-3,4-дигидронафталин-1-ил)ацетальдегид,
или его нетоксичная соль.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2006-01-20—Публикация
2001-12-21—Подача