Изобретение относится к способу получения ненасыщенных и насыщенных кислот жирного ряда, а также к способу получения триглицеридов с высоким содержанием ненасыщенных или насыщенных кислот жирного ряда.
Изобретение относится также к последовательности нуклеиновых кислот, к конструкту нуклеиновых кислот, к вектору и организмам, содержащим по меньшей мере одну последовательность нуклеиновых кислот, соответственно конструкт нуклеиновых кислот. Кроме того, изобретение относится к насыщенным или ненасыщенным кислотам жирного ряда, а также к триглицеридам с повышенным содержанием ненасыщенных или насыщенных кислот жирного ряда и к их применению.
Кислоты жирного ряда и триглицериды имеют множество возможностей применения в промышленности пищевых продуктов, в промышленности кормов, косметической и в фармацевтической промышленности. В зависимости от того, идет ли речь о свободных насыщенных или ненасыщенных кислотах жирного ряда или о триглицеридах с повышенным содержанием насыщенных или ненасыщенных кислот жирного ряда, они пригодны для различных целей применения. Так, например, полиненасыщенные кислоты жирного ряда добавляются к питанию грудных детей для повышения пищевой ценности. Главным образом различные кислоты жирного ряда и триглицериды получают из микроорганизмов, таких как Mortierella, или из производящих масло растений, таких как соя, рапс, подсолнечник и т.п., при этом они, как правило, получаются в форме триацилглицеридов. Их также получают из животных, например, из рыбы. Свободные жирные кислоты получают предпочтительно омылением.
В зависимоти от цели применения предпочитают масла с насыщенными или ненасыщенными кислотами жирного ряда. Так, например, в питании человека липиды с ненасыщенными жирными кислотами предпочитаются специальным полиненасыщенным жирным кислотам, так как они оказывают положительное влияние на уровень холестерина в крови и вместе с этим на возможность сердечного инфаркта. Они находят применение в различных диетических средствах питания или в медикаментах.
Особенно ценными и имеющими широкое применение ненасыщенными жирными кислотами являются так называемые сопряженные ненасыщенные жирные кислоты, такие как сопряженная линолевая кислота. Для сопряженных кислот жирного ряда можно привести целый ряд положительных эффектов, так например дача сопряженной линолевой кислоты снижает содержание жира в организме человека и животного, соответственно, повышает обмен веществ в теле животных (см. WO 94/16690, WO 96/06605, WO 97/46230, WO 97/46118). Дачей сопряженной линолевой кислоты можно положительно влиять на аллергические заболевания (WO 97/32008) или раковые заболевания (см. публикацию Banni и др., Carcinogenesis, Vol.20, 1999: стр.1019-1024, Thompson и др., Cancer, Res., Vol.57, 1997: стр.5067-5072).
Химическое получение сопряженных кислот жирного ряда, например, календульной кислоты или сопряженной линолевой кислоты описано в US 3356699 и US 4164505. Календульная кислота упомянута в Calendula officinalis (см. Ul'chenko и др., Chemistry of Natural Compounds, 34, 1998, стр.272-274). Сопряженная линолевая кислота имеется, например, в говяжьем мясе (см. публикацию Chin и др., Journal of Food Composition and Analysis, 5, 1992, стр.185-197). Биохимические исследования синтеза календульной кислоты можно найти в публикации Crombie и др., J. Chem. Soc. Chem. Commun., 15, 1984, стр.953-955 и J. Chem. Soc. Perkin Trans., 1, 1985, стр.2425-2434.
В прошлом было предпринято много попыток сделать доступными гены вследствие их положительных свойств, которые участвуют в синтезе кислот жирного ряда, соответственно, триглицеридов, для получения масел в различных организмах с измененным содержанием ненасыщенных жирных кислот. Так например, в заявке WO 91/13972 и в ее американском эквиваленте описана Δ-9-десатураза. В заявке WO 93/11245 предлагается Δ-15-десатураза, в WO 94/11516 предлагается Δ-12-десатураза. Δ-6-десатуразы описаны в WO 93/06712 и в WO 96/21022. Другие десатуразы описаны, например, в ЕР-А-0550162, WO 94/18337, WO 97/30582, WO 97/21340, WO 95/18222, EP-A-0794250, публикации Stukey и др., J. Biol. Chem., 265, 1990: 20144-20149, Wada и др., Nature 347, 1990: 200-203 или же в Huang и др., Lipids 34, 1999: 649-659. Биохимическая характеристика различных десатураз до сих пор проводилась неудовлетворительно, так как ферменты в качестве мембраносвязанных протеинов трудно выделять и характеризовать (см. публикации McKeon и др., Methods в Enzymol. 71, 1981: 12141-12147, Wang и др., Plant Physiol. Biochem., 26, 1988: 777-792). В дрожжах было установлено как смещение спектра кислот жирного ряда к ненасыщенным жирным кислотам, так и повышение продуктивности (см. Huang и др., Lipids 34, 1999: 649-659, Napier и др., Biochem. J., Vol. 330, 1998: 611-614). Экспрессия различных десатураз в трансгенных растениях, однако, не показала желательного успеха. Было установлено смещение спектра жирных кислот к ненасыщенным жирным кислотам, однако одновременно было установлено, что производительность синтеза трансгенных растений сильно снижается, т.е. по отношению к исходному растению можно было получить только малые количества масел.
Поэтому до сих пор имеется большая потребность в новых генах, которые кодируют ферменты, участвующие в биосинтезе ненасыщенных кислот жирного ряда и позволяют синтезировать эти и специально сопряженные ненасыщенные кислоты жирного ряда и получать их в техническом масштабе.
Задачей изобретения поэтому является разработка новых десатураз для синтеза ненасыщенных сопряженных кислот жирного ряда.
Эта задача решается выделенной последовательностью нуклеиновой кислоты, которая кодирует полипептид с десатуразной активностью, выбранной из группы, включающей:
a) последовательность нуклеиновой кислоты с представленной в SEQ ID NO: 1 последовательностью,
b) последовательность нуклеиновой кислоты, получаемая из SEQ ID NO: 1 за счет вырожденности генетического кода,
c) производная представленной в SEQ ID NO: 1 нуклеотидной последовательности, кодирующая полипептид с аминокислотной последовательностью SEQ ID NO: 2 или с последовательностью, имеющей, по меньшей мере, 75% гомологию с последовательностью SEQ ID NO: 2 по всей ее длине, без существенного снижения ферментативного действия полипептида.
Под производным (производными) следует понимать, например, функциональные гомологи кодированного последовательностью SEQ ID NO: 1 фермента или его ферментативной активности, т.е. ферментов, которые катализируют те же ферментативные реакции, что и кодированный последовательностью SEQ ID NO: 1 фермент. Эти гены позволяют получение ненасыщенных сопряженных кислот жирного ряда. Под ненасыщенными кислотами жирного ряда следует понимать ниже моно, или полиненасыщенные кислоты жирного ряда, двойные связи которых могут быть сопряженными или не сопряженными. Приведенная в SEQ ID NO: 1 последовательность кодирует новую, неизвестную десатуразу, которая участвует в синтезе календульной кислоты в Calendula officinalis. Фермент превращает (9Z,12Z)октадекадиен/линолевую кислоту в (8Е,10Е,12Z)октадекаконьютриен/календульную кислоту. Ниже ее обозначают дезатуразой календульной кислоты.
Последовательность нуклеиновой кислоты по изобретению или ее фрагменты могут с успехом применяться для выделения других геномных последовательностей посредством гомогологического скриннинга.
Названные выше производные могут выделяться, например, из других эукариотических организмов, таких как растения, например, из Calendula stellata, Osteospermum spinescens или Osteospermum hyoseroides, водорослей, таких простейших, как Dinoflagellaten или грибов.
Далее под производными, соответственно, функциональными производными приведенной в SEQ ID No.1 последовательности следует понимать, например, аллельные варианты, которые имеют по меньшей мере 75%-ую гомологию на выведенном аминокислотном уровне, предпочтительно по меньшей мере 80% гомологию, особенно предпочтительно по меньшей мере 85% гомологию, и в частности 90% гомологию. Гомология рассчитывается по общему аминокислотному диапазону. Для расчета применяют программу PileUp (см. J. Mol. Evolution., 25, 351-360, 1987, Higgins и др., CABIOS, 5 1989: 151-153). Выведенная из указанной нуклеиновой кислоты аминокислотная последовательность представлена в последовательности SEQ ID No.2. Аллельные варианты охватывают, в частности, функциональные варианты, которые получают делецией, инсерцией или замещением нуклеотидов из представленной в SEQ ID No.1 последовательности, причем ферментативная активность выведенных синтезированных протеинов сохраняется.
Подобные последовательности ДНК могут быть изолированы из приведенной в SEQ ID NO: 1 последовательности ДНК или участков этой последовательности, например, обычными способами гибридизации или техникой PCR (полимеразной цепной реакции) из других, приведенных выше эукариотов. Эти последовательности ДНК гибридизуются при стандартных условиях с названными последовательностями. Для гибридизации применяют предпочтительно короткие участки олигонуклеотидов, например, консервативные участки, которые определяются посредством сравнения с другими генами, кодирующими десатуразу известным специалисту в данной области методом. Для гибридизации могут также применяться более длинные фрагменты нуклеиновых кислот по изобретению или целые последовательности. В зависимости от примененной нуклеиновой кислоты: олигонуклеотид, длинный фрагмен или полная последовательность или в зависимости от того, какой вид нуклеиновой кислоты ДНК или РНК применяется для гибридизации, эти стандартные условия варьируются. Так, например, температура плавления гибридов ДНК: ДНК на прибл. 10°С ниже, чем температура гибридов ДНК: РНК одинаковой длины.
Под стандартными условиями следует понимать в зависимости от нуклеиновой кислоты температуру между 42°С и 58°С в водном буферном растворе с концентрацией между 0,1 до 5×SSC (1×SSC=0,15 М NaCl, 15 мМ цитрата натрия, рН 7,2) или дополнительно в присутствии 50% формамида, например, 42°С в 5×SSC, 50% формамида. Предпочтительно условия гибридизации для гибрида ДНК: ДНК составляют 0,1×SSC с температурой между 20°С до 45°С, предпочтительно между прибл. 30°С до 45°С. Для гибрида ДНК: РНК условия гибридизации составляют 0,1×SSC и с температурой между прибл. 30°С до 55°С, предпочтительно между 45°С до 55°С. Приведенные температурные диапазоны гибридизации являются рассчитанными значениями температуры плавления для нуклеиновой кислоты с длиной в прибл. 100 нуклеотидов и содержанием G+С в 50% в отсутствии формамида. Экспериментальные условия гибридизации ДНК описаны в учебниках по генетике, например, в Sambrook и др., "Molecular Cloning", Cold Spring Harbor Laboratory, 1989, и могут рассчитываться по известным специалисту в данной области формулам, например в зависимости от длины нуклеиновых ксилот, вида гибридов или содержания G+С. Дальнейшую информацию по гибридизации специалист может найти в следующих учебниках: Ausubel и др. (eds), 1985, Current Protocols в публикации Molecular Biology, John Wiley & Sons, New York; Hames and Higgins (eds), 1985, Nucleic Acids Hybridization: A Practical Approach, IRL Press at Oxford University Press, Oxford; Brown (ed), 1991, Essential Molecular Biology: A Practical Approach, IRL Press at Oxford University Press, Oxford.
Далее под производными следует понимать гомологи последовательности SEQ ID No.1, например, эукариотные гомологи, сокращенные последовательности, однонитевую ДНК кодирующей или некодирующей ДНК-последовательности или РНК кодирующей или некодирующей ДНК-последовательности.
Кроме того, под гомологами последовательности SEQ ID No.1 следует понимать производные, например такие, как варианты промоторов. Эти варианты могут быть изменены одним или несколькими обменами нуклеотидов посредством инсерции (инсерций) и/или делеции (делеций), без отрицательного воздействия на функциональность, соответственно, эффективность промоторов. Эффективность промоторов может быть повышена изменением их последовательностей или же они могут быть полностью заменены на более эффективные промоторы, также и на чужие по виду организмы.
Под производными также следует понимать предпочтительные варианты, нуклеотидная последовательность которых в диапазоне от -1 до -2000 перед стартовым кодоном изменена таким образом, что изменяется, соответственно, повышается экспрессия генов и/или экспрессия протеинов. Далее под производными следует понимать варианты, которые были изменены на 3'-конце.
Для оптимальной экспрессии гетерологических генов в организме имеет преимущество изменение последовательности нуклеиновых кислот в соответствии с применяемым в организме специфичным применением кодона. Применение кодона можно легко определять с помощью компьютерной обработки других, известных генов соответствующего организма.
Предпочтительно ген, кодирующий десатуразу календульной кислоты, можно согласно изобретению комбинировать с другими генами биосинтеза кислот жирного ряда.
Под аминокислотными последовательностями по изобретению следует понимать протеины, которые содержат представленную в SEQ ID NO: 2 аминокислотную последовательность или получаемую из нее замещением, инверсией, инсерцией или делецией одного или нескольких сложных эфиров аминокислоты последовательность, при этом сохраняется ферментативная активность представленного в SEQ ID NO: 2 протеина, соответственно незначительно снижается. Под незначительно сниженными в их активности понимаются все ферменты, которые имеют еще по меньшей мере 10%, предпочтительно 20%, особенно предпочтительно 30% ферментативной активности исходного фермента. При этом, например, определенные аминокислоты можно заменить на кислоты с одинаковыми физикохимическими свойствами (объемное наполнение, основность, гидрофобность и т.д.). Например, остатки аргинина заменяются остатками лизина, остатки валина заменяются на остатки изолейцина или остатки аспарагиновой кислоты заменяются остатками глютаминовой кислоты. Одна или несколько аминокислот в их последовательности могут заменяться, добавляться или удаляться, или же несколько таких приемов могут комбинироваться друг с другом.
Под конструктом или фрагментом нуклеиновых кислот по изобретению понимают приведенную в SEQ ID NO: 1 последовательность, являющуюся результатом генетического кода и/или их функциональных или нефункциональных производных, которые функционально связаны с одним или несколькими регуляторными сигналами для повышения экспрессии гена. Например, при таких регуляторных последовательностях речь идет о последовательностях, к которым присоединяются индукторы или репрессоры и таким образом регулируют экспрессию нуклеиновых кислот. Дополнительно к этим новым регуляторным последовательностям или вместо этих последовательностей может еще иметься естественная регуляция этих последовательностей перед собственными структурными генами и, в случае необходимости, она может быть генетически изменена, так что естественная регуляция отключается и экспрессия генов повышается. Генный конструкт может также быть построен более просто, т.е. дополнителеные регуляторные сигналы не инсерированы перед последовательностью или ее производными и естественный промотор с его регуляцией не удален. Вместо этого естественная последовательность мутирована таким образом, что регуляция больше не происходит и экспрессия генов повышается. Эти измененные промоторы могут одни размещаться перед естественным геном для повышения активности. Генный конструкт может, кроме этого, также содержать один или несколько так называемых энхансерных последовательностей, связанных с промотором, которые обеспечивают повышенную экспрессию последовательности нуклеиновых кислот. Также и на 3'-конце ДНК-последовательностей могут быть инсерированы дополнительные последовательности, такие, как другие регуляторные элементы или терминаторы. Ген, кодирующий десатуразу календульной кислоты, может содержаться в генном конструкте в одной или нескольких копиях.
Регуляторные последовательности для способа по изобретению содержатся, например, в таких промоторах, как cos-, tac-, trp-, tet-, trp-tet-, lpp-, lac-, lpp-lac-, laclq-, T7-, T5-, T3-, gal-, trc-, ara-, SP6-, l-PR- или в l-РL-промоторе, которые находят применение в грамотрицательных бактериях. Другие предпочтительные регуляторные последовательности содержатся, например, в грамположительных промоторах amy и SPO2, грибковых или дрожжевых промоторах ADC1, MFa, AC, P-60, CYC1, GAPDH, TEF, rp28, ADH или в растительных промоторах, таких как CaMV/35S [Franck и др., Cell 21 (1980) 285-294], PRP1 [Ward и др., Plant.Mol. Biol. 22 (1993)], SSU, OCS, lib4, STLS1, B33, nos или в Ubiquitin-промоторе. Другими предпочтительными растительными промоторами являются, например, индуцируемый бензенсульфонамидом промотор (см. ЕР 388186), индуцируемый тетрациклином промотор (см. Gatz и др., (1992) Plant J. 2,397-404), индуцируемый абсцизиновой кислотой промотор (см. ЕР335528), соответственно индуцируемый этанолом или циклогексаноном промотор (см. WO 9321334). Другими растительными промоторами являются, например, промотор цитозольной FBPазы из картофеля, промотор ST-LSI из картофеля (см. Stockhaus и др., ЕМВО J. 8 (1989) 2445-245), промотор фосфорибозилпирофосфат амидотрансферазы из Glycine max (см. также Genbank Accession Nummer U87999) или нодий-специфичный промотор, описанный в ЕР 249676. Предпочтительными являются такие растительные промоторы, которые обеспечивают экспрессию в ткани и частях растений, в которых имеет место биосинтез жиров, соответственно, его предварительная стадия. В частности, к ним причисляются промоторы, которые обеспечивают специфичную семенам экспрессию, как например, usp-промотор, der LEB4-промотор, фазеолин-промотор или напин-промотор.
В принципе, для способа по изобретению могут применяться все естественные промоторы с их регуляторными последовательностями, как приведено выше. Сверх этого могут применяться синтетические промоторы.
Во фрагменте нуклеиновой кислоты (генном конструкте, конструкте нуклеиновой кислоты) могут содержаться еще и другие гены, которые должны встраиваться в организм. Эти гены могут находиться под разделенной регуляцией или же под таким же регуляционным регионом, что и ген, кодирующий десатуразу по изобретению. При этих генах речь идет, например, еще о других генах биосинтеза кислот жирного ряда и липидов, которые обеспечивают повышенный синтез. Например, следует назвать гены Δ15-, Δ12-, Δ9-, Δ6-, Δ5-десатуразы, различных гидроксилаз, ацетиленазы, ацил-АСР-тиоэстеразы, β-кетоацил-АСР-синтазы, ацилтрансферазы, такой как диацилглицероацилтрансфераза, глицерол-3-фосфатацилтрансфераза или лизофосфатитацилтрансфераза или β-кетоацил-АСР-редуктаза. Преимущественно применяют гены десатуразы в конструкте нуклеиновых кислот, предпочтительно, гены Δ12-десатуразы.
Для экспрессии фрагмент нуклеиновых кислот инсерируется в организме-хозяине, например, в микроорганизме, в таком как гриб или растение, предпочтительно в вектор, например, плазмиду, фаг или прочую ДНК, который позволяет оптимальную экспрессию генов в хозяине. Подходящие плазмиды имеются, например, в Е.coli pLG338, pACYC184, pBR322, pUC18, pUC19, рКС30, pRep4, pHS1, pHS2, pPLc236, pMBL24, pLG200, pUR290, plN-III113-B1, λgt11 или pBdCl, в стрептомицетах рlJ101, plJ364, plJ702 или plJ361, Bacillus pUB110, pC194 или pBD214, в коринебактериях pSA77 или pAJ667, в грибах pALS1, plL2 или рВВ116, в дрожжах 2μМ, pAG-1, YEp6, YEp13 или pEMBLYe23 или в растениях pLGV23, pGHlac+, pBIN19, pAK2004, pVKH или pDH51 или в производных вышеприведенных плазмид. Вышеприведенные плазмиды представляют собой лишь малый выбор возможных плазмид. Другие плазмиды известны специалисту в данной области и приведены в книге Cloning Vectors (Eds. Pouwels P.H. и др. Elsevier, Amsterdam-New York-Oxford, 1985, ISBN 0444904018). Пригодные растительные векторы описаны среди прочего в "Methods in Plant Molecular Biology and Biotechnology" (CRC Press), раздел 6/7, стр.71-119.
Под векторами кроме плазмид следует понимать также и все другие, известные специалисту векторы, как например, фаги, вирусы, такие как SV40, CMV, бакуловирус, аденовирус, транспозоны, IS-элементы, фазмиды, фагмиды, космиды, линейные или кольцевые ДНК. Эти векторы могут быть реплицированы автономно в организме-хозяине или же хромосомально. Предпочтительна хромосомальная репликация.
Вектор содержит по меньшей мере одну копию последовательности нуклеиновых кислот по изобретению и/или фрагмента нуклеиновой кислоты.
Для повышения числа генных копий последовательности нуклеиновой кислоты или гомологовые гены могут быть вставлены, например, в один фрагмент нуклеиновой кислоты, соответственно, вектор, который содержит предпочтительно приданные соответствующим генам, регуляторные последовательности генов или аналогично действующую промоторную активность. В частности, применяются такие регуляторные последовательности, которые усиливают экспрессию гена.
Фрагмент нуклеиновой кислоты для экспрессии других генов содержит дополнительно еще 3'- и/или 5'-концевые регуляторные последовательности для усиления экспрессии, которые в зависимости от выбранного организма-хозяина и гена или генов выбираются для оптимальной экспресии.
Эти регуляторные последовательности должны обеспечивать направленную экспрессию генов и протеинов. Это в зависимости от организма-хозяина может означать то, что ген экспримируется и/или сверхэкспримируется после индукции или же сразу.
Регуляторные последовательности, соответственно, факторы могут при этом положительно влиять на экспрессию введенных генов и вследствие этого повышать ее. Так, например, усиление регуляторных элементов может происходить на уровне транскрипции, при этом применяются сильные сигналы транскрипции, такие как промоторы и/или энхансеры. Наряду с этим возможно также усиление трансляции, например, улучшение стабильности матричной РНК.
При еще одной форме выполнения вектора генный конструкт по изобретению может вводиться в организм в форме линейной ДНК и интегрироваться через гетерологическую или гомологическую рекомбинацию в геном организма-хозяина. Эта линейная ДНК может состоять из линеаризованного плазмида или только из фрагмента нуклеиновой кислоты в качестве вектора или последовательности нуклеиновых кислот по изобретению.
Предпочтительным образом последовательность нуклеиновой кислоты по изобретению вместе с по меньшей мере одним геном-репортером клонируется в конструкт нуклеиновой кислоты, который встраивается в геном. Этот ген-репортер должен обеспечивать возможность легкого детектирования с помощью анализа роста, флуоресценции, хемо- или биолюминесценции или стойкости или же фотометрического измерения. Пригодными в качестве генов-репортеров являются, например, гены устойчивости к антибиотикам и гербицидам, гены гидролазы, гены флуоресцентных протеинов, гены биолюминесценции, гены сахарного или нуклеотидного обмена веществ или гены биосинтеза, такие как Ura3-ген, llv2-ген, ген люциферазы, ген β-галактосидазы, gfp-ген, ген 2-дезоксиглюкоза-6-фосфат-фосфатазы, ген β-глюкуронидазы, ген β-лактамазы, ген неомицинфосфотрансферазы, ген гидромицинфосфотрансферазы или ген стойкости к BASTA (глюфосинату). Эти гены позволяют легкую измеряемость и количественное определение транскрипционной активности и вместе с этим экспрессии генов. Этим могут определяться места геномов, которые проявляют различную продуктивность.
При другой форме выполнения изобретения последовательность нуклеиновых кислот по изобретению также и одна может быть введена в организм.
Если наряду с последовательностью нуклеиновых кислот по изобретению в организм должны вводиться другие гены, то они могут все вместе вводиться геном-репортером в единственном векторе или каждый отдельный ген может вводиться геном-репортером в соответствующем одном векторе, причем различные векторы могут вводиться одновременно или последовательно.
Организм-хозяин получает по меньшей мере одну копию нуклеиновой кислоты по изобретению и/или конструкта нуклеиновой кислоты по изобретению.
Введение нуклеиновой кислоты, конструкта нуклеиновой кислоты или вектора по изобретению в организм, например, растения, может в принципе осуществляться всеми известными специалисту в данной области методами.
Для микроорганизмов специалист может найти соответствующий метод в учебниках Sambrook, J. и др. (1989) Molecular cloning: A laboratory manual, Cold Spring Harbor Laboratory Press, F.M.Ausubel и др. (1994) Current protocols in molecular biology, John Wiley and Sons, D.M.Glover и др., DNA Cloning Vol.1, (1995), IRL Press (ISBN 019-963476-9), Kaiser и др. (1994) Methods in Yeast Genetics, Cold Spring Habor Laboratory Press или Guthrie и др. Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, 1994, Academic Press.
Перенос чужих генов в геном растения называется трансформацией. При этом используются описанные методы трансформации и регенерации растений из тканей растений или частей растений для трансиентной или стабильной трансформации. Пригодными методами являются трансформация протопластов посредством индуцированного полиэтиленгликолем поглощения ДНК, применение генной-пушки, электропорация, инкубация сухих зародышей в содержащем ДНК растворе, микроинъекция и опосредованный Agrobacterium перенос генов. Приведенные способы описаны, например, в публикациях В. Jenes и др., Techniques for Gene Transfer, Transgenic Plants, Vol.1, Engineering and Utilization, выпущенном S.D.Kung и R.Wu, Academic Press (1993) 128-143, a также в публикации Potrykus Annu. Rev. Plant Physiol.Plant Molec.Biol. 42 (1991) 205-225). Предпочтительно подлежащий экспрессии конструкт клонируется в вектор, который пригоден для трансформации Agrobacterium tumefaciens, например, pBin19 (см. Bevan и др., Nucl. Acids Res. 12 (1984) 8711). Трансформация растений с помощью Agrobacterium tumefaciens описана, например, в публикации Höfgen und Willmitzer Nucl. Acid Res. (1988) 16, 9877.
Трансформированные вектором экспрессии по изобретению агробактерии могут также известным образом применяться для трансформации растений, например, испытательных растений, таких как Arabidopsis или культурных растений, в частности, содержащих масло культурных растений, таких как соя, земляной орех, подсолнечник, клещевина, кукуруза, хлопчатник, лен, рапс, кокосовый орех, масличная пальма, Carthamus tinctorius или бобы какао, например, таким образом, что в поврежденные листья или куски листьев погружают в раствор агробактерии и после этого культивируют в подходящей среде.
Генетически измененные клетки растений можно регенерировать посредством всех известных специалисту методов. Соответствующие методы можно найти в вышеприведенных публикациях S.D.Kung и R.Wu, Potrykus или Höfgen и Willmitzer.
В качестве организмов, соответственно, организмов-хозяев для нуклеиновой кислоты по изобретению, конструкта нуклеиновой кислоты или вектора пригодны в принципе все организмы, которые в состоянии синтезировать кислоты жирного ряда, а именно ненасыщенные кислоты, соответственно, которые пригодны для экспрессии рекомбинантных генов. В качестве примеров следует привести такие растения, как Arabidopsis, Asteraceae, такие, как календула или культурные растения, такие, как соя, земляной орех, подсолнечник, клещевина, кукуруза, хлопчатник, лен, рапс, кокосовый орех, масличная пальма, или бобы какао, такие микроорганизмы, как грибы, например, вида Mortierella, Saprolegnia или Pythium, такие бактерии, как вида Escherichia, дрожжи, такие, как вида Saccharomyces, водоросли или простейшие, такие, как динофлагелаты, такие, как Crypthecodinium. Предпочтительными являются организмы, которые могут синтезировать большое количество масел естественным путем, такие, как грибы, например Mortierella alpina, Pythium insidiosum или такие растения, как соя, рапс, лен, кокосовый орех, масличная пальма, Carthamus tinctorius, клещевина, календула, земляной орех, бобы какао или подсолнечник или дрожжи, такие, как Saccharomyces cerevisiae, особенно предпочтительны соя, рапс, лен, подсолнечник, календула или Saccharomyces cerevisiae. В принципе в качестве организмов-хозяев могут быть также и трансгенные животные, например, Caenorhabditis elegans.
Другим объектом изобретения являются трансгенные растения, которые содержат функциональную или нефункциональную нуклеиновую кислоту или функциональный или нефункциональный конструкт нуклеиновой кислоты. Под понятием "нефункциональные" следует понимать то, что ферментативно активный протеин больше не синтезируется, так как естественный ген инактивирован. Кроме того, под нефункциональными нуклеиновыми кислотами или фрагментами нуклеиновых кислот следут понимать также и так называемую антисмысловую ДНК, которая приводит к трансгенным растениям, которые имеют сниженную ферментативную активность или не имеют ферментативной активности. С помощью антисмысловой техники, особенно если последовательность нуклеиновой кислоты по изобретению комбинируется с другими генами синтеза кислот жирного ряда в антисмысловой ДНК, можно синтезировать триглицериды с повышенным содержанием насыщенных, соответственно, ненасыщенных кислот жирного ряда. Под трансгенными растениями следует понимать отдельные клетки растений или их культуры в твердой среде или в жидкой культуре, части растений и целые растения.
Применение последовательности нуклеиновой кислоты по изобретению или конструктов нуклеиновой кислоты по изобретению для получения трансгенных растений является также объектом изобретения.
Другим объектом изобретения является фермент, который превращает кислоту жирного ряда общей формулы I,
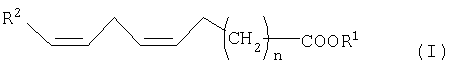
имеющую две отделенные друг от друга метиленовой группой двойные связи, в трижды ненасыщенную кислоту жирного ряда общей формулы II
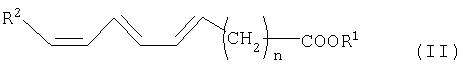
причем три двойных связи кислоты жирного ряда находятся в сопряжении и заместители в соединениях общей формулы I и II имеют следующее значение:
R1 означает водород, замещенный или незамещенный, ненасыщенный или насыщенный, разветвленный или неразветвленный С1-С10-алкил-,
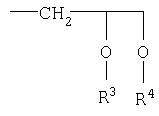
R2 означает замещенный или незамещенный, насыщенный или ненасыщенный C1-С9алкил-.
R3 и R4 означают независимо друг от друга водород, замещенный или незамещенный, насыщенный или ненасыщенный, разветвленный или неразветвленный C1-C22алкилкарбонил - или фосфо-, и
n равно 1 до 14, предпочтительно от 1 до 8, особенно предпочтительно от 4 до 6, очень предпочтително 6.
R1 означает в соединениях формул I и II водород, замещенный или незамещенный, ненасыщенный или насыщенный, разветвленный или неразветвленный C1-С10-алкил-, или группу
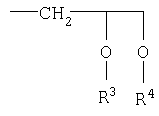
В качестве алкильных остатков приводятся замещенные или незамещенные, разветвленные или неразветвленные C1-С10-алкильные цепи, например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил.
Предпочтительными остатками R1 являются водород и группировка

R2 означает в соединениях формул I и II замещенный или незамещенный, ненасыщенный или насыщенный С1-С9-алкил-.
В качестве алкильных остатков следует привести замещенные или незамещенные, или ненасыщенные или насыщенные С1-С9-алкильные цепи, например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил- 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил или н-нонил. Предпочтителен С1-С5-алкил. Особенно предпочтителен С5-алкил.
R3 и R4 означают независимо друг от друга водород, замещенный или незамещенный, насыщенный или ненасыщенный, разветвленный или неразветвленный С1-С22-алкилкарбонил- или фосфо-.
С1-С22-алкилкарбонилом являются, например, метилкарбонил, этилкарбонил, н-пропилкарбонил, 1-метилэтилкарбонил, н-бутилкарбонил, 1-метилпропилкарбонил, 2-метилпропилкарбонил, 1,1-диметилэтилкарбонил, н-пентилкарбонил, 1-метилбутилкарбонил, 2-метилбутилкарбонил, 3-метилбутилкарбонил, 1,1-диметилпропилкарбонил, 1,2-диметилпропилкарбонил, 2,2-диметилпропилкарбонил, 1-этилпропилкарбонил, н-гексилкарбонил, 1-метилпентилкарбонил, 2-метилпентилкарбонил, 3-метилпентилкарбонил, 4-метилпентилкарбонил, 1,1-диметилбутилкарбонил, 1,2-диметилбутилкарбонил, 1,3-диметилбутилкарбонил, 2,2-диметилбутилкарбонил, 2,3-диметилбутилкарбонил, 3,3-диметилбутилкарбонил, 1-этилбутилкарбонил, 2-этилбутилкарбонил, 1,1,2-триметилпропилкарбонил, 1,2,2-триметилпропилкарбонил, 1-этил 1-метилпропилкарбонил и 1-этил-2-метилпропилкарбонил, гептилкарбонил, нонилкарбонил, децилкарбонил, ундецилкарбонил, н-додецилкарбонил, н-тридецилкарбонил, н-тетрадецилкарбонил, н-пентадецилкарбонил, н-гексадецилкарбонил, н-гептадецилкарбонил, н-октадецилкарбонил, н-нонадецилкарбонил или н-эйкозилкарбонил.
Предпочтительными заместителями для R3 и R4 является насыщенный или ненасыщенный С16-С22-алкилкарбонил.
В качестве заместителей приведенных остатков следует привести, например, галоген, такой как фтор или хлор, а также алкил или гидроксил.
При взаимодействии с ферментом по изобретению в кислоту жирного ряда вводится одна двойная связь и одна двойная связь смещается, так что участвующие в реакции три двойных связи находятся в сопряжении. Далее одна двойная связь изомеризуется (из цис в транс).
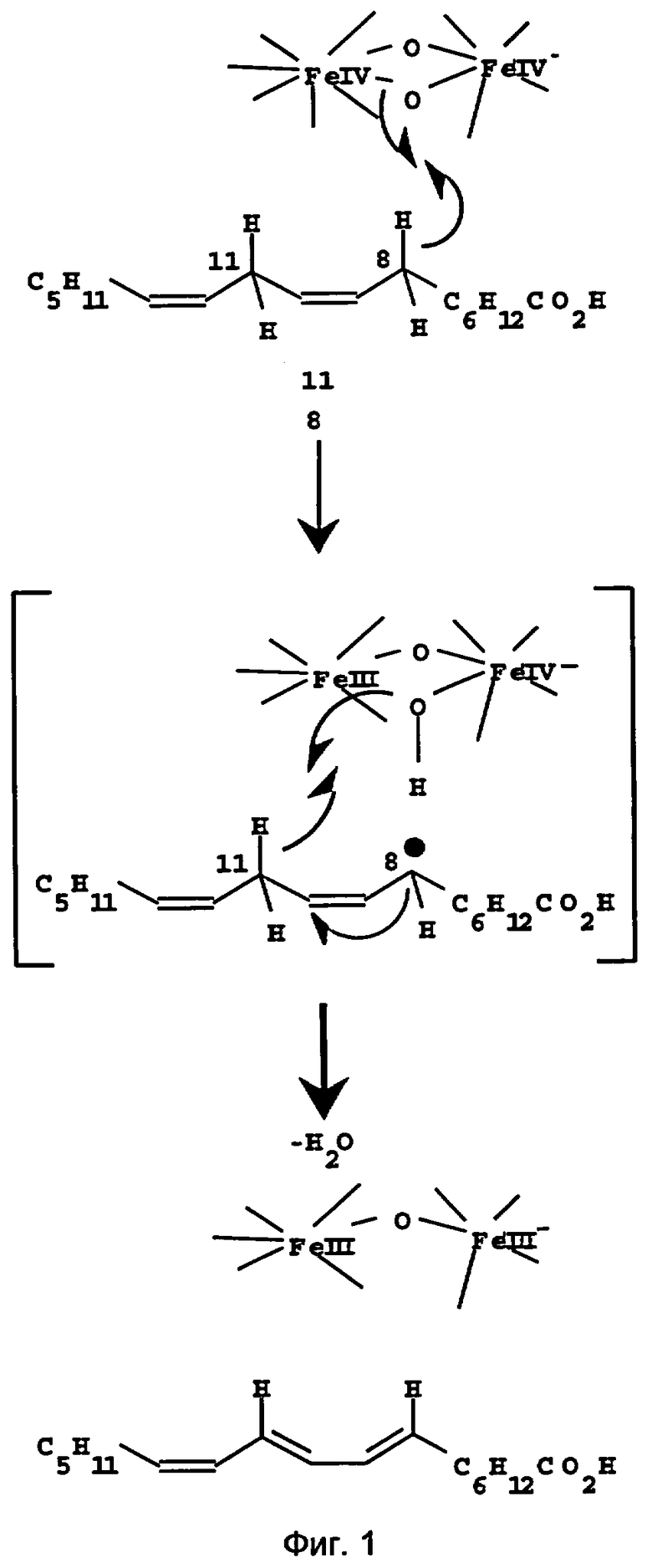
Фермент (а именно десатураза календульной кислоты) катализирует превращение линолевой кислоты (18:2, 9Z,12Z) в календульную кислоту (18:3, 8E,10E,12Z). Фермент вводит транс-двойную связь в положение С8 и приводит к специфичному смещению цис-двойной связи в положение С9 к транс-двойной связи в положении С 10, причем изомеризация происходит специфично для данного участка. Возможный гипотетический механизм реакции представлен на фиг.1. После депротонирования в С8 линолевой кислоты и перегруппировки радикала по С10 в ходе отщепления воды происходит депротонирование в С11 и вместе с этим образование календульной кислоты. Одновременно связанный Fe IV снижается до Fe III. На Фиг.1 изображен гипотетический механизм для (8,11)-линолеол-десатуразы (десатуразы календульной кислоты), модифицированный согласно публикации Svatos, А и др. (Insect Biochemistry and Molecular Biology 29,1999:225-232) основанный на предложенном механизме катализа для Δ9-десатуразы из клещевины (см. Lindqvist, Y и др., ЕМВО Journal 15, 1996:4081-4092). В качестве субстрата пригодны также 6Z,9Z,12Z, 18:3-жирная кислота и 9Z,12Z,15Z, 18:3-жирная кислота, которые потом превращаются в 6Z,8E,10E,12Z - соответственно 8Е,10Е,12Z,15Z-жирные кислоты.
Другим объектом изобретения является способ получения ненасыщенных кислот жирного ряда, согласно которому по меньшей мере одну вышеописанную последовательность нуклеиновых кислот по изобретению или по меньшей мере один конструкт нуклеиновой кислоты по изобретению вводят в производящий предпочтительно масло организм, этот организм культивируют, содержащееся в нем масло выделяют и высвобождают содержащиеся в масле кислоты жирного ряда.
Объектом изобретения является также способ получения триглицеридов с повышенным содержанием ненасыщенных кислот жирного ряда, при котором по меньшей мере одну вышеприведенную последовательность нуклеиновых кислот по изобретению или по меньшей мере один конструкт нуклеиновой кислоты по изобретению вводят в производящий масло организм, этот организм культивируют и содержащееся в организме масло выделяют.
Оба способа позволяют синтез кислот жирного ряда или триглицеридов с повышенным содержанием ненасыщенных кислот жирного ряда, таких как календульная кислота.
Другим объектом изобретения является способ получения насыщенных кислот жирного ряда, при котором по меньшей мере одну нефункциональную, вышеприведенную последовательность нуклеиновой кислоты по изобретению или по меньшей мере один конструкт нуклеиновой кислоты по изобретению вводят в производящий масло организм, этот организм культивируют, содержащееся в организме масло выделяют и содержащиеся в масле кислоты жирного ряда высвобождают, а также способ получения триглицеридов с повышенным содержанием насыщенных кислот жирного ряда, при котором по меньшей мере одну нефункциональную, вышеприведенную последовательность нуклеиновой кислоты по изобретению или по меньшей мере один нефункциональный конструкт нуклеиновой кислоты по изобретению вводят в производящий масло организм, этот организм культивируют и содержащееся в организме масло выделяют. Для обоих этих способов применяется так называемая антисмысловая технология (см. выше), соответственно инактивируются естественные гены синтеза.
В качестве организмов для приведенных способов следует привести, например, такие растения, как Arabidopsis, соя, земляной орех, клещевина, подсолнечник, кукуруза, хлопчатник, лен, рапс, кокосовый орех, масличная пальма, Carthamus tinctorius или бобы какао, такие микроорганизмы, как грибы Mortierella, Saprolegnia или Pythium, такие бактерии, как вида Escherichia, такие дрожжи, как вида Saccharomyces, такие водоросли или простейшие, как Dinoflagellaten и Crypthecodinium. Предпочтительны организмы, которые могут синтезировать естественные масла в большом количестве, такие, как грибы вида Mortierella alpina, Pythium insidiosum или растения, такие как соя, рапс, лен, кокосовый орех, масличная пальма, Carthamus tinctorius, клещевина, календула, земляной орех, бобы какао или подсолнечник, или дрожжи, такие как Saccharomyces cerevisiae, особенно предпочтительны соя, рапс, лен, подсолнечник, календула Saccharomyces cerevisiae.
Применяемые в способах по изобретению организмы в зависимости от организма-хозяина культивируются известным специалисту в данной области методом. Микроорганизмы, как правило, культивируются в жидкой среде, которая содержит источник углерода в большинстве случаев в форме сахара, источник азота в большинстве случаев в форме органического источника азота, такого, как дрожжевой экстракт или солей, таких, как сульфат аммония, источник фосфата, гидрофосфат калия, микроэлементы, такие, как соли железа, марганца, магния и в случае необходимости витамины, при температуре от 0°С до 100°С, предпочтительно от 10°С до 60°С с подводом кислорода. При этом значение рН питательной жидкости может поддерживаться постоянным. Т.е. во время культивирования значение рН регулируется. Возможно также выращивание без регулирования значения рН. Выращивание может производиться прерывным, полупрерывным или непрерывным способом. Питательные вещества могут присутствовать в начале ферментации или подаваться полунепрерывно или непрерывно.
Растения регенерируют после трансформации сначала как описано выше и потом их как обычно культивируют, соответственно, выращивают.
Из организмов после выращивания получают обычным методом липиды. Для этого растения после сбора урожая сначала разлагают или непосредственно применяют. Липиды экстрагируют с помощью подходящих растворителей, например, неполярных растворителей, таких, как гексан или полярных растворителей, таких, как этанол, изопропанол или их смесей, например, гексан/изопропанол, фенол/хлороформ/изоамиловый спирт при температуре от 0°С до 80°С, предпочтительно от 20°С до 50°С. Биомассу экстрагируют, как правило, избыточным количеством растворителя, например, с избытком растворителя к биомассе 1:4. Растворитель удаляют после этого отгонкой. Экстракцию можно осуществлять также и с помощью сверхкритичного количества CO2. После экстракции остаточную биомассу удаляют, например, фильтрацией. Стандартные методы экстракции кислот жирного ряда из растений и микроорганизмов описаны в публикации Bligh и др. (Can. J. Biochem. Physiol. 37, 1959: 911-917) или в Vick и др. (Plant Physiol. 69, 1982: 1103-1108).
Полученное таким образом сырое масло подвергают очистке, например, удалением помутнения посредством смешения с полярным растворителем, таким как ацетон, или аполярным растворителем, таким как хлороформ, и после этого фильтрацией или центрифугированием. Возможна также дальнейшая очистка на колонне или другими методами.
Для получения свободных кислот жирного ряда из триглицеридов их подвергают обычным образом омылению, например, посредством NaOH или КОН.
Другим объектом изобретения являются ненасыщенные или насыщенные кислоты жирного ряда, а также триглицериды с повышенным содержанием насыщенных или ненасыщенных кислот жирного ряда, которые были получены вышеприведенными способами, а также их применение для получения питательных средств, кормов животных, косметических или фармацевтических продуктов. Они добавляются в обычных количествах в питательные средства, корма, в косметические и фармацевтические продукты.
Изобретение поясняется далее с помощью нижеприведенных примеров выполнения.
Примеры
Методом полимеразной цепной реакции с обратной транскрипцией RT-PCR и техникой RACE (быстрой амплификации концов кДНК), из матричной РНК Calendula officinalis клонируют кДНК. При экспрессии этой кДНК в дрожжах линолевая кислота преобразуется в октадекасопряженную календульную кислоту (8Е, 10Е, 12Z). При этом, насколько это известно заявителю, здечь речь идет о первом описании десатуразы календульной кислоты. Фермент вызывает специфичное к участку смещение цис-двойной связи в положение С9 к транс-двойной связи в положении С10 и вводит новую транс-двойную связь в положении С8.
Трансгенные дрожжи и растения с повышенной экспрессией кДНК-десатуразы календульной кислоты содержат календульную кислоту в их липидах.
Пример 1: Выделение РНК из семян Calendula officinalis
Чтобы можно было выделять кДНК-клоны для десатуразы из календульной кислоты путем ПЦР препарируют РНК из семян Calendula officinalis. Вследствие высокого содержания кислот жирного ряда в семенах применение стандартных протоколов было не возможно, и поэтому были применены следующие методы:
20 г растительного материала растирают в жидком азоте в порошок. Добавляют 100 мл буфера экстракции I [100 мМ трис-HCl, рН 7,5, 25 мМ EDTA, 2% (вес/об) лаурилсаркосила, 4М тиоцианата гуанидиния, 5% (весовое соотношение w/v) PVP (поливилпирролидона), 1% (объемное соотношение v/v) β-меркапто-этанола, сразу перемешивают и гомогенизируют. Раствор переводят в емкость вместимостью 50 мл и встряхивают в течение прибл. 15 минут. После центрифугирования при 4000 g в течение 10-15 мин. снимают плавающий сверху слой жира, соответственно, капли жира и надосадочную жидкость переводят в свежую емкость. Затем следует экстракция с помощью 1 объема смеси фенол/хлороформ/изоамиловый спирт (PCI, 25:24:1) и экстракция хлороформом, причем смесь встряхивают в течение 15 минут и потом центрифугируют. Верхнюю водную фазу снимают, выливают на слой 8 мл CsCl (5 М CsCl) и центрифугируют 18 часов при 18°С и 100 000 g. Надосадочную жидкость декантируют и осадок РНК коротко сушат. После промывки посредством 70% этанола РНК растворяют в смеси из 7,5 мл экстракционного буффера II (100 мл трис/HCl, рН 8,8, 100 мМ NaCl, 5 мМ ЭДТА, 2% додецилсульфата натрия) и 10 мл смеси фенол/хлороформ/изоамиловый спирт, в течение 15 минут встряхивают и центрифугируют. Верхнюю водную фазу после экстракции хлороформом смешивают с таким же количеством 5М LiCl. Осаждение РНК осуществляют в течение ночи при 4°С. После этого центрифугируют в течение 60 минут при 12000 g и 4°С. Осадок промывают два раза посредством 70% этанола и сушат и затем загружают в 500 мкл H2O.
Из полученной таким оразом общей календульной РНК выделяют с помощью Poly-Attract-Kit (Promega, Mannheim) по указаниям изготовителя мРНК. 1 мкг этой мРНК с помощью обратной транскриптазы Superscriptll reversen фирмы Gibco BRL (Eggenstein) переводят посредством 200 пмоль праймера олиго-dT по указаниям изготовителя в мДНК и применяют в полимеразной цепной реакции в качестве матрицы.
Пример 2: Выделение и клонирование десатуразы календульной кислоты из Calendula officinalis
Чтобы выделить последовательности ДНК из Calendula officinalis, которые кодируют десатуразу календульной кислоты, выводят различные вырожденные олигонуклеотидные праймеры из аминокислотных последовательностей консервативных гистидин-боксов различных Δ12-десатураз.
Праймер А: 5'-CCD TAY ТТС TCI TGG AAR WWH AGY CAY CG-3'
Прямой праймер, выведенный из аминокислотной последовательности
P Y F S W K Y/I S H R
Праймер В: 5'-ССА RTY ССА YTC IGW BGA RTC RTA RTG-3'
Обратный праймер, выведенный из аминокислотной последовательности
Н Y D S S/T E W D/N W
Буквы в праймере А и В имеют следующее значение:
R=A/G=С/T
W=А/T
Н=А/С/T
В=C/G/T
D=A/G/T
I = инозитол
Фрагмент ДНК с длиной в 470 пар оснований амплифицирован праймерами А и В в полимеразной цепной реакции PCR с календульной однонитевой кДНК (полученной по примеру 1) в качестве матрицы. Применяют следующую программу полимеразной цепной реакции:
Для амплификации применяют ДНК-полимеразу Tfl фирмы Biozym (Hess. Ольдендорф). Фрагмент ДНК длиной в 470 пар оснований клонируют с помощью ТОРО ТА Cloning Kits (фирма Invitrogen, Carlsbad, USA) в вектор pCR 2.1-ТОРО и секвенируют. Последовательность фрагмента длиной 470 пар оснований соответствовала нуклеотидной последовательности от 466 до 893 из SEQ ID NO: 1.
Пример 3: Получение и секвенирование полных кДНК-клонов
Чтобы получить клон полной длины фрагмент удлиняют с помощью 5'- и 3'-RACE (быстрой амплификации концов кДНК). Исходя из 1 мкг мРНК (выделенной по примеру 1), с помощью "Marathon cDNA Amplification Kit" фирмы CLONTECH (Гейдельберг, Германия) получают двунитевую кДНК. После адапторного лигирования проводят 5'- и 3'-RACE с помощью следующих праймеров:
Специфичный праймер для 5'-RACE:
Праймер С 5'-GTG AGG GAG TGA GAG ATG GGT GTG GTG С-3'
Праймер D 5'-AAC АСА СТТ АСА ССТ AGT ACT GGA ATT G-3'
Специфичный праймер для 3'-RACE:
Праймер Е 5'-TAT TCC AAA CTT CTT AAC AAT CCA CCC G-3'
Праймер F 5'-САА ТТС CAG TAG TAG GTG TAA GTG TGT Т-3'
Сначала проводят полимеразную цепную реакцию PCR с помощью прошедшей адапторное лигирование двунитевой кДНК и праймеров С, соответственно Е, после чего осуществляют вторую полимеразную цепную реакцию праймерами D, соответственно, F и разбавлением в соотношении 1:50 продукта ПЦР из реакции с праймерами С, соответственно Е в качестве матрицы.
Реакции RACE-PCR проводят по следующей программе:
Полученные фрагменты ДНК клонируют с помощью ТОРО ТА Cloning-Kits (фирма Invitrogen, Carlsbad, USA) в вектор pCR 2.1-TOPO и секвенируют. Продукт быстрой амплификации концов 5'-RACE проходит через стартовый кодон в 5'-нетранслатированный участок (5'-UTR), в то время как продукт 3'-RACE входит через стоп-кодон в 3'-UTR.
Составная последовательность, состоящая из первого продукта PCR и продукта RACE представлена в SEQ ID NO: 1. Кодирующий участок простирается от нуклеотида 42 (старт-кодон) до 1175 (стоп-кодон). 5- и 3'-UTRs секвенированы однонитевыми, так что возможны отдельные ошибки секвенирования.
Для получения сплошного клона полной длины проводят полимеразную цепную реакцию с помощью Expand High Fidelity-System (Boehringer, Mannheim) и праймеров G и Н, а также с помощью кДНК календульной кислоты (см. пример 1) в качестве матрицы.
Праймер G 5'-ATTAGAGCTCATGGGTGCTGGTGGTCGGATGTCG-3'
Прямой праймер (с местом резки SacI)
Праймер Н 5'-ATTACTCGAGTGACATACACCTTTTTGATTACATCTTG-3'
Обратный праймер (с местом резки Xhol)
Реакцию PCR проводят по следующей программе:
Продукт реакции PCR с длиной в 1,2 тыс. п.о. клонируют в вектор pGEM-T (фирмы Promega, Маннгейм)и трансформируют в Е.coli DH10B. Вставляемую ДНК подвергают двунитевому секвенированию с помощью ДНК - секвенора 373 (Applied Biosystems). Для этого наряду с обратным праймером и -21 праймером применяют еще следующие специфичные секвенированию праймеры:
Праймер I: 5'-CGG TCT TCT CGC TGT АТТ-3'
Праймер J: 5'-АТТ АСС САА GCT GCC С-3'
Полная ДНК-последовательность десатуразы календульной кислоты (CalDes) идентична с участком нуклеотидов от 42 до 1193 последовательности SEQ ID NO: 1. Последовательность охватывает кодирующий участок и короткий участок 3'-UTR.
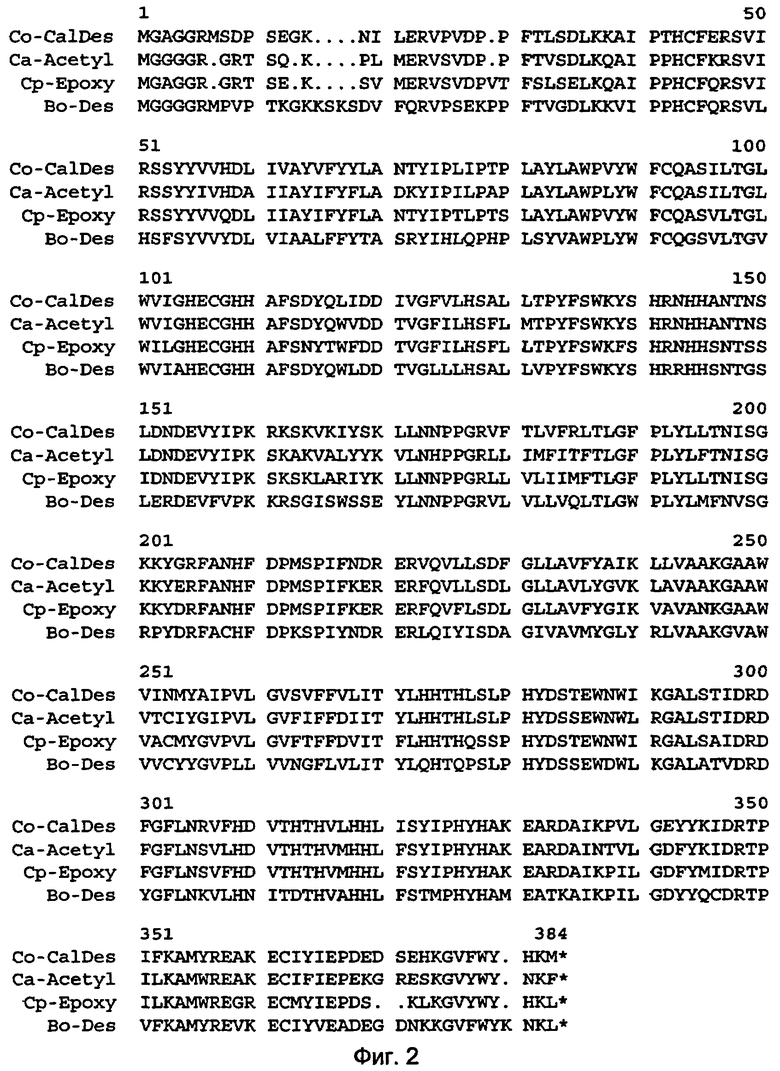
Сравнение выведенной Co-CalDes (SEQ ID NO: 2) аминокислотной последовательности с аннотированными протеиновыми последовательностями SWISS-PROT и SP-TREMBL-банком данных дает наибольшую гомологию с Δ12-ацетиленазой из Crepis alpina (SP_PL: O81931, 74% идентичные аминокислоты), с Δ12-эпоксигеназой из Crepis palaestina (SP_PL: O65771, 73% идентичные аминокислоты) и с Δ12-десатуразой из Borago officinalis (SP_PL: O82729, 62% идентичные аминокислоты) по всему кодирующему участку. Сравнения последовательностей представлены на фиг.2. Фиг.2 показывает сравнение аминокислотных последовательностей Co-CalDes с Δ12-ацетиленазой из Crepis alpina (Са-ацетил), Δ12-эпоксиназой из Crepis palaestina (Ср-эпокси) и с Δ12-десатуразой из Borago officinalis (Bo-Des).
Пример 4: Экспрессия десатуразы календульной кислоты в дрожжах
Для подтверждения функциональности десатуразы календульной кислоты CalDes сначала клонируют кодирующий участок кДНК в вектор экспрессии в дрожжах и экспримируют в S.cerevisiae. Полученная в дрожжах десатураза календульной кислоты должна преобразовывать поданную линолевую кислоту в календульную кислоту. Календульная кислота в свою очередь должна распознаваться в гидролизированных экстрактах липидов с помощью высокопроизводительной жидкостной хроматографии.
На второй стадии дополнительно к CalDes экспримируют Δ12-десатуразу FAD2 из A.thaliana (Kajiwara и др., Appl. Environ. Microbiol., 62, 1996: 4309-4313 в дрожжах, так что клетки дрожжей производят эндогенную линолевую кислоту, которая потом вследствие активности гена CalDes может быть преобразована в календульную кислоту. Календульная кислота определяет также с помощью высокопроизводительной жидкостной хроматографии.
Все жидкие и твердые среды для дрожжей были получены согласно протоколам, зафиксированным в публикации Ausubel и др. (Current Protocols в Molecular Biology, John Wiley & Sons, New York, 1995).
Комплементарную ДНК-десатуразу календульной кислоты (CalDes-cDNA) вырезают посредством переваривания рестрикционными ферментами с помощью Sacl/Xhol из вектора pGEM-T, клонируют в вырезанный Sacl/Xhol бифункциональный вектор pYES2 (Invitrogen, Carlsbad, USA) и полученный таким образом вектор pYES2-CalDes трансформируют в Е.coli XL1 blue. После повторной обработки плазмиды с помощью Plasmid Maxi Kits (QIAGEN) вектор pYES2-CalDes трасформируют с помощью полиэтиленгликолевого метода (Von Pein M., Dissertation, Heinrich Heine-Universität Düsseldorf, 1992) в S. cerevisiae INCSv1 (Invitrogen, Carlsbad, USA). Где экспрессия CalDes-cDNA находится под контролем GAL1-промотора.
Чтобы на воторой стадии можно было экспрессировать в дрожжах дополнительно к CalDes также и FAD2, сначала амплифицируют кодирующий участок гена FAD2 посредством реакции PCR (праймеры G и Н) из А.thaliana-кДНК с помощью полимеразы Tfl (фирмы Biozym). Применяют следующие праймеры:
Праймер К: 5'-AAACTCGAGATGGGTGCAGGTGGAAGAATGCCGG-3'
прямой праймер (место резки XhoI)
Праймер L: S'-AAAAAGCTTTCATAACTTATTGTTGTACCAGTACACACC-3'
обратный праймер (место резки HindIII)
Полученный продукт реакции ПЦР (PCR) после переваривания рестрикционными ферментами с помощью Xhol/HindIII клонируют в вырезанный XhoI/HindIII вектор экспресси в дрожжах pESC-Leu (фирмы Stratagene), где FАD2-ДНК находится под контролем GAL1-промотора.
Экспрессия CalDes в S.cerevisiae INCSv1 происходит по модификации метода, указанного в Avery и др. (Appl. Environ. Microbiol., 62, 1996: 3960-3966) и Girke и др. (The Plant Journal, 5, 1998: 39-48). Для получения исходной культуры 10 мл YPAD-среды заражают отдельной колонией и инкубируют 48 часов при 30°С при 200 об/мин. Клеточную культуру промывают потом в 1×YPA-среде без сахара и центрифугируют. Гранулированные клетки ресуспендируют в 2 мл минимальной среды без добавок и без сахара. С помощью 1 мл этой клеточной суспензии заражают 100 мл минимальной среды (dropout порошок, 2% раффинозы, 1% тергитола NP40) в 500 мл в колбе Эрленмайера и культуру культивируют при 30°С и 200 rpm. При оптической плотности, равной 0,5 при 600 нм добавляют 2% (вес./об) галактозы и (для первой стадии) 0,003% линолевой кислоты (3%-ый маточный раствор в 5% тергитола NP40). Клетки культивируют далее до достижения стационарной фазы. Потом их промывают в минимальной среде без добавок и хранят при -20°С.
Пример 5: Экстракция липидов и анализ высокопроизводительной жидкостной хромотографией кислот жирного ряда из трансгенных дрожжей.
Дрожжевые клетки суспендируют в 30 мл HIP-раствора (0,1 мМ 2,6-ди-трет-бутил-4-метилфенола в смеси гексан/изопропанол (3:2 об/об)), подкисляют с помощью 150 мкл концентрированной HCl и гомогенизируют в Ultra-Turrax (1 мин, 24000 об/мин). После этого пробы встряхивают в течение 10 минут при 4°С и при 5000 g и 4°С 10 мин центрифугируют. Надосадочную жидкость переводят в новую емкость и дополняют с помощью 0,38М K2SO4 до 47,5 мл. Пробы встряхивают в течение 10 минут при 4°С и центрифугируют (см. выше). Гексанову фазу снимают и упаривают в атмосфере азота. Остаток растворяют в 20 мкл хлороформа. Для щелочного гидролиза сложных эфиров кислоты жирного ряда добавляют 400 мкл метанола, а также 80 мкл 40%-го раствора КОН и пробу инкубируют в течение 20 минут при 60°С под аргоном. После этого пробу охлаждают до комнатной температуры, подкисляют с помощью 35 мкл концентрированной HCl до значения рН 3,0 и отделяют с помощью высокопроизводительной жидкостной хромотографии.
Отделение свободных кислот жирного ряда осуществляют с помощью ЕТ 250/4 нуклеозил 120-5 С18-колонны (Macherey & Nagel). В качестве элюента служит смесь метанол/Н2О/ледяная уксусная кислота (85:15:0,1 об/об/об). Разделение осуществляют при скорости течения 1 мл/мин при 25°С, для определения сопряженных тройных связей измеряют адсорбцию при 268 нм.
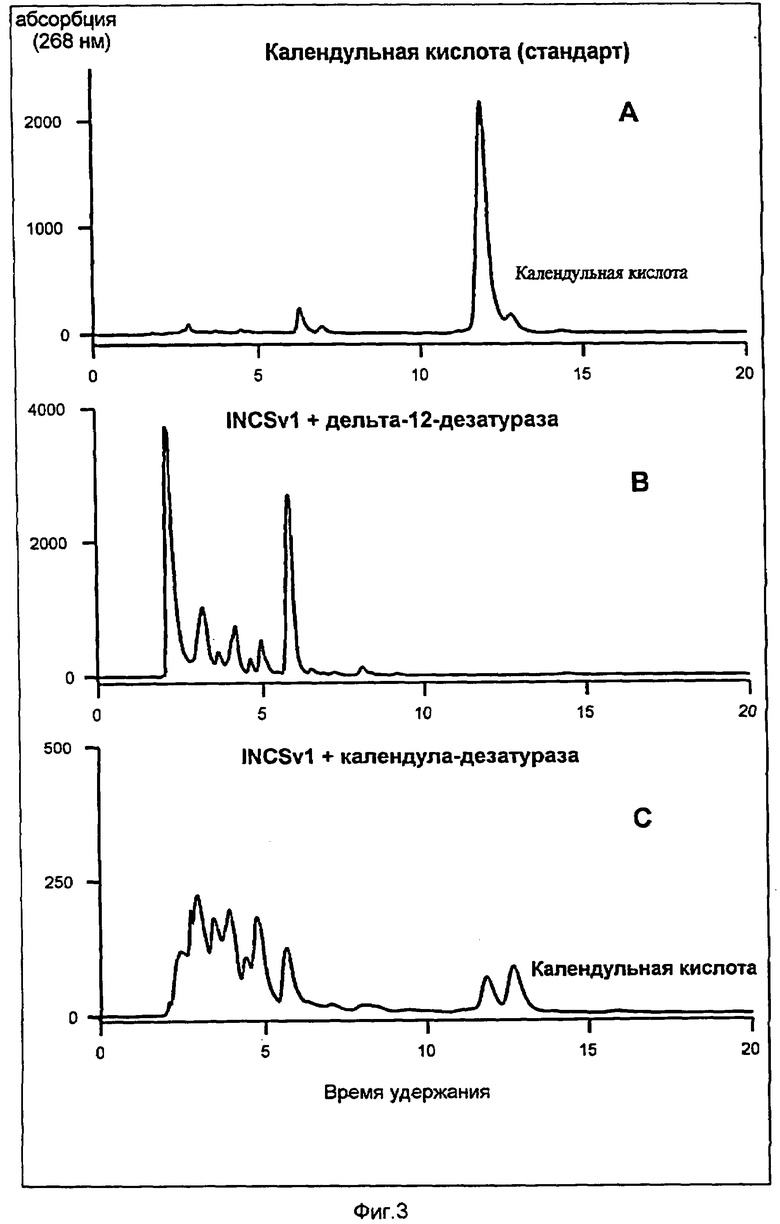
Фиг.3 показывает элюационную кривую липидных экстрактов после щелочного гидролиза из трансформированных дрожжевых клеток (фиг.3В показывает элюационную кривую S. cerevisiae INCSv1, трансформированного с помощью FAD2-ДНК из A.thaliana и С, элюационную кривую S.cerevisiae INCSv1, трасформированного с помощью pYES2-CalDes из Calendula officinalis), соответственно элюационную кривую стандарта календульной кислоты (фиг.3А). Календульная кислота имеет время удерживания в 12 мин с сильной абсорбцией при 268 нм, типичной для сопряженных тройных связей. Гидролизованные липидные экстракты дрожжевых клеток, которые трансформировали пустым вектором pYES2 и культивировали 0,003% линолевой кислоты, не имеют кислот жирного ряда со временем удерживания календульной кислоты (не показано). Гидролизированные липидные экстракты дрожжевых клеток, экспримирующие ген FAD2, не содержат календульной кислоты (фиг.3В).
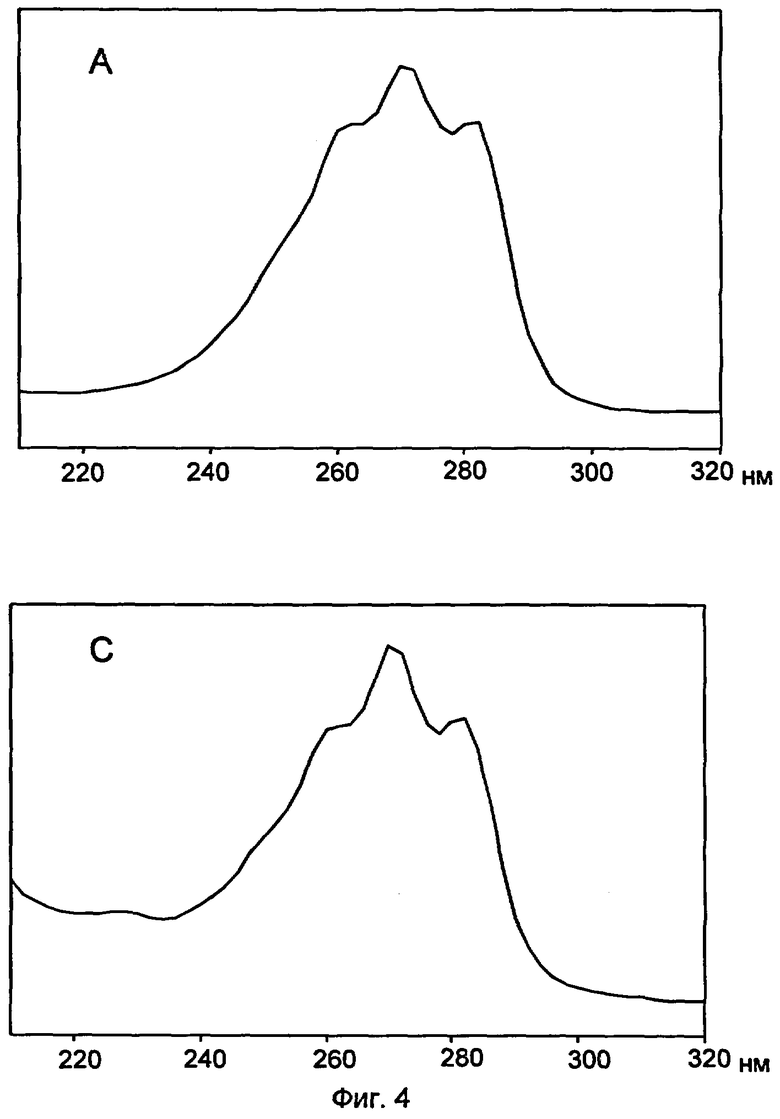
Анализ высокопроизводительной жидкостной хромотографией экстрактов трансформированных с помощью pYES2-CalDes дрожжевых клеток, которые были культивированы посредством 0,003%-ой линолевой кислоты, показывают в противоположность этому сигнал со временем удерживания календульной кислоты (фиг.3С), такой же спектр абсорбции с максимумом при 268 нм и побочными максимумами 258 и 282 нм, что и стандарт (фиг.4А, стандарт и С, элюационная кривая S.cerevisiae INCSv1 трасформированного с помощью pYES2-CalDes из Calendula officinalis). Таким образом было показано, что экспрессия десатуразы календульной кислоты в дрожжах приводит к биосинтезу календульной кислоты. Это доказательство календульной кислоты из трансформированных дрожжевых клеток удалось только после гидролиза липидов. В свободных кислотах жирного ряда этих клеток не было возможно определить календульной кислоты, что означает, что в дрожжах календульная кислота встраивается в липиды. В связи с тем, что дрожжи не содержат триацилглицериды, следует исходить из того, что определенная календульная кислота была связана с фосфолипидами дрожжей.
Кроме того, липидные экстракты трансгенных дрожжевых клеток, которые экспримируют одновременно FAD2 и CalDes, содержат также календульную кислоту (не показано).
Пример 6: Экспрессия десатуразы календульной кислоты в Arabidopsis thaliana и Linum usitatissimum
Экспрессия десатуразы календульной кислоты из Calendula officinalis в трансгенных растениях имеет то преимущество, что она повышает содержание календульной кислоты в этих растениях. Для этого клонируют CalDes-кДНК в бинарные векторы и посредством Т-ДНК Agrobacterium переносят в A. thaliana и L. usitatissimum. Экспрессия CalDes-кДНК находится при этом под контролем конститутивного CaMV 35 S-промотора, соответственно, специфичного семенам USP-промотора.
В качестве векторов экспрессии применяют вектор pBinAR (Höfgen и Willmitzer, Plant Science, 66, 1990: 221-230), соответственно pBinAR - производное pBinAR-USP, при котором CaMV 35 S-промотор заменен на USP-промотор из V.faba. Z. Для переклонирования необходимо вырезать CalDes-кДНК из вектора pGEM-T. Для этого сначала разрезают с помощью Ncol и дополняют методом Кленова до гладких концов, после чего вырезают инсерт с помощью Sall и клонируют в вырезанные Smal/Sall векторы pBinAR, соответственно, pBinAR-USP.
Полученные плазмиды pBinAR-CalDes, соответственно, pBinAR-USP-CalDes трансформируют в Agrobacterium tumefaciens (см. Höfgen и Willmitzer, Nucl. Acids Res., 16, 1988: 9877). Трансформацию от A. thaliana осуществляют с помощью "floral dip" (см. Clough и Bent, Plant Journal, 16, 1998: 735-743), трансформированные от L. usitatissimum посредством сокультивации кусочков льна с трансформированными клетками A.tumefaciens.
Экспрессию гена, кодирующего десатуразу календульной кислоты CalDes в трансгенных Arabidopsis и растениях Linum исследуют анализом Northern-Blot. Выбранные растения исследовали на содержание календульной кислоты в масле их семян.
Аналогично USP-промотору может также применяться напин-промотор, чтобы достигать специфичную семенам экспрессию гена CalDes.





Изобретение относится к генной инженерии и может быть использовано в производстве насыщенных или ненасыщенных жирных кислот или триглицеридов с повышенным содержанием таких кислот. Функциональную или нефункциональную последовательность нуклеиновой кислоты, кодирующую полипептид с активностью десатуразы, вводят в геном кодирующего масло растения или микроорганизма. После культивирования трансформированного организма в подходящих условиях из него выделяют масло или триглицерид. Увеличенное или уменьшенное продуцирование в организме полипептида с активностью соответствующей десутуразы приводит, например, к изменению количества в нем жирной кислоты с новым содержанием в ней календульной кислоты. 4 н. и 4 з.п. ф-лы, 4 ил.
a) последовательность нуклеиновой кислоты с представленной в SEQ ID NO:1 последовательностью,
b) последовательность нуклеиновой кислоты, получаемая из SEQ ID NO:1 за счет вырожденности генетического кода,
c) производная представленной в SEQ ID NO:1 нуклеотидной последовательности, кодирующая полипептид с аминокислотной последовательностью SEQ ID NO:2 или с последовательностью, имеющей, по меньшей мере, 75% гомологию с последовательностью SEQ ID NO:2 по всей ее длине, без существенного снижения ферментативного действия полипептида.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Экономайзер | 0 |
|
SU94A1 |
| US 5850026 A, 15.12.1998 | |||
| RU 94040177 A, 27.09.1996. | |||
Авторы
Даты
2006-04-20—Публикация
2000-08-23—Подача