К лечению опухоли можно подходить несколькими терапевтическими способами, включающими оперативное вмешательство, облучение, химиотерапию, либо любое сочетание указанных вариантов лечения. Из них химиотерапия является обязательной для неоперабельных или метастатических форм раковой опухоли. Учитывая многообразие опухолей, а именно, типа клеток, морфологию, скорость роста и других клеточных характеристик National Cancer Institute (NCI) США разработал «направленный на заболевание» подход к проведению скрининга на противоопухолевую активность. Boyd, M.R. (1989) In Principle of Practice of Oncology Devita, J.T., Hellman, S. и Rosenberg, S.A. (Eds.) Vol.3, PPO Update, №10. Эта система скрининга in vitro основана на панелях клеточных линий опухолей человека, включающих приблизительно 60 клеточных линий основных опухолей человека (например, лейкемии, карциномы легкого, карциномы ободочной или толстой кишки, карциномы ЦНС, меланомы, овариальной карциномы, карциномы почек, карциномы предстательной железы или карциномы молочной железы), и служит инструментом для идентификации соединений, обладающих противоопухолевой активностью.
Особенный интерес представляют противоопухолевые соединения, действующие по одному или более из четырех механизмов: (1) подавление G2/M развития клеточного цикла, которое может в конечном счете вызывать апоптоз клеток опухолей (Yeung et al. (1999) Biochem. Biophys. Res. Com. 263:398-404); (2) нарушение соотношения агрегация/дисагрегация тубулина, которое может ингибировать клеточный митоз и вызывать апоптоз клеток (Panda et al. (1997) Proc. Natl. Acad. Sci. USA 94:10560-10564); (3) ингибирование пролиферации эндотелиальных клеток и эффекта ангиогенеза (Witte et. al. (1998) Cancer Metastasis Rev. 17: 155-161; Prewett et. al. (1999) Cancer Res. 59: 5209-5218) или (4) регуляция Ras протеин-зависимых проводящих путей трансдукции сигнала (Hernandez-Alcoceba et al. (2000) Cell Mol. Life Sci. 57: 65-76; Buolamwini (1999) Cur. Opin. Che. Biol 3: 500-509).
Данное изобретение основано на открытии того, что соединения пиперазиндиона обладают противоопухолевой активностью, идентифицированной по системе NCI скрининга, и действуют посредством одного или более вышеуказанных механизмов.
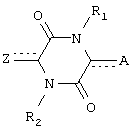
Один из аспектов данного изобретения составляют соединения пиперазиндиона формулы:
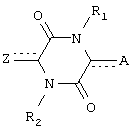
Каждый из 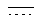 и
и 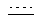 независимо означает простую связь или двойную связь; A означает H или CH(RaRb), когда
независимо означает простую связь или двойную связь; A означает H или CH(RaRb), когда  означает простую связь, или C(RaRb), когда
означает простую связь, или C(RaRb), когда  означает двойную связь. Z означает R3O-(Ar)-B, где B означает CH(Rс), когда
означает двойную связь. Z означает R3O-(Ar)-B, где B означает CH(Rс), когда  означает простую связь, или C(Rс), когда
означает простую связь, или C(Rс), когда  означает двойную связь; Ar означает гетероарил; R3 означает H, алкил, арил, гетероарил, C(O)Rd, C(O)ORd, C(O)NRdRe или SO2Rd; и оба, B и R3O могут быть замещены по любой подходящей позиции на Ar. Каждый из R1 и R2 независимо означает H, C(O)Rd, C(O)ORd, C(O)NRdRe или SO2Rd; и каждый из Ra, Rb, Rc, Rd и Re, независимо, означает H, алкил, арил, гетероарил, циклильную или гетероциклильную группу. Необязательно, Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; и, также необязательно, R1 и Ra или R1 и Rb, взятые вместе, образуют циклильную или гетероциклильную группу.
означает двойную связь; Ar означает гетероарил; R3 означает H, алкил, арил, гетероарил, C(O)Rd, C(O)ORd, C(O)NRdRe или SO2Rd; и оба, B и R3O могут быть замещены по любой подходящей позиции на Ar. Каждый из R1 и R2 независимо означает H, C(O)Rd, C(O)ORd, C(O)NRdRe или SO2Rd; и каждый из Ra, Rb, Rc, Rd и Re, независимо, означает H, алкил, арил, гетероарил, циклильную или гетероциклильную группу. Необязательно, Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; и, также необязательно, R1 и Ra или R1 и Rb, взятые вместе, образуют циклильную или гетероциклильную группу.
Относительно вышеуказанной формулы, особую подгруппу соединений пиперазиндиона по данному изобретению составляют соединения, где обе связи,  и
и  , означают двойные связи. В таких соединениях, Ar означает пиридил, присоединенный к B в положение 2, Rс означает H, R3O означает арилалкокси, присоединенный в положение 5 пиридила, оба R1 и R2 означают H, один из Ra и Rb означает арил или гетероарил, а другой из Ra и Rb означает H. Другая подгруппа соединений пиперазиндиона по данному изобретению отличается тем, что обе связи
, означают двойные связи. В таких соединениях, Ar означает пиридил, присоединенный к B в положение 2, Rс означает H, R3O означает арилалкокси, присоединенный в положение 5 пиридила, оба R1 и R2 означают H, один из Ra и Rb означает арил или гетероарил, а другой из Ra и Rb означает H. Другая подгруппа соединений пиперазиндиона по данному изобретению отличается тем, что обе связи  и
и  означают простые связи. В таких соединениях Ar означает пиридил, присоединенный к B в положение 2, Rс означает H, R3O означает арилалкокси, присоединенный в положение 5 пиридила, оба, R1 и R2, означают H, один из Ra и Rb означает водород, арил или гетероарил, а другой из Ra и Rb означает H.
означают простые связи. В таких соединениях Ar означает пиридил, присоединенный к B в положение 2, Rс означает H, R3O означает арилалкокси, присоединенный в положение 5 пиридила, оба, R1 и R2, означают H, один из Ra и Rb означает водород, арил или гетероарил, а другой из Ra и Rb означает H.
Приведенные в данном описании алкил, арил, гетероарил, циклильная или гетероциклильная группа включают как замещенные, так и незамещенные группы. Термин «замещенный» означает один или более заместителей (которые могут быть одинаковыми или различными), каждый из которых замещает атом водорода. Примеры заместителей включают, но не ограничиваются ими, галоген, гидроксил, амино, алкиламино, ариламино, диалкиламино, диариламино, циано, нитро, меркапто, карбонил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфоамидо, C1˜C6-алкил, C1˜C6-алкенил, C1˜C6-алкокси, арил, гетероарил, циклильную или гетероциклильную группу, где алкил, алкенил, алкокси, арил, гетероарил(,) циклильная или гетероциклильная группа необязательно замещены C1˜C6-алкилом, арилом, гетероарилом, галогеном, гидроксилом, амино, меркапто, циано или нитро. Термин «арил» означает углеводородную циклическую систему, имеющую, по меньшей мере, одно ароматическое кольцо. Примеры арильных групп включают, но не ограничиваясь ими, фенил, нафтил и пиренил. Термин «гетероарил» означает углеводородную кольцевую систему, имеющую, по меньшей мере, одно ароматическое кольцо, содержащее, по меньшей мере, один гетероатом, такой как O, N или S. Примеры гетероарильных групп включают, но не ограничиваясь ими, фурил, флуоренил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридинил, пиримидинил, хиназолинил и индолил.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и эффективное количество, по меньшей мере, одного из вышеуказанных соединений пиперазиндиона.
Кроме того, настоящее изобретение относится к способу лечения опухоли (например, лейкемии, карциномы легкого, карциномы ободочной или толстой кишки, карциномы ЦНС, меланомы, овариальной карциномы, карциномы почек, карциномы предстательной железы или карциномы молочной железы). Способ включает введение нуждающемуся в этом пациенту эффективного количества соединения пиперазиндиона, имеющего формулу:

Каждый из  и
и  независимо означает простую связь или двойную связь; A означает H или CH(RaRb), когда
независимо означает простую связь или двойную связь; A означает H или CH(RaRb), когда  означает простую связь, или C(RaRb), когда
означает простую связь, или C(RaRb), когда  означает двойную связь. Z означает CH(RcRd), когда
означает двойную связь. Z означает CH(RcRd), когда  означает простую связь, или C(RсRd), когда
означает простую связь, или C(RсRd), когда  означает двойную связь; каждый из R1 и R2 независимо означает H, C(O)Rе, C(O)ORе, C(O)NRеRf или SO2Rе; и каждый из Ra, Rb, Rc, Rd, Re и Rf независимо, означает H, алкил, арил, гетероарил, циклильную или гетероциклильную группу, при условии, что один из Rc и Rd означает арил или гетероарил. Если
означает двойную связь; каждый из R1 и R2 независимо означает H, C(O)Rе, C(O)ORе, C(O)NRеRf или SO2Rе; и каждый из Ra, Rb, Rc, Rd, Re и Rf независимо, означает H, алкил, арил, гетероарил, циклильную или гетероциклильную группу, при условии, что один из Rc и Rd означает арил или гетероарил. Если  означает двойную связь,
означает двойную связь,  означает простую связь и один из Rc и Rd означает H, то другой из Rc и Rd означает гетероарил. Необязательно, Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; и, также необязательно, R1 и Ra или R1 и Rb, взятые вместе, образуют циклильную или гетероциклильную группу.
означает простую связь и один из Rc и Rd означает H, то другой из Rc и Rd означает гетероарил. Необязательно, Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; и, также необязательно, R1 и Ra или R1 и Rb, взятые вместе, образуют циклильную или гетероциклильную группу.
Относительно вышеуказанной формулы, особую подгруппу только что указанных соединений пиперазиндиона по данному изобретению составляют соединения, где обе связи,  и
и  , означают двойные связи. В таких соединениях один из Rс и Rd означает 2-пиридил, другой из Rc и Rd означает H, оба, R1 и R2, означают H, один из Ra и Rb означает арил или гетероарил, а другой из Ra и Rb означает H. 2-Пиридил может быть дополнительно замещен 5-арилалкокси. Другая подгруппа соединений пиперазиндиона отличается тем, что обе связи
, означают двойные связи. В таких соединениях один из Rс и Rd означает 2-пиридил, другой из Rc и Rd означает H, оба, R1 и R2, означают H, один из Ra и Rb означает арил или гетероарил, а другой из Ra и Rb означает H. 2-Пиридил может быть дополнительно замещен 5-арилалкокси. Другая подгруппа соединений пиперазиндиона отличается тем, что обе связи  и
и  означают простые связи. В таких соединениях один из Rс и Rd означает 2-пиридил, другой из Rс и Rd означает H, оба R1 и R2 означают H, один из Ra и Rb означает H, арил, или гетероарил, и другой из Ra и Rb означает H.
означают простые связи. В таких соединениях один из Rс и Rd означает 2-пиридил, другой из Rс и Rd означает H, оба R1 и R2 означают H, один из Ra и Rb означает H, арил, или гетероарил, и другой из Ra и Rb означает H.
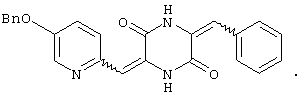
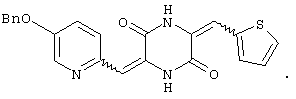
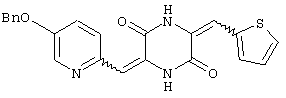
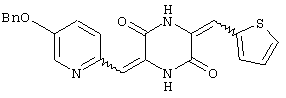
Семь типичных примеров соединений пиперазиндиона представляют 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-фенил-метилиденпиперазин-2,5-дион,
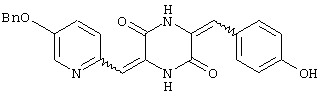
3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-гидроксифенилметилиденпиперазин-2,5-дион,
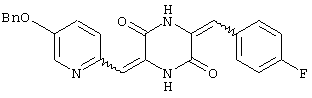
3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-фторфенилметилиденпиперазин-2,5-дион,
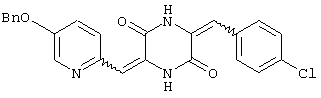
3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-хлорфенилметилиденпиперазин-2,5-дион,
3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-фенилметоксифенилметилиденпиперазин-2,5-дион,
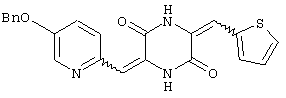
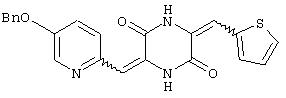
3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(тиен-2-ил)метилиден)пиперазин-2,5-дион и
3,6-ди[(5-фенилметоксипиридин-2-ил)метил]пиперазин-2,5-дион.
Структуры указанных соединений представлены ниже:
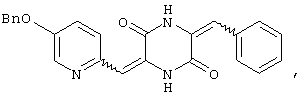
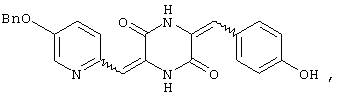
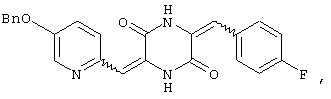
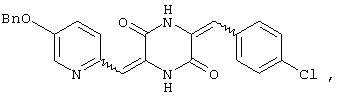
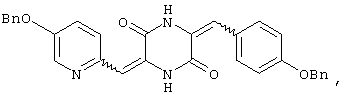
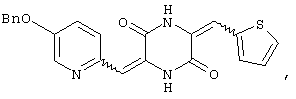
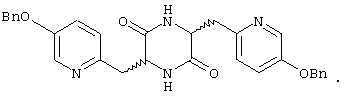
Вышеуказанные соединения пиперазиндиона включают сами соединения, а также их соли и пролекарства, по потребности. Такие соли, например, могут быть образованы положительно заряженным заместителем (например, амино) на соединении пиперазиндиона и анионом. Подходящие анионы включают, но не ограничиваются ими, хлорид, бромид, иодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат. Подобным образом, отрицательно заряженный заместитель (например, карбоксилат) на соединении пиперазиндиона может образовывать соль с катионом. Подходящие катионы включают, но не ограничиваясь ими, ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Примеры пролекарств включают сложные эфиры и другие фармацевтически приемлемые производные, которые, при введении пациенту, способны давать вышеуказанные соединения пиперазиндиона.
Также в объем настоящего изобретения и приложенных пунктов формулы изобретения включена композиция, содержащая одно или более вышеуказанных соединений пиперазиндиона, и применение такой композиции для промышленного получения лекарственного средства вышеуказанного назначения.
Другие особенности и преимущества настоящего изобретения будут очевидными из последующего подробного описания некоторых вариантов воплощения, а также из приложенных пунктов формулы изобретения.
Подробное описание изобретения
Вышеуказанные соединения пиперазиндиона могут быть получены способами, хорошо известными из уровня техники, а также описанными здесь способами синтеза. Например, можно осуществить взаимодействие соединения пиперазин-2,5-диона с гетероарилформальдегидом с получением промежуточного гетероарилметилиденпиперазин-2,5-диона. Промежуточное соединение может быть затем восстановлено до гетероарилметилпиперазин-2,5-диона (соединения по изобретению) или подвергнуто взаимодействию с кетоном или другим формальдегидом с последующей обработкой основанием, что дает смесь изомеров пиперазиндиона, которые представляют собой цис- или транс-, или E- или Z-изомерные формы относительно двойной связи. Требуемый изомерный продукт может быть отделен от других с помощью высокоэффективной жидкостной хроматографии (HPLC-ВЭЖХ). По желанию, подходящие функциональные группы могут быть введены в гетероарильное кольцо путем дополнительных модификаций. Альтернативно, требуемый восстановленный продукт может быть получен взаимодействием продукта с восстанавливающим агентом.
На приведенной ниже схеме показан синтез семнадцати соединений пиперазиндиона.
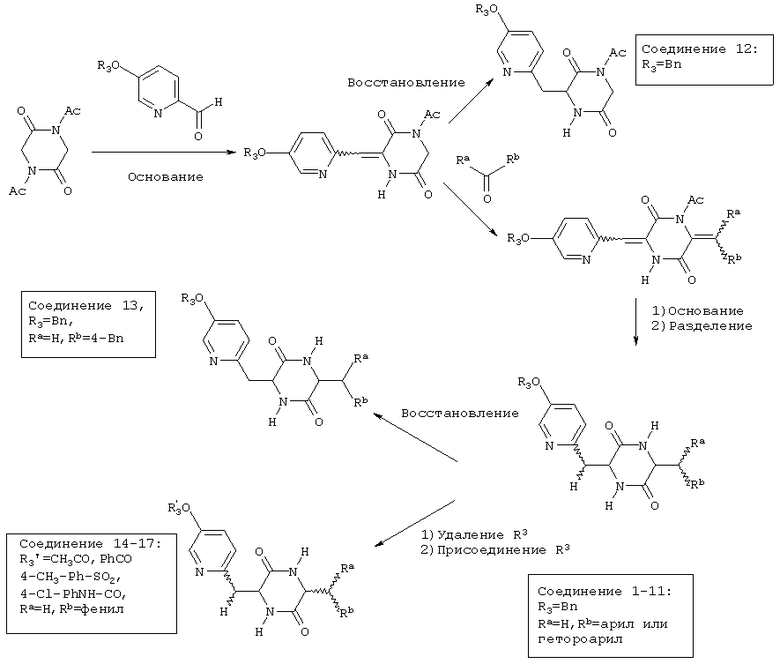
Подробности синтезов соединений 1-17 описаны в примерах 1-17, соответственно. Для получения других соединений пиперазиндиона, пиридинил (показан на приведенной выше схеме) может быть замещен на арил или другой гетероарил (например, фурил, пирролил, имидазолил, пиримидинил или индолил) и одна из двух ацетильных групп (Ac) на кольце пиперазиндиона (также показано на приведенной выше схеме) может быть заменена на другой заместитель (например, карбонил, карбамидо, карбамил или карбоксил).
Следует отметить, что соединения пиперазиндиона содержат, по меньшей мере, две двойные связи и могут дополнительно иметь один или более асимметричных центров. Следовательно, указанные соединения могут существовать как рацематы и рацемические смеси, отдельные энантиомеры, индивидуальные диастереомеры, диастереомерные смеси и цис- или транс-, или E- или Z-изомерные формы относительно двойной связи. Все указанные изомерные формы рассматриваются.
Также в объем настоящего изобретения и приложенных пунктов формулы изобретения входит фармацевтическая композиция, содержащая эффективное количество, по меньшей мере, одного из соединений пиперазиндиона по настоящему изобретению и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение охватывает способ введения эффективного количества одного или более соединений пиперазиндиона, указанных в разделе «краткое описание», нуждающемуся в лечении опухоли пациенту. Соединения пиперазиндиона могут работать по одному или более вышеуказанным механизмам действия, либо по любому другому механизму. «Эффективное количество» означает количество соединения, которое требуется для оказания терапевтического действия на проходящего лечение пациента. Соотношение доз для животных и людей (рассчитанных в миллиграммах на квадратный метр поверхности тела) описаны в Freireich et al. (1966) Cancer Chemother Rep 50:219. Площадь поверхности тела приблизительно может быть определена по росту и массе пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardley, N.Y., 1970, 537. Эффективное количество соединений пиперазиндиона может меняться приблизительно в пределах от 0,1 мг/кг до 50 мг/кг. Как известно специалистам в данной области, эффективные дозы также будут изменяться в зависимости от типов излечиваемых опухолей, способа введения, используемого наполнителя и возможности применения совместно с другими терапевтическими подходами, такими как использование других противоопухолевых средств или радиационной терапии.
При осуществлении способа по настоящему изобретению содержащая соединения пиперазиндиона композиция может быть введена орально, парентерально, с помощью спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или посредством имплантированного резервуара. Термин «парентеральный», как использован здесь, включает подкожный, внутрикожный, внутривенный, внутримышечный, интраартикулярный, внутриартериальный, внутрисуставный, внутригрудинный, внутриоболочечный, интралезиональный и интракраниальный способы инъекции или вливания.
Стерильная композиция для инъекции, например, стерильная водная или масляная суспензия для инъекции, может быть формулирована согласно приемам, известным из уровня техники, с применением подходящих диспергирующих или смачивающих средств (таких как, например, Tween 80) и суспендирующих средств. Стерильный препарат для инъекции может также быть стерильным раствором для инъекции или суспензией в нетоксичном для парентерального введения приемлемом разбавителе или растворителе, как раствор в 1,3-бутандиоле. К числу приемлемых носителей и растворителей, которые могут быть использованы, относятся маннит, вода, раствор Ringer'а и изотонический раствор хлорида натрия. В дополнение, в качестве растворителя или суспендирующей среды обычно используют стерильные, нелетучие масла (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота, и их глицеридные производные полезны для получения инъекций, а также натуральные фармацевтически приемлемые масла, такие как оливковое масло, в особенности в полиоксиэтилированных вариантах. Такие масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергатор, или карбоксиметилцеллюлозу, или подобные диспергирующие средства. В целях формулирования могут также быть использованы другие обычно применяемые ПАВ, такие как Tweens или Spans, или иные подобные эмульгаторы или биологически доступные усиливающие средства, которые обычно используются при промышленном получении фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Композиция для перорального введения может быть в любой приемлемой для перорального введения форме, включающей, но не ограничиваясь ими, капсулы, таблетки, эмульсии и водные суспензии, дисперсии или растворы. В случае таблеток для перорального применения обычно используемые носители включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как стеарат магния, также обычно добавляют. Для орального введения в форме капсул используемые разбавители включают лактозу и сухой кукурузный крахмал. Когда водные суспензии или эмульсии вводят перорально, активные ингредиенты могут быть суспендированы или растворены в масляной фазе, объединенной с эмульгирующим или суспендирующим средством. По желанию, могут быть добавлены некоторые подсластители, корригенты или красители. Назальный аэрозоль или композиция для ингаляции могут быть получены по хорошо известным из области фармацевтического формулирования методикам и могут быть приготовлены в виде растворов в солевом растворе с применением бензилового спирта или других подходящих консервантов, промоторов абсорбции для усиления биологической доступности, фторуглеродов и/или других растворяющих или диспергирующих средств, известных из уровня техники. Содержащая соединения пиперазиндиона композиция может также быть введена в форме суппозиториев для ректального введения.
Носитель в фармацевтической композиции должен быть «приемлемым» в том смысле, что он должен быть совместим с активным ингредиентом состава (и предпочтительно, способным стабилизировать его) и не вредным для проходящего лечение пациента. Например, растворяющие агенты, такие как циклодекстрины, образующие специфические, более растворимые комплексы с соединениями пиперазиндиона, или один или более растворяющих агентов, могут быть использованы в качестве фармацевтических наполнителей для доставки соединений пиперазиндиона. Примеры других носителей включают коллоидную двуокись кремния, стеарат магния, целлюлозу, натрийлаурилсульфат и D&C Yellow # 10.
Соединения пиперазиндиона могут быть предварительно проверены на эффективность при лечении раковой опухоли с помощью одного или более приведенных ниже тестов in vitro.
Один из тестов основан на NCI системе скрининга, состоящей приблизительно из 60 клеточных линий основных опухолей человека. См., Monks, et al. (1991) JNCI, J. Natl Cancer Inst. 83: 757-766; Alley, et al. (1988) Cancer Res. 48: 589-601; Shoemaker, et al. (1988) Prog. Clin. Biol. Res. 276:265-286 и Stinson, et al. (1989) Proc. Am. Assoc. Cancer Res. 30: 613. Вкратце, клеточную суспензию, разбавленную в соответствии с конкретным типом клеток и проверенную на плотность клеток-мишеней (5000-40000 клеток на лунку, по характеристикам роста клеток) добавляют (100 мкл) в 96-луночный планшет для микротитрования. Проводят предварительную инкубацию при 37°C в течение 24 час.
В начальный момент времени к каждую лунку планшета для микротитрования добавляют разбавители до концентрации, превышающей вдвое предполагаемую испытуемую концентрацию, в 100 мкл аликвотах. Обычно испытуемое соединение оценивают при пяти 10-кратных разведениях. В стандартном испытании наибольшая концентрация испытуемого соединения составляет 10-4 M. Инкубацию проводят в течение 48 час в атмосфере 5% CO2 при 100% влажности. Клетки оценивают, используя пробу на сульфородамин B, описанную Rubinstein, et al. (1990, JNCI, J. Natl. Cancer Inst. 82: 1113-1118) и Skehan, et al. (1990, JNCI, J. Natl Cancer Inst. 82: 1107-1112). Для установления оптических плотностей используют считывающее устройство для планшетов и с помощью микрокомпьютера преобразуют оптические плотности в специальные концентрационные параметры. NCI заменил название величины IC50, концентрации, вызывающей 50% торможение роста, на величину GI50, чтобы подчеркнуть поправку на клетки, подсчитанные к нулевому моменту времени; таким образом, GI50 измеряет способность по подавлению роста клеток для испытуемого соединения. См., Boyd, et al. (1992) In Cytotoxic Anticancer Drugs: Models and Concepts for Drug Discovery and Development; Vleriote, FA.; Corbett, T.H.; Baker, L.H. (Eds.); Kluwer Academic: Hingham, MA, pp. 11-34.
В другом тесте соединение пиперазиндиона исследуют на его цитотоксичность по отношению к PC-3 клеткам (клеточная линия карциномы предстательной железы). В частности, клетки инкубируют с испытуемым соединением в бессывороточной питательной среде в течение 24 час. Цитотоксический эффект может быть определен анализом пробы на 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (MTT), описанным в Boyd (In Principle of Practice of Oncology Devita, J.T., Hellman, S., and Rosenberg, S.A. (Eds.) Vol.3, PPO Update, №10, 1989).
Другой анализ in vitro может быть использован для оценки эффективности соединения пиперазиндиона в остановке развития клеточного цикла. В частности, испытуемое соединение пиперазиндиона добавляют к PC-3 клеткам концентрационно-зависимым способом, используя цитометрическое определение с окрашиванием пропидийиодидом. Затем определяют клеточную популяцию суб-G0/G1, G0/G1, S и G2/M фазы. В дополнение, действие соединения пиперазиндиона на Ras активность может быть оценено определением его регуляции Ras протеин-зависимых проводящих путей трансдукции сигнала.
Противоопухолевая активность соединений пиперазиндиона может дополнительно быть оценена с помощью модели на животных. В качестве модели используют SCID мышей, PC-3 клетки впрыскивают мышам подкожно для развития опухоли предстательной железы. Противоопухолевую активность соединений пиперазиндиона определяют после обработки. В дополнение, противоопухолевая активность соединений пиперазиндиона может быть оценена испытанием на анти-ангиогенезную активность in vivo. Например, голые мыши могут быть использованы для определения влияния соединения пиперазиндиона на bFGF-индуцированный ангиогенез. Матриксный гель с bFGF или васкулярный эндотелиальный фактор роста (VEGF) подкожно впрыскивают мыши при одновременном внутривенном введении соединения пиперазиндиона. После нескольких дней инкубации, матриксный гель обрезают для оценки ангиогенеза.
Таким образом, приведенное выше описание адекватно раскрывает данное изобретение. Поэтому приведенные ниже специфические варианты выполнения имеют исключительно иллюстративный характер, и никоим образом не ограничивают право собственности на изобретение. Все указанные публикации полностью включены в данное описание в качестве ссылок.
Пример 1: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-фенилметилиденпиперазин-2,5-диона (соединение 1).
1,4-Диацетилпиперазин-2,5-дион (8,6 г) добавляют к раствору 5-бензиоксипиридин-2-ил-формальдегида (4,0 г) в 5,6 мл триэтиламина и 40 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 16 час и затем охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 5,4 г (77%) 1-ацетил-3-[(5-бензиоксипиридин-2-ил)метилиден] пиперазин-2,5-диона (Соединение A), т.пл.: 189-191°C.
1Н-ЯМР (400 МГц, ДМСО): δ 2,52 (с, 3H), δ 4,54 (с, 3H), δ 4,33 (с, 2H), δ 5,25 (с, 2H), δ 6,85 (с, 1H), δ 7,384˜δ ,488 (м, 5H, ароматический), δ 7,499 (д, J=8,8, 1H), δ 7,689 (д, J=8,8, 1H), δ8,533 (с, 1H) и δ 12,147 (с, 1H).
Соединение A (3,51 г) добавляют к 40 мл диметилформамидного раствора, содержащего эквимолярное количество бензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 60°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,3 г (83%) требуемого продукта, 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-фенилметилиденпиперазин-2,5-диона (соединение 1), в виде смеси изомеров. Смесь преимущественно состоит из ZZ и EZ изомеров.
Т.пл.: 223-225°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,243 (с, 2H), δ 6,695 (с, 1H), δ 6,812 (с, 1H), δ 7,346˜δ 7,634 (м, 12H, ароматический), δ 8,528 (с, 1H), δ 10,245 (с, 1H) и δ 12,289 (с, 1H).
Пример 2: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-гидроксифенилметилиденпиперазин-2,5-диона (соединение 2).
Соединение A (3,51 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,5 г 4-гидроксибензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,3 г (83%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-гидроксифенилметилиденпиперазин-2,5-диона (соединение 2).
Т.пл.: 260-263°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,244 (с, 2H), δ 6,669 (с, 1H), δ 6,753 (с, 1H), δ 6,798 (с, 1H, ароматический), δ 6,819 (с, 1H, ароматический), δ 7,347˜δ 7,647 (м, 9H, ароматический), δ 9,821 (с, 1H), δ 10,064 (с, 1H) и δ 12,216 (с, 1H).
Пример 3: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-метоксифенилметилиденпиперазин-2,5-диона (соединение 3).
Соединение A (3,51 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,4 г 4-метоксибензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,3 г (83%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-метоксифенилметилиденпиперазин-2,5-диона (соединение 3).
Т.пл.: 238-240°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,244 (с, 2H), δ 6,669 (с, 1H), δ 6,753 (с, 1H), δ 6,798 (с, 1H, ароматический), δ 6,819 (с, 1H, ароматический), δ 7,347˜δ 7,647 (м, 9H, ароматический), δ 9,821 (с, 1H), δ 10,064 (с, 1H) и δ 12,216 (с, 1H).
Пример 4: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-фторфенилметилиденпиперазин-2,5-диона (соединение 4).
Соединение A (3,51 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,3 г 4-фторбензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,12 г (75%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-фторфенилметилиденпиперазин-2,5-диона (соединение 4).
Т.пл.: 242-244°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,237 (с, 2H), δ 6,688 (с, 1H), δ 6,794 (с, 1H), δ 7,209˜δ 7,624 (м, 11H, ароматический), δ 8,520 (с, 1H), δ 10,348 (с, 1H) и δ 12,279 (с, 1H).
Пример 5: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-хлорфенилметилиденпиперазин-2,5-диона (соединение 5).
Соединение A (3,51 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,3 г 4-хлорбензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,45 г (80%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-хлорфенилметилиденпиперазин-2,5-диона (соединение 5).
Т.пл.: 250-251°C.
Пример 6: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-бензиоксифенилметилиденпиперазин-2,5-диона (соединение 6).
Соединение A (3,51 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,45 г 4-бензиоксибензальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 16 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают, промывают этилацетатом и перекристаллизовывают из диметилформамида, получая 3,45 г (80%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-п-бензиоксифенилметилиденпиперазин-2,5-диона (соединение 6).
Т.пл.: 253-255°C.
1Н-ЯМР (400МГц, ДМСО): δ 5,142 (с, 2H), δ 5,235 (с, 2H), δ 6,672 (с, 1H), δ 6,777 (с, 1H), δ 7,041˜δ 7,639 (м, 16H, ароматический), δ 8,520 (с, 1H), δ 10,180 (с, 1H) и δ 12,235 (с, 1H).
Пример 7: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(фуран-2-ил)метилиден]пиперазин-2,5-диона (соединение 7).
Соединение A (2,8 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 2 мл фурфураля и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 60°C, с обратным холодильником в течение 48 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают, промывают этилацетатом и перекристаллизовывают из диметилформамида, получая 2,5 г (80%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(фуран-2-ил)метилиден]пиперазин-2,5-диона (соединение 7).
Т.пл.: 256-257°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,245 (с, 2H), δ 6,656 (д, J=1,6, 1H), δ 6,664 (д, J=1,6, 1H), δ 6,685 (с, 1H), δ 6,720 (с, 1H), δ 7,349˜δ 7,942 (м, 8H, ароматический), δ 8,527 (с, 1H), δ 9,515 (с, 1H) и δ 12,312 (с, 1H).
Пример 8: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(тиен-2-ил)метилиден]пиперазин-2,5-диона (соединение 8).
Соединение A (2,8 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 2 мл тиофен-2-карбальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 60°C, с обратным холодильником в течение 2 дней и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают, промывают этилацетатом и перекристаллизовывают из диметилформамида, получая 1,9 г (59%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(тиофен-2-ил)метилиден]пиперазин-2,5-диона (соединение 8).
Т.пл.: 215-217°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,245 (с, 2H), δ 6,716 (с, 1H), δ 6,974 (с, 1H), δ 7,186 (с, 1H), δ 7,384˜δ 7,746 (м, 9H, ароматический), δ 8,525 (с, 1H), δ 9,753 (с, 1H) и δ 12,288 (с, 1H).
Пример 9: Синтез 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(2-пиридинил)метилиден]пиперазин-2,5-диона (соединение 9).
Соединение A (2,8 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 2 мл пиридин-2-карбальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 60°C, с обратным холодильником в течение 2 дней и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают, промывают этилацетатом и перекристаллизовывают из диметилформамида, получая 2,7 г (85%) требуемого 3-[(5-бензиоксипиридин-2-ил)метилиден]-6-[(2-пиридинил)метилиден]пиперазин-2,5-диона (соединение 9).
Т.пл.: 248-250°C.
1Н-ЯМР (400 МГц, ДМСО): δ 5,246 (с, 2H), δ 6,709 (с, 1H), δ 6,788 (с, 1H), δ 7,349˜δ 7,661 (м, 8H, ароматический), δ 7,923 (д, J=8,1H, ароматический), δ 8,473 (д, J=3,6, 1H), δ 8,533 (д, J=2,8, 1H), δ 8,680 (д, J=2, 1H), δ 10,667 (с, 1H) и δ 12,324 (с, 1H).
Пример 10: Синтез 3,6-ди[(5-фенилметоксипиридин-2-ил)метилиден]пиперазин-2,5-диона (соединение 10).
Соединение A (0,31 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего эквимолярное количество 5-бензиоксипиридин-2-ил-формальдегида и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение ночи и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают, промывают этилацетатом и перекристаллизовывают из диметилформамида, получая 0,36 г (80%) требуемого 3,6-ди[(5-фенилметоксипиридин-2-ил)метилиден]пиперазин-2,5-диона (соединение 10).
Т.пл.: 283-285°C.
1Н-ЯМР (400МГц, ДМСО): δ 5,145 (с, 4H), δ 6,780 (с, 2H), δ 7,240˜δ 7,394 (м, 14H, ароматический), δ 8,381 (с, 2H), δ 10,145 (с, 1H) и δ 12,58 (с, 1H).
Пример 11: Синтез 3-[(5-фенилметоксипиридин-2-ил)метилиден]-6-(2-оксо-3-индолилиденпиперазин-2,5-диона (соединение 11).
Соединение A (2,8 г), полученное по примеру 1, добавляют к 40 мл диметилформамидного раствора, содержащего 1,5 г изатина и 4 эквивалента триэтиламина. Раствор нагревают до температуры кипения, 130°C, с обратным холодильником в течение 2 час и охлаждают на ледяной бане, получая желтый осадок. После чего осадок собирают и промывают этилацетатом, получая 3,04 г (87%) требуемого 3-[(5-фенилметоксипиридин-2-ил)метилиден]-6-(2-оксо-3-индолилиденпиперазин-2,5-диона (соединение 11).
Т.пл.: >300°C.
Пример 12: Синтез 1-ацетил-3-[(5-бензиоксипиридин-2-ил)метил]пиперазин-2,5-диона (соединение 12).
Суспензию 3,51 г 1,4-диацетилпиперазин-2,5-диона и избыток цинка-порошка в смеси 100 мл уксусной кислоты и 10 мл воды перемешивают, нагревают до температуры кипения с обратным холодильником в течение 5-10 минут и охлаждают. Смесь фильтруют. Полученное таким образом твердое вещество собирают и промывают водой, получая 2,0 г требуемого 1-ацетил-3-[(5-бензиоксипиридин-2-ил)метил]пиперазин-2,5-диона (соединение 12).
Т.пл.: 215-216°C.
Пример 13: Синтез 3,6-ди[(5-бензиоксипиридин-2-ил)метил]пиперазин-2,5-диона (соединение 13).
Суспензию 3,6-ди[(5-бензиоксипиридин-2-ил)метилиден] пиперазин-2,5-диона (0,2 г) и избыток цинка-порошка в смеси 10 мл уксусной кислоты и 10 мл воды перемешивают, нагревают до температуры кипения с обратным холодильником в течение 5-10 минут и фильтруют еще горячей. Добавляют воду для растворения ацетата цинка. Фильтрат концентрируют и фильтруют. Полученное таким образом твердое вещество собирают и промывают водой, получая 80 мг (40%) требуемого 3,6-ди[(5-бензиоксипиридин-2-ил)метил]пиперазин-2,5-диона (соединение 13).
Т.пл.: 228-231°C.
Пример 14: Синтез 3-[(5-ацетоксипиридин-2-ил)метилиден]-6-(бензилметилиден)пиперазин-2,5-диона (соединение 14).
3-[(5-Бензилоксипиридин-2-ил)метилиден]-6-(бензилметилиден)пиперазин-2,5-дион (соединение 1, 0,5 г, 1,26 ммоль) и NaOH (0,5 г, 12,5 ммоль) растворяют в 100 мл метанола. Смесь гидрируют 0,5 г палладий/уголь при давлением 1 атмосфера. После завершения взаимодействия, контролируемого с помощью ТСХ, катализатор удаляют фильтрованием и фильтрат упаривают в вакууме, получая остаток. К остатку добавляют 50 мл воды и образовавшийся водный раствор доводят до pH 7. Образующийся осадок собирают, получая 0,27 г продукта, 3-[(5-гидроксипиридин-2-ил)метилиден]-6-(бензилметилиден)пиперазин-2,5-диона (соединение B) (70% выход).
1Н-ЯМР (400 МГц, CDCl3): δ 6,758 (с, 1H), δ 7,087 (с, 1H), δ 7,290˜δ 7,580 (м, 7H, ароматический), δ 8,328 (с, 1H) и δ 12,289 (с, 1H).
Раствор соединения B (0,05 г, 0,16 ммоль) в уксусном ангидриде (50 мл) нагревают до температуры кипения, 150°C, с обратным холодильником в течение 24 час. Не прореагировавший уксусный ангидрид и выделяемую уксусную кислоту удаляют в вакууме, получая остаток. Остаток очищают хроматографией, используя колонку с силикагелем и проявляющий растворитель (CH2Cl2:MeOH=9:1), что дает 0,051 г (90%) соединения 14 в виде смеси изомеров. Смесь преимущественно содержит ZZ изомер.
1Н-ЯМР (400 МГц, CDCl3): δ 2,377 (с, 3H), δ 6,786 (с, 1H), δ 7,107 (с, 1H), δ 7,368˜δ8,496 (м, 7H, ароматический), δ 8,224 (с, 1H) и δ 12,498 (с, 1H).
Пример 15: Синтез 3-[(5-бензоилоксипиридин-2-ил)метилиден]-6-(бензилметилиден)пиперазин-2,5-диона (соединение 15).
Реакционную смесь, содержащую соединение B (0,05 г, 0,16 ммоль; полученного по примеру 14), бензоилхлорида (15 мл, 0,16 ммоль) и 50 мл хлороформа нагревают до 150°C в течение 2 час. Хлороформ удаляют в вакууме, получая остаток. Остаток очищают хроматографией, используя колонку с силикагелем и проявляющий растворитель (CH2Cl2), что дает 0,007 г (10%) соединения 15.
1Н-ЯМР (400 МГц, CDCl3): δ 6,786 (с, 1H), δ 7,107 (с, 1H), δ 7,368˜δ 8,496 (м, 13H, ароматический) и δ 8,223 (с, 1H).
Пример 16: Синтез 3-[(5-(4-толуолсульфонил)пиридин-2-ил) метилиден]-6-(бензилметилиден)пиперазин-2,5-диона (соединение 16).
Реакционную смесь из соединения B (0,05 г, 0,16 ммоль; полученного по примеру 14), толуолсульфонилхлорида (0,03 г, 0,16 ммоль) и 50 мл толуола нагревают до 150°C в течение 2 час. Толуол удаляют в вакууме, получая остаток. Остаток очищают хроматографией, используя колонку с силикагелем и проявляющий растворитель (CH2Cl2), что дает 0,007 г (10%) соединения 16.
1Н-ЯМР (400 МГц, CDCl3): δ 2,503 (с, 3H), δ 6,751 (с, 1H), δ 7,102 (с, 1H), δ 7,343˜δ 8,159 (м, 12H, ароматический), δ 8,223 (с, 1H) и δ 12,315 (с, 1H).
Пример 17: Синтез 3-[(5-(4-хлорфенилкарбамил)пиридин-2-ил)метилиден]-6-(бензилметилиден)пиперазин-2,5-дион (соединение 17).
Реакционную смесь из соединения B (0,05 г, 0,16 ммоль; полученного по примеру 14), 4-хлорфенилизоцианата (0,024 г, 0,16 ммоль) и 50 мл хлороформа нагревают до 100°C в течение 24 час. Хлороформ удаляют (в вакууме), получая остаток. Остаток очищают хроматографией, используя колонку с силикагелем и проявляющий растворитель (CH2Cl2), что дает 0,01 г (15%) соединения 17.
Пример 18: Скрининг противоопухолевой активности (NCI клеточные линии).
Цитотоксические активности ряда соединений пиперазиндиона измерены относительно панели из 60 различных NCI клеточных линий опухолей человека.
Обнаружено, что все испытуемые соединения активны. Наименее эффективное соединение имеет значения GI50<10-4 M для 4 клеточных линий. Наиболее эффективное соединение имеет значения GI50<10-4 M для всех 60 клеточных линий, при GI50<10-8 M для 9 клеточных линий.
Пример 19: Скрининг противоопухолевой активности (клеточные линии предстательной железы).
Цитотоксическая активность ряда соединений пиперазиндиона и таксола (хорошо известное противоопухолевое средство) протестированы на PC-3 клетках. Клетки инкубируют в присутствии каждого из соединений в бессывороточной питательной среде в течение 24 час. Цитотоксические активности определяют путем MTT пробы. Все испытуемые соединения активны. Неожиданно оказалось, что наиболее эффективное соединение пиперазиндиона имеет значение ЕС50 порядка 0,3 микроМ, эффективнее таксола >30 раз.
Пример 20: Испытание in vitro (подавление G2/M развития клеточного цикла).
PC-3 клетки инкубируют в присутствии соединения пиперазиндиона в бессывороточной питательной среде и собирают, фиксируют и окрашивают пропидийиодидом на 6ом, 12ом, 18ом и 24ом час, соответственно. Стадию клеточных циклов определяют на основании измерений цитометрического проникновения. Испытуемое соединение при введении вызывает остановку развития клеточного цикла, о чем свидетельствует большое число клеток на G2/M фазе. В дополнение, соединение пиперазиндиона оказывает заметное действие, связанное с регуляцией Ras активности.
Пример 21: Испытание in vitro (нарушение тубулин/микротубулин агрегации).
Тубулин/микротубулин инкубируют в присутствии соединения пиперазиндиона при различных концентрациях в растворе (0,1 M MES, 1 мМ EGTA, 0,5 мМ MgCl2, 0,1 мМ EDTA и 2,5 M глицерина) при 37°C. Затем добавляют GTP, чтобы вызвать полимеризацию тубулин/микротубулин. Для определения степени полимеризации измеряют оптическую (OD-ОП) при 350 нм в различные моменты времени. Испытуемые соединения ингибируют полимеризацию при 10-6-10-5 М.
Пример 22: Испытание in vivo (подавление развития опухолей).
У SCID мышей, которым подкожно впрыснуты PC-3 клетки, разрастается опухоль более 800 мм3 в объеме. Соединение пиперазиндиона значительно уменьшает объем опухоли после 14-28 дней обработки.
Пример 23: Испытание in vivo (регуляция ангиогенезной активности).
После подкожного инкубационного периода для пробки из bFGF или VEGF-содержащего матриксного геля (0,5 мл/20 г мышь), равного 6 дням, в пробке обнаруживается значительный ангиогенный эффект. Интраперитонеальное впрыскивание соединения пиперазиндиона почти полностью снимает ангиогенный эффект.
Другие варианты выполнения
Все характерные признаки, раскрытые в данном описании, могут быть объединены в любом сочетании. Каждый характерный признак, раскрытый в данном описании, может быть заменен альтернативным, служащим той же, эквивалентной или подобной цели. Так, если не оговорено особо, каждый из раскрытых характерных признаков является только примером общего ряда эквивалентных или подобных признаков.
Из приведенного выше описания каждый квалифицированный специалист в данной области легко может установить главные признаки настоящего изобретения, не выходя за пределы объема и сущности изобретения, осуществить различные замены и модификации изобретения с целью удовлетворения запросов потребителя и адаптации к различным условиям. Например, соединения, являющиеся структурными аналогами соединений пиперазиндиона по изобретению, могут быть получены, проверены на противоопухолевую активность и использованы в целях настоящего изобретения. Так, другие варианты воплощения также включены в приложенные пункты.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОЛЬНЫЕ И ТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2436779C2 |
| ПРОИЗВОДНЫЕ АМИНОХИНАЗОЛИНА В КАЧЕСТВЕ P2X3 ИНГИБИТОРОВ | 2020 |
|
RU2821714C2 |
| ПОЛУЧЕНИЕ ЗАМЕЩЕННОГО АКРИЛАТНОГО СОЕДИНЕНИЯ | 2021 |
|
RU2830161C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИМИДАЗОЛИЛЬНЫХ СОЕДИНЕНИЙ | 2003 |
|
RU2314296C2 |
| АМИНОТИАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2018 |
|
RU2772645C2 |
| ИНДОЛИЛ ИЛИ ИНДОЛИНИЛГИДРОКСАМАТНЫЕ СОЕДИНЕНИЯ, ИХ СОДЕРЖАЩАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ РАКА (ВАРИАНТЫ) С ИХ ПОМОЩЬЮ | 2011 |
|
RU2584682C2 |
| АНАЛОГ ПИРИДИНО[1,2-А]ПИРИМИДОНА, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ ИНГИБИТОРА mTOR/PI3K | 2015 |
|
RU2658912C1 |
| ИНДОЛИЛМАЛЕИМИДНЫЕ ПРОИЗВОДНЫЕ | 2005 |
|
RU2373201C2 |
| ПРОИЗВОДНЫЕ ИНДОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2013 |
|
RU2627706C2 |
| АГОНИСТЫ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ-1, СОДЕРЖАЩЕЙ ДОМЕН ГОМОЛОГИИ-2 SRC, И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ УКАЗАННЫХ АГОНИСТОВ | 2012 |
|
RU2584986C2 |
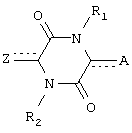
Настоящее изобретение относится к соединениям пиперазиндиона формулы I
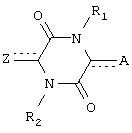
где каждый из 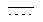 и
и 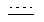 независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда
независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда  означает простую связь, или C(RaRb), когда
означает простую связь, или C(RaRb), когда  означает двойную связь. Z означает R3О-(Ar)-В, где В означает CH(Rc), когда
означает двойную связь. Z означает R3О-(Ar)-В, где В означает CH(Rc), когда  означает простую связь, или C(Rc), когда
означает простую связь, или C(Rc), когда  означает двойную связь; Ar означает пиридил и R3 означает алкил, арил, С(O)Rd, С(O)NRdRe или SO2Rd; каждый из R1 и R2 независимо означает Н, С(O)Rd. Соединения формулы I обладают противоопухолевой активностью. Описан также способ лечения опухолей и способ ингибирования ангиогенеза. 3 н. и 39 з.п. ф-лы.
означает двойную связь; Ar означает пиридил и R3 означает алкил, арил, С(O)Rd, С(O)NRdRe или SO2Rd; каждый из R1 и R2 независимо означает Н, С(O)Rd. Соединения формулы I обладают противоопухолевой активностью. Описан также способ лечения опухолей и способ ингибирования ангиогенеза. 3 н. и 39 з.п. ф-лы.
где каждый из 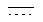 и
и  независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда
независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда  означает простую связь, или C(RaRb), когда означает двойную связь;
означает простую связь, или C(RaRb), когда означает двойную связь;
Z означает R3О-(Ar)-В, где В означает CH(Rc), когда  означает простую связь, или C(Rc), когда
означает простую связь, или C(Rc), когда  означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
каждый из R1 и R2 независимо означает Н or С(O)Rd; и
где каждый из Ra и Rb, независимо, представляет Н, алкил, арил, гетероарил; или Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; Rc является Н; Rd является Н, алкилом или арилом; и Re является Н или алкил.
 или
или  означает двойную связь.
означает двойную связь.гетероарил, а другой из Ra и Rb означает Н.
 или
или  означает простую связь.
означает простую связь.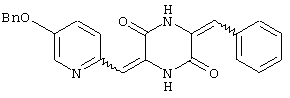
 или
или 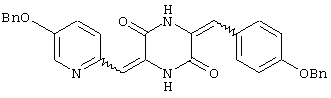
где каждый из  и
и  независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда
независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда  означает простую связь, или C(RaRb), когда
означает простую связь, или C(RaRb), когда  означает двойную связь;
означает двойную связь;
Z означает R3О-(Ar)-В, где В означает CH(Rc), когда  означает простую связь, или C(Rc), когда
означает простую связь, или C(Rc), когда  означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
каждый из R1 и R2 независимо означает Н or С(O)Rd;
где каждый из Ra и Rb, независимо, представляет Н, алкил, арил, гетероарил; или Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; Rc является Н; Rd является Н, алкилом или арилом; Re является Н или алкил.
 или
или  означает двойную связь.
означает двойную связь. или
или  означает простую связь.
означает простую связь.



 или
или 


где каждый из  и
и  независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда
независимо означает простую связь или двойную связь; А означает Н или CH(RaRb), когда  означает простую связь, или C(RaRb), когда
означает простую связь, или C(RaRb), когда  означает двойную связь;
означает двойную связь;
Z означает R3О-(Ar)-В, где В означает CH(Rc), когда  означает простую связь, или C(Rc), когда
означает простую связь, или C(Rc), когда  означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
означает двойную связь; Ar означает пиридил, присоединенный к В в положении 2; R3 означает алкил, арил, C(O)Rd, C(O)NRdRe или SO2Rd;
каждый из R1 и R2 независимо означает Н or C(O)Rd; и
где каждый из Ra и Rb, независимо, представляет Н, алкил, арил, гетероарил; или Ra и Rb, взятые вместе, образуют циклильную или гетероциклильную группу; Rc является Н; Rd является Н, алкилом или арилом; Re является Н или алкил.
 или
или  означает двойную связь.
означает двойную связь. или
или  означает простую связь.
означает простую связь.



 или
или 

| RU 95108387 A1, 10.12.1996 | |||
| Экономайзер | 0 |
|
SU94A1 |
| US 5902812 A, 11.05.1999. | |||
Авторы
Даты
2006-02-10—Публикация
2001-05-08—Подача