Изобретение относится к области химической технологии, а именно к группе соединений, содержащих хитозан. Получаемый модифицированный хитозан может быть применен в медицине, косметологии, сельском хозяйстве, ветеринарии, пищевой и легкой промышленности.
Хитозан представляет собой физиологически активное соединение природного происхождения, широко использующееся в составе косметических средств и лекарственных препаратов. Его получают гидролизом хитина - основного компонента наружного скелета членистоногих:
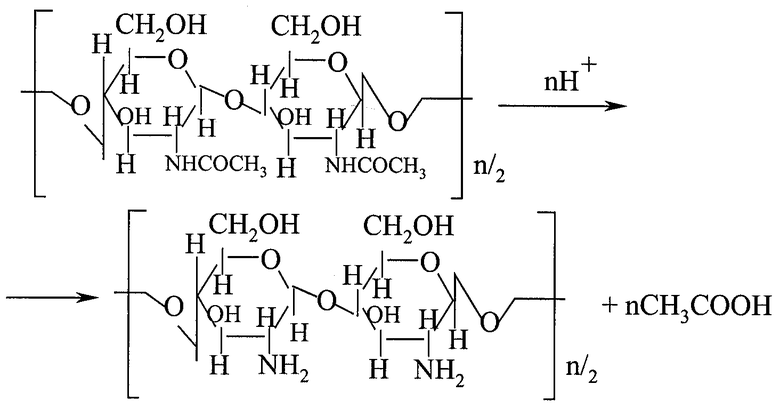
n=150-1400
Хитин (от французского "chitine" и греческого "chitone", что означает "кожа", "оболочка") широко распространен в природе, он входит в состав клеточной стенки грибов и бактерий, где выполняет опорную и защитную функцию.
По химической структуре хитозан представляет собой высокомолекулярные полимеры (ММ˜30000-260000 у.е.) из группы полисахаридов, построенные из остатков глюкозамина (ацетилглюкозамина), связанных между собой β(1→4) гликозидными связями. По своему строению, физико-химическим свойствам и биологической роли хитозан аналогичен целлюлозе растений.
В последнее время в разных областях медицины и косметологии появился повышенный интерес к использованию хитозана в качестве мягкого лечебного средства, обладающего слабым антисептическим эффектом. Особенно ценно то, что хитозан, будучи продуктом жизнедеятельности живых организмов, безвреден для человека.
Известно эффективное антибактериальное средство - антибиотик стрептомицин, молекула которого представляет собой трициклический углевод, содержащий в одном из циклов две гуанидиновые группировки [Энциклопедия лекарств. 8-е изд., под ред. Ю.Ф.Крылова, М., "РЛС", 2001 г., стр.813].
Структурная формула стрептомицина имеет следующий вид:
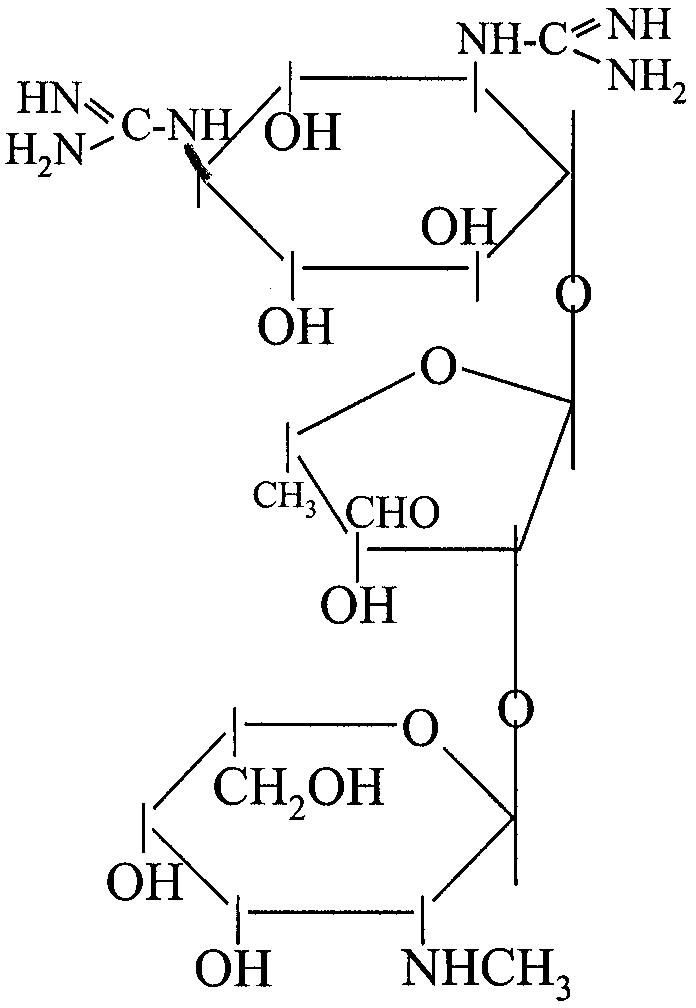
Стрептомицин по своей химической природе, как и хитозан, относится к аминогликозидам, является эффективным антибиотиком широкого спектра действия, активным в отношении микобактерий туберкулеза, возбудителей чумы, туляремии, бруцеллеза, дизентерии, стрепто-, гоно- и менингококков, вырабатывается лучистым грибом (рода Streptomyces).
Однако стрептомицин является достаточно токсичным и при длительном применении поражает слуховой нерв.
Наиболее близким к предлагаемому решению является препарат карбоксиметилхитозан, полученный реакцией хитозана с монохлоруксусной кислотой (Пат. РФ №2185387, кл. С 08 В 37/08, 2000 г.).
К недостаткам известного препарата относится недостаточная бактерицидная активность и сложный метод получения.
Технической задачей данного изобретения является повышение бактерицидной активности препарата.
Для решения технической задачи синтезирован модифицированный хитозан следующего строения:
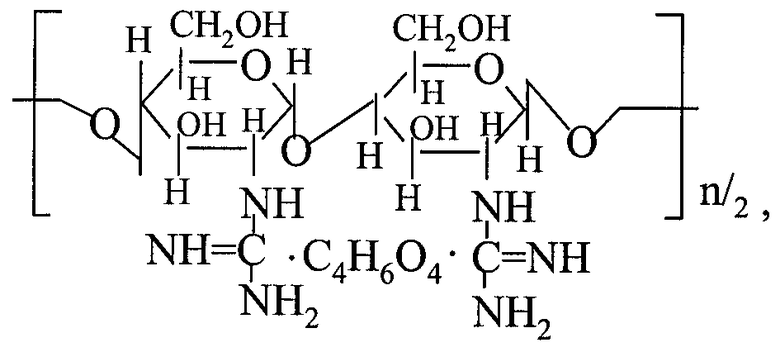
где n=150-1400
Поскольку полимерные формы лекарственных препаратов обычно являются предпочтительными вследствие усиления эффекта благодаря наличию множества активных группировок, расположенных на молекулярных расстояниях, меньшей токсичности, а также эффекту депонирования (более длительному терапевтическому эффекту) препарата, представлялось целесообразным осуществить гуанидирование аминных группировок хитозана, превратив их из малоактивных аминных в высокоэффективные гуанидиновые.
Модифицированный хитозан получают следующим образом. В связи с невысокой термической стабильностью хитозана в качестве мягкого гуанидирующего средства был выбран карбодиимид (NH=C=NH) - таутомер мономерного цианамида (NH2CN).
В качестве исходного хитозанового сырья служили два коммерческих образца сукцината хитозана фирм ЗАО "Биопрогресс" и "Химмед", высушенные сублимационным методом. Их молекулярные массы составляют по данным ультрафильтрации (осмос на мембранах) 30000 и 26000; степени полимеризации соответственно n=150 и n=1400. Реакцию проводили с набухшим сукцинатом хитозана в растворе ацетонитрила, содержащем расчетное количество 50% водного карбодиимида:
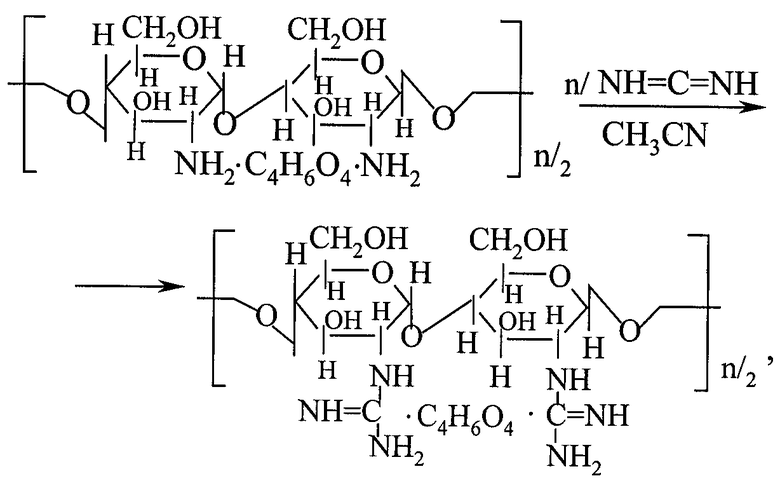
где n=150-1400
Для завершения процесса реакционную смесь после 24-часовой выдержки при обычных условиях нагревали еще в течение 10 часов при 40°С. Модифицированный хитозан отличается от исходного более рыхлой структурой.
ИК-спектроскопическое исследование полученного полимера (см. чертеж) свидетельствует о появлении в структуре модифицированного хитозана (кривая 1) значительного числа гуанидиновых группировок: интенсивные полосы 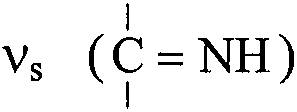 и
и 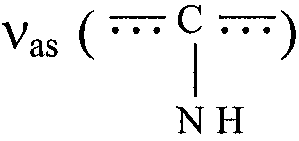 при ˜3350 и 1600-1650 см-1. Для сравнения на чертеже приведен также спектр гуанидированного полиэтиленимина, содержащий гуанидиновые полосы (кривая 2). ИК-спектр исходного хитозана полос при 3350 и 1600 см-1 не содержит [хитин и хитозан]. Поскольку мы не располагали методом осмометрического определения молекулярных масс для определения молекулярной массы модифицированного хитозана был использован следующий прием. Навески исходного модифицированного хитозана растворяли в 2% уксусной кислоте и определяли их характеристические вязкости. Равенство полученных значений (ηисх=0,41 дл/л; ηмод=0,43 дл/л) свидетельствует о том, что в ходе реакции деструкция полимерной цепи хитозана не имела места. В свою очередь, небольшое возрастание молекулярной массы вследствие модификации, составляющее около 20%, также не на столько значительно, чтобы повлиять на характеристическую вязкость.
при ˜3350 и 1600-1650 см-1. Для сравнения на чертеже приведен также спектр гуанидированного полиэтиленимина, содержащий гуанидиновые полосы (кривая 2). ИК-спектр исходного хитозана полос при 3350 и 1600 см-1 не содержит [хитин и хитозан]. Поскольку мы не располагали методом осмометрического определения молекулярных масс для определения молекулярной массы модифицированного хитозана был использован следующий прием. Навески исходного модифицированного хитозана растворяли в 2% уксусной кислоте и определяли их характеристические вязкости. Равенство полученных значений (ηисх=0,41 дл/л; ηмод=0,43 дл/л) свидетельствует о том, что в ходе реакции деструкция полимерной цепи хитозана не имела места. В свою очередь, небольшое возрастание молекулярной массы вследствие модификации, составляющее около 20%, также не на столько значительно, чтобы повлиять на характеристическую вязкость.
Появление гуанидиновых группировок в хитозане регистрируется также химическим анализом: колориметрия с эозином.
Методом серийных разведении исследована антимикробная активность гуанидированного хитозана. Бактериостатическая активность на штамме синегнойной палочки составила 0,075%, бактерицидная 0,15%.
В связи с близостью гуанидированного хитозана к стрептомицину препарат был испытан также на противотуберкулезную активность. Здесь также отмечена повышенная эффективность, обусловленная полимерной природой препарата (по сравнению со стрептомицином) и по сравнению с немодифицированным хитозаном.
Приводимые примеры иллюстрируют практическое осуществление синтеза гуанидированного хитозана.
Пример 1
Порцию 25 г (0,1 моля) сукцината хитозана (n=150) измельчали в кофейной мельнице в тонкий порошок желтоватого цвета и смешивали в колбе со 100 мл раствора ацетонитрила, содержащего 4,5 г (0,1 моля) карбодиимида. После набухания хитозана в растворе ацетонитрила в течение суток реакционную смесь для завершения реакции нагревали с периодическим перемешиванием при температуре 40°С. Модифицированный хитозан отделяли фильтрованием, затем его промывали 50 мл дистиллированной воды на фильтре и высушивали на воздухе.
Полученный гуанидиновый модификат хитозана представляет собой объемный легкий порошок светло-желтого цвета, трудно растворимый в воде и несколько лучше в 2% растворе уксусной кислоты.
Пример 2
Порцию 25 г коммерческого сукцината хитозана (n=150) очищали переосаждением. С этой целью ее растворяли в 1,5 л 2% водного раствора уксусной кислоты. Полное растворение навески хитозана требует при периодическом перемешивании ˜48 часов. Полученный гомогенный раствор ацетата хитозана декантировали от небольшого осадка, который может включать непрогидролизовавшийся хитин, а также белковые примеси. Прозрачный раствор прибавляли при интенсивном перемешивании к 2 л 15% водного раствора аммиака. Реакционную смесь оставляли на сутки и после этого осторожно декантировали верхний прозрачный раствор. К осадку, имеющему вид белой ваты, добавляли 1,5 л дистиллированной воды, тщательно перемешивали и снова оставляли на сутки. Операцию промывания и декантации повторяли трижды до полного исчезновения запаха амиака. После этого осадок основания хитозана обезвоживали на центрифуге и нейтрализовали добавлением по каплям 5 г ледяной уксусной кислоты, тщательным перемешиванием в ступке и подсушиванием на воздухе до постоянного веса. Выход 20 г.
Полученный ацетат хитозана использовали в реакции с карбодиимидом по методике примера 1. Степень гуанидирования очищенного хитозана выше (75%), чем непереосажденного (60%), по данным колориметрического определения с эозином.
Навески по 0,5 г модифицированного и исходного хитозана растворяли в 100 мл 2% водного раствора уксусной кислоты и измерили приведенную удельную вязкость полученных растворов. Близкие значения полученных вязкостей ηисх=0,4 и ηмод=0,3 свидетельствует об отсутствии деструкции цепи хитозана при гуанидировании.
Пример 3
Порцию 5 г коммерческого сукцината хитозана (n=1400) модифицировали обработкой 1 г карбодиимида в 20 мл ацетонитрила по методике примера 1. Модифицированный хитозан промывали на фильтре и высушивали до постоянного веса.
Навески по 0,1 г модифицированного и исходного хитозана растворяли в 100 мл 2% водного раствора уксусной кислоты и измеряли приведенную удельную вязкость полученных растворов. Близкие значения полученных вязкостей ηисх=1,0 и ηмод=0,9 свидетельствует об отсутствии деструкции цепи хитозана при гуанидировании.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ ПОКРЫТИЯ ПОЛИМЕРНЫХ ИЗДЕЛИЙ | 2012 |
|
RU2524929C1 |
| СОЛИ БИС(3-ГУАНИДИНОПРОПИЛ)ДОДЕЦИЛАМИНА | 2004 |
|
RU2273632C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЛОКСОПОЛИМЕРА АЛКИЛЕНГУАНИДИНА С ПОЛИАЛКИЛЕНАМИНОМ И БЛОКСОПОЛИМЕР | 1999 |
|
RU2176651C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ СУКЦИНАТА ХИТОЗАНА | 1998 |
|
RU2144040C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛЕНОЧНОГО ПОКРЫТИЯ НА ОСНОВЕ ХИТОЗАНА И ПЛЕНОЧНОЕ ПОКРЫТИЕ НА ОСНОВЕ ХИТОЗАНА | 2010 |
|
RU2461575C2 |
| Способ получения гибридного препарата фицина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822735C1 |
| СТАБИЛИЗАТОР ЛИПОСОМАЛЬНЫХ СУСПЕНЗИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2529179C1 |
| Биопрепарат для профилактики и лечения эндометритов у коров | 2018 |
|
RU2687041C1 |
| СПОСОБ СТАБИЛИЗАЦИИ КОСМЕТИЧЕСКИХ ПРЕПАРАТОВ | 1989 |
|
RU2028138C1 |
| Способ получения ацетатных солейгуАНидиРОВАННыХ АлифАТичЕСКиХпОлиАМиНОВ | 1978 |
|
SU852169A3 |
Изобретение относится к области химической технологии, а именно к группе соединений, содержащих хитозан. Сущность изобретения заключается в синтезе модифицированного хитозана следующего строения:
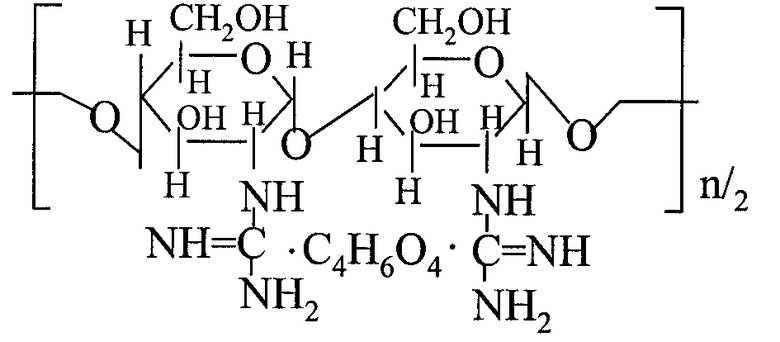
где n=150-1400, который обладает бактерицидной активностью, в частности противотуберкулезной активностью. 1 табл., 1 ил.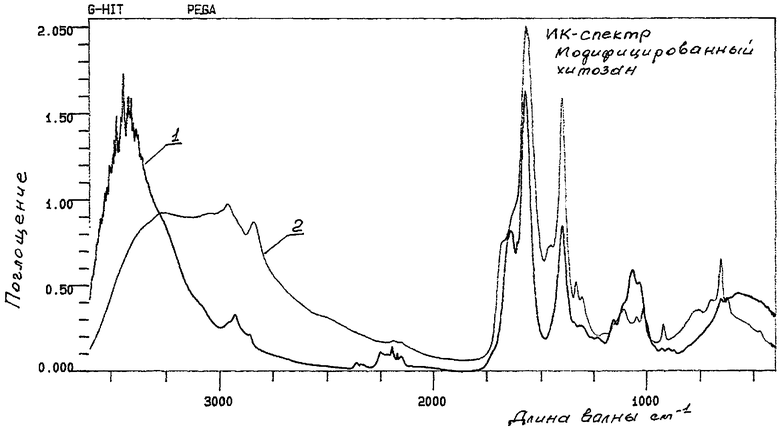
Модифицированный хитозан следующего строения:
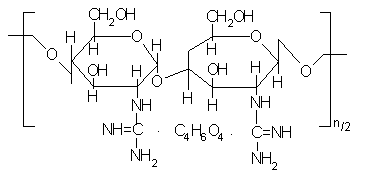
где n=150-1400.
| СПОСОБ ПОЛУЧЕНИЯ КАРБОКСИМЕТИЛХИТОЗАНА | 2000 |
|
RU2185387C2 |
| N-ЦИАНОМЕТИЛИРОВАННЫЕ ХИТОЗАНЫ, ПРОДУКТЫ ИХ ГИДРОЛИЗА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 1995 |
|
RU2158270C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ИТАКОНОИЛХИТОЗАНА | 1997 |
|
RU2123500C1 |
Авторы
Даты
2006-02-10—Публикация
2004-12-27—Подача