Настоящее изобретение относится к новому способу получения анилиновых производных и к их применению в качестве промежуточных продуктов при приготовлении гербицидов изобензофуранонового типа.
Уже в "Berichte der deutschen chemischen Gesellschaft", 1893, с.2060, приведено упоминание о восстановлении нитробензола до анилина с использованием гидразингидрата в спиртовом растворе. В "Journal fur praktische Chemie", 1896, с. 433-447, описано применение фенилгидразина при восстановлении нитробензолов до соответствующих анилиновых производных. Другое описание действия гидразина на нитро- и хлорнитробензолы помещено в "Journal fur praktische Chemie", 1925, cc. 277-284. Все такие реакции без исключения проводят при повышенной температуре, а в некоторых случаях процесс проходит в спиртовом растворе.
Было установлено, что протекание процесса восстановления нитробензолов до анилиновых производных можно значительно улучшить, если вместо спирта в качестве растворителя использовать водное основание.
Таким образом, объектом настоящего изобретения является способ получения анилиновых производных формулы
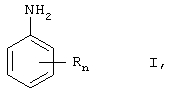
в которой
n обозначает целое число от 1 до 5, а
R обозначает водородный атом, алкил, гидроксиалкил, алкиламино-, диалкиламиногруппу, алкенил, алкинил, алкокси, алкилтио, фенил, нафтил, фенокси, фенилтио, атом галогена, аминогруппу, гидроксил, меркаптогруппу, карбоксил, сульфо-, нитро-, нитрозо-, гидроксиламиногруппу или гетероциклил,
реакцией нитросоединений формулы
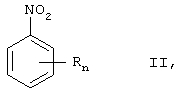
в которой n и R имеют такие же значения, как указанные, с гидразином при повышенной температуре в среде растворителя и выделением соединений формулы I, при осуществлении которого в качестве растворителя используют водное основание.
Для соединений формулы I предпочтительным значением n является целое число от 1 до 3, а преимущественным значением n является 2. Было установлено, что особенно приемлемы и особую ценность представляют те соединения формулы I, которые содержат карбоксильные или сульфогруппы или остатки их солей. Особенно эффективным оказалось, в частности, соединение формулы I, которое содержит карбоксильную группу в орто-положении и гидроксиалкильную группу, в особенности группу СН3СН(ОН), в мета-положении (3-е положение). Нитросоединение формулы II, соответствующее этому соединению, находится в водном растворе в зависящем от рН гидролитическом равновесии с соответствующей циклической, лактоновой формой 3-метил-7-нитро-3Н-изобензофуран-1-она Это последнее соединение, которое может быть также получено, например, восстановлением 2-нитро-6-ацетилбензойной кислоты, известной из работ Horii и др, Yakugaku Zasshi, 1954, 466, и Baker и др, J. Org. Chem. 1952, 17, 164, с использованием боргидрида натрия, является новым, поэтому оно также составляет объект настоящего изобретения Это соединение также можно эффективно использовать при приготовлении гербицидов изобензофуранонового типа.
Обычно соединения формул I и II, которые содержат примыкающие друг к другу заместители, способные совместно образовывать (при объединении) кольцо, например карбоксильная группа в орто-положении и гидроксиалкильная группа в мета-положении, находятся в водном растворе в зависящем от рН равновесии с соответствующей циклической формой, например с лактоновой формой, 5-членной кольцевой лактоновой формой, в частности в виде 7-амино-З-метил-3Н-изобензофуран-1-она, особенно легко образуются в кислом растворе. Как правило, с увеличением размера кольца тенденция к образованию циклов ослабляется, причем 6- и 7-членные кольца обычно образуются менее легко, чем 5-членные кольца.
Таким образом, способ в соответствии с изобретением охватывает также получение соединений формулы I тех циклических форм, у которых два заместителя R располагают образованным при объединении кольцом.
Предпочтительные алкильные радикалы, приведенные в качестве значений R, содержат от 1 до 4 углеродных атомов каждый, ими являются, например, метил, этил, пропил, бутил и их разветвленные изомеры. Предпочтительные алкокси, алкилтио- и гидроксиалкильные радикалы дериватизируют из упомянутых алкильных радикалов. Предпочтительные алкенильные и алкинильные радикалы R содержат от 2 до 4 углеродных атомов каждый, ими являются, например, этенил, пропенил этинил, пропинил и их разветвленные изомеры, а также бутенил, бутинил и их разветвленные и диненасыщенные изомеры. Понятия "гидроксил (-ОН)", "меркапто-(-SH)", "сульфогруппа (-SO3Н)" и "карбоксил (-CO2H)" в каждом случае распространяются также на их солевые формы, например на остатки солей щелочных металлов, щелочно-земельных металлов и аммония. Термин "гетероциклил" в предпочтительном варианте понимают как обозначающий насыщенное или ненасыщенное кольцо, включающее от 4 до 8 членов, которое содержит по меньшей мере один гетероатом, выбранный из атомов азота, серы и кислорода. Его примерами служат пиридил, фуранил, тиофуранил, оксетанил, тиазинил, морфолинил, пиперазинил, пиридазинил, пиразинил, тиопиранил, пиразолил, пиримидинил, тиазинил, изофуранил, пиранил, пиперидил, пиколинил, тиадиазолинил, тиетанил, триазолил, оксазоланил, тиоланил, азепинил, тиазолил, изотиазолил, имидазолил и пирролил.
Гидразин может быть использован как таковой или, что предпочтительно, в форме его гидрата. Предпочтение отдают применению от 1,4 до 3 молей, преимущественно от 1,6 до 2 молей, гидразинового соединения на моль нитросоединения.
В предпочтительном варианте выражение "повышенная температура" обозначает температурный интервал от 30 до 150°С. Особенно предпочтительно вести процесс в интервале от 70 до 100°С, поскольку для поддержания реакционных температур свыше 100°С требуется создание повышенного давления.
Подходящим водным основанием является преимущественно водный раствор гидроксида щелочного металла, гидроксида щелочно-земельного металла, карбоната щелочного металла или карбоната щелочно-земельного металла. Приемлемы также органические амины, например алкилендиамины, уротропин и хинуклидин. Предпочтение отдают использованию от 0,5 до 5 молей, преимущественно от 1 до 2 молей, основания на моль нитросоединения. Если нитросоединение формулы II в качестве заместителей уже содержит кислотные группы, на каждую кислотную группу требуется дополнительный моль основания.
Основное преимущество способа в соответствии с изобретением заключается в том, что его можно осуществлять в большом, промышленном масштабе. Обычно процесс проводят введением соединения формулы II в воду и добавлением основания. После нагревания образовавшейся смеси до необходимой реакционной температуры в нее дозируют гидразин или гидразингидрат.
Способ в соответствии с изобретением можно осуществлять проведением либо непрерывного, либо прерывистого (ненепрерывного, периодического) процесса, причем предпочтение отдают прерывистому процессу. В предпочтительном варианте как прерывистый, так и непрерывный реакционные процессы проводят в сосуде смешения или в каскаде сосудов смешения.
Процесс выделения анилиновых производных зависит от строения и природы конкретного соединения, его проводят, когда это уместно, после подкисления реакционной смеси добавлением, например, соляной кислоты до рН в интервале от 1 до 9, преимущественно от 5 до 8, путем либо кристаллизации, либо, если при комнатной температуре продуктом является жидкость, экстракции органическим растворителем, например толуолом.
Обычно выход выделенного анилинового производного находится в интервале от 80 до 100%. Химический выход в реакционной смеси обычно превышает 97%.
Перед известным в данной области техники способом предлагаемый в соответствии с изобретением способ обладает следующими преимуществами:
его можно осуществлять в большом, промышленном масштабе,
ход реакции можно в значительной мере регулировать путем дозируемого добавления, которое с точки зрения безопасности является преимуществом,
в отличие от процесса в этаноле в качестве растворителя реакция протекает быстро и очень селективно,
когда исходными являются соединения формулы II, в особенности те, у которых R обозначает сульфо- или карбоксильную группу, или остаток соответствующей соли, в форме водного раствора, что возможно, например, в случае проведения непрерывного процесса, эти соединения можно восстанавливать непосредственно путем добавления основания вместе с гидразином,
результатом его осуществления являются продукты с выходом до 100%,
его можно осуществлять в многоцелевом аппарате.
Анилиновые производные формулы I, полученные в соответствии с изобретением, используют, в частности, в качестве промежуточных продуктов при приготовлении гербицидов изобензофуранонового типа.
Изобретение дополнительно проиллюстрировано следующими примерами.
Пример 1. Получение 2-амино-6-(1-гидроксиэтил)бензойной кислоты (натриевая соль)
0,75 моля водного раствора гидроксида натрия (30%-ный) вводят в водный раствор 0,5 моля 2-нитро-6-(1-гидроксиэтил)бензойной кислоты (натриевая соль) и при температуре от 90 до 95°С в течение 1 ч дозируют 50 г гидразингидрата (1,0 моля). При температуре от 90 до 95°С перемешивание осуществляют в течение от 4 до 6 ч до полного превращения нитросоединения, а после выделения с 97%-ным выходом от теоретического в пересчете на 2-ацетил-6-нитробензойную кислоту (ЖХ анализ) получают 2-амино-6-(1-гидроксиэтил)бензойную кислоту.
Пример 2. Получение 2-амино-4-хлорбензойной кислоты
В 1-литровый тефлоновый сосуд с мешалкой вводят 201,5 г 4-хлор-2-нитробензойной кислоты (1 моль) в 500 мл воды и при перемешивании дозируют 3 моля водного раствора гидроксида натрия (30%-ный). Реакционную смесь нагревают и при температуре от 90 до 95°С в течение 60 мин дозируют 100 г гидразингидрата (2 моля). Перемешивание осуществляют в течение от 3 до 4 ч до полного превращения 4-хлор-2-нитробензойной кислоты в 2-амино-4-хлорбензойную кислоту. Затем с использованием соляной кислоты (32%-ная) рН реакционной смеси доводят до 6, осаждая в кристаллической форме аминобензойную кислоту. Суспензию кристаллов охлаждают до комнатной температуры, фильтруют, продукт промывают водой и сушат под вакуумом. Получают 166 г 2-амино-4-хлорбензойной кислоты с 99%-ным содержанием основного вещества (по методу ЖХ), что соответствует 96%-ному выходу от теоретического в пересчете на 4-хлор-2-нитробензойную кислоту.
Пример 3. Получение 7-[(4,6-диметоксипиримидин-2-ил)тиол]-3-метил-3Н-изобензофуран-1-она
В 2,5-литровой колбе для сульфанирования 50%-ный водный раствор 2-амино-6-(1-гидроксиэтил)бензойной кислоты (натриевая соль, 1 моль) при температуре от 0 до 3°С диазотируют в 3,75 моля соляной кислоты (32%-ная) с использованием 1,05 моля раствора нитрита натрия (40%-ный). Затем этот раствор диазопродукта с перемешиванием при 50°С в течение 60 мин дозируют в смесь 500 мл воды, 666 г раствора гидроксида натрия (30%-ный, 5 молей) и 176 г этилксантогената калия (1,1 моля). При 50°С с использованием 32%-ной соляной кислоты рН реакционной смеси доводят до 3; в виде масла выделяется промежуточный 7-меркапто-3-метил-3Н-изобензофуран-1-он, который отделяют от водной фазы. При 70°С этот промежуточный продукт дозируют в смесь 1,0 моля 2-хлор-4,6-диметоксипиримидина с 1,05 моля карбоната калия в 1600 мл ацетонитрила и перемешивают в течение от 4 до 6 ч до завершения превращения. В реакционную смесь добавляют 700 мл воды и водный солевой раствор выделяют из органической фазы, которая содержит 7-[(4,6-диметоксипиримидин-2-ил)тиол]-3-метилфталида. В органическую фазу добавляют 700 мл воды и смесь охлаждают до комнатной температуры. 7-[(4,6-диметоксипиримидин-2-ил)тиол]-3-метил-3Н-изобензофуран-1-он, выпадающий в осадок в кристаллической форме, отфильтровывают и промывают 300 мл изопропанола. После сушки под вакуумом при 70°С 7-[(4,6-диметоксипиримидин-2-ил)тиол]-3-метил-3Н-изобензофуран-1-он получают с выходом 70% от теоретического в пересчете на натриевую соль 2-амино-6-(1-гидроксиэтил)бензойной кислоты при степени чистоты 98% (по методу ЖХ).
Пример 4. Получение 3-метил-7-нитро-3Н-изобензофуран-1-она
10,0 г (48 ммолей) 2-нитро-6-ацетилбензойной кислоты (см работы Horii и др., Yakugaku Zasshi, 1954, 466, и Baker и др., J. Org. Chem. 1952, 17, 164) при 40°С растворяют в 50 мл 2 н. раствора гидроксида натрия и обрабатывают добавлением порциями 1,87 г (48 ммолей) боргидрида натрия. По прошествии 40 мин реакционную смесь, которую предварительно охлаждают, подкисляют, а выпадающие в осадок кристаллы отфильтровывают и сушат под вакуумом. Продукт включает 8,4 г образовавшейся смеси 82% 2-нитро-6-(1-гидроксиэтил)бензойной кислоты, 1Н-ЯМР (ДМСО-D6) 8,00 част./млн, m, 2H, 7,68 част./млн, t, 1H, 5,6 част./млн, b, ОН, 4,92 част./млн, q, 1H, 1,32 част./млн, d, 3Н, и 18% 3-метил-7-нитро-3Н-изобензофуран-1-она, 1H-ЯМР (ДМСО-D6) 8,02 част./млн, m, 2H, 7,68 част./млн, t, 1H, 5,80 част./млн, q, 1H, 1,62 част./млн, d, 3Н. Затем кислую водную фазу также экстрагируют этилацетатом, объединяют с полученными по вышеизложенному кристаллами, тщательно сушат над сульфатом магния и выпариванием концентрируют до полного высыхания Таким образом получают 9,14 г (выход 98,6%) 3-метил-7-нитрофталида (3-метил-7-нитро-3Н-изобензофуран-1-он), 1H-ЯМР (CDCl3) 7,92 част./млн, d, 1H, 7,88 част./млн, t, 1H, 7,72 част./млн, d, 1H, 5,63 част./млн, q, 1H, 1,72 част./млн, d, 3H.
Пример 5. Получение 7-амино-3-метил-3Н-изобензофуран-1-она
2,37 г (12,2 ммоля) 3-метил-7-нитро-3Н-изобензофуран-1-она (из примера 4) выдерживают в 5 мл 30%-ного раствора гидроксида натрия (49 ммолей) при 90°С в течение 1 ч до возможности продемонстрировать с помощью ТЖХ (подвижная фаза: этилацетат/гексан в соотношении 3:1 плюс 1 капля муравьиной кислоты) почти количественное образование 2-нитро-6-(1-гидроксиэтил)бензойной кислоты. Затем медленно, по каплям добавляют 1,2 мл (24,5 ммоля) гидразингидрата и температуру поддерживают в течение последующих 4 ч. Далее рН охлажденной реакционной смеси доводят до 2 и экстрагируют этилацетатом. Получают 1,8 г (выход: 90,4%) сырого 7-амино-3-метил-3Н-изобензофуран-1-она; 1Н-ЯМР (CDCl3): 7,37 част./млн, t, 1H; 6,63 част./млн, d, 1H; 6,61 част./млн, d, 1H; 5,44 част./млн, q, 1H; 5,22 част./млн, b, 2H; 1,58 част./млн, d, 3Н.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 7-МЕРКАПТО-3-МЕТИЛ-3Н-ИЗОБЕНЗОФУРАН-1-ОНА | 2001 |
|
RU2310649C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛА | 1993 |
|
RU2126003C1 |
| 4-(АРИЛАМИНОМЕТИЛЕН)-2,4-ДИГИДРОПИРАЗОЛ-3-ОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2180659C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ПОЛИ(АДФ-РИБОЗА)ПОЛИМЕРАЗ | 2005 |
|
RU2344138C2 |
| СОЕДИНЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2244709C2 |
| ПРОИЗВОДНЫЕ УРАЦИЛА, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ ПОДАВЛЕНИЯ РОСТА СОРНЯКОВ | 2000 |
|
RU2259359C2 |
| БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ ДЛЯ МОДУЛЯЦИИ РЕЦЕПТОРНОГО КОМПЛЕКСА ГАММА-АМИНОМАСЛЯНОЙ КИСЛОТЫ (GABA) | 2006 |
|
RU2405779C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛУКСУСНОЙ КИСЛОТЫ И СРЕДСТВО БОРЬБЫ ПРОТИВ НАСЕКОМЫХ И ПАУКООБРАЗНЫХ И ПРОТИВ ВРЕДОНОСНЫХ ГРИБОВ | 1995 |
|
RU2162075C2 |
| ПРОИЗВОДНЫЕ 5-АРИЛ-1Н-1,2,4-ТРИАЗОЛА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2249588C2 |
| НОВЫЕ БЕНЗАМИДОАЛЬДЕГИДЫ | 1997 |
|
RU2189973C2 |
Изобретение относится к улучшенному способу получения анилинового производного формулы

в которой n обозначает целое число от 1 до 5, а R обозначает водород, алкил, гидроксиалкил, алкиламино-, диалкиламиногруппу, алкенил, алкинил, алкокси, алкилтио, фенил, нафтил, фенокси, фенилтио, галоген, гидроксил, меркаптогруппу, карбоксил, сульфо-, нитро-, нитрозо-, гидроксиламиногруппу или гетероциклил, или, если n больше 1, два соседних заместителя могут образовывать конденсированное гетероциклическое 5-7-членное кислородсодержащее кольцо реакцией нитросоединения формулы
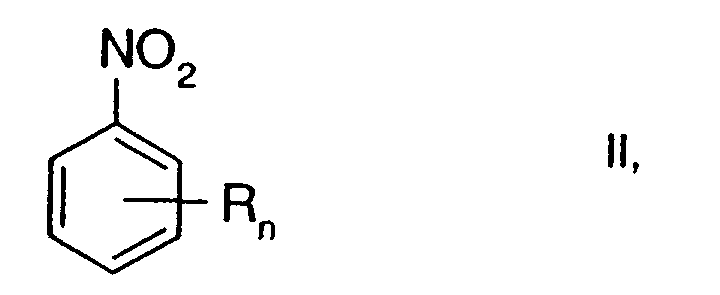
в которой n и R имеют вышеуказанные значения, с гидразином при повышенной температуре в среде водного основания в качестве растворителя. Изобретение также относится к новому соединению: 3-метил-7-нитро-3Н-изобензофуран-1-ону. Способ позволяет упростить процесс за счет исключения катализатора при сохранении выхода и качества получаемых продуктов. Соединения формулы (I) могут быть использованы в качестве промежуточных продуктов при приготовлении гербицидов изобензофуранонового типа. 2 с.п.ф-лы.

в которой n обозначает целое число от 1 до 5, а
R обозначает водород, алкил, гидроксиалкил, алкиламино-, диалкиламиногруппу, алкенил, алкинил, алкокси, алкилтио, фенил, нафтил, фенокси, фенилтио, галоген, гидроксил, меркаптогруппу, карбоксил, сульфо-, нитро-, нитрозо-, гидроксиламиногруппу или гетероциклил, или, если n больше 1, два соседних заместителя могут образовывать конденсированное гетероциклическое 5-7-членное кислородсодержащее кольцо,
реакцией нитросоединения формулы
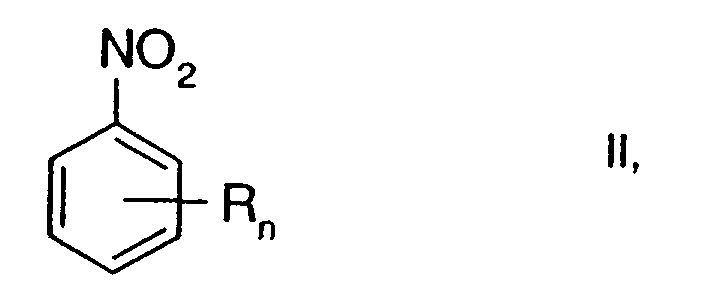
в которой n и R имеют вышеуказанные значения, с гидразином при повышенной температуре в среде растворителя, при осуществлении которого в качестве растворителя используют водное основание.
Приоритет по пунктам:
| 1971 |
|
SU416118A1 |
Авторы
Даты
2006-02-20—Публикация
2001-05-15—Подача