Область изобретения
Настоящее изобретение относится к спиро[6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онам], которые ингибируют внеклеточное высвобождение воспалительных цитокинов, при этом указанные цитокины ответственны за одно или большее количество болезненных состояний человека или высших млекопитающих. Далее, настоящее изобретение относится к композициям, содержащим указанные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-оны, и способам предупреждения, ослабления или иного регулирования действия ферментов, которые, как предполагают, являются активными компонентами, ответственными за рассматриваемые в настоящем описании болезненные состояния.
Предпосылки изобретения
Интерлейкин-1 (IL-1) и фактор альфа, вызывающий некроз опухолевых клеток (TNF-α), входят в группу важных биологических веществ, известных под общим названием «цитокины». Известно, что указанные молекулы являются посредниками при передаче воспалительного ответа, связанного с иммунологическим распознаванием инфекционных агентов.
Предполагают, что указанные провоспалительные цитокины являются важными медиаторами при многих болезненных состояниях или синдромах, в том числе ревматоидном артрите, остеоартрите, заболеваниях, связанных с воспалением кишечника (IBS), септическом шоке, легочно-сердечной дисфункции, остром респираторном заболевании, кахексии, и поэтому ответственны за развитие и проявление болезненных состояний человека.
В связи с этим в течение длительного времени ощущается настоятельная потребность в соединениях и фармацевтических композициях, включающих соединения, которые могут блокировать, ослаблять, регулировать, смягчать или предотвращать высвобождение цитокинов из клеток, которые их производят.
Краткое описание изобретения
Настоящее изобретение решает указанную проблему, поскольку, как неожиданно было обнаружено, некоторые спиро-бициклические пиразолоны и их производные эффективны для ингибирования высвобождения из клеток воспалительных цитокинов, в том числе интерлейкина-1 (IL-1) и фактора альфа, вызывающего некроз опухолевых клеток (TNF-α), и поэтому эффективны для предупреждения, ослабления или иного регулирования действия ферментов, которые, как предполагают, являются активными компонентами, ответственными за описываемые здесь болезненные состояния.
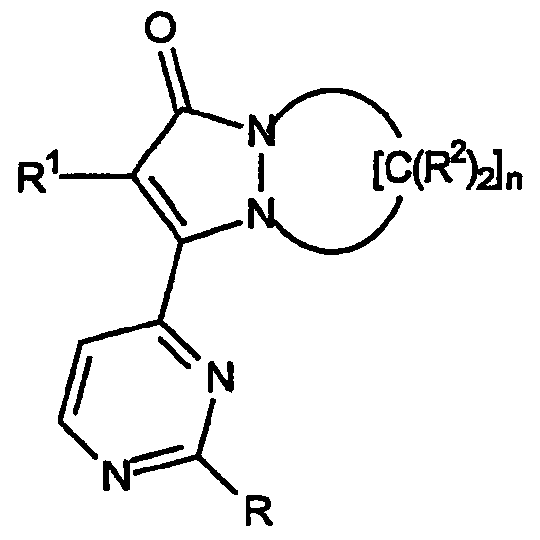
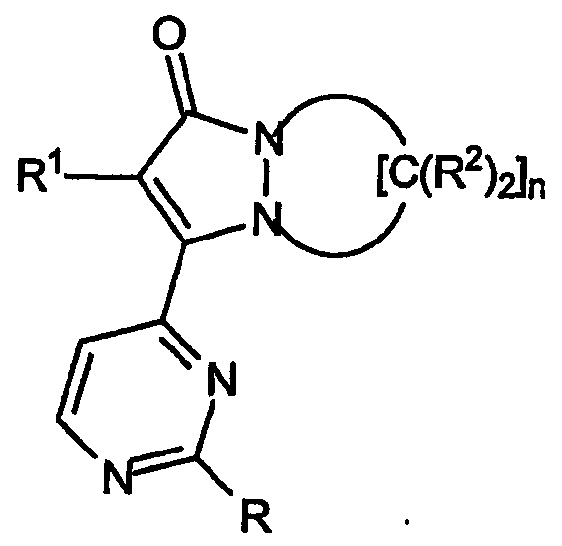
Первый аспект настоящего изобретения относится к соединениям, включая все их энантиомерные и диастереомерные формы и их фармацевтически приемлемые соли, при этом указанные соединения имеют формулу:
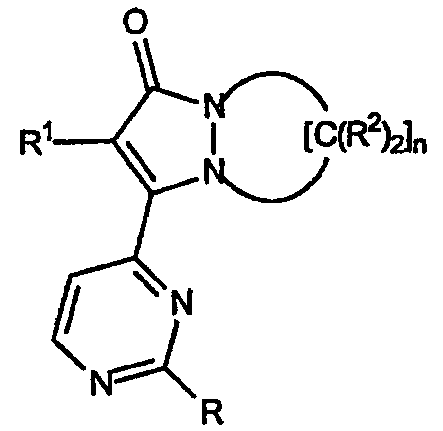
где R обозначает
a) -O[CH2]kR3 или
b) -NR4aR4b;
R3 обозначает замещенный или незамещенный C1-C4алкил, замещенный или незамещенный углеводородный радикал, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или алкиленарил, замещенный или незамещенный гетероарил или алкиленгетероарил; индекс k имеет значение от 0 до 5;
R4a и R4b каждый независимо обозначает:
a) водород или
b) -[C(R5aR5b)2]mR6;
каждый R5a и R5b независимо обозначает водород, группу -OR7, -N(R7)2, -CO2R7, -CON(R7)2; линейный, разветвленный или циклический C1-C4алкил и их сочетания; R6 обозначает водород, группу -OR7, -N(R7)2, -CO2R7, -CON(R7)2; замещенный или незамещенный C1-C4алкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; R7 обозначает водород, растворимый в воде катион или C1-C4алкил; индекс m имеет значение от 0 до 5;
R1 обозначает:
a) замещенный или незамещенный арил или
b) замещенный или незамещенный гетероарил;
по крайней мере две группы R2 одного фрагмента -[C(R2)2]- кольца, взятые вместе, образуют спироциклическое кольцо, содержащее от 4 до 7 атомов, при этом остальные группы R2 независимо выбраны из группы, включающей:
a) водород;
b) -(CH2)kO(CH2)jR8;
c) -(CH2)jNR9aR9b;
d) -(CH2)jCO2R10;
e) -(CH2)jOCO2R10;
f) -(CH2)jCON(R10)2 и
g) две группы R2 могут быть взяты вместе с образованием карбонильной группы;
R8, R9a, R9b и R10 каждый независимо обозначает водород, C1-C4алкил и их сочетания; R9a и R9b могут быть взяты вместе с образованием карбоциклического или гетероциклического кольца, содержащего от 3 до 7 атомов; две группы R10 могут быть взяты вместе с образованием карбоциклического или гетероциклического кольца, содержащего от 3 до 7 атомов; индекс j имеет значение от 0 до 5; индекс k имеет значение от 0 до 5; индекс n имеет значение от 3 до 5.
Другой аспект настоящего изобретения относится к фармацевтическим композициям, которые могут доставлять соединения настоящего изобретения человеку или высшему млекопитающему, при этом указанные композиции содержат:
a) эффективное количество одного или более соединений настоящего изобретения; и
b) один или более фармацевтически приемлемых эксципиентов.
Еще один аспект настоящего изобретения относится к способам регулирования одного или более заболеваний или состояний у млекопитающих, посредниками или модуляторами в которых выступают воспалительные цитокины, при этом указанный способ включает стадию введения человеку или высшему млекопитающему эффективного количества композиции, содержащей одно или более соединений настоящего изобретения.
Эти и другие объекты, свойства и преимущества будут понятны специалистам в данной области после ознакомления с подробным описанием изобретения и формулой изобретения. Все проценты, соотношения и пропорции по тексту описания даны, если специально не оговаривается, по массе. Все значения температуры, если специально не оговаривается, даны в градусах Цельсия (°C). Все цитируемые документы, в той их части, которая касается настоящего изобретения, включены в настоящее описание посредством ссылки; цитирование любого документа не должно быть истолковано как признание того, что он является предшествующим уровнем техники по отношению к настоящему изобретению.
Подробное описание изобретения
Настоящее изобретение относится к соединениям, которые способны выступать в качестве посредников, регулировать или иным другим образом ингибировать внеклеточное высвобождение некоторых цитокинов, в частности воспалительных цитокинов, при этом указанные цитокины играют роль в стимулировании, возбуждении и проявлении широкого круга заболеваний, болезненных состояний или синдромов.
В настоящем изобретении термин «углеводородный радикал» определяет любую органическую группу или звено, которые состоят из атомов углерода и атомов водорода. Термин «углеводородный радикал» включает гетероциклические кольца, которые рассмотрены ниже. Примеры различных незамещенных негетероциклических углеводородных групп включают пентил, 3-этилоктанил, 1,3-диметилфенил, циклогексил, цис-3-гексил, 7,7-диметилбицикло[2.2.1]гептан-1-ил и нафт-2-ил.
Термин «углеводородный радикал» включает ароматические (арильные) и неароматические карбоциклические кольца, не ограничивающими настоящее изобретение примерами которых являются циклопропил, циклобутанил, циклопентанил, циклогексан, циклогексенил, циклогептанил, бицикло[0.1.1]бутанил, бицикло[0.1.2]пентанил, бицикло[0.1.3]гексанил (туйанил), бицикло[0.2.2]гексанил, бицикло[0.1.4]гептанил (каранил), бицикло[2.2.1]гептанил (норборанил), бицикло[0.2.4]октанил (кариофилленил), спиропентанил, дициклопентанспиранил, декалинил, фенил, бензил, нафтил, инденил, 2H-инденил, азуленил, фенантрил, антрил, флуоренил, аценафтиленил, 1,2,3,4-тетрагидронафталенил и т.п.
Термин «гетероцикл» включает как ароматические (гетероарильные), так и неароматические гетероциклические кольца, не ограничивающими настоящее изобретение примерами которых являются: пирролил, 2H-пирролил, 3H-пирролил, пиразолил, 2H-имидазол, 1,2,3-триазолил, 1,2,4-триазолил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, 2H-пиранил, 4H-пиранил, 2H-пиран-2-онил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, s-триазинил, 4H-1,2-оксазинил, 2H-1,3-оксазинил, 1,4-оксазинил, морфолинил, азепинил, оксепинил, 4H-1,2-диазепинил, инденил, 2H-инденил, бензофуранил, изобензофуранил, индолил, 3H-индолил, 1H-индолил, бензоксазолил, 2H-1-бензопиранил, хинолинил, изохинолинил, хиназолинил, 2H-1,4-бензоксазинил, пирролидинил, пирролинил, хиноксалинил, фуранил, тиофенил, бензимидазолил и т.п., каждый из которых может быть замещенным или незамещенным.
Примером группы, обозначенной термином «алкиленарил», является бензильная группа, имеющая формулу:
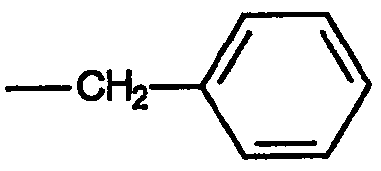
в то время как примером группы, обозначенной термином «алкиленгетероарил», является 2-пиколильная группа, имеющая формулу:
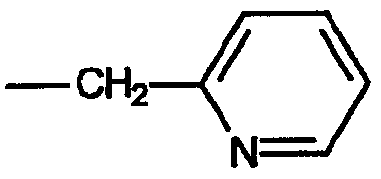 .
.
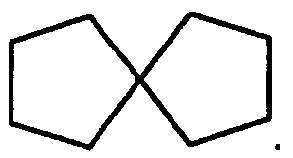
В настоящем изобретении термины «спироциклический» или «спирокольцевой», которые по тексту описания настоящего изобретения используются как взаимозаменяемые, обозначают два кольца, объединенные одним общим атомом углерода, например:
Термин «замещенный» используют по всему тексту описания настоящего изобретения. Термин «замещенный» обозначает окружающие звенья или группы, которые могут заменять один атом водорода, два атома водорода или три атома водорода в углеводородном звене. Термин замещенный может также включать замену атомов водорода у двух соседних атомов углерода с образованием нового звена или группы. Например, заместитель, который требуется для замены одного атома водорода, включает галоген, гидроксил и т.п. Замещение двух атомов водорода велючает карбонил, оксиминогруппу и т.п. Замещение двух атомов водорода у соседних атомов углерода включает эпоксигруппу и т.п. Замещение трех атомов водорода включает цианогруппу и т.п. Эпоксигруппа является примером заместителя, который требуется для замещения двух атомов водорода у соседних атомов углерода. Термин «замещенный» используется по тексту описания настоящего изобретения для обозначения того, что в углеводородном фрагменте, в том числе ароматическом кольце, алкильной цепи, один или более атомов водорода могут быть заменены заместителем. Если фрагмент обозначен как «замещенный», то в нем может быть заменено любое количество атомов водорода. Например, 4-гидроксифенил представляет собой «замещенное ароматическое карбоциклическое кольцо», (N,N-диметил-5-амино)октанил представляет собой «замещенную C8алкильную группу», 3-гуанидинопропил представляет собой «замещенную C3алкильную группу», а 2-карбоксипиридинил представляет собой «замещенную гетероарильную группу». Далее приводятся не ограничивающие настоящее изобретение примеры групп, которые могут быть использованы для замены атомов водорода в углеводородной группе, если она обозначена как «замещенная».
i) -[C(R12)2]p(CH=CH)qR12; где p обозначает число от 0 до 12; q обозначает число от 0 до 12;
ii) -C(Z)R12;
iii) -C(Z)2R12;
iv) -C(Z)CH=CH2;
v) -C(Z)N(R12)2;
vi) -C(Z)NR12N(R12)2;
vii) -CN;
viii) -CNO;
ix) -CF3, -CCl3, -CBr3;
x) -N(R12)2;
xi) -NR12CN;
xii) -NR12C(Z)R12;
xiii) -NR12C(Z)N(R12)2;
xiv) -NHN(R12)2;
xv) -NHOR12;
xvi) -NCS;
xvii) -NO2;
xviii) -OR12;
xix) -OCN;
xx) -OCF3, -OCCl3, -OCBr3;
xxi) -F, -Cl, -Br, -I и их сочетания;
xxii) -SCN;
xxiii) -SO3M;
xxiv) -OSO3M;
xxv) -SO2N(R12)2;
xxvi) -SO2R12;
xxvii) -P(O)H2;
xxviii) -PO2;
xxix) -P(O)(OH)2
xxx) и их сочетания;
где R12 обозначает водород, замещенный или незамещенный, линейный, разветвленный или циклический C1-C20алкил, C6-C20арил, C7-C20алкиленарил и их сочетания; M обозначает водород или солеобразующий катион; Z обозначает =O, =S, =NR11 и их сочетания. Подходящие солеобразующие катионы включают натрий, литий, калий, кальций, магний, аммоний и т.п.
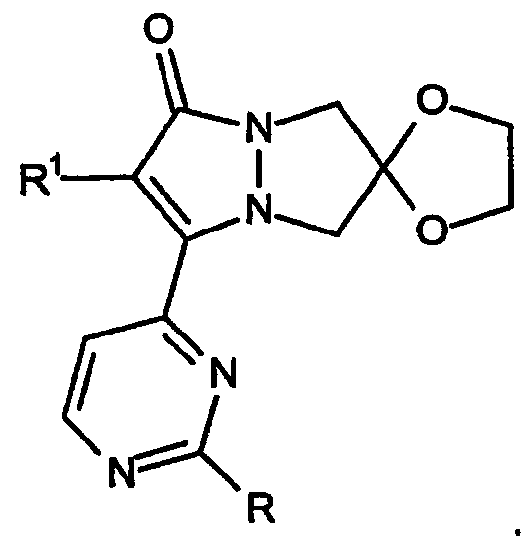
Соединения настоящего изобретения включают скелет спироциклического кольца, составленный из двух частей; первая из которых представляет собой конденсированное кольцо, содержащее 10-12 атомов, например конденсированную кольцевую систему 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она. Вторая часть представляет собой кольцо, содержащее от 4 до 7 атомов, при этом указанное кольцо присоединено к конденсированному кольцу с образованием конечной спироциклической кольцевой системы.
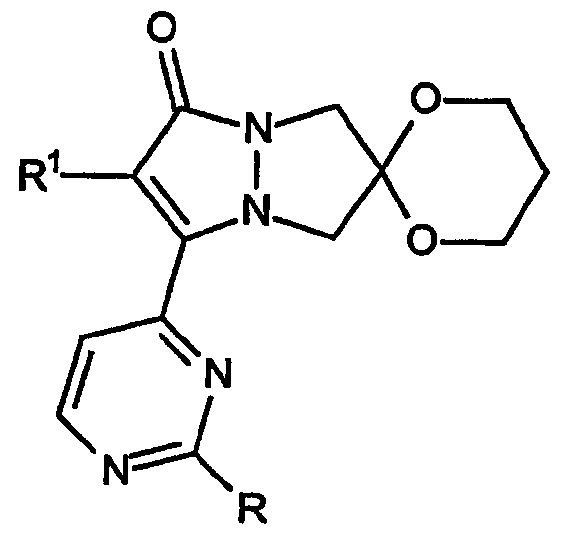
С целью более точного определения кольцевой системы настоящего изобретения далее приводится пример система нумерации атомов кольцева, используемой в описании настоящего изобретения для определения соединений и их вариатнов, которые охватываются настоящим изобретением.
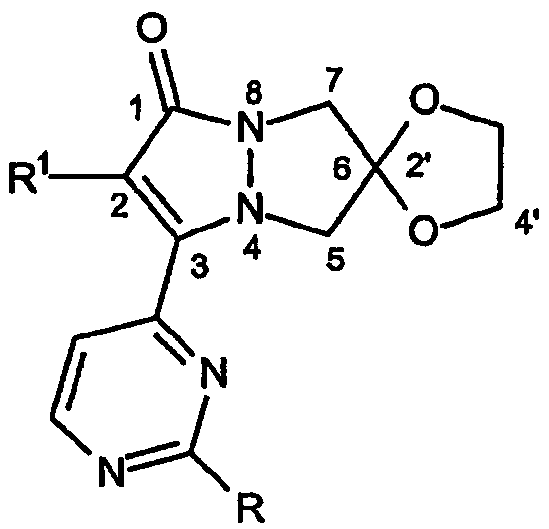
Приведенная выше структура представляет собой спиро[1,3-диоксолан[2',6]-2-R1-замещенный-3-[2-R-замещенный-пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он].
Ниже приводится пример того, как обозначаются кольцевые системы настоящего изобретения.
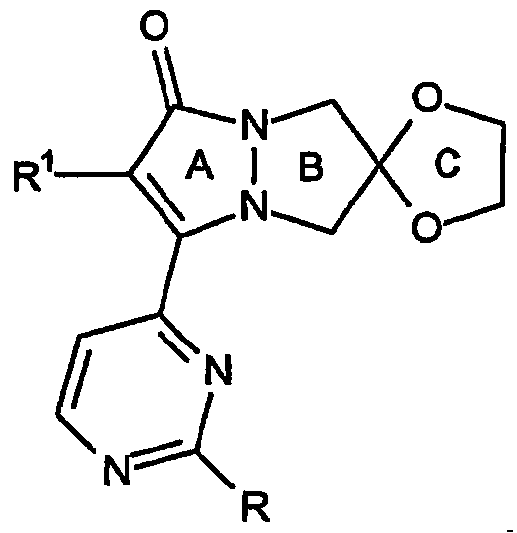
В общем случае соединения настоящего изобретения имеют формулу:
где индекс n указывает количество имеющихся в кольце звеньев -[C(R2)2]- и, таким образом, определяет количество атомов, составляющих B-кольцо каждого аналога. «C-кольцо», полученное из двух групп R2, расположенных у одного и того же атома углерода, может быть образовано из любых двух групп R2 у любого атома углерода B-кольца.
Первый аспект настоящего изобретения в том, что касается кольцевых структур, относится к конденсированной 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-оновой кольцевой системе, имеющей формулу:
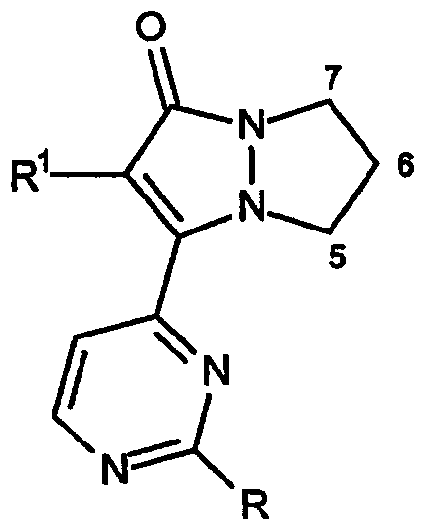
где C-кольцо может быть присоединено к любому положению 5, 6 или 7 кольца, как показано.
Первый тип конденсированного 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онового кольца по изобретению включает спиро[1,3-диоксолан]овые кольцевые системы, имеющие, например, формулу:
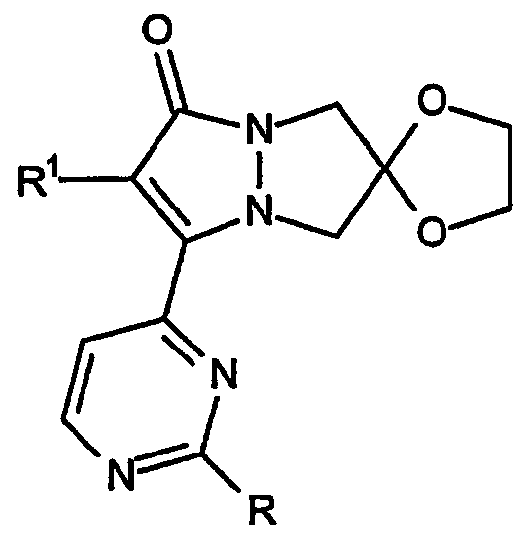
где 1,3-диоксолановое кольцо присоединено к атому углерода в положение 6 пиразольного кольца. Другие разновидности этого варианта включают 1,3-диоксолановое кольцо, присоединенное в положение 5 кольца, например:
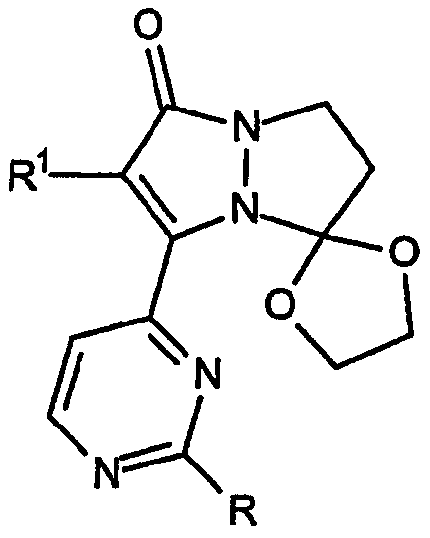
а также 1,3-диоксолановое кольцо, присоединенное в положение 7 кольца, как указано в формуле:
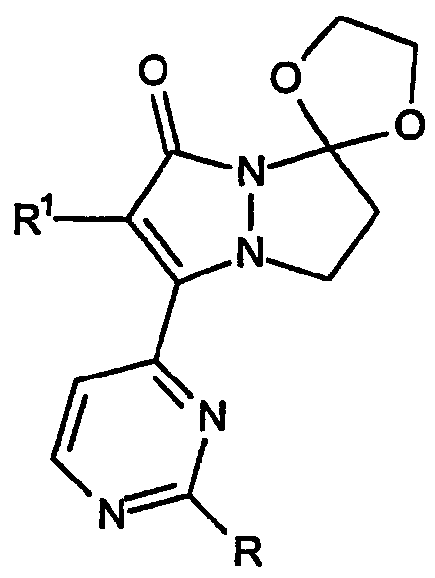
Второй тип конденсированного 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онового кольца по изобретению включает спиро[1,3-диоксан]овые кольцевые системы, имеющие, например, формулу:
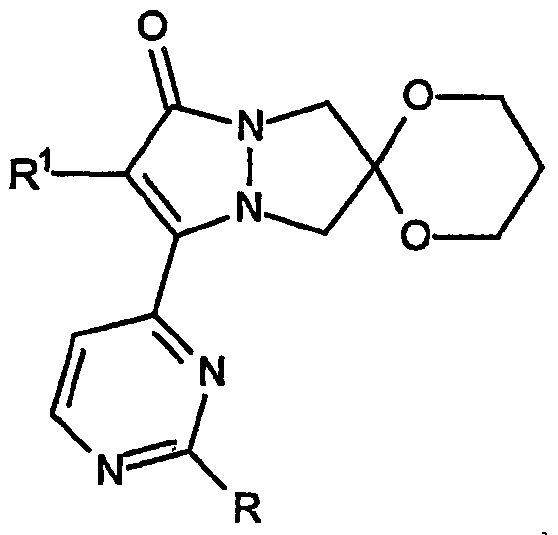
Этот вариант также включает разновидности, в которых спиро[1,3-диоксан]овое кольцо присоединено в положение 5 и 7 кольца.
Третий тип конденсированного 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онового кольца по изобретению включает спиро[1,3-дитиолан]овые кольцевые системы, имеющие, например, формулу:
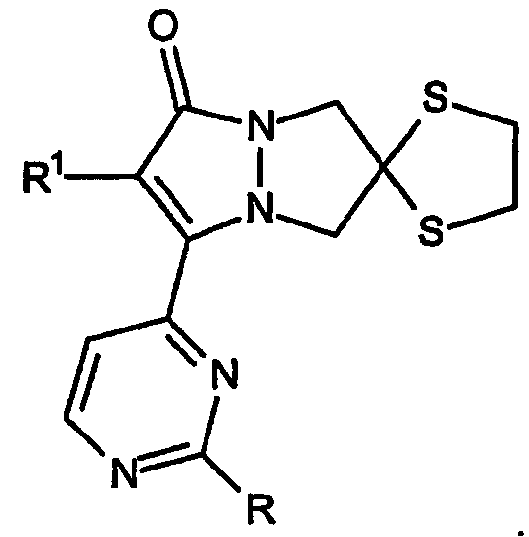
Этот вариант также включает разновидности, в которых спиро[1,3-дитиолан]овое кольцо присоединено в положение 5 и 7 кольца.
Другие варианты кольцевых систем настоящего изобретения относятся к структурам, включающим B-кольцо, содержащее 6 атомов (n=4) или 7 атомов (n=5), примеры которых представлены ниже формулами:
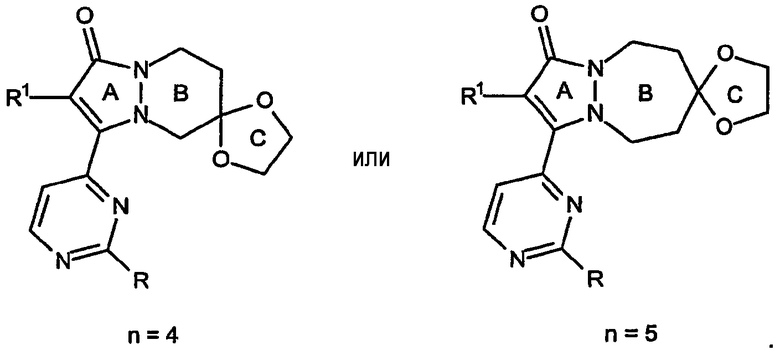
Первая кольцевая система в приведенных выше двух примерах содержит, в качестве компонента конденсированного кольца, 5,6,7,8-тетрагидропиразоло[1,2-a]пиридазин-1-оновую систему, а вторая структура содержит, в качестве компонента конденсированного кольца, 6,7,8,9-тетрагидро-5H-пиразоло[1,2-a][1,2]диазепин-1-оновую кольцевую систему. Каждая из этих кольцевых систем является частью отдельных типов скелета кольцевых структур по настоящему изобретению.
В рамках первого аспекта изобретения, в той части, которая касается кольцевых структур, B-кольцо содержит 5 атомов, а C-кольцо представляет собой [1,3]диоксолановое, [1,3]диоксановое или [1,3]дитиолановое кольцо, приведенное выше. Случаи, когда атом углерода, к которому присоединено указанное C-кольцо, представляет собой, например, любой атом углерода с номером 5, 6 или 7, относятся к указанному первому аспекту изобретения.
Второй аспект настоящего изобретения относится к ингибиторам высвобождения воспалительных цитокинов, в которых индекс n равен 4, при этом указанные структуры имеют, например, формулу:
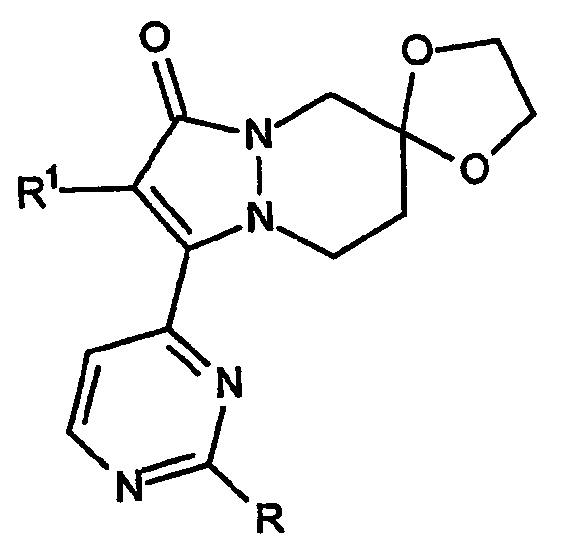
и представляют собой спиро[5,6,7,8-тетрагидропиразоло[1,2-a]пиридазин-1-он]овые кольцевые системы, в которых C-кольцо может быть присоединено к любому атому углерода кольца в положении 5, 6, 7 или 8. В рамках второго варианта осуществления изобретения, в той части, которая касается кольцевых структур, B-кольцо содержит 6 атомов, и C-кольцо представляет собой [1,3]диоксолановое, [1,3]диоксановое или [1,3]дитиолановое кольцо, приведенное выше. Случаи, когда атом углерода, к которому присоединено указанное C-кольцо, представляет собой, например, любой атом углерода с номером 5, 6, 7 или 8, относятся к варианту осуществления указанного второго аспекта изобретения.
Третий аспект настоящего изобретения относится к ингибиторам высвобождения воспалительных цитокинов, в которых индекс n равен 5, при этом указанные структуры имеют, например, формулу:
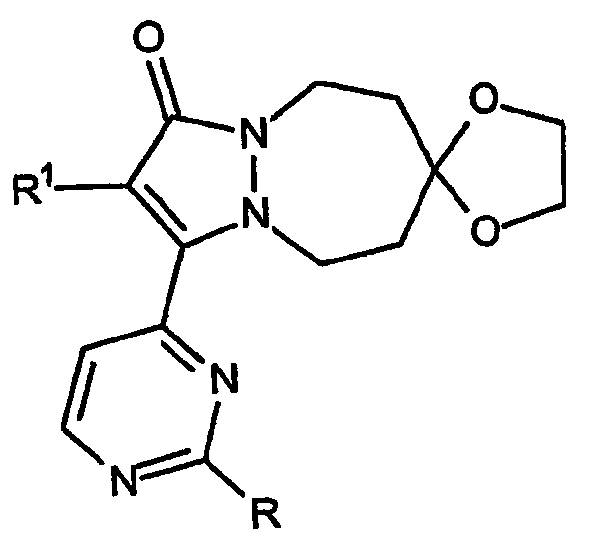
и представляют собой спиро[6,7,8,9-тетрагидро-5H-пиразоло[1,2-a][1,2]диазепин-1-он]овые кольцевые системы, в которых C-кольцо может быть присоединено к любому атому углерода кольца в положении 5, 6, 7, 8 или 9. В рамках третьего аспекта изобретения, в той части, которая касается кольцевых структур, B-кольцо содержит 7 атомов, а C-кольцо представляет собой [1,3]диоксолановое, [1,3]диоксановое или [1,3]дитиолановое кольцо, приведенное выше. Случаи, когда атом углерода, к которому присоединено указанное C-кольцо, представляет собой, например, любой атом углерода с номером 5, 6, 7, 8 или 9, относятся к варианту осуществления указанного третьего аспекта изобретения.
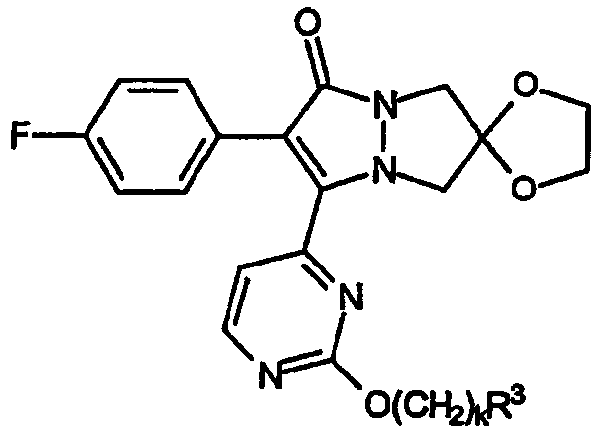
Соединения настоящего изобретения содержат пиримидиновое кольцо, присоединенное в положении 3 A-кольца. Группы R обозначают заместители в положении 2 пиримидин-4-ильной части общего скелета структуры, при этом указанная группа R представляет собой:
a) простой эфир, имеющий формулу -O[CH2]kR3 или
b) аминогруппу, имеющую формулу -NR4aR4b;
где R3 обозначает замещенный или незамещенный C1-C4алкил, замещенный или незамещенный циклический углеводородный радикал, замещенный или незамещенный гетероциклический радикал, замещенный или незамещенный арил или алкиленарил, замещенный или незамещенный гетероарил или алкиленгетероарил; индекс k имеет значение от 0 до 5.
Далее приводятся различные виды групп R по настоящему изобретению, где R обозначает простой эфир, имеющий формулу -O[CH2]kR3.
A) Группы R охватывают простые эфиры формулы -OR3 (индекс k равен 0), где R3 обозначает замещенный или незамещенный арил.
i) Одну разновидность групп R данного вида составляют простые эфиры формулы -OR3, где R3 обозначает замещенный или незамещенный арил. Эта разновидность включает следующие не ограничивающие изобретение примеры R: фенокси, 2-фторфенокси, 3-фторфенокси, 4-фторфенокси, 2,4-дифторфенокси, 3-трифторметилфенокси, 4-трифторметилфенокси, 2,4-трифторметилфенокси и т.п.
ii) Другую разновидность групп R данного вида составляют простые эфиры формулы -OR3, где R3 обозначает замещенный или незамещенный арил. Эта разновидность включает следующие не ограничивающие изобретение примеры: 2-метилфенокси, 3-метилфенокси, 4-метилфенокси, 2,4-диметилфенокси, 2-цианофенокси, 3-цианофенокси, 4-цианофенокси, 4-этилфенокси и т.п.
iii) Следующую разновидность групп R данного вида составляют простые эфиры формулы -OR3, где R3 обозначает замещенный или незамещенный арил. Эта разновидность включает следующие не ограничивающие изобретение примеры: (2-метокси)фенокси, (3-метокси)фенокси, (4-метокси)фенокси, 3-[(N-ацетил)амино]фенокси, 3-бензо[1,3]диоксо-5-ил и т.п.
B) Группы R охватывают простые эфиры формулы -OR3 (индекс k равен 0), где R3 обозначает замещенный или незамещенный гетероарил.
i) Первую разновидность групп R данного вида составляют простые эфиры формулы -OR3, где R3 обозначает незамещенный гетероарил. Эта разновидность включает следующие не ограничивающие изобретение примеры: пиримидин-2-ил, пиримидин-4-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил и т.п.
ii) Вторую разновидность групп R данного вида составляют простые эфиры формулы -OR3, где R3 обозначает замещенный гетероарил. Эта разновидность включает следующие не ограничивающие изобретение примеры: 2-аминопиримидин-4-ил и т.п.
C) Группы R охватывают простые эфиры формулы -OCH2R3 (индекс k равен 1), где R3 обозначает замещенный или незамещенный арил.
i) Первую разновидность групп R данного вида составляют простые эфиры формулы -OCH2R3, где R3 обозначает замещенный или незамещенный гетероарил. Эта разновидность включает следующие не ограничивающие изобретение примеры: пиримидин-2-ил, пиримидин-4-ил, 2-аминопиримидин-4-ил, 4-аминопиримидин-6-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил и т.п.
ii) Вторую разновидность групп R данного вида представляет простой эфир формулы -OCH2R3, где R3 обозначает замещенный или незамещенный алкиленгетероарил. Эта разновидность включает следующие не ограничивающие изобретение примеры: пиридин-3-илэтил, (2-метил-2-пиридин-3-ил)этил и т.п.
D) Группы R охватывают простые эфиры формулы -OR3 (индекс k равен 0), где R3 обозначает замещенный или незамещенный C1-C4алкил.
i) Первую разновидность групп R данного вида представляет простой эфир формулы -OR3, где R3 обозначает незамещенный линейный, разветвленный или циклический C1-C4алкил. Эта разновидность включает следующие не ограничивающие изобретение примеры: метил, этил, изопропил, (S)-1-метилпропил и т.п.
ii) Вторую разновидность групп R данного вида представляет простой эфир формулы -OR3, где R3 обозначает замещенный линейный, разветвленный или циклический C1-C4алкил. Эта разновидность включает следующие не ограничивающие изобретение примеры: 2-метоксиэтил, (S)-1-метил-3-метоксипропил и т.п.
Тем не менее, перечисленное не ограничивается приведенными выше разновидностями и примерами.
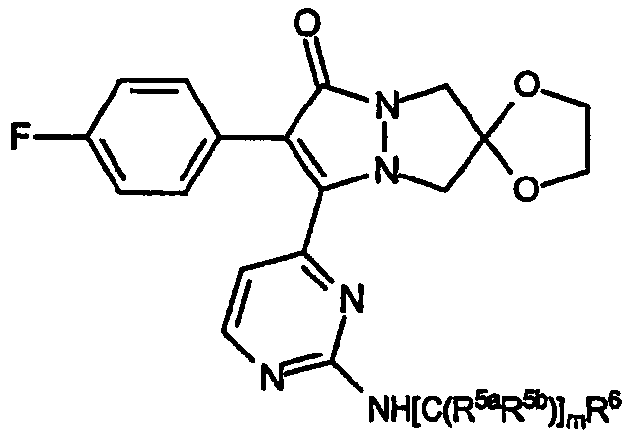
Далее приводятся различные виды групп R по настоящему изобретению, где R обозначает амин, имеющий формулу -NR4aR4b, где R4a и R4b каждый независимо обозначает:
a) водород или
b) -[C(R5aR5b)2]mR6;
где каждый из R5a и R5b независимо представляет водород, линейный, разветвленный или циклический C1-C4алкил и их сочетания; R6 обозначает водород, замещенный или незамещенный C1-C4алкил, C2-C4алкенил, группу -OR7, -N(R7)2, -CO2R7, -CON(R7)2, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; R7 обозначает водород, растворимый в воде катион или C1-C4алкил; индекс m имеет значение от 0 до 5.
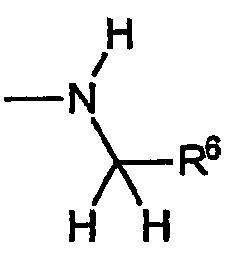
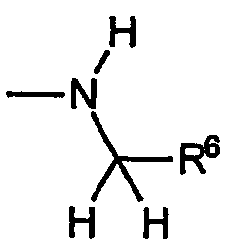
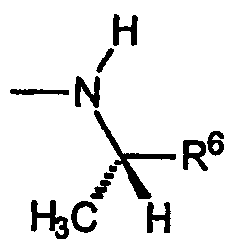
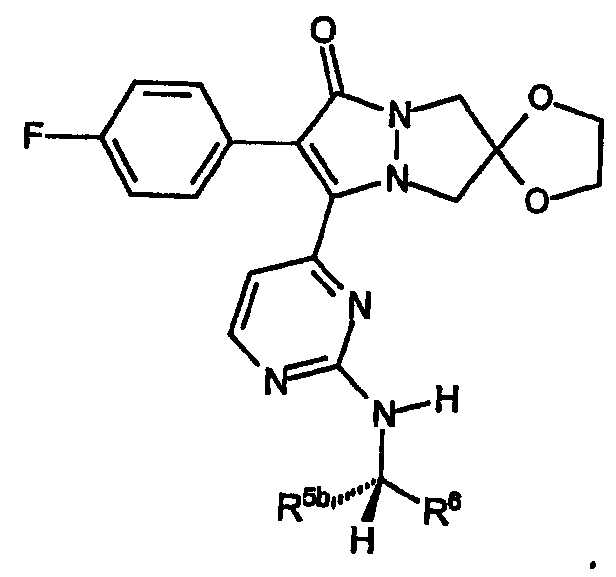
A) Группы R охватывают хиральные аминогруппы, в которых R4a обозначает водород, R5a обозначает водород и R5b обозначает метил, при этом указанные заместители имеют формулу:
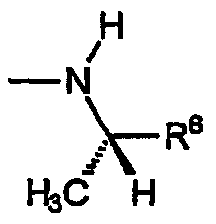
и указанную стереохимию.
i) Первую разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный фенил. Эта разновидность включает следующие не ограничивающие изобретение примеры: (S)-1-метил-1-фенилметиламино, (S)-1-метил-1-(4-фторфенил)метиламино, (S)-1-метил-1-(4-метилфенил)метиламино, (S)-1-метил-1-(4-метоксифенил)метиламино, (S)-1-метил-1-(2-аминофенил)метиламино, (S)-1-метил-1-(4-аминофенил)метиламино и т.п.
ii) Вторую разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный гетероарил. Эта разновидность включает следующие не ограничивающие изобретение примеры: (S)-1-метил-1-(пиридин-2-ил)метиламино, (S)-1-метил-1-(пиридин-3-ил)метиламино, (S)-1-метил-1-(пиридин-4-ил)метиламино, (S)-1-метил-1-(фуран-2-ил)метиламино, (S)-1-метил-1-(3-бензо[1,3]диоксол-5-ил)метиламино и т.п.
iii) Третью разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный C1-C4алкил. Эта разновидность включает следующие не ограничивающие изобретение примеры: (S)-1-метилпропиламино, (S)-1-метил-2-(метокси)этиламино.
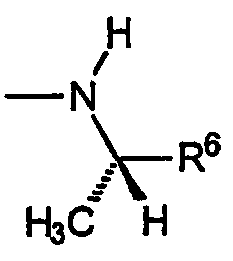
B) Группы R охватывают хиральные аминогруппы, в которых R4a обозначает водород, R5a и R5b каждый обозначает C1-C4алкил, при этом указанные заместители имеют формулу:
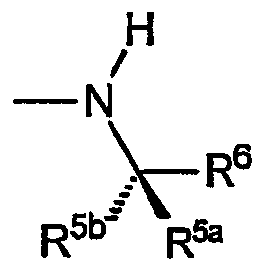
и указанную стереохимию в том случае, если значения R5a, R5b и R6 не являются одинаковыми.
i) Первую разновидность групп R данного вида представляет амин, не содержащий хиральный центр, не ограничивающими изобретение примерами которого являются: 1,1-диметилэтиламин, 1,1-диметилбензиламин и т.п.
ii) Вторую разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный C1-C4алкил. Эта разновидность включает следующие не ограничивающие изобретение примеры: (S)-1-метил-2-гидрокси-2-метилпропиламин, (S)-1-метил-2-гидрокси-2-метилбутиламин и т.п.
C) Группы R охватывают алкиленариламины, в которых R4a обозначает водород, оба R5a и R5b в R4b обозначают водород, R6 обозначает замещенный или незамещенный арил, при этом указанный заместитель имеет формулу:
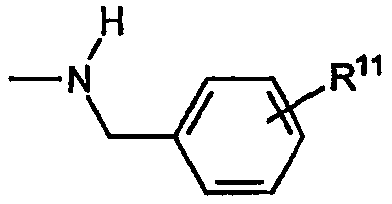
где R11 обозначает водород или замещенную группу, как описано выше.
i) Первую разновидность данного вида составляют следующие не ограничивающие изобретение примеры групп R: бензиламино, (2-аминофенил)метиламино, (4-фторфенил)метиламино, (4-метоксифенил)метиламино, (4-пропансульфонилфенил)метиламино и т.п.
ii) Вторую разновидность данного вида составляют следующие не ограничивающие изобретение примеры групп R: (2-метилфенил)метиламино, (3-метилфенил)метиламино, (4-метилфенил)метиламино и т.п.
D) Группы R охватывают амины, в которых R4a обозначает водород, R4b включает R5a, обозначающий водород, и R5b, обозначающий группу -CO2R7 или -CON(R7)2; при этом указанный заместитель имеет формулу:
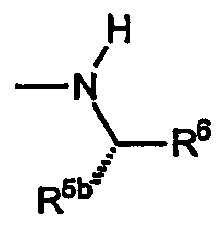
(i) Первую разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный фенил. Эта разновидность включает следующие не ограничивающие изобретение примеры:
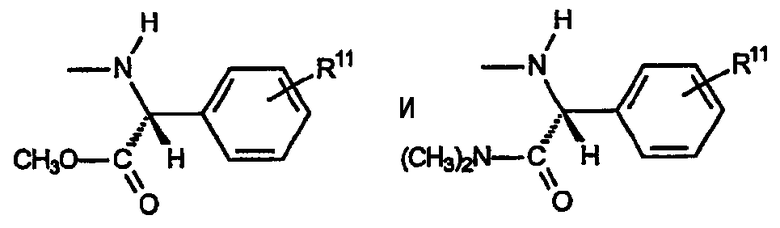
где R11 обозначает водород или заместитель, как описано выше.
(ii) Вторую разновидность групп R данного вида представляет амин, включающий R6, который обозначает замещенный или незамещенный алкил. Эта разновидность включает следующие не ограничивающие изобретение примеры:
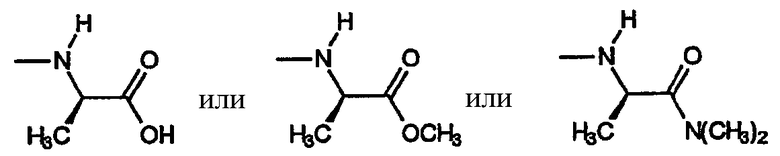 .
.
Тем не менее, перечисленное не ограничивается приведенными выше разновидностями и примерами.
Группы R1 выбраны из:
a) замещенного или незамещенного арила или
b) замещенного или незамещенного гетероарила.
Первая разновидность групп R1 включает замещенную галогеном фенильную группу, не ограничивающими изобретение примерами которой являются 4-фторфенил, 2,4-дифторфенил, 4-хлорфенил и т.п.
Группы R2 включают спироциклическое кольцо, имеющее скелет структуры по изобретению. Кроме того, группы R2 включают замещенные или незамещенные метиленовые фрагменты формулы -[C(R2)2]-. В том случае, если группы R2 не составляют часть (5-7)-членной спироциклической кольцевой части скелета структуры, каждая из групп R2 независимо выбрана из группы, включающей:
a) водород;
b) -(CH2)kO(CH2)jR8;
c) -(CH2)jNR9aR9b;
d) -(CH2)jCO2R10;
e) -(CH2)jOCO2R10;
f) -(CH2)jCON(R10)2;
g) две группы R2 могут быть взяты вместе с образованием карбонильной группы
h) и их сочетания.
R8, R9a, R9b или R10 каждый независимо обозначает водород, C1-C4алкил и их сочетания; R9a и R9b могут быть взяты вместе с образованием карбоциклического или гетероциклического кольца, содержащего от 3 до 7 атомов; две группы R10 могут быть взяты вместе с образованием карбоциклического или гетероциклического кольца, содержащего от 3 до 7 атомов; значение индекса j составляет от 0 до 5; значение индекса n составляет от 3 до 5.
Как указано выше, значение индекса n определяет размер B-кольца. Первая разновидность скелета структур настоящего изобретения относится к B-кольцам, в которых значение n равно 3, например, соединениям, включающим 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-оновую кольцевую систему, не ограничивающие настоящее изобретение примеры которых включают:
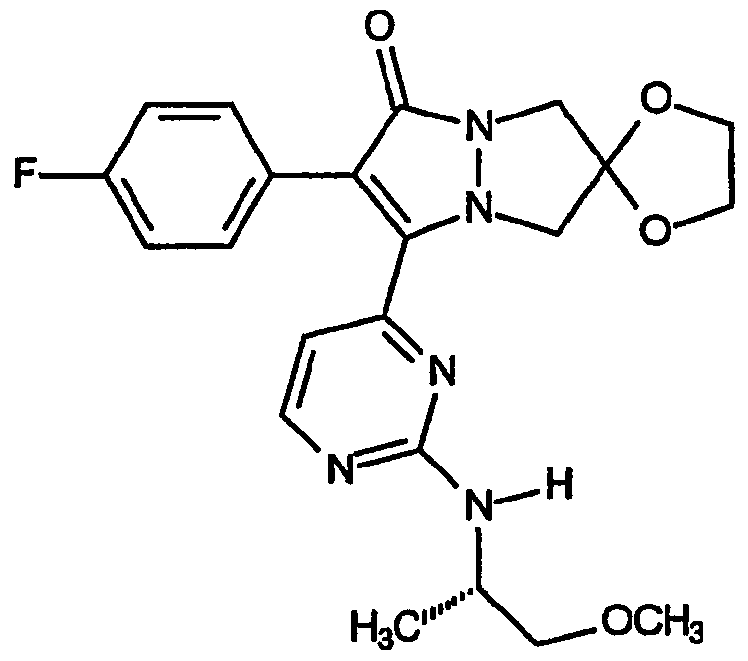
спиро[1,3]диоксолан[2',6]-2-(4-фторфенил)-3-{2-(S)-[(2-метокси-1-метил)этиламино]пиримидин-4-ил}-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]; и
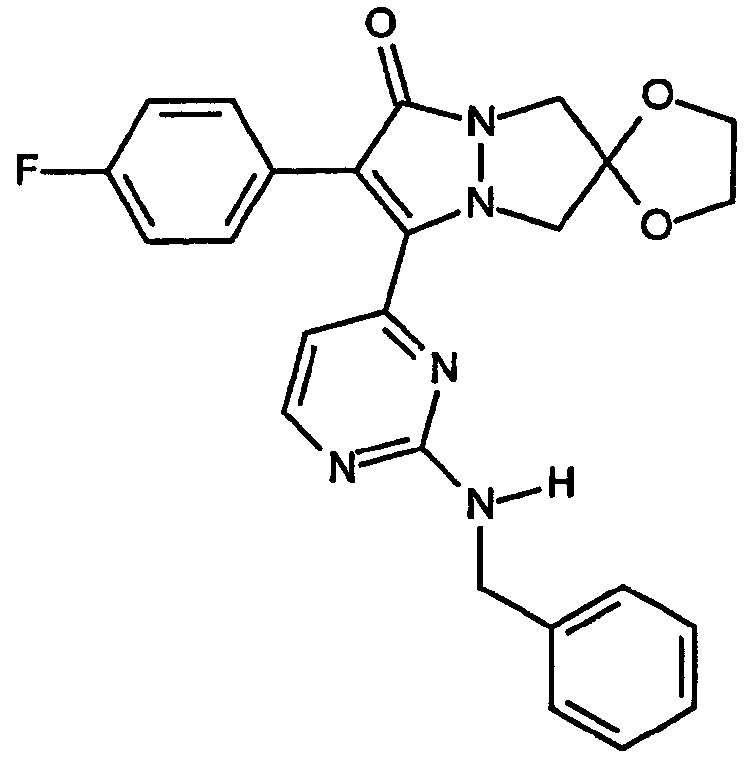
спиро[1,3]диоксолан[2',6]-2-(4-фторфенил)-3-{2-(бензиламино]пиримидин-4-ил}-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он].
Второй вариант осуществления первого аспекта изобретения относится к пиразоло[1,2-a]пиразол-1-оновым кольцевым системам, содержащим спиро[1,3-диоксан], не ограничивающие настоящее изобретение примеры которых включают:
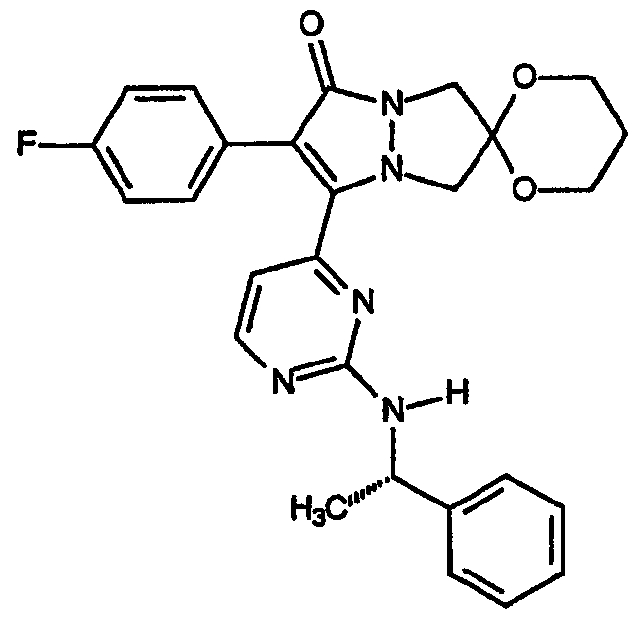
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-{2-(S)-[(α-метил)бензиламино]пиримидин-4-ил}-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]; и
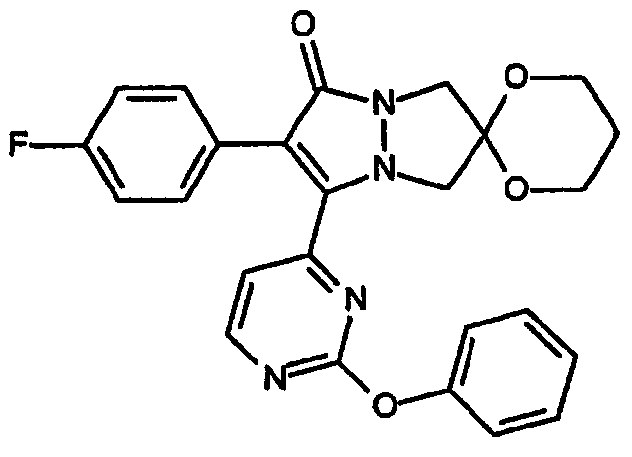
спиро[1,3]диоксан[2',6]-2-(4-фторфенил)-3-[2-(фенокси)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он].
Соединения настоящего изобретения, которые представляют собой аналоги ингибиторов высвобождения воспалительных цитокинов, разделяют на несколько не ограничивающих настоящее изобретение категорий. Некоторые из таких категорий указанных аналогов приведены ниже.
Первая разновидность соединений Категории I, ингибирующих высвобождение воспалительных цитокинов, в соответствии с настоящим изобретением имеет общую структуру формулы:
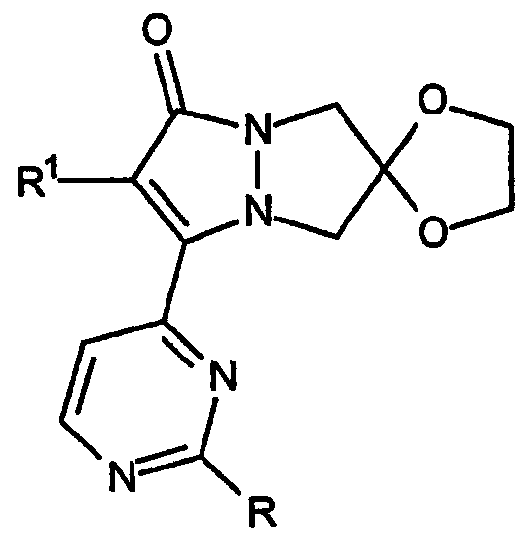
и представляет собой 2',6-спиро[1,3-диоксолан]овые производные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онов, в которых группы R имеют формулу:
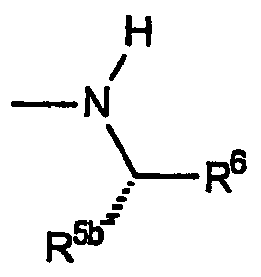
В таблице I ниже приводятся не ограничивающие настоящее изобретение примеры R1, R5b и R6.
Вторая разновидность соединений Категории I, ингибирующих высвобождение воспалительных цитокинов, в соответствии с настоящим изобретением имеет общую структуру формулы:
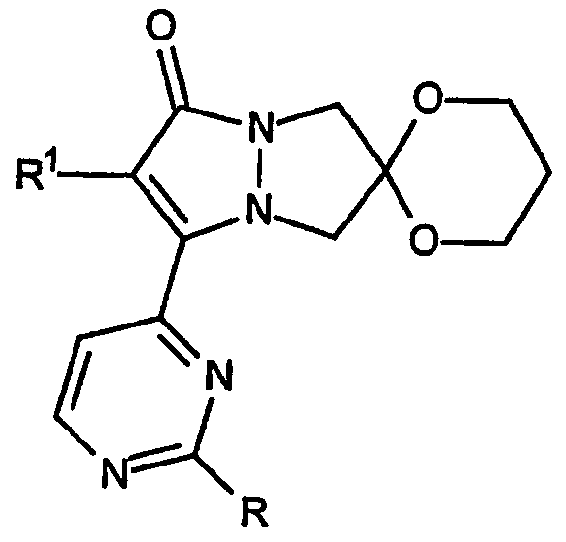
и представляет собой 2',6-спиро[1,3-диоксан]овые производные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онов. Вторая разновидность соединений Категории I относится к соединениям, где группы R имеют формулу:
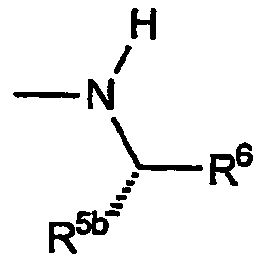
В таблице II ниже приводятся не ограничивающие настоящее изобретение примеры R1, R5b и R6.
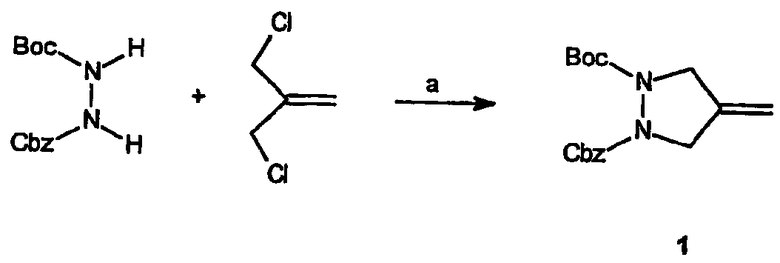
Реагенты и условия: (a) NaH
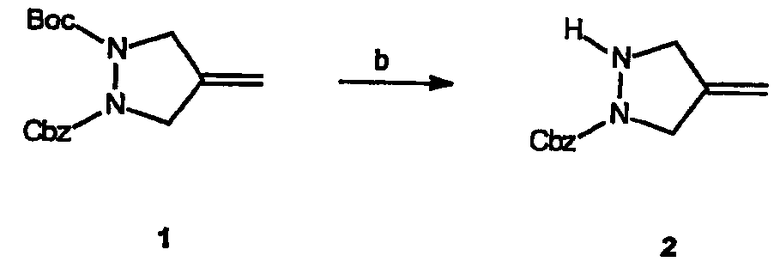
Реагенты и условия: (b) SOCl2, MeOH
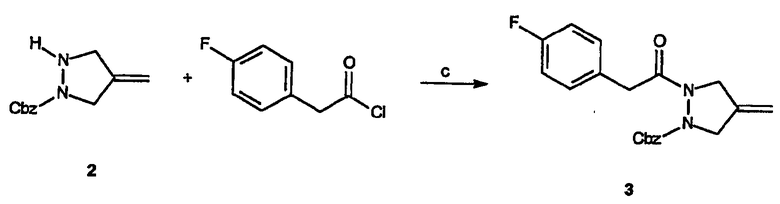
Реагенты и условия: (c) NaOH, CH2Cl2/вода, 18 час при комнатной температуре
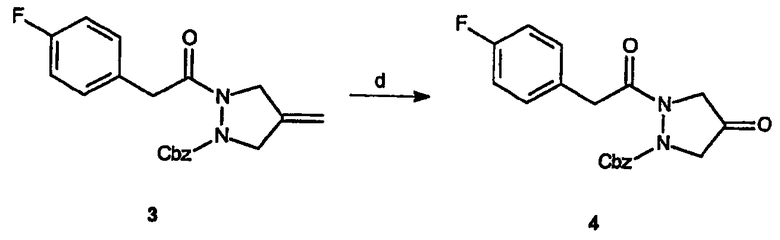
Реагенты и условия: (d) O3, CH2Cl2, ДМСО, от -78°C до комнатной температуры, 18 час.
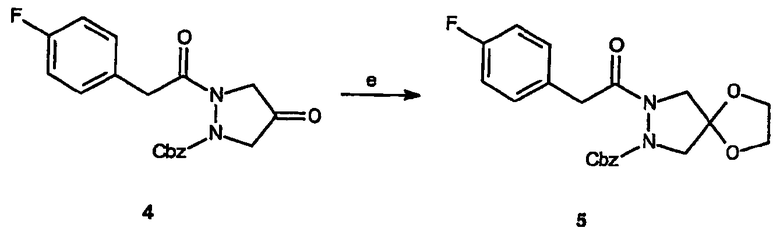
Реагенты и условия: (e) этиленгликоль, TsOH, толуол, кипячение с обратным холодильником в течение 18 час.
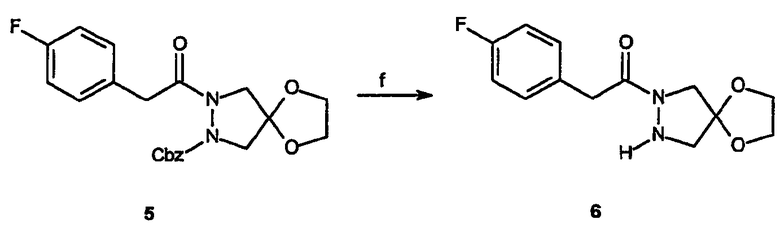
Реагенты и условия: (f) H2:Pd/C, MeOH, 4 час при комнатной температуре
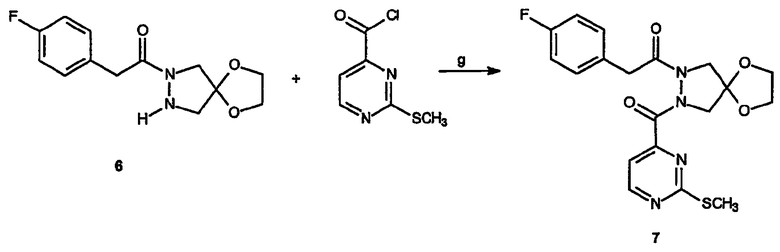
Реагенты и условия: (g) NaOH, CH2Cl2/вода, 12 час при комнатной температуре
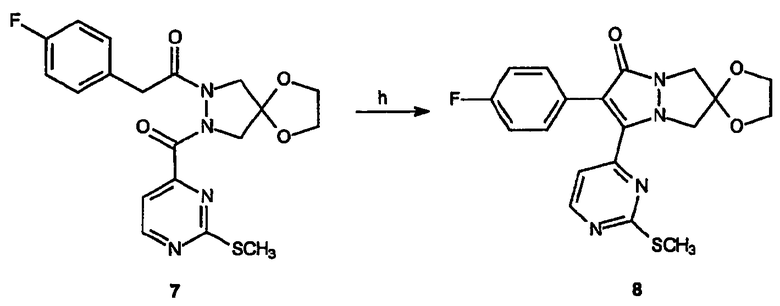
Реагенты и условия: (h) NaH, ДМФА, от 0°C до комнатной температуры, 3 час.
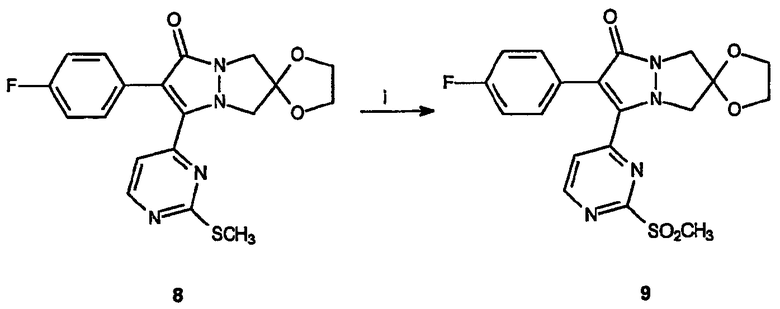
Реагенты и условия: (i) Oxone®, MeOH/ТГФ/вода, 2 час при комнатной температуре
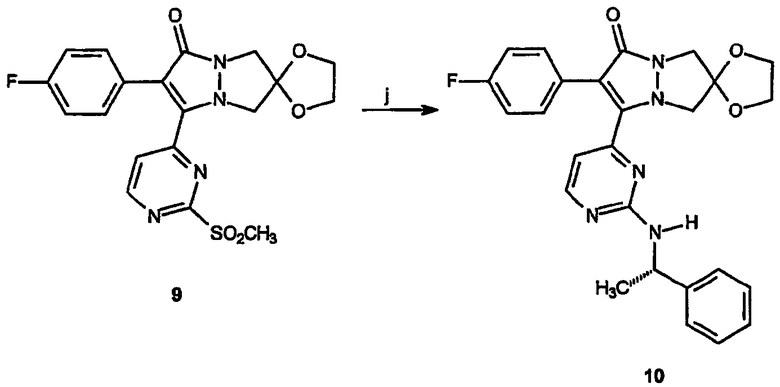
Реагенты и условия: (j) (α)-(-)-метилбензиламин, 3 час при 100°C
ПРИМЕР 1
Спиро[1,3-диоксолан[2',6]-2-[2-(4-фторфенил)ацетил]-3-[2-(1-фенилэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он (10)
Получение 1-бензилового эфира 2-трет-бутилового эфира 4-метиленпиразолидин-1,2-дикарбоновой кислоты (1): К суспензии NaH (3,81 г, 95,4 ммоль) в ДМФА (80 мл) по каплям добавляют раствор N-Cbz-N'-Boc-гидразина (12,1 г, 45,4 ммоль) в ДМФА (20 мл). Реакционную смесь перемешивают в течение приблизительно 20 мин, по каплям добавляют 3-хлор-2-хлорметилпропен (5,8 мл, 50 ммоль) и перемешивают смесь при комнатной температуре до завершения реакции по данным ТСХ. Реакционную смесь распределяют между этилацетатом и водой, водный слой несколько раз экстрагируют растворителем. Объединенные органические слои сушат, фильтруют и концентрируют, получая требуемый продукт в виде бесцветного масла, которое используют затем без дальнейшей очистки.
Получение 1-бензилового эфира 4-метиленпиразолидин-1-карбоновой кислоты (2): К раствору неочищенного 1-бензилового эфира 2-трет-бутилового эфира 4-метиленпиразолидин-1,2-дикарбоновой кислоты, 1, (30 г) в метаноле (300 мл) при 0°C по каплям добавляют тионилхлорид. Реакционную смесь нагревают до комнатной температуры и перемешивают еще в течение 18 час. Реакционную смесь концентрируют в вакууме с получением желтого масла, которое кристаллизуется при стоянии с образованием 23 г (97% выход) требуемого продукта в виде HCl соли.
Получение бензилового эфира 2-[2-(4-фторфенил)ацетил]-4-метиленпиразолидин-1-карбоновой кислоты (3): Гидроксид натрия (0,12 г, 3 ммоль) растворяют при энергичном перемешивании в смеси 1:2 вода/метиленхлорид (30 мл) с последующим добавлением при комнатной температуре 1-бензилового эфира 4-метиленпиразолидин-1-карбоновой кислоты, 2, (0,62 г, 2,8 ммоль). Добавляют (4-фторфенил)ацетилхлорид (0,39 мл, 4,2 ммоль) и затем реакционную смесь перемешивают 18 час, разбавляют водой (10 мл) и слои разделяют. Водный слой экстрагируют метиленхлоридом, органические слои объединяют, сушат и отфильтровывают. Концентрирование в вакууме дает неочищенный продукт, который очищают на силикагеле (1:3 этилацетат/гексан) с получением 0,54 г (выход 62%) требуемого продукта.
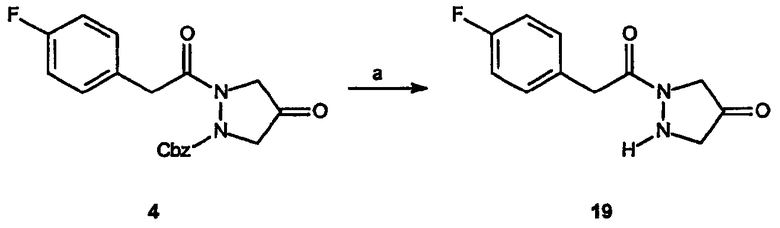
Получение бензилового эфира 2-[2-(4-фторфенил)ацетил]-4-оксопиразолидин-1-карбоновой кислоты (4): Газообразный озон барботируют при -78°C через раствор бензилового эфира 2-[2-(4-фторфенил)ацетил]-4-метиленпиразолидин-1-карбоновой кислоты, 3, (0,28 г, 0,8 ммоль) в метиленхлориде (15 мл) до тех пор, пока раствор не приобретет устойчивый синий цвет. Источник озона перекрывают, добавляют диметилсульфоксид (0,23 мл), дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение 18 час. Растворитель удаляют в вакууме и полученное масло очищают на силикагеле (1:3 этилацетат/гексан), получая 0,15 г (выход 53%) требуемого продукта в виде бесцветного масла.
Получение бензилового эфира спиро[1,3-диоксолан[2',4]-2-[2-(4-фторфенил)ацетил]пиразолидин-1-карбоновой кислоты] (5): В колбу, снабженную насадкой Дина-Старка, помещают бензиловый эфир 2-[2-(4-фторфенил)ацетил]-4-оксопиразолидин-1-карбоновой кислоты, 4, (4,0 г, 11,2 ммоль), этиленгликоль (6,26 мл, 112 ммоль), толуолсульфокислоту (400 мг) и толуол (40 мл). Смесь кипятят с обратным холодильником в течение 3 дней, концентрируют в вакууме, получая масло коричневого цвета, которое растворяют в CH2Cl2, промывают NaHCO3, сушат и концентрируют до коричневого масла. Выделенный неочищенный продукт очищают на силикагеле (этилацетат/гексан 1:3) с получением 2,68 г (выход 59,7%) требуемого продукта.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-пиразолидин-1-илэтанона (6): Бензиловый эфир спиро[1,3-диоксолан[2',4]-2-[2-(4-фторфенил)ацетил]пиразолидин-1-карбоновой кислоты, 5, (400 мг, 1 ммоль) растворяют в метаноле и добавляют Pd/C (40 мг). Раствор затем гидрируют, используя аппарат гидрирования Парра, в течение 4 час, после чего катализатор удаляют фильтрованием и фильтрат концентрируют в вакууме, получая 265 мг (выход 99%) требуемого продукта в виде бледно-коричневого твердого вещества.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-[2-(2-метилсульфанилпиримидин-4-карбонил)пиразолидин-1-ил]этанона] (7): К раствору спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-пиразолидин-1-илэтанона, 6, (265 мг, 1 ммоль) в дихлорметане (2 мл) добавляют 2-метилсульфонилпиримидин-4-карбонилхлорид (375 мг, 2 ммоль), с последующим добавлением по каплям 1,0 N водного раствора гидроксида натрия (3,5 мл). Смесь энергично перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь разбавляют дихлорметаном (10 мл) и промывают водой (10 мл). Водный слой дополнительно экстрагируют дихлорметаном (10 мл). Объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия (10 мл) и насыщенным раствором соли (10 мл), сушат, фильтруют и концентрируют в вакууме. Полученный неочищенный продукт очищают на силикагеле (от 1:1 гексан/этилацетат до 100% этилацетата) с получением 314 мг (выход 75%) требуемого продукта в виде бесцветного масла.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-метилсульфанилпиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она] (8): Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-[2-(2-метилсульфанилпиримидин-4-карбонил)пиразолидин-1-ил]этанон], 7, (314 мг, 0,75 ммоль) растворяют в ТГФ (5 мл). Полученный раствор затем через канюлю по каплям при 0°C добавляют к суспензии NaH (45 мг 60% суспензии в минеральном масле, 1,1 ммоль). Реакционной смеси дают постепенно нагреться до комнатной температуры, затем ТГФ отгоняют в вакууме. Полученный остаток растворяют в дихлорметане и промывают водой. Водный слой дополнительно экстрагируют дихлорметаном, органические слои объединяют, сушат и концентрируют в вакууме, получая неочищенный продукт, который очищают на силикагеле (от 100% этилацетата до 5%, 10%, 20% смеси метиловый спирт/этилацетат) с получением 44 мг (выход 19,6%) требуемого продукта в виде желтого твердого вещества.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-метансульфонилпиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она] (9): К раствору спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-метилсульфанилпиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она], 8, (44 мг, 0,1 ммоль) в смеси ТГФ/метанол/вода (5 мл смеси 2:1:2) по каплям добавляют раствор Oxone® (пероксимоносульфат натрия)(270 мг, 0,4 ммоль) в воде. Реакционной смеси дают нагреться до комнатной температуры, распределяют между CH2Cl2 и водой, водный слой повторно экстрагируют растворителем, после чего органические слои объединяют, сушат и концентрируют в вакууме, получая 45 мг (выход 95%) неочищенного продукта, представляющего собой смесь сульфоксида и сульфона, который используют без дальнейшей очистки.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[(2-(S)-(α)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она] (10): Неочищенный спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-метансульфонилпиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он], 9, полученный как описано выше (100 мг, 0,23 ммоль), и (S)-(-)-α-метилбензиламин (2 мл) растворяют в толуоле (2 мл). Полученную смесь нагревают при 100°C в течение 3 час, охлаждают до комнатной температуры и растворитель удаляют в вакууме. Полученный остаток очищают на силикагеле (1:1 EtOAc/гексан) с получением 77 мг (выход 70%) указанного в заголовке продукта в виде желтого твердого вещества. 1H-ЯМР (CDCl3, 300 МГц) δ 1,60 (д, 3H, J=6,9Гц), 3,92-4,09 (м, 8H), 5,15 (кв, 1H, J= 5,1, 6,9Гц), 5,67 (д, 1H, J=5,1Гц), 6,41 (д, 1H, J=5,1Гц), 7,01-7,07 (м, 2H), 7,26-7,43 (м, 7H), 8,18 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 474,27 (100, М++Н). Элементный анализ: Вычислено для C26H24FN5O3.0,25H2O: C 65,33; H 5,17; N 14,65. Найдено: C 65,22; H 4,58; N 14,19.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-метоксиэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1Н-ЯМР (CDCl3, 300 МГц) δ 1,31 (д, 3Н, J=6,6Гц), 3,42 (с, 3Н), 3,48 (д, 3Н, J=4,8Гц), 4,07-4,11 (м, 6Н), 4,16 (д, 2H, J=3,6Гц), 4,20-4,30 (м, 1Н), 6,44 (д, 1Н, J=5,1Гц), 7,04-7,10 (м, 2Н), 7,41-7,46 (м, 2H ), 8,15 (д, 1Н, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 442,25 (100, М++Н) Элементный анализ: Вычислено для C22H24FN5O4.0,25Н2О: С 59,25; Н 5,54; N 15,70. Найдено: С 59,37; Н 5,17; N 15,52.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(бензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,61-3,86 (м, 8Н), 4,51 (д, 2Н, J=5,89Гц), 6,29 (д, 1Н, J=5,2Гц), 6,87-7,09 (м, 2Н), 7,11-7,25 (м, 7Н), 7,99 (д, 1Н, J=5,2Гц). HRMS: m/z (относительная интенсивность) для C25H22FN5O3. Вычислено 460,1785 (М++Н), найдено 460,1775.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-гидрокси-2-метилпропиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1Н-ЯМР (CDCl3, 300 МГц) δ 1,25-1,31 (м, 9Н), 4,05-4,11 (м, 9Н), 5,48 (д, 1Н, J=8,7Гц), 6,43 (д, 1Н, J=5,1Гц), 7,03-7,09 (м, 2Н), 7,41-7,46 (м, 2Н), 8,17 (д, 1Н, J=5,1Гц); HRMS: Вычислено для C23H26FN5O4 456,2047 (М++Н), найдено 456,2059.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(циклопропиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 0,59-0,64 (м, 2Н), 0,87 (кв, 2H, J=12,3, 6Гц), 2,78-2,82 (м, 1Н), 4,06-4,11 (м, 6Н), 4,23 (с, 2Н), 5,50 (с, 1Н), 6,50 (д, 1Н, J=5,1Гц), 7,04-7,10 (м, 2Н), 7,42-7,47 (м, 2Н), 8,23 (д, 1Н, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 410,24 (100, М++Н).
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(2-фторбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,96-4,10 (м, 8Н), 4,74 (д, 2Н, J=6,3Гц), 5,73 (с, 1Н), 6,47 (д, 1Н, J=5,1Гц), 7,03-7,16 (м, 4Н), 7,26-7,45 (м, 4Н), 8,22 (д, 1Н, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 478,1 (100, М++Н). Элементный анализ: Вычислено для C25H21F2N5O3.0,75H2O: C 61,16; H 4,62; N 14,26. Найдено: C 61,26; H 4,39; N 14,13.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(3-фторбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,96-4,05 (м, 8Н), 4,69 (д, 2Н, J=6,3Гц), 5,79 (с, 1Н), 6,49 (д, 1Н, J=5,1Гц), 6,98-7,16 (м, 4Н), 7,28-7,45 (м, 4Н), 8,23 (д, 1Н, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 478,1 (100, М++Н). Элементный анализ: Вычислено для C25H21F2N5O3.0,5H2O: C 61,72; H 4,56; N 14,40. Найдено: C 61,84; H 4,21; N 14,28.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(2-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,95-4,08 (м, 8Н), 4,91 (д, 2H, J=6,0Гц), 5,79 (с, 1H), 6,50 (д, 1H, J=5,1Гц), 7,06 (т, 2H, J=8,7Гц), 7,39-7,44 (м, 3H), 7,52-7,57 (м, 2H), 7,72 (д, 1H, J=7,8Гц), 8,23 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 528,2 (100, М++Н).
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(3-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,94-4,04 (м, 8H), 4,75 (д, 2H, J=6,3Гц), 5,79 (с, 1H), 6,50 (д, 1H, J=5,1Гц), 7,03-7,08 (м, 2H), 7,39-7,62 (м, 6H), 8,24 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 528,24 (100, М++Н).
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(4-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,90-4,03 (м, 8H), 4,75 (д, 2H, J=6,0Гц), 5,86 (с, 1H), 6,49 (д, 1H, J=5,1Гц), 7,02-7,08 (м, 2H), 7,39-7,50 (м, 4H), 7,63 (д, 2H, J=8,4Гц), 8,23 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 528,24 (40, М++Н).
Аналоги, которые охватывает вторая разновидность соединений Категории I, могут быть синтезированы путем замены этиленгликоля 1,3-пропиленгликолем при получении промежуточного соединения 5, как это показано ниже для получения промежуточного соединения 11.
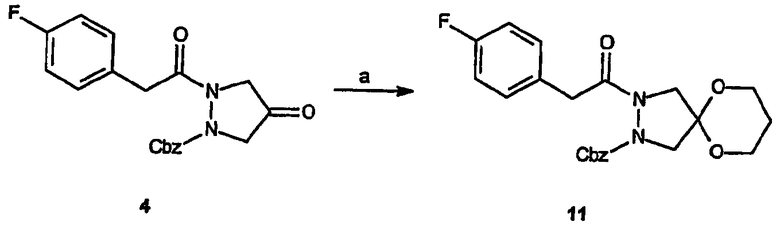
Реагенты и условия: (a) пропиленгликоль, TsOH, толуол, кипячение с обратным холодильником в течение 18 час.
Спиро[5',5'-диметил-1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 0,92 (с, 3H), 1,13 (с, 3H), 1,61 (д, 3H, J=6,9Гц), 3,45-3,58 (м, 5H), 3,84 (уш.с, 1H), 4,07-4,11 (м, 1H),4,31 (д, 1H, J=11,4Гц), 5,18 (квинт, 1H, J=6,6Гц), 5,64 (д, 1H, J=6,9Гц), 6,41 (д, 1H, J=4,8Гц), 7,04 (т, 2H, J=8,7Гц), 7,28-7,42 (м, 7H), 8,18 (д, 1H, J=4,8Гц). ESI+ МС: m/z (относительная интенсивность) 516,2 (100, М++Н). Элементный анализ: Вычислено для C29H30FN5O3: C 67,56; H 5,86; N 13,58. Найдено: C 67,46; H 5,44; N 13,42.
Спиро[5',5'-диметил-1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-метоксиэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 0,95 (с, 3H), 1,14 (с, 3H), 1,32 (д, 3H, J=6,6Гц), 3,43 (с, 3H), 3,48 (д, 2H, J=4,5Гц), 3,61 (дд, 4H, J=16,5, 11,4Гц), 4,25 (д, 4H, J=10,2Гц), 5,43 (д, 1H, J=7,5Гц), 6,42 (д, 1H, J=5,1Гц), 7,03-7,09 (м, 2H), 7,41-7,46 (м, 2H), 8,19 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 484,1 (100, М++Н).
Первой разновидностью соединений Категории II, ингибирующих высвобождение воспалительных цитокинов, в соответствии с настоящим изобретением являются простые эфиры, имеющие общий скелет структуры формулы:
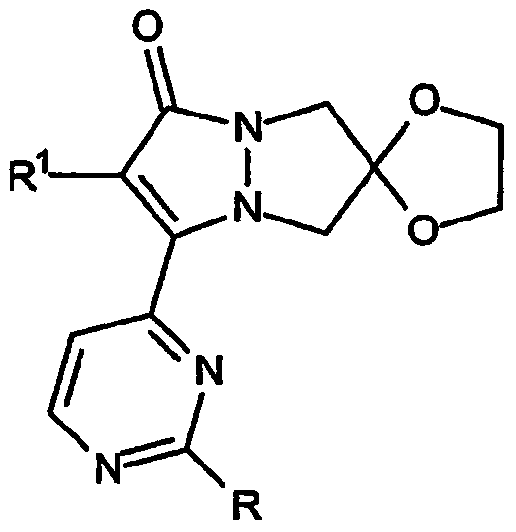
которые представляют собой 2',6-спиро[1,3-диоксолан]овые производные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онов, в которых группы R имеют формулу -OR3. В таблице III приведены не ограничивающие настоящее изобретение примеры R1 и R3.
Вторая разновидность соединений Категории II, ингибирующих высвобождение воспалительных цитокинов, в соответствии с настоящим изобретением включает общий скелет структуры формулы:
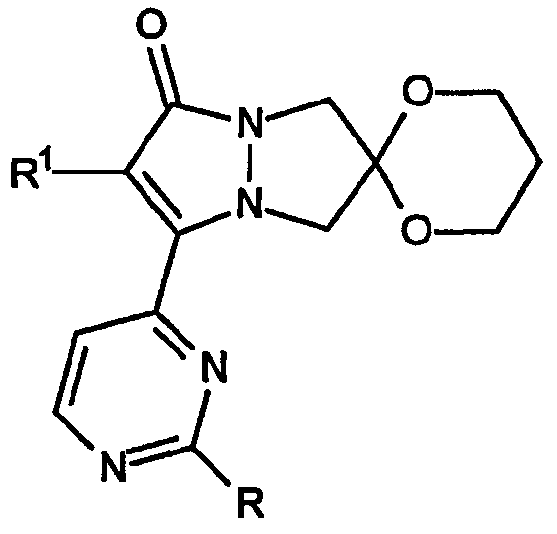
и представляет собой 2',6-спиро[1,3-диоксан]овые производные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онов, в которых группы R имеют формулу -OR3. В таблице IV приведены не ограничивающие настоящее изобретение примеры R1 и R3.
Соединения, которые составляют Категорию II аналогов настоящего изобретения, получают, используя аналогичный путь синтеза, но предварительно, до формирования конечного скелета структуры 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она, вводят в пиримидиновое кольцо группу R. Следующая схема поясняет синтез соединения 16 и пример получения промежуточного соединения, используемого для получения соединений Категории II.
Общая схема получения промежуточных простых эфиров пиримидина
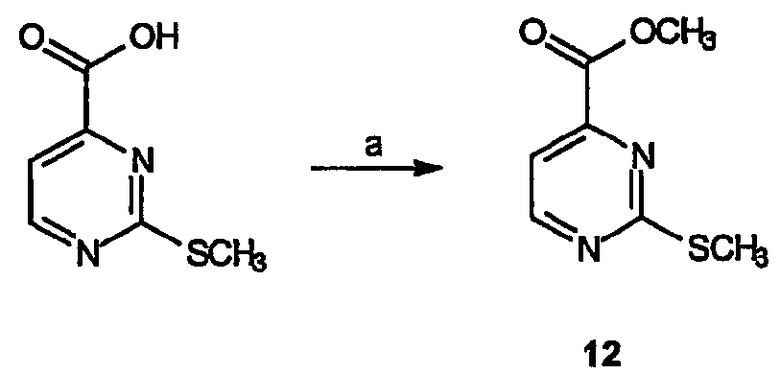
Реагенты и условия: (a) SOCl2, MeOH, 12 час при комнатной температуре
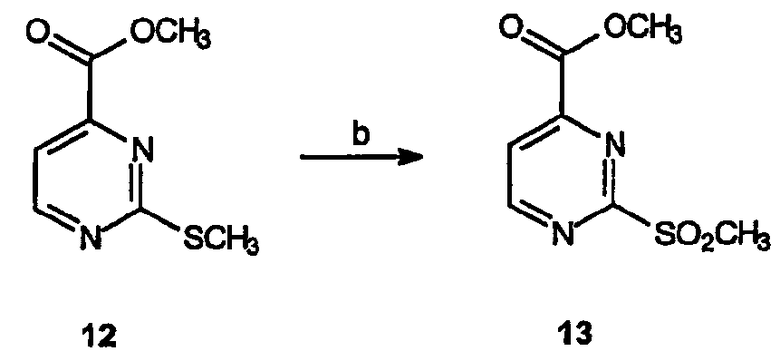
Реагенты и условия: (b) Oxone®, MeOH/ТГФ/H2O, 12 час при комнатной температуре
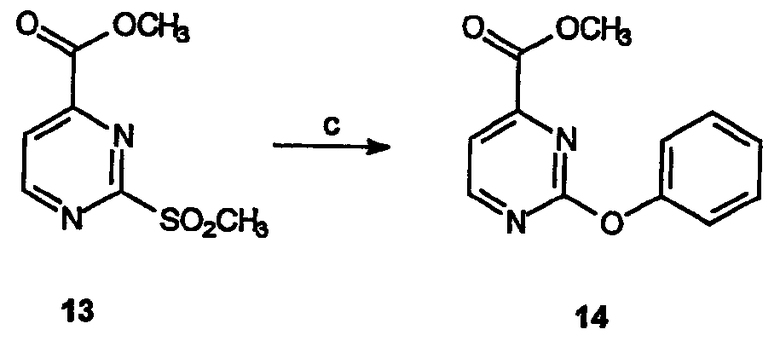
Реагенты и условия: (c) фенол, NaH, ТГФ, 12 час при комнатной температуре
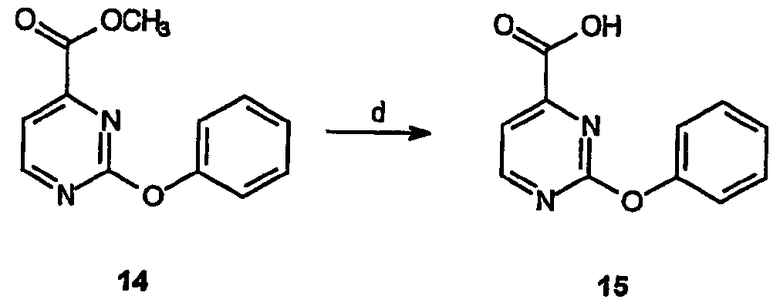
Реагенты и условия: (d) NaOH, MeOH/H2O, 1,5 часа при комнатной температуре
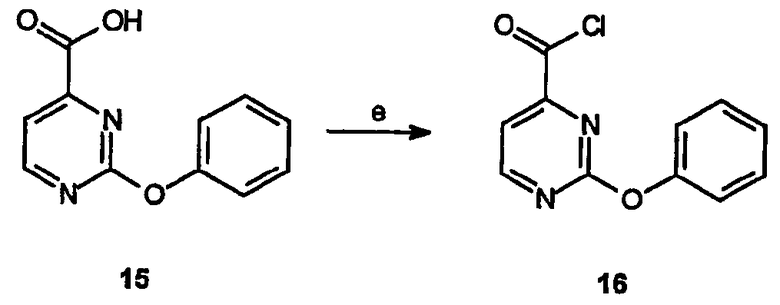
Реагенты и условия: (e) оксалилхлорид, CH2Cl2/ДМФА, 2 часа при комнатной температуре
ПРИМЕР 2
2-Феноксипиримидин-4-карбонилхлорид (16)
Получение метилового эфира 2-метилсульфанилпиримидин-4-карбоновой кислоты (12): К суспензии 2-метилсульфанилпиримидин-4-карбоновой кислоты (15 г, 88 ммоль) в метаноле (200 мл) по каплям добавляют тионилхлорид (25 мл). Смеси дают нагреться до комнатной температуры и перемешивают в течение 12 час. Затем раствор концентрируют в вакууме, остаток в виде желтого твердого вещества растворяют в метиленхлориде и вновь концентрируют, получая 19 г (выход 97%) HCl соли требуемого продукта в виде белого твердого вещества.
Получение метилового эфира 2-метансульфонилпиримидин-4-карбоновой кислоты (13): Водный раствор (1 л) Oxone® (211,7 г, 344 ммоль) при 0°C по каплям добавляют к раствору метилового эфира 2-метилсульфанилпиримидин-4-карбоновой кислоты, 12, (19 г, 86,1 ммоль) в смеси 1:1 метанол/ТГФ (1 л). Реакционному раствору дают нагреться до комнатной температуры и перемешивают в течение 1,5 час. Полученную суспензию распределяют между метиленхлоридом и водой. Водную фазу подщелачивают добавлением NaOH и дополнительно экстрагируют растворителем. Объединенные органические слои сушат, фильтруют и концентрируют в вакууме, получая 18,4 г требуемого продукта в виде желтого масла.
Получение метилового эфира 2-феноксипиримидин-4-карбоновой кислоты (14): NaH (3,5 г 60% суспензии, 87,4 ммоль) добавляют при комнатной температуре к раствору фенола (8,23 г, 87,4 ммоль) в ТГФ (100 мл). Метиловый эфир 2-метансульфонилпиримидин-4-карбоновой кислоты, 13,(6,3 г, 29,1 ммоль) растворяют в ТГФ (60 мл) и по каплям добавляют к раствору фенола. Реакционную смесь перемешивают 12 час, затем реакцию гасят добавлением насыщенного водного NH4Cl. Водную фазу экстрагируют метиленхлоридом, объединенные органические слои сушат, фильтруют и концентрируют в вакууме, получая неочищенный продукт, который очищают на силикагеле (этилацетат/гексан 2:3) с получением 1,72 г (выход 25%) требуемого продукта в виде белого твердого вещества.
Получение 2-феноксипиримидин-4-карбоновой кислоты (15): К раствору метилового эфира 2-феноксипиримидин-4-карбоновой кислоты, 14, (1,72 г, 74,8 ммоль) в метаноле (50 мл) при комнатной температуре добавляют 50% раствор NaOH (10 мл). После перемешивания в течение 1,5 часов растворитель отгоняют в вакууме и полученную водную фазу экстрагируют этилацетатом. Затем водную фазу осторожно подкисляют концентрированной HCl и образовавшееся белое твердое вещество дважды экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют в вакууме, получая 0,95 г (выход 60%) требуемого продукта в виде белого твердого вещества.
Получение 2-феноксипиримидин-4-карбонихлорида (16): К раствору 2-феноксипиримидин-4-карбоновой кислоты, 15, (0,19 г, 0,89 ммоль) в метиленхлориде (10 мл), содержащем несколько капель ДМФА, добавляют оксалилхлорид (0,1 мл). Раствор перемешивают при комнатной температуре в течение 2 час и концентрируют в вакууме, получая требуемый продукт, который используют без дальнейшей очистки.
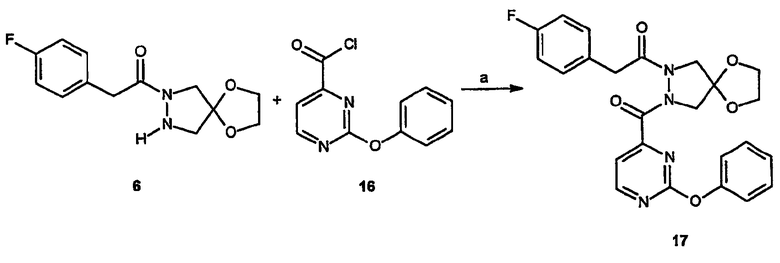
Реагенты и условия: (a) NaOH: CH2Cl2/вода, 12 час при комнатной температуре
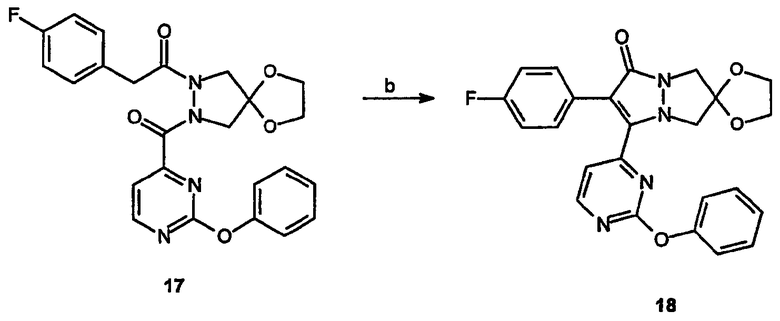
Реагенты и условия: (b) NaH, ДМФА, 0°C, 2 часа.
ПРИМЕР 3
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он (18)
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-[2-(2-феноксипиримидин-4-карбонил]пиразолидин-1-ил]этанона (17): 2-Феноксипиримидин-4-карбонилхлорид, 16, (0,066 г, 0,28 ммоль) в метиленхлориде (1,5 мл) по каплям добавляют при комнатной температуре к суспензии спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-пиразолидин-1-илэтанона, 6, (0,05г, 0,18 ммоль) в смеси 2:5 вода/CH2Cl2 (7 мл), содержащей NaOH (0,0112 г, 0,28 ммоль). Раствор перемешивают в течение 18 час и разбавляют, добавляя дополнительное количество смеси 2:5 вода/CH2Cl2. Слоям дают разделиться и водную фазу дополнительно экстрагируют метиленхлоридом. Органические слои объединяют, сушат, фильтруют и концентрируют в вакууме, получая требуемый продукт.
Получение спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она (18): К раствору спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-1-[2-(2-феноксипиримидин-4-карбонил]пиразолидин-1-ил]этанона, 17, (0,19 г, 0,4 ммоль) в ДМФА (10 мл) при 0°C добавляют NaH (0,024 г, 0,6 ммоль) и полученный раствор перемешивают в течение 2 час. Растворитель удаляют в вакууме, остаток растворяют в метиленхлориде и экстрагируют водой, сушат и вновь концентрируют, получая требуемый продукт.
Спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[(2-фторфенокси)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 3,87 (с, 2H), 3,98-4,12 (м, 6H), 6,96 (д, 1H, J=5,4Гц), 7,09-7,15 (м, 2H), 7,25-7,43 (м, 6H), 8,50 (д, 1H, J=5,4Гц). ESI+ МС: m/z (относительная интенсивность) 465,2 (100, М++Н). Элементный анализ: Вычислено для C24H18F2N4O4.0,5H2O: C 60,89; H 4,05; N 11,83. Найдено: C 61,26; H 3,72; N 11,63.
Соединения, которые составляют вторую разновидность соединений Категории II, могут быть получены по аналогичным синтетическим схемам, указанным выше, если вместо промежуточного соединения 6 взять промежуточное соединение 11.
Спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он]: 1H-ЯМР (CDCl3, 300 МГц) δ 1,75-1,94 (м, 2H), 3,82-3,98 (м, 6H), 4,24 (с, 2H), 6,91 (д, 1H, J=5,4Гц), 7,08-7,14 (м, 2H), 7,24-7,42 (м, 5H), 7,48-7,54 (м, 2H), 8,49 (д, 1H, J=5,4Гц). ESI+ МС: m/z (относительная интенсивность) 460,9 (100, М++Н). Элементный анализ: Вычислено для C25H21FN4O4.H2O: C 62,76; H 4,85; N 11,71. Найдено: C 62,57; H 4,22; N 11,57.
Первой разновидностью соединений Категории III, ингибирующих высвобождение воспалительных цитокинов, в соответствии с настоящим изобретением являются простые эфиры, имеющие общий селет структуры формулы:
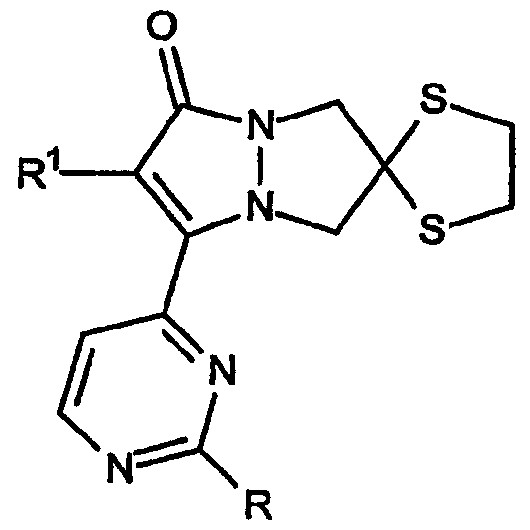
которые представляют собой 2',6-спиро[1,3-дитиолан]овые производные 6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-онов, в которых группы R имеют формулу -OR3. В таблице V приведены не ограничивающие настоящее изобретение примеры R и R1.
На следующих схемах приведены методы получения соединений Категории III по настоящему изобретению.
Реагенты и условия: (a)
Реагенты и условия: (b)
Реагенты и условия: (c)
Реагенты и условия: (d)
ПРИМЕР 4
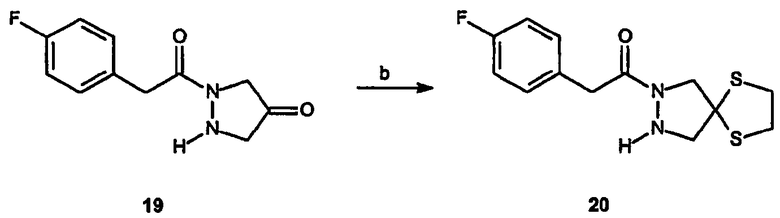
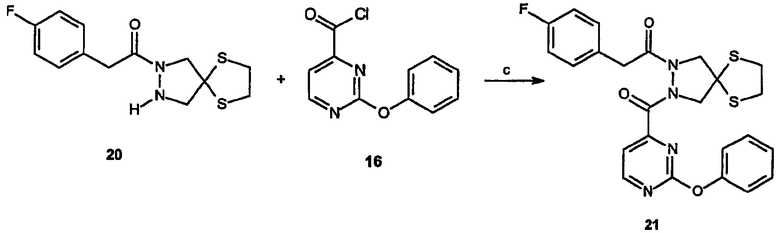
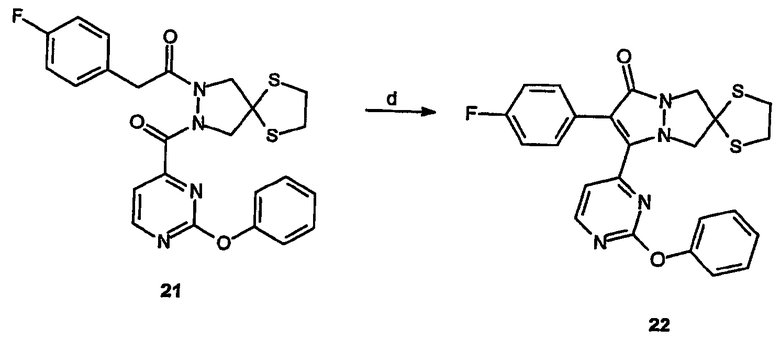
Спиро[1,3-дитиолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он (22)
Получение 1-[2-(4-фторфенил)ацетил]пиразолидин-4-она (19): К раствору бензилового эфира 2-[2-(4-фторфенил)ацетил]-4-оксопиразолидин-1-карбоновой кислоты, 4, (1 г, 4,5 ммоль) в метаноле (30 мл) добавляют Pd/C (100 мг). Колбу подсоединяют к баллону с водородом и смесь перемешивают в течение 3 час. Раствор фильтруют, чтобы удалить катализатор, и концентрируют в вакууме, получая 0,8 г требуемого продукта в виде желтого масла, которое используют без дальнейшей очистки.
Получение спиро[1,3-дитиолан[2',4]-2-[(4-фторфенил)-1-пиразолидин-1-ил]этанона (20): К раствору 1-[2-(4-фторфенил)ацетил]пиразолидин-4-она, 19, (0,4 г, 1,8 ммоль) и 1,2-этандитиола (0,23 мл, 2,7 ммоль) в метиленхлориде (13 мл) добавляют эфират трифторида бора (0,4 мл). Реакционную смесь перемешивают в течение 18 час, после чего раствор экстрагируют 0,1 N HCl, насыщенным раствором соли, сушат и концентрируют в вакууме, получая неочищенный продукт, который используют без дальнейшей очистки.
Получение спиро[1,3-дитиолан[2',4]-2-(4-фторфенил)-1-[2-(2-феноксипиримидин-4-карбонил)пиразолидин-1-ил]этанона] (21): К суспензии спиро[1,3-дитиолан[2',4]-2-[(4-фторфенил)-1-пиразолидин-1-ил]этанона, 20, (0,25 г, 0,83 ммоль) и NaOH (0,05 г, 1,2 ммоль) в смеси 5:3 метиленхлорид/вода (8 мл) добавляют 2-феноксипиримидин-4-карбонилхлорид, 16, (0,295 г, 1,2 ммоль). Реакционный раствор перемешивают при комнатной температуре в течение 18 час, после чего слои разделяют и органическую фазу промывают 20% NaHCO3, насыщенным раствором соли, сушат и концентрируют в вакууме, получая остаток, который очищают методом ВЭЖХ с получением 0,35 г требуемого продукта.
Получение спиро[1,3-дитиолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-она] (22): К раствору спиро[1,3-дитиолан[2',4]-2-(4-фторфенил)-1-[2-(2-феноксипиримидин-4-карбонил)пиразолидин-1-ил]этанона], 21, (0,35 г, 0,7 ммоль) в ДМФА (5 мл) при -5°C добавляют NaH (0,42 г, 1,1 ммоль) и перемешивают в указанных условиях в течение 1 часа. Реакционную смесь разбавляют метиленхлоридом и промывают 0,1 N HCl. Кислые слои подщелачивают и экстрагируют метиленхлоридом, органические слои объединяют, промывают насыщенным раствором соли, сушат и концентрируют в вакууме с получением 0,1 г (выход 30%) требуемого продукта. 1H-ЯМР (CDCl3, 300 МГц) δ 3,35-3,50 (м, 4H), 4,09 (с, 2H), 4,46 (с, 2H), 6,93 (д, 1H, J=5,1Гц), 7,10-7,17 (м, 2H), 7,23-7,43 (м, 5H), 7,48-7,53 (м, 2H), 8,52 (д, 1H, J=5,1Гц). ESI+ МС: m/z (относительная интенсивность) 478,9 (100, М++Н). Элементный анализ: Вычислено для C24H19FN4O2S2.0,5H2O: C 59,12; H 4,13; N 11,49. Найдено: C 58,87; H 3,95; N 11,91.
Ниже приведены не ограничивающие настоящее изобретение примеры соединений в соответствии с настоящим изобретением.
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[(2-(S)-(α)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1,1-диметилэтиламино)пиримидин-4-ил)-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(бензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-{2-[(2-метилфенил)метиламино]пиримидин-4-ил}-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он].
Аналоги (соединения) настоящего изобретения собраны в несколько категорий с тем, чтобы помочь специалисту в выборе правильной стратегии синтеза тех аналогов, которые полностью не приведены в данном описании в качестве примеров. Группирование в категории ни в коей мере не предполагает повышение или уменьшение эффективности любой из приводимых в данном описании композиций, содержащих соединения по настоящему изобретению.
Было обнаружено, что во многих случаях перечисленные и описанные выше соединения проявляют активность на уровне ниже 1 микромоль (μM) (по значениям IC50, полученным на основе анализов в клетках, которые приведены ниже, или на основании анализов, которые указаны в литературе, приведенной в качестве ссылки).
Соединения настоящего изобретения способны эффективно блокировать продуцирование воспалительных цитокинов в клетках и тем самым позволяют смягчать, облегчать, регулировать, ослаблять, замедлять или предупреждать одно или более болезненных состояний или синдромов, которые связаны с внеклеточным высвобождением одного или большего количества цитокинов. Воспалительные болезненные состояния включают такие болезненные состояния, которые относятся к следующим примерам, не лимитирующим настоящее изобретение:
i) Интерлейкин-1 (IL-1): Вовлекается в процесс в качестве молекулы, которая ответствена за большое количество болезненных состояний, в том числе ревматоидного артрита, остеоартрита, а также других болезненных состояний, которые относятся к деградации соединительной ткани.
ii) Циклоксигеназа-2 (COX-2): Ингибиторы высвобождения цитокинов предложены в качестве ингибиторов стимулируемой экспрессии COX-2, которая, как было показано, усиливается цитокинами. M.K.O'Banion et al., Proc. Natl. Acad. Sci. USA., 89, 4888 (1998).
iii) Фактор альфа, вызывающий некроз опухолевых клеток (TNF-α): Этот провоспалительный цитокин предложен в качестве важного медиатора при многих болезненных состояниях или синдромах, в том числе ревматоидного артрита, остеоартрита, заболеваний, связанных с воспалением кишечника (IBS), септического шока, легочно-сердечной дисфункции, острого респираторного заболевания и кахексии.
Каждое из болезненных состояний, которое собирается лечить специалист, может потребовать для достижения терапевтического порога различных уровней или количеств описываемых в настоящем изобретении соединений. Специалист может определить это количество с помощью любой методики испытаний, известной в данной области.
Настоящее изобретение относится далее к формам соединений настоящего изобретения, которые в физиологических условиях, нормальных для человека или высших млекопитающих, высвобождают приведенные в настоящем описании соединения. Одним вариантом данного аспекта являются фармацевтически приемлемые соли аналогов, описанных в настоящей заявке. Специалист в данной области, в целях обеспечения совместимости со способом доставки, эксципиентами и т.п., может выбрать ту или иную солевую форму аналогов настоящего изобретения, поскольку сами соединения являются активными веществами, смягчающими протекание описываемых болезненных процессов.
С этим аспектом изобретения связаны различные предшественники «пролекарственных» форм аналогов настоящего изобретения. Может оказаться желательным получить композиции из соединений настоящего изобретения в виде их химических производных, которые сами не активны по отношению к активности цитокинов, рассматриваемой в настоящем изобретении, а вместо этого представляют собой формы аналогов настоящего изобретения, которые после введения в организм человека или высшего млекопитающего претерпевают химическое превращение, катализируемое нормальными функциями внутри организма, в частности ферментами, которые находятся в желудке, сыворотке крови, при этом указанное химическое превращение приводит к высвобождению исходного аналога. Термин «пролекарство» относится к таким производным, которые в условиях in vivo превращаются в активный фармацевтический препарат.
КОМПОЗИЦИИ
Настоящее изобретение также относится к композициям или составам, включающим соединения настоящего изобретения, которые ингибируют высвобождение воспалительных цитокинов. В общем случае композиции настоящего изобретения содержат:
a) эффективное количество одного или нескольких бициклических пиразолонов или их производных по настоящему изобретению, которые эффективны для ингибирования высвобождения воспалительных цитокинов; и
b) один или несколько фармацевтически приемлемых эксципиентов.
В соответствии с настоящим изобретением термины «эксципиент» и «носитель» используют в данном описании как равнозначные, при этом указанные термины определены как «ингредиенты, которые используют на практике для приготовления безопасных и эффективных фармацевтических композиций».
Для специалиста должно быть понятно, что эксципиенты в первую очередь способствуют доставке надежного, устойчивого и функционально способного фармацевтического препарата, при этом они играют роль не только как составляющие общего носителя для доставки, но и как средства достижения эффективной абсорбции активного ингредиента реципиентом. Функция эксципиента может быть простой и прямой, как инертного наполнителя, или же эксципиент, который используется в настоящем изобретении, может быть частью системы стабилизации рН или частью покрытия, которое обеспечивает безопасное попадание ингредиентов в желудок. Специалист может также использовать то преимущество, что соединения настоящего изобретения обладают лучшей клеточной активностью, фармакокинетическими свойствами, а также улучшенной биодоступностью при пероральном введении.
Настоящее изобретение относится также к композициям или составам, которые содержат предшественник или «пролекарственную» форму соединений настоящего изобретения, которые ингибируют высвобождение воспалительных цитокинов. В общем случае указанные композиции настоящего изобретения, содержащие соединения-предшественники, включают:
a) эффективное количество одного или нескольких производных бициклических пиразолонов по настоящему изобретению, которые в условиях in vivo высвобождают соответствующий аналог, эффективный для ингибирования высвобождения воспалительных цитокинов; и
b) один или несколько фармацевтически приемлемых эксципиентов.
СПОСОБЫ ПРИМЕНЕНИЯ
Настоящее изобретение относится также к способу регулирования уровня одного или нескольких индуцирующих воспаление цитокинов, в том числе интерлейкина-1 (IL-1), фактора альфа, вызывающего некроз опухолевых клеток (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8), и тем самым относится к способу регулирования, лечения или ослабления болезненных состояний, которые определяются уровнем внеклеточных воспалительных цитокинов. Указанный способ включает стадию введения человеку или высшему млекопитающему эффективного количества композиции, которая содержит один или несколько ингибиторов воспалительных цитокинов по настоящему изобретению.
Поскольку ингибиторы воспалительных цитокинов по настоящему изобретению могут быть доставлены таким образом, что может быть обеспечено регулирование более чем одного сайта, то одновременно можно модулировать более чем одно болезненное состояние. Не ограничивающими настоящее изобретение примерами заболеваний, на которые оказывает влияние регулирование или ингибирование воспалительных цитокинов, и тем самым модулирование избыточной активности цитокинов, являются остеоартрит, ревматоидный артрит, диабет, инфекция, вызываемая вирусом иммунодефицита человека (ВИЧ).
МЕТОДИКИ
Эффективность соединений настоящего изобретения можно оценить, например, с помощью измерения констант ингибирования цитокинов, Ki, и значения IC50 можно определить любым способом, который по выбору использует специалист в данной области.
Не ограничивающими настоящее изобретение примерами подходящих анализов являются:
i) Ферментный анализ с УФ-визуализируемым субстратом, описанный L.AL Reiter, Int. J. Peptide Protein Res., 43, 87-96 (1994).
ii) Ферментный анализ с флуоресцирующим субстратом, описанный Thornberry et al., Nature, 356, 768-774 (1992).
iii) Анализ мононуклеарных клеток периферической крови (PBMC Cell), описанный в Патенте США 6204261 B1, выданном на имя Batchelor et al. и опубликованном 20 марта 2001 г.
Каждый из приведенных документов включен в настоящее описание посредством ссылки.
Кроме того, ингибирование фактора альфа, вызывающего некроз опухолевых клеток (TNF-α), можно измерить с помощью стимулированных липополисахаридом моноцитарных клеток человека (THP-1), как это описано в:
i) K.M.Mohler et al., "Protection Against a Lethal Dose of Endotoxin by an Inhibitor of Tumor Necrosis Factor Processing", Nature, 370, pp. 218-220 (1994).
ii) Патенте США 6297381 B1, выданном на имя Cirillo et al. и опубликованном 2 октября 2001 г., который включен в данное описание посредством ссылки и который воспроизводится в части, относящейся к предмету настоящего изобретения.
Ингибирование продуцирования цитокинов можно наблюдать путем определения ингибирования TNF-α в стимулированных липополисахаридом клетках THP. Все клетки и реагенты разводят в RPMI 1640 феноловым красным и L-глутамином, добавляют дополнительное количество L-глутамина (общее количество: 4 мМ), пенициллин и стрептомицин (по 50 единиц/мл каждого) и фетальную телячью сыворотку (FBS 3%)(GIBCO, все концентрации конечные). Анализ проводят в стерильных условиях, лишь испытуемые соединения готовят в нестерильных условиях. Первичные исходные растворы готовят в диметилсульфоксиде и затем разводят в RPMI 1640 до концентрации, вдвое превышающей требуемую для проведения анализа. Конфлюэнтные клетки ТНР.1 (2×106 клеток/мл, конечная концентрация; American Type Culture Company, Роквилл, Мэриленд) добавляют в 96-луночные круглодонные полипропиленовые планшеты для культивирования (Costar 3790; стерильно), содержащие 125 мкл на лунку испытуемого соединения (2-кратная концентрация) или носитель диметилсульфоксид (контрольные, слепой опыт). Концентрация ДМСО не должна превышать 0,2% конечной концентрации. Смесь клеток перед стимулированием липополисахаридом (LPS, конечная концентрация 1 мкг/мл; Sigma L-2630, из Е.coli серотип 0111.В4, хранят при -80°С в виде 1 мг/мл исходного раствора в разведенном водой носителе, защищенном от эндотоксинов) выдерживают в течение 30 минут при температуре 37°С в 5% CO2. В контрольные (нестимулированные) лунки добавляют водный носитель; конечный объем инкубации составляет 250 мкл. Инкубация (4 час) протекает, как описано выше. Процесс прекращают путем центрифугирования планшетов в течение 5 мин при комнатной температуре при 1600 об/мин (4033 g); супернатант переносят на чистый 96-луночный планшет и хранят при температуре -80°С до проведения анализа TNF-α человека с использованием набора ELISA (Biosource #KHC3015, Камарилло, Калифорния). Вычисленное значение IC50 соответствует концентрации тестируемого соединения, которая вызывает 50% снижение максимального уровня продуцирования TNF-α. Результаты представлены в Таблице VI.
Несмотря на то, что были проиллюстрированы и описаны конкретные варианты осуществления настоящего изобретения, специалистам в данной области должно быть понятно, что не отходя от сути и объема настоящего изобретения, можно провести различные модификации. Поэтому подразумевается, что приведенная ниже формула изобретения охватывает все подобные изменения и модификации, которые входят в объем настоящего изобретения.
Данные TNF-α IC50 для соединений по изобретению
IC50 (мкМ)
IC50 (мкМ)
IC50 (мкМ)
IC50 (мкМ)
| название | год | авторы | номер документа |
|---|---|---|---|
| 6,7-ДИГИДРО-5H-ПИРАЗОЛО[1,2-a]ПИРАЗОЛ-1-ОНЫ (ВАРИАНТЫ), ИНГИБИРУЮЩИЕ ВЫСВОБОЖДЕНИЕ ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ | 2002 |
|
RU2299885C2 |
| 6,7-ДИГИДРО-5H-ПИРАЗОЛО[1,2-А]ПИРАЗОЛ-1-ОНЫ, РЕГУЛИРУЮЩИЕ ВОСПАЛИТЕЛЬНЫЕ ЦИТОКИНЫ (ВАРИАНТЫ), И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2003 |
|
RU2289584C2 |
| БИЦИКЛИЧЕСКИЕ ПИРАЗОЛОНОВЫЕ ИНГИБИТОРЫ ЦИТОКИНОВ | 2004 |
|
RU2358976C2 |
| СОЕДИНЕНИЯ, КОТОРЫЕ ИНГИБИРУЮТ ВЫСВОБОЖДЕНИЕ ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ | 2002 |
|
RU2278864C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-3Н-ПИРАЗОЛО[3,4-D]ПИРИМИДИН-3-ОНЫ | 2019 |
|
RU2812726C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ДИГИДРОНАФТИРИДИНОНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2809869C1 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИРИДИНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА A | 2005 |
|
RU2370496C2 |
| Соединения 6, 7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-2-карбоксамида | 2017 |
|
RU2719599C2 |
| ЗАМЕЩЁННЫЕ ПИРАЗОЛОПИРИМИДИНЫ КАК АКТИВАТОРЫ ГЛЮКОЦЕРЕБРОЗИДАЗЫ | 2011 |
|
RU2603637C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ | 2012 |
|
RU2665021C2 |
Изобретение относится к новым соединениям, способным предотвращать внеклеточное высвобождение воспалительных цитокинов. При этом указанные соединения, включая их диастереомерные формы и их фармацевтически приемлемые соли, имеют формулу:
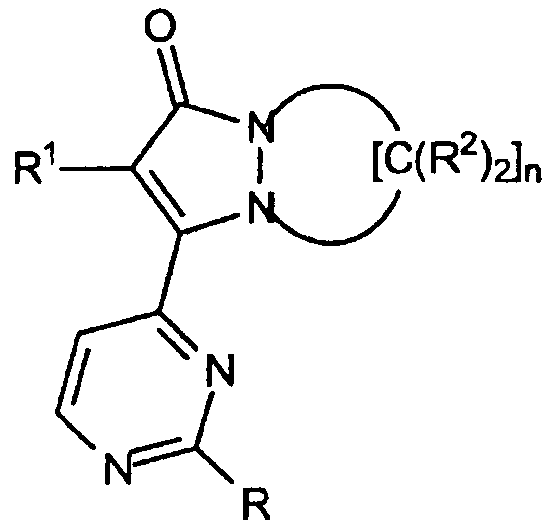
где R обозначает: a) -O[CH2]kR3 или b) -NR4aR4b; R3 обозначает замещенный или незамещенный C1-C4алкил, замещенный или незамещенный фенил, где заместители выбирают из галогена, циано, тригалоидметила, C1-C4алкила, C1-C4алкилсульфонила, -NR4aR4b, -O[CH2]kR3, где R3 обозначает водород, R4a и R4b каждый независимо обозначает водород или C1-C4алкил-СО-; или бензо(1,3)диоксол, индекс k имеет значение от 0 до 5; R4a и R4b каждый независимо обозначает: a) водород или b) -[C(R5aR5b)2]mR6; каждый R5a обозначает водород, и R5b обозначает водород, линейный или разветвленный C1-C4алкил; R6 обозначает винил, группу -OR7, -CO2R7; циклический C3-C6алкил, незамещенный фенил или фенил, замещенный C1-C4алкилом, C1-C4алкилсульфонилом, -NR4aR4b, -O[CH2]kR3, где R3, R4a и R4b каждый независимо обозначает водород; или незамещенный 6-членный азотсодержащий гетероарил, R7 обозначает водород, растворимый в воде катион или C1-C4алкил; индекс m имеет значение от 0 до 5. Изобретение также относится к фармацевтической композиции, содержащей эффективное количество соединений, соответствующих указанной выше формуле, и к способу ингибирования внеклеточного высвобождения воспалительных цитокинов. 3 н. и 11 з.п. ф-лы, 6 табл.
где R обозначает
a) -O[CH2]kR3 или
b) -NR4aR4b;
R3 обозначает замещенный или незамещенный C1-C4алкил, замещенный или незамещенный фенил, где заместители выбирают из галогена,циано, тригалоидметила, C1-C4алкила, C1-C4алкилсульфонила ,-NR4aR4b , -O[CH2]kR3 , где R3 обозначает водород, R4a и R4b каждый независимо обозначает водород, или C1-C4алкил-СО-, или бензо(1,3)диоксол, индекс k имеет значение от 0 до 5;
R4a и R4b каждый независимо обозначает
a) водород или
b) -[C(R5aR5b)2]mR6;
каждый R5a обозначает водород и
R5b обозначает водород, линейный или разветвленный C1-C4алкил; R6 обозначает винил, группу -OR7, -CO2R7, циклический C3-C6алкил, незамещенный фенил или фенил, замещенный C1-C4алкилом, C1-C4алкилсульфонилом, -NR4aR4b, -O[CH2]kR3, где R3 , R4a и R4b каждый независимо обозначает водород, или незамещенный 6-членный азотсодержащий гетероарил;
R7 обозначает водород, растворимый в воде катион или C1-C4алкил;
индекс m имеет значение от 0 до 5;
R1 обозначает
a) незамещенный фенил, или фенил, замещенный заместителями, выбранными из галогена, тригалоидметила,
две группы R2 у одного и того же атома углерода, взятые вместе, образуют кислород- или серу-содержащее спироциклическое кольцо, содержащее от 5 до 6 атомов, при этом остальные группы R2 независимо выбраны из группы, включающей
a) водород;
индекс n имеет значение от 3 до 5.
где R обозначает группу формулы -OR3, в которой R3 выбран из группы, включающей фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,6-дифторфенил,2-цианофенил, 3-цианофенил, 2-трифторметилфенил, 4-трифторметилфенил,2-метилфенил,4-метилфенил,2,4-диметилфенил, 3-N-ацетиламинофенил,2-метоксифенил,4-метоксифенил и 3-бензо[1,3]диоксол-5-ил;
аминогруппу, имеющую формулу
или аминогруппу, имеющую формулу
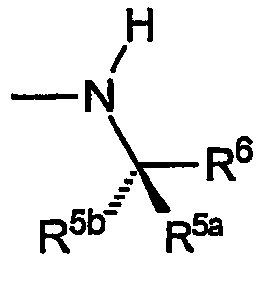
R5a обозначает водород и R5b каждый обозначает C1-C4алкил, R6 выбран из группы, включающей водород, метил, этил, винил, циклопропил, циклогексил, метоксиметил, метоксиэтил, 1-гидрокси-1-метилэтил, карбокси, фенил, 4-фторфенил, 2-аминофенил, 2-метилфенил,4-метилфенил,4-метоксифенил,4-(пропансульфонил)фенил, пиридин-2-ил, пиридин-3-ил, при этом группа R имеет указанную стереохимию, когда значения R5a, R5b и R6 не являются одинаковыми.
где R обозначает группу формулы -OR3, в которой R3 выбран из группы, включающей фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,6-дифторфенил,2-цианофенил, 3-цианофенил, 2-трифторметилфенил, 4-трифторметилфенил,2-метилфенил,4-метилфенил,2,4-диметилфенил, 3-N-ацетиламинофенил,2-метоксифенил,4-метоксифенил и 3-бензо[1,3]диоксол-5-ил;
аминогруппу, имеющую формулу
или аминогруппу, имеющую формулу
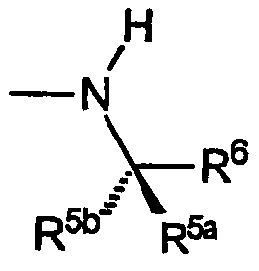
R5a и R5b каждый обозначает C1-C4алкил, R6 выбран из группы, включающей винил, циклопропил, циклогексил, метоксиметил, метоксиэтил,1-гидрокси-1-метилэтил,карбокси,фенил,4-фторфенил,2-аминофенил, 2-метилфенил, 4-метилфенил, 4-метоксифенил, 4-(пропансульфонил)фенил,пиридин-2-ил, пиридин-3-ил, при этом указанная группа R имеет указанную стереохимию, когда значения R5a, R5b и R6 не являются одинаковыми.
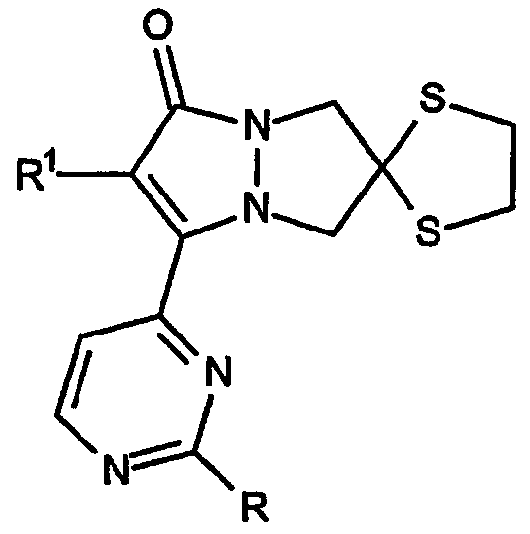
где R обозначает группу формулы -OR3, в которой R3 выбран из группы, включающей фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,6-дифторфенил,2-цианофенил,3-цианофенил,2-трифторметилфенил, 4-трифторметилфенил,2-метилфенил,4-метилфенил,2,4-диметилфенил, 3-N-ацетиламинофенил,2-метоксифенил,4-метоксифенил и 3-бензо[1,3]диоксол-5-ил;
аминогруппу, имеющую формулу
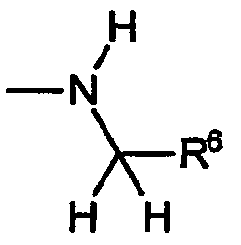
или аминогруппу, имеющую формулу
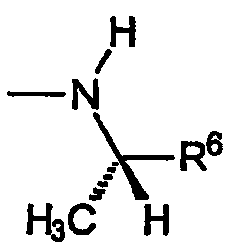
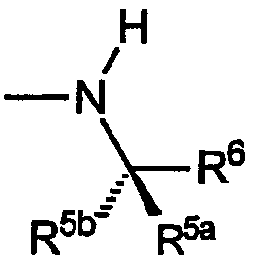
R5a обозначает водород, R5b обозначает C1-C4алкил, R6 выбран из группы, включающей винил, циклопропил, циклогексил, метоксиметил, метоксиэтил,1-гидрокси-1-метилэтил, карбокси, фенил, 4-фторфенил, 2-аминофенил, 2-метилфенил, 4-метилфенил, 4-метоксифенил,4-(пропансульфонил)фенил,пиридин-2-ил,пиридин-3-ил, при этом указанная группа R имеет указанную стереохимию, когда значения R5a, R5b и R6 не являются одинаковыми.
где R3 обозначает замещенный или незамещенный C1-C4алкил, замещенный или незамещенный фенил, где заместители выбирают из галогена, циано, тригалоидметила, C1-C4алкила, C1-C4алкилсульфонила, -NR4aR4b, -O[CH2]kR3, где R3 обозначает водород, R4a и R4b каждый независимо обозначает водород или C1-C4алкил-СО-; или бензо(1,3)диоксол;
индекс k имеет значение от 0 до 5.
где R5a обозначает водород, R5b обозначает водород, линейный или разветвленный C1-C4алкил; R6 обозначает винил, группу -OR7,-CO2R7,циклический C3-C6алкил, незамещенный фенил или фенил, замещенный C1-C4алкилом,C1-C4алкилсульфонилом, -NR4aR4b,-O[CH2]kR3, где R3 , R4a и R4b каждый независимо обозначает водород, или незамещенный 6-членный азотсодержащий гетероарил, R7 обозначает водород, растворимый в воде катион или C1-C4алкил; индекс m имеет значение от 0 до 5.
где R5b обозначает метил; R6 выбран из группы, включающей винил,-ОН,-СО2Н,-СО2СН3 ,циклический C3-C6алкил, незамещенный фенил или фенил, замещенный C1-C4алкилом,C1-C4алкилсульфонилом, -NR4aR4b,-O[CH2]kR3, где R3 , R4a и R4b каждый независимо обозначает водород, или незамещенный 6-членный азотсодержащий гетероарил.
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[(2-(S)-(α)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-метоксиэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(бензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-гидрокси-2-метилпропиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(циклопропиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(2-фторбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(3-фторбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(2-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(3-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[2-(4-трифторметилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[5',5'-диметил-1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[5',5'-диметил-1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1-(S)-метил-2-метоксиэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он;
спиро[1,3-диоксолан[2',6]-2-(4-фторфенил)-3-[(2-фторфенокси)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-дитиолан[2',6]-2-(4-фторфенил)-3-(2-феноксипиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он;
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[(2-(S)-(α)-метилбензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(1,1-диметилэтиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он];
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-[2-(бензиламино)пиримидин-4-ил]-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он] и
спиро[1,3-диоксан[2',6]-2-(4-фторфенил)-3-{2-[(2-метилфенил)метиламино]пиримидин-4-ил}-6,7-дигидро-5H-пиразоло[1,2-a]пиразол-1-он].
a) эффективное количество одного или нескольких соединений, соответствующих формуле по п.1, включая их диастереомерные формы и их фармацевтически приемлемые соли, и
b) один или несколько фармацевтически приемлемых эксципиентов.
a) эффективное количество одного или нескольких соединений, соответствующих формуле по п.1, включая их диастереомерные формы и их фармацевтически приемлемые соли, и
b) один или несколько фармацевтически приемлемых эксципиентов.
Авторы
Даты
2006-03-20—Публикация
2002-09-20—Подача