Способ относится к сельскохозяйственной биотехнологии, в частности к способу культивирования in vitro изолированных семяпочек растений, и может быть использован для выполнения работ по практической селекции и семеноводству тюльпанов, а также при разработке более совершенных методов селекции этой ценной промышленной цветочной культуры в условиях in vitro - гаплоидии, полиплоидии, клеточной селекции.
Наиболее эффективными методами формообразования у тюльпанов считаются отдаленная гибридизация и разноплоидные скрещивания, при которых очень часто наблюдаются проявления генеративной несовместимости, что мешает формированию полноценных гибридных семян.
Исследование совместимости родительских форм и причин плохой завязываемости семян тюльпанов при межвидовых и разноплоидных скрещиваниях люминесцентно-микроскопическим методом (Братухина Е.В, 1997) показало, что во всех изученных комбинациях барьерные моменты несовместимости морфологически четко не обозначены. Тюльпанам свойственна случайность, неспецифичность нарушений, которая проявлялась на всех этапах прогамной фазы (на рыльце, в столбике, в каналах завязи), как и в вариантах, наблюдаемых у ячменно-ржаных гибридов.
Кроме того, нормальное проникновение мужских гаметофитов в пестики не может служить надежным критерием полной совместимости родительских форм. Нарушение оплодотворения нередко может обнаруживаться только при созревании плодов.
В результате исследований, проведенных в 1993-1996 гг., нами разработан "Способ получения микролуковиц тюльпанов из изолированных зародышей в условиях in vitro (патент № 2123256 Россия МПК6 A 01 4/00, Бюл. 35 - М., 1998 г.).
Вместе с тем было выявлено, что возможности использования метода изолированных зародышей на культуре тюльпана ограничены. По характеру развития зародыша тюльпан выделен в особую группу - эмбриогенез с замедленной дифференциацией зародыша. Извлечь эмбрион из незрелых семян удается лишь на 53-55 день после опыления, когда они достигают размера не менее 1-1,5 мм, в то время как приостановка их развития в несовместимых комбинациях скрещивания может наступить на 15-40 день после опыления.
За последние 10-20 лет опубликован целый ряд работ, касающихся технологии сохранения эмбрионов различных растений через культуру семяпочек (F.Kishi, Y.Kagami, M.Shinohara S.Hatano, 1994; F.S.Rangan, 1984).
Однако аналоги способа получения полноценных растений тюльпанов из семяпочек нам не известны. По M.G.M.Van Creij, D.M.F.J.Kerckhoffs & J.M.Van Tuyl (1999), стадия развития эмбриона, возможность его изоляции и переноса вместе с семяпочкой in vitro зависит от условий культивирования растений in vivo.
Метод получения полноценных растений тюльпанов из семяпочек, изолированных на ранней стадии развития эмбрионов, разработан в нашей стране впервые.
Цель изобретения - через культивирование семяпочек in vitro повысить жизнеспособность зародышей на возможно ранней стадии их развития, сохранить уникальные новообразования полиплоидных и межвидовых гибридов с одновременным увеличением их коэффициента размножения в ювенильном возрасте.
Поставленная цель достигается культивированием изолированных семяпочек тюльпанов в условиях in vitro в 3 этапа, каждый из которых отличается использованием определенной питательной среды, температурным и световым режимом.
Семяпочки через 5 недель после опыления (НПО) изолируют от материнского растения с частью завязи и высаживают в чашки Петри на агаризованную половинную питательную среду Мурасиге и Скуга с содержанием 9% сахарозы, дополненную глицином 2 мл/г, α-нафтилуксусной кислотой 1 мг/л, антибиотиком ампициллином 100 мг/л (фиг.1). Семяпочки культивируют в течение 16-17 недель в темноте, при температуре не выше +20°С. По мере разрастания и увеличения в размере семяпочек их выделяют из завязи и переносят в чашки Петри на свежую питательную среду того же состава, уменьшая содержание сахарозы до 3%. Культивируют 9-12 недель в темноте при температуре +5°С (фиг.2).
Семяпочки, изолированные с плацентой через 7 недель после опыления (НПО), высаживают на половинную агаризованную питательную среду Мурасиге и Скуга того же состава, что и пятинедельные, но с 3%-ной концентрацией сахарозы. Культивируют 4 недели в темноте при температуре +20°С.
Сформировавшиеся зародыши размером до 1,5 мм извлекают из семяпочек, переносят на питательную среду Ван Гофа и выращивают в течение 2-3 недель при температуре 22-25°С, освещенности 2-3 тыс. лк, 16-часовом фотопериоде. Разросшиеся семинедельные семяпочки, из которых после 4 недель культивирования невозможно извлечь зародыши (они размером менее 1 мм), переносят на питательную среду того же состава и содержат еще 9-12 недель в темноте при температуре +5°С для стимулирования прорастания зародышей.
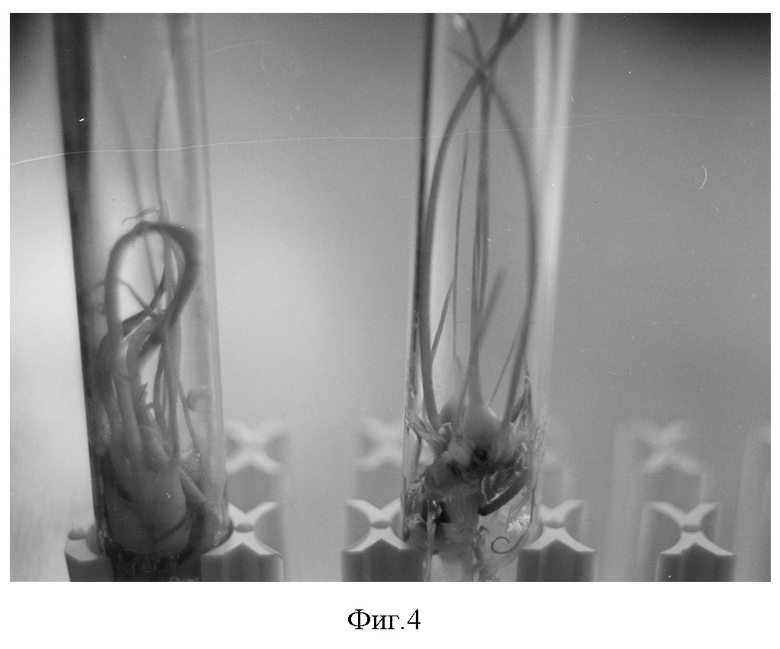
Проростки, полученные из семяпочек 5 и 7 НПО, переносят на модифицированную питательную среду Мурасиге и Скуга с содержанием регуляторов роста α-нафтилуксусной кислоты - 0,15 мг/л, 6-бензиламинопурина (6-БАП) - 3,0 мг/л и 6% сахарозы. Культивируют при температуре +23-25°С, освещенности 2-3 тыс. лк, 16-часовом фотопериоде в течение 12-20 недель. Это дает возможность получить от одного эмбриона от 5 до 15 растений-регенерантов размером до 30 мм ( фиг.3, 4, 5).
Пример получения растений-регенерантов тюльпанов из изолированных семяпочек в условиях in vitro, осуществляемого в 3 этапа, показан на комбинации Уайт триумфатор×смесь пыльцы, Куин оф Найт×смесь пыльцы, Крисмэс Марвел×смесь пыльцы.
1 Этап - введение семяпочек in vitro:
а) изоляция семяпочек от материнского растения через 5 НПО с частью завязи и перенос на 3 варианта питательной среды с 9%-ной сахарозой, культивирование 16-17 недель в темноте при температуре +20°С;
б) изоляция семяпочек от материнского растения через 7 НПО на 2 варианта питательной среды с 3%-ной сахарозой, культивирование 4 недели в темноте при температуре +20°C.
Активность развития семяпочек на первом этапе культивирования устанавливалась по степени разрастания эндосперма, таблица 1, фиг.1.
Развитие пяти- и семинедельных семяпочек тюльпанов через 16 недель культивирования in vitro.
Лучшей питательной средой на 1 этапе культивирования для пятинедельных семяпочек с частью завязи оказался вариант II (половинная Мурасиге и Скуга с 9%-сахарозой), а для семинедельных семяпочек - вариант IV (половинная Мурасиге и Скуга с 3%-ной сахарозой).
2 Этап - перенос разросшихся семяпочек на половинную питательную среду Мурасиге и Скуга с исходным содержанием регуляторов роста, 3%-ной сахарозой и культивирование их в темноте при температуре +5°С в течение 9-12 недель с целью получения проростков. Результаты экспериментов представлены в таблице 2, фиг.2.
Развитие эмбрионов тюльпанов на вторичной питательной среде (24 недели культивирования in vitro)
3 Этап - перенос зародышей, развившихся из пяти- и семинедельных семяпочек, на модифицированную питательную среду Мурасиге и Скуга, содержащую в качестве регуляторов роста 6-бензиламинопурин (6 БАП) от 2,0 до 3,0 мг/л и α-нафтилуксусную кислоту (НУК) от 0,1 до 0,2 мг/л, сахарозу 3-6% при световом режиме 16/8 и температуре +23-25°С. Влияние совместного действия ауксинов и цитокининов на развитие регенератов из изолированных зародышей тюльпанов оценивалось по выходу полноценных растений после культивирования in vitro и по образованию дополнительных побегов, таблица 3, фиг.3.
Выход регенерантов тюльпанов in vitro в зависимости от концентрации регуляторов роста в питательной среде (Крисмэс Марвел×смесь пыльцы)
Наилучшее развитие регенерантов и образование дополнительных побегов получено с регуляторами роста 6 БАП-3 мг/л плюс НУК-0,15 мг/л при содержании в питательной среде 6% сахарозы (табл.4).
Выход регенерантов тюльпанов in vitro в зависимости от концентрации сахарозы (среда М-С модифицированная, комб. Крисмэс Марвел×смесь пыльцы)
Исходя из полученных данных, наиболее ранним сроком изоляции семяпочек от материнского растения для введения in vitro является 5 недель после опыления, показавшим наилучшие результаты, табл.5.
Выход регенерантов тюльпанов in vitro при разном сроке изолирования семяпочек от материнского растения
Предложенный способ культивирования семяпочек in vitro позволяет обеспечить сохранность гибридных эмбрионов на ранней стадии их развития (через 5 недель после опыления), увеличить коэффициент размножения в ювенильном возрасте и значительно ускорить селекционный процесс, продолжающийся у тюльпанов около 25 лет. Кроме того, этот метод позволяет сохранить оригинальные образцы генотипов от единичных эмбрионов, полученных при отдаленных и разноплоидных скрещиваниях.
В целом заявленный способ дает возможность управлять селекционным процессом для получения сортов тюльпанов по заданным признакам.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения растений-регенерантов Brassica oleracea L. in vitro | 2021 |
|
RU2759735C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОЛУКОВИЦ ТЮЛЬПАНОВ ИЗ ИЗОЛИРОВАННЫХ ЗАРОДЫШЕЙ В УСЛОВИЯХ IN VITRO | 1996 |
|
RU2123256C1 |
| Способ получения растений-регенерантов рода Brassica in vitro | 2020 |
|
RU2741647C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИРИСА МЕЧЕВИДНОГО (I. ENSATA THUNB.) IN VITRO | 2011 |
|
RU2481766C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАПЛОИДНЫХ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИЗ РЕПРОДУКТИВНЫХ ОРГАНОВ BRASSICA OLERACEA L. IN VITRO | 2015 |
|
RU2607007C1 |
| Способ получения микрорастений лекарственного растения Stephania glabra (Roxb.) Miers | 2021 |
|
RU2757318C1 |
| СПОСОБ РЕГЕНЕРАЦИИ ХЛОПЧАТНИКА ИЗ СОМАТИЧЕСКИХ КЛЕТОК (ВАРИАНТЫ) | 1988 |
|
RU2128428C1 |
| Способ размножения растений сорго @ @ | 1982 |
|
SU1107799A1 |
| Способ клонального микроразмножения растений сем. Betulaceae | 2016 |
|
RU2627194C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ РАПСА IN VITRO | 2008 |
|
RU2374834C1 |



Изобретение относится к сельскому хозяйству, в частности к способу получения полноценных растений-регенератов тюльпанов культивированием семяпочек in vitro. Используют агаризованную половинную среду Мурасиге и Скуга, дополненную глицином, альфа-нафтилуксусной кислотой, антибиотиком ампициллином и 9%-ной или 3%-ной сахарозой (в зависимости от возраста семяпочек) для развития эмбрионов после изоляции от материнского растения семяпочек с частью завязи. Переносят разросшиеся семяпочки на свежую питательную среду сначала с тем же составом регуляторов роста и уменьшенным до 3% содержанием сахарозы, а затем на модифицированную среду Мурасиге и Скуга, содержащую 6% сахарозы, 6 БАП и НУК, при последовательной смене температурного и светового режимов. Заявленное изобретение обеспечивает сохранность гибридных эмбрионов на ранней стадии их развития, повышает жизнеспособность семинедельных гибридных зародышей, а также дает возможность сохранить оригинальные образцы генотипов от единичных эмбрионов. 5 ил., 5 табл.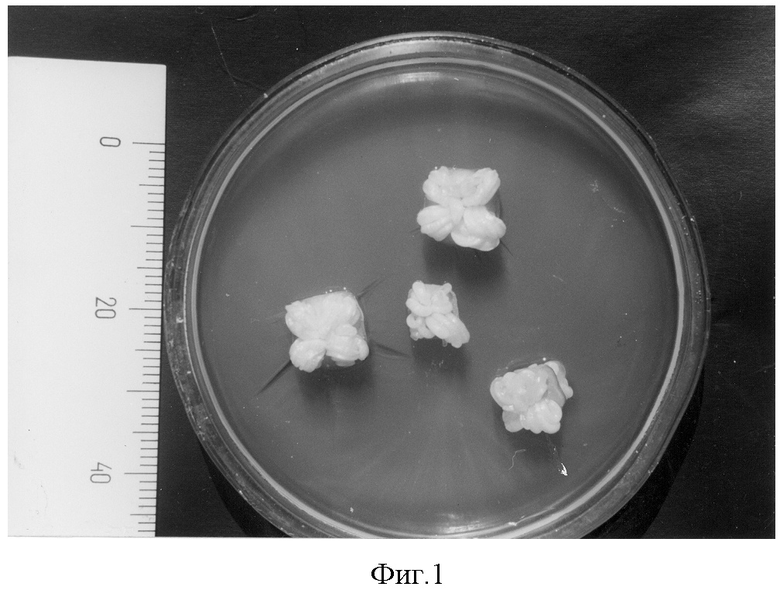
Способ получения полноценных растений-регенерантов тюльпанов культивированием семяпочек in vitro, заключающийся в том, что изолируют семяпочки с частью завязи через пять или семь недель после опыления, культивируют их в течение 16-17 недель в случае пятинедельных семяпочек и 4 недели - в случае семинедельных семяпочек при температуре +20°С на агаризованной половинной питательной среде Мурасиге и Скуга, дополненной глицином 2,0 мг/л, α-нафтилуксусной кислотой 1,0 мг/л, антибиотиком ампициллином 100 мг/л и 9%-ной сахарозой - в случае пятинедельных семяпочек или 3%-ной сахарозой - в случае семинедельных семяпочек, затем разросшиеся семяпочки переносят на свежую питательную среду с тем же составом регуляторов роста с 3%-ным содержанием сахарозы, культивируют их в темноте при температуре +5°С в течение 9-12 недель, снова переносят на модифицированную среду Мурасига и Скуга с 6%-ной сахарозой, содержащую регуляторы роста 6 БАП-3 мг/л, НУК-0,15 мг/л и продолжают культивировать при температуре +23-25°С, 16-часовом фотопериоде, освещенности 2-3 тыс. люкс до развития регенерантов высотой около 30 мм и образования дополнительных побегов.
| СПОСОБ ПОЛУЧЕНИЯ МИКРОЛУКОВИЦ ТЮЛЬПАНОВ ИЗ ИЗОЛИРОВАННЫХ ЗАРОДЫШЕЙ В УСЛОВИЯХ IN VITRO | 1996 |
|
RU2123256C1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ РАСТЕНИЙ | 1994 |
|
RU2080780C1 |
| СПОСОБ РАЗМНОЖЕНИЯ СМОРОДИНЫ IN VITRO | 1991 |
|
RU2039427C1 |
Авторы
Даты
2006-04-20—Публикация
2004-02-24—Подача