Изобретение относится к области биотехнологии, в частности прикладным исследованиям, связанным с получением нового исходного материала (гаплоидных и дигаплодных растений) для создания сортов и гибридов, и может быть востребовано научными учреждениями биотехнологического и сельскохозяйственного профиля, семеноводческими кампаниями и селекционными станциями, а также образовательными учреждениями.
В настоящее время для получения гаплоидных растений в культуре in vitro наиболее часто применяют такие известные способы как - андрогенез (культивирование изолированных микроспор и пыльников) и гиногенез (культивирование изолированных завязей и семяпочек). Эти способы до сих пор применяются для многих культур. Однако, для большинства исследуемых видов растений, частота регенерации растений из культивируемых эксплантов не превышает 0,1-2% (а.с. SU: №1650051, №1036306, патент WO 2005084420, патент JPH 0698648, патент KR 100952103, патент WO 2002052926 A3, патенты RU: №2120741, №2175189, №2035134, №2084135, №2142013, №2557389, №2681339).
Анализ научной литературы и патентный поиск показал, что нет универсальной технологии, позволяющей получать в необходимом количестве гаплоидные растения разных таксономических групп.В связи с этим существует необходимость разработки регламента для конкретных видов растений для решения частных проблем селекции растений.
Культура in vitro репродуктивных органов - один из эффективных методов создания чистых линий за короткое время. С его помощью можно ускорить процесс получения F1 гибридов экономически важных сельскохозяйственных культур, которые возделывают во всем мире, в частности, представителей рода Brassica (капуста белокочанная, капуста краснокочанная, капуста брокколи, капуста кольраби, капуста брюссельская).
Однако эффективность применяемых технологий зависит от способности репродуктивных органов растений образовывать в культуре in vitro эмбриоиды, из которых в дальнейшем формируются растения-регенеранты. Данный процесс зависит от многих взаимосвязанных факторов, которые в настоящее время еще недостаточно изучены. В связи с этим эффективная технология культивирования пыльников и завязей in vitro представителей рода Brassica пока что не разработана и работы по выявлению сортов, гибридов, линий, обладающих высокой эмбриогенной способностью, а также установление факторов, оказывающих влияние на этот процесс, являются актуальными.
Для создания гаплоидных растений применяют различные первичные экспланты: изолированные пыльники, микроспоры, завязи, семяпочки, а также изолированные зародыши, у которых потеряна отцовская хромосома.
Например, известен способ получения гаплоидных растений овощных культур, заключающийся в культивировании изолированных пыльников на безгормональной питательной среде Мурасиге и Скуга, обогащенной 120 г/л сахарозы + 3 мг/л 6-БАП + 1 мг/л 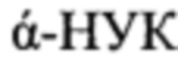 + 2 мг/л AgNO3+1 мг/л янтарной кислоты (Савенко Е.Г., Королева С. В., Мухина Ж.М, Глазырина В.Α., Шундри Л.А. Получение гаплоидов овощных культур для повышения эффективности селекции // Е.Г. Савенко, С. В. Королева, Ж.М. Мухина, В.А. Глазырина, Л. А. Шундри / Овощеводство.- №2(25).- 2014). Недостатком данного метода является то, что на изолированных пыльниках всех изучаемых генотипов капусты белокочанной первоначально образуется каллусная ткань. В таком способе, образовавшиеся растения-регенеранты часто отличаются между собой по плоидности и не всегда бывают гаплоидными, в связи с гетерогенностью клеток каллусной ткани, прежде всего, по числу хромосом. Кроме того, в настоящее время до конца не выявлено, образуются ли растения из поли плоидизированных гаплоидных клеток или от слившихся клеток.
+ 2 мг/л AgNO3+1 мг/л янтарной кислоты (Савенко Е.Г., Королева С. В., Мухина Ж.М, Глазырина В.Α., Шундри Л.А. Получение гаплоидов овощных культур для повышения эффективности селекции // Е.Г. Савенко, С. В. Королева, Ж.М. Мухина, В.А. Глазырина, Л. А. Шундри / Овощеводство.- №2(25).- 2014). Недостатком данного метода является то, что на изолированных пыльниках всех изучаемых генотипов капусты белокочанной первоначально образуется каллусная ткань. В таком способе, образовавшиеся растения-регенеранты часто отличаются между собой по плоидности и не всегда бывают гаплоидными, в связи с гетерогенностью клеток каллусной ткани, прежде всего, по числу хромосом. Кроме того, в настоящее время до конца не выявлено, образуются ли растения из поли плоидизированных гаплоидных клеток или от слившихся клеток.
Известен способ создания гаплоидов и удвоенных гаплоидов овощных культур - из изолированных пыльников. С помощью цитологического анализа или по морфологическим признакам с интактного растения отбирали бутоны, пыльники которых содержали микроспоры преимущественно в одноядерной стадии развития. Бутоны предварительно поверхностно стерилизовали, после чего их раздавливали в стерильной ступке в небольшом объеме питательной среды. Полученную суспензию затем фильтровали, центрифугировали для выделения микроспор. Полученные микроспоры дважды промывали свежей питательной средой и культивировали в темноте на жидкой питательной среде NLN с добавлением активированного угля и регуляторов роста - нафтилуксусной кислоты и 2,4-дихрорфеноксиуксусной кислоты. После введения в культуру in vitro микроспоры подвергали высокотемпературной обработке (+35°С) в течение 2 суток, затем культивировали при температуре +24°С при бытовом освещении на шейкере со скоростью вращения 65 об/мин. Через три месяца наблюдали формирование веретеновидных и шаровидных многоклеточных структур и эмбриоидов, находящихся в стадии развития семядольных листьев. На пятый месяц формирование эмбриоидов наблюдали у пяти из двенадцати исследуемых генотипов. В зависимости от генотипа наблюдали образование от 0 до 3,5 эмбриоподобных структур, однако только 4 из 17 сформировавшихся структур достигли семядольной стадии развития (Чистова А.В., Монахос С.Г. // Получение удвоенных гаплоидов моркови в культуре изолированных микроспор и перспективы их использования / А.В. Чистова, С.Г. Монахос.Тезисы XV Молодежной конференции «Биотехнология в растениеводстве, животноводстве и ветеринарии» (Москва, 8 апреля 2015 г.). - М.: ВНИИСБ, 2015. - С. 18-20).
Известен другой способ получения гаплоидных растений - из изолированных микроспор. Технология предусматривает применение стандартного протокола получения DH-растений в культуре изолированных микроспор in vitro и протокола с добавлением в питательную среду нитрата серебра (AgNO3) в концентрации 0,1 мг/л, для индукции эмбриогенеза у Brassica purpuraria - (Козарь Е.В., Коротцева К.С., Романова О.В., Чичварина О.А., Кан Л.Ю., Ахраменко В.А., Домблидес Е.А. // Получение удвоенных гаплоидов Brassica purpurarial Е.В. Козарь, К.С. Коротцева, О.В. Романова, О.А Чичварина., Л.Ю. Кан, В.А. Ахраменко, Е.А. Домблидес. Овощи России. 2019. №6(50). С. 10-18). прототип.
Стандартный протокол получения DH-растений включает в себя культивирование микроспор in vitro на питательной среде NLN-13, с последующей их температурной обработкой в термостате при +32°С. Эмбриоиды в стадии развития сердечко и торпедо затем помещают на среду Мурасига и Скуга (МС), содержащей 2% сахарозы, 7 г/л агара, а также регуляторы роста - гибберелловая кислота (ГК) 0,1 мг/л и 6-бензиламинопурин (БАП) 1 мг/л. рН питательной среды составляет 5,8.
В результате исследования было установлено, что эмбриогенез в культуре В. purpuraria возможен как при использовании стандартного протокола, так протокола, в котором в состав питательной среды добавляют нитрат серебра. Выход эмбриоидов в этих вариантах культивирования варьировал в зависимости от исследуемого генотипа в пределах сортообразца и составил 40 эмбриоидов на одну чашку Петри
Недостатком данного метода являлось то, что на этапе регенерации, примерно половина растений-регенерантов оказались альбиносами и были нежизнеспособны. Показана высокая степень спонтанного удвоения хромосом в растениях-регенерантах. Всего было получено 38 растений из сортообразца №1301. Выявлено, что у некоторых DH-растений при инбридинге проявляется самонесовместимость (4 шт), в то время как у остальных растений было получено семенное потомство.
Из анализа известных аналогичных технических решений выявлено, что технической проблемой в данной области является необходимость расширения арсенала методов и технологий для массового получения гаплоидных растений различных таксономических групп.
Техническим результатом изобретения является ускорение процесса селекции за счет быстрого и с высокой эффективностью получения гаплоидных растений рода Brassica in vitro, используемых в качестве нового исходного материала для создания улучшенных сортов и гибридов, что позволит получать гаплоидные растения семейства Brassicaceae независимо от исследуемого генотипа.
Для решения указанной проблемы и достижения заявленного технического результата, в способе получения растений-регенерантов рода Brassica in vitro, включающем изолирование бутонов с последующим культивированием пыльников и завязей на питательной среде Мурасиге и Скуга, с добавлением индуктора эмбриогенеза, изолированные бутоны стерилизуют и подвергают вакуумной инфильтрации в течение 10 минут в вакуумной камере при давлении 0,8 атм раствором препарата Аминовен 15%-ного в концентрация 3 мл/л или раствором препарата Дропп в концентрации 1 мг/л, с последующим культивированием изолированных пыльников, микроспор, завязей или семяпочек на питательной среде, по прописи Мурасига и Скуга, при этом в качестве индукторов эмбриогенеза в состав питательной среды добавляют гормоны тидиазурон в концентрации 0,01 мг/л и индолилуксусной кислоты в концентрации 0,3 мг/л.
Благодаря предложенному способу повышается способность культивируемых эксплантов к эмбриогенезу
Из анализа известных аналогичных технических решений выявлено, что заявленная совокупность существенных признаков, характеризующих сущность заявленного изобретения не известна из уровня техники, а также не следует для специалиста явным образом из известного уровня, может быть многократно использована для массового получения гаплоидных растений различных таксономических групп и результат, полученный у предложенного решения, обусловленный применением вакуумной инфильтрацией, не достигался в известных решениях. Следовательно техническое решение удовлетворяет всем критериям, предъявляемым к изобретению.
Конкретный пример осуществления предполагаемого способа.
Работу проводят на бутонах, которые изолируют как с главного, так и боковых побегов. В исследованиях была применена следующая схема работы:
1) поверхностная стерилизация бутонов 0,1% раствором сулемы (HgCl2) в течение 5 минут с последующим промыванием их стерильной дистиллированной водой в течение 10 минут.
2) стерильные бутоны погружают в 15%-ный раствор препарата Аминовен (концентрация 3 мл/л) или в раствор препарата Дропп (концентрация 1 мг/л) и помещают в вакуумную камеру на 10 минут. Давление в камере равно 0,8 атм.
3) пыльники и завязи асептически извлекают из бутонов в условиях ламинар-бокса и культивируют на индуцирующей питательной среде МС, содержащей препарат Дропп 0,01 мг/л и индолилуксусную кислоту (ИУК) 0,3 мг/л в чашках Петри. Культивируют пыльники и завязи в климакамере (Binder, Германия) в темноте при температуре 35°С в течение 5-ти суток, после чего температурный режим уменьшают до 25°С. В этих условиях экспланты выращивают в течение 25 суток и затем переносят в световую комнату, где поддерживается 16-часовой фотопериод и освещение белыми люминесцентными лампами с интенсивностью света 5 тыс. лк.
4) Сформированные эмбриоиды отделяют от первичного экспланта и переносят на среду, содержащую минеральные соли по прописи МС, а также гормоны ИУК - 2 мг/л, БАП - 1 мг/л, сахарозу - 3%, агар - 7 г/л. В этих условиях из эмбриоидов формируются растения, которые проявляли высокую способность к последующему размножению.
Предлагаемый способ получения гаплоидных растений из изолированных репродуктивных органов сочетает ряд положительных свойств, которые позволяют использовать ее в практической селекционной работе:
1. Способ предполагает применение вакуумной инфильтрации бутонов капусты белокочанной растворами препарата Аминовен или препарата Дропп на этапе введения изолированных пыльников и завязей в культуру in vitro.
2. Способ увеличивает на 25-30% выход жизнеспособных пыльников и завязей и повышает способность культивируемых эксплантов к эмбриогенезу на 3,7%.
3. Предлагаемый способ получения гаплоидных растений является экологически чистой и экономически выгодной технологией, которая не сложна в исполнении по сравнению с ранее предложенными.
По сравнению с прототипом предлагаемое изобретение позволит увеличить частоту возникновения гаплоидных растений на 25-30%, что даст возможность получать их в количестве, достаточном для проведения селекционных работ. Предлагаемый способ позволяет значительной степени ускорить селекционный процесс получения новых гибридов и сортов важных сельскохозяйственных растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения растений-регенерантов рода Brassica in vitro | 2020 |
|
RU2741647C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАПЛОИДНЫХ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИЗ РЕПРОДУКТИВНЫХ ОРГАНОВ BRASSICA OLERACEA L. IN VITRO | 2015 |
|
RU2607007C1 |
| Способ получения удвоенных гаплоидов моркови в культуре изолированных микроспор in vitro | 2020 |
|
RU2750959C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГАПЛОИДНЫХ РАСТЕНИЙ ЯЧМЕНЯ ИЗ КУЛЬТИВИРУЕМЫХ МИКРОСПОР IN VITRO | 2013 |
|
RU2557389C2 |
| Способ получения посадочного материала хризантемы в условиях in vitro | 2020 |
|
RU2743967C1 |
| Способ создания удвоенных гаплоидов кабачка Cucurbita pepo L. в культуре изолированных семязачатков | 2023 |
|
RU2831839C1 |
| Способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro | 2022 |
|
RU2798292C1 |
| Питательные среды для способа получения дигаплоидов озимой пшеницы | 2023 |
|
RU2821590C1 |
| Способ создания удвоенных гаплоидов капусты белокочанной (Brassica oleracea L.) в культуре изолированных микроспор | 2021 |
|
RU2769815C1 |
| Способ культивирования растений in vitro разных таксономических групп | 2023 |
|
RU2804965C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения растений-регенерантов Brassica oleracea L. in vitro, относится к области биотехнологии, предназначено для культивирования in vitro репродуктивных органов и может быть использовано для получения нового исходного материала для создания сортов. Задача изобретения ускорить процесс селекции. Это достигается за счет того, что бутоны первоначально подвергаются вакуумной инфильтрации растворами препарата Аминовен 15%-ного (концентрация 3 мл/л) или препарата Дропп (концентрация 1 мг/л) в течение 10 минут при 0,8 атм с последующим культивированием изолированных пыльников, микроспор, завязей или семяпочек на питательной среде, содержащей минеральные соли по прописи Мурасиге и Скуга (МС). В качестве индукторов эмбриогенеза в состав питательной среды добавляют гормоны (тидиазурон в концентрации 0,01 мг/л и индолилуксусная кислота (ИУК) 0,3 мг/л). Изобретение позволяет увеличить частоту возникновения гаплоидных растений на 25-30%. 1 пр.
Способ получения растений-регенерантов Brassica oleracea L. in vitro, включающий изолирование бутонов с последующим культивированием пыльников и завязей на питательной среде Мурасиге и Скуга, с добавлением индуктора эмбриогенеза, отличающийся тем, что изолированные бутоны стерилизуют и подвергают вакуумной инфильтрации в течение 10 минут в вакуумной камере при давлении 0,8 атм раствором препарата Аминовен 15%-ного в концентрации 3 мл/л или раствором препарата Дропп в концентрации 1 мг/л, с последующим культивированием изолированных пыльников, микроспор, завязей или семяпочек на питательной среде по прописи Мурасиге и Скуга, при этом в качестве индукторов эмбриогенеза в состав питательной среды добавляют гормоны тидиазурона в концентрации 0,01 мг/л и индолилуксусной кислоты в концентрации 0,3 мг/л.
| КОЗАРЬ Е.В | |||
| и др | |||
| Получение удвоенных гаплоидов Brassica purpuraria, Овощи России, N6, 2019, с | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| КИРАКОСЯН Р.Н | |||
| и др | |||
| Получение растений-регенерантов из репродуктивных органов растений капусты белокачанной (Brassica oleracea L.) in vitro, Известия ТСХА, выпуск 1, 2015, с | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| СТАРЦЕВ С.В | |||
| Основные этапы технологии получения | |||
Авторы
Даты
2021-11-17—Публикация
2021-04-08—Подача