Настоящее изобретение относится к новым соединениям, которые являются ингибиторами JAK3 киназы, способам их получения, промежуточным соединениям и фармацевтическим композициям, содержащим их.
Янус-киназа-3 (JAK3) является членом Янус-семейства протеинкиназ. Хотя другие члены этого семейства экспрессируются по существу всеми тканями, экспрессия JAK3 ограничена гематопоэтическими клетками. Это согласуется с их существенной ролью в передаче сигналов через рецепторы IL-2, IL-4, IL-7, IL-9, IL-13 и IL-15 путем нековалентной ассоциации JAK3 с гамма-цепью, общей для этих многоцепочечных рецепторов. Все эти цитокины обладают той общей функцией, что они вовлечены в дифференциацию и пролиферацию лимфоцитов. Были идентифицированы группы пациентов с XSCID (Х-сцепленная форма тяжелого комбинированного иммунодефицита) со значительно сниженными уровнями JAK3 белка или с генетическими дефектами общей гамма-цепи, позволяющие предположить, что причиной иммуносупрессии должно являться блокирование передачи сигналов по JAK3 пути. Исследования на животных позволили предположить, что JAK3 не только играет критическую роль в созревании В- и Т-лимфоцитов, но также JAK3 постоянно требуется для поддержания функции Т-клеток. Модулирование иммунной активности посредством этого нового механизма может оказаться полезным в лечении Т-клеточных пролиферативных нарушений, таких как отторжение трансплантата и аутоиммунные заболевания.
Роль JAK3 в тучных клетках описана у нокаутированных мышей. Так, IgE/антиген-индуцированная дегрануляция и высвобождение медиаторов существенно уменьшались в тучных клетках, образующихся у мышей с дефицитом JAK3. Дефицит JAK3 не влияет на пролиферацию тучных клеток in vitro, также было показано, что уровни IgE рецепторов и содержание медиаторов одинаковы в JAK3-/- и JAK3+/+ тучных клетках. Следовательно, JAK3 оказывается существенным для полного ответа тучных клеток, стимулированных IgE. Роль JAK3 в активации тучных клеток была хорошо установлена в системе на мышах, однако нет опубликованных данных о функции тучных клеток у пациентов с AR-SCID (аутосомно-рецессивная форма тяжелого комбинированного иммуннодефицита). Нацеливание JAK3 обеспечивает основу для нового и эффективного лечения аллергических реакций, опосредованных тучными клетками.
К настоящему времени был описан ряд ингибиторов JAK3, в число которых входят хиназолины (Sudbeck, E.A. et al. Clinical Cancer Res. 5 (1999) 1569-82, WO 00/0202) и пирроло[2,3-d]пиримидины (Blumenkopf, Т.А. et al. WO 99/65909).
В данной заявке в качестве ингибиторов JAK3 заявлены соединения, представляющие собой 4-анилинохинолин-3-карбоксамиды. Структурно родственные соединения были ранее описаны в качестве ингибиторов киназ; например, в WO 00/18761 и WO 98/43960 описаны хинолин-3-карбонитрильные производные. В недавней публикации (Boschelli, D.H. et al. J. Med. Chem. 44 (2001) 822-33) было показано, что одно соединение по настоящему изобретению не обладает никакой ингибирующей способностью в отношении активности Src-протеин-тирозинкиназы. JAK3 не упоминается ни в одном указанном выше литературном примере.
Два соединения и их синтез, относящиеся к данному изобретению, были описаны ранее (Boschelli, D.H. et al. J. Med. Chem. 44 (2001) 822-33 и Wissner et al. WO 98/43960).
Следовательно, в настоящем изобретении предложены ароматические производные 6,7-дизамещенных 3-хинолинкарбоксамидов формулы (I) и их фармацевтически приемлемые соли для применения в изготовлении лекарства для лечения заболевания, опосредованного JAK3:
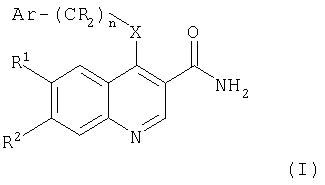
где:
n равно 0 или 1;
Х представляет собой NR3 или О;
Ar выбирают из фенила, тетрагидронафтенила, индолила, пиразолила, дигидроинденила, 1-оксо-2,3-дигидроинденила или индазолила, каждый из которых может быть, возможно, замещен одной или более чем одной группой, выбранной из галогена, гидрокси, циано, C1-C8алкокси, CO2R8, CONR9R10, C1-C8алкил-О-C1-C8алкила, C1-C8алкил-NR8-C1-C8алкила, C1-C8алкил-CONR9R10, NR8COC1-C8алкила, C1-C8алкилтио или C1-C8алкила (возможно, замещенного одной или более чем одной гидрокси или цианогруппой или атомами фтора);
группы R являются независимо водородом или C1-C8алкилом;
R1 и R2 независимо выбирают из водорода, галогена, нитро, циано, C1-C8алкила, C1-C8алкокси, гидрокси, фенила, Y(CR11 2)pNR4R5, Y(CR11 2)pCONR4R5, Y(CR11 2)pCO2R6, Y(CR11 2)pOR6, Y(CR11 2)pR6;
или R1 и R2 соединены вместе как -ОСН2O- или -OCH2CH2O-;
группы R11 представляют собой независимо водород, C1-C8алкил, гидрокси или галоген;
р равно 0, 1, 2, 3, 4 или 5;
Y представляет собой кислород, CH2 или NR7;
R3 представляет собой водород или C1-C8алкил;
R4 и R5 каждый независимо представляют собой водород, C1-C8алкил, или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют 4-7-членную насыщенную или ароматическую гетероциклическую кольцевую систему, возможно, содержащую дополнительный кислород, серу или группу NR6, или один из R4 и R5 является водородом или C1-C8алкилом, а другой представляет собой 5- или 6-членную гетероциклическую кольцевую систему, возможно, содержащую дополнительный атом кислорода, серы или азота;
R6 представляет собой водород, C1-C8алкил, фенил или бензил;
R7 представляет собой водород или C1-C8алкил;
R8 представляет собой водород или C1-C8алкил;
R9 и R10 каждый независимо представляют собой водород или C1-C8алкил,
при условии, что это соединение не является 4-[(3-бромфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-[(2,4-дихлорфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-(2-бромоанилино)-6,7-диметокси-3-хинолинкарбоксамидом и 4-(1,5-дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамидом.
Предпочтительно обе R группы являются водородом.
Предпочтительно Х представляет собой NR3.
Также предпочтительно, чтобы Ar представлял собой фенил, возможно, замещенный одной или более чем одной группой, выбранной из галогена, гидрокси, циано, C1-C8алкокси, CO2R8, CONR9R10, C1-C8алкил-О-C1-C8алкила, C1-C8алкил-NR8-C1-C8алкила, C1-C8алкил-CONR9R10, NR8COC1-C8алкила, C1-C8алкилтио или C1-C8алкила (возможно замещенного одной или более чем одной гидрокси или цианогруппой или атомами фтора).
R1 предпочтительно представляет собой метокси, этокси, OCH2CONH2, O(СН2)2OMe, O(СН2)2NR4R5 или O(CH2)3NR4R5, где R4 и R5 оба являются водородом или метилом, или вместе с азотом, к которому они присоединены, образуют пиперидиновое или морфолиновое кольцо, или R1 представляет собой NH(CH2)3NR4R5, где R4 и R5 вместе с азотом, к которому они присоединены, образуют имидазольное кольцо.
R2 предпочтительно представляет собой метокси, этокси, O(СН2)2OMe, O(СН2)3ОН, O(СН2)3CO2Ме, O(CH2)2NR4R5, O(CH2)3NR4R5 или O(CH2)4NR4R5, где один из R4 или R5 является метилом, а другой является пиридилом, или R4 или R5 выбирают из водорода или метила, или вместе с азотом, к которому они присоединены, они образуют тиоморфолиновую, пиперидиновую, морфолиновую, имидазольную, триазольную или 2,6-диметилморфолиновую группу.
Наиболее предпочтительными соединениями по изобретению являются следующие:
6-Бензилокси-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-Гидрокси-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-(2-метоксиэтокси)-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-октилокси-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(4-морфолинил)этокси]-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пиперидинил)этокси]-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пирролидинил)этокси]-3-хинолинкарбоксамид;
6-[2-(Диметиламино)этокси]-4-(3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-[2-(Диметиламино)-2-оксоэтокси]-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-(2-Амино-2-оксоэтокси)-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
6-Метокси-4-(2-(метилсульфанил)анилино]-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-(1Н-Индол-4-иламино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
Метил-4-{[3-(аминокарбонил)-6-метокси-4-(2-толуидино)-7-хинолинил]окси}бутаноат;
4-(2-Этиланилино)-7-(3-гидроксипропокси)-6-метокси-3-хинолинкарбоксамид;
6-Метокси-7-[2-(4-морфолинил)этокси]-4-(2-толуидино)-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-[3-(1H-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-[4-(4-морфолинил)бутокси]-3-хинолинкарбоксамид;
7-(3-Хлоропропокси)-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
7-{3-[(цис)-2,6-Диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
7-{3-[(транс)-2,6-Диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(1-пиперидинил)пропокси]-3-хинолинкарбоксамид;
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-тиоморфолинил)пропокси]-3-хинолинкарбоксамид;
6-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-[3-(1Н-имидазол-1-ил)пропокси]-7-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-7-метокси-6-(3-тиенилметокси)-3-хинолинкарбоксамид;
6-[2-(Диметиламино)этокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
6-(3-Аминопропокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-7-метокси-6-[2-(метиламино)этокси]-3-хинолинкарбоксамид;
6-(2-Аминоэтокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
7-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-{3-[метил(4-пиридинил)амино]пропокси}-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-{2-[метил(4-пиридинил)амино]этокси}-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-[2-(метиламино)этокси]-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-7-[2-(1-пиперазинил)этокси]-3-хинолинкарбоксамид;
4-(2-Этиланилино)-7-[3-(1Н-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-7-[2-(1H-имидазол-1-ил)этокси]-6-метокси-3-хинолинкарбоксамид;
7-(3-Аминопропокси)-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид;
7-Гидрокси-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
6-{[3-(1H-имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-Метокси-6-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид;
7-Метокси-6-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
7-Метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
6-Метокси-7-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
6-Метокси-7-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид;
7-{[3-(1H-имидазол-1-ил)пропил]амино}-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-[(1-Бензил-4-пиперидинил)амино}-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6-Метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
4-[3-(Гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(4-Фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[(1-Этил-1H-пиразол-5-ил)амино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-Аминокарбонил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(2,3-диметиланилино)-3-хинолинкарбоксамид;
6,7-Диметокси-4-(5,6,7,8-тетрагидро-1-нафталиниламино)-3-хинолинкарбоксамид;
4-(4-Карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-Индол-4-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(Аминокарбонил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-Гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(3-метокси-2-метиланилино)-3-хинолинкарбоксамид;
6,7-Диметокси-4-[(1-метил-1Н-индол-4-ил)амино]-3-хинолинкарбоксамид;
6,7-Диметокси-4-[(1-оксо-2,3-дигидро-1H-инден-4-ил)амино]-3-хинолинкарбоксамид;
4-(1-Гидрокси-2,3-дигидро-1Н-инден-4-ил)амино-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(4-метоксикарбонил-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-Гидроксиметил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(2-пропиланилино)-3-хинолинкарбоксамид;
4-(2-Изопропиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(втор-Бутил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-[3-(метоксиметил)-2-метиланилино]-3-хинолинкарбоксамид;
4-[3-(изо-Бутоксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(Цианометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-{3-[(Этиламино)метил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид;
4-{3-[2-(Этиламино)-2-оксоэтил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид;
Этил-2-(3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилфенил)ацетат;
4-[3-(2-Амино-2-оксоэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(2-Гидроксиэтил)-2-метиланилино]-6,7-ДИметокси-3-хинолинкарбоксамид;
4-(3-{2-[(2-Гидроксиэтил)амино]-2-оксоэтил}-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
трет-Бутил-3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилбензилкарбамат;
4-[3-(Аминометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Фторо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(4-Бромо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(4-Хлоро-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2,4-Диметиланилино)-6-метокси-3-хинолинкарбоксамид;
6-Метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-Гидрокси-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-Бромоанилино)-6-метокси-3-хинолинкарбоксамид;
4-(2,4-Диметоксианилино)-6-метокси-3-хинолинкарбоксамид;
6-Метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(2-Этоксианилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6-метокси-3-хинолинкарбоксамид;
6-Метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6-Метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(4-Бромо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-Диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(2-Бромо-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-Бромо-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-Диметоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Фторо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(4-Бромо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(4-Хлоро-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2,4-Диметиланилино)-7-метокси-3-хинолинкарбоксамид;
7-Метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-Гидрокси-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Бромоанилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Бромо-4-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-Бромо-4-фтороанилино)-7-метокси-3-хинолинкарбоксамид;
4-(2,4-Диметоксианилино)-7-метокси-3-хинолинкарбоксамид;
6,7-Дихлоро-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
6,7-Дихлоро-4-(2,4-диметоксианилино)-3-хинолинкарбоксамид;
4-(2-Этиланилино)-3-хинолинкарбоксамид;
4-(2-Толуидино)-3-хинолинкарбоксамид;
4-[2-(Метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2-Этоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(Гидроксиметил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6,7-Диметокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2,4-Дибромоанилино)-6,7-диметокси-3-хинолинкарбоксамид;
7-Метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(2-Этоксианилино)-7-метокси-3-хинолинкарбоксамид;
4-[2-(Аминокарбонил)анилино]-7-метокси-3-хинолинкарбоксамид;
4-(2-Этиланилино)-7-метокси-3-хинолинкарбоксамид;
7-Метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-Метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
6,7-Дихлоро-4-(2-метоксианилино)-3-хинолинкарбоксамид;
6,7-Дихлоро-4-(2-этиланилино)-3-хинолинкарбоксамид;
6,7-Дихлоро-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2,5-Диметиланилино)-6,7-Диметокси-3-хинолинкарбоксамид;
4-(5-Фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(5-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Гидрокси-2,5-диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-Гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-Анилино-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-Хлоро-2-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,6-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(4-метоксианилино)-3-хинолинкарбоксамид;
4-(3-Хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-Хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(Ацетиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,5-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-Индол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-Индазол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-Индазол-6-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,5-Дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(2-Гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-Хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-[3-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
6,7-Диметокси-4-(2-метокси-5-метиланилино)-3-хинолинкарбоксамид;
4-[4-(Диметиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-[4-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-[4-(2-Гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-Гидрокси-4-метоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,3-Дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-(2,3,4-трифтороанилино)-3-хинолинкарбоксамид;
6,7-Диметокси-4-(3-толуидино)-3-хинолинкарбоксамид;
4-(2-Гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-4-гидроксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(Гидроксиметил)-4-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-Хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-5-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[(2-Цианофенил)амино]-6,7-диметоксихинолин-3-карбоксамид;
4-[(2,5-Дифторофенил)амино]-6,7-диметоксихинолин-3-карбоксамид;
4-(1Н-индол-5-иламино)-6,7-диметоксихинолин-3-карбоксамид;
6,7-Дихлоро-4-(2-метиланилино)-3-хинолинкарбоксамид;
4-(2,3-Дигидро-1Н-инден-1-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-Диметокси-4-{[2-(трифторометил)бензил]амино}-3-хинолинкарбоксамид;
6,7-Диметокси-4-[(1-фенилэтил)амино]-3-хинолинкарбоксамид;
4-(3-Гидроксиметил-2-метиланилино)-3-хинолинкарбоксамид;
9-(3-Гидроксиметил-2-метиланилино)-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксамид;
4-[(2-Этилфенил)амино]-7-метокси-6-[2-(пропиламино)этокси]хинолин-3-карбоксамид;
6-[2-(Этиламино)этокси]-4-[(2-этилфенил)амино]-7-метоксихинолин-3-карбоксамид;
6-[2-(Изопропиламино)этокси]-7-метокси-4-[(3-метокси-2-метилфенил)амино]хинолин-3-карбоксамид;
6-[2-(Диметиламино)этокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-7-метоксихинолин-3-карбоксамид;
6-[3-(Диэтиламино)пропокси]-4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-метоксихинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-7-метокси-6-[2-(метиламино)этокси]хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-4-иламино)пропокси]хинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-7-метокси-6-[3-[(2-амино-2-оксоэтил)амино]пропокси]-хинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-7-метокси-6-[3-(1Н-пиразол-3-иламино)пропокси]хинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-7-метокси-6-[3-(пиридин-2-иламино)пропокси]хинолин-3-карбоксамид;
Этил-4-[(3-(аминокарбонил)-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-7-ил)окси]бутаноат;
7-[3-(Диэтиламино)пропокси]-6-метокси-4-[(2-метоксифенил)амино]хинолин-3-карбоксамид;
7-[3-(Этиламино)пропокси]-6-метокси-4-{[2-(трифторметил)фенил]амино}хинолин-3-карбоксамид;
7-[3-(Этиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-7-[3-(изопропиламино)пропокси]-6-метоксихинолин-3-карбоксамид;
7-[3-(Этиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(пропиламино)пропокси]хинолин-3-карбоксамид;
7-[3-(Диметиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(Диэтиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(Диметиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
7-[3-(Диэтиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
4-[(2-Этилфенил)амино]-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбоксамид;
4-{[3-(Гидроксиметил)-2-метилфенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(1,1-Диоксидотиоморфолин-4-ил)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
4-{[3-(Гидроксиметил)-2-метилфенил]амино}-7-[3-(3-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]хинолин-3-карбоксамид;
7-(3-Азепан-1-илпропокси)-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
6,7-Диметокси-4-{[2-(метилтио)фенил]амино}хинолин-3-карбоксамида трифторацетат;
6,7-Диметокси-4-[(4-метокси-2-метилфенил)амино]хинолин-3-карбоксамид;
4-{[2-Бромо-3-(гидроксиметил)фенил]амино}-6,7-Диметоксихинолин-3-карбоксамид;
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6,7-диметоксихинолин-3-карбоксамид;
или их фармацевтически приемлемые соли.
Согласно изобретению предложено также соединение формулы (I), как оно определено выше, для ингибирования JAK3.
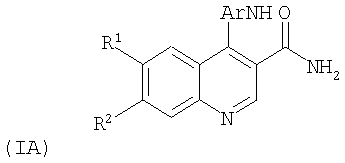
Согласно изобретению предложены также 4-анилинохинолин-3-карбоксамиды формулы (IA):
где
Ar представляет собой фенил, замещенный этилом, пропилом, гидроксиметилом или СО2Н или дизамещенный метилом и гидроксиметилом;
R1 представляет собой метокси, этокси или группу OCH2CONH2, ОСН2СН2ОСН3 или O(CH2)pNR4R5, где р равно 2 или 3, а R4 и R5 представляют собой водород, метил, этил или пропил, или R4 и R5 совместно образуют пирролидиновое, имидазольное или морфолиновое кольцо;
R2 представляет собой метокси, этокси или O(CH2)pNR4R5, где р равно 2, 3 или 4, а R4 и R5 представляют собой водород, метил или этил, или один из R4 или R5 является метилом, а другой является пиридилом или пиразолом, или R4 и R5 образуют пиперидиновое, гидроксипиперидиновое, тиоморфолиновое, морфолиновое, пирролидиновое, 2,6-диметилморфолиновое, имидазольное или триазольное кольцо;
или их фармацевтически приемлемые соли или сольваты,
- при условии, что когда А представляет собой фенил, замещенный этилом или пропилом или дизамещенный метилом, то тогда R1 и R2 не являются оба метокси, R1 и R2 не являются оба этокси, или один из R1/R2 не является метокси, когда другой является этокси.
Наиболее предпочтительными соединениями формулы (IA) являются следующие:
4-(2-этиланилино)-6-метокси-7-{2-[метил(4-пиридинил)амино]этокси}-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-тиоморфолинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(1-пиперидинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
7-[3-(диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамида,
7-{3-[(2R,6S)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[4-(4-морфолинил)бутокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-{3-[метил(4-пиридинил)амино]пропокси}-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-метокси-6-[2-(метиламино)этокси]-3-хинолинкарбоксамида,
7-{3-[(2S,6S)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-[3-(1Н-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбоксамида,
6-(2-аминоэтокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[2-(метиламино)этокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-(3-гидроксипропокси)-6-метокси-3-хинолинкарбоксамида,
6-метокси-7-[2-(4-морфолинил)этокси]-4-(2-толуидино)-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[2-(1-пирролидинил)этокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-[2-(1H-имидазол-1-ил)этокси]-6-метокси-3-хинолинкарбоксамида,
4-[3-(2-гидроксиэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
7-метокси-6-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-[3-(1H-имидазол-1-ил)пропокси]-7-метокси-3-хинолинкарбоксамида,
7-(3-аминопропокси)-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамида,
метил-4-{[3-(аминокарбонил)-6-метокси-4-(2-толуидино)-7-хинолинил]окси}бутаноата,
4-[3-(аминометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
6-{[3-(1H-имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-(2-метоксиэтокси)-3-хинолинкарбоксамида,
6-[2-(диметиламино)этокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-[3-(цианометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
4-[3-(2-амино-2-оксоэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
6-(3-аминопропокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[2-(4-морфолинил)этокси]-3-хинолинкарбоксамида,
и их фармацевтически приемлемые соли.
Также предпочтительными соединениями формулы (IA) являются соединения, выбранные из:
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-4-иламино)пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-[(2-амино-2-оксоэтил)амино]пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-(1Н-пиразол-3-иламино)пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-2-иламино)пропокси]хинолин-3-карбоксамида,
этил-4-[(3-(аминокарбонил)-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-7-ил)окси]бутаноата,
7-[3-(диэтиламино)пропокси]-6-метокси-4-[(2-метоксифенил)амино]хинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-6-метокси-4-{[2-(трифторметил)фенил]амино}хинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-[3-(изопропиламино)пропокси]-6-метоксихинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(пропиламино)пропокси]хинолин-3-карбоксамида,
7-[3-(диметиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
7-[3-(диэтиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамида,
7-[3-(диметиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
7-[3-(диэтиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
7-{3-[(2-этоксиэтил)амино]пропокси}-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1илпропокси)хинолин-3-карбоксамида,
4-[(2-Этилфенил)амино]-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбоксамида,
4-{[3-(гидроксиметил)-2-метилфенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-[3-(3-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]хинолин-3-карбоксамида,
и их фармацевтически приемлемые соли.
Согласно изобретению предложены соединения формулы (IA) для применения в качестве ингибиторов JAK3 киназы.
Изобретение также относится к фармацевтической композиции, ингибирующей JAK3 киназу, содержащей соединение формулы (IA) или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем.
Согласно изобретению предложено также применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли для изготовления лекарства для лечения заболевания или состояния, опосредованного JAK3.
Предпочтительно это заболевание или состояние представляет собой астму, отторжение/трансплантацию "трансплантат против хозяина" или ревматоидный артрит.
В изобретение предложен способ получения соединения формулы (I), при котором:
соединение формулы (II):
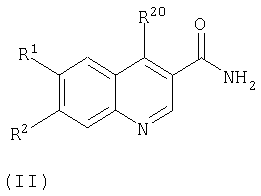
где R1 и R2 такие, как определено в формуле (I), или являются их защищенными производными, а R20 представляет собой уходящую группу, подвергают взаимодействию с соединением формулы (III):
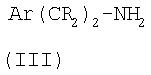
где Ar и R такие, как определено в формуле (I), или являются их защищенными производными,
и возможно затем
- удаляют любые защитные группы,
- превращают соединение формулы (I) в другое соединение формулы (I),
- осуществляют образование фармацевтически приемлемой соли.
В этом способе группа R20 является уходящей группой, такой как галоген, в частности хлоро. Реакцию можно осуществлять в инертном растворителе, таком как DMF (диметилформамид), при повышенной температуре, например при приблизительно 100°С.
Кроме того, согласно изобретению предложен также способ получения соединения формулы (I), при котором:
для соединений формулы (I), где R1 и/или R2 являются группами Y(CH2)pNR4R5, Y(CH2)pCONR4R5, Y(CH2)pCO2R6, Y(CH2)pOR6 или Y(CH2)pR6, где Y является кислородом, соединение формулы (IV):
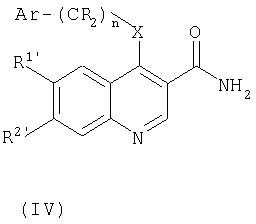
где R1' или R2', подлежащий превращению в группу Y(CH2)pNR4R5, Y(CH2)pCONR4R5 Y(CH2)pCO2R6, Y(CH2)pOR6 или Y(CH2)pR6, представляет собой гидрокси, а другой R1 или R2 и Ar являются такими, как определено в предыдущем способе, подвергают взаимодействию с соединением формулы (V):
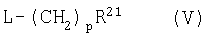
где R21 представляет собой NR4R5, CONR4R5, CO2R6, OR6 или R6, a R4, R5 и R6 такие, как определено в формуле (I), или являются их защищенными производными,
и возможно затем
- удаляют любые защитные группы,
- превращают соединение формулы (I) в другое соединение формулы (I),
- осуществляют образование фармацевтически приемлемой соли.
В этом способе уходящая группа L предпочтительно представляет собой галоген, в частности хлоро. Реакцию можно осуществлять в присутствии основания, такого как карбонат цезия, в инертном растворителе, таком как DMF или этанол.
Соединения формулы (II) можно получать путем взаимодействия соединений формулы (VI):
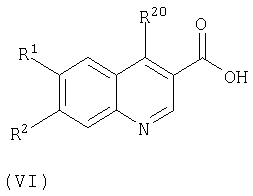
где R1, R2 и R20 такие, как определено в формуле (II), с хлорирующим агентом, таким как тионилхлорид, и взаимодействия соответствующего хлорангидрида с аммиаком.
Соединения формулы (VI) можно получить, используя информацию из химической литературы.
Термин «алкил» при использовании его самого по себе или как части другой группы, такой как алкокси, означает любую алкильную группу с прямой или разветвленной цепью. Термин «арил» включает в себя фенильную и нафтильную группы.
Группы R представляют собой предпочтительно водород или метил, и наиболее предпочтительно обе группы R представляют собой водород.
Х представляет собой NR3 или О. Предпочтительно Х представляет собой NR3, где R3 является С1-4алкилом, более предпочтительно Х представляет собой NH.
n равно 0 или 1, предпочтительно n равно 0.
р равно 0, 1, 2, 3, 4 или 5, предпочтительно р равно 1-4, более предпочтительно р равно 2 или 3.
Заместители в группе Ar могут присутствовать в любом подходящем положении. Может присутствовать более чем один заместитель, и они могут быть одинаковыми или разными. Предпочтительно Ar представляет собой индолил или фенил, наиболее предпочтительно фенил.
Более предпочтительно группа Ar является незамещенной или имеет один или более чем один заместитель, включая заместители в соединениях, приведенных в данном описании в качестве примеров, такие как метил, этил, пропил, бутил, тиометил, гидроксиметил, бромо, фторо, гидрокси, CO2Н, CONH2, CF3, метоксиметил, бутоксиметил, цианометил, этиламинометил, аминометил, этиламино-2-оксоэтил, гидроксиэтил, 2-амино-2-оксоэтил, СО2СН3, метокси или этокси. Когда Ar является фенилом, тогда предпочтительными являются одна или две замещающие группы. Еще более предпочтительные заместители включают в себя этил, н-пропил, изопропил, гидроксиметил, гидроксиэтил, тиометил, аминометил, бромо и CO2Н. Наиболее предпочтительными заместителями являются метил, этил и гидроксиметил.
Соответственно, R1 и R2 независимо выбраны из водорода, галогена, нитро, циано, C1-C8алкила, C1-C8алкокси, гидрокси, Y(CH2)pNR4R5, Y(CH2)pCONR4R5, Y(CH2)pCO2R6, Y(CH2)pOR6, Y(CH2)pR6; или R1 и R2 соединены вместе как -ОСН2O- или -ОСН2СН2O-. Предпочтительно R1 и R2 представляют собой водород, хлоро, метокси, этокси, C(CH2)2NR4R5, O(CH2)3NR4R5, NH(CH2)2NR4R5, или NH(CH2)2NR4R5, где R4 и R5 являются водородом или метилом, или один является метилом, а другой является пиридилом, или R4 и R5 образуют морфолиновое, 3,5-диметилморфолиновое, тиоморфолиновое, пирролидиновое, пиперазиновое (возможно замещенное), пиперидиновое, триазольное или имидазолильное кольцо, или R4 и R5 представляют собой независимо O(СН2)3CO2СН3, O-бензил, 1-бензил-4-пиперидиниламино, O(CH2)2NMe2, OCH2CONH2, O(CH2)2NHMe, O(СН2)3NH2, нитро или циано; или R1 и R2 соединены вместе как -ОСН2O- или -ОСН2СН2O-.
Когда R4 и R5 образуют 4-7-членную насыщенную или ароматическую гетероциклическую кольцевую систему, подходящие примеры таких колец включают в себя морфолин, 3,5-диметилморфолин, 2,6-диметилморфолин, тиоморфолин, пирролидин, пиперазин (возможно замещенный C1-C8алкилом), пиперидин, триазол или имидазолил.
Если один из R4 и R5 является водородом или C1-C8алкилом, а другой является 5- или 6-членной гетероциклической кольцевой системой, возможно, содержащей дополнительный атом кислорода, серы или азота, то тогда примеры таких колец включают в себя тиенил, фурил, пиримидил, имидазолил, пиридил и пиразол.
Наиболее предпочтительными соединениями являются те, в которых R1 и/или R2 являются оба метокси или этокси, или один является метокси и другой является этокси.
Особенно предпочтительные соединения по изобретению включают в себя соединения, приведенные здесь в качестве примеров, как в форме свободного основания, так и в виде фармацевтически приемлемых солей.
Соединения по изобретению могут образовывать фармацевтически приемлемые сольваты и соли. Соединения формулы (I) могут образовывать соли присоединения кислот с кислотами, такими как традиционные фармацевтически приемлемые кислоты, например малеиновая, соляная, бромистоводородная, фосфорная, уксусная, фумаровая, салициловая, лимонная, молочная, миндальная, винная, трифторуксусная и метансульфоновая кислоты.
Соединения по настоящему изобретению включают в себя все стереоизомеры, чистые и смешанные рацематы и их смеси. Таутомеры соединений формулы (I) и (IA) также образуют аспект данного изобретения.
Очевидно, что для некоторых функциональных группы может быть необходимой защита с использованием обычных защитных групп. Защита и удаление защиты функциональных групп описаны, например, в "Protective Groups in Organic Chemistry", edited by J. W. F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Chemistry", 3rd edition, T.W.Greene & P.G.M.Wuts, Wiley-lnterscience (1999).
Заболевания, опосредованные JAK3, включают в себя воспалительные, иммунологические и бронхолегочные расстройства, включая следующие: отторжение органотрансплантата, волчанку, рассеянный склероз, ревматоидный артрит, псориаз, диабет I типа и осложнения диабета, рак, астму, ринит, атопический дерматит, аутоиммунные заболевания щитовидной железы, язвенный колит, болезнь Крона, болезнь Альцгеймера, лейкемию и другие аутоиммунные заболевания.
Доза соединения, которую следует вводить, зависит от релевантного показания, возраста, массы и пола пациента, и ее может определить врач. Дозировка предпочтительно будет находиться в интервале от 0,1 мг/кг до 100 мг/кг.
Эти соединения можно вводить местно, например в легкое и/или дыхательные пути, в форме растворов, суспензий, HFA (гидрофторалкановых) аэрозолей или сухих порошковых препаратов, например препаратов в устройстве для ингаляции, известном как Turbuhaler®; или системно, например путем перорального введения в форме таблеток, пилюль, капсул, сиропов, порошков или гранул, или путем парентерального введения, например в форме стерильных парентеральных растворов или суспензий, или путем ректального введения, например в форме суппозиториев.
Соединения по изобретению можно вводить самих по себе или в виде фармацевтической композиции, содержащей соединение по изобретению в комбинации с фармацевтически приемлемым разбавителем, адъювантом или носителем. Особенно предпочтительными являются композиции, не содержащие вещества, способного вызвать побочную, например аллергическую, реакцию.
Сухие порошковые препараты и находящиеся под давлением HFA аэрозоли соединений по изобретению можно вводить путем пероральной или интраназальной ингаляции. Для ингаляции желательно, чтобы соединение было тонко диспергировано. Тонко диспергированное соединение предпочтительно имеет срединный массовый диаметр менее 10 мкм и может быть суспендировано в смеси пропеллентов при помощи диспергирующего агента, такого как С8-С20 жирная кислота или ее соль (например олеиновая кислота), соль желчной кислоты, фосфолипид, алкилсахарид, перфторированное или полиэтоксилированное поверхностно-активное вещество или другой фармацевтически приемлемый диспергирующий агент.
Соединения по изобретению также можно вводить при помощи ингалятора сухого порошка. Этот ингалятор может представлять собой одно- или многодозовый ингалятор и может являться ингалятором для сухого порошка, активируемым вдохом.
Одной возможностью является смешивание тонко диспергированного соединения с веществом-носителем, например моно-, ди- или полисахаридом, сахарным спиртом или другим полиолом. Подходящими носителями являются сахара, например лактоза, глюкоза, раффиноза, мелезитоза, лактит, мальтит, трегалоза, сахароза, маннит; и крахмал. Альтернативно тонко диспергированное соединение можно покрыть оболочкой другого вещества. Порошковую смесь также можно распределить в твердые желатиновые капсулы, каждая из которых содержит требуемую дозу активного соединения.
Другой возможностью является переработка тонко диспергированного порошка в сферы, которые разрушаются во время процесса ингаляции. Этим сферонизированным порошком можно заполнить резервуар для лекарства, например, известный как Turbuhaler®, где дозирующее устройство отмеряет требуемую дозу, которая затем ингалируется пациенту. При помощи этой системы активное соединение с веществом-носителем или без него доставляется пациенту.
Для перорального введения активное соединение можно смешивать с адъювантом или носителем, например лактозой, сахарозой, сорбитом, маннитом; крахмалом, например картофельным крахмалом, кукурузным крахмалом или амилопектином; производным целлюлозы; связывающим веществом, например желатином или поливинилпирролидоном, и/или смазывающим веществом, например стеаратом магния, стеаратом кальция, полиэтиленгликолем, воском, парафином и тому подобным, и затем прессовать в таблетки. Если требуются таблетки, покрытые оболочкой, ядра, полученные, как описано выше, можно покрыть концентрированным сахарным раствором, который может содержать, например, гуммиарабик, желатин, тальк, диоксид титана и тому подобное. Альтернативно таблетку можно покрыть подходящим полимером, растворенным в легколетучем органическом растворителе.
Для получения мягких желатиновых капсул соединение можно смешивать с, например, растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы соединения с использованием любого из указанных выше эксципиентов для таблеток. Также твердые желатиновые капсулы можно наполнить жидкими или полутвердыми препаратами лекарственного средства.
Жидкие препараты для перорального применения могут находиться в форме сиропов или суспензий, например растворов, содержащих соединение, при этом остальной частью является сахар и смесь этанола, воды, глицерина и пропиленгликоля. Возможно, такие жидкие препараты могут содержать красящие агенты, ароматизирующие агенты, сахарин и/или карбоксиметилцеллюлозу в качестве загущающего агента или другие эксципиенты, известные специалистам в данной области техники.
Соединения по изобретению также можно вводить в комбинации с другими соединениями, применяемыми для лечения указанных выше состояний.
Подразумевается, что термин "лечебная терапия" при использовании здесь включает в себя профилактические, диагностические и терапевтические режимы, осуществляемые in vivo или ex vivo у людей или других млекопитающих.
Следующие примеры иллюстрируют данное изобретение.
Общие методы. Все реакции осуществляли в сухой стеклянной посуде в атмосфере аргона при комнатной температуре, если не указано иного. Все растворители и реагенты использовали такими, как они были получены. Для препаративной хроматографии на силикагеле использовали силикагель Merck 60 (0,040-0,063 мм). Для препаративной HPLC (высокоэффективная жидкостная хроматография) использовали колонку Kromasil KR-100-5-C18 (250×20 мм, Akzo Nobel) и смеси ацетонитрил/вода со скоростью потока 10 мл/мин. Мониторинг реакций проводили при 254 нм при помощи аналитической HPLC, используя Kromasil C18 колонку (150×4,6 мм) и градиент (содержащий 0,1% трифторуксусной кислоты) от 5 до 100% ацетонитрила в воде со скоростью потока 1 мл/мин. Выпаривание растворителей осуществляли при пониженном давлении, используя роторный испаритель с максимальной температурой 40°С. Продукты сушили при пониженном давлении при 40°С.
1H-ЯМР (ядерный магнитный резонанс) спектры регистрировали на Varian lnova-400 или Unity-500 + приборе. Центральный пик растворителя - хлороформа-d (δн 7,27 м.д. (миллионные доли)), диметилсульфоксида-d6 (δн 2,50 м.д.) или метанола-d4 (δн 3,35 м.д.) использовали в качестве внутренних стандартов. Масс-спектры низкого разрешения получали в системе Hewlett Packard 1100 LC-MS (жидкостная хроматография - масс-спектрометрия), снабженной ионизационной камерой APCI (химическая ионизация при атмосферном давлении).
Силикагель Merck 60 (0,040-0,063) использовали для препаративной хроматографии на силикагеле. Для препаративной HPLC использовали Kromasil KR-100-5-C18 колонку (250×20 мм, Akzo Nobel) и смеси ацетонитрил/вода со скоростью потока 10 мл/мин. Мониторинг реакций проводили при 254 нм при помощи аналитической HPLC, используя Kromasil С18 колонку (150×4,6 мм) и градиент (содержащий 0,1% трифторуксусной кислоты) от 5 до 100% ацетонитрила в воде со скоростью потока 1 мл/мин. Выпаривание растворителей осуществляли при пониженном давлении, используя роторный испаритель с максимальной температурой 40°С. Продукты сушили при пониженном давлении при 40°С.
Пример 1
6-(Бензилокси)-4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-3-хинолинкарбоксамид
а) 1-(Бензилокси)-2-метокси-4-нитробензол
4-Нитрогваякола калиевой соли моногидрат (25 г, 111 ммоль) и карбонат цезия (3,25 г, 10 ммоль) переносили в одногорлую колбу на 500 мл и добавляли сухой диметилформамид (200 мл), по каплям добавляли бензилбромид (21,4 г, 125 ммоль) при комнатной температуре в атмосфере N2 и реакционную смесь интенсивно перемешивали в течение приблизительно 3 часов. Растворитель и избыток бензилбромида затем удаляли при пониженном давлении. К неочищенному продукту добавляли воду (200 мл) и этанол (100 мл) и кипятили с обратным холодильником в течение 10-15 минут. Желтоватые кристаллы отфильтровывали от холодной смеси, промывали водой и сушили с получением 29 г (100%-ный выход) указанного в заголовке соединения.
1H ЯМР (CDCl3): δ 7.85 (1Н, dd); 7.77 (1H, d); 7.46-7.32 (5H, m); 5.26 (2H, s); 3.97 (3Н, s).
б) 4-(Бензилокси)-3-метоксианилин. К 1-(бензилокси)-2-метокси-4-нитробензолу (26 г, 100 ммоль), растворенному в этаноле (500 мл) в 2-литровой одногорлой колбе, по каплям добавляли в течение 30 минут раствор дитионита натрия в воде (500 мл), перемешивание продолжали при температуре окружающей среды в течение 2 часов и после этого реакционную смесь нагревали при 70-80°С в течение приблизительно 4 часов, охлаждали и подщелачивали карбонатом натрия. Осадок отфильтровывали, промывали водой и сушили. Объединенные водные фазы экстрагировали этилацетатом. Объединенные органические фазы промывали водой, сушили над сульфатом натрия, фильтровали и упаривали до сухости. Остаток объединяли с отфильтрованным осадком с получением 9,3 г (41%-ный выход) продукта.
1H ЯМР (DMSO-d6): δ 7.42-7.24 (5Н, т); 6.67 (1Н, d); 6.27 (1Н, d); 6.02 (1Н, dd); 4.86 (2H, s); 4.68 (2H, s); 3.67 (3H, s).
в) Диэтил-2-(4-бензилокси-3-метоксианилино)метиленмалонат
Смесь 4-(бензилокси)-3-метоксианилина (9,3 г, 40 ммоль) и диэтилэтоксиметиленмалоната (9,65 г, 45 ммоль) нагревали при 120°С в течение 1-1,5 часов, получаемый этанол удаляли при пониженном давлении с получением 16 г (100%-ный выход) указанного в заголовке соединения.
1H ЯМР (CDCl3): δ 11.0 (1Н, d); 8.43 (1Н, d); 7.45-7.29 (5Н, m); 6.87 (1Н, d); 6.67 (1Н, d); 6.64 (1Н, dd); 5.14 (2H, s); 4.31 (2H, q); 25 (2H, q); 3.91 (3H, s); 1.39 (3H, t); 1.32 (3H, t).
г) Этил-6-бензилокси-4-хлоро-7-метокси-3-хинолинкарбоксилат
Смесь диэтил-2-(4-бензилокси-3-метоксианилино)метиленмалоната (16 г, 40 ммоль), толуола (100 мл) и оксихлорида фосфора (25 мл) нагревали до кипения с обратным холодильником в атмосфере азота в течение 5 часов. После охлаждения раствор упаривали для удаления растворителей и избытка оксихлорида фосфора. Остаток обрабатывали водным бикарбонатом натрия, водой и небольшим количеством этанола, нагревали до кипения с обратным холодильником в течение нескольких минут. После охлаждения осадок отфильтровывали, промывали три раза водой и сушили в вакууме при 50°С с получением 12 г (81%-ный выход) указанного в заголовке соединения.
1H ЯМР (DMSO-d6): δ 8.97 (1Н, s); 7.68 (1Н, s); 7.55 (2H, bd); 7.53 (1Н, s); 7.46-7.35 (3H, m); 5.34 (2H, s); 4.40 (2H, q); 4.00 (3H, s); 1.37 (3H, t).
д) 6-(Бензилокси)-4-хлоро-7-метокси-3-хинолинкарбоновая кислота
Этил-6-(бензилокси)-4-хлоро-7-метокси-3-хинолинкарбоксилат (11,9 г, 32 ммоль) растворяли в смеси тетрагидрофурана (THF) и метанола (300 мл) в соотношении 1:1. Добавляли водный гидроксид натрия (2,0 M, 65 мл, 130 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Органические растворители удаляли путем выпаривания на роторном испарителе и полученный в результате раствор разбавляли еще водой (200 мл), охлажденной на льду, и подкисляли до рН 2-3 соляной кислотой при интенсивном перемешивании. Осадок отфильтровывали, дважды промывали водой, дважды - этанолом и диэтиловым эфиром и, наконец, сушили в вакууме при 50°С в течение ночи с получением белого твердого вещества, 11,0 г (100%-ный выход).
1H ЯМР (DMSO-d6): δ 13.66 (1Н, bs); 8.97 (1H, s); 7.68 (1H, s); 7.54 (2H, bd); 7.52 (1H, s); 7.46-7.34 (3H, m); 5.34 (2H, s); 4.00 (3H, s).
e) 6-(Бензилокси)-4-хлоро-7-метокси-3-хинолинкарбоксамид
Смесь 6-бензилокси-4-хлоро-7-метокси-3-хинолинкарбоновой кислоты (11,0 г, 32 ммоль), тионилхлорида (30 мл) и толуола (100 мл) кипятили с обратным холодильником в течение 2 часов в атмосфере N2.
После охлаждения толуол и избыток тионилхлорида удаляли выпариванием на роторном испарителе, а остаток суспендировали в ацетоне (250 мл) и полученную в результате суспензию охлаждали в ледяной бане. Понемногу добавляли водный аммиак (25%, 20 мл), поддерживая температуру ниже 10°С. Перемешивание продолжали в течение 3 часов и затем ацетон удаляли выпариванием на роторном испарителе. Остаток суспендировали в воде (200 мл) и перемешивали в течение одного часа, отфильтровывали, промывали дважды водой, дважды этанолом и диэтиловым эфиром и, наконец, сушили в вакууме при 50°С в течение ночи с получением не грязно-белого твердого вещества, 10,4 г (95%-ный выход).
1H ЯМР (DMSO-d6): δ 8.65 (1H, s); 8.10 (1H, s); 7.83 (1H, s); 7.59 (1H, s); 7.54 (2H, bd); 7.50 (1H, s); 7.46-7.34 (3H, m); 5.33 (2H, s); 3.98 (3H, s).
ж) 6-Бензилокси-4-3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид. Смесь 6-бензилокси-4-хлоро-7-метокси-3-хинолинкарбоксамида (1,72 г, 5 ммоль), 3-амино-2-метилбензилового спирта (0,82 г, 6 ммоль), уксусной кислоты (1,2 мл) в DMF (20 мл) нагревали при 100°С в течение двух часов. После охлаждения реакционную смесь выливали на ледяную воду (500 мл) и подщелачивали до рН 9 разведенным гидроксидом натрия. Полученный в результате осадок отфильтровывали, промывали водой, сушили на воздухе, промывали дважды диэтиловым эфиром и затем сушили в вакууме при 50°С с получением 2,15 г (97%-ный выход) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (CDCl3): δ 10.82 (1H, s); 8.87 (1H, s); 8.26 (1H, s); 7.59 (1H, s); 7.37-7.20 (5H, m); 7.14-7.04 (3H, m); 6.73 (1H, s); 6.65 (1H, d); 5.22 (1H, t); 4.61 (2H, d); 4.50 (2H, s); 3.91 (3H, s); 2.20 (3H, s).
Пример 2
6-Гидрокси-4-3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
Смесь 6-бензилокси-4-3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамида (2,1 г, 4,7 ммоль) и 10%-ного палладия на угле (0,44 г) в метаноле (50 мл), DMF (40 мл), этилацетате (40 мл) и уксусной кислоте (0,5 мл) подвергали гидрогенолизу при атмосферном давлении при 25°С. Через 24 часа реакционную смесь фильтровали через подушку из целита, которую затем промывали DMF. Объединенные фильтраты подщелачивали добавлением водного аммиака и растворители удаляли при пониженном давлении. Остаток суспендировали в метаноле (10 мл), фильтровали и промывали метанолом и диэтиловым эфиром, сушили в вакууме при 50°С в течение ночи с получением 1,1 г (66%-ный выход) указанного в заголовке соединения в виде желтого твердого вещества.
1H ЯМР (DMSO-d6): δ 10.43 (1Н, s); 9.53 (1H, s); 8.85 (1H, s); 8.27 (1H, s); 7.60 (1H, s); 7.27 (1H, s); 7.08 (1H, d); 6.95 (1H, t); 6.78 (1H, s); 6.40 (1H, d); 5.13 (1H, t); 4.57 (2H, d); 3.92 (3H, s); 2.29 (3H, s).
Пример 3
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
Смесь 6-гидрокси-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамида (0,071 г, 0,20 ммоль), 4-(3-хлорпропил)морфолина (0,036 г, 0,22 ммоль), карбоната цезия (0,13 г, 0,40 ммоль) и DMF (2,5 мл) нагревали при 100°С в течение двух часов. После охлаждения реакционную смесь выливали на воду и экстрагировали три раза дихлорметаном, растворители удаляли при пониженном давлении и остаток хроматографировали на диоксиде кремния, используя смесь дихлорметан/метанол/аммиак (200:10:1) в качестве элюента.
Фракции, содержащие продукт (слегка загрязненный), объединяли и упаривали. Остаток растирали с элюентом с получением 40 мг (38%-ный выход) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (DMSO-d6): δ 10.91 (1H, s); 8.76 (1H, s); 7.26 (1H, s); 7.16 (1H, dd); 7.14 (1H, t); 7.04 (1H, dd); 6.74 (1H, s); 6.15 (2H, bs); 4.69 (2H, bs); 3.95 (3H, s); 3.79 (4Н, bt); 3.54 (2Н, bt); 3.49 (1H, s); 2.46 (4H, m); 2.32 (2H, m); 2.30 (3H, s); 1.63 (2H, qv).
Пример 4
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-(2-метоксиэтокси)-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.81 (1H, s); 8,87 (1H, s); 8.26 (1H, s); 7.59 (1H, s); 7.25 (1H, s); 7.19 (1H, d); 7.07 (1H, t); 6.67 (1H, d); 6.65 (1H, s); 5.15 (1H, t); 4.56 (2H, d); 3.89 (3H, s); 3.47 (2H, bt); 3.40 (2H, bt); 3.20 (3H, s); 2.26 (3H, s).
Пример 5
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-октилокси-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3.
1H ЯМР (DMSO-d6): δ 10.89 (1H, s); 8.86 (1H, s); 8.25 (1H, s); 7.58 (1H, s); 7.22 (1H, s); 7.18 (1H, d); 7.07 (1H, t); 6.70 (1H, d); 6.65 (1H, s); 5.14 (1H, t); 4.55 (2H, d); 3.88 (3H, s); 3.32 (2H, bt); 2.24 (3H, s); 1.45 (2H, m); 1.33-1.15 (10Н, m); 0.87 (3H, t).
Пример 6
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(4-морфолинил)этокси]-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.86 (1H, s); 8.87 (1H, s); 8.26 (1H, br s); 7.59 (1H, br s); 7.24 (1H, s); 7.18 (1H, d); 7.07 (1H, t); 6.68 (1H, d); 6.67 (1H, s); 5.15 (1H, t); 4.55 (2H, d); 3.88 (3H, s); 3.54 (4H, m); 3.45 (2H, bit); 2.43 (2H, t); 2.30 (4H, m); 2.24 (3H, s).
Пример 7
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пиперидинил)этокси]-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.84 (1H, s); 8.86 (1H, s); 8.25 (1H, br s); 7.57 (1H, br s); 7.22 (1H, s); 7.17 (1H, d); 7.05 (1H, t); 6.67 (1H, d); 6.65 (1H, s); 5.13 (1H, br s); 4.54 (2H, s); 3.86 (3H, s); 3.41 (2H, brt); 2.39 (2H, t); 2.25 (4H, m); 2.23 (3H, s); 1.45 (4H, m); 1.35 (2H, m).
Пример 8
4-(3-Гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пирролидинил)этокси]-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3.
1H ЯМР (DMSO-d6): δ 10.83 (1Н, s); 8.87 (1H, s); 8.26 (1H, br s); 7.58 (1H, br s); 7.24 (1H, s); 7.18 (1H, d); 7.06 (1H, t); 6.67 (1H, s); 6.66 (1H, d); 5.16 (1H, brt); 4.55 (2H, d); 3.88 (3H, s); 3.44 (2H, brt); 2.51 (2H, m); 2.35 (4H, m); 2.26 (3H, s); 1.65 (4H, m).
Пример 9
6-[2-(Диметиламино)этокси]-4-(3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.87 (1H, s); 8.88 (1H, s); 8.27 (1H, br s); 7.60 (1H, br s); 7.26 (1H, s); 7.19 (1H, d); 7.08 (1H, t); 6.69 (1H, d); 6.68 (1H, s); 5.14 (1H, br s); 4.56 (2H, s); 3.89 (3H, s); 3.51 (2H, brt); 2.62 (2H, brt); 2.26 (6H, s); 2.25 (3H, s).
Пример 10
6-[2-(Диметиламино)-2-оксоэтокси]-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.81 (1H, s); 8.89 (1H, s); 8.28 (1H, br s); 7.60 (1H, br s); 7.27 (1H, s); 7.17 (1H, d); 7.03 (1H, t); 6.58 (1H, d); 6.48 (1H, s); 5.18 (1H, brt); 4.57 (2H, d); 4.23 (2H, br s); 3.91 (3H, s); 2.74 (3H, s); 2.66 (3H, s); 2.22 (3H, s).
Пример 11
6-(2-Амино-2-оксоэтокси)-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
получали согласно способу, описанному в Примере 3
1H ЯМР (DMSO-d6): δ 10.71 (1H, s); 8.88 (1H, s); 8.26 (1H, br s); 7.59 (1H, br s); 7.27 (1H, s); 7.26 (1H, s); 7.18 (1H, d); 7.05 (1H, s); 7.03 (1H, t); 6.62 (1H, s); 6.58 (1H, d); 5.11 (1H, t); 4.57 (2H, d); 3.91 (3H, s); 3.85 (2H, s); 2.26 (3H, s).
Пример 12
4-(2-Этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
а) 4-Хлоро-7-гидрокси-6-метокси-3-хинолинкарбоксамид
Смесь 7-бензилокси-4-хлоро-6-метокси-3-хинолинкарбоксамида (1,0 г, 2,9 ммоль), полученного аналогично способу, описанному в Примере 1, и тиоанизола (1,75 мл, 14,1 ммоль) в TFA (трифторуксусная кислота) (15 мл) кипятили с обратным холодильником в течение 3 часов. После охлаждения растворители удаляли при пониженном давлении, а остаток выливали на воду и подщелачивали водным аммиаком. Осадок отфильтровывали, промывали водой и сушили с получением 0,52 г (72%-ный выход) указанного в заголовке соединения.
б)4-(2-Этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
Смесь 4-хлоро-7-гидрокси-6-метокси-3-хинолинкарбоксамида (0,056 г, 0,22 ммоль), 2-этиланилина (32 мкл, 0,26 ммоль) и уксусной кислоты (10 мкл) в этаноле (5 мл) нагревали с обратным холодильником в течение четырех часов. Растворители удаляли при пониженном давлении, а остаток хроматографировали на диоксиде кремния, используя в качестве элюента метанол. Продукт растворяли в DMSO (диметилсульфоксид) (5 мл), добавляли морфолинопропилхлорид (0,018 г, 0,11 ммоль) и Cs2СО3 (0,090 г, 0,28 ммоль) и смесь нагревали при 100°С в течение 20 часов. После охлаждения смесь выливали на воду и водные фазы экстрагировали метиленхлоридом. Остаток хроматографировали на диоксиде кремния, используя смесь метиленхлорид/метанол (9/1-1/1) в качестве элюента, с получением 9 мг (9%-ный выход) указанного в заголовке соединения.
1H ЯМР (CDCl3): δ 11.05 (1Н, s); 8.96 (1H, s); 7.35 (1H, s); 7.32 (1H, dd); 7.12 (2H, m); 6.91 (1H, dd); 6.74 (1H, s); 4.22 (2H, m); 3.68 (4H, m); 3.25 (3H, s); 2.80 (2H, m); 2.52 (2H, q); 2.44 (4H, m); 2.08 (2H, т); 1.30 (3H, t).
Соединения, указанные в заголовках примеров 13-15, получали способом, аналогичным описанному в Примере 12.
Пример 13
6-Метокси-4-[2-(метилсульфанил)анилино]-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 10.76 (1Н, s); 8.89 (1Н, s); 7.34 (1Н, s); 7.32 (1Н, d); 7.11 (1H, dd); 7.02 (1Н, dd); 6.79 (1Н, d); 6.75 (1Н, s); 4.21 (2H, t); 3.72 (4H, t); 3.39 (3Н, s); 2.55-2.42 (6H, m); 2.49 (3Н, s); 2.10-2.02 (2H, m).
Пример 14
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 10.81 (1Н, s); 8.79 (1Н, s); 7.26 (1Н, s); 7.20 (1Н, d); 7.16 (1Н, dd); 6.84 (1Н, d); 6.69 (1Н, s); 4.74 (2H, s); 4.15 (2H, t); 3.68 (4H, t); 3.29 (3Н, s); 2.48 (2H, t); 2.42 (4H, m); 2.32 (3Н, s); 2.01 (2H, m).
Пример 15
4-(1Н-Индол-4-иламино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.82 (1Н, s); 7.37 (1Н, d); 7.23 (1Н, d); 7.15 (1Н, s); 7.14 (1Н, t); 6.92 (1Н, s); 6.88 (1Н, d); 6.21 (1Н, d); 4.21 (2H, t); 3.78 (4H, t); 2.98 (3Н, s); 2.98-2.88 (6H,m); 2.18 (2H, m).
Пример 16
Метил-4-{[3-(аминокарбонил)-6-метокси-4-(2-толуидино)-7-хинолинил]окси}бутаноат
Смесь 7-гидрокси-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамида (0,026 г, 0,080 ммоль), DMSO (2,5 мл), К2СО3 (0,017 г, 0,12 ммоль) и метил-4-хлорбутаноата (0,011 г, 0,080 ммоль) кипятили с обратным холодильником в течение 2 часов. Реакционную смесь фильтровали, упаривали и хроматографировали на диоксиде кремния с получением указанного в заголовке соединения.
1H ЯМР (DMSO-d6): δ 10.72 (1Н, s); 8.85 (1Н, s); 8.25 (1Н, br s); 7.58 (1Н, br s); 7.28 (1Н, d); 7.22 (1Н, s); 7.10-6.97 (2H, m); 6.68 (1Н, d); 6.67 (1Н, s); 4.10 (2H, t); 3.57 (3Н, s); 3.26 (3Н, s); 3.28 (3Н, s); 2.05-1.93 (4H, m).
APCI-MS m/z: 424,1 [MH+]
Пример 17
4-(2-Этиланилино)-7-(3-гидроксипропокси)-6-метокси-3-хинолинкарбоксамид
Смесь 4-(2-этиланилино)-7-гидрокси-6-метокси-3-хинолинкарбоксамида (0,12 г, 0,35 ммоль), DMSO (15 мл), Cs2СО3 (0,34 г, 1,0 ммоль) и 1,3-дибромпропана перемешивали при 100°С в течение 2 часов. Реакционную смесь выливали на NaHCO3 (водн.) и экстрагировали CH2Cl2. Вещество хроматографировали с получением указанного в заголовке соединения (0,012 г, 9%).
1H ЯМР (CDCl3): δ 10.82 (1Н, s); 8.83 (1Н, s); 7.34-7.26 (2Н, m); 7.09 (1Н, m); 6.83 (1Н, dd); 6.70 (1Н, s); 4.60 (2Н, t); 3.93 (2Н, t); 3.28 (3H, s); 2.77 (2Н, q); 2.12 (2H, m); 1.22 (3H, t).
APCI-MS m/z: 396,1 [MH+]
Пример 18
6-Метокси-7-[2-(4-морфолинил)этокси]-4-(2-толуидино)-3-хинолинкарбоксамид
Указанное в заголовке соединение получали согласно способу, описанному в Примере 12.
1H ЯМР (CDCl3): δ 10.60 (1Н, s); 8.72 (1Н, s); 7.28-7.26 (2Н, m); 7.07 (1Н, m); 6.89 (1Н, m); 6.75 (1Н, s); 4.28 (2Н, t); 3.72 (4H, t); 3.32 (3H, s); 2.88 (3H, t); 2.58 (4H, t); 2.36 (3H, s).
APCI-MS m/z: 437,2 [MH+]
Пример 19
4-(2-Этиланилино)-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбоксамид
Смесь 4-(2-этиланилино)-7-гидрокси-6-метокси-3-хинолинкарбоксамида (0,22 г, 0,65 ммоль), DMF (15 мл), Cs2СО3 (0,64 г, 1,98 ммоль) и 2-бромэтилметилового эфира перемешивали при 100°С в течение 2 часов. Реакционную смесь упаривали и хроматографировали с получением указанного в заголовке соединения (0,045 г, 18%).
1H ЯМР (CDCl3): δ 10.70 (1Н, s); 8.72 (1Н, s); 7.30 (1Н, dd); 7.26 (1Н, s); 7.08 (1Н, m); 6.85 (1Н, dd); 6.74 (1Н, s); 4.28 (2Н, t); 3.83 (2Н, t); 3.45 (3H, s); 3.30 (3H, s); 2.80 (2Н, q); 1.30 (3H, t).
APCI-MS m/z: 396,1 [МН+]
Пример 20
4-(2-Этиланилино)-6-метокси-7-[3-(1H-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамид
а) Этил-3-(1H-1,2,4-триазол-1-ил)пропаноат. К раствору 1Н-1,2,4-триазола (5 г, 72,4 ммоль), EtOH (36 мл) и Na (1,66 г, 72,4 ммоль) по каплям добавляли этил-3-бромпропионат (9,9 мл, 79,6 ммоль). Реакционную смесь перемешивали в течение ночи, фильтровали, упаривали до 50 мл и подвергали дистилляции с получением указанного в заголовке соединения (3,3 г, 30%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6): δ 8.43 (1Н, s); 7.90 (1H, s); 4.30 (2H, t); 3.94 (2H, q); 2.78 (2H, t); 1.05 (3Н, t).
б) 3-(1H-1,2,4-триазол-1-ил)-1-пропанол. К раствору этил-3-(1Н-1,2,4-триазол-1-ил)пропаноата (2,95 г, 17,5 ммоль) в диэтиловом эфире (90 мл) добавляли LiAlH4 (0,66 г, 17,5 ммоль). После нагревания до кипения с обратным холодильником в течение 60 часов добавляли 10 мл смеси 50%-метанол-вода. Реакционную смесь фильтровали и фильтр промывали 100 мл метанола и дважды 100 мл горячей воды. После выпаривания и после очистки с использованием препаративной HPLC получали указанный в заголовке продукт.
1H ЯМР (CDCl3): δ 8.42 (1H, s); 7.98 (1H, s); 4.35 (2H, t); 3.47 (2H, t); 2.09 (2H, q).
в) 1-(3-Хлоропропил)-1Н-1,2,4-триазол. 3-(1Н-1,2,4-триазол-1-ил)-1-пропанол (0,160 г, 1,3 ммоль) кипятили с обратным холодильником в тионилхлориде (3 мл) в течение 2 часов. Реакционную смесь упаривали с получением указанного в заголовке продукта.
APCI-MS m/z: 146,1 [МН+]
г) 4-(2-Этиланилино)-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамид
Указанный в заголовке продукт получали согласно способу, описанному в Примере 17
1H ЯМР (CDCl3): δ 10.71 (1Н, s); 8.70 (1H, s); 8.07 (1H, s); 7.94 (1H, s); 7.34-7.29 (1H, m); 7.20 (1H, s); 7.16-7.05 (2H, m); 6.90-6.85 (1H, m); 6.76 (1H, s); 4.44 (2H, t); 4.28 (2H, t); 3.62 (3H, s); 2.80 (2H, q); 2.46 (2H, m); 1.30 (3H, t).
APCI-MS m/z: 447,5 [MH+]
Пример 21
4-(2-Этиланилино)-6-метокси-7-[4-(4-морфолинил)бутокси]-3-хинолинкарбоксамид
4-(2-Этиланилино)-7-гидрокси-6-метокси-3-хинолинкарбоксамид (0,064 г, 0,19 ммоль) растворяли в DMSO (4 мл), 1-бром-4-хлорбутане (22 мкл, 0,19 ммоль) и добавляли Cs2СО3 (0,18 г, 0,55 ммоль), смесь перемешивали при температуре окружающей среды в течение трех суток. Смесь вливали в воду и экстрагировали метиленхлоридом. Остаток хроматографировали на диоксиде кремния, используя смесь этилацетат/метанол (1:0→1:1) в качестве элюента. Полученное в результате масло растворяли в DME, морфолине (25 мкл, 0,29 ммоль) и добавляли каталитическое количество KI, смесь нагревали с обратным холодильником в течение четырех суток. После охлаждения смесь выливали на воду и экстрагировали метиленхлоридом. Неочищенный продукт очищали препаративной HPLC с получением 20 мг (22%-ный выход) указанного в заголовке соединения.
1H ЯМР (CDCl3): δ 11.31 (1H, s); 9.02 (1H, s); 7.40 (1H, s); 7.34 (1H, d); 7.22-7.11 (2H, m); 6.95 (1H, d); 6.73 (1H, s); 4.18 (2H, t); 3.72 (4H, m); 3.29 (3H, s); 2.79 (2H, q); 2.5-2.40 (6H, m); 1.93 (2H, m); 1.69 (2H, m); 1.28 (3H, t).
Пример 22
7-(3-Хлоропропокси)-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид
7-Гидрокси-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид (0,90 мг, 2,54 ммоль) растворяли в DMF (10 мл), 1-бромо-4-хлорбутане (0,28 мл, 2,79 ммоль) и добавляли Cs2СО3 (1,7 г, 5,2 ммоль), смесь перемешивали при температуре окружающей среды в течение трех суток. Смесь выливали на воду и экстрагировали метиленхлоридом. Остаток хроматографировали на диоксиде кремния, используя смесь этилацетат/метанол (1:0→5:1) в качестве элюента, с получением 550 мг (50%-ный выход) указанного в заголовке соединения.
1H ЯМР (DMSO-d6): δ 10.85 (1Н, s); 8.83 (1Н, s); 8.22 (1Н, s, br); 7.30 (1H, s, br); 7.22 (1Н, s); 7.10 (1Н, d); 7.02 (1Н, t); 6.65 (1Н, d); 6.62 (1Н, s); 5.18 (1Н, m); 4.58 (2H, d); 4.21 (2H, t); 3.78 (2H, t); 3.22 (3H, s); 2.23 (3H, s); 2.23-2.19 (2H, m).
Пример 23(а), 23(б)
7-{3-[(цис)-2,6-Диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид и
7-{3-[(транс)-2,6-Диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид
7-(3-Хлоропропокси)-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид (50 мг, 0,12 ммоль) растворяли в DME (3 мл), 2,6-диметилморфолине (25 мкл, 0,29 ммоль) и добавляли каталитическое количество KI, смесь нагревали с обратным холодильником в течение четырех суток. После охлаждения смесь фильтровали и неочищенный продукт очищали препаративной HPLC с получением 14 мг (23%-ный выход) цис-соединения и 8 мг (13%-ный выход) транс-соединения.
7-{3-[(цис)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид:
1H ЯМР (CD3CO): δ 8.89 (1Н, s); 7.24 (1Н, d); 7.20 (1Н, s); 7.18 (1Н, t); 6.95 (1Н, d); 6.79 (1Н, s); 4.68 (2H, s); 4.20 (2H, t); 3.75-3.65 (2H, m); 3.29 (3H, s); 3.0 (2H, d); 2.78 (2H, t); 2.38 (3H, s); 2.16 (2H, m); 1.95 (2H, m); 1.18 (6H, d).
7-{3-[(транс)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид:
1H ЯМР (CD3OD при 55°С): δ 8.82 (1Н, s); 7.52 (1Н, d); 7.35 (1Н, t); 7.29 (1Н, s); 7.18 (1Н, d); 6.85 (1Н, s); 4.78 (2H, s); 4.30 (2H, t); 4.18 (2H, m); 3.35 (3H, s); 3.21 (4H, m); 2.93 (2H, m); 2.34 (2H, m); 2.35 (3H, s); 1.35 (6H, d).
Соединения, указанные в заголовках примеров 24-26, получали способом, аналогичным описанному в Примере 23.
Пример 24
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(1-пиперидинил)пропокси]-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.82 (1Н, s); 7.34 (1Н, d); 7.25 (1Н, s); 7.18 (1Н, t); 6.89 (1Н, d); 6.85 (1Н, s); 4.75 (2H, s); 4.22 (2H, t); 3.35 (3H, s); 3.20-3.05 (6H, m); 2.40 (3H, s); 2.28 (2H, m); 1.85 (4H, m); 1.64 (2H, m).
Пример 25
7-{3-[(2-Этоксиэтил)амино]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.82 (1Н, s); 7.30 (1H, d); 7.25 (1H, s); 7.18 (1H, t); 6.89 (1H, d); 6.82 (1H, s); 4.76 (2H, s); 4.22 (2H, t); 3.59 (2H, t); 3.53 (2H, q); 3.35 (3H, s); 2.89 (2H, t); 2.83 (2H, t); 2.40 (3H, s); 2.12 (2H, m); 1.18 (3H, t).
Пример 26
4-[3-(Гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-тиоморфолинил)пропокси]-3-хинолинкарбоксамид
1H ЯМР (CD3CO): δ 8.81 (1H, s); 7.31 (1H, d); 7.22 (1H, s); 7.18 (1H, t); 6.86 (1H, d); 6.80 (1H, s); 4.75 (2H, s); 4.20 (2H, t); 3.38 (3H, s); 3.08 (2H, m); 2.80-2.60 (8H, m); 2.39 (3H, s); 2.08 (2H, m).
Пример 27
6-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
а) 6-(Бензилокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали согласно способу, описанному в Примере 1(ж).
APCI-MS m/z: 428 [МН+]
б)4-(2-Этиланилино)-6-гидрокси-7-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали согласно способу, описанному в Примере 2.
1H ЯМР (DMSO-d6): δ 10.52 (1H, s); 9.54 (1H, br s); 8.86 (1H, s); 8.29 (1H, br s); 7.62 (1H, br s); 7.28 (1H, s); 7.28 (1H, m); 6.98 (2H, m); 6.76 (1H, s); 6.45 (1H, m); 3.92 (3H, s); 2.75 (2H, q); 1.29 (3H, t).
APCI-MS m/z: 338 [МН+]
в) 6-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
Связанный с полимером трифенилфосфин (0,15 г, 0,44 ммоль) и 3-диметиламино-1-пропанол (26 мкл, 0,22 ммоль) суспендировали и растворяли в CH2Cl2 и THF при -15°С и перемешивали в течение 30 минут. По каплям добавляли DEAD (диэтилазодикарбоксилат) (70 мкл, 0,44 ммоль) при -15°С. 4-(2-Этиланилино)-6-гидрокси-7-метокси-3-хинолинкарбоксамид (50 мг, 0,15 ммоль) суспендировали в THF и затем добавляли к реакционной смеси. Реакционную смесь перемешивали в течение ночи, позволяя температуре подниматься до ˜10°С. Полимер отфильтровывали и фильтрат концентрировали в вакууме. Продукт очищали, используя препаративную HPLC, с получением 15 мг (24%) белых кристаллов.
1H ЯМР (CD3OD): δ 8.79 (1Н, s); 7.37 (1Н, m); 7.22 (1Н, s); 7.15 (2H, m); 6.84 (1Н, m); 6.78 (1Н, s); 3.95 (3H, s); 3.42 (2H, t); 2.79 (2H, q); 2.35 (2H, t); 2.23 (6H,s); 1.74(2H,m); 1.29(3H,t).
APCI-MS m/z: 423 [MH+].
Соединения, указанные в заголовках примеров 28-33, получали способом, аналогичным описанному в Примере 27.
Пример 28
4-(2-Этиланилино)-6-[3-(1Н-имидазол-1-ил)пропокси]-7-метокси-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.80 (1Н, s); 7.54 (1Н, s); 7.29 (1Н, m); 7.24 (1Н, s); 7.06 (3H, m); 6.98 (1Н, s); 6.80 (1Н, m); 6.71 (1Н, s); 3.99 (3H, s); 3.28 (2H, m); 2.75 (2H, q); 2.04 (2H, m); 1.27 (3H, t)
APCI-MS m/z: 446 [MH+]
Пример 29
4-(2-Этиланилино)-7-метокси-6-(3-тиенилметокси)-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.80 (1Н, s); 7.37 (2H, m); 7.24 (1Н, s); 7.16 (2H, m); 7.06 (1Н, m); 6.91 (1Н, m); 6.87 (1Н, s); 6.83 (1Н, m); 4.53 (2H, s); 3.97 (3H, s); 2.76 (2H, q); 1.29 (3H, t).
APCI-MS m/z: 434 [MH+].
Пример 30
6-[2-(Диметиламино)этокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
1Н ЯМР (CD3OD): δ 8.80 (1Н, s); 7.37 (1Н, m); 7.22 (1Н, s); 7.15 (2H, m); 6.84 (1Н, m); 6.78 (1Н, m); 3.95 (3H, s); 3.50 (2H, brt); 2.80 (2H, q); 2.57 (2H, t); 2.24 (6H, s); 1.30 (3H, t)
APCI-MS m/z: 409 [MH+]
Пример 31
6-(3-Аминопропокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
Данное соединение синтезировали, как описано выше, используя Вос-аминозащищенный спирт. После отфильтровывания полимера и упаривания остаток растворяли в CH2Cl2 и TFA (50:50) и перемешивали при комнатной температуре в течение 30 минут. Растворитель выпаривали и продукт очищали препаративной HPLC.
1H ЯМР (CD3OD): δ 8.82 (1Н, s); 7.38 (1Н, m); 7.23 (1Н, s); 7.16 (2H, m); 6.86 (1Н, m); 6.80 (1Н, s); 3.97 (3H, s); 3.48 (2H, brt); 2.81 (2H, q); 2.71 (2H, t); 1.74 (2H, m); 1.31 (3H, t)
APCI-MS m/z: 395 [MH+].
Пример 32
4-(2-Этиланилино)-7-метокси-6-[2-(метиламино)этокси]-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.80 (1Н, s); 7.36 (1Н, m); 7.23 (1Н, s); 7.15 (2H, m); 6.84 (1Н, m); 6.80 (1Н, s); 3.97 (3H, s); 3.50 (2H, brt); 2.79 (2H, q); 2.75 (2H, t); 2.37 (3H, s); 1.29 (3H, t)
APCI-MS m/z: 395 [MH+]
Пример 33
6-(2-Аминоэтокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.80 (1Н, s); 7.36 (1Н, brd); 7.23 (1Н, s); 7.14 (2H, m); 6.84 (1Н, brd); 6.78 (1Н, s); 3.96 (3H, s); 3.41 (2H, brt); 2.79 (4H, m); 1.29 (3H, t)
APCI-MS m/z: 381 [MH+]
Пример 34
7-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид
а)4-(2-Этиланилино)-7-бензилокси-6-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали, как описано в Примере 27(а), начиная с 7-бензилокси-4-хлоро-6-метокси-3-хинолинкарбоксамида, полученного способом, аналогичным описанному в Примере 1. Выход 4,4 г (89%) светло-коричневого порошка.
1H ЯМР (DMSO-d6): δ 11.85 (1Н, br s); 8.98 (1H, s); 8.47 (1H, br s); 7.84 (1H, br s); 7.52-7.33 (7H, m); 7,29-7.17 (2H, m); 6.99 (1H, brd); 6.75 (1H, s); 5.26 (2H, s); 3.24 (3H, s); 2.70 (2H, q); 1.20 (3H, t)
APCI-MS m/z: 428 [MH+]
б) 4-(2-Этиланилино)-7-гидрокси-6-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали, как описано в Примере 27(б).
Выход 0,3 г (90%) желтого масла, которое кристаллизовалось через несколько часов.
1H ЯМР (CD3OD): δ 8.70 (1H, s); 7.39 (1H, m); 7.19 (2H, m); 7.00 (1H, s); 6.94 (1H, m); 6.73 (1H, s); 2.78 (2H, q); 1.29 (3H, t)
APCI-MS m/z: 338 [MH+]
в) 7-[3-(Диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали, как описано в Примере 27(в).
1H ЯМР (CD3OD): δ 8.78 (1H, s); 7.35 (1H, m); 7.19 (1H, s); 7.13 (2H, m); 6.83 (1H, m); 6.77 (1H, s); 4.15 (2H, t); 3.28 (3H, s); 2.79 (2H, q); 2.57 (2H, t); 2.29 (6H, s); 2.05 (2H, m); 1.28 (3H, t).
APCI-MS m/z: 423 [MH+]
Соединения, указанные в заголовках примеров 35-37, получали способом, аналогичным описанному в Примере 34.
Пример 35
4-(2-Этиланилино)-6-метокси-7-{3-[метил(4-пиридинил)амино]пропокси}-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.78 (1H, s); 7.93 (2H, brm); 7.37 (1H, m); 7.16 (2H, m); 7.13 (1H, s); 6.84 (1H, m); 6.79 (1H, s); 6.67 (2H, brd); 4.12 (2H, t); 3.65 (2H, t); 3.33 (3H, s); 3.01 (3H, s); 2.80 (2H, q); 2.13 (2H, m); 1.31 (3H, t)
APCI-MS m/z: 486 [MH+]
Пример 36
4-(2-Этиланилино)-6-метокси-7-{2-[метил(4-пиридинил)амино]этокси}-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 11.11 (1H, s); 8.88 (1H, s); 8.20 (2H, br s); 7.33 (1H, d); 7.32 (1H, s); 7.15 (2H, m); 6.90 (1H, d); 6.75 (1H, d); 6.74 (1H, s); 4.36 (2H, t); 3.94 (2H, t); 3.23 (3H, s); 3.19 (3H, s); 2.78 (2H, q); 1.29 (3Н, t)
APCI-MS m/z: 472 [MH+]
Пример 37
4-(2-Этиланилино)-6-метокси-7-[2-(метиламино)этокси]-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.80 (1H, s); 7.37 (1H, m); 7.23 (1H, s); 7.15 (2H, m); 6.86 (1H, m); 6.80 (1H, s); 4.24 (2H, t); 3.30 (3H, s); 3.04 (2H, t); 2.80 (2H, q); 2.47 (3H, s); 1.29 (3H, t)
APCI-MS m/z: 395 [MH+]
Пример 38
4-(2-Этиланилино)-6-метокси-7-[2-(1-пиперазинил)этокси]-3-хинолинкарбоксамид
Трифенилфосфин (0,12 г, 0,44 ммоль) и 1-(2-гидроксиэтил)пиперазин (25 мкп, 0,22 ммоль) растворяли в CH2Cl2 и THF при -15°С и перемешивали в течение 30 мин. По каплям добавляли DEAD (70 мкл, 0,44 ммоль) при -15°С. 4-(2-Этиланилино)-7-гидрокси-6-метокси-3-хинолинкарбоксамид (0,50 г, 0,15 ммоль) суспендировали в THF и затем добавляли к реакционной смеси. Реакционную смесь перемешивали в течение ночи, позволяя температуре подниматься до ˜10°С. Растворитель удаляли при пониженном давлении и продукт очищали, используя препаративную HPLC, с получением 34 мг (24%) прозрачного масла.
1H ЯМР (CD3OD): δ 8.80 (1H, s); 7.36 (1H, m); 7.21 (1H, s); 7.13 (2H, m); 6.83 (1H, m); 6.77 (1H, s); 4.28 (2H, t); 3.28 (3H, s); 2.86 (6H, m); 2.79 (2H, q); 2.62 (4H, br s); 1.29 (3H, t)
APCI-MS m/z: 450 [MH+]
Соединения, указанные в заголовке примеров 39-41, получали способом, аналогичным описанному в Примере 38.
Пример 39
4-(2-Этиланилино)-7-[3-(1Н-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.79 (1H, s); 7.64 (1H, s); 7.37 (1H, m); 7.15 (3H, m); 6.95 (1H, s); 6.84 (1H, m); 6.79 (1H, s); 4.26 (2H, t); 4.06 (2H, t); 3.31 (3H, s); 2.80 (2H, q); 2.32 (2H, m); 1.29 (3H, t)
APCI-MS m/z: 446 [MH+]
Пример 40
4-(2-Этиланилино)-7-[2-(1H-имидазол-1-ил)этокси]-6-метокси-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.78 (1H, s); 7.75 (1H, s); 7.36 (1H, m); 7.25 (1H, s); 7.17 (1H, s); 7.13 (2H, m); 6.93 (1H, s); 6.83 (1H, m); 6.78 (1H, s); 4.48 (2H, t); 4.36 (2H, t); 3.29 (3H, s); 2.78 (2H, q); 1.28 (3H, t)
APCI-MS m/z: 432 [MH+]
Пример 41
7-(3-Аминопропокси)-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид
Это соединение синтезировали, как описано выше, используя Вос-амино-защищенный спирт. После отфильтровывания полимера и выпаривания остаток растворяли в СН2Cl2 и TFA (50:50) и перемешивали при комнатной температуре в течение 30 мин. Растворитель выпаривали и продукт очищали при помощи препаративной HPLC.
1H ЯМР (CD3OD): δ 8.79 (1H, s); 7.36 (1H, m); 7.20 (1H, s); 7.13 (2H, m); 6.83 (1H, m); 6.77 (1H, s); 4.21 (2H, t); 3.28 (3H, s); 2.88 (2H, t); 2.79 (2H, q); 2.03 (2H, m); 1.29 (3H, t)
APCI-MS m/z: 395 [MH+]
Пример 42
7-Гидрокси-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали согласно способу, описанному в Примере 34(б).
1H ЯМР (DMSO-d6): δ 10.86 (1Н, s); 8.81 (1Н, s); 8.21 (1Н, br s); 7.54 (1H, br s); 7.18 (1Н, d); 7.12 (1Н, s); 7.08 (1Н, t); 6.69 (1Н, d); 6.65 (1Н, s); 5.14 (1Н, br s); 4.56 (2H, s); 3.25 (3H, s); 2.25 (3H, s)
APCI-MS m/z: 354 [MH+]
Пример 43
6-{[3-(1Н-Имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамид
а) Этил-4-хлоро-6-бромо-7-метокси-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
б) Этил-6-бромо-7-метокси-4-(2-толуидино)-3-хинолинкарбоксилат
Этил-6-бромо-4-хлоро-7-метокси-3-хинолинкарбоксилат (0,90 г, 2,6 ммоль), орто-толуидин (0,30 мл, 2,9 ммоль) и АсОН (1 мл) растворяли в EtOH (50 мл) и кипятили с обратным холодильником в течение 4 часов. После охлаждения смесь нейтрализовали водным аммиаком, а остаток отфильтровывали с получением 870 мг (80%) зеленого порошка.
1H ЯМР (DMSO-d6): δ 9.84 (1Н, s); 8.94 (1Н, s); 7.89 (1Н, s); 7.41 (1Н, s); 7.36 (1Н, brd); 7.16 (2H, m); 6.94 (1Н, brd); 4.15 (2H, q); 3.99 (3H, s); 2.28 (3H, s); 1.26 (3H, t)
в) 6-{[3-(1Н-Имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамид
Смесь 6-бромохинолина (0,25 ммоль), Pd2(dba)3 (0,005 ммоль), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (0,015 ммоль), Cs2СО3 (0,33 ммоль) и 1-(3-аминопропил)-имидазола (0,29 ммоль) перемешивали при 90°С в течение ночи в атмосфере N2. После охлаждения смесь очищали колоночной флэш-хроматографией на силикагеле. После элюирования с помощью CH2Cl2 и затем смесью CH2Cl2/MeOH (10:1) получили 110 мг (100%) желтого масла, которое содержало незначительные фосфиновые примеси.
APCI-MS m/z: 460 [MH+]
Неочищенный этиловый эфир гидролизовали в смеси МеОН/5М NaOH (1:1) при комнатной температуре в течение ночи. После концентрирования в вакууме оставшуюся водную фазу подкисляли 2 M HCl и промывали CH2Cl2. Водную фазу нейтрализовали 5 М NaзСО3 и экстрагировали CHCl3. После концентрирования в вакууме получали 25 мг (25%) желтого масла.
APCI-MS m/z: 432 [МН+]
Неочищенную кислоту (0,025 г, 0,06 ммоль) и CDI (0,020 г, 0,1 ммоль) растворяли в DMF и перемешивали при 60°С в течение 1 часа. Смесь охлаждали в бане EtOH/сухой лед и насыщали NH3 (газ.) и затем перемешивали при комнатной температуре в течение 45 минут. Смесь разбавляли CHCl3, промывали насыщенным водным NaHCO3 и водой и концентрировали в вакууме. После очистки при помощи препаративной HPLC получали после удаления трифторуксусной соли ацетата 15 мг (60%) белого твердого вещества.
1H ЯМР (CD3OD): δ 8.67 (1Н, s); 7.56 (1Н, s, Im); 7.27 (1Н, brd); 7.13 (1H, s); 7.02 (1Н, s, Im); 6.97 (1Н, s, Im); 6.95 (2H, m); 6.68 (1Н, brd); 6.28 (1Н, s); 3.99 (3H, s); 3.90 (2H, t); 2.67 (2H, t); 2.36 (2H, s); 1.68 (2H, m)
APCI-MS m/z: 431 [МН+]
Соединения, указанные в заголовках примеров 44-46, получали способом, аналогичным описанному в Примере 43.
Пример 44
7-Метокси-6-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.66 (1Н, s); 7.31 (1Н, m); 7.11 (1Н, s); 7.10 (2H, m); 6.81 (1Н, m); 6.34 (1Н, s); 4.00 (3H, s); 3.27 (3H, s); 3.24 (2H, t); 2.77 (2H, t); 2.35 (3H, s).
APCI-MS m/z: 381 [МН+].
Пример 45
7-Метокси-6-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.41 (1Н, s); 8.74 (1Н, s); 8.23 (1Н, br s); 7.56 (1Н, br s); 7.25 (1Н, d); 7.17 (2H, s); 6.96 (2H, m); 6.50 (1Н, s); 6.22 (1Н, d); 5.43 (1Н, t); 3.95 (3H, s); 3.42 (4H, brt); 2.71 (2H, q); 2.33 (3H, s); 2.19 (6H, m).
APCI-MS m/z: 436 [МН+].
Пример 46
7-Метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.65 (1Н, s); 7.27 (1H, brd); 7.11 (1H, s); 7.03 (2H, m); 6.72 (1H, brd); 6.32 (1H, s); 3.99 (3H, s); 3.69 (4H, t); 2.68 (2H, t); 2.39 (4H, brm); 2.37 (3H, s); 2.27 (2H, t); 1.49 (2H, m).
APCI-MS m/z: 450 [MH+].
Пример 47
6-Метокси-7-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид
а) Этил-4-хлоро-7-бромо-7-метокси-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
б) Этил-7-бромо-6-метокси-4-(2-толуидино)-3-хинолинкарбоксилат
Указанное в заголовке соединение получали согласно способу, описанному в Примере 43(б).
1H ЯМР (DMSO-d6): δ 9.83 (1H, s); 8.87 (1H, s); 8.15 (1H, s); 7.38 (1H, m); 7.17 (2H, m); 7.09 (1H, s); 6.98 (1H, m); 4.17 (2H, q); 3.45 (3H, s); 2.30 (3H, s); 1.28 (3H, t).
в) 6-Метокси-7-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид
Указанное в заголовке соединение получали согласно способу, описанному в Примере 43(в).
1H ЯМР (CD3OD): δ 8.68 (1H, s); 7.28 (1H, brd); 7.06 (2H, m); 6.81 (1H, brd); 6.73 (1H, s); 6.60 (1H, s); 3.67 (4H, brt); 3.34 (2H, t); 3.33 (3H, s); 2.65 (2H, t); 2.49 (4H, brt); 2.31 (3H, s).
APCI-MS m/z: 436 [MH+].
Соединения, указанные в заголовках примеров 48-51, получали способом, аналогичным описанному в Примере 47.
Пример 48
6-Метокси-7-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 10.50 (1Н, s); 8.73 (1H, s); 7.25 (1H, brd); 7.04 (2H, m); 6.88 (1H, s); 6.87 (1H, brd); 6.63 (1H, s); 5.06 (1H, brt); 3.66 (2H, t); 3.42 (2H, q); 3.39 (3H, s); 3.34 (3H, s); 2.37 (3H, s).
APCI-MS m/z: 381 [MH+].
Пример 49
7-{[3-(1Н-имидазол-1-ил)пропил]амино}-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 10.93 (1H, br s); 8.93 (1H, s); 7.51 (1H, s); 7.27 (1H, brd); 7.09 (2H, m); 7.06 (1H, s); 6.93 (1H, brd); 6.91 (1H, s); 6.90 (1H, s); 6.62 (1H, s); 4.81 (1H, brt); 4.06 (2H, t); 3.32 (3H, s); 3.25 (2H, m); 2.35 (3H, s); 2.16 (2H, m).
APCI-MS m/z: 431 [MH+].
Пример 50
7-[(1-Бензил-4-пиперидинил)амино]-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.68 (1H, s); 7.32 (6Н, m); 7.09 (2H, m); 6.85 (1H, brd); 6.78 (1H, s); 6.65 (1H, s); 3.59 (2H, s); 3.49 (1H, m); 3.35 (3H, s); 2.93 (2H, brd); 2.34 (3H, s); 2.28 (2H, brt); 2.08 (2H, brd); 1.60 (2H, m).
APCI-MS m/z: 496 [MH+]
Пример 51
6-Метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид
1H ЯМР (CD3OD): δ 8.67 (1H, s); 7.31 (1H, brd); 7.11 (2H, m); 6.89 (1H, s); 6.70 (1H, s); 6.61 (1H, s); 4.84 (3H, s); 3.33 (3H, s); 3.30 (2H, t); 2.49 (2H, t); 2.46 (4H, brt); 2.32 (3H, s); 1.87 (2H, m).
APCI-MS m/z: 450 [MH+]
Пример 52
4-[3-(Гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
а) Этил-6,7-диметокси-4-хлоро-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
б) 6,7-Диметокси-4-хлоро-3-хинолинкарбоксамид
Смесь этил-6,7-диметокси-4-хлоро-3-хинолинкарбоксилата (3,0 г, 10,2 ммоль) растворяли в 40 мл метанола и NaOH (водн.) (20 мл, 5 М). Смесь нагревали до 100°С в течение четырех часов. После охлаждения метанол выпаривали. Водный раствор подкисляли 2 М HCl до рН 2-3. Белый осадок центрифугировали и затем декантировали. Эту процедуру повторяли дважды. Твердое вещество сушили в вакууме в течение ночи. Твердое вещество растворяли в 50 мл тионилхлорида и нагревали до кипения с обратным холодильником в течение трех часов. После охлаждения избыток тионилхлорида удаляли при помощи выпаривания на роторном испарителе, а остаток суспендировали в ацетоне, полученную в результате суспензию охлаждали в ледяной бане. Добавляли гидроксид аммония (7 мл), поддерживая температуру ниже 0°С. Суспензию перемешивали в течение 30 минут и полученную в результате суспензию фильтровали, промывали водой и сушили на воздухе.
1H ЯМР (DMSO-d6): δ 8.66 (1Н, s); 8.12 (1H, br s); 7.87 (1H, br s); 7.46 (2H, d); 3.98 (3H, s); 3.97 (3H, s).
в)4-[3-(Гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,15 г, 0,56 ммоль), 3-амино-2-метилбензилового спирта (0,1 г, 0,73 ммоль), уксусной кислоты (0,2 мл) в EtOH (10 мл) кипятили с обратным холодильником в течение 4 часов. После охлаждения рН доводили до 9 водным NH3. Полученный в результате осадок отфильтровывали и промывали холодным EtOH, сушили в вакууме при 40°С с получением 0,1 г (49%-ный выход) указанного в заголовке соединения.
1H ЯМР (DMSO-d6): δ 10.84 (1Н, s); 8.83 (1Н, s); 8.25 (1Н, s); 7.56 (1H, s); 7.21 (1Н, s); 7.17 (1Н, d); 7.05 (1Н, t); 6.17 (1Н, d); 6.15 (1Н, s); 5.12 (1Н, br s); 4.52 (2H, s); 3.87 (3H, s); 3.21 (3H, s); 2.23 (3H, s).
APCI-MS m/z: 368.2 [MH+].
Соединения, указанные в заголовках примеров 53-56, получали способом, аналогичным описанному в Примере 52.
Пример 53
4-(2-Бромоанилино)-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (CDCl3): δ 10.28 (1Н, s); 8.80 (1Н, s); 7.63 (1Н, d); 7.34 (1Н, s); 7.21 (1Н, s); 7.10 (1Н, t); 7.05 (1Н, t); 6.90 (1Н, t); 6.75 (1Н, s); 6.72 (1Н, s); 4.0 (3H, s); 3.48 (3H, s).
APCI-MS m/z: 402,1, 404,1 [MH+].
Пример 54
4-(4-Гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.81 (1Н, s); 9.30 (1Н, s); 8.79 (1Н, d); 8.18 (1Н, br s); 7.45 (1Н, br s); 7.19 (1Н, s); 6.75-6.50 (4H, m); 3.84 (3H, s); 3.26 (3H, s); 2.32 (3H, s).
APCI-MS m/z: 354,1 [MH+].
Пример 55
6,7-Диметокси-4-(2-метоксианилино)-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.41 (1Н, s); 8.87 (1Н, s); 8.13 (1Н, s); 7.57 (1Н, br s); 7.28 (1Н, s); 7.09 (1Н, dd); 7.03 (1Н, dt); 6.83-6.78 (2H, m); 6.65 (1Н, brd); 3.91 (3H, s); 3.83 (3H, s).
APCI-MS m/z: 354,1 [MH+].
Пример 56
4-(4-Фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.91 (1Н, br s); 8.83 (1Н, s); 8.22 (1Н, br s); 7.61 (1Н, br s); 7.26 (1Н, s); 7.23-6.93 (5H, m); 7.03 (1Н, dt); 3.89 (3H, s); 3.37 (3H, s); 2.28 (3H, s).
APCI-MS m/z: 356,2 [MH+].
Пример 57
4-[(1-Этил-1H-пиразол-5-ил)амино]-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 1-этил-5-аминопиразола (0,030 г, 0,27 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 7,5 часов. DMF выпаривали при пониженном давлении и остаток растворяли в смеси MeCN и воды (1:7), содержащей 0,1% трифторуксусной кислоты. После препаративной HPLC с использованием градиента (содержащего 0,1% трифторуксусной кислоты) 10→40% MeCN в воде в качестве элюента получали после выпаривания указанное в заголовке соединение в виде соли трифторуксусной кислоты. Продукт суспендировали в насыщенном водном NaHCO3 и абсорбировали на короткой SPE (экстракция на твердую фазу) колонке [ISOLUTE™ C18 (ЕС)], предварительно кондиционированной последовательно метанолом и водой. Колонку экстенсивно промывали водой до тех пор, пока рН элюента не становился нейтральным. Продукт затем элюировали метанолом, растворитель выпаривали и остаток кристаллизовали из этанола с получением указанного в заголовке соединения (19 мг, 32%).
1H ЯМР (DMSO-d6): δ 11.09 (1Н, bs); 8.88 (1H, s); 8.34 (1H, bs); 7.71 (1H, bs); 7.42 (1H, d, J 1,4 Гц); 7.27 (1H, s); 6.67 (1H, s); 5.87 (1H, bs); 4.02 (2H, q, J 7,2 Гц); 3.90 (3H, s); 3.46 (3H, s); 3.12 (3Н, s) и 1.29 (3Н, t, J 7,2 Гц).
APCI-MS m/z: 342,1 [MH+]
Пример 58
4-(3-Аминокарбонил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 3-амино-2-метилбензамида (0,036 г, 0,24 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 18 часов. После охлаждения реакционную смесь разбавляли водой (20 мл) и подщелачивали с помощью 1 М NaOH. Осадок отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (41 мг, 61%).
1H ЯМР (DMSO-d6): δ 10.76 (1Н, s); 8.90 (1H, s); 8.30 (1H, bs); 7.75 (1H, bs); 7.64 (1H, bs); 7.44 (1H, bs); 7.28 (1H, s); 7.13-7.06 (2H, m); 6.75-6.45 (1H, m); 6.67 (1H, s); 3.90 (3H, s); 3.33 (3Н, s) и 2.36 (3Н, s).
APCI-MS m/z: 381,1 [MH+].
Пример 59
6,7-Диметокси-4-(2,3-диметиланилино)-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 2,3-диметиланилина (20 мкл, 0,22 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 3,5 часов. После охлаждения реакционную смесь разбавляли водой (15 мл) и подщелачивали с помощью 1 М NaOH. Осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (48 мг, 79%).
1H ЯМР (DMSO-d6): δ 10.87 (1H, s); 8.87 (1H, s); 8.26 (1H, bs); 7.58 (1H, bs); 7.24 (1H, s); 7.02-6.96 (1H, m); 6.98 (1H, s); 6.68 (1H, s); 6.66-6.60 (1H, m); 3.88 (3Н, s); 3.25 (3Н, s); 2.31 (3Н, s) и 2.23 (3Н, s).
Пример 60
6,7-Диметокси-4-(5,6,7,8-тетрагидро-1-нафталиниламино)-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,090 г, 0,34 ммоль), 5,6,7,8-тетрагидронафтиламина (0,062 г, 0,42 ммоль) и уксусной кислоты (80 мкл) в DMF (1,6 мл) нагревали при 100°С в течение 3,5 часов. После охлаждения реакционную смесь разбавляли водой (20 мл) и подщелачивали с помощью 1 М NaOH. Осадок отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (62 мг, 48%).
1H ЯМР (DMSO-d6): δ 10.66 (1H, s); 8.86 (1H, s); 8.26 (1H, bs); 7.59 (1H, bs); 7.25 (1H, s); 6.98 (1H, t, J 7,7 Гц); 6.86 (1H, d, J 7,4 Гц); 6.70 (1H, s); 6.53 (1H, d, J 7,6 Гц); 3.89 (3Н, s); 3.29 (3Н, s); 2.76 (1H, bt, J 6 Гц); 2.70 (1H, bt, J 6 Гц); 1.86-1.77 (1Н, m) и 1.77-1.69 (1Н, m).
APCI-MS m/z: 378,1 [MH+].
Пример 61
4-(4-Карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 3-амино-2-метилбензойной кислоты (0,035 г, 0,23 ммоль) и уксусной кислоты (40 мкл) в DMSO (0,8 мл) перемешивали при 100°С в течение 5 часов. После охлаждения реакционную смесь промывали несколько раз диэтиловым эфиром. Масляный осадок растворяли в воде и подщелачивали с помощью 1 М NaOH, и затем слегка подкисляли уксусной кислотой. Смесь оставляли при 5°С в течение ночи и полученный в результате осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (35 мг, 50%).
1H ЯМР (DMSO-d6): δ 12.9 (1Н, b); 10.74 (1Н, s); 8.89 (1Н, s); 8.28 (1Н, bs); 7.63 (1Н, bs); 7.45 (1Н, d, J7.6 Гц); 7.28 (1Н, s); 7.13 (1Н, t, J7.8 Гц); 6.84 (1Н, t, J 7.9 Гц); 3.90 (3Н, s); 3.07 (3Н, s) и 2.50 (3Н, s).
APCI-MS m/z: 382,1 [MH+].
Пример 62
4-(1H-Индол-4-иламино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,90 г, 0,34 ммоль), 4-аминоиндола (0,039 г, 0,23 ммоль), ацетата натрия (0,020 г, 0,23 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 4,5 часов. После охлаждения реакционную смесь разбавляли водой (20 мл) и подщелачивали с помощью 1 М NaOH. Осадок отделяли центрифугированием, ресуспендировали в воде и снова центрифугировали. Эту процедуру повторяли дважды, твердое вещество сушили с получением указанного в заголовке соединения (27 мг, 43%).
1H ЯМР (DMSO-d6): δ 11.20 (1H, s); 11.10 (1H, s); 8.91 (1Н, s); 8.27 (1Н, bs); 7.60 (1Н, bs); 7.27 (1Н, m); 7.24 (1Н, s); 7.17 (1Н, d, J 8,1 Гц); 6.99 (1Н, t, J 7,8 Гц); 6.87 (1Н, s); 6.50 (1Н, d, J 7,5 Гц); 6.21 (1Н, m); 3.88 (3Н, s) и 3.08 (3Н, s).
APCI-MS m/z: 363,1 [MH+].
Пример 63
4-(3-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 3-хлоро-2-метиланилина (25 мкл, 0,21 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 4,5 часов. После охлаждения реакционную смесь разбавляли водой (15 мл) и подщелачивали с помощью 1 М NaOH. Осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (51 мг, 79%).
1H ЯМР (DMSO-d6): δ 10.65 (1Н, s); 8.89 (1H, s); 8.29 (1H, bs); 7.65 (1H, bs); 7.30 (1Н,8);7.17(1Н, d, J 7,8 Гц); 7.01 (1H, t, J 8,0 Гц); 6.71 (1H, s); 6.63 (1H, d, J 7,9 Гц); 3.91 (3Н, s); 3.38 (3Н, s) и 2.40 (3Н, s).
Пример 64
4-[2-(Аминокарбонил)анилино]-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 2-аминобензамида (0,029 г, 0,21 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 6 часов. После охлаждения реакционную смесь упаривали. Остаток растворяли в смеси MeCN и воды (1:3), содержащей 0,1% трифторуксусной кислоты, и мутный раствор фильтровали через подушку из стекловолокна. После препаративной HPLC с использованием градиента (содержащего 0,1% трифторуксусной кислоты) 10→40% MeCN в воде в качестве элюента получали после выпаривания указанное в заголовке соединение в виде соли трифторуксусной кислоты. Продукт суспендировали в насыщенном водном NaHCO3 и абсорбировали на короткой SPE колонке [ISOLUTE™ C18 (ЕС)], предварительно кондиционированной последовательно метанолом и затем водой. Колонку экстенсивно промывали водой до тех пор, пока рН элюента не стало нейтральным. Продукт затем элюировали метанолом. После выпаривания остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (26 мг, 41%).
1H ЯМР (DMSO-d6): δ 10.87 (1H, s); 8.79 (1H, s); 8.07 (1H, bd, J 7,5 Гц); 7.66 (1H, dd, J 7,7 и 1,2 Гц); 7.47 (1H, bd, J 5,6 Гц); 7.34 (1H, s); 7.20 (1H, dt, J 7,7 и 1,2 Гц); 6.95 (1H, s); 6.92 (1H, d, J 7,4 Гц); 6.52 (1H, d, J 8,1 Гц); 3.93 (3Н, s) и 3.50 (3Н, s).
APCI-MS m/z: 367,0 [МН+]
Пример 65
4-(3-Гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 3-амино-2-метилфенола (0,032 г, 0,26 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 1,5 часов. После охлаждения смесь разбавляли водой (15 мл) и подщелачивали насыщенным NaHCO3. Указанное в заголовке соединение, которое медленно выпадало в осадок, отфильтровывали и сушили с получением 34 мг (55%).
1H ЯМР (DMSO-d6): δ 10.77 (1Н, s); 9.49 (1H, s); 8.86 (1H, s); 8.25 (1H, bs); 7.58 (1H, bs); 7.24 (1H, s); 6.88 (1H, t, J 8,0 Гц); 6.76 (1H, s); 6.61 (1H, d, J 8,0 Гц); 6.23 (1H, d, J 7,9 Гц); 3.89 (3Н, s); 3.30 (3Н, s) и 2.11 (3Н, s).
APCI-MS m/z: 354,1 [МН+]
Пример 66
6,7-Диметокси-4-(3-метокси-2-метиланилино)-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 3-метокси-2-метиланилина (0,036 г, 0,26 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 2,5 часов. После охлаждения смесь разбавляли водой (15 мл) и подщелачивали насыщенным NaHCO3. Полученный в результате клейкий осадок собирали и кристаллизовали из смеси метанол-вода с получением указанного в заголовке соединения (45 мг, 70%).
1H ЯМР (DMSO-d6): δ 10.76 (1H, s); 8.87 (1H, s); 8.26 (1H, bs); 7.60 (1H, bs); 7.25 (1H, s); 7.05 (1H, t, J 8,2 Гц); 6.77 (1H, d, J 8,2 Гц); 6.72 (1H, s); 6.36 (1H,d,J 8,0 Гц); 3.89 (3Н, s); 3.81 (3Н, s); 3.29 (3Н, s) и 2.16 (3Н, s).
APCI-MS m/z: 368,1 [МН+]
Пример 67
6,7-Диметокси-4-[(1-метил-1H-индол-4-ил)амино]-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,028 г, 0,10 ммоль), 4-амино-1-метилиндола гидрохлорида (0,026 г, 0,14 ммоль) и ацетата натрия (0,013 г, 0,16 ммоль)) в DMF (0,6 мл) нагревали при 100°С в течение 8 часов. После охлаждения смесь разбавляли водой и подщелачивали насыщенным NaHCO3. Клейкий осадок собирали и кристаллизовали из смеси метанол-вода с получением указанного в заголовке соединения (24 мг, 60%).
1H ЯМР (DMSO-d6): δ 11.07 (1H, s); 8.91 (1H, s); 8.28 (1H, bs); 7.61 (1H, bs); 7.27 (1H, d, J 3,2 Гц); 7.26 (1H, s); 7.20 (1H, d, J 8,2 Гц); 7.05 (1H, t, J 7,9 Гц); 6.50 (1H, d, J 7.4 Гц); 6.23 (1H, d, J 3,1 Гц); 3.98 (3Н, s); 3.79 (3Н, s) и 3.12 (3Н, s).
APCl-MS m/z: 377,1 [MH+]
Пример 68
6,7-Диметокси-4-[(1-оксо-2,3-дигидро-1H-инден-4-ил)амино]-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 4-амино-1-инданона (0,036 г, 0,24 ммоль) и уксусной кислоты (40 мкл) в DMF (0,6 мл) нагревали при 100°С в течение 1 часа 45 минут. После охлаждения смесь разбавляли водой и подщелачивали насыщенным NaHCO3. Осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (59 мг, 90%).
1H ЯМР (DMSO-d6): δ 10.60 (1H, s); 8.92 (1H, s); 8.30 (1H, bs); 7.67 (1H, bs); 7.36 (1H, s); 7.32-7.25 (2H, m); 6.89 (1H, dd, J 6,6 и 2,0 Гц); 6.87 (1H, s); 3.94 (3Н, s); 3.42 (3Н, s); 3.06-2.95 (2H, m) и 2.74-2.67 (2H, m).
APCl-MS m/z: 378,1 [MH+]
Пример 69
4-(1-Гидрокси-2,3-дигидро-1H-инден-4-ил)амино-6,7-диметокси-3-хинолинкарбоксамид
6,7-Диметокси-4-[(1-оксо-2,3-дигидро-1H-инден-4-ил)амино]-3-хинолинкарбоксамид (0,062 г, 16,4 ммоль) растворяли в смеси метанола (7 мл), тетрагидрофурана (4 мл) и воды (3 мл). Боргидрид натрия добавляли порциями (3×5 мг) в течение 5 минут. Через 20 минут реакционную смесь подкисляли уксусной кислотой и затем подщелачивали насыщенным водным гидрокарбонатном натрия и упаривали. Остаток разделяли между водой и этилацетатом. Органическую фазу дважды промывали водой и упаривали. Остаток растворяли в метаноле и добавляли воду. Указанное в заголовке соединение, которое медленно выпадало в осадок, отфильтровывали и сушили с получением 40 мг (64%).
1H ЯМР (DMSO-d6): δ 10.68 (1Н, s); 8.82 (1H, s); 8.20 (1H, bs); 7.55 (1H, bs); 7.22 (1H, s); 7.07 (1H, t, J 7,5 Гц); 7.04 (1H, t, J 7,4 Гц); 6.75 (1H, s); 6.63 (1H, d, J 7,5 Гц); 5.20 (1H, d, J 5,7 Гц); 5.01 (1H, q, J 6,2 Гц); 3.85 (3Н, s); 3.26 (s, перекрывающий сигнал от влаги); 2.72-2.63 (1H, m); 2.50-2.36 (m, перекрывающий сигнал растворителя); 2.30-2.20 (1H, m) и 1.76-1.65 (1H, m).
Пример 70
4-(4-Карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,17 ммоль), 4-амино-2-метилбензойной кислоты (0,036 г, 0,24 ммоль) и уксусной кислоты (40 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 12 часов. После охлаждения смесь разбавляли водой (15 мл) и подщелачивали насыщенным NaHCO3, а затем слегка подкисляли уксусной кислотой. Осадок отфильтровывали и суспендировали в теплом метаноле. После охлаждения осадок отфильтровывали и сушили с получением указанного в заголовке соединения (31 мг, 47%).
1H ЯМР (DMSO-d6): δ 12.59 (1H, bs); 10.52 (1H, s); 8.93 (1H, s); 8.34 (1H, bs); 7.58 (1H, d, J 1,4 Гц); 7.73 (1H, s); 7.60 (1H, dd, J 8,4 и 1,9 Гц); 7.36 (1H, s); 6.75 (1H, s); 6.53 (1H, d, J 8,4 Гц); 3.94 (3Н, s); 3.42 (3Н, s) и 2.41 (3Н, s).
APCI-MS m/z: 382,1 [MH+]
Пример 71
6,7-Диметокси-4-(4-метоксикарбонил-2-метиланилино)-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,046 г, 0,35 ммоль), метил-4-амино-2-метилбензойной кислоты (0,076 г, 0,46 ммоль) и уксусной кислоты (100 мкл) в DMF (0,8 мл) нагревали при 100°С в течение 9 часов. После охлаждения смесь объединяли с двумя аналогичными реакционными смесями (начиная с 92 и 46 мг 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида соответственно) и разбавляли водой. Смесь подщелачивали насыщенным NaHCO3, клейкий осадок собирали, промывали водой и перекристаллизовывали из метанола с получением указанного в заголовке соединения (130 мг, 47%).
1H ЯМР (DMSO-d6): δ 10.49 (1Н, s); 8.94 (1H, s); 8.35 (1H, bs); 7.88 (1H, d, J 1,4 Гц); 7.62 (1H, dd, J 8,2 и 2,0 Гц); 7.37 (1H, s); 6.53 (1H, d, J=8,4 Гц); 3.94 (3H, s); 3.80 (3H, s); 3.43 (3Н, s) и 2.43 (3Н, s).
APCI-MS m/z: 395,9 [MH+]
Пример 72
4-(4-Гидроксиметил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
6,7-Диметокси-4-(4-метоксикарбонил-2-метиланилино)-3-хинолинкарбоксамид (0,080 г, 0,20 ммоль) растворяли в тетрагидрофуране (25 мл, сушили на 4 А молекулярных ситах). Добавляли боргидрид лития (0,15 мг, 6,8 ммоль). Смесь перемешивали в течение 24 часов и добавляли дополнительное количество боргидрида лития (0,050 г, 2,2 ммоль). Реакционную смесь перемешивали в течение еще 25 часов и затем вливали в охлажденную смесь воды (20 мл) и уксусной кислоты (0,5 мл). Добавляли уксусную кислоту (2 мл) и смесь выпаривали при пониженном давлении. Остаток суспендировали в воде, фильтровали, а осадок промывали водой и перекристаллизовывали из водного метанола с получением указанного в заголовке соединения (32 мг, 43%).
1H ЯМР (DMSO-d6): δ 11.54 (1H, s); 8.94 (1H, s); 8.46 (1H, bs); 7.86 (1H, s); 7.69 (1H, bs); 7.31 (1H, d, J 1,3 Гц); 7.16 (1H, dd, J 8,1 и 1,4 Гц); 7.04 (1H, d, J 8,0 Гц); 6.89 (1H, s); 5.20 (1H, t, J 5,6 Гц); 4.47 (2Н, d, J 5,7 Гц); 3.91 (3H, s); 3.27 (3Н, s) и 2.23 (3Н, s).
APCI-MS m/z: 368,1 [MH+]
Пример 73
6,7-Диметокси-4-(2-пропиланилино)-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,062 г, 0,23 ммоль), 2-пропиланилина (0,038 г, 0,28 ммоль), 2-бутанола (2 мл), DMF (2 мл) и уксусной кислоты (8,2 мкл) нагревали в течение ночи при 100°С. После охлаждения объем раствора уменьшали путем выпаривания. Остаток растворяли в воде (3 мл) и обрабатывали водным аммиаком. Твердый продукт отфильтровывали, промывали водой, сушили на воздухе в течение 0,5 часов, снова промывали гептаном и сушили в вакуумной сушилке при 50°С с получением желто-коричневого твердого вещества, 35 мг (41%) указанного в заголовке соединения.
APCI-LC/MS m/z: 366,1 [МН+].
1H ЯМР (DMSO-d6): δ 10.95 (1Н, s); 8.88 (1Н, s); 8.28 (1Н, br s); 7.62 (1H, br s); 7.29 (1Н, m); 7.24 (1Н, s); 7.05 (2H, m); 6.68 (1Н, m); 6.63 (1Н, s); 3.88 (3H, s); 3.21 (3H, s); 2.67 (2H, t); 1.65 (2H, m); 0.93 (3H, t).
Соединения, указанные в заголовках примеров 74-86, получали способом, аналогичным описанному в Примере 73.
Пример 74
4-(2-Изопропиланилино)-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 11.07 (1H, s); 8.87 (1Н, s); 8.28 (1H, br s); 7.58 (1Н, br s); 7.40 (1Н, d); 7.23 (1Н, s); 7.13 (1Н, t); 7.07 (1Н, t); 6.68 (1Н, d); 6.59 (1Н, s); 3.88 (3H, s); 3.35 (1Н, m); 3.18 (3H, s); 1.27 (6H, d).
APCI-MS m/z: 366,1 [МН+]
Пример 75
4-[2-(втор-Бутил)анилино]-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 11.08 (1Н, s); 8.87 (1Н, s); 8.28 (1Н, br s); 7.59 (1Н, br s); 7.34 (1Н, d); 7.22 (1Н, s); 7.13 (1Н, t); 7.07 (1Н, t); 6.68 (1Н, d); 6.61 (1Н, s); 3.86 (3H, s); 3.17 (3H, s); 3.13 (1Н, m); 1.65 (2H, m); 1.21 (3H, d); 0.80 (3H, t).
APCI-MS m/z: 380.2 [МН+].
Пример 76
6,7-Диметокси-4-[3-(метоксиметил)-2-метиланилино]-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.82 (1Н, s); 8.86 (1Н, s); 8.25 (1Н, br s); 7.58 (1Н, br s); 7.22 (1Н, s); 7.08 (2H, m); 6.71 (1Н, d); 6.64 (1Н, s); 4.45 (2H, s); 3.86 (3H, s); 3.22 (3H, s); 2.25 (3H, s).
APCI-MS m/z: 382,1 [МН+]
Пример 77
4-[3-(изо-Бутоксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.83 (1Н, s); 8.83 (1Н, s); 8.23 (1Н, br s); 7.58 (1Н, br s); 7.22 (1Н, s); 7.08 (2H, m); 6.72 (1Н, d); 6.62 (1Н, s); 4.48 (2H, s); 3.86 (3H, s); 3.22 (3H, s); 3.19 (2H, d); 2.25 (3H, s); 1.80 (1Н, m); 0.84 (6H, d).
APCI-MS m/z: 424,1 [МН+]
Пример 78
4-[3-(Цианометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 10.76 (1Н, s); 8.86 (1H, s); 8.25 (1H, br s); 7.60 (1H, br s); 7.24 (1H, s); 7.12 (2H, m); 6.71 (1H, d); 6.61 (1H, s); 4.07 (2H, s); 3.87 (3H, s); 3.22 (3H, s); 2.30 (3H, s).
APCl-LC/MS m/z: 377,1 [МН+].
Пример 79
4-{3-[(Этиламино)метил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид
Указанное в заголовке соединение получали, начиная с трет-бутил-3-амино-2-метилбензил(этил)карбамата, после удаления защиты с использованием TFA получали указанное в заголовке соединение.
1H ЯМР (CDCl3): δ 10.68 (1H, s); 8.75 (1H, s); 7.23 (1H, s); 7.13 (1H, d); 7.05 (1H, t); 6.83 (1H, d); 6.72 (1H, s); 6.25 (2H, br s); 3.95 (3H, s); 3.82 (2H, s); 3.31 (3H, s); 2.73 (2H, q); 2.35 (3H, s); 0.64 (3H, t).
APCI-MS m/z: 395,1 [МН+]
Пример 80
4-{3-[2-(Этиламино)-2-оксоэтил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 10.86 (1H, s); 8.85 (1H, s); 8.23 (1H, br s); 7.94 (1H, m); 7.56 (1H, br s); 7.21 (1H, s): 7.01 (1H, d); 6.66 (1H, m); 6.62 (1H, s); 3.86 (3H, s); 3.49 (2H, s); 3.21 (3H, s); 3.05 (2H, m); 2.25 (3H, s); 1.00 (3H, t).
APCI-MS m/z: 423,3 [МН+]
Пример 81
Этил-2-(3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилфенил)ацетат
1H ЯМР (DMSO-d6) δ 10.87 (1H, s); 8.86 (1H, s); 8.26 (1H, br s); 7.56 (1H, br s); 7.22 (1H, s); 7.04 (2H, m): 6.72 (1H, m); 6.16 (1H, s); 4.06 (2H, q); 3.86 (3H, s); 3.76 (2H, s); 3.23 (3H, s); 2.20 (3H, s); 1.15 (3H, t).
APCI-MS m/z: 424,1 [МН+]
Пример 82
4-[3-(2-Амино-2-оксоэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 10.83 (1Н, s); 8.83 (1H, s); 8.24 (1H, br s); 7.56 (1H, br s); 7.38 (1H, br s); 7.21 (1H, s): 7.08 (2H, m); 6.89 (1H, br s); 6.66 (1H, m); 6.62 (1H, s); 3.86 (3H, s); 3.50 (2H, s); 3.22 (3H, s); 2.26 (3H, s).
APCI-MS m/z: 395,1 [MH+]
Пример 83
4-[3-(2-Гидроксиэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 10.82 (1H, s); 8.82 (1H, s); 8.24 (1H, br s); 7.56 (1H, br s); 7.22 (1H, s); 7.01 (2H, m); 6.62 (2H, m); 4.66 (1H, t); 3.86 (3H, s); 3.55 (2H, q); 3.21 (3H, s); 2.82 (2H, t); 2.26 (3H, s); 2.27 (3H, s).
APCI-MS m/z: 382,1 [MH+]
Пример 84
4-(3-{2-[(2-Гидроксиэтил)амино]-2-оксоэтил}-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 10.83 (1H, s); 8.82 (1H, s); 8.25 (1H, br s); 7.95 (1H, m); 7.58 (1H, br s); 7.21 (1H, s); 7.03 (2H, m): 6.68 (1H, m); 6.62 (1H, s); 4.65 (1H, t); 3.86 (3H, s); 3.54 (2H, s); 3.39 (2H, m); 3.23 (3H, s); 3.12 (2H, m); 2.26 (3H, s).
APCI-MS m/z: 439,1 [MH+]
Пример 85
трет-Бутил-3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилбензилкарбамат
1H ЯМР (DMSO-d6) δ 10.83 (1H, s); 8.84 (1H, s); 8.22 (1H, br s); 7.55 (1H, br s); 7.32 (1H, m); 7.22 (1H, s); 7.08 (2H, m); 6.66 (1H, d); 6.60 (1H, s); 4.15 (2H, d); 3.85 (3H, s); 3.21 (3H, s); 2.25 (3H, s); 1.39 (9H, s).
APCI-MS m/z: 467,2 [MH+]
Пример 86
4-[3-(Аминометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
трет-Бутил-3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилбензилкарбамат (0,12 мг, 0,25 ммоль) растворяли в CH2Cl2 (5 мл), охлаждали на льду и добавляли TFA (3 мл). Через 2 часа перемешивания при комнатной температуре смесь упаривали с получением масла, которое растворяли в смеси СН2Cl2/водный раствор Na2СО3. Водную фазу экстрагировали CH2Cl2 (×6). Экстракты промывали рассолом, сушили (Na2SO4) и упаривали. Остаток очищали хроматографией (CH2Cl2/MeOH/NH3) с получением указанного в заголовке соединения, 54 мг (59%), в виде белого порошка.
1H ЯМР (CDCl3) δ 10.83 (1H, s); 8.82 (1H, s); 8.11 (1H, br s); 7.55 (1H, br s); 7.22 (1H, s); 7.16 (1H, d); 7.05 (1H, m); 6.65 (2H, m); 3.86 (3H, s); 3.75 (2H, s); 3.22 (3H, s); 2.27 (3H, s).
APCI-MS m/z: 353,1 [MH+]
Промежуточные соединения, использованные в качестве исходных веществ в примерах 87-179
Этил-7-метокси-4-хлоро-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
7-Метокси-4-хлоро-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 8.80 (1H, s); 8.19 (1H, s); 8.15 (1H, br s); 7.90 (1H, br s); 7.50 (1H, d); 7.46 (1H, dd); 3.96 (3H, s).
Этил-4-хлоро-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
4-Хлоро-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 8.8 (1H, s); 8.30 (1H, d); 8.19 (1H, br s); 8.13 (1H, d); 7.96 (1H, br s); 7.93 (1H, t); 7.83 (1H, t).
Этил-6,7-дихлоро-4-хлоро-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
6,7-Дихлоро-4-хлоро-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 8.94 (1H, s); 8.47 (2H, d); 8.27 (1H, br s); 8.06 (1H, br s).
Этил-6-метокси-4-хлоро-3-хинолинкарбоксилат
Указанное в заголовке соединение получали по существу так, как описано Burke et al. J. Med. Chem, 36 (1993) 425-432.
6-Метокси-4-хлоро-З-хинолинкарбоксамид
1H ЯМР (DMSO-d6) δ 8.70 (1Н, s); 8.17 (1H, br s); 8.04 (1H, d); 7.92 (1H, br s); 7.56 (1H, dd); 7.52 (1H, d); 3.97 (3H, s).
Пример 87
4-(4-Фторо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид
Смесь 4-фторо-2-метиланилина (0,025 ммоль), 6-метокси-4-хлоро-З-хинолинкарбоксамида (0,025 ммоль), 50 мкл смеси 20% уксусная кислота/этанол и 250 мкл этанола кипятили с обратным холодильником в течение четырех часов. После охлаждения до комнатной температуры растворитель удаляли в вакууме.
APCI-MS m/z: 326 [МН+]
Соединения, указанные в заголовках примеров 88-179, получали способом, аналогичным описанному в Примере 87.
Пример 88
4-(4-Бромо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 388 [МН+]
Пример 89
4-(4-Хлоро-2-метиланилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 342 [МН+]
Пример 90
4-(2,4-Диметиланилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 322 [МН+]
Пример 91
6-Метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+]
Пример 92
4-(4-Гидрокси-2-метиланилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 324 [МН+]
Пример 93
4-(2-Бромоанилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 374 [МН+]
Пример 94
4-(2,4-Диметоксианилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 354 [МН+]
Пример 95
6-Метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид
APCI-MS m/z: 324 [МН+]
Пример 96
4-(2-Этоксианилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+]
Пример 97
4-(2-Этиланилино)-6-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 322 [МН+]
Пример 98
6-Метокси-4-(2-толуидино)-3-хинолинкарбоксамид
APCI-MS m/z: 308 [МН+]
Пример 99
6-Метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 340 [МН+]
Пример 100
4-(4-Бромо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 417 [МН+]
Пример 101
4-(4-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 372 [МН+]
Пример 102
4-(2,4-Диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 352 [МН+]
Пример 103
6,7-Диметокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+]
Пример 104
4-(2-Бромо-4-метиланилино)-6,7-ДИметокси-3-хинолинкарбоксамид
APCI-MS m/z:417[MH+]
Пример 105
4-(2-Бромо-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 421 [МН+]
Пример 106
4-(2,4-Диметоксианилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 384 [МН+]
Пример 107
4-(4-Фторо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 326 [МН+]
Пример 108
4-(4-Бромо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 388 [МН+]
Пример 109
4-(4-Хлоро-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 342 [МН+]
Пример 110
4-(2,4-Диметиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 322 [МН+]
Пример 111
7-Метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+]
Пример 112
4-(4-Гидрокси-2-метиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 324 [МН+]
Пример 113
4-(2-Бромоанилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 374 [МН+]
Пример 114
4-(2-Бромо-4-метиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 388 [МН+]
Пример 115
4-(2-Бромо-4-фтороанилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 390 [МН+]
Пример 116
4-(2,4-Диметоксианилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 354 [МН+]
Пример 117
6,7-Дихлоро-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 376 [МН+]
Пример 118
6,7-Дихлоро-4-(2,4-диметоксианилино)-3-хинолинкарбоксамид
APCI-MS m/z: 392 [МН+]
Пример 119
4-(2-Этиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 292 [МН+]
Пример 120
4-(2-Толуидино)-3-хинолинкарбоксамид
APCI-MS m/z: 278 [МН+]
Пример 121
4-[2-(Метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 310 [МН+]
Пример 122
4-(2-Этоксианилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+]
Пример 123
4-[2-(Гидроксиметил)анилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 354 [МН+]
Пример 124
4-(2-Этиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-LC/MS m/z: 352 [МН+]
Пример 125
6,7-Диметокси-4-(2-толуидино)-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+]
Пример 126
6,7-Диметокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 370 [МН+]
Пример 127
4-(2,4-Дибромоанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 481 [МН+]
Пример 128
7-Метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид
APCI-MS m/z: 324 [МН+]
Пример 129
4-(2-Этоксианилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+]
Пример 130
4-[2-(аминокарбонил)анилино]-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 337 [МН+]
Пример 131
4-(2-Этиланилино)-7-метокси-3-хинолинкарбоксамид
APCI-MS m/z: 322 [МН+]
Пример 132
7-Метокси-4-(2-толуидино)-3-хинолинкарбоксамид
APCI-MS m/z: 308 [МН+]
Пример 133
7-Метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 340 [МН+]
Пример 134
6,7-Дихлоро-4-(2-метоксианилино)-3-хинолинкарбоксамид
APCI-MS m/z: 361 [МН+]
Пример 135
6,7-Дихлоро-4-(2-этиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 360 [МН+]
Пример 136
6,7-Дихлоро-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 378 [МН+]
Пример 137
4-(2,5-Диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 352 [МН+]
Пример 138
4-(5-Фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 356 [МН+]
Пример 139
4-(5-Хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 372 [МН+]
Пример 140
4-(3-Фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 356 [МН+]
Пример 141
4-(4-Гидрокси-2,5-диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+]
Пример 142
4-(2-Гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 354 [МН+]
Пример 143
4-Анилино-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 324 [МН+]
Пример 144
4-(4-Хлоро-2-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 375 [МН+]
Пример 145
4-(2-Фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 341 [МН+]
Пример 146
4-(2,6-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 359 [МН+]
Пример 147
4-(3-Бромоанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 401, 403 [MH+]
Пример 148
4-(3-Фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 341 [МН+].
Пример 149
6,7-Диметокси-4-(4-метоксианилино)-3-хинолинкарбоксамид
APCI-MS m/z: 337 [МН+].
Пример 150
4-(3-Хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 357 [МН+].
Пример 151
4-(2-Хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 357 [МН+].
Пример 152
4-[3-(Ацетиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 380 [МН+].
Пример 153
4-(2,5-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 359 [МН+].
Пример 154
4-(1Н-Индол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 363 [МН+].
Пример 155
4-(1Н-Индазол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z; 364 [МН+].
Пример 156
4-(1Н-Индазол-6-иламино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 364 [МН+].
Пример 157
4-(2,4-Дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 359 [МН+].
Пример 158
4-(2-Фторо-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 356 [МН+].
Пример 159
4-(2,4-Дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 391, 393 [МН+].
Пример 160
4-(2,5-Дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 391, 393 [МН+].
Пример 161
4-[2-(2-Гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+].
Пример 162
4-(3-Хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 375 [МН+].
Пример 163
6,7-Диметокси-4-[3-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 370 [МН+].
Пример 164
6,7-Диметокси-4-(2-метокси-5-метиланилино)-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+].
Пример 165
4-[4-(Диметиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 367 [МН+].
Пример 166
6,7-Диметокси-4-[4-(метилсульфанил)анилино]-3-хинолинкарбоксамид
APCI-MS m/z: 370 [МН+].
Пример 167
4-[4-(2-Гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+].
Пример 168
4-(3-Гидрокси-4-метоксианилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 370 [МН+].
Пример 169
4-(2,3-Дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 391 [МН+].
Пример 170
6,7-Диметокси-4-(2,3,4-трифтороанилино)-3-хинолинкарбоксамид
APCI-MS m/z: 378 [МН+].
Пример 171
6,7-Диметокси-4-(3-толуидино)-3-хинолинкарбоксамид
APCI-MS m/z: 338 [МН+].
Пример 172
4-(2-Гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 354 [МН+].
Пример 173
4-(2-Фторо-4-гидроксианилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 358 [МН+].
Пример 174
4-[2-(Гидроксиметил)-4-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 368 [МН+].
Пример 175
4-(2-Хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 375 [МН+].
Пример 176
4-(2-фторо-5-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид
APCI-MS m/z: 356 [МН+].
Пример 177
4-[(2-Цианофенил)амино]-6,7-диметоксихинолин-3-карбоксамид
APCI-MS m/z: 349 [МН+].
Пример 178
4-[(2,5-Дифторофенил)амино]-6,7-диметоксихинолин-3-карбоксамид
APCI-MS m/z; 360[MH+]
Пример 179
4-(1Н-индол-5-иламино)-6,7-диметоксихинолин-3-карбоксамид
APCI-MS m/z: 363[MH+]
Пример 180
6,7-Дихлоро-4-(2-метиланилино)-3-хинолинкарбоксамид
Смесь этил-6,7-дихлоро-4-(2-метиланилино)-3-хинолинкарбоксилата (0,050 г, ммоль) и NH4Cl нагревали в сосуде высокого давления с метанолом, насыщенным NH3, в течение пяти суток. Смесь упаривали и осадок перекристаллизовывали из EtOH.
1H ЯМР (DMSO-d6): δ 10.9 (1Н, s); 9.0 (1Н, s); 8.3 (1H, br s); 8.1 (1H, s); 7.7 (1H, br s); 7.6 (1H, s); 7.6 (1H, dd); 7.2 (2H, m); 6.6 (1H, dd); 2.27 (3H, s).
Пример 181
4-(2,3-Дигидро-1H-инден-1-иламино)-6,7-диметокси-3-хинолинкарбоксамид
Смесь 4-хлоро-6,7-диметокси-3-хинолинкарбоксамида (0,066 г, 0,25 ммоль), 1-аминоиндана (0,66 мг, 0,50 ммоль), 2-бутанола (2 мл), DMF (2 мл) нагревали в течение 48 часов при 100°С. После охлаждения объем раствора уменьшали выпариванием. Осадок растворяли в воде (3 мл) и обрабатывали водным аммиаком. Твердый продукт отфильтровывали, промывали водой, сушили на воздухе в течение 0,5 часа, снова промывали гептаном и сушили.
Остаток очищали хроматографией на диоксиде кремния (CH2Cl2/MeOH) с получением 63 мг (70%) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (DMSO-d6): δ 8.74 (1H, d); 8.63 (1H, s); 8.05 (1H, br s); 7.55 (1H, s); 7.35 (1H, br s); 7.30-7.14 (5H, m); 5.46 (1H, q); 3.89 (3H, s); 3.83 (3H, s); 2.99-2.91 (1H, m); 2.88-2.76 (1H, m); 2.62-2.52 (1H, m); 1.02-0.91 (1H, m).
APCI-MC m/z: 364,1 [МН+]
Соединения, указанные в заголовках примеров 182-183, получали способом, аналогичным описанному в Примере 181.
Пример 182
6,7-Диметокси-4-{[2-(трифторометил)бензил]амино}-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 8.91 (1Н, t); 8.59 (1Н, s); 7.98 (1Н, br s); 7.75 (2H, m); 7.68 (1H,t); 7.51 (1H, t); 7.34 (1H,br s); 7.25 (1H,s); 7.21 (1Н, s); 4.91 (2H, d); 3.88 (3H, s); 3.51 (3H, s).
APCI-MS m/z: 406,1 [MH+]
Пример 183
6,7-Диметокси-4-[(1-фенилэтил)амино]-3-хинолинкарбоксамид
1H ЯМР (DMSO-d6): δ 9.40 (1Н, d); 8.66 (1Н, s); 8.06 (1Н, br s); 7.43-7.35 (2H, m); 7.30 (2H, t); 7.18-7.22 (2H, m); 7.14 (1Н, s); 5.18 (1Н, m); 3.83 (3H, s); 3.45 (3H, s); 1.52 (3H, d).
APCI-MS m/z: 352,1 [MH+]
Пример 184
4-(3-Гидроксиметил-2-метиланилино)-3-хинолинкарбоксамид
а) Диэтил-2-[1,3-бензодиоксол-5-иламино)метилен]малонат
Диэтил-2-(этоксиметилен)малонат (4,1 мл, 20,3 ммоль), 3,4-метилендиоксианилин (2,77 г, 20,2 ммоль) перемешивали в атмосфере азота при 120°С в течение 2,5 часов. Реакционную смесь охлаждали и добавляли этанол. Осадок собирали фильтрацией и перекристаллизовывали из этанола с получением указанного в заголовке соединения (3,52 г, 56%)
1H ЯМР (DMSO-d6): δ 10.67 (1Н, d, J 13,9 Гц); 8.28 (1Н, d, J 13,9 Гц); 7.12 (1Н, d, J 2,2 Гц); 6.91 (1Н, d, J 8,3 Гц); 6.81 (1Н, dd, J 8,4 и 2,3 Гц); 6.04 (2H, s); 4.19 (2H, q, J 7,1 Гц); 4.10 (2H, q, J 7,1 Гц); 1.25 (3H, t, J 7,1 Гц); и 1.23 (3H, t, J 7,2 Гц).
б) Этил-4-хлоро-6,7-метилендиокси-3-хинолинкарбоксилат
Диэтил-2-[1,3-бензодиоксол-5-иламино)метилен]малонат (3,25 г, 11,6 ммоль) растворяли в POCl3 (60 мл) и нагревали с обратным холодильником в течение 4,5 часов, охлаждали и дважды выпаривали вместе с толуолом. Остаток суспендировали в ледяном насыщенном водном NaHCO3, осадок собирали фильтрацией, промывали в воде и сушили с получением указанного в заголовке соединения (3,01 г, 95%).
1H ЯМР (DMSO-d6): δ 8.92 (1Н, s); 7.64 (1H, s); 7.49 (1H, s); 6.33 (2H, s); 4.40 (2H, q, J 7,1 Гц) и 1.36 (ЗН, t, J 7,1 Гц).
APCI-MS m/z: 279,9 [MH+]
в) 4-Хлоро-6,7-метилендиокси-3-хинолинкарбоновая кислота
Этил-4-хлоро-6,7-метилендиокси-3-хинолинкарбоксилат (1,54 г, 5,5 ммоль) суспендировали в смеси этанола (25 мл), THF (5 мл) и водного 2 М NaOH (25 мл) и перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь нейтрализовали 1 М водной HCl и органические растворители выпаривали при пониженном давлении. После подкисления до рН 2-3 с помощью 1 М HCl полученный осадок отделяли центрифугированием. Осадок ресуспендировали в воде и центрифугировали снова. Процедуру повторяли дважды с получением после сушки указанного в заголовке соединения (1,25 г, 90%)
1H ЯМР (DMSO-d6): δ 13.71 (1H, bs); 8.93 (1H, s); 7.63 (1H, s); 7.47 (1H, s) и 6.32 (2H, s).
г) 3-Хлоро-6,7-метилендиокси-3-хинолинкарбоксамид
4-Хлоро-6,7-метилендиокси-3-хинолинкарбоновую кислоту (0,68 г, 2,7 ммоль) суспендировали в тионилхлориде (30 мл) и смесь нагревали до кипения с обратным холодильником в течение 1 часа и затем выпаривали вместе с толуолом. Остаток суспендировали в ледяном ацетоне (25 мл) и обрабатывали порциями охлажденного на льду насыщенного водного аммиака (28%, 2 мл) при 0°С. Реакционную смесь перемешивали при 0°С в течение 2 минут и затем фильтровали. Твердое вещество промывали водой и сушили с получением указанного в заголовке соединения (501 мг, 74%).
1H ЯМР (DMSO-d6): δ 8.63 (1H, s); 8,10 (1H, bs); 7.84 (1H, s); 7.56 (1H, s); 7.46 (1Н, s) и 6.30 (2Н, s).
д) 4-(3-Гидроксиметил-2-метиланилино)-3-хинолинкарбоксамид
Смесь 3-хлоро-6,7-метилендиокси-3-хинолинкарбоксамида (106 мг, 0,42 ммоль); 3-амино-2-метилбензилового спирта (72 мг, 0,52 ммоль) и уксусной кислоты (100 мкл) в DMF (2 мл) нагревали при 100°С в течение 6 часов. После охлаждения смесь разбавляли водой (20 мл) и промывали дважды этилацетатом. Водную фазу подщелачивали с помощью 1 М NaOH и полученный осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (113 мг, 75%).
1H ЯМР (DMSO-d6): δ 10.47 (1Н, s); 8.86 (1H, s); 8.30 (1H, s); 7.64 (1H, s); 7.26 (1H, s); 7.13 (1H, d, J7,3 Гц); 7.00 (1H, t, J7,7 Гц); 6.66 (1H, s); 6.49 (1H, d, J 7,8 Гц); 6.11 (2Н, s); 5.14 (1H, bs); 4.56 (2H, s) и 2.28 (3Н, s).
APCI-MSm/z: 352,1 [MH+]
Пример 185
9-(3-Гидроксиметил-2-метиланилино)-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксамид
а) Этил-9-хлоро-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксилат
Диэтил-2-(этоксиметилен)малонат (4,1 мл, 20,3 ммоль) и 2,3-дигидро-1,4-бензодиоксин-6-амин (2,48 мл, 20,2 ммоль)) перемешивали в атмосфере азота при 120°С в течение 4 часов, реакционную смесь затем выпаривали при пониженном давлении. Неочищенный диэтил-2-[2,3-дигидро-1,4-бензодиоксин-6-иламино)метилен]малонат растворяли в POCl3 и нагревали с обратным холодильником в течение 5 часов, смесь затем упаривали вместе с толуолом. Остаток растворяли в метиленхлориде и промывали насыщенным водным NaHCO3 и водой, сушили (Na2SO4), фильтровали и выпаривали. Остаток кристаллизовали из смеси метанол-вода с получением 3,5 г неочищенного продукта. После перекристаллизации из смеси метанол-вода и в заключение из метанола получали указанное в заголовке соединение (1,14 г, 19%).
1H ЯМР (DMSO-d6): δ 8.93 (1H, s); 7.65 (1H, s); 7.51 (1H, s); 4.49-4.42 (4H, m); 4.40 (2H, q, J 7,1 Гц); и 1.36 (3Н, t, J 7,1 Гц).
APCI-MS m/z: 293,9 [MH+]
б) 9-Хлоро-2,3-дигидро[1,4]диоксино[1,3g]хинолин-8-карбоновая кислота
Этил-9-хлоро-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксилат (1,1 г, 3,7 ммоль) растворяли в смеси этанола (20 мл) и THF (5 мл). Добавляли водный NaOH (2 М, 20 мл). После перемешивания при температуре окружающей среды в течение 1 часа 45 минут реакционную смесь подкисляли с помощью 1 М HCl. Органические растворители выпаривали при пониженном давлении, а неочищенный продукт отделяли центрифугированием. После декантации осадок ресуспендировали в воде, центрифугировали снова. Эту процедуру повторяли дважды и осадок окончательно сушили с получением указанного в заголовке соединения (0,65 г, 65%).
1H ЯМР (DMSO-d6): δ 13.78 (1Н, bs); 8.94 (1Н, s); 7.66 (1H,s); 7.51 (1Н, s)и 4.45 (4Н, s).
в) 9-Хлоро-2,3-дигидро[1,4]диоксино[1,3g]хинолин-8-карбоксамид
9-Хлоро-2,3-дигидро[1,4]диоксино[1,3g]хинолин-8-карбоновую кислоту (0,61 г) в тионилхлориде (30 мл) нагревали с обратным холодильником в течение 3 часов и реакционную смесь затем упаривали вместе с толуолом. Остаток суспендировали в охлажденном на льду ацетоне (25 мл) и обрабатывали охлажденным на льду насыщенным водным аммиаком (28%, 1,5 мл) порциями при 0°С. Реакционную смесь перемешивали при 0°С в течение 2 минут и затем фильтровали. Твердое вещество промывали водой и сушили с получением незначительно загрязненного указанного в заголовке соединения (435 мг, 71%). Из водного фильтрата дополнительно осаждали указанное в заголовке соединение (91 мг), которое было достаточно чистым для использования без дальнейшей очистки.
1H ЯМР (DMSO-d6): δ 8.64 (1Н, s); 8.10 (1Н, bs); 7.85 (1Н, bs); 7.58 (1Н, s); 7.50 (1H, s) и 4.40 (4H, s).
APCI-MS m/z: 265,0 [MH+]
г) 9-(3-Гидроксиметил-2-метиланилино)-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксамид
Смесь 9-хлоро-2,3-дигидро[1,4]диоксино[1,3g]хинолин-8-карбоксамида (0,090 г, 0,34 ммоль), 3-амино-2-метилбензилового спирта (0,058 г, 0,45 ммоль) и уксусной кислоты (80 мкл) в DMF (1,6 мл) нагревали при 100°С в течение 3 часов. После охлаждения смесь разбавляли водой и подщелачивали с помощью 1 М NaOH. Добавляли метанол и смесь нагревали до частичного растворения клейкого осадка. После охлаждения осадок собирали фильтрацией, промывали водой и сушили с получением указанного в заголовке соединения (98 мг, 75%).
1H ЯМР (DMSO-d6): δ 10.78 (1Н, s); 8.85 (1Н, s); 8.27 (1Н, bs); 7.61 (1Н, bs); 7.26 (1Н, s); 7.17(1H,q, J 7,4 Гц); 7.03 (1H,t, J 7,6 Гц); 6.79 (1Н, s); 6.59 (1H, d, J 7,9 Гц); 5.17 (1Н, t, J 5,2 Гц); 4.57 (2Н, d, J 5,2 Гц); 4.31 (2Н, s); 4.21 (2H, s) и 2.27 (3Н, s).
APCI-MS m/z: 366,1 [MH+]
Соединения, указанные в заголовках примеров 186-195, получали способом, аналогичным описанному в Примере 3.
Пример 186
4-[(2-Этилфенил)амино]-7-метокси-6-[2-(пропиламино)эток-си]хинолин-3-карбоксамид
APCI-MS m/z: 423 [MH+]
Пример 187
6-[2-(Этиламино)этокси]-4-[(2-этилфенил)амино]-7метоксихинолин-3-карбоксамид
APCI-MS m/z: 409 [MH+]
Пример 188
6-[2-(Изопропиламино)этокси]-7-метокси-4-[(3-метокси-2-метилфенил)амино]хинолин-3-карбоксамид
APCI-MS m/z: 439 [MH+]
Пример 189
6-[2-(Диметиламино)этокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-7-метоксихинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 667 [MH+]
Пример 190
6-[3-(Диэтиламино)пропокси]-4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-метоксихинолин-3-карбоксамид
APCI-MS m/z: 467 [MH+]
Пример 191
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-7-метокси-6-[2-(метиламино)этокси]хинолин-3-карбоксамид
APCI-MS m/z: 425 [MH+]
Пример 192
4-[(2-Этилфенил)амино]-7-метокси-6-[3-(пиридин-4-иламино)пропокси]хинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 700 [МН+]
Пример 193
4-[(2-Этилфенил)амино]-7-метокси-6-[3-[(2-амино-2-оксоэтил)амино]пропокси]-хинолин-3-карбоксамид
APCI-MS m/z: 680 [МН+]
Пример 194
4-[(2-Этилфенил)амино]-7-метокси-6-[3-(1Н-пиразол-3-иламино)пропокси]хинолин-3-карбоксамида трифторацетат
APCI-MS m/z: 575 [МН+]
Пример 195
4-[(2-Этилфенил)амино]-7-метокси-6-[3-(пиридин-2-иламино)пропокси]хинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 700 [МН+]
Соединение, указанное в заголовке примера 196, получали способом, аналогичным описанному в Примере 12.
Пример 196
Этил-4-[(3-(аминокарбонил)-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-7-ил)окси]бутаноата трифторацетат
APCI-MS m/z: 597 [МН+]
Соединения, указанные в заголовках примеров 197-218, получали способом, аналогичным описанному в Примере 23.
Пример 197
7-[3-(Диэтиламино)пропокси]-6-метокси-4-[(2-метоксифенил)амино]хинолин-3-карбоксамид
APCI-MS m/z: 453 [МН+]
Пример 198
7-[3-(Этиламино)пропокси]-6-метокси-4-{[2-(трифторметил)фенил]амино}хинолин-3-карбоксамид
APCI-MS m/z: 463 [МН+]
Пример 199
7-[3-(Этиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 423 [МН+]
Пример 200
4-[(2-Этилфенил)амино]-7-[3-(изопропиламино)пропокси]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 437 [МН+]
Пример 201
7-[3-(Этиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 453 [МН+]
Пример 202
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(пропиламино)пропокси]хинолин-3-карбоксамид
APCI-MS m/z: 467 [МН+]
Пример 203
7-[3-(Диметиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 651 [МН+]
Пример 204
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 677 [МН+]
Пример 205
7-[3-(Диэтиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 679 [МН+]
Пример 206
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 691 [МН+]
Пример 207
7-[3-(Диметиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 681 [МН+]
Пример 208
7-[3-(Диэтиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 709 [МН+]
Пример 209
7-{3-[(2-Этоксиэтил)амино]пропокси}-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 467 [МН+]
Пример 210
4-[(2-Этилфенил)амино]-6-метокси-7-(3-пиперидин-1илпропокси)хинолин-3-карбоксамид
APCI-MS m/z: 463 [МН+]
Пример 211
4-[(2-Этилфенил)амино]-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбоксамид
APCI-MS m/z: 481 [МН+]
Пример 212
4-{[3-(Гидроксиметил)-2-метилфенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид
APCI-MS m/z: 465 [МН+]
Пример 213
7-[3-(1,1-Диоксидотиоморфолин-4-ил)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 513 [МН+]
Пример 214
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид
APCI-MS m/z: 479 [МН+]
Пример 215
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид
APCI-MS m/z: 493 [МН+]
Пример 216
4-{[3-(Гидроксиметил)-2-метилфенил]амино}-7-[3-(3-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 495 [МН+]
Пример 217
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]хинолин-3-карбоксамида бис(трифторацетат)
APCI-MS m/z: 705 [МН+]
Пример 218
7-(3-Азепан-1-илпропокси)-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид
APCI-MS m/z: 477 [МН+]
Соединения, указанные в заголовках примеров 219-222, получали способом, аналогичным описанному в Примере 87.
Пример 219
6,7-Диметокси-4-{[2-(метилтио)фенил]амино}хинолин-3-карбоксамида трифторацетат
APCI-MS m/z: 484 [МН+]
Пример 220
6,7-Диметокси-4-[(4-метокси-2-метилфенил)амино]хинолин-3-карбоксамида трифторацетат
APCI-MS m/z: 482 [МН+]
Пример 221
4-{[2-Бромо-3-(гидроксиметил)фенил]амино}-6,7-диметоксихинолин-3-карбоксамид
APCI-MS m/z: 433 [МН+]
Пример 222
4-{[2-Этил-3-(гидроксиметил)фенил]амино}-6,7-диметоксихинолин-3-карбоксамид
APCI-MS m/z: 382 [МН+]
Синтез анилинов, используемых выше
Метил-2-метил-3-нитробензиловый эфир
К раствору натрия (0,10 г, 4,3 ммоль) в метаноле (40 мл) добавляли 2-метил-3-нитробензилхлорид (0,50 г, 2,7 ммоль) и каталитические количества Lil в атмосфере азота. После того, как реакция протекала при 40°С в течение ночи, растворитель выпаривали, а остаток очищали при помощи хроматографии (гептан/EtOAc) с получением указанного в заголовке соединения, 450 мг (92%), в виде желтого масла.
1H ЯМР (CDCl3): δ 7.70 (1Н, d); 7.58 (1H, d); 7.29 (1H, t); 4.49 (2H, s); 3.43 (3Н, s); 2.42 (3Н, s).
Изобутил-2-метил-3-нитробензиловый эфир
Использовали ту же процедуру, что и для метил-2-метил-3-нитробензилового эфира, с получением указанного в заголовке соединения, 486 мг, (81%), в виде желтого масла.
1H ЯМР (CDCl3): δ 7.71 (1H, d); 7.58 (1H, d); 7.29 (1H, t); 4.52 (2H, s); 3.27 (2H, d); 2.42 (3Н, s); 1.91 (1H, m); 0.93 (6H, d).
3-(Метоксиметил)-2-метиланилин
Смесь метил-2-метил-3-нитробензилового эфира (0,19 г, 1,05 ммоль) и 5% Pd/C (70 мг) в смеси EtOAc/EtOH 1:1 (14 мл) гидрировали при давлении 1 атм (1,01×105 Па) в течение ночи. Смесь фильтровали через целит и фильтрат концентрировали с получением указанного в заголовке соединения, 125 мг (78%), в виде желтого масла.
1H ЯМР (CDCl3): δ 6.99 (1H, t); 6.75 (1H, d); 6.66 (1H, d); 4.42 (2H, s); 3.60 (2H, br s); 3.37 (3Н, s); 2.12 (3Н, s).
3-(Изобутоксиметил)-2-метиланилин
Указанное в заголовке соединение получали при помощи той же процедуры, что и 3-(метоксиметил)-2-метиланилин.
1H ЯМР (CDCl3): δ 6.99 (1H, t); 6.76 (1H, d); 6.65 (1H, d); 4.46 (2H, s); 3.60 (2H, br s); 3.21 (2H, d); 2.13 (3Н, s); 1.89 (1H, m); 0.91 (6H, d).
2-(3-Амино-2-метилфенил)ацетонитрил
2-(2-Метил-3-нитрофенил)ацетонитрил (Askam, V. et al. J. Chem. Soc. С (1969) 1935-1936) гидрировали над 5% палладием на угле, 50 мг в смеси ЕЮАс/ЕЮН 1:1 (14 мл) в течение трех часов. Смесь фильтровали через целит и фильтрат концентрировали с получением указанного в заголовке соединения, 77 мг (77%) в виде белого порошка.
1H ЯМР (CDCl3): δ 7.03 (1Н, t); 6.78 (1Н, d); 6.68 (1Н, d); 3.66 (2H, br s); 3.63 (2H, s); 2.22 (3Н, s).
N-(2-метил-3-нитробензил)-1-этанамин
Смесь 2-метил-З-нитробензилхлорида (0,50 г, 2,7 ммоль) и этиламина (2,76 г, 61,2 ммоль) в смеси THF (10 мл)/МеОН (5 мл) перемешивали при температуре окружающей среды в течение 48 часов. Количество растворителя уменьшали и остаток растворяли в смеси EtOAc/водный К2СО3 раствор. Водную фазу экстрагировали EtOAc (×2). Объединенные органические слои промывали рассолом, сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения 0,46 г (86%) в виде желтого масла.
1H ЯМР (CDCl3): δ 7.65 (1Н, d); 7.55 (1Н, d); 7.27 (1Н, d); 3.83 (2H, s); 2.72 (2H, q); 2.45 (3Н, s); 1.15 (3H, t).
3-[(Этиламино)метил]-2-метиланилин
N-(2-метил-3-нитробензил)-1-этанамин (0,46 г, 2,3 ммоль) гидрировали над 5% палладием на угле, 80 мг в смеси EtOAc/EtOH 1:1 (14 мл) в течение четырех часов. Смесь фильтровали через целит, а фильтрат концентрировали с получением указанного в заголовке соединения, 0,373 г (97%), в виде бледно-желтого масла.
1H ЯМР (CDCl3): δ 6.98 (1Н, t); 6.74 (1Н, d); 6,62 (1Н, d); 3.74 (2H, s); 3.60 (2H, br s); 2.71 (2H, q); 2.14 (3Н, s); 1.13 (3Н, t).
трет-Бутил-3-амино-2-метилбензил(этил)карбамат
К раствору 3-[(этиламино)метил]-2-метиланилина (0,32 г, 1,95 ммоль) в THF (20 мл) добавляли ди-трет-бутилдикарбонат, 0,43 г (1,97 ммоль). После 16 часов перемешивания при температуре окружающей среды растворитель выпаривали, а остаток очищали при помощи хроматографии с получением указанного в заголовке соединения, 0,51 г (99%), в виде бесцветного масла.
1H ЯМР (CDCl3): δ 6.97 (1H, s); 6.61 (2H, m); 4.42 (2H, br s); 3.60 (2H, br s); 3.12 (2H, br d); 2.08 (3Н, s); 1.45 (9H, br s); 0.98 (3Н, br s).
трет-Бутил-2-аминобензилкарбамат
К охлажденному на льду раствору 2-амино-бензиламина (1,2 г, 10 ммоль) в THF (70 мл) добавляли ди-трет-бутилдикарбонат (2,15 г, 9,9 ммоль). После 18 часов перемешивания при температуре окружающей среды количество растворителя уменьшали, а осадок собирали фильтрацией, промывали холодным диэтиловым эфиром (×2), гептаном (х2) и сушили с получением указанного в заголовке соединения, 1,9 г (85%), в виде бледно-желтого порошка.
1H ЯМР (CDCl3): δ 7.09 (1Н, т); 7.02 (1Н, т); 6.66 (1Н, т); 4.76 (1Н, br s); 4.25 (2Н, d); 4.21 (2Н, br s); 1.43 (9H, s).
2-(3-Амино-2-метилфенил)-N-этилацетамид
Смесь 2-(3-амино-2-метилфенил)уксусной кислоты (0,32 г, 1,78 ммоль) и тионилхлорида (2 мл) кипятили с обратным холодильником в течение 1,5 часов. После охлаждения избыток тионилхлорида удаляли выпариванием. Последние следы тионилхлорида удаляли путем азеотропной перегонки с толуолом.
Остаток растворяли в сухом EtOAc (2 мл) и охлаждали в бане со льдом. Добавляли этиламин (2 мл), реакция протекала в течение ночи при температуре окружающей среды. Органический слой промывали водой, рассолом, сушили над Na2SO4 и выпаривали с получением белого порошка, который гидрировали на 5% палладии на угле (70 мг) в смеси EtOAc/EtOH 1:1 (25 мл) в течение трех часов. Смесь фильтровали через целит, а фильтрат концентрировали с получением масла, которое затем очищали при помощи хроматографии на диоксиде кремния, (CH2Cl2/MeOH), с получением 0,266 г (78%) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (CDCl3): δ 6.99 (1Н, t); 6.65 (1Н, d); 6.61 (1Н, d); 5.32 (1Н, br s); 3.66 (2Н, br s); 3.55 (2Н, s); 3.20 (2Н, m); 2.41 (3H, s); 1.05 (3Н, t).
2-(3-Амино-2-метилфенил)-N-(2-гидроксиэтил)ацетамид
Смесь 2-(3-амино-2-метилфенил)уксусной кислоты (0,33 г, 1,84 ммоль) и тионилхлорида (2 мл) кипятили с обратным холодильником в течение 1,5 часов. После охлаждения избыток тионилхлорида удалили выпариванием. Последние следы тионилхлорида удаляли путем азеотропной перегонки с толуолом.
Остаток растворяли в сухом EtOAc (2 мл) и охлаждали в бане со льдом. Добавляли 2-аминоэтанол (2 мл), реакция протекала в течение ночи при температуре окружающей среды. Органический слой разбавляли EtOAc (15 мл), промывали водой, рассолом, сушили над Na3SO4 и выпаривали с получением белого порошка, который гидрировали на 5% палладии на угле (70 мг) в этаноле (20 мл) в течение ночи. Смесь фильтровали через целит, а фильтрат концентрировали с получением 0,28 г (73%) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (DMSO-d6): δ 7.69 (1Н, m); 6.77 (1H, t); 6.49 (1H, d); 6.39 (1H, d); 4.70 (2H, br s); 4.62 (1H, t); 3.36 (2H, q); 3.34 (3H, s); 3.09 (2H, q); 1.93 (3H, s).
APCI-MS m/z: 209,2 [MH+]
3-(Аминометил)-2-метиланилин
Смесь 2-метил-3-нитробензилхлорида (0,70 г, 3,77 ммоль), азида натрия (1 г, 15,4 ммоль), этанола (10 мл) и воды (2 мл) нагревали при 45°С в течение ночи. Смесь фильтровали, фильтрат концентрировали и остаток очищали при помощи хроматографии на диоксиде кремния (гептан/EtOAc) с получением соединения, 2-метил-3-нитробензилазида, 0,35 г, которое гидрировали над 5% палладием на угле, 80 мг, в смеси EtOAc/EtOH 1:1 (14 мл) в течение ночи. Смесь фильтровали через целит, фильтрат концентрировали с получением 0,23 г (45%) указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (DMSO-d6): δ 6.79 (1H, t); 6.52 (2H, t); 4.67 (2H, br s); 3.59 (2H, s); 1.96 (3H, s).
трет-Бутил-3-амино-2-метилбензилкарбамат
К раствору 3-[(этиламино)метил]-2-метиланилина (0,21 г, 1,54 ммоль) в THF (20 мл) добавляли ди-трет-бутилдикарбонат (0,35 г, 1,97 ммоль). После 18 часов перемешивания при температуре окружающей среды растворитель выпаривали, а остаток очищали при помощи хроматографии на диоксиде кремния (CH2Cl2/MeOH) с получением 0,51 г (99%) указанного в заголовке соединения в виде бесцветного масла.
1H ЯМР (CDCl3): δ 6.99 (1H, t); 6.69 (1H, d); 6.64 (1H, d); 4.63 (1H, br s); 4.29 (2H, d); 3.63 (2H, br s); 2.10 (3H, s); 1.45 (9H, s).
3-(2-Нитрофенил)пропановая кислота
Указанное в заголовке соединение получали при помощи модифицированного способа, изложенного Grob et al. Helv. Chim. Acta 206 (1961) 1736-1747.
Гидрид натрия (60% в парафиновом масле, 1,0 г, 25 ммоль) добавляли к раствору диэтилмалоната (3,2 г, 20 ммоль) в DMF (20 мл), смесь перемешивали в течение 3 минут. Затем порциями добавляли 1-бромометил-2-нитробензол (4,3 г, 20 ммоль) в течение 5 минут. Реакционную смесь перемешивали в течение 3 часов, разбавляли водой и экстрагировали дважды этилацетатом. Объединенные органические фазы промывали водой и выпаривали. Остаток суспендировали в уксусной кислоте (40 мл) и добавляли 7,5 М HCl (10 мл). Смесь кипятили с обратным холодильником в течение 19 часов, охлаждали и разделяли между диэтиловым эфиром и насыщенным водным NaHCO3. Органическую фазу промывали насыщенным водным NaHCO3 и затем подкисляли 2 М HCl. Осадок собирали фильтрацией и сушили с получением указанного в заголовке соединения (2,22 г, 77%).
1H ЯМР (CDCl3): δ 7.97 (1H, dd, J 8,1 и 1,3 Гц); 7.57 (1Н, dt, J 7,5 и 1,3 Гц); 7.47-7.37 (2Н, m); 3.24 (2Н, t, J 7,6 Гц); и 2.81 (2Н, t, J 7,6 Гц).
4-Нитро-1-инданон
Указанное в заголовке соединение получали по существу так, как описано Grob et al. Helv. Chim. Acta 206 (1961) 1736-1747.
3-(2-Нитрофенил)пропановую кислоту (2,17 г, 11,1 ммоль) в тионилхлориде (30 мл) нагревали при температуре дефлегмации в течение 1,5 часов и реакционную смесь затем выпаривали. Остаток растворяли в дисульфиде углерода (15 мл, дистиллированный над AlCl3) и при перемешивании добавляли AlCl3 (3,2 г, 24 ммоль). Смесь нагревали при температуре дефлегмации в течение 4 часов и растворитель затем выпаривали, используя поток азота, при температуре окружающей среды. К остатку при перемешивании добавляли смесь концентрированной H2SO4 (5,3 мл) и льда (33 г), затем толуол (25 мл). Смесь перемешивали до тех пор, пока все твердое вещество не растворилось, и затем отделяли органическую фазу. Водную фазу экстрагировали дважды диэтиловым эфиром и объединенные органические фазы промывали последовательно насыщенным NaHCO3, водой и рассолом и окончательно сушили над MgSO4, фильтровали и выпаривали. Остаток хроматографировали на колонке диоксида кремния (2×18 см), используя смесь этила цетат-гептан (1:3) в качестве элюента, с получением указанного в заголовке соединения (0,8 г, 40%).
1H ЯМР (CDCl3): δ 8.49 (1Н, dd, J 8,0 и 1,1 Гц); 8.10 (1Н, d, J 7,5 Гц, дополнительно сдвоенный); 7.63 (1Н, t, J 7,8 Гц, дополнительно сдвоенный); 3.67 (2Н, m) и 2.82 (2Н, m).
4-Амино-1-инданон
4-Нитро-1-инданон (0,84 г, 4,75 ммоль) суспендировали в водной соляной кислоте (9 М, 40 мл) и добавляли хлорид двухвалентного олова (3 г, 15,8 ммоль). Смесь перемешивали при температуре окружающей среды. Через 2 часа получали прозрачный раствор. Перемешивание продолжали в течение 23 часов, после чего образовывался желтый осадок. Реакционную смесь разбавляли водой и промывали дважды метиленхлоридом. Водную фазу подщелачивали 2 М водным NaOH и экстрагировали четыре раза метиленхлоридом. Объединенные органические фазы промывали водой, сушили (Na2SO4), фильтровали, упаривали и окончательно сушили с получением указанного в заголовке соединения (630 мг, 90%).
1H ЯМР (CDCl3): δ 7.28-7.18 (2Н, m); 6.93 (1H, d, J 7,0 Гц); 2.92 (2Н, t, J 5,6 Гц, дополнительно сдвоенный) и 2.71 (2Н, t, J 5,5 Гц, дополнительно сдвоенный).
2-Бромо-3-аминобензиловый спирт
Соединение описано в (Cladingboel, David E. et al. J. Chem. Soc. Chem. Commun.; EN; 21; 1990; 1543-1544.)
Метил-3-нитро-2-винилбензоат
Соединение описано в (Söderberg, Björn С. et al. J. Org. Chem. 1997; 62; 5838-5845).
Метил-3-амино-2-этилбензоат
Смесь метил-З-нитро-2-винилбензоата (1,1 г, 5,31 ммоль), и 5% Pd/C (100 мг) в смеси EtOAc/EtOH 1:1 (50 мл) гидрировали при давлении 3 атмосферы (3,03×105 Па) в течение ночи. Смесь фильтровали через целит и фильтрат концентрировали с получением указанного в заголовке соединения, 0,93 г ( 97%). в виде бесцветного масла.
1H ЯМР (CDCl3): δ 7.20 (1Н, q); 7.05 (1H, t,); 6.82 (1H, q,); 3.88 (3H, s); 3.75 (2Н, br s); 2.78 (2Н, q); 1.24 (3H, t).
(3-Амино-2-этилфенил)метанол
К раствору метил-3-амино-2-этилбензоата (0,83 г, 4,63 ммоль) в THF (40 мл) добавляли алюмогидрид лития (0,9 г, 23,7 ммоль). Смесь нагревали при 50°С в течение 5 часов, охлаждали до 0°С и осторожно гидролизовали водой. Взвесь экстрагировали EtOAc (×5). Экстракты промывали рассолом, сушили Na2SO4 и упаривали. Остаток очищали хроматографией (СН2Cl2/МеОН) с получением указанного в заголовке соединения, 0,63 г (89%). в виде белого порошка.
1H ЯМР (CDCl3): δ 7.05 (1H, t); 6.82 (1H, d); 6.70 (1H, d); 4.68 (2H, d); 3.71 (2H, br s); 2.68 (2H, q); 1.47 (1H, t); 1.23 (3H, t).
Фармакологические данные
JAK3 HTRF (homogenous time released fluorescence, гомогенная флюоресценция с разрешением во времени) анализ
В анализе JAK3 киназ использовали слитый белок (JAK3 киназный домен, слитый с глутатион-3-трансферазой, GST), совместно экспрессируемый в Е. coli с GroEL/S, и очищенный аффинной хроматографией на глутатион-сефарозе. Фермент разводили в смеси 10 мМ трис-HCl, 150 мМ NaCl, 5% маннита, 2 мМ 2-меркаптоэтанола и 30% глицерина. Субстратом в киназной реакции является биотинилированный пептид сайта аутофосфорилирования JAK3 (биотин-LPDKDYYWREPG), используемый в количестве 2 мкМ. Условия анализа следующие: JAK3, соединение и субстрат инкубируют в смеси 25 мМ трис-основания, 5 мМ MgCl2, 5 мМ MnCl2, 0,05% ТритонХ-100 и 2 мкМ АТФ (аденозинтрифосфат) в течение 45 мин при комнатной температуре. Реакционный объем составлял 20 мкМ. Останавливающий раствор добавляют до конечной концентрации EDTA (этилендиаминтетрауксусной кислоты) 100 мкМ. В заключение добавляют 0,065 мг/мл РТ66-К и 10,42 мкМ SA-XL665 в 50 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), 0,5 М KF и 0,1% BSA (бычий сывороточный альбумин). Планшет считывают в Discovery приборе после 60 минут инкубирования.
Соединения из примеров имеют значения IC50 менее 25 мкМ.
Соединения по изобретению могут быть представлены, например, в виде следующих препаратов.
1. Растворы для внутривенного введения
Активное соединение растворяют в полиэтиленгликоле 400 и добавляют 550 мл воды. рН раствора доводят приблизительно до 7 путем добавления водного раствора динатрия гидрокарбоната, а затем добавляют воду до конечного объема 1000 мл. Раствор фильтруют через фильтр 22 мкм и немедленно разливают в стерильные ампулы на 10 мл, которые герметично запаивают.
2. Таблетки для перорального введения, г:
Активное соединение, алюмосиликат натрия, парафин и микрокристаллическую целлюлозу смешивают и добавляют водный раствор гидроксипропилцеллюлозы. Полученную смесь высушивают и размалывают с получением гранул, которые затем смешивают со стеарилфумаратом натрия. Готовую смесь прессуют в таблетки в таблеточной машине с получением 1000 таблеток, каждая из которых содержит 150 мг активного соединения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ Axl | 2011 |
|
RU2573834C2 |
| 6-СУЛЬФАМОИЛХИНОЛИН-4-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ПРОИЗВОДНЫЕ И КОМБИНАТОРНАЯ БИБЛИОТЕКА | 2003 |
|
RU2229475C1 |
| ПРОИЗВОДНОЕ АЦИЛТИОМОЧЕВИНЫ ИЛИ ЕГО СОЛЬ, И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2503664C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ | 1997 |
|
RU2196137C2 |
| ПРОИЗВОДНЫЕ 3-КАРБОКСИ-4-АМИНОХИНОЛИНА, ПОЛЕЗНЫЕ КАК МОДИФИКАТОРЫ СЛАДКОГО ВКУСА | 2011 |
|
RU2605549C2 |
| ХИНОЛИНИЛ-СОДЕРЖАЩЕЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2803116C2 |
| ПРОИЗВОДНЫЕ ХРОМОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2545214C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ФЕНИЛУКСУСНОЙ КИСЛОТЫ | 2000 |
|
RU2273628C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА, ДЕМОНСТРИРУЮЩИЕ ЗАЩИТНОЕ ОТ ВИЧ-ИНФЕКЦИИ ДЕЙСТВИЕ | 2005 |
|
RU2350604C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКИХ АМИНОВ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ЕР4 | 2011 |
|
RU2565596C2 |
Настоящее изобретение относится к новым соединениям, которые являются ингибиторами JAK3 киназы, способам их получения, промежуточным соединениям и фармацевтическим композициям, содержащим их. Описываются ароматические производные 6,7-дизамещенных 3-хинолинкарбоксамидов формулы (I) и их фармацевтически приемлемые соли для применения в изготовлении лекарства для лечения заболевания, опосредованного JAK3:
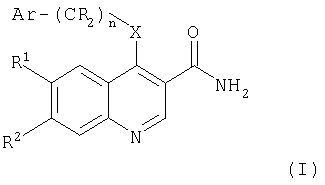
где: n равно 0 или 1; Х представляет собой NR3 или О; Ar выбирают из фенила, тетрагидронафтенила, индолила, пиразолила, дигидроинденила, 1-оксо-2,3-дигидроинденила или индазолила, каждый из которых может быть, возможно, замещен одной или более чем одной группой, выбранной из галогена, гидрокси, циано, C1-C8алкокси, CO2R8, CONR9R10, C1-C8алкил-О-С1-С8алкила, C1-C8алкил-NR8-C1-C8алкила, C1-C8алкил-CONR9R10, NR8COC1-C8алкила, C1-C8алкилтио или C1-C8алкила (возможно замещенного одной или более чем одной гидрокси или цианогруппой или атомами фтора); R группы являются независимо водородом или C1-C8алкилом; R1 и R2 независимо выбраны из водорода, галогена, нитро, циано, C1-C8алкила, C1-C8алкокси, гидрокси, фенила, Y(CR11 2)pNR4R5, Y(CR11 2)pCONR4R5, Y(CR11 2)pCO2R6, Y(CR11 2)pOR6, Y(CR11 2)pR6; или R1 и R2 соединены вместе как -ОСН2O- или -ОСН2СН2O-; R11 группы представляют собой независимо водород, C1-C8алкил, гидрокси или галоген; р равно 0, 1, 2, 3, 4 или 5; Y представляет собой кислород, СН2 или NR7; R3 представляет собой водород или C1-C8алкил; R4 и R5 каждый независимо представляют собой водород, C1-C8алкил, или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют 4-7-членную насыщенную или ароматическую гетероциклическую кольцевую систему, возможно, содержащую дополнительные кислород, серу или группу NR6, или один из R4 и R5 является водородом или C1-C8алкилом, а другой представляет собой 5- или 6-членную гетероциклическую кольцевую систему, возможно, содержащую дополнительный атом кислорода, серы или азота; R6 представляет собой водород, C1-C8алкил, фенил или бензил; R7 представляет собой водород или C1-C8алкил; R8 представляет собой водород или C1-C8алкил; R9 и R10 каждый независимо представляют собой водород или C1-C8алкил, при условии, что это соединение не является 4-[(3-бромфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-[(2,4-дихлорфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-(2-бромоанилино)-6,7-диметокси-3-хинолинкарбоксамидом и 4-(1,5-дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамидом. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 6 н. и 11 з.п. ф-лы.
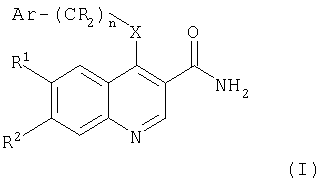
где n равно 0 или 1;
Х представляет собой NR3 или О;
Ar выбирают из фенила, тетрагидронафтенила, индолила, пиразолила, дигидроинденила, 1-оксо-2,3-дигидроинденила или индазолила, каждый из которых может быть возможно замещен одной или более чем одной группой, выбранной из галогена, гидрокси, циано, C1-C8алкокси, CO2R8, CONR9R10, C1-C8алкил-О-C1-C8алкила, C1-C8алкил-NR8-C1-C8алкила, C1-C8алкил-CONR9R10, NR8COC1-C8алкила, C1-C8алкилтио или C1-C8алкила (возможно замещенного одной или более чем одной гидрокси или цианогруппой или атомами фтора);
R группы являются независимо водородом или C1-C8алкилом;
R1 и R2 независимо выбраны из водорода, галогена, нитро, циано, C1-C8алкила, C1-C8алкокси, гидрокси, фенила, Y(CR11 2)pNR4R5, Y(CR11 2)pCONR4R5, Y(CR11 2)pCO2R6, Y(CR11 2)pOR6, Y(CR11 2)pR6;
или R1 и R2 соединены вместе как -ОСН2O- или -ОСН2СН2O-;
R11 группы представляют собой независимо водород, C1-C8алкил, гидрокси или галоген;
р равно 0, 1, 2, 3, 4 или 5;
Y представляет собой кислород, СН2 или NR7;
R3 представляет собой водород или C1-C8алкил;
R4 и R5 каждый независимо представляют собой водород, C1-C8алкил, или R4 и R5 вместе с атомом азота, к которому они присоединены, образуют 4-7-членную насыщенную или ароматическую гетероциклическую кольцевую систему, возможно содержащую дополнительные кислород, серу или группу NR6, или один из R4 и R5 является водородом или C1-C8алкилом, а другой представляет собой 5- или 6-членную гетероциклическую кольцевую систему, возможно содержащую дополнительный атом кислорода, серы или азота;
R6 представляет собой водород, C1-C8алкил, фенил или бензил;
R7 представляет собой водород или C1-C8алкил;
R8 представляет собой водород или C1-C8алкил;
R9 и R10 каждый независимо представляют собой водород или C1-C8алкил, при условии, что это соединение не является 4-[(3-бромфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-[(2,4-дихлорфенил)амино]-6,7-диметокси-3-хинолинкарбоксамидом, 4-(2-бромоанилино)-6,7-диметокси-3-хинолинкарбоксамидом и 4-(1,5-дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамидом.
6-бензилокси-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-гидрокси-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-(2-метоксиэтокси)-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-октилокси-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-[2-(4-морфолинил)этокси]-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пиперидинил)этокси]-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-7-метокси-6-[2-(1-пирролидинил)этокси]-3-хинолинкарбоксамид;
6-[2-(диметиламино)этокси]-4-(3-(гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-[2-(диметиламино)-2-оксоэтокси]-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
6-(2-амино-2-оксоэтокси)-4-(3-гидроксиметил-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
6-метокси-4-[2-(метилсульфанил)анилино]-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
4-(1Н-индол-4-иламино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамид;
метил-4-{[3-(аминокарбонил)-6-метокси-4-(2-толуидино)-7-хинолинил]окси}бутаноат;
4-(2-этиланилино)-7-(3-гидроксипропокси)-6-метокси-3-хинолинкарбоксамид;
6-метокси-7-[2-(4-морфолинил)этокси]-4-(2-толуидино)-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-[4-(4-морфолинил)бутокси]-3-хинолинкарбоксамид;
7-(3-хлоропропокси)-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
7-{3-[(цис)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
7-{3-[(транс)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(1-пиперидинил)пропокси]-3-хинолинкарбоксамид;
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-тиоморфолинил)пропокси]-3-хинолинкарбоксамид;
6-[3-(диметиламино)пропокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-[3-(1Н-имидазол-1-ил)пропокси]-7-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-7-метокси-6-(3-тиенилметокси)-3-хинолинкарбоксамид;
6-[2-(диметиламино)этокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
6-(3-аминопропокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-7-метокси-6-[2-(метиламино)этокси]-3-хинолинкарбоксамид;
6-(2-аминоэтокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
7-[3-(диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-{3-[метил(4-пиридинил)амино]пропокси}-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-{2-[метил(4-пиридинил)амино]этокси}-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-[2-(метиламино)этокси]-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-7-[2-(1-пиперазинил)этокси]-3-хинолинкарбоксамид;
4-(2-этиланилино)-7-[3-(1Н-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-7-[2-(1Н-имидазол-1-ил)этокси]-6-метокси-3-хинолинкарбоксамид;
7-(3-аминопропокси)-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид;
7-гидрокси-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамид;
6-{[3-(1H-имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-метокси-6-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид;
7-метокси-6-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
7-метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
6-метокси-7-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
6-метокси-7-[(2-метоксиэтил)амино]-4-(2-толуидино)-3-хинолинкарбоксамид;
7-{[3-(1H-имидазол-1-ил)пропил]амино}-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-[(1-бензил-4-пиперидинил)амино}-6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6-метокси-6-{[3-(4-морфолинил)пропил]амино}-4-(2-толуидино)-3-хинолинкарбоксамид;
4-[3-(гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(4-фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[(1-этил-1H-пиразол-5-ил)амино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-аминокарбонил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2,3-диметиланилино)-3-хинолинкарбоксамид;
6,7-диметокси-4-(5,6,7,8-тетрагидро-1-нафталиниламино)-3-хинолинкарбоксамид;
4-(4-карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-индол-4-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(аминокарбонил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-гидрокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(3-метокси-2-метиланилино)-3-хинолинкарбоксамид;
6,7-диметокси-4-[(1-метил-1Н-индол-4-ил)амино]-3-хинолинкарбоксамид;
6,7-диметокси-4-[(1-оксо-2,3-дигидро-1Н-инден-4-ил)амино]-3-хинолинкарбоксамид;
4-(1-гидрокси-2,3-дигидро-1Н-инден-4-ил)амино-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-карбокси-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(4-метоксикарбонил-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-гидроксиметил-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2-пропиланилино)-3-хинолинкарбоксамид;
4-(2-изопропиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(втор-бутил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-[3-(метоксиметил)-2-метиланилино]-3-хинолинкарбоксамид;
4-[3-(изо-бутоксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(цианометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-{3-[(этиламино)метил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид;
4-{3-[2-(этиламино)-2-оксоэтил]-2-метиланилино}-6,7-диметокси-3-хинолинкарбоксамид;
этил-2-(3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилфенил)ацетат;
4-[3-(2-амино-2-оксоэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(2-гидроксиэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-{2-[(2-гидроксиэтил)амино]-2-оксоэтил}-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
трет-бутил-3-{[3-(аминокарбонил)-6,7-диметокси-4-хинолинил]амино}-2-метилбензилкарбамат;
4-[3-(аминометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-фторо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(4-бромо-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(4-хлоро-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2,4-диметиланилино)-6-метокси-3-хинолинкарбоксамид;
6-метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-гидрокси-2-метиланилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-бромоанилино)-6-метокси-3-хинолинкарбоксамид;
4-(2,4-диметоксианилино)-6-метокси-3-хинолинкарбоксамид;
6-метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(2-этоксианилино)-6-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамид;
6-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6-метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(4-бромо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(2-бромо-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-бромо-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-диметоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-фторо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(4-бромо-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(4-хлоро-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2,4-диметиланилино)-7-метокси-3-хинолинкарбоксамид;
7-метокси-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
4-(4-гидрокси-2-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-бромоанилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-бромо-4-метиланилино)-7-метокси-3-хинолинкарбоксамид;
4-(2-бромо-4-фтороанилино)-7-метокси-3-хинолинкарбоксамид;
4-(2,4-диметоксианилино)-7-метокси-3-хинолинкарбоксамид;
6,7-дихлоро-4-(4-метокси-2-метиланилино)-3-хинолинкарбоксамид;
6,7-дихлоро-4-(2,4-диметоксианилино)-3-хинолинкарбоксамид;
4-(2-этиланилино)-3-хинолинкарбоксамид;
4-(2-толуидино)-3-хинолинкарбоксамид;
4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2-этоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(гидроксиметил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2-толуидино)-3-хинолинкарбоксамид;
6,7-диметокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2,4-дибромоанилино)-6,7-диметокси-3-хинолинкарбоксамид;
7-метокси-4-(2-метоксианилино)-3-хинолинкарбоксамид;
4-(2-этоксианилино)-7-метокси-3-хинолинкарбоксамид;
4-[2-(аминокарбонил)анилино]-7-метокси-3-хинолинкарбоксамид;
4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамид;
7-метокси-4-(2-толуидино)-3-хинолинкарбоксамид;
7-метокси-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
6,7-дихлоро-4-(2-метоксианилино)-3-хинолинкарбоксамид;
6,7-дихлоро-4-(2-этиланилино)-3-хинолинкарбоксамид;
6,7-дихлоро-4-[2-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-(2,5-диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(5-фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(5-хлоро-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-фторо-2-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-гидрокси-2,5-диметиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-анилино-6,7-диметокси-3-хинолинкарбоксамид;
4-(4-хлоро-2-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,6-дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(4-метоксианилино)-3-хинолинкарбоксамид;
4-(3-хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-хлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[3-(ацетиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,5-дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-индол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1Н-индазол-5-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(1H-индазол-6-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,4-дифтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,5-дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(2-гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-[3-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
6,7-диметокси-4-(2-метокси-5-метиланилино)-3-хинолинкарбоксамид;
4-[4-(диметиламино)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-[4-(метилсульфанил)анилино]-3-хинолинкарбоксамид;
4-[4-(2-гидроксиэтил)анилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(3-гидрокси-4-метоксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2,3-дихлороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-(2,3,4-трифтороанилино)-3-хинолинкарбоксамид;
6,7-диметокси-4-(3-толуидино)-3-хинолинкарбоксамид;
4-(2-гидрокси-4-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-4-гидроксианилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[2-(гидроксиметил)-4-метиланилино]-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-хлоро-4-фтороанилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-(2-фторо-5-метиланилино)-6,7-диметокси-3-хинолинкарбоксамид;
4-[(2-цианофенил)амино]-6,7-диметоксихинолин-3-карбоксамид;
4-[(2,5-дифторофенил)амино]-6,7-диметоксихинолин-3-карбоксамид;
4-(1H-индол-5-иламино)-6,7-диметоксихинолин-3-карбоксамид;
6,7-дихлоро-4-(2-метиланилино)-3-хинолинкарбоксамид;
4-(2,3-дигидро-1Н-инден-1-иламино)-6,7-диметокси-3-хинолинкарбоксамид;
6,7-диметокси-4-{[2-(трифторометил)бензил]амино}-3-хинолинкарбоксамид;
6,7-диметокси-4-[(1-фенилэтил)амино]-3-хинолинкарбоксамид;
4-(3-гидроксиметил-2-метиланилино)-3-хинолинкарбоксамид;
9-(3-гидроксиметил-2-метиланилино)-2,3-дигидро[1,4]диоксино[2,3g]хинолин-8-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[2-(пропиламино)этокси]хинолин-3-карбоксамид;
6-[2-(этиламино)этокси]-4-[(2-этилфенил)амино]-7-метоксихинолин-3-карбоксамид;
6-[2-(изопропиламино)этокси]-7-метокси-4-[(3-метокси-2-метилфенил)амино]хинолин-3-карбоксамид;
6-[2-(диметиламино)этокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-7-метоксихинолин-3-карбоксамид;
6-[3-(диэтиламино)пропокси]-4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-метоксихинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-7-метокси-6-[2-(метиламино)этокси]хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-4-иламино)пропокси]хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[3-[(2-амино-2-оксоэтил)амино]пропокси]-хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[3-(1H-пиразол-3-иламино)пропокси]хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-2-иламино)пропокси]хинолин-3-карбоксамид;
этил-4-[(3-(аминокарбонил)-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-7-ил)окси]бутаноат;
7-[3-(диэтиламино)пропокси]-6-метокси-4-[(2-метоксифенил)амино]хинолин-3-карбоксамид;
7-[3-(этиламино)пропокси]-6-метокси-4-{[2-(трифторметил)фенил]амино}хинолин-3-карбоксамид;
7-[3-(этиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-7-[3-(изопропиламино)пропокси]-6-метоксихинолин-3-карбоксамид;
7-[3-(этиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(пропиламино)пропокси]хинолин-3-карбоксамид;
7-[3-(диметиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(диэтиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(диметиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
7-[3-(диэтиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
4-[(2-этилфенил)амино]-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбоксамид;
4-{[3-(гидроксиметил)-2-метилфенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
7-[3-(1,1-диоксидотиоморфолин-4-ил)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамид;
4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-[3-(3-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(1H-1,2,4-триазол-1-ил)пропокси]хинолин-3-карбоксамид;
7-(3-азепан-1-илпропокси)-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамид;
6,7-диметокси-4-{[2-(метилтио)фенил]амино}хинолин-3-карбоксамидатрифторацетат;
6,7-диметокси-4-[(4-метокси-2-метилфенил)амино]хинолин-3-карбоксамид;
4-{[2-бромо-3-(гидроксиметил)фенил]амино}-6,7-диметоксихинолин-3-карбоксамид;
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6,7-диметоксихинолин-3-карбоксамид;
или его фармацевтически приемлемая соль.
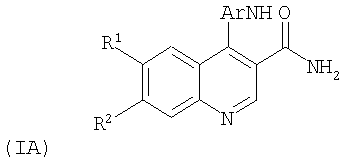
где Ar представляет собой фенил, замещенный этилом, пропилом, гидроксиметилом или СО2Н или дизамещенный метилом и гидроксиметилом;
R1 представляет собой метокси, этокси или группу OCH2CONH2, ОСН2CH2ОСН3 или O(CH2)pNR4R5, где р равно 2 или 3, а R4 и R5 представляют собой водород, метил, этил или пропил, или R4 и R5 совместно образуют пирролидиновое, имидазольное или морфолиновое кольцо;
R2 представляет собой метокси, этокси или O(CH2)pNR4R5, где р равно 2, 3 или 4, а R4 и R5 представляют собой водород, метил или этил, или один из R4 или R5 является метилом, а другой является пиридилом или пиразолом, или R4 и R5 образуют пиперидиновое, гидроксипиперидиновое, тиоморфолиновое, морфолиновое, пирролидиновое, 2,6-диметилморфолиновое, имидазольное или триазольное кольцо;
или их фармацевтически приемлемая соль или сольват,
при условии, что когда А представляет собой фенил, замещенный этилом или пропилом или дизамещенный метилом, то тогда R1 и R2 не являются оба метокси, R1 и R2 не являются оба этокси, или один из R1/R2 не является метокси, когда другой является этокси.
4-(2-этиланилино)-6-метокси-7-{2-[метил(4-пиридинил)амино]этокси}-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-тиоморфолинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(1-пиперидинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
7-[3-(диметиламино)пропокси]-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамида,
7-{3-[(2R,6S)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[4-(4-морфолинил)бутокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-{3-[метил(4-пиридинил)амино]пропокси}-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-метокси-6-[2-(метиламино)этокси]-3-хинолинкарбоксамида,
7-{3-[(2S,6S)-2,6-диметилморфолинил]пропокси}-4-[3-(гидроксиметил)-2-метиланилино]-6-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-[3-(1H-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбоксамида,
6-(2-аминоэтокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[3-(1Н-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-[2-(метиламино)этокси]-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-метокси-7-(2-метоксиэтокси)-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-(3-гидроксипропокси)-6-метокси-3-хинолинкарбоксамида,
6-метокси-7-[2-(4-морфолинил)этокси]-4-(2-толуидино)-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[2-(1-пирролидинил)этокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
4-(2-этиланилино)-7-[2-(1H-имидазол-1-ил)этокси]-6-метокси-3-хинолинкарбоксамида,
4-[3-(2-гидроксиэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
7-метокси-6-{[2-(4-морфолинил)этил]амино}-4-(2-толуидино)-3-хинолинкарбоксамида,
4-(2-этиланилино)-6-[3-(1H-имидазол-1-ил)пропокси]-7-метокси-3-хинолинкарбоксамида,
7-(3-аминопропокси)-4-(2-этиланилино)-6-метокси-3-хинолинкарбоксамида,
метил-4-{[3-(аминокарбонил)-6-метокси-4-(2-толуидино)-7-хинолинил]окси}бутаноата,
4-[3-(аминометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
6-{[3-(1H-имидазол-1-ил)пропил]амино}-7-метокси-4-(2-толуидино)-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-(2-метоксиэтокси)-3-хинолинкарбоксамида,
6-[2-(диметиламино)этокси]-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-[3-(цианометил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
4-[3-(2-амино-2-оксоэтил)-2-метиланилино]-6,7-диметокси-3-хинолинкарбоксамида,
6-(3-аминопропокси)-4-(2-этиланилино)-7-метокси-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[3-(4-морфолинил)пропокси]-3-хинолинкарбоксамида,
4-[3-(гидроксиметил)-2-метиланилино]-7-метокси-6-[2-(4-морфолинил)этокси]-3-хинолинкарбоксамида,
и его фармацевтически приемлемые соли.
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-4-иламино)пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-[(2-амино-2-оксоэтил)амино]пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-(1Н-пиразол-3-иламино)пропокси]хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-метокси-6-[3-(пиридин-2-иламино)пропокси]хинолин-3-карбоксамида,
этил-4-[(3-(аминокарбонил)-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-7-ил)окси]бутаноата,
7-[3-(диэтиламино)пропокси]-6-метокси-4-[(2-метоксифенил)амино]хинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-6-метокси-4-{[2-(трифторметил)фенил]амино}хинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-7-[3-(изопропиламино)пропокси]-6-метоксихинолин-3-карбоксамида,
7-[3-(этиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(пропиламино)пропокси]хинолин-3-карбоксамида,
7-[3-(диметиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
7-[3-(диэтиламино)пропокси]-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамида,
7-[3-(диметиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
7-[3-(диэтиламино)пропокси]-4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метоксихинолин-3-карбоксамида,
7-{3-[(2-этоксиэтил)амино]пропокси}-4-[(2-этилфенил)амино]-6-метоксихинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-пиперидин-1илпропокси)хинолин-3-карбоксамида,
4-[(2-этилфенил)амино]-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбоксамида,
4-{[3-(гидроксиметил)-2-метилфенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пирролидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-(3-пиперидин-1-илпропокси)хинолин-3-карбоксамида,
4-{[3-(гидроксиметил)-2-метилфенил]амино}-7-[3-(3-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбоксамида,
4-{[2-этил-3-(гидроксиметил)фенил]амино}-6-метокси-7-[3-(1H-1,2,4-триазол-1-ил)пропокси]хинолин-3-карбоксамида,
и его фармацевтически приемлемые соли.
соединение формулы (II)
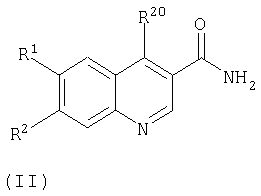
где R1 и R2 такие, как определено в формуле (I), или являются их защищенными производными, а R20 представляет собой уходящую группу, подвергают взаимодействию с соединением формулы (III)
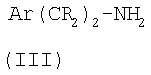
где Ar и R такие, как определено в формуле (I), или являются их защищенными производными,
и возможно затем
удаляют любые защитные группы,
превращают соединение формулы (I) в другое соединение формулы (I),
осуществляют образование фармацевтически приемлемой соли.
для соединений формулы (I), где R1 и/или R2 являются группами Y(CH2)pNR4R5, Y(CH2)pCONR4R5, Y(CH2)pCO2R6, Y(CH2)pOR6 или Y(CH2)pR6, где Y является кислородом, соединение формулы (IV)
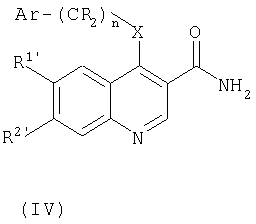
где R1' или R2', подлежащий превращению в группу Y(CH2)pNR4R5, Y(CH2)pCONR4R5, Y(CH2)pCO2R6, Y(CH2)pOR6 или Y(CH2)pR6, представляет собой гидрокси, а другой R1' или R2' и Ar являются такими, как определено в п.16, подвергают взаимодействию с соединением формулы (V)
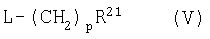
где R21 представляет собой NR4R5, CONR4R5, CO2R6, OR6 или R6, a R4, R5 и R6 такие, как определено в формуле (I), или являются их защищенными производными,
и возможно затем
удаляют любые защитные группы,
превращают соединение формулы (I) в другое соединение формулы (I),
осуществляют образование фармацевтически приемлемой соли.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| DIANE H | |||
| BOSCHELLI, J.Med.Chem., vol.44, no.5, march 2001, p.823 | |||
| ALLAN WISSER, J.Med.Chem., vol.43, no.17, 2000, p.3249 | |||
| WO 00/10981 A1, 02.03.2000 | |||
| Способ получения производных 3-хинолинкарбоновой кислоты или их солей | 1977 |
|
SU867299A3 |
Авторы
Даты
2006-08-20—Публикация
2002-05-06—Подача