Настоящее изобретение относится к новому ферменту, гистидин-протеин-фосфатазе, который получают из млекопитающих, и его гомологическим вариациям. Кроме того, данное изобретение относится к последовательностям ДНК, кодирующим упомянутые протеины, способу получения последних и антителам к ним. Новую фосфатазу можно применять для диагностики патологий клеточной регуляции и роста клеток, а также в качестве фармацевтического препарата, который может применяться при патологических состояниях, связанных с нарушениями функций указанного фермента. Более подробно, настоящее изобретение относится к применению упомянутого фермента в диагностике и лечении заболеваний, применению агонистов и антагонистов при идентификации факторов фосфорилирования гистидина, а также агонистам и антагонистам, которые можно применять в терапии.
Предпосылки создания изобретения
Фосфорилирование протеинов представляет собой важнейший биологический процесс, нередко играющий ключевую роль в трансдукции сигналов и регуляции активности протеинов. Фосфорилирование серина, треонина и тирозина - обычное явление на путях эукариотной трансдукции сигнала. Существует огромное количество литературы, посвященной биохимическим методам выявления фосфорилирования серина, треонина и тирозина неизвестных протеинов. Например, когда выращенные клетки млекопитающих обрабатываются факторами роста, цитокинами, лекарственными веществами, пептидами или другими стимулирующими молекулами, такими как фактор роста, выделенный из тромбоцитов, фактор роста нервов, IL-2 (интерлейцин-2) и т.д., фосфорилирование протеинов в серине, треонине и тирозине можно легко выявить путем культивирования клеток с меченым радиоизотопом фосфатом, выделения протеинов после обработки фактором роста и т.д. и разделения их методом электрофореза в полиакриламидном геле додецилсульфатом натрия, связывания геля и проведения авторадиографии, позволяющей идентифицировать полосы протеинов, содержащие меченый фосфат. В качестве альтернативы протеины из обработанных и необработанных клеток можно разделить с использованием двухмерной системы, сравнивая положения пятен протеинов. Явное перемещение пятна говорит об изменении в модификации, полученной в результате обработки. В еще одном варианте предусматривается проведение кислотного гидролиза протеинов с получением аминокислот, с которыми затем проводят тонкослойную хроматографию и исследуют на наличие меченого радиоизотопом фосфора.
Однако эти методы белковой химии осуществляются в условиях, при которых фосфорилированный гистидин, лизин или аргинин нестабильны. В частности, при низком рН фосфогистидин спонтанно распадается через приблизительно 5-100 минут, тогда как при среднем рН период его полураспада составляет от нескольких дней до нескольких недель (Matthews, Н. R. [1995] Pharmac. Ther. 67:323-350). Например, после проведения электрофореза полиакриламидные гели, используемые для разделения протеинов, связывают в кислотных условиях. К распаду фосфогистидина также приводит использование кислотных условий при гидролизе аминокислоты.
Было установлено, что фосфорилированный гистидин играет ключевую роль в трансдукции сигналов в бактериях. Пути трансдукции регулируют целый ряд процессов бактериального метаболизма. Например, система ArcA/ArcB управляет аэробным и анаэробным метаболизмом в Е. coli (luchi S, Weiner L. J Biochem (Токио) [1996] 120:1055-63). OmpR и OmpF отвечают за реакции на различные осмотические условия (Pratt LA., Hsing W., Gibson K.E, Silhavy T.J. Mol Microbiol [1996] 20:911-7). CheA и CheZ принимают участие в хемотаксисе (Alon U. Nature [1999] 397:168-171). Впервые все эти протеины были идентифицированы генетически: в результате мутаций в соответствующих генах образуются требуемые фенотипы, и после клонирования данных генов проводят идентификацию полученных протеинов.
Также недавно было обнаружено, что эукариоты S. cerevisiae и Arabidopsis thaliana имеют системы трансдукции сигналов с протеинами, в которых происходит фосфорилирование гистидина (Loomis и др., [1997] J. Cell Science 110:1141-1145). Например, протеин Sln1 обладает внеклеточным сенсорным доменом, цитоплазматическим доменом гистидин-киназы и доменом трансляции аспартата. ETR1 вида Arabidopsis thaliana из семейства горчичных был также идентифицирован мутантами, не реагирующими на этилен. Ген ETR1 затем клонировали и проводили исследование протеина, в результате которого было обнаружено, что последний представляет собой гистидин-киназу. S. cerevisiae и Arabidopsis thaliana являются генетически модифицируемыми организмами, и их протеины, принимающие участие в фосфорилировании гистидина, такие как Sln1 и Etr1, как правило, идентифицируют генетически.
Существующие методики включают разделение по размерам либо протеинов, либо фосфоаминокислот.
N-фосфорилирование в клетках млекопитающих является важным процессом в энергетическом обмене и изменяется при развитии различных типов рака. Например, протеин Nm23 представляет собой нуклеозид-дифосфат-киназу, которая может переводить нуклеозид- и деоксинуклеозиддифосфаты в трифосфаты, используя для этого АТФ, образуемый в результате гликолиза и окислительного фосфорилирования. Nm23 фосфорилируется в Гистидине 118 на промежуточной стадии пинг-понгового механизма его реакции. Nm23 также способен передавать свою фосфатную группу гистидиновым остаткам в АТФ-цитрат-лиазе и сукцинил-СоА-синтетазе. Таким образом, фосфорилирование гистидина играет важную роль в энергетическом обмене в клетках.
В организме человека имеется несколько протеинов Nm23. При раковых заболеваниях с высоким метастазом эти протеины Nm23 нередко экспрессируются на низких уровнях. Исходя из этого, полагают, что Nm 23 является антионкогеном. Кроме того, при некоторых раковых заболеваниях в отдельных протеинах Nm23 наблюдаются мутации. В результате этих мутаций нередко изменяется скорость фосфорилирования или дефосфорилирования Nm23.
Если обобщить все вышеуказанное, становится очевидным, что N-фосфорилирование играет важную роль в энергетическом обмене и процессах, происходящих при развитии рака. Таким образом, протеины или лекарства, модулирующие N-фосфорилирование или дефосфорилирование, могут оказаться весьма полезными при лечении рака или расстройств обмена веществ, таких как ожирение, анорексия, изможденность как следствие рака, ВИЧ или другие заболевания и т.д. Кроме того, поскольку N-фосфорилирование играет определенную роль в целом ряде биологических явлений, имеющих место в других организмах, вполне возможно, что оно также так или иначе воздействует на развитие иных болезней и расстройств млекопитающих, таких как иммунные расстройства, вирусные инфекции, генетические расстройства, порок сердца и т.д.
К сожалению, млекопитающие растут намного медленнее бактерий (S. cerevisiae и Arabidopsis thaliana). Таким образом, идентифицировать протеины, принимающие участие в фосфорилировании гистидина, лизина или аргинина, пользуясь при этом теми же генетическими методами, к которым прибегают при работе с более простыми организмами, довольно сложно. К тому же биохимические методики идентификации протеинов, фосфорилируемых в серине, треонине и тирозине, не совсем применимы для идентификации протеинов, которые фосфорилируются в гистидине, лизине и аргинине. Таким образом, в данной области техники имеется потребность в методиках и биохимических реагентах, которые можно было бы применять для изучения процесса N-фосфорилирования.
Гистидин-фосфатазы и гистидин-киназы - это ферменты, действующие в противоположных направлениях. Гистидин-киназа инициирует фосфорилирование определенных гистидиновых остатков в протеинах, тогда как гистидин-фосфатазы обращают этот процесс. Вероятно, оба фермента играют не последнюю роль в трансдукции сигналов, апоптозе, регуляции роста клеток и дифференциации клеток. Известно, что они могут вызывать заболевания, связанные с нарушениями этих клеточных функций. Таким образом, цель настоящего изобретения -это получение агента, который можно было бы применять для исследования причин патофизиологических нарушений и, когда это возможно, устранения последних.
Гормоны или пептиды стимулируют рецепторы, располагающиеся на поверхности клетки, и, задействуя путь трансдукции сигнала, индуцируют явления, имеющие место в клетке. Обратимое фосфорилирование специфических протеиновых подложек регуляторными протеинкиназами и фосфатазами играет существенную роль во внутриклеточной передаче сигнала. Рецепторсвязанные, мембраносвязанные и внутриклеточные протеинкиназы и фосфатазы регулируют процессы пролиферации и дифференциации клеток, а также управляют иммунной системой. Нарушения функций этих регуляторов играет решающую роль в ряде патофизиологических явлений. Таким образом, при разработке лекарства должны решаться задачи получения соединений, действующих подобно протеинкиназам и фосфатазам, а также моделирования пути трансдукции сигнала, в котором они принимают участие.
Трансдукция сигнала в млекопитающих включает обратимое фосфорилирование Ser/Thr/Tyr. Хотя и известно, что гистидинфосфат присутствует в клетках млекопитающих (Crovello C.S., Furie B.C., Furie В. (1995) Cell 82:279-286), до сих пор не удалось идентифицировать ни соответствующие киназы, ни подходящие фосфатазы. Одна из проблем заключается в том, что гистидинфосфат нестабилен при гидролизе и не обнаруживается методом стандартного анализа с использованием фосфоаминокислоты.
Функции His-киназ и His-фосфатаз в бактериях исследованы весьма основательно. Их участие в процессах хемотаксиса и адаптации позволяет говорить о результативном лечении заболеваний, вызываемых бактериями, путем воздействия на эти соединения.
Краткое изложение сущности изобретения
Настоящее изобретение относится к гистидин-протеин-фосфатазе, в частности полипептидам и полинуклеотидам гистидин-протеин-фосфатазы, рекомбинантным материалам и способам их получения. Подобные полипептиды и полинуклеотиды рассматриваются с точки зрения лечения определенных болезней, к числу которых относятся, среди прочего, рак и расстройства обмена веществ, сердечно-сосудистые заболевания и расстройства центральной нервной системы, далее "заболевания по данному изобретению". Кроме того, настоящее изобретение относится к способам идентификации агонистов и антагонистов (напр., ингибиторов) с использованием материалов по данному изобретению, а также снятию с помощью идентифицированных соединений состояний, связанных с нарушением баланса N-фосфорилирования. Помимо этого данное изобретение относится к методам диагностики заболеваний, связанных с нарушениями активности гистидин-протеин-фосфатазы или уровня ее содержания в клетках.
Настоящее изобретение также включает соответствующие варианты или мутанты, получаемые, например, методами случайного или направленного замещения, сплайсинга различных конструкций, делеции либо путем добавления одного или нескольких нуклеотидов либо аминокислот с сохранением, в основном, биологической активности.
Таким образом, целью настоящего изобретения является получение полипептида, который обладал бы биологической активностью гистидин-фосфатазы, отличающейся высокой специфичностью к фосфогистидину и имеющей молекулярную массу 13,000-15,000. Подобный полипептид можно выделить из ткани млекопитающего способом, включающим как минимум одну стадию анионообменной хроматографии, одну операцию гель-фильтрации и одну стадию аффинной хроматографии. В предпочтительном варианте ткань извлекают из сердца, почек, печени, поджелудочной железы, скелетных мышц и яичек млекопитающего. Предпочтительными млекопитающими являются человек, кролик, крыса.
Полипептид по данному изобретению содержит по меньшей мере основной фрагмент аминокислотной последовательности (SEQ. No. 3)
DCECLGGGRISHQSQD.
В другом варианте осуществления настоящего изобретения полипептид содержит как минимум основной фрагмент аминокислотной последовательности (SEQ.№4)
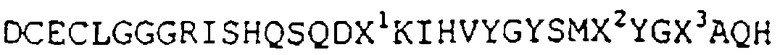
в котором X1=К или R, X2=А либо G, и X3=Р или R.
В следующем варианте осуществления данного изобретения полипептид содержит как минимум основной фрагмент аминокислотной последовательности (SEQ. №5)
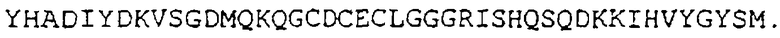
В составе аминокислотной последовательности фермента все эти неполные последовательности отличаются высокой консервативностью и, как полагают, играют определенную роль в активном центре упомянутого фермента либо обладают иными биологическими или фармацевтическими свойствами, которые они проявляют в ходе процессов, происходящих в клетках млекопитающих.
В предпочтительном варианте осуществления настоящего изобретения полипептид обладает биологической активностью гистидин-фосфатазы, отличающейся высокой специфичностью к фосфогистидину и имеющей молекулярную массу 13,000-15,000, и содержит следующую аминокислотную последовательность (SEQ. №2):
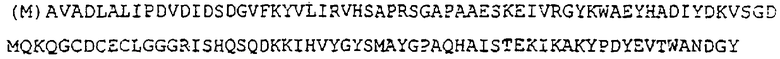
Наличие метионинового остатка на N-конце последовательности необязательно. Вышеуказанная аминокислотная последовательность извлечена из клетки человека.
Однако в данном изобретении также раскрываются особо гомологические вариации упомянутых последовательностей. Таким образом, еще одной целью настоящего изобретения является получение полипептида, который обладал бы биологической активностью гистидин-фосфатазы, отличающейся высокой специфичностью к фосфогистидину и имеющей молекулярную массу 13,000-15,000, аминокислотная последовательность которого была бы на 64-99%, предпочтительно 75-99%, гомологичной последовательности, описанной выше. В данном изобретении раскрывается целый ряд других гомологичных полипептидов, обладающих биологической активностью гистидин-протеин-фосфатазы, что становится очевидным из приведенного ниже.
Следующей целью настоящего изобретения стало получение последовательностей ДНК, которые бы кодировали упоминаемый выше и приводимый ниже по тексту полипептид. В основном данное изобретение относится к упомянутой ДНК, содержащей следующую нуклеотидную последовательность (SEQ. №1):

Настоящее изобретение также относится к антителам, предпочтительно моноклональным антителам, к полипептидам по данному изобретению.
Наконец, целью настоящего изобретения является изготовление фармацевтического препарата, содержащего упоминаемые выше и приводимые ниже по тексту полипептиды в комбинации, если это целесообразно, с соответствующими эксципиентами, носителями и другими активными компонентами.
Подробное описание
(А) ВЫДЕЛЕНИЕ И ОЧИСТКА
Гистидин-протеин-фосфатаза была выделена из печени кролика.
Сперва 110 г печени разрезают не мелкие кусочки. Затем материал смешивают с буфером для гомогенизации (220 мл 30 мМ-триэтаноламин/соляной кислоты с рН 7,5, 1 мМ-этилендиаминтетрауксусной кислоты, 300 мМ-сахарозы, 0,1 мМ-бензамидина с 0,1% 2-меркаптоэтанола) и измельчают в гомогенизаторе с охлаждением льдом. По завершении первого этапа центрифугирования (10 мин, 3800 г, 4°С), надосадочную жидкость центрифугируют повторно (1 ч, 48,000 г, 4°С). Последнюю фильтруют через марлю и замораживают при -80°С в количествах, кратных приблизительно 20 мл.
Методы хроматографического разделения на колонках
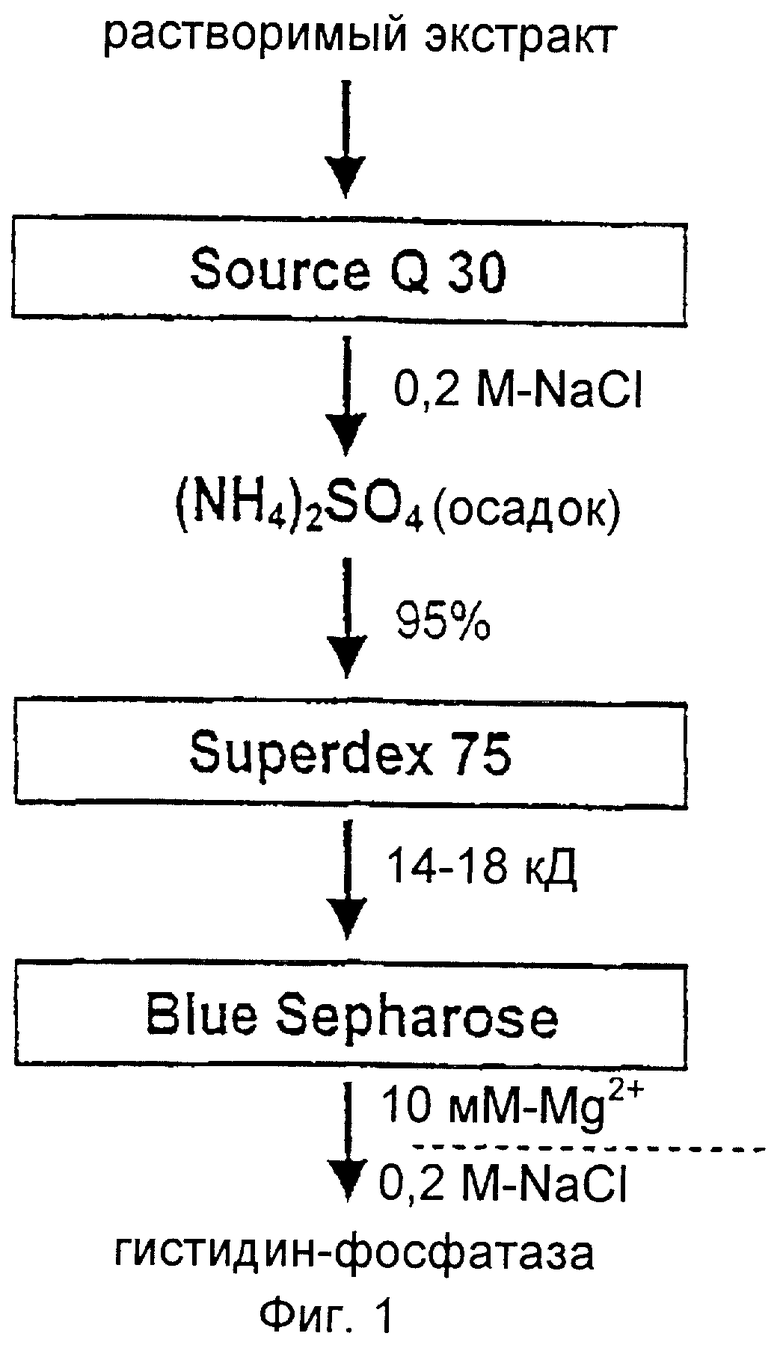
Гистидин-фосфатазу выделяли посредством осуществления трех стадий очистки (Фиг.1).
1. Анионообменная хроматография
Неочищенный экстракт печени вновь один раз центрифугируют (30 мин, 48,000 г). Надосадочную жидкость загружают в колонку Source Q30 (фирма Pharmacia, Фрайбург), уравновешенную буфером А (20 мМ-триэтаноламин/соляная кислота с рН 8,0, 1 мМ этилендиаминтетрауксусная кислота с 0,1% 2-меркаптоэтанола и 0,02% азотистокислого натрия).
Элюирование осуществляют 200 мМ-хлористым натрием в буфере А со скоростью потока 1 мл/мин.
2. Гель-фильтрация
Активную фракцию (см. определение активности) перемешивают и охлаждают, добавляя при этом твердый сернокислый аммоний (11,2 г на 17 мл). Каплю осадка, образованную в результате центрифугирования (20 мин, 48,000 г, 4°С), повторно суспендируют в буфере А и загружают в колонку Superdex 75 26/60 1,6×60 см (фирма Pharmacia, Фрайбург). Гель-фильтрацию проводят, каждую минуту добавляя в буфер А 1 мл 50 мМ-хлористого натрия.
3. Аффинная хроматография
Активную фракцию, полученную в результате гель-фильтрации, в соотношении 1:3 растворяют в буфере В (20 мМ-триэтаноламин/соляная кислота с рН 8,0, 0,1 мМ-этилендиаминтетрауксусная кислота с 0,1% 2-меркаптоэтанола и 0,02% азотистокислого натрия) и стабилизируют на отметке 10 мМ в хлористом магнии. Образец загружают в колонку Blue Sepharose 6 25×510 мм (фирма Pharmacia, Фрайбург). Элюирование осуществляют с использованием буфера В, содержащего 200 мМ-хлористый натрий, со скоростью потока 1 мл/мин.
(Б) ОБНАРУЖЕНИЕ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ
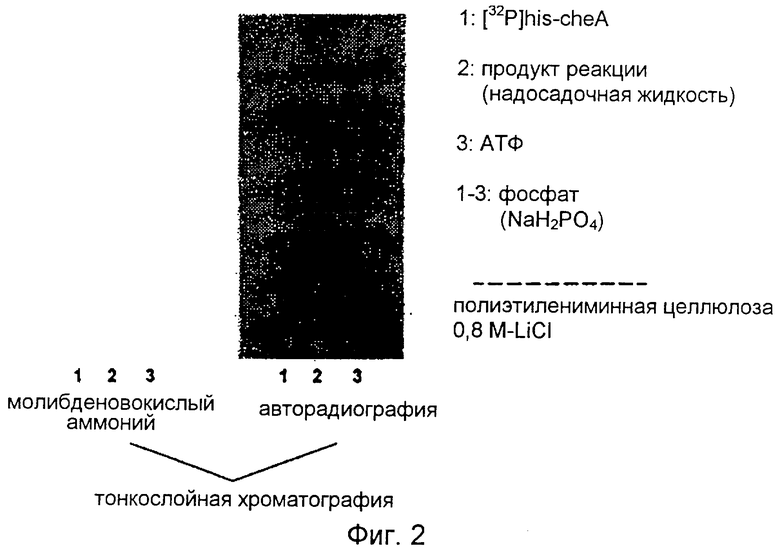
Активность растворимой гистидин-фосфатазы определяют по дефосфорилированию меченого 32P фосфорилированного в гистидине протеина (CheA), выполняющего функцию подложки. CheA представляет собой рекомбинантную бактериальную гистидин-аутокиназу (Bilwes A.M., Alex L.A., Crane B.R., Simon M.I. (1999) Cell 96:131-141); домен киназы на С-конце фосфорилирует N-концевой His48. В результате реакции образуется свободный фосфат, идентифицируемый методом тонкослойной хроматографии (планшеты из полиэтилениминной целлюлозы, 0,5 М-хлористый литий в качестве подвижной фазы). Обнаружение, с одной стороны, с использованием молибденовокислого аммония, а с другой - методом авторадиографии (Фиг.2). В ходе реакции не происходило ни передачи фосфата другим протеинам, ни расщепления подложки на пептидные фрагменты. При этом получают фосфат, иными словами, в реакции принимает участие фосфогистидин-протеин-фосфатаза.
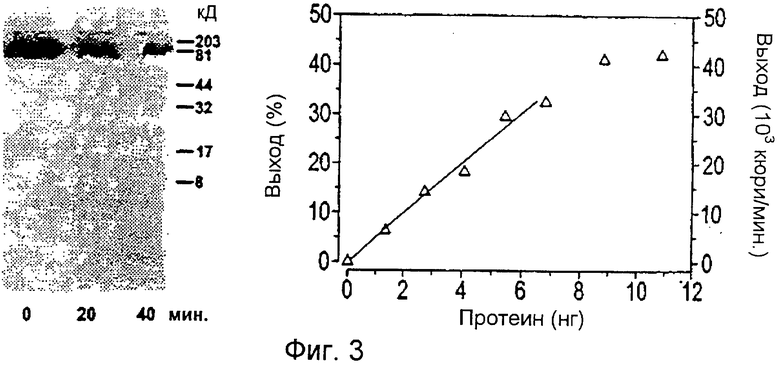
Очищенный протеин обладает способностью дефосфорилировать меченый 32Р фосфорилированный CheA в гистидине. Выход зависит от времени, температуры, рН и протеина (Фиг.3).
Устойчивость
Устойчивость очищенного протеина при хранении обеспечивается при использовании сырого гомогената и частично очищенных фракций.
Ферментный образец
Приготовление подложки: (мечение CheA 32Р)
Рекомбинантный CheA (5 мкл) смешивают с 0,5 мкл 100 мМ-фенилметилсульфонилфторида в диметилсульфоксиде и 5 мкл 500 мМ-HEPES с рН 8,0, 1 мМ-хлористый магний. Добавив 108 микрокюри 32Р-g-аденозинтрифосфорной кислоты, 5 мкл 10 мкМ-аденозинтрифосфорной кислоты и 50 мкл воды, при 37°С в течение 3 ч проводят инкубирование.
Определение активности
Подложку (10 мкл 32P-CheA) смешивают с 10 мкл буфера для количественного анализа (100 мМ-триэтаноламин/соляная кислота с рН 8,0 с 0,1% 2-меркаптоэтанола и 0,02% азотистокислого натрия) и ферментным раствором. Реакцию осуществляют при 37°С в течение 30 мин. Затем добавляют 2 мкл 500 мМ-этилендиаминтетрауксусной кислоты и 126 мкл раствора метанол/ацетон в соотношении 1:1. По завершении центрифугирования (5 мин, 15,800 г) отделяют надосадочную жидкость, в которой затем с помощью сцинтилляционного счетчика проводят все необходимые измерения.
Таким образом, описанную фосфатазу отличают от других протеин-фосфатаз, исходя из
1) специфичности к фосфогистидину (Таблица 1), гистидин-фосфатаза не гидролизовала, напр., р-нитрофенилфосфат;
2) сохранения активности, несмотря на воздействие окадаевой кислоты или ванадата, ингибирующих активность остальных фосфатаз (Таблица 2);
3) значительно более низкой молекулярной массы.
Гидролиз новой гистидин-протеин-фосфатазой
Реагенты, воздействующие на активность гистидин-фосфатазы
(В) ИССЛЕДОВАНИЕ ГИСТИДИН-ПРОТЕИН-ФОСФАТАЗЫ
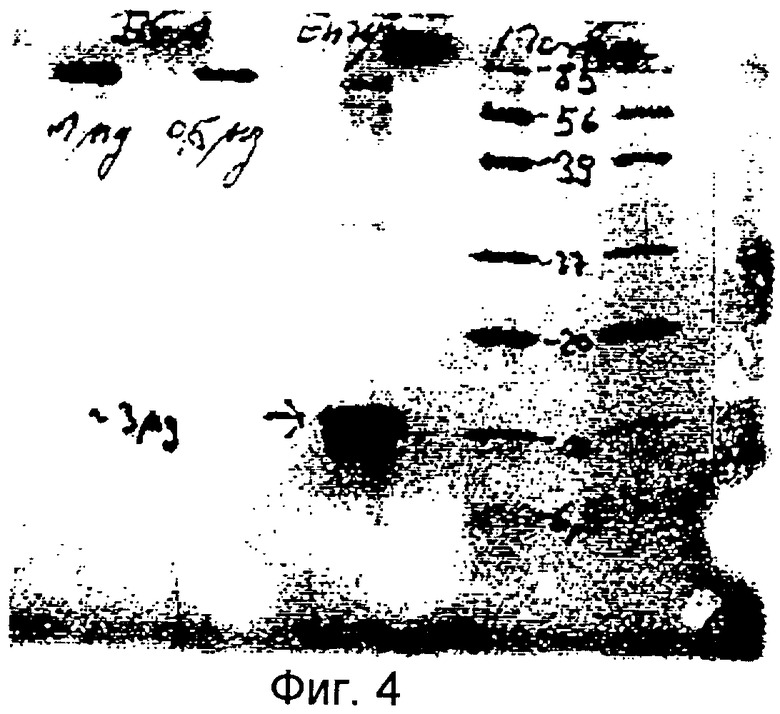
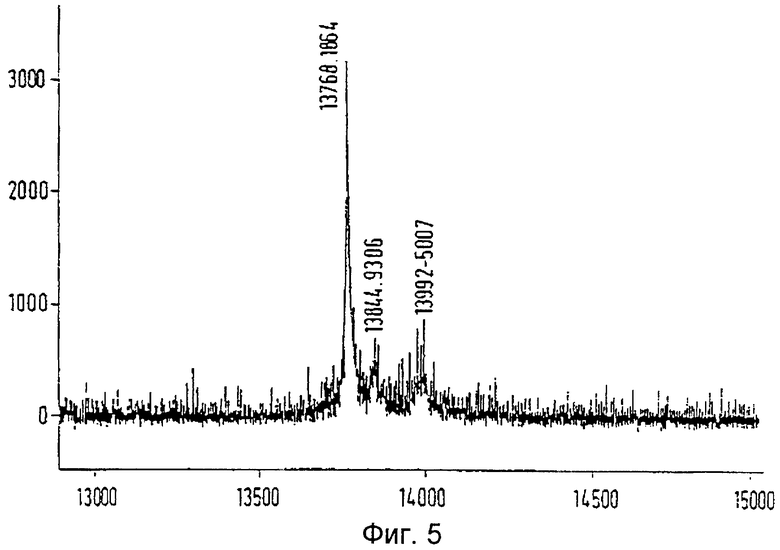
С помощью анализа методом электрофореза в полиакриламидном геле додецилсульфатом натрия в очищенной белковой фракции была обнаружена четкая полоса с молекулярной массой явно 14,000 (Фиг.4). Проведя анализ масс, получили протеин с молекулярной массой 13,768 (Фиг.5). Гистидин-протеин-фосфатаза на N-конце блокируется ацетильной группой. Таким образом, методом расщепления по Эдману доступ к информации, содержащейся в последовательности, получить нельзя. Исследовать протеин можно только в том случае, если происходит протеолитический распад.
(Г) АНАЛИТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПРОТЕИНА
Активную фракцию (Фиг.4), с целью определения аминокислотной последовательности, подвергли ферментативному расщеплению. Полученные пептидные фрагменты секвенировали, применяя расщепление по Эдману и масс-спектрометрию (Kellner R., Lottspeich F., Meyer Н.Е. (1999) Microcharacterization of Proteins, Wiley-VCH).
Ферментативное расщепление
С помощью скальпеля отрезали полоску геля, которую помещали в трубку Эппендорфа. Процесс ферментативного расщепления начинался после добавления трипсина в качестве протеазы (1 мкг трипсина, 100 мкл 0,5 М-кислого углекислого аммония, 37°С, 12 ч). Полученные пептидные фрагменты экстрагировали (50% трифторуксусной кислоты, 50% ацетонитрила). Экстракт концентрировали в вакуумной центрифуге.
Хроматографическое разделение пептидных фрагментов
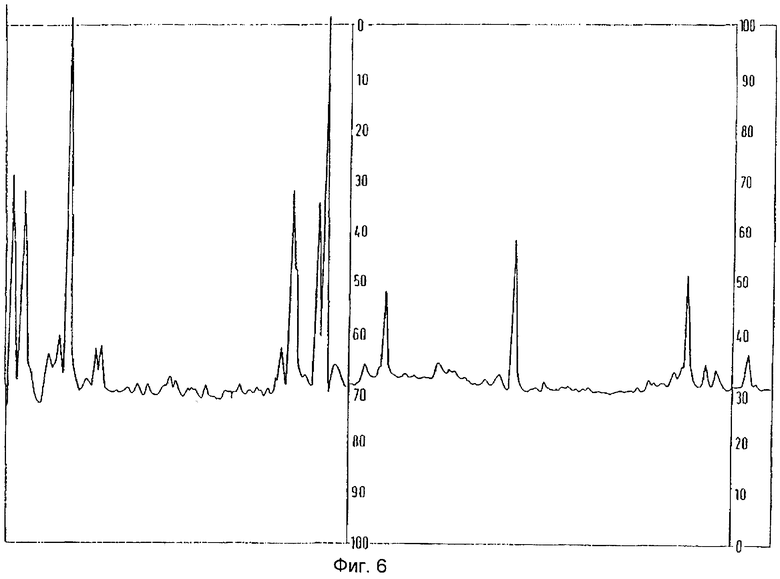
Пептидные фрагменты растворяли в элюенте А (0,1% трифторуксусной кислоты в воде) и разделяли методом хроматографии с обращенной фазой (элюент В: 20% 0,1%-ной трифторуксусной кислоты в воде, 80% ацетонитрила). В результате фракционирования с определением при помощи ультрафиолетового излучения (длина волны 214 нм) (см. Фиг.6) разделенные пептидные фрагменты растворялись и определялись с помощью секвенирования по Эдману и масс-спектрометрии.
Определение методами секвенирования по Эдману и масс-спектрометрии
По завершении хроматографического разделения с 90% жидких фракций провели секвенирование по Эдману (стандартные условия, прибор: модель 494, PE-Applied Biosystems, Вайтерштадт). Остальные фракции прошли анализ масс (MALDI-MS), (прибор: Voyager STR, Perseptive Biosystems, Висбаден).
Идентифицированные пептидные последовательности
Были определены следующие пептидные последовательности (кролик):
AAAGLAQIPD VDIDSDGVFK
YVLIR
VHAAPPSEAPGGESK
DIVR
WAEYHADIYDK
VSGELQK
ISHQSQDR
KIHVYGYSMGYGR
YPDYEVTWADDGY
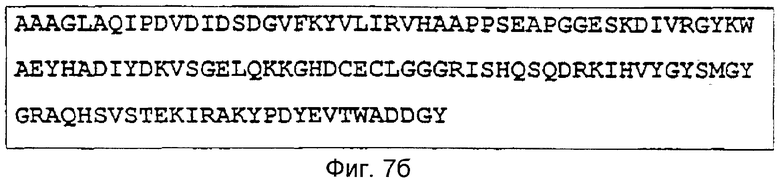
Эти пептиды составляют пептид фермента кролика (SEQ. №6):

(Д) Секвенирование нуклеотида
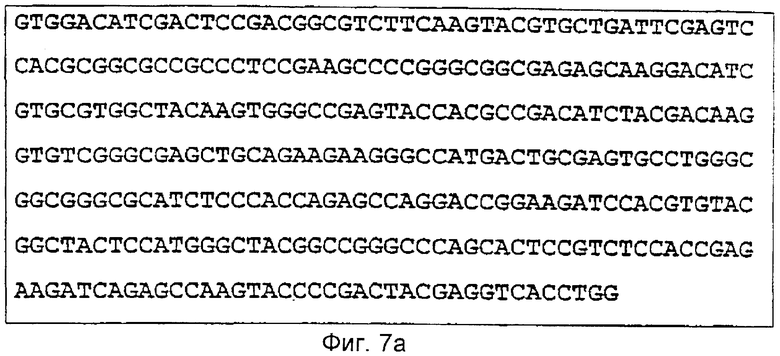
С помощью праймеров, которые выбирали из полученной аминокислотной последовательности для нуклеотидной последовательности гистидин-протеин-фосфатазы, провели скрининг библиотеки ДНК кролика. В результате клонирования и секвенирования была идентифицирована нуклеотидная последовательность, приведенная на Фиг.7а. 327 основ соответствуют последовательности протеина гистидин-протеин-фосфатазы, начинающейся в положении 11-119 (Фиг.7б).
Поиск в базе данных
Поиск в базе данных осуществляли, используя алгоритм BLAST. Протеины в базах данных протеинов идентифицировали из C.elegans, Drosophila melanogaster, Drosophila pseudoobscura.
Пути ЭТС (эукариотной трансдукции сигнала) в базах данных нуклеотидов идентифицировали в человеке, крысе и мыши. Человеческий гомолог пока не опубликован. Исходя из структуры этих путей ЭТС, протеин человека гистидин-протеин-фосфатаза имеет следующую последовательность (SEQ. No 2 без метионинового остатка):

Гомолог крысы еще не опубликован. Исходя из структуры этих путей ЭТС, протеин крысы гистидин-протеин-фосфатаза имеет следующую последовательность (SEQ. №7):
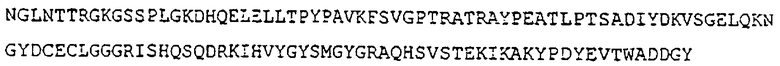
Гомолог мыши еще не опубликован. Исходя из структуры этих путей ЭТС, протеин мыши гистидин-протеин-фосфатаза имеет следующую последовательность (SEQ. №8):

Гомология последовательности для протеина гистидин-фосфатазы из различных биологических видов, выраженная в % идентичности
(Е) ЛОКАЛИЗАЦИЯ ПРОТЕИНОВ и их распределение в ткани
Ген гистидин-протеин-фосфатазы человека локализуют в хромосоме 9 (9q33-Tel, маркер sts-N90764, интервал D9S159-qTEL).
В качестве источников экспрессии кДНК использовали:
головной мозг, грудную железу, центральную нервную систему, толстую кишку, крайнюю плоть, зародышевую клетку, сердце, почку, печень, легкое, мышцу, поджелудочную железу, околощитовидную железу, pooled, простату, селезенку, яичко, щитовидную железу, миндалевидную железу, матку, весь зародыш.
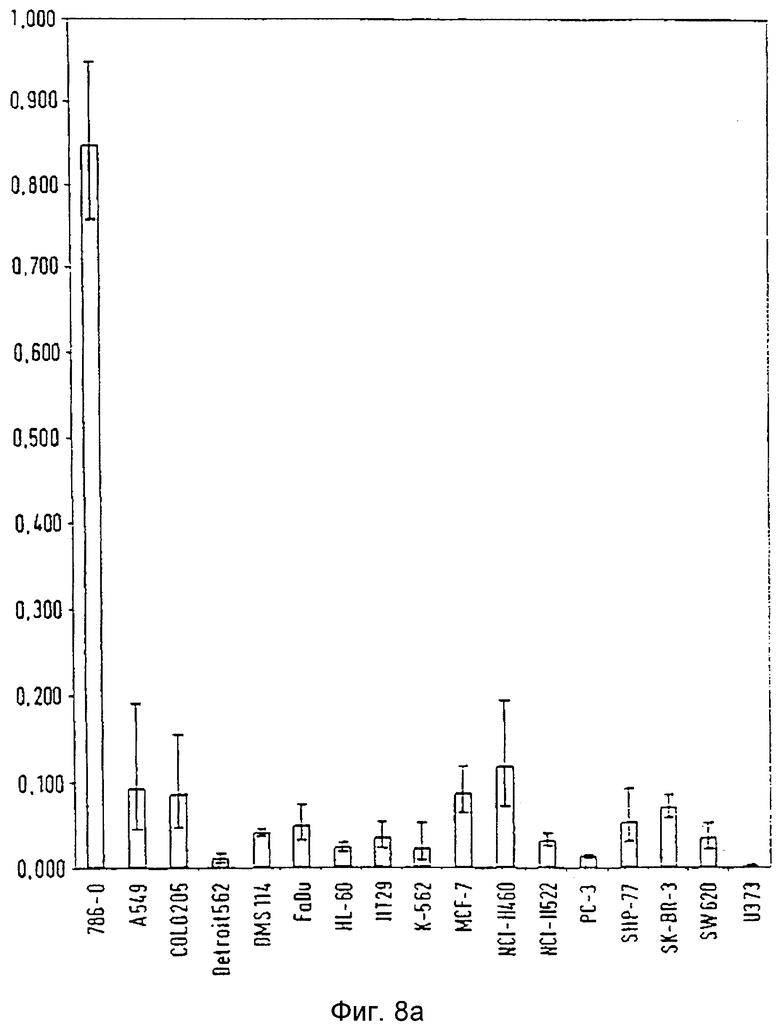
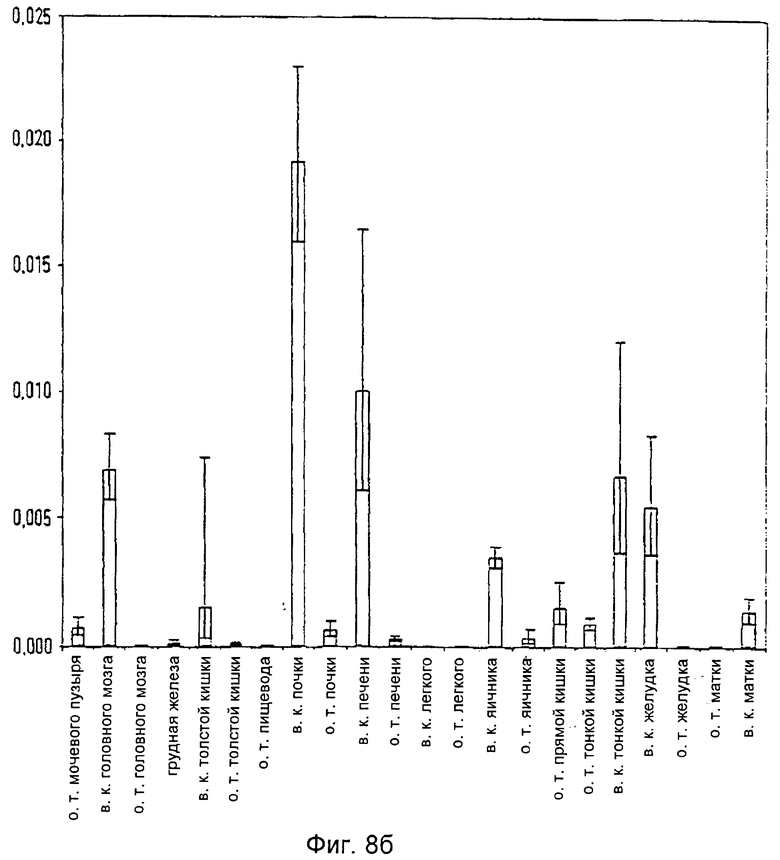
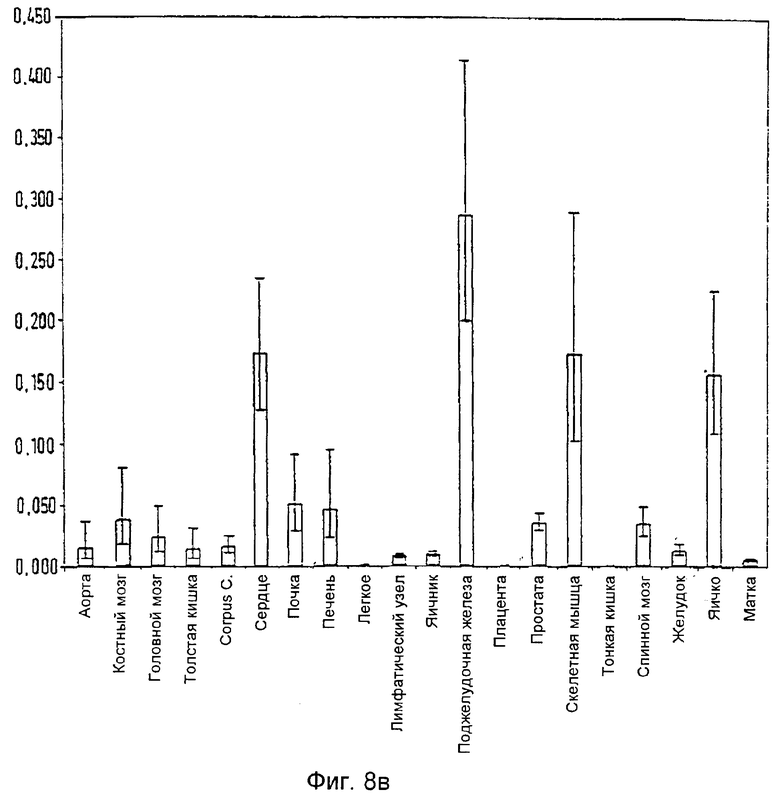
Проведя анализ распределения мРНК гистидин-протеин-фосфатазы, наибольший ее уровень обнаружили в нормальных тканях, таких как сердце, почка, печень, поджелудочная железа, скелетная мышца и яичко (Фиг.9а, б).
(Ж) Антитела к гистидин-фосфатазе
Антитела к гистидин-фосфатазе должны обезвреживать три отдельные зоны этого протеина, а именно n-концевой, средний и с-концевой фрагменты молекулы. В качестве таких зон избрали три пептидные последовательности:
пептид 1 - QIPDVDIDSD GVFKYV (16аа, SEQ. №9);
пептид 2 - CLGGGRISHQ SQDK (14aa, SEQ. №10);
пептид 3 - CTEKIKAKYP DYEV (14aa, SEQ. №11).
Эти пептиды синтезировали, используя стандартную химию ФМОК. С целью иммунизации каждый из пептидов впрыскивали (4 инъекции) двум кроликам. Делали четыре анализа крови (в последний раз через приблизительно 3 месяца). Образовавшиеся антитела способны выявлять и локализовать гистидин-фосфатазу.
Кроме того, имеется возможность исследования различных зон молекулы по отдельности. В частности, предполагается, что центральный фрагмент гистидин-фосфатазы, отличающийся высокой консервативностью и содержащий следующую аминокислотную последовательность:
DCECLGGGRISHQSQD (SEQ. №3),
включает активный центр, ответственный за функции протеинов in vivo. Антитело к пептиду должно обезвреживать эту зону, ингибируя и нейтрализуя ее.
Вот вкратце характеристики гистидин-протеин-фосфатазы:
1. Аминокислотная последовательность гистидин-протеин-фосфатазы человека содержит около 124 аминокислот.
2. Аминокислотная последовательность гистидин-протеин-фосфатазы характеризуется высокой гомологией в С-концевом фрагменте в отличие от такового N-конца, где гомология весьма слаба.
3. Молекулярная масса составляет 13,800 +/-100 (Фиг.5).
4. В N-конце гистидин-протеин-фосфатаза блокируется ацетилированием.
Фармацевтические препараты
Нативный (-ные), а также рекомбинантный (-ные) протеин (-ны), может (-гут) применяться в качестве лекарства, принимать которое пациенты могут как таковое либо в составе фармацевтических композиций. Таким образом, очередной целью настоящего изобретения является получение описанного выше и приводимого ниже по тексту рекомбинантного или нативного протеина, который можно было бы применять в качестве лекарства, и приготовление соответствующей фармацевтической композиции, содержащей упомянутый протеин и его фармацевтически приемлемый растворитель, носитель или эксципиент.
В состав фармацевтических композиций по данному изобретению может входить целый ряд дополнительных активных фармацевтических соединений.
Термин "фармацевтически приемлемый носитель" в контексте настоящего описания обозначает инертный, нетоксичный твердый или жидкий наполнитель, растворитель либо вещество, образующее оболочку капсулы, которое не реагирует с активным соединением и не может повредить пациенту. Подходящие в предпочтительном варианте жидкие носители широко известны в данной области. Такими носителями могут служить стерильная вода, соль, водная декстроза, сахарные растворы, этанол, гликоли и масла, включая таковые животного или растительного происхождения, получаемые в результате переработки нефти либо синтетические, например арахисовое масло, соевое масло и минеральное масло.
Соединения по настоящему изобретению можно вводить как разовые дозы, содержащие обычные нетоксичные фармацевтически приемлемые носители, растворители, адъюванты и связующие, типичные для парентерального применения.
Под термином "парентеральный" в контексте настоящего описания подразумеваются подкожная, внутривенная, внутрисуставная и внутритрахеальная инъекции, а также вливания. Кроме того, приемлемы другие способы применения, такие как оральное и местное. Композиции и комбинированные препараты для парентерального применения в наиболее предпочтительном варианте вводят внутривенно в форме болюса или в качестве постоянных фузий, пользуясь при этом известными методами. Таблетки и капсулы, предназначенные для орального введения, содержат обычные эксципиенты, такие как связующие вещества, наполнители, растворители, агенты таблетирования, смазочные материалы, вещества, способствующие освобождению действующего начала, и поверхностно-активные вещества. С помощью широко известных в данной области методов таблетки можно покрывать оболочкой. Жидкие препараты для орального применения могут иметь форму водных или масляных суспензий, растворов, эмульсий, сиропов либо эликсиров или выпускаться в качестве сухого продукта, который перед применением следует довести до необходимой консистенции, добавив воду либо иное подходящее связующее. Подобные жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, неводные связующие и противостарители. Препараты для местного применения могут иметь форму водных или масляных суспензий, растворов, эмульсий, гелей либо, что является предпочтительным, эмульсионных мазей.
Разовые дозы по настоящему изобретению могут содержать дневные количества протеина по данному изобретению или его дольные единицы, составляющие необходимую дозу. Какая дозировка будет оптимальной для того или иного пациента (млекопитающие, в том числе человек), зависит от целого ряда факторов, таких как активность применяемого действующего вещества, возраст, масса тела, общее состояние здоровья, пол, диета, время и способ введения, скорость выведения, активность фермента (единицы/мг протеина), цель применения препарата, т.е. предназначен ли он для терапии либо профилактического лечения, а также характер заболевания.
Таким образом, фармацевтически эффективная дневная доза протеина по настоящему изобретению в композициях и комбинированных препаратах в организме пациента (in vivo) составляет около 0,01-100 мг/кг (исходя из удельной активности 100 кЕд/мг), предпочтительно от 0,1 до 10 мг/кг массы тела. В зависимости от формы применения одна доза может содержать от 0,5 до 10 мг гистидин-протеин-фосфатазы.
Краткое описание фигур
Фиг.1: Схема очистки, используемая с целью выделения гистидин-фосфатазы
Фиг.2: Идентификация неорганического фосфата как продукта реакции расщепления гистидин-фосфатазы. Применяется метод тонкослойной хроматографии на планшетах (полиэтилениминная целлюлоза, 0,8 M-LiCl); слева: обнаружение с использованием молибденовокислого аммония; справа: обнаружение методом авторадиографии; 1: [32P]his-cheA, 2: продукт реакции, 3: АТФ, 1-3: фосфат (NaH2PO4)
Фиг.3: Дефосфорилирование подложки cheA, зависящее от времени и протеина; слева: деструкция через 0, 20 и 40 мин, справа: выход меченого радиоизотопом фосфата (левая ось у: %, правая ось у: радиоактивность) для различных количеств подложки (ось х: нг протеина)
Фиг.4: Анализ фракции с активной гистидин-фосфатазой (электрофорез в полиакриламидном геле додецилсульфатом натрия); АФ: активная фракция; 1,2: BSA (сывороточный альбумин крупного рогатого скота) (1 мкг, 0,5 мкг), 3: АФ; 4,5: молекулярные маркеры
Фиг.5: Анализ масс гистидин-фосфатазы. Ось у: отсчет, ось х: масса (m/z)
Фиг.6: Разделение гистидин-фосфатазы методом хроматографии с обращенной фазой по завершении ферментативного расщепления; элюент А: 0,1%-ная трифторуксусная кислота в воде и элюент В: 20% 0,1%-ной трифторуксусной кислоты в воде, 80% ацетонитрила; определение при помощи ультрафиолетового излучения, длина волны 214 нм
Фиг.7а: (Частичная) нуклеотидная последовательность гистидин-протеин-фосфатазы кролика
Фиг.7б: Транслированная полная аминокислотная последовательность гистидин-протеин-фосфатазы кролика
Фиг.8а: Распределение гистидин-протеин-фосфатазы в линии опухолевых клеток
Фиг.8б: Распределение гистидин-протеин-фосфатазы в опухолевой ткани (о. т. - опухолевая ткань, в. к. - воспалительный конгломерат)
Фиг.8в: Распределение гистидин-фосфатазы в нормальной ткани
Перечень последовательностей приведен в конце описания.






Изобретение относится к области биотехнологии и может быть использовано в медицине и фармацевтике. Получен полипептид, обладающий биологической активностью гистидин-протеин-фосфатазы, а также кодирующий его полинуклеотид. На основе полипептида получен фармацевтический препарат, применяемый при патологических состояниях, связанных с нарушением функции гистидин-протеин-фосфатазы. Также получены антитела, специфичные к участкам указанного полипептида. Применение изобретения позволяет изучать процесс N-фосфолирования, диагностировать патологии клеточной регуляции и роста клеток, а также регулировать патологические состояния, связанные с нарушением функции гистидин-протеин-фосфатазы. 7 н. и 4 з.п. ф-лы, 8 ил., 3 табл.
DCECLGGGRISHQSQD.
DCECLGGGRISHQSQDX1KIHVYGYSMX2YGX3AQH,
в котором Х1=К или R, Х2=А либо G и Х3=Р или R.
YHADIYDKVSGDMQKQCDCECLGGGRISHQSQDKKIHVYGYSM.
(M)AVADLALIPDVDIDSDGVFKYVLIRVHSAPRSGAPAAESKEIVRGYKWAEYHADIYDKVSGDMQKQGCDCECLGGGRISHQSQDKKIHVYGYSMAYGPAQHAISTEKIKAKYPDYEVTWANDGY.
AAAGLAQIPDVDIDSDGVFKYVLIRVHAAPPSEAPGGESKDIVRGYKWAEYHADIYDKVSGELQKKGHDCECLGGGRISHQSQDRKIHVYGYSMGYGRAQHSVSTEKIRAKYPDYEVTWADDGY.
Приоритет в части признаков пп.3, 5-11 установлен от 04.03.1999, в части других признаков от 02.03.2000.
| HILLER L | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| MATTHEWS HARRY R И ДР.: "Protein histidine phosphatase activity in rat liver and spinach leaves." FEBS LETTERS, том 364, №1, 1995, с.51-54, ISSN: 0014-5793. | |||
Авторы
Даты
2006-08-20—Публикация
2000-03-02—Подача